低免疫原性胶原蛋白微粉的制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于医用生物材料的技术领域,尤其是涉及一种低免疫原性胶原蛋白微粉的制备方法。
背景技术
胶原是人体皮肤中的重要组成成分,胶原对皮肤及相邻软组织提供重要的结构支撑,其含量的减少会导致皮肤变薄、萎缩和老化。胶原产品是注射美容外科学中的重要填充材料。1974年,首款真皮填充胶原产品问世。1978年,人源性和牛源性胶原作为真皮填充材料用于治疗凹陷性瘢痕、皮下萎缩和皱纹。1981年,胶原作为真皮填充材料获得FDA批准,用于鼻唇沟填充。目前,真皮填充物几乎被用于面部的所有区域,包括眼睛、下巴和脸颊。大多数这些手术是安全的,可预测的,不良后果很小。
胶原蛋白作为生物材料的成功很大程度上是由于其低抗原性和低免疫原性。尽管如此,对于新型生物医学设备的设计和应用,了解人类免疫对胶原蛋白的潜在机制及其临床意义仍然是至关重要的。然而,使用填充物可能会发生不良事件,从轻微水肿、瘀伤到感染、失明、缺血和中风等。在注射胶原产品前必须进行皮试过敏试验,阳性反应一般为肿胀、硬结、红斑、瘙痒等,较为严重的反应为肉芽过度生长、重度炎症反应、皮肤坏死等,阳性率达3%。对于皮试阴性的患者,过敏反应发生率一般在1%以下。
一般来说,胶原材料中引起的免疫反应物质主要为提取过程中未能完全清除的细胞残留、DNA残留和杂蛋白等。其中,细胞表面的α-Ga l抗原是动物组织或器官引起免疫排斥反应的主要靶抗原,α-Ga l抗原与人体内的抗α-Ga l抗体结合,会导致人体发生一系列不良炎症反应。动物源性生物材料的残留Ga l抗原含量检测,是控制产品质量的重要指标之一。脊椎动物所特有的DNA中CpG抑制,是一种识别自身和外源DNA的重要免疫机制。外源性DNA进入机体时,免疫系统通过识别CpG特征结构做出免疫应答。对残留DNA的检测,是控制生物源性材料免疫原性风险的重要指标之一。此外,在胶原材料的制备过程中,可通过酶解、盐析、透析等提纯工艺的改变有效降低细胞残留、DNA残留和杂蛋白含量。
酸酶法切除端肽,可控制C-端肽和N-端肽含量以清除由端肽结构引起的免疫原性;采用高渗盐复合表面活性剂和H
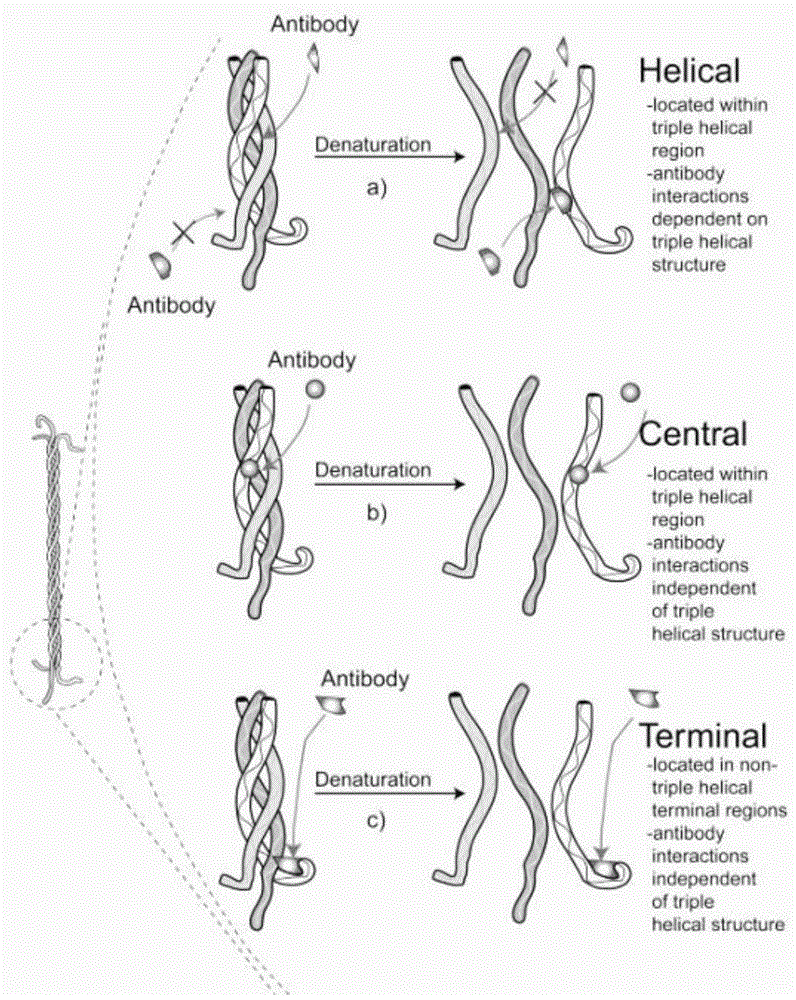
但是,胶原蛋白分子本身也存在一定的抗原成分,其中的部分抗原成分无法在提取过程中得以有效的降低。胶原蛋白分子中抗原决定因素可以分为三类:螺旋区抗体,识别依赖于3D构象(即完整的三重螺旋的存在);中心区抗体,位于天然胶原的三重螺旋部分,但识别仅基于氨基酸序列,而不是3D构象;末端肽链区抗体,位于分子的非螺旋末端区域(末端肽)。其中,Ⅰ型胶原的免疫原性主要分布在分子链的C、N末端,由短的、非螺旋氨基酸序列所组成的端肽区域,端肽是天然Ⅰ胶原蛋白产生免疫原性的根源,因此端肽的去除效果,在很大程度上影响了去端肽Ⅰ型胶原蛋的免疫原性的强弱。在胶原的提取过程中,需要去除胶原产品中的免疫成分,避免胶原基生物材料在植入人体后,杂质的存在可能会导致过敏、致热或异物反应等不良现象发生。
但是,胶原的三股螺旋结构是维持胶原材料生物活性的必要条件,胶原的提取过程,应尽可能的保持胶原的三股螺旋结构的完整性。因而,胶原的提取纯化过程,虽然基本清除了细胞残留、DNA残留、杂蛋白以及C、N末端肽链,有效降低了胶原产品的免疫原性。但是,胶原的螺旋区和中心区抗体被胶原分子链包裹缠绕,位于胶原分子链螺旋区和中心区的抗体成分却未能获得有效的清除和灭活处理。三氟乙醇(TFE)、六氟异丙醇(HFI P)等溶剂因具有捕捉氢键、电价键或破坏疏水键的能力,可以用来溶解胶原,充分解离胶原三股螺旋结构,有效暴露螺旋区抗体和中心区抗体,利于后续的除抗体处理。但是,一旦溶解在TFE或HFI P中,胶原将会失去其独特的三股螺旋结构,永远的丧失了应有的生物活性,而与明胶无异,目前尚无这两种溶剂处理后胶原的再生技术。在这两种溶剂中的变性行为,违背了其作为一种仿生材料的初衷,进而阻碍了它在纺丝、医用生物材料、食品保健、美容化妆品等方面的高值化利用。而且这类氟醇溶剂饱和蒸气压大、易挥发、腐蚀性及毒性强。
发明内容
有鉴于此,本发明旨在提出一种低免疫原性胶原蛋白微粉的制备方法,以缓解上述的技术问题。
为达到上述目的,本发明的技术方案是这样实现的:
一种低免疫原性胶原蛋白微粉的制备方法,包括如下步骤:
S1:将动物组织粉碎并进行病毒灭活处理;
S2:使用酸酶法从上述材料中获得胶原蛋白海绵;
S3:将胶原蛋白海绵溶于离子液体,获得混合溶液;
S4:将该混合溶液滴入沉淀剂中,经沉淀、离心洗涤后,获得再生胶原微粉;
S5:对再生胶原微粉使用交联剂进行交联处理,并离心洗涤、冷冻干燥,最后粉碎筛分,获得胶原蛋白微粉。
进一步地,步骤S2包括:
对步骤S1中的材料使用胃蛋白酶酸性溶液提取、高渗盐析洗涤、去离子水透析以及冷冻干燥,获得胶原蛋白海绵。
进一步地,步骤S1中的动物组织为动物皮肤、跟腱以及牛心包中的一种或者两种以上。
进一步地,步骤S1中使用过氧乙酸或者双氧水进行病毒灭活处理。
进一步地,交联剂包括戊二醛、己二异氰酸酯、环氧化合物、京尼平、碳化二亚胺以及双醛多糖。
进一步地,沉淀剂为乙醇、甲醇或者丙酮与去离子水的混合物。
进一步地,离子液体为咪唑醋酸盐型离子液体、1-丁基-3-甲基咪唑氯盐型离子液体、溴代1-乙基-3-甲基咪唑盐型离子液体、氯化胆碱·2ZnC l离子液体以及1-烯丙基-3-甲基咪唑氯盐离子液体中的一种。
进一步地,步骤S5中交联处理与离心洗涤之间包括使用氨基酸或者低分子量多肽浸泡去除未反应的交联剂。
进一步地,步骤S5中离心洗涤与冷冻干燥之间包括装袋透析。
进一步地,步骤S5之后包括使用γ射线辐照灭菌。
相对于现有技术,本发明提供的一种低免疫原性胶原蛋白微粉的制备方法具有以下优势:
1、本发明旨在制备一种更低免疫原性的胶原蛋白微粉材料,该微粉主要用于皮肤填充,该技术方法有效降低了末端肽抗体、螺旋区抗体和中心区抗体的免疫原性反应,进一步降低了胶原材料可能引起的免疫原性反应,而且保持了胶原的三重螺旋结构和生物活性,使其具有更为广阔的应用范围。
2、本发明针对上述技术缺陷和离子液体的特性,利用离子液体-沉淀剂对胶原三重螺旋结构的重整,一定程度上降低了三重螺旋结构的紧密性,有效暴露螺旋区抗体和中心区抗体,通过后续交联处理工艺实现螺旋区抗体和中心区抗体的降低或灭活,有效降低了胶原的免疫原性反应,而且胶原的生物活性得到了有效的保持。
附图说明
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明所述的胶原蛋白中三种抗体示意图;具体为螺旋区抗体、中心区抗体、端肽抗体;图1来自文献【Furthmayr F,T imp l R.Immunochemi stry of co l lagens and proco l l agens.I nt Rev Connect T i ssue Res 1976;7:61–99】;
图2为按照本发明描述进行的具体实施例所述的三种材料的圆二相色谱图,即CD图,其中A为胶原蛋白原料,B为离子液体处理后胶原,C为离子液体处理+交联处理后胶原。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
下面将结合实施例来详细说明本发明。
一种低免疫原性胶原蛋白微粉的制备方法,包括如下步骤:
S1:将动物组织粉碎并进行病毒灭活处理;
S2:使用酸酶法从上述材料中获得胶原蛋白海绵;
S3:将胶原蛋白海绵溶于离子液体,获得混合溶液;
S4:将该混合溶液滴入沉淀剂中,经沉淀、离心洗涤后,获得再生胶原微粉;
S5:对再生胶原微粉使用交联剂进行交联处理,并离心洗涤、冷冻干燥,最后粉碎筛分,获得胶原蛋白微粉。
更为优选地,步骤S2包括:
对步骤S1中的材料使用胃蛋白酶酸性溶液提取、高渗盐析洗涤、去离子水透析以及冷冻干燥,获得胶原蛋白海绵。
更为优选地,步骤S1中的动物组织为动物皮肤、跟腱以及牛心包中的一种或者两种以上。
更为优选地,步骤S1中使用过氧乙酸或者双氧水进行病毒灭活处理。
更为优选地,交联剂包括戊二醛、己二异氰酸酯、环氧化合物、京尼平、碳化二亚胺以及双醛多糖。
更为优选地,沉淀剂为乙醇、甲醇或者丙酮与去离子水的混合物。
更为优选地,离子液体为咪唑醋酸盐型离子液体、1-丁基-3-甲基咪唑氯盐型离子液体、溴代1-乙基-3-甲基咪唑盐型离子液体、氯化胆碱·2ZnC l离子液体以及1-烯丙基-3-甲基咪唑氯盐离子液体中的一种。
更为优选地,步骤S5中交联处理与离心洗涤之间包括使用氨基酸或者低分子量多肽浸泡去除未反应的交联剂。
更为优选地,步骤S5中离心洗涤与冷冻干燥之间包括装袋透析。
更为优选地,步骤S5之后包括使用γ射线辐照灭菌。
具体地,使用的胶原蛋白包括的类型有:I型胶原蛋白、Ⅱ型胶原蛋白、I I I型胶原蛋蛋白、Ⅴ型胶原蛋蛋白与Ⅶ型胶原蛋白。对具体实施例来说,可能是单纯的一种胶原蛋白,也可能是两种或两种以上的组合物。
所用的处理剂离子液体包括:咪唑醋酸盐型离子液体、1-丁基-3-甲基咪唑氯盐型离子液体、溴代1-乙基-3-甲基咪唑盐型离子液体、氯化胆碱·2ZnC l离子液体以及1-烯丙基-3-甲基咪唑氯盐离子液体。每一种都可以单独使用,用于处理胶原蛋白的,但使用温度不同。
离子液体处理后,所用的沉淀剂为乙醇、甲醇或者丙酮;或这些试剂与去离子水的混合物。
所用的交联剂包括戊二醛、己二异氰酸酯、环氧化合物、京尼平、碳化二亚胺以及双醛多糖。
具体实施例
如图2所示:三种材料在200nm、220nm附近分别出现一正一副二个吸收峰,表示三种材料均保持了三维螺旋结构,但随处理过程的推进,胶原三股螺旋的完整性稍有所降低,螺旋结构的紧密性呈下降趋势。胶原螺旋结构的改变将导致CD图谱中峰强度的降低,并且在长波长处(约223nm)出现的峰强度与在短波长处(约200nm)出现的峰强度比值(Rpn)会降低。胶原在[BMI M]Ac溶解再生后的Rpn值由原来的0.152降到了0.127,说明再生胶原三股螺旋的完整性稍有所降低,但是[BMI M]C l溶解再生后的胶原Rpn值减少到0.05,说明75℃下加热溶解后的胶原三股螺旋结构发生部分解构,显然更高的溶解温度不利于胶原三股螺旋构象的保留。
采用Ga l抗原缺失小鼠,通过皮下植入方式对胶原蛋白原料(Co l)、离子液体处理后胶原(I-Co l)、离子液体处理+交联处理后胶原三种材料(I-Co l-C)进行免疫学评价研究(每组6只)。同时设空白对照组(CON)、阳性对照组(POS)。CON组进行“假”手术,POS组小鼠背部皮下注射BSA-完全弗氏佐剂混悬液。供试品植入后4周后,进行免疫学指标检测。结果显示:POS组血清总I gG、I gM含量与CON组比较均明显增加,统计学有显著性差异(P<0.05);其余各组总I gG、I gM含量与CON组比较均无统计学显著性差异(P>0.05)。Co l组抗Ga l I gG、I gM抗体略高于I-Co l组和I-Co l-C组。表明改性处理后,材料免疫原性呈降低趋势。小鼠血清细胞因子含量检测结果如表1所示。POS组小鼠血清I FN-γ、I L-6含量与CON组相比显著升高(P<0.05);Co l组、I-Co l组和I-Co l-C组各数值整体呈下降趋势,其中I-Co l-C组与Co l组相比,I L-6、I L-10有统计学意义(标#),表明改性处理后,材料免疫原性呈降低趋势。
表1小鼠免疫学评价检测结果
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种耐高温低钠氢氧化铝微粉制备方法
- 一种胶原蛋白肽粉的制备方法
- 适用于航天员健康调节的胶原蛋白肽粉及其制备方法
- 一种基于低免疫原性多肽微米囊泡及其制备方法
- 一种低免疫原性鱼皮胶原蛋白及其制备方法
- 一种低免疫原性的海洋医用胶原蛋白及其制备方法及应用
