基于固相微萃取及实时分析质谱检测毒品量的检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及毒品检测方法的技术领域,具体涉及一种基于固相微萃取及实时分析质谱检测毒品量的检测方法。
背景技术
目前常见的毒品主要为苯丙胺类中的甲基苯丙胺、吗啡类中的海洛因、大麻、可卡因、氯胺酮这几类。近些年,甲卡西酮等新型毒品的出现对现有常规的检测技术发出了新的挑战。
在痕量毒品分析检测领域中,实验室毒品检测方法主要包括相色谱法(GC)、高效液相色谱法(HPLC)、毛细管电泳法、气相色谱-质谱联用法(GC/MS)、高效液相色谱法-质谱联合检测(HPLC/MS)、质谱法(MS)等。虽然上述毒品检测方法灵敏度高、专属性强,但是,上述检测分析方法在测试前通常需要复杂的前处理。以SPE为例,受样品局限、液面、填料的装填松紧等问题影响,增加了操作的技术难度,且需要进行活化、净化,洗脱等系列操作,无疑使得处理时间变长,因此上述检测分析方法的测试前处理,存在操作繁琐、用时较长、效率较低的情况。
近年来,虽然采用色谱法与质谱法的方法是对样品进行定性定量分析的方式较为多见,但是采用质谱法分析对检测条件要求较高,离子源部分受自身结构与工作环境的限制(通常采用封闭式电离方式,或处于相对真空环境),难以满足实际样品(尤其是生物样品)实时、原位和活体分析的需求。检测设备的体积较大,往往只适用于在实验室而不便于外出携带,因此难以实现在现场精准快速检测分析样品中毒品情况的功能。
发明内容
为了克服现有技术的不足,本发明的目的在于提供一种基于固相微萃取及实时分析质谱检测毒品量的检测方法,该检测方法能够简化检测步骤,实现现场检测分析,提高检测灵活性和工作效率。
本发明的目的通过以下技术方案实现:
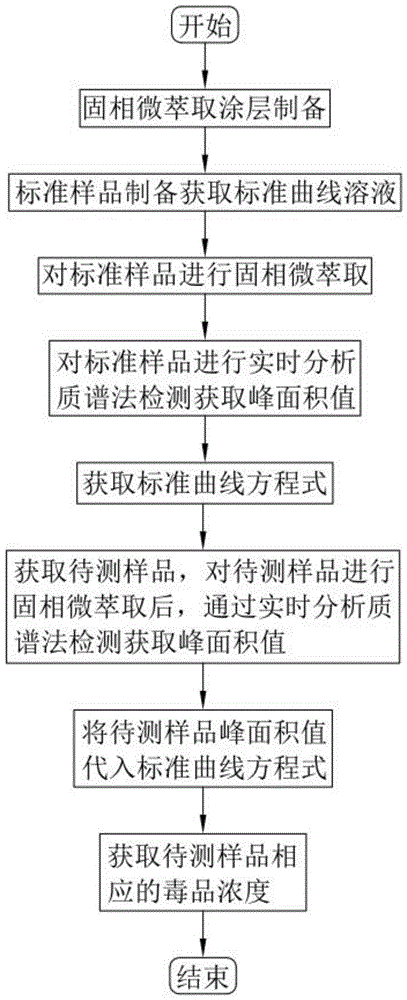
一种基于固相微萃取及实时分析质谱检测毒品量的检测方法,包括以下步骤:
固相微萃取涂层制备:根据待测样品及目标检测毒品种类,在玻璃棒上涂抹相应的涂层溶液,制成固相微萃取头;
标准样品制备处理:通过标准样品制备获取标准曲线溶液;
固相微萃取及实时直接分析质谱检测:将制作好的固相微萃取头推进标准曲线溶液内进行萃取,然后对该萃取好的固相微萃取头进行实时直接分析质谱分析;
标准工作曲线绘制:获取标准曲线溶液的质谱图,进而获取标准曲线溶液的标准曲线方程式;
试样检测:获取呈液态的待测样品,将固相微萃取头推进待测样品内进行萃取,然后对该萃取好的固相微萃取头进行实时直接分析质谱分析,获取采样溶液质谱图,基于采样溶液质谱图与标准曲线方程式,获取采样溶液中所含毒品成分的含量。
进一步得,在制备涂层溶液和制备固相微萃取头过程中,选择PDMS作为涂层材料制备涂层溶液,包括以下步骤:
(1)使用PDMS材料制备套件,以磁性柚子皮生物炭作为组分A,以C18和SCX的混合物作为组分B,将组分A和组分B以重量比20:1的比例混合,然后加入至重量比为5:1的二氯甲烷和正己烷的混合溶液中,使得组分A和组分B混合物的最终浓度为0.10g/mL;
(2)在真空条件下将准备好的涂有上述溶液的玻璃棒,加热至75-85℃并保持两小时,再加热至110-125℃并保持3小时,最后加热至240-260℃并保持8小时,以完成固相微萃取头的制备。
进一步得,所述标准样品制备过程包括标准储备溶液的制备、混合标准溶液①和混合标准溶液②的制备、标准曲线溶液的制备。
进一步得,所述标准储备溶液的配制包括:称取各种毒品成分固体标准物于容量瓶中,用甲醇溶解并定容至刻度,获得1000mg/L的标准储备溶液。
进一步得,所述混合标准溶液①和混合标准溶液②的制备包括:提取标准储备溶液于容量瓶中,用甲醇稀释并定容,获得10mg/L的混合标准溶液①;提取部分混合标准溶液①,通过甲醇稀释并定容,获得1mg/L的混合标准溶液②。
进一步得,所述标准曲线溶液的制备包括:将混合标准溶液②用甲醇水溶液稀释,分别配置成多个不同浓度的标准曲线溶液,其中,每一标准曲线溶液中同位素示踪物的浓度均为100μg/L。
进一步得,在固相微萃取头推进标准曲线溶液内进行萃取时,采用磁力搅拌器搅拌标准曲线溶液,固相微萃取头伸入标准曲线溶液液面下0.8-1.5厘米处,萃取时间为15-30分钟。
进一步得,在对萃取好的固相微萃取头进行实时直接分析质谱分析的过程中,将在标准曲线溶液中萃取完成的固相微萃取头取出后,插入实时直接分析质谱设备的进样口内,利用实时直接分析质谱设备进行实时直接分析质谱分析。
进一步得,在获取标准曲线溶液的标准曲线方程式过程中:通过实时直接分析质谱设备进行实时直接分析质谱分析后,获取所述标准曲线溶液的质谱图,通过该质谱图获取每一标准曲线溶液的峰面积值,以每一标准曲线溶液的毒品浓度作为横坐标,以每一标准曲线溶液的峰面积作为纵坐标,进行线性回归分析,由此获取所述标准曲线溶液的标准曲线方程式。
进一步得,在试样检测时,在通过实时直接分析质谱设备进行实时直接分析质谱分析获取待测样品的质谱图后,通过该质谱图获取待测样品的峰面积值,将该峰面积值代入标准曲线方程式中,最终获取待测样品中所含毒品成分的含量。
本发明具有如下有益效果:
1、一种基于固相微萃取及实时分析质谱检测毒品量的检测方法,旨在于简化检测步骤,实现现场检测分析,提高检测灵活性和工作效率。故而通过步骤固相微萃取涂层制备在玻璃棒的表面涂抹涂层溶液,以制备形成固相微萃取头;然后通过标准样品制备,以制备形成标准曲线溶液,在具体实施过程中,可以通过控制增减标准样品的质量,从而制成多个不同浓度的标准曲线溶液;进而在固相微萃取和实时直接分析质谱检测过程中,通过涂层溶液制成的固相微萃取头推进标准曲线溶液内进行萃取后,对该固相微萃取头进行实时直接分析质谱检测分析,进而获取标准曲线溶液的质谱图,由该质谱图获取标准曲线溶液的标准曲线方程式。
2、该标准曲线方程式主要包含标准样品(毒品成分)的浓度,以及质谱图中关于该标准曲线溶液的相应参数值。因此以该标准曲线方程式作为检测的参考标准,在后续实际检测痕量毒品(试样检测)时,可以直接将待测样品进行固相微萃取和实时直接分析质谱检测,从而获得待测样品的质谱图,由待测样品质谱图获得相应参数值,将该参数值代入标准曲线方程式中,以获得采样溶液中对应毒品的浓度值。在该过程中,主要涉及检测前获取标准曲线方程式的萃取、定容、检测、计算操作,而在实际检测操作过程中,同样进行定容、检测、计算操作,相比于现有技术中检测前的操作步骤,本发明的检测步骤明显得以简化,并且可以根据实际需求在现场进行定容、检测、计算操作,由此实现操作方式及操作场地灵活,并且可以提高检测效率的有益效果。
附图说明
图1为本发明的方法流程图。
图2为PDMS、PA、PEG三种涂层材料的萃取效果对比柱形图。
图3为分别带有两种毒品样品溶液关于盐度量的萃取效果散点折线图。
图4为分别带有两种毒品样品溶液关于pH值的萃取效果散点折线图。
图5为分别带有两种毒品样品溶液关于萃取时间的萃取效果散点折线图。
图6为分别带有两种毒品样品溶液关于搅拌速率的萃取效果散点折线图。
图7为甲基苯丙胺样品溶液经固相微萃取和实时直接分析质谱检测后的质谱图。
图8为氯胺酮样品溶液经固相微萃取和实时直接分析质谱检测后的质谱图。
图9为吗啡样品溶液经固相微萃取和实时直接分析质谱检测后的质谱图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步的详细说明。本说明书中所引用的如“上”、“内”、“中”、“左”、“右”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
为了使阅读者了解固相微萃取、固相微萃取纤维涂层、实时直接分析质谱和实时直接分析质谱结合固相微萃取,进而便于较佳地理解本发明所阐述的具体技术方案,因此在介绍本发明的具体实施例及其实验例之前,首先对固相微萃取、固相微萃取纤维涂层、实时直接分析质谱和实时直接分析质谱结合固相微萃取进行介绍。
1、固相微萃取:是在固相萃取(SPE)基础上发展起来的一种简单、有效的样品吸附/脱附前处理技术,将取样、萃取、浓缩和进样集于一体,具有操作方便,耗时短,测定快速高效,无需任何有机溶剂等优点;同时该技术所需设备简单,操作快速,无需其他附属设备,且分析灵敏度高,检测限能够达到μg/L~ng/L水平,分析所需样品的体积小,不需要完全萃取或者完全平衡等特点。目前,在毒品分析应用中,固相微萃取技术已广泛应用于尿液、血液、唾液、毛发及其他生物检材中苯丙胺类、甲卡西酮类、可卡因及其衍生物、大麻、氯胺酮等滥用毒品及非法药物的检测。
2、固相微萃取纤维涂层:涂层材料的性质和制备方法是固相微萃取技术研究的核心内容,材料的结构和性能直接影响了固相微萃取的选择性和应用范围,在很大程度上决定了整个分析结果的准确性和灵敏度。
3、实时直接分析质谱:是一种热解析和离子化技术。在大气压条件下,中性或惰性气体(如氮气或氦气)经放电产生激发态原子,对该激发态原子进行快速加热和电场加速,使其解析并瞬间离子化待测样品表面的标志性化合物或待测化合物,进行质谱或串联质谱检测,从而实现样品的实时直接分析。
4、实时直接分析质谱结合固相微萃取:将固相微萃取技术与实时直接分析质谱组合的分析方法(SPME-DART-MS)在国内外均属于一套新颖的方法。该方法将两种技术的优势最大程度的发挥出来,不仅能够在高效快速预处理样品的前提下,实现对实际样品进行高通量、原位和在线分析,同时,不受工作环境的限制(如真空环境),可以在大气压环境下正常进行检测分析。目前实时直接分析质谱结合固相微萃取在各领域的运用均处于一个起步摸索的阶段。
基于上述关于固相微萃取、固相微萃取纤维涂层、实时直接分析质谱和实时直接分析质谱结合固相微萃取的介绍,以下对本发明的具体实施例及其实验例进行具体介绍:
实施例1
一种基于固相微萃取及实时分析质谱检测毒品量的检测方法,包括以下步骤:
固相微萃取涂层制备:根据待测样品及目标检测毒品种类,在玻璃棒上涂抹相应的涂层溶液,制成固相微萃取头;
标准样品制备处理:通过标准样品制备获取标准曲线溶液,其中的标准样品为各种毒品成分;
固相微萃取及实时直接分析质谱检测:将制作好的固相微萃取头推进标准曲线溶液内进行萃取,然后对该萃取好的固相微萃取头进行实时直接分析质谱分析;
标准工作曲线绘制:获取标准曲线溶液的质谱图,进而获取标准曲线溶液的标准曲线方程式;
试样检测:获取呈液态的待测样品,将固相微萃取头推进待测样品内进行萃取,然后对该萃取好的固相微萃取头进行实时直接分析质谱分析,获取采样溶液质谱图,基于采样溶液质谱图与标准曲线方程式,获取采样溶液中所含毒品成分的含量。
具体的,本发明旨在于简化检测步骤,实现现场检测分析,提高检测灵活性和工作效率。故而通过步骤固相微萃取涂层制备在玻璃棒的表面涂抹涂层溶液,以制备形成固相微萃取头;然后通过标准样品制备,以制备形成标准曲线溶液,在具体实施过程中,可以通过控制增减标准样品的质量,从而制成多个不同浓度的标准曲线溶液;进而在固相微萃取和实时直接分析质谱检测过程中,通过涂层溶液制成的固相微萃取头推进标准曲线溶液内进行萃取后,对该固相微萃取头进行实时直接分析质谱检测分析,进而获取标准曲线溶液的质谱图,由该质谱图获取标准曲线溶液的标准曲线方程式。
该标准曲线方程式主要包含标准样品(毒品成分)的浓度,以及质谱图中关于该标准曲线溶液的相应参数值。因此以该标准曲线方程式作为检测的参考标准,在后续实际检测痕量毒品(试样检测)时,可以直接将待测样品进行固相微萃取和实时直接分析质谱检测,从而获得待测样品的质谱图,由待测样品质谱图获得相应参数值,将该参数值代入标准曲线方程式中,以获得采样溶液中对应毒品的浓度值。
在该过程中,主要涉及检测前获取标准曲线方程式的萃取、定容、检测、计算操作,而在实际检测操作过程中,同样进行定容、检测、计算操作,相比于现有技术中检测前的操作步骤,本发明的检测步骤明显得以简化,并且可以根据实际需求在现场进行定容、检测、计算操作,由此实现操作方式及操作场地灵活,并且可以提高检测效率的有益效果。
进一步得,在所述涂层溶液制备过程中,需要根据待测样品的选取和不同毒品及其代谢物的性质需求,从而选择不同的涂层材料制作萃取膜(fiber coating)。以下关于涂层溶液的制备操作进行公开:选择PDMS作为涂层材料制备涂层溶液,包括以下步骤:
(1)使用PDMS材料制备套件,以磁性柚子皮生物炭作为组分A,以C18和SCX的混合物作为组分B,将组分A和组分B以重量比20:1的比例混合,然后加入至重量比为5:1的二氯甲烷和正己烷的混合溶液中,使得组分A和组分B混合物的最终浓度为0.10g/mL;
其中,组分A的磁性柚子皮生物炭,也称为magnetic pomelo peel-derivedbiochar,是一种优质吸附剂;组分B中C18是十八烷基硅烷键合相的简称,其纯度为80%;SCX是硅胶基质的苯磺酸基填料,其纯度为20%。
(2)将上述准备好的溶液,均匀涂抹在玻璃棒表面;
(3)在真空条件下将准备好的涂有上述溶液的玻璃棒,加热至80℃并保持两小时,再加热至120℃并保持3小时,最后加热至250℃并保持8小时,以完成固相微萃取头的制备。
进一步得,为了对标准样品制备处理的过程进行公开,标准样品制备过程包括标准储备溶液的制备、混合标准溶液①和混合标准溶液②的制备、标准曲线溶液的制备。
所述标准储备溶液的配制包括:分别称取10mg(±0.01mg)各种毒品成分固体标准物于10mL容量瓶中,用甲醇溶解并定容至刻度。标准储备溶液浓度基本控制在1000mg/L。若因毒品成分标准物性状影响(如粘度过大等原因)可适当调整其称重量、定容体积或最终浓度。标准储备溶液贮存于-18℃±4℃冰箱中,有效期为1年。每次新配制母液需要做期间核查以确保母液的稳定性。母液的有效期不得超过用于配制它的标准参考物质的有效期。
所述混合标准溶液①和混合标准溶液②的制备包括:移取适量上述标准储备溶液于10mL容量瓶中,用甲醇稀释并定容至刻度,得到10mg/L的混合标准溶液1。混合标准溶液①(10mg/L)贮存于-4℃±4℃冰箱中,有效期为3个月。准确移取1.0ml混合标准溶液①(10mg/L)于10mL容量瓶中,用甲醇稀释并定容至刻度,得到1mg/L的混合标准溶液②,贮存于-4℃±4℃冰箱中,有效期为1个月。
所述标准曲线溶液的制备包括:将上述混合标准溶液②(1mg/L)用甲醇水(1:1)溶液稀释,配制成0.1μg/L、0.5μg/L、1.0μg/L、5.0μg/L、10.0μg/L、50.0μg/L、100.0μg/L、500.0μg/L、1000μg/L、5000μg/L十个不同浓度的标准曲线溶液,其中标准曲线溶液中同位素示踪物的浓度均为100μg/L。值得说明的是标准曲线溶液临用现配。
进一步得,在固相微萃取头推进标准曲线溶液内进行萃取时,采用磁力搅拌器搅拌标准曲线溶液,固相微萃取头伸入标准曲线溶液液面下0.8-1.5厘米处,萃取时间为15-30分钟。
进一步得,为在对萃取好的固相微萃取头进行实时直接分析质谱分析的过程中,将在标准曲线溶液中萃取完成的固相微萃取头取出后,插入实时直接分析质谱设备的进样口内,利用实时直接分析质谱设备进行实时直接分析质谱分析。
在利用实时直接分析质谱设备对固相微萃取头进行实时直接分析质谱分析时,测定条件如下:
1)采用DART离子源和三重四级杆质谱;
2)离子的质量扫描范围:m/z 40~500;
3)检测模式:正离子模式采集数据;
4)离子传输管温度:300℃;
5)离子化气体为高纯氦气,待机气体为高纯氮气;
6)Gridvoltage范围为100-400V,气压为0.2-0.5MPa;
7)检测方式:多反应监测模式(MRM);
8)碰撞电压为0-200eV,碰撞气压为0-5mTorr。
进一步得,在获取标准曲线溶液的标准曲线方程式过程中:通过实时直接分析质谱设备进行实时直接分析质谱分析后,获取所述标准曲线溶液的质谱图,通过该质谱图获取每一标准曲线溶液的峰面积值,以每一标准曲线溶液的毒品浓度作为横坐标,以每一标准曲线溶液的峰面积作为纵坐标,进行线性回归分析,由此获取所述标准曲线溶液的标准曲线方程式。
进一步得,在试样检测时,在通过实时直接分析质谱设备进行实时直接分析质谱分析获取待测样品的质谱图后,通过该质谱图获取待测样品的峰面积值,将该峰面积值代入标准曲线方程式中,最终获取待测样品中所含毒品成分的含量。
为了体现试样检测的准确度,试样检测时,会平行取多个待测样品2-5mL,本实施例中所取的待测样品数量为三个。该待测样品可以是同一类型如均为污水,也可以是不同类型待测样品如尿液、唾液、污水。三个待测样品分别置于三个采样瓶内,标位实验组1、实验组2、实验组3。样品在萃取前无需进行任何处理,接着将三个固相微萃取头分别推进实验组1、实验组2、实验组3的待测样品内进行萃取,进而通过实时直接分析质谱设备进行实时直接分析质谱分析获取分别对应实验组1、实验组2、实验组3的待测样品的质谱图,通过该质谱图获得不同实验组的峰面积至,将获得的峰面积值代入标准曲线方程式中,获得不同实验组中所含不同毒品成分的含量。
基于上述关于本发明一种基于固相微萃取及实时分析质谱检测毒品量的检测方法的公开,进一步对本发明的设计原理进行介绍:
本方法采用实时直接分析质谱结合固相微萃取分析方法,采用固相微萃取技术,通过不同材料探针涂层的合成制备不同的萃取头,再对复杂待测样品进行简单的预处理,通过将探针插进样品中,一定时间后抽出这一快捷高效全程无污染的动作,即完成了取样、萃取、浓缩和进样的一整套操作。克服了原来样品预处理中存在的操作繁琐、用时较长、所需试剂材料复杂等问题,对于复杂生物检材中痕量毒品的分析效率问题有着极大的改善与提高。
分析检测部分采用实时直接分析质谱技术,使得整套分析过程可以在常压下进行,无需真空系统的辅助,在大气压状态下,通过持续不断的氮气/氦气吹出和高温电场的轰击,使待测化合物瞬间离子化。与常规的色谱-质谱技术相比,离子源部分不需要真空系统,样品前处理简单,不需色谱分离,同时可减少质谱污染;灵敏度高,样品损耗小;操作简便,样品分析时间短,可实现实时定性分析。
基于上述关于本发明设计原理的介绍,进而获得本发明的整体方案相比于现有技术而产生的有益效果:
(1)实时直接分析质谱结合固相微萃取分析方法在痕量毒品分析检测领域的率先应用。实时直接分析质谱结合固相微萃取分析方法作为一种新颖高效的分析方法在各个领域的研究应用进程还比较缓慢,本方法在痕量毒品分析检测领域率先研究与应用,对毒品成分的精准分析与快速检测具有重要意义。本方法的前处理技术集取样、萃取、浓缩和进样于一体,操作方便,耗时短,测定快速高效;无需任何有机溶剂,是真正意义上的固相萃取,避免了对环境的二次污染;仪器简单,无需附属设备,适于现场分析,也易于操作;灵敏度高,可以实现超痕量分析,可以达到纳克每克(ng/g)级别的检测。
(2)本方法的分析检测技术与常规的色谱-质谱技术相比,在常压条件下即可进行,离子源部分不需要真空系统,样品前处理简单,不需色谱分离,同时可减少质谱污染;灵敏度高,样品损耗小;操作简便,样品分析时间短,可实现实时定性分析。
(3)本方法可以实现多组分同时分析;无需冗长的色谱分离,分析速度为秒级,能够有效的节省时间(单个样本分析时间只需几秒);
(4)萃取膜(fiber coating)可以根据需求自行合成;可以做成车载,方便快捷得出结果;
(5)使用该套方法可以检测复杂基质(如血液、尿液、唾液等体液,以及污水、空气等)。
实验例1(涂层材料的选择)
选取PDMS、PA、PEG三种涂层材料制备出对应的固相微萃取头,分别取这三种固相微萃取头每种两个,每三种固相微萃取头作为一组,然后将这两组固相微萃取头分别推进含AMP(苯丙胺)浓度相同的溶液和含MAMP(甲基苯丙胺)浓度相同的溶液中进行萃取。其中,每一固相微萃取头伸入液面下的深度一致,且萃取时间相同,接着将这六个固相微萃取头分别插入实时直接分析质谱设备的进样口进行实时直接分析质谱分析后,获得每一固相微萃取头相应的质谱图,由该质谱图获取相应的峰面积值。接着,以图层材料的不同作为横坐标,以峰面积值作为纵坐标,建立柱状对比图,具体如图2的柱状对比图所示。通过图2的柱状图可以看出,三种涂层材料对不同的毒品均具有萃取效果,其中PDMS的萃取效果最好。
实验例2(离子化气体温度的选择)
气体温度对实时直接分析质谱离子化效率的影响很重要,温度过低,离子化不完全;温度过高,可导致部分样品成分受热分解。考察了在各个实时直接分析质谱条件不变的情况下,设置不同离子化温度组别,分别为250℃、300℃、350℃、400℃时的离子化效率,发现在300℃时的响应最大。因此,选择300℃作为离子化气体温度。
实验例3(样品溶液盐度的选择)
样品溶液的离子强度会影响分析物的溶解度以及在液相和气相之间的分布。因此,取两组样品溶液,其中一组样品溶液中均存在有浓度相同的苯丙胺,另一组样品溶液中均存在有浓度相同的甲基苯丙胺,每组样品溶液的数量均为五份;向每组五份样品溶液中加入不同浓度(0%、10%、20%、30%、40%)的NaCl,然后取10支相同的固相微萃取头分别推进十份样品溶液内进行萃取。其中,每一固相微萃取头伸入液面下的深度一致,且萃取时间相同,接着将这十个固相微萃取头分别插入实时直接分析质谱设备的进样口进行实时直接分析质谱分析后,获得每一固相微萃取头相应的质谱图,由该质谱图获取相应的峰面积值,进而研究离子强度对萃取率的影响。
接着,以样品溶液的盐度作为横坐标,以峰面积值作为纵坐标,建立散点折线图,具体如图3的散点折线图所示。通过图3的散点折线图可以看出,在加入30%NaCl的样品溶液中,峰面积值最大,故纤维萃取的量最大,所以30%NaCl最佳。因此,在制备标准曲线溶液的过程中可以加入30%NaCl,同时获取待测样品时可以加入30%NaCl,从而使标准曲线溶液和待测样品的盐度保持在最佳状态,进而提高检测效果的功能。
实验例4(样品溶液pH值的选择)
样品溶液的pH值会影响分析物的溶解度以及在液相和气相之间的分布。因此取两个分别含有苯丙胺和甲基苯丙胺样品溶液,且这两个样品溶液的pH值均为7,通过向这两个样品溶液中加入NaOH以调节溶液的pH值,每次将溶液调节至相应pH值后,则取两个固相微萃取头分别推进这两个样品溶液内进行萃取。其中,每一固相微萃取头伸入液面下的深度一致,且萃取时间相同,接着将这两个固相微萃取头分别插入实时直接分析质谱设备的进样口进行实时直接分析质谱分析后,获得每一固相微萃取头相应的质谱图,由该质谱图获取相应的峰面积值,研究pH对萃取效率的影响。
接着,以样品溶液的pH值为横坐标,以峰面积值作为纵坐标,建立散点折线图,具体如图4的散点折线图所示。通过图4的散点折线图可以看出,当pH值为14时,峰面积值最大,故纤维萃取的量最大,所以pH值为14最佳。因此,在制备标准曲线溶液的过程中调节pH值为14,同时获取待测样品时可以调节pH值为14,从而使标准曲线溶液和待测样品的pH值保持在最佳状态,进而提高检测效果的功能。
实验例5(萃取时间的选择)
在固相微萃取中,萃取量和萃取时间之间存在直接关系,但固相微萃取是一种萃取不完全技术。因此,不需要达到最大萃取量,节约时间、提高分析效率同样是考虑的重要因素。因此取两个分别含有苯丙胺和甲基苯丙胺的样品溶液,然后取多个固相微萃取头,分为两份后分别推进两个样品溶液内进行萃取,其中,每一固相微萃取头伸入液面下的深度一致,每过10分钟,则取出一个固相微萃取头插入插入实时直接分析质谱设备的进样口进行实时直接分析质谱分析后,获得每一固相微萃取头相应的质谱图,由该质谱图获取相应的峰面积值。
接着,以时间为横坐标,以峰面积值作为纵坐标,建立散点折线图,具体如图5的散点折线图所示。通过图5的散点折线图可以看出,在30min后增加缓慢,综合考虑萃取的有效性和时间成本,认为30min是最佳萃取时间。
实验例6(搅拌速率的选择)
适当的转速可以增加目标分子从液相到气相的分散速率。因此取两个分别含有苯丙胺和甲基苯丙胺的样品溶液,调节调节两个样品溶液搅拌速率,同时取两个固相微萃取头分别插入两个样品溶液内进行萃取,控制固相微萃取头的插入深度一致,且萃取时间相同,接着将这两个固相微萃取头分别插入实时直接分析质谱设备的进样口进行实时直接分析质谱分析后,获得每一固相微萃取头相应的质谱图,由该质谱图获取相应的峰面积值。
接着,以搅拌速率为横坐标,以峰面积值为纵坐标,建立散点折线图,具体如图6的散点折线图所示。通过图6的散点折线图可以看出,从400rpm到600rpm的萃取量增加显著,然而从600rpm到700rpm的萃取量增长缓慢。因此,600rpm为最佳转速。
实验例7(标准曲线方程的线性可靠性)
选取常见毒品甲基苯丙胺、吗啡和氯胺酮标准品为例以实施例1中制备标准曲线溶液的方式制备相应的标准曲线溶液,通过步骤固相微萃取和实时直接分析质谱分析测定获得如下表所示的标准曲线方程式,以考察该方法的线性、检出限、定量限等参数,结果如下表1所示:
表1各种毒品制备的标准曲线溶液对应的标准曲线方程式及其相关参数
从上表可以看出,常见毒品制备的标准曲线溶液对应的标准曲线方程在0.1-100μg/L范围内线性良好,线性范围在0.9960-0.9974之间,RSD均<10%,方法重现性好,可以用来测定基质中的常见毒品。
实验例8
为了通过污水验证实验例7中三种毒品的样品浓度与通过实验例7的标准曲线方程式获得的理论浓度是否在可允许的相对标准偏差范围内,进而验证本发明的毒品浓度检测方法是否适用于污水中常见毒品的定量检测。
实际样品(以污水样品为例)中甲基苯丙胺、吗啡和氯胺酮的定量结果采用外标定量法,在三组污水样品中添加的三种毒品标准品,每组污水样品为三份,每组中三份污水样品的毒品标准品浓度分别为1ug/L、10ug/L、100ug/L,按
实施例1中制备标准曲线溶液的方式制备相应的标准曲线溶液,通过固相微萃取头和实时直接分析质谱设备实时直接分析质谱分析测定,每一份污水样品通过实时直接分析质谱设备检测获得相应的峰面积值(如图7至图9所示),将获得的峰面积值代入是实验例7中毒品类型相同的对应标准曲线方程式中,从而获得每一份污水样品的理论浓度,进一步通过验算获得相应的相对标准偏差值,三组标准样品的理论浓度及其标准偏差如下表2所示。
表2各种毒品的理论浓度及其相对标准偏差
由表2可以看出,每一样品的RSD(相对标准偏差)≤11%,根据标曲换算出的样品浓度与理论值相近,说明该方法适用于污水中常见毒品的定量检测。
本发明的实施方式不限于此,按照本发明的上述内容,利用本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,本发明还可以做出其它多种形式的修改、替换或组合,均落在本发明权利保护范围之内。
- 一种顶空固相微萃取-气相色谱质谱检测分析方法
- 一种固相萃取与实时直接分析质谱联用的分析方法及实时直接质谱分析装置
