提高CAR-NK细胞阳性率的表达方法及LDL受体应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及慢病毒转染、包装等技术领域,尤其涉及一种LDL受体基因及其应用。
背景技术
肿瘤(tumour)是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物(neogrowth),因为这种新生物多呈占位性块状突起,也称赘生物(neoplasm)。其中,恶性肿瘤因易发生转移,治疗后易复发且在某些特殊的微环境下导致极难治愈。
原代NK细胞对于基因转染的抵抗力较强,这导致NK细胞对多种载体系统的摄取率低,NK细胞的转基因表达量低,只有病毒载体在原代NK细胞中实现了较高的基因转移效率。为了提高病毒载体的安全性,已经创建了表达系统,其中包膜蛋白在单独的质粒上表达。这允许在称为假型化的过程中安全生成具有外源包膜蛋白的修饰病毒颗粒。增强NK细胞转导的一种方法是选择最佳假型包膜蛋白。常用的水泡性口炎病毒(VSV)糖蛋白G通常非常有效,因为它与存在于多种细胞中的LDL受体结合。然而,它对淋巴细胞的感染效率低下,并且由于NK细胞表面LDL受体表达量极低,即使使用高病毒滴度侵染,也无法有效提高侵染效率还往往对细胞有毒性。
近几年来,肿瘤免疫疗法发展迅速,尤其是过继性细胞疗法(ACT),即指从病人体内分离出T细胞、NK细胞等免疫细胞,通过体外修饰扩增培养,随后回输入患者体内进行肿瘤治疗的方法。2013年,肿瘤的免疫疗法被Science杂质评为“十大突破”之首。
CAR-T和TCR-T是过继性细胞疗法重要的组成部分,尤其CAR-T疗法,在血液肿瘤的治疗上取得了显著的成就,取得了较高的缓解率,典型的CAR结构由三部分组成,胞外识别肿瘤抗原的scFv、铰链和跨膜结构域、胞内共刺激信号和激活结构域。第一代的CAR并不包含胞内共刺激信号,CAR-T细胞的杀伤活性较低且生存时间较短。因此,第二代CAR开始加入共刺激信号如CD28和4-1BB,采用不同的共刺激信号的CAR-T细胞的特性也不尽相同,CD28增强了CAR-T细胞的杀伤活性而4-1BB则增强CAR-T细胞杀伤活性的同时延长了CAR-T细胞的生存时间。随后,出现了共同表达两个共刺激信号域的三代CAR,然而其抗肿瘤效果并不如二代CAR-T。因此,现在临床应的主要为二代CAR-T细胞。
带有CAR受体的NK细胞(CAR-NK),被认为是一种有效的抗癌工具。最初,CAR-NK细胞的创建是使用为CAR-T细胞开发的结构进行的;然而,最近的发展已经纳入了对NK细胞的适应。然而,NK细胞带来了特殊和独特的问题。与T细胞和B细胞不同,NK细胞通常不会克隆扩增,这使得CAR-NK细胞的生成、维持和扩增具有挑战性。NK-CAR细胞生成中最重要的阶段是将遗传元件引入NK细胞本身以及随后的CAR-NK细胞扩增。
发明内容
基于上述问题,本发明所要解决的问题在于提供一种可以在NK细胞表面瞬时过表达LDL受体,并可以有效提高慢病毒侵染效率的LDL受体基因。
本发明的技术方案如下:
一种提高CAR-NK细胞阳性率的表达方法,包括如下步骤:
NK细胞激活并瞬时过表达LDL受体;
对过表达LDL受体的NK细胞进行慢病毒侵染。
NK细胞激活并瞬时过表达LDL受体,采用瞬转方式在已激活的NK细胞表面瞬时过表达LDL受体,且瞬转方式包括钙转法、LIPO3000转染法、脂质体转染法及其他试剂盒转染法中的任一种。
对过表达LDL受体的NK细胞进行慢病毒侵染,采用慢病毒侵染方式在经过处理的NK细胞中表达CAR基因,且NK细胞激活方法包括抗体激活法、磁珠激活法、细胞刺激法、化学试剂法及其他试剂盒激活法中的任一种或多种组合;慢病毒包膜为水泡性口炎病毒糖蛋白G(VSV-G),并且慢病毒中包含CAR基因。慢病毒包装过程包括三质粒系统、四质粒系统中的任一种。
一实施例,所述表达方法中,所述NK细胞激活并瞬时过表达LDL受体步骤中,还包括如下步骤:
从外周血中获取NK细胞,并按照5.0×10
NK细胞培养16~18小时后,去除培养基,更换无血清培养基,孵育1小时;
将质粒转染混合液加入24孔板中,对NK细胞进行瞬时转染处理;
转染6小时后,去除24孔板中的混合液,更换完全培养基;转染48小时后,收集上清NK细胞悬浮液,此时NK细胞激活并瞬时过表达LDL受体。
一实施例,所述表达方法中,NK细胞无血清培养时,每5.0×10
一实施例,所述表达方法中,所述质粒转染混合液包括四质粒、Lipo 3000和OPTI-MEM,且LIPO3000与四质粒总数按2:1(v/m),OPTI-MEM为100~300ul。
一实施例,所述表达方法中,所述对过表达LDL受体的NK细胞进行慢病毒侵染步骤中,还包括如下步骤:
往激活后的瞬转过表达LDL受体的NK细胞悬液中加入转染助转剂,获得NK细胞转染悬液;
往NK细胞转染悬液中加入慢病毒,进行慢病毒转染;
慢病毒转染完成后,加入完全培养基,对慢病毒转染的NK细胞进行培养;随后收集细胞悬液,备用。
一实施例,所述表达方法中,所述转染助转剂为Polybrene助转剂或碱性氨基酸的无血清培养基;且每1ml NK细胞悬液添加2μl~20μl的转染助转剂。
一实施例,所述表达方法中,慢病毒转染步骤中,所述慢病毒的加入量为MOI=1~20,且转染时间为6~24小时。
一实施例,所述表达方法中,对慢病毒转染后的NK细胞进行培养时,完全培养基的加入量应保持细胞浓度为5.0×10
一实施例,所述表达方法中,所述完全培养基为含10~20%v/v FBS的完全培养基。
上述CAR基因包括二代、三代、四代、五代CAR;CAR结构靶向靶点包括CLDN18.2、GUCY2C、Nectin4、GPC3、CD19、CD22中的任一种或多种。
上述表达方法中,所述LDL受体基因的核酸序列如SEQ ID NO:1所示;该LDL受体基因可以提高CAR-NK细胞阳性率。
一种载体,该载体包含LDL受体基因;较好的,所述载体包括质粒、DNA或mRNA。
一种表达盒,该表达盒包含LDL受体基因,或者包含上述载体。
一种重组微生物,该微生物包含LDL受体基因、上述载体或者上述表达盒
一种重组NK免疫细胞,该重组NK免疫细胞包含LDL受体基因、上述载体或者上述表达盒。
一实施例,所述重组NK免疫细胞结构中,在LDL受体基因前设有CMV或EF1a启动子,在LDL受体基因后设有eGFP荧光基因;其中,LDL受体基因与eGFP基因之间由蛋白分割元件分割,蛋白分割元件包括T2A、P2A、E2A、F2A及IRES中的任一种。
一实施例,CAR-NK细胞中,质粒表达盒包括过表达LDL受体基因表达盒、慢病毒包膜基因表达盒及CAR基因表达盒中的一种或多种。
一种生物制剂,该生物制剂包含LDL受体基因、上述载体、上述表达盒,或者上述重组免疫细胞;且该生物制剂可以应用于制备治疗/预防肿瘤和/或癌症的药物。
与现有技术相比,本发明具有如下有益效果:
1、在NK细胞表面瞬时过表达LDL受体,不影响NK细胞正常表型及发育过程;
2、有效提升NK细胞的侵染效率,解决NK细胞慢病毒侵染效率低下的问题;
3、侵染后的CAR-NK细胞保持良好杀伤能力,经过工艺优化可达到临床标准。
本发明提供的CAR-NK细胞制备方式,可以安全、方便、有效的制备出临床等级的CAR-NK细胞,并保证其拥有极高的阳性率和制备成功率,通过工艺优化保证其各项检测指标符合临床需求,并且完整保留其应有的功能及表型,具有极高的肿瘤清除效果。
附图说明
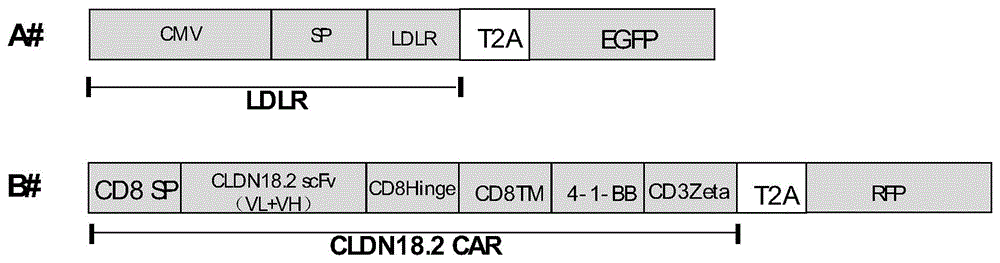
图1为CAR-NK免疫细胞中的蛋白和氨基酸序列结构设计图;其中,A#为L DLR蛋白结构,使用P2A蛋白切割元件分割LDLR蛋白和eGFP荧光标记蛋白;B#为CAR结构设计图;
图2为靶细胞HGC-27和HGC27-CLDN18.2的表型流式检测结果;
图3a、3b分别为PBMC中分离纯化NK细胞表型检测结果;其中图3a为NK细胞空白对照,图3b为NK细胞CD3/CD56表型检测结果;
图4a、4b分别为NK细胞瞬转LDLR表达检测图;其中,4a为NK细胞空白对照,4b为NK细胞瞬转LDLR后阳性表达检测结果;
图5a、5b分别为CAR-NK和CAR-LDLR-NK细胞的CAR阳性率检测图;其中,图5a为CAR-NK细胞的CAR阳性率检测结果;图5b为CAR-LDLR-NK细胞的CAR阳性率检测结果;
图6为CAR-NK和CAR-LDLR-NK细胞的扩增生长曲线图;
图7a、7b分别为CAR-NK和CAR-LDLR-NK细胞对肿瘤细胞体外杀伤效果图;其中,图7a的靶细胞为HGC27;图7b的靶细胞为HGC27-CLDN18.2;
图8为CAR-NK和CAR-LDLR-NK细胞动物实验生存曲线。
具体实施方式
下面结合附图,对本发明的较佳实施例作进一步详细说明。
本发明设计原理:
原代NK细胞对于基因转染的抵抗力较强,这导致NK细胞对多种载体系统的摄取率低,NK细胞的转基因表达量低,只有病毒载体在原代NK细胞中实现了较高的基因转移效率。为了提高病毒载体的安全性,已经创建了表达系统,其中包膜蛋白在单独的质粒上表达。这允许在称为假型化的过程中安全生成具有外源包膜蛋白的修饰病毒颗粒。增强NK细胞转导的一种方法是选择最佳假型包膜蛋白。常用的水泡性口炎病毒(VSV)糖蛋白G通常非常有效,因为它与存在于多种细胞中的LDL受体结合。然而,它对淋巴细胞的感染效率低下,并且由于NK细胞表面LDL受体表达量极低,即使使用高病毒滴度侵染,也无法有效提高侵染效率还往往对细胞有毒性。因此本发明开创性的在慢病毒侵染NK细胞前,先通过瞬转在NK细胞表面过表达LDL受体,使得带有VSV-G包膜蛋白的慢病毒的侵染效率大幅提升,该设计最大限度的兼顾了慢病毒侵染效果的提升及对NK细胞的基因型和表型的稳定,本发明的CAR-LDLR-NK细胞杀伤效果精准,安全性高,不易复发,可有效提高患者的生存质量。
上述CAR-LDLR-NK细胞的制备方法,为使用瞬转方式在已激活的NK细胞表面瞬时过表达LDL受体,然后通过慢病毒侵染方式在经过处理的NK细胞中表达CAR基因。
本发明中,所述的制备方法其表达LDL受体基因载体包括质粒、DNA、mRNA。
本发明提供的LDL受体基因可以提高CAR-NK细胞阳性率,其核酸序列如SEQ IDNO:1所示,该LDL受体基因的氨基酸序列如SEQ ID NO:2所示;其中:
核酸序列如SEQ ID NO:1所示:
ATGGGGCCCTGGGGCTGGAAATTGCGCTGGACCGTCGCCTTGCTCCTCGCCGCGGCGGGGACTG CAGTGGGCGACAGATGTGAAAGAAACGAGTTCCAGTGCCAAGACGGGAAATGCATCTCCTACAAGTGGGTCTGCGATGGCAGCGCTGAGTGCCAGGATGGCTCTGATGAGTCCCAGGAGACGTGCTTGTCTGTCACCTGCAAATCCGGGGACTTCAGCTGTGGGGGCCGTGTCAACCGCTGCATTCCTCAGTTCTGGAGGTGCGATGGCCAAGTGGACTGCGACAACGGCTCAGACGAGCAAGGCTGTCCCCCCAAGACGTGCTCCCAGGACGAGTTTCGCTGCCACGATGGGAAGTGCATCTCTCGGCAGTTCGTCTGTGACTCAGACCGGGACTGCTTGGACGGCTCAGACGAGGCCTCCTGCCCGGTGCTCACCTGTGGTCCCGCCAGCTTCCAGTGCAACAGCTCCACCTGCATCCCCCAGCTGTGGGCCTGCGACAACGACCCCGACTGCGAAGATGGCTCGGATGAGTGGCCGCAGCGCTGTAGGGGTCTTTACGTGTTCCAAGGGGACAGTAGCCCCTGCTCGGCCTTCGAGTTCCACTGCCTAAGTGGCGAGTGCATCCACTCCAGCTGGCGCTGTGATGGTGGCCCCGACTGCAAGGACAAATCTGACGAGGAAAACTGCGCTGTGGCCACCTGTCGCCCTGACGAATTCCAGTGCTCTGATGGAAACTGCATCCATGGCAGCCGGCAGTGTGACCGGGAATATGACTGCAAGGACATGAGCGATGAAGTTGGCTGCGTTAATGTGACACTCTGCGAGGGACCCAACAAGTTCAAGTGTCACAGCGGCGAATGCATCACCCTGGACAAAGTCTGCAACATGGCTAGAGACTGCCGGGACTGGTCAGATGAACCCATCAAAGAGTGCGGGACCAACGAATGCTTGGACAACAACGGCGGCTGTTCCCACGTCTGCAATGACCTTAAGATCGGCTACGAGTGCCTGTGCCCCGACGGCTTCCAGCTGGTGGCCCAGCGAAGATGCGAAGATATCGATGAGTGTCAGGATCCCGACACCTGCAGCCAGCTCTGCGTGAACCTGGAGGGTGGCTACAAGTGCCAGTGTGAGGAAGGCTTCCAGCTGGACCCCCACACGAAGGCCTGCAAGGCTGTGGGCTCCATCGCCTACCTCTTCTTCACCAACCGGCACGAGGTCAGGAAGATGACGCTGGACCGGAGCGAGTACACCAGCCTCATCCCCAACCTGAGGAACGTGGTCGCTCTGGACACGGAGGTGGCCAGCAATAGAATCTACTGGTCTGACCTGTCCCAGAGAATGATCTGCAGCACCCAGCTTGACAGAGCCCACGGCGTCTCTTCCTATGACACCGTCATCAGCAGGGACATCCAGGCCCCCGACGGGCTGGCTGTGGACTGGATCCACAGCAACATCTACTGGACCGACTCTGTCCTGGGCACTGTCTCTGTTGCGGATACCAAGGGCGTGAAGAGGAAAACGTTATTCAGGGAGAACGGCTCCAAGCCAAGG GCCATCGTGGTGGATCCTGTTCATGGCTTCATGTACTGGACTGACTGGGGAACTCCCGCCAAGATCAAGAAAGGGGGCCTGAATGGTGTGGACATCTACTCGCTGGTGACTGAAAACATTCAGTGGCCCAATGGCATCACCCTAGATCTCCTCAGTGGCCGCCTCTACTGGGTTGACTCCAAACTTCACTCCATCTCAAGCATCGATGTCAATGGGGGCAACCGGAAGACCATCTTGGAGGATGAAAAGAGGCTGGCCCACCCCTTCTCCTTGGCCGTCTTTGAGGACAAAGTATTTTGGACAGATATCATCAACGAAGCCATTTTCAGTGCCAACCGCCTCACAGGTTCCGATGTCAACTTGTTGGCTGAAAACCTACTGTCCCCAGAGGATATGGTCCTCTTCCACAACCTCACCCAGCCAAGAGGAGTGAACTGGTGTGAGAGGACCACCCTGAGCAATGGCGGCTGCCAGTATCTGTGCCTCCCTGCCCCGCAGATCAACCCCCACTCGCCCAAGTTTACCTGCGCCTGCCCGGACGGCATGCTGCTGGCCAGGGACATGAGGAGCTGCCTCACAGAGGCTGAGGCTGCAGTGGCCACCCAGGAGACATCCACCGTCAGGCTAAAGGTCAGCTCCACAGCCGTAAGGACACAGCACACAACCACCCGGCCTGTTCCCGACACCTCCCGGCTGCCTGGGGCCACCCCTGGGCTCACCACGGTGGAGATAGTGACAATGTCTCACCAAGCTCTGGGCGACGTTGCTGGCAGAGGAAATGAGAAGAAGCCCAGTAGCGTGAGGGCTCTGTCCATTGTCCTCCCCATCGTGCTCCTCGTCTTCCTTTGCCTGGGGGTCTTCCTTCTATGGAAGAACTGGCGGCTTAAGAACATCAACAGCATCAACTTTGACAACCCCGTCTATCAGAAGACCACAGAGGATGAGGTCCACATTTGCCACAACCAGGACGGCTACAGCTACCCCTCGAGACAGATGGTCAGTCTGGAGGATGACGTGGCGTGA。
氨基酸序列如SEQ ID NO:2所示:
MGPWGWKLRWTVALLLAAAGTAVGDRCERNEFQCQDGKCISYKWVCDGSAECQDGSDESQETCLSVTCKSGDFSCGGRVNRCIPQFWRCDGQVDCDNGSDEQGCPPKTCSQDEFRCHDGKCISRQFVCDSDRDCLDGSDEASCPVLTCGPASFQCNSSTCIPQLWACDNDPDCEDGSDEWPQRCRGLYVFQGDSSPCSAFEFHCLSGECIHSSWRCDGGPDCKDKSDEENCAVATCRPDEFQCSDGNCIHGSRQCDREYDCKDMSDEVGCVNVTLCEGPNKFKCHSGECITLDKVCNMARDCRDWSDEPIKECGTNECLDNNGGCSHVCNDLKIGY ECLCPDGFQLVAQRRCEDIDECQDPDTCSQLCVNLEGGYKCQCEEGFQLDPHTKACKAVGSIAYLFFTNRHEVRKMTLDRSEYTSLIPNLRNVVALDTEVASNRIYWSDLSQRMICSTQLDRAHGVSSYDTVISRDIQAPDGLAVDWIHSNIYWTDSVLGTVSVADTKGVKRKTLFRENGSKPRAIVVDPVHGFMYWTDWGTPAKIKKGGLNGVDIYSLVTENIQWPNGITLDLLSGRLYWVDSKLHSISSIDVNGGNRKTILEDEKRLAHPFSLAVFEDKVFWTDIINEAIFSANRLTGSDVNLLAENLLSPEDMVLFHNLTQPRGVNWCERTTLSNGGCQYLCLPAPQINPHSPKFTCACPDGMLLARDMRSCLTEAEAAVATQETSTVRLKVSSTAVRTQHTTTRPVPDTSRLPGATPGLTTVEIVTMSHQALGDVAGRGNEKKPSSVRALSIVLPIVLLVFLCLGVFLLWKNWRLKNINSINFDNPVYQKTTEDEVHICHNQDGYSYPSRQMVSLEDDVA。
本发明中,LDL受体基因前,设有包括CMV、EF1a等其中一种启动子,并在LDL受体基因后添加eGFP荧光基因,LDL受体基因与eGFP基因间由蛋白分割元件分割,蛋白分割元件包括T2A、P2A、E2A、F2A及IRES中的任一种。
本发明中,NK细胞采用外周血,即脐带血NK细胞培养获得,这部分内容属于现有技术,由常规工艺可以获得;在此不再赘述。
本发明中,提高CAR-NK细胞阳性率的表达方法,其制备工艺如下:
首先,NK细胞激活并瞬时过表达LDL受体;
然后,再对LDL受体进行慢病毒包膜侵染。
本发明中,瞬转方式包括钙转法、Lipo3000转染法、脂质体转染法及其他试剂盒转染法中的任一种。
本发明中,NK细胞激活方法包括抗体激活法、磁珠激活法、细胞刺激法、化学试剂法及其他试剂盒激活法中的任一种或多种组合。
在NK细胞激活并瞬时过表达LDL受体后对其进行慢病毒侵染。
其中,NK细胞激活并瞬时过表达LDL受体步骤中,还包括如下步骤:
从外周血中获取NK细胞,并按照5.0×10
NK细胞培养16~18小时后,去除培养基,更换无血清培养基,孵育1小时;其中,每5.0×10
将质粒转染混合液加入24孔板中,对NK细胞进行瞬时转染处理;
转染6小时后,去除24孔板中的混合液,更换完全培养基;转染48小时后,收集上清NK细胞悬浮液,此时NK细胞激活并瞬时过表达LDL受体;其中,完全培养基为含10~20%v/vFBS的完全培养基。
本发明中,所述的慢病毒包膜为水泡性口炎病毒糖蛋白G(VSV-G),并且慢病毒中包含CAR基因;慢病毒包装过程包括三质粒系统、四质粒系统中的任一种;其中,所述质粒转染混合液包括四质粒、Lipo3000和OPTI-MEM,且Lipo3000与四质粒总数按2:1(v/m),OPTI-MEM为100~300ul。
本发明中,CAR基因包括二代、三代、四代、五代CAR。CAR结构靶向靶点包括CLDN18.2、GUCY2C、Nectin4、GPC3、CD19、CD22中的任一种或多种。
提高CAR-NK细胞阳性率的表达方法中,对过表达LDL受体的NK细胞进行慢病毒侵染步骤中,还包括如下步骤:
往激活后的瞬转过表达LDL受体的NK细胞悬液中加入转染助转剂,获得N K细胞转染悬液;
往NK细胞转染悬液中加入慢病毒,进行慢病毒转染;其中,所述慢病毒的加入量为MOI=1~20,且转染时间为6~24小时;
慢病毒转染完成后,加入完全培养基,对慢病毒转染的NK细胞进行培养;随后收集细胞悬液,备用;其中,完全培养基的加入量应保持细胞浓度为5.0×10
其中,所述转染助转剂为Polybrene助转剂或碱性氨基酸的无血清培养基;且每1ml NK细胞悬液添加2μl~20μl的转染助转剂。本发明中,优选转染助转剂为碱性氨基酸的无血清培养基,且碱性氨基酸包括1mg/ml~50mg/ml组氨酸、1mg/ml~50mg/ml赖氨酸及1mg/ml~50mg/ml精氨酸,无血清培养基为DMEM、IME M、RPMI-1640、KPM-581及OPTMIZERTCELL EXPANSFMCTS中的任一种。
本发明中,慢病毒为质粒转送载体。
本发明中,质粒的表达盒包含以上过表达LDL受体基因表达盒、慢病毒包膜基因表达盒、CAR基因表达盒等一种或多种。
本发明中,所述重组微生物含有以上任一所述LDL受体基因、或者含有以上所述表达盒、或者以上所述载体。
本发明中,免疫细胞为重组NK免疫细胞,其包括以上所述LDL受体基因、或者以上所述表达盒、或者以上所述载体。
本发明中,所述生物制剂包括以上所述LDL受体基因、或者以上所述表达盒、或者以上所述载体、或者以上所述重组NK免疫细胞。
本发明中,所述的生物制剂可以应用在制备治疗/预防肿瘤和/或癌症的药物方面;另外,上述方法制备的CAR-LDLR-NK细胞,也可被制成生物制剂,该生物制剂为药学上可接受的载体、稀释剂或赋形剂。
生物制剂的施用可以以任何方便的方式进行,包括通过喷雾法、注射、吞咽、输液、植入或移植。该生物制剂可应用于预防和/或治疗实体肿瘤的药物中。
本发明提供的CAR-LDLR-NK细胞解决了传统慢病毒侵染方法CAR阳性率低的问题,极大的提高了慢病毒侵染效率,并保持了良好的对于肿瘤的杀伤能力及免疫细胞治疗的有效性和安全性。
下列实施例,以外周血中NK细胞制备CAR-LDLR-NK为例,对免疫细胞的制备方法及功能验证等进行详细说明。
免疫细胞的制备方法具体包括以内容:
1、蛋白的结构设计;
2、构建过表达LDLR的CAR-LDLR-NK细胞并进行体外功能试验;
3、CAR-LDLR-NK细胞体内功能试验。
实施例1、蛋白的结构设计与靶细胞系培养
1.蛋白的结构设计
按照图1所示的结构图,设计如A#为LDLR(即LDL)蛋白结构,使用T2A蛋白切割元件分割LDLR蛋白和eGFP荧光标记蛋白;B#为CAR结构设计图,CAR结构的靶蛋白结合结构域为抗CLDN18.2 scFv,其他结构中包括信号肽CD8SP、跨膜结构域CD8Hinger、CD8TM、胞内激活元件4-1BB及CD3Zeta。
2、慢病毒制备、靶细胞系培养
将表达CLDN18.2碱基序列克隆至PHBLV慢病毒载体骨架中,置于EF1α(E F-1α)的启动子下,形成PHBLV-EF1α-CLDN18.2,将PHBLV-EF1α-CLDN18.2、慢病毒包膜质粒pMD2.G(Addgene,Plasmid#12259)及慢病毒包装质粒psPAX2(A ddgene Plasmid#12260)等三个质粒,使用Lipo3000转入293T细胞中制备的慢病毒完整表达载体上;然后分别在48h和72h收集病毒上清,并对所收集的病毒上清进行超速离心浓缩(Merck Millipore);浓缩后的病毒即可用于感染HGC-27,最终得到过表达CLDN18.2的HGC-27细胞系,命名为HGC-27-CLDN18.2。
如图2所示,HGC-27-CLDN18.2细胞表达CLDN18.2的检测结果;其中,HG C-27细胞为未过表达CLDN18.2的阴性对照细胞,对应的检测图为阴性对照图;根据HGC-27-CLDN18.2与HGC-27对应的检测结果,由图2中纵向两图可知,在FITC通道检测CLDN18.2抗原表达水平结果显示,HGC-27中CLDN18.2表达为阴性(峰图位于竖线左侧),HGC-27-CLDN18.2中CLDN18.2表达为阳性(峰图位于竖线右侧)。
实施例2、外周血PBMC的分离和NK细胞的分离
从供体外周血中分离单个核细胞,使用ficol法进行密度梯度离心,并用N K细胞分选试剂盒富集NK细胞,分选及富集试剂盒为商用产品化技术,在此不再赘述。
NK细胞培养时,使用TexMACS GMP Medium(Miltenyi Biotec,170-076-309)培养基,培养基中含10%FBS、2mM L-glutamine及100IU/ml rhIL-2,细胞培养时均置于37℃,5%CO
NK细胞表型使用CD3/CD56两种流式抗体进行双染,检测结果如图3a、3b所示。其中图3a为未染色NK细胞作为阴性对照,图3b为NK细胞的CD3/CD56双抗体染色结果,其中CD3-/CD56+表型细胞为NK细胞占比91.3%。
实施例3、LDLR的NK细胞瞬转表达
NK细胞计数,记录细胞活力、密度及数量;其中24孔板接种细胞数5.0×10
静置培养16到18h后,弃旧的完全培养基,更换为1ml无血清培养基,孵育1h;
找两支分离管,标识为A管和B管,A管中包括:125微升opti-MEM、5微升Lipo3000;B管中包括:125微升opti-MEM、2.5微克质粒,随后将A管与B管混合,制得质粒转染混合液并孵育15分钟后,把质粒转染混合液均匀加入24孔板中,对NK细胞进行瞬时转染处理;Lipo
转染6h后,吸弃转染混合液,更换成2ml完全培养基;转染48小时后,收集上清NK细胞悬浮液,此时NK细胞激活并瞬时过表达LDL受体。
流式细胞仪检测目标蛋白的表达,瞬转结果如图4a、4b所示,其中,图4a为NK细胞空白对照,图4b显示NK细胞瞬转LDLR后阳性率为80.53%,将该瞬转NK细胞命名为NK-LDLR。
将阳性对照CLDN18.2-CAR进行慢病毒包装,已MOI=3条件通过慢病毒侵染NK及NK-LDLR细胞制备得到的CAR-NK及CAR-LDLR-NK,所获得的CAR-NK及CA R-LDLR-NK细胞的阳性率检测结果,如图5a、5b所示,其中,图5a为CAR-NK对照样品,阳性率检测结果为11.55%;图5b为对NK-LDLR细胞进行慢病毒侵染后CAR-LDLR-NK细胞的阳性率检测结果;结果显示,CAR-LDLR-NK细胞的阳性率为80.3%,其阳性率相较普通NK细胞提升了7倍。
实施例4、慢病毒转染
按照溶液中氨基酸的浓度计算,提供成分:浓度50mg/ml的组氨酸、浓度10mg/ml的赖氨酸、浓度10mg/ml的精氨酸及余量为OPTMIZER TCELL EXPANSFMCTS无血清培养基,混合制得转染助转剂;
将转染助转剂加入实施例3中得到的NK细胞激活并瞬时过表达LDL受体中,获得NK细胞转染悬液;
往NK细胞转染悬液中加入MOI=5的慢病毒,进行慢病毒转染12小时;
慢病毒转染完成后,加入含18%v/v FBS的完全培养基并保持细胞浓度为5.0×10
对慢病毒侵染后细胞进行增殖情况检测,NK细胞增殖情况如图6所示,CA R-NK与CAR-LDLR-NK细胞表现出基本相同的扩增能力,表明瞬转过程未对NK细胞增殖状态产生影响。
实施例5、细胞杀伤实验评价
1、细胞体外杀伤实验评价
使用HGC-27、HGC-27-CLDN18.2细胞分别作为阴性和阳性靶细胞,采用流式检测方法对CAR-NK和CAR-LDLR-NK细胞体外杀瘤功能进行验证。
如图7a、7b所示,其中,图7a的靶细胞为HGC27;图7b的靶细胞为HGC27-CLDN18.2。
图7a的检测结果显示,CAR-NK和CAR-LDLR-NK对HGC-27无杀伤效果;图7b的检测结果显示,CAR-NK和CAR-LDLR-NK对CLDN18.2表达阳性的HGC-27-C LDN18.2细胞显示出特异性的杀伤效果;相比之下,CAR-LDLR-NK细胞对HGC-27-CLDN18.2细胞进行特异性杀伤效率略高于一般CAR-NK细胞。
2、细胞体内杀伤实验
取6-8周龄NSG小鼠(体重18-22g)42只,适应饲养一周后,皮下接种H GC-27-CLDN18.2肿瘤细胞株,每只小鼠接种5×10
表1动物实验方案
如图8所示,CAR-NK和CAR-LDLR-NK相较于NK细胞和DPBS组可以大幅延长小鼠生存期,并且CAR-LDLR-NK组生存期略长于CAR-NK组,两者的生存期无显著差异,这证明瞬转工艺未对NK细胞的长期杀瘤效果产生影响。
以上实施例证明:使用对NK细胞瞬转过表达LDLR的工艺方法可有效提升慢病毒对CAR基因的转导效率,可制备出CAR阳性率远超一般工艺的CAR-LDLR-NK细胞,并且相对于一般工艺的CAR-NK其表型、增殖能力及对肿瘤的体内体外杀瘤活性无显著影响,并且有效提升了小鼠生存期,在需要相同CAR阳性率NK细胞的情况下,高CAR阳性率所需细胞总数更少,相当于变相降低了细胞培养成本。
应当理解的是,上述针对本发明较佳实施例的表述较为详细,并不能因此而认为是对本发明专利保护范围的限制,本发明的专利保护范围应以所附权利要求为准。
- 嵌合抗原受体、表达该嵌合抗原受体的NKG2D CAR-NK细胞及其制备方法和应用
- 一种CAR嵌合抗原受体序列及应用其的CAR-NK细胞
