一套用于筛选高抗炎活性β葡聚糖的生物标志物及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于食品生物技术领域,特别涉及一套用于筛选高抗炎活性β葡聚糖的生物标志物及其应用。
背景技术
β葡聚糖是一种在植物和微生物中大量存在的非淀粉多糖,最常见的是谷物β葡聚糖、酵母β葡聚糖和食用真菌β葡聚糖。β葡聚糖主要由β1,3、β1,4、β1,6等糖苷键组成。与其他非淀粉多糖一样,β葡聚糖可以完整地通过消化系统并在大肠被肠道菌群发酵,产生多种代谢物,包括次级胆汁酸、短链脂肪酸、胆碱代谢物等。而肠道微生物群及其代谢物可以影响人体生理和能量平衡以及宿主的健康和疾病状态。近期研究表明,β葡聚糖具有调节肠道菌群组成、促进肠道发育、增强机体免疫反应、抑制肿瘤、缓解炎症等生物学功能。其中炎症是各种慢性病发生发展的前奏,且所有β葡聚糖的生物活性均与缓解慢性炎症有关,但没有报道比较它们的抗炎效果,可能是缺乏快速有效的评价方法,这严重阻碍了β葡聚糖的开发和应用。
目前大多数研究β葡聚糖活性的常规方法使用相对耗时的动物或细胞模型。因此,有必要筛选出一些能够快速有效评估不同来源β葡聚糖生物活性的生物标志物。β葡聚糖会在宿主的大肠中发酵并转化为发酵代谢物,从而改变肠道菌群及代谢物的丰度。因此,可以通过测定体外厌氧发酵过程后与β葡聚糖抗炎活性显著相关的菌群和发酵代谢物的丰度,并以此作为指标来筛选高抗炎活性的β葡聚糖。
发明内容
本发明的首要目的在于克服不同来源β葡聚糖抗炎活性比较的复杂性,提供了一套用于筛选高抗炎活性β葡聚糖的生物标志物。
本发明的另一个目的在于提供通过上述用于筛选高抗炎活性β葡聚糖的生物标志物的应用。
本发明的目的通过下述技术方案实现:
一种用于筛选高抗炎活性β葡聚糖的生物标志物,包括细菌生物标志物和代谢生物标志物;其中,
细菌生物标志物包括:经黏液真杆菌属(Blautia)、毛螺菌科ND3007组(Lachnospiraceae ND3007group)、小类杆菌属(Dialister)和阿加杆菌属(Agathobacter);
代谢物生物标志物包括:乙酸、丁酸、乳酸、二羟基苯乙酸、香兰素、2,3-二羟基苯甲酸、邻苯二酚和咖啡酸。
上述用于筛选高抗炎活性β葡聚糖的生物标志物在高抗炎活性β葡聚糖筛选中的应用。
一套筛选高抗炎活性β葡聚糖的方法,优选包括如下步骤:
(1)β葡聚糖的体外发酵:将待测β葡聚糖做为唯一碳源,配制得到发酵培养基;将得到的发酵培养基除菌或灭菌后,接种粪便菌群溶液并进行体外厌氧发酵;将得到的发酵液固液分离,得到固体和液体;同时,设置对照,对照即不含β葡聚糖的发酵培养基;
(2)生物标志物测定:使用实时荧光定量PCR测定步骤(1)得到的固体中的细菌生物标志物的丰度;测定步骤(1)得到的液体中的代谢物生物标志物的浓度;其中,细菌生物标志物的总丰度为T1,乙酸、丁酸和乳酸的总浓度为T2,二羟基苯乙酸、香兰素、咖啡酸、2,3-二羟基苯甲酸和邻苯二酚的总浓度为T3;
(3)筛选评价:根据细菌生物标志物的丰度和代谢物生物标志物的含量结合如下判定标准,得到待测β葡聚糖的抗炎活性;
判定标准:
1)满足以下情况,则判定该待测β葡聚糖的抗炎效果较强:T1≥2.1*TC1,T2≥2.9*TC2和(或)T3≥1.5*TC3;
2)满足以下情况,则判定该待测β葡聚糖的抗炎效果适中:1.6*TC1≤T1<2.1*TC1,2.1*TC2≤T2<2.9*TC2和(或)1.3*TC3≤T3<1.5*TC3;
3)满足以下情况,则判定该待测β葡聚糖抗炎效果较弱:1.1*TC1≤T1<1.6*TC1,1.3*TC2≤T2<2.1*TC2和(或)1.1*TC3≤T3<1.3*TC3。
4)满足以下情况,则判定该待测β葡聚糖的抗炎效果不显著:1.1*TC1≤T1<1.6*TC1,1.3*TC2≤T2<2.1*TC2和(或)1.1*TC3≤T3<1.3*TC3。
步骤(1)中所述的β葡聚糖的来源优选为燕麦、大麦、小麦、青稞、酵母、灵芝、灰树花和云芝中的至少一种;更优选为燕麦、大麦、青稞、酵母和灵芝中的至少一种。
步骤(1)中所述的β葡聚糖优选通过乙醇脱脂、热水浸提、淀粉酶处理、浓缩醇沉、sevage法除蛋白、透析冻干的步骤提取得到;更优选通过如下步骤制备得到:
1)使用浓度为70~90%(v/v)的乙醇溶液浸泡原料脱脂并干燥;
2)按1g脱脂干燥后的原料:15~25mL水的比例将脱脂干燥后的原料和水混合,在70~90℃浸提,得到浸提液;
3)然后在浸提液中加入α-高温淀粉酶,在70~90℃下反应30~90min,将得到的酶解液浓缩;
4)将步骤3)得到的浓缩液用无水乙醇2~6℃过夜醇沉,收集沉淀,加水重新溶解沉淀;
5)用sevage法对步骤(4)得到的沉淀进行除蛋白,浓缩上清液,将得到的浓缩液进行透析和真空冷冻干燥,得到β葡聚糖。
步骤1)中所述的乙醇溶液的用量为能浸没原料为基准;更优选按料液比1g:3~5mL计算;最优选按料液比1g:4mL计算。
步骤1)中所述的乙醇溶液的浓度优选为80%(v/v)。
步骤1)中所述的浸泡的时间为12h以上;更优选为20~28h;最优选为24h。
步骤2)中所述的比例优选为1g:20mL。
步骤2)中所述的水优选为去离子水或超纯水。
步骤2)中所述的浸提的温度优选为80℃。
步骤2)中所述的浸提的次数优选为至少2次,每次浸提2h,每次浸提后将水溶液用四层纱布过滤,得到的滤渣用于下一轮加水浸提;合并滤液,即为浸提液。
步骤3)中所述的反应的条件优选为在80℃下反应60min。
步骤3)中所述的浓缩的方式优选为旋转蒸发。
步骤3)中所述的浓缩的程度优选为浓缩至原溶液体积的1/3。
步骤3)中所述的α-高温淀粉酶的用量优选为在浸提液中的浓度为0.3~1%(w/w);更优选为0.5%(w/w)。
步骤4)中所述的无水乙醇的体积用量优选为相当于浓缩液体积的3~5倍;更优选为相当于浓缩液体积的4倍。
步骤5)中所述的除蛋白的次数优选为3次。
步骤5)中所述的浓缩的方式优选为旋转蒸发。
步骤(1)中所述的发酵培养基的组成优选如下:β葡聚糖10mg/mL、酵母提取物2.0mg/mL、蛋白胨2.0mg/mL、胆汁盐0.5mg/mL、血红素0.02mg/mL、L半胱氨酸0.5mg/mL、碳酸氢钠2.0mg/mL、氯化钠0.1mg/mL、六水合氯化钙0.01mg/mL、七水合硫酸镁0.01mg/mL、磷酸氢二钾0.04mg/mL、磷酸二氢钾0.04mg/mL、维生素K
所述的pH值优选为7.2。
步骤(1)中所述的灭菌的条件优选为121℃灭菌15~30min。
步骤(1)中所述的粪便取自三名健康成年志愿者,志愿者无消化疾病或饮食限制,并在过去3个月内未服用任何抗生素,以及过去2周内未服用任何益生菌产品。
步骤(1)中所述的粪便菌群溶液制备方法为:收集的粪便样本并立即放入厌氧室,使用生理盐水按粪便:生理盐水=1g:9mL的量和粪便样本混合均匀,然后通过四层纱布过滤,获得粪便菌群溶液。
步骤(1)中所述的粪便菌群溶液的接种量优选为体积百分比10%。
步骤(1)中所述的厌氧发酵的条件优选为36~38℃恒温、恒pH厌氧发酵7~9h;更优选为37℃恒温、恒pH厌氧发酵8h。
步骤(1)中所述的固液分离的方式优选为离心。
所述的离心的条件为:在4℃、12000×g条件下离心10min。
步骤(2)中所述的细菌生物标志物的丰度采用实时荧光定量PCR测定,优选通过如下步骤测定:
A)提取微生物群落总DNA,使用琼脂糖凝胶电泳检测DNA的提取质量,使用紫外分光光度计测定DNA的浓度和纯度;
B)通过实时荧光定量PCR测定步骤(1)得到的发酵沉淀中细菌生物标志物的含量;
实时荧光定量PCR的引物为:
Blautia上游引物:5’-AGTCTGATGTGAAAGGCGGG-3’;
Blautia下游引物:5’-AGCCTCAACGTCAGTTACCG-3’;
Lachnospiraceae ND3007 group上游引物:5’-GCGTAGACGGCAATGCAAG-3’;
Lachnospiraceae ND3007 group下游引物:5’-ACGCATTTCACCGCTACACT-3’;
Dialister上游引物:5’-CTAGTGGCAAACGGGTGAGT-3’;
Dialister下游引物:5’-TCAGACGCAAACCCCTCTTC-3’;
Agathobacter上游引物:5’-GCTAAATACGTGCCAGCAGC-3’;
Agathobacter下游引物:5’-AATGCAGTACCGGGGTTGAG-3’;
338F:5’-ACTCCTACGGGAGGCAGCAG-3’;
806R:5’-GGACTACHVGGGTWTCTAAT-3’。
步骤B)中所述的实时荧光定量PCR的体系如下:2×ChamQ Universal SYBR qPCRMaster Mix 10μL,上游引物(10μM)0.4μL,下游引物(10μM)0.4μL,模板DNA 10ng,最后用ddH
步骤B)中所述的实时荧光定量PCR的条件为:95℃预变性30s;95℃变性10s、60℃退火30s,40个循环;溶解曲线绘制条件为:95℃保持15s,60℃保持60s,95℃保持15s。
步骤(2)中所述的乙酸和所述的丁酸优选通过气相色谱法进行测定;更优选通过如下步骤测定得到:将步骤(1)得到的液体通过0.45μm膜过滤,然后将0.02mL浓度为6mol/L的盐酸溶液和0.03mL浓度为0.04mol/L的2-乙基丁酸溶液添加到0.45mL过滤的液体中;用带有氢火焰离子化检测器的GC2010 Plus系统的气相色谱仪以及DBWAX毛细管柱进行检测侧,检测条件如下:载气为N
步骤(2)中所述的乳酸优选为使用乳酸试剂盒检测,然后测定530nm处的吸光度。
步骤(2)中所述的二羟基苯乙酸、香兰素、2,3-二羟基苯甲酸、邻苯二酚、咖啡酸优选通过液相色谱法进行测定;更优选通过如下步骤测定得到:使用标准品定量,具体步骤如下:
①将步骤(1)得到的液体和提取液混合均匀,于4~5℃、35~45KHz超声提取25~35min后于18~25℃静置20~40min,然后离心,移取上清液,氮气吹干后用复溶液复溶,于4~5℃、35~45KHz超声提取3~6min,离心,收集上清液至进样小瓶中;提取液为乙腈和甲醇按体积比1:1混合得到;复溶液为乙腈和水按体积比1:1混合得到;
②色谱柱:BEH C18色谱柱,进样量:10μL,流动相A为浓度为体积百分比0.1%的甲酸水溶液,流动相B为按体积比1:1混合得到的乙腈/异丙醇溶液,其中含体积百分比0.1%的甲酸;流速为0.40mL/min,柱温为40℃;
③分离梯度:0-3min,流动相A从线性95%降至80%,流动相B从线性5%升至20%;3-9min,流动相A从线性80%降至5%,流动相B线性从20%升至95%;9-13min,流动相A线性维持5%,流动相B线性维持95%;13.01-3.1min,流动相A线性从5%升至95%,流动相B线性从95%降至5%;13.1-16min,流动相A线性维持95%,流动相B线性维持5%。
步骤①中所述提取液的用量优选按液体:提取液=体积比1:3~5配比;更优选按液体:提取液=体积比1:4配比。
步骤①中所述的离心的条件优选为于4℃,13000×g离心15min。
步骤①中所述的复溶液的用量优选为120μL。
步骤②中所述的BEH C18色谱柱的规格为100mm×2.1mm,孔径为1.8μm。
上述生物标志物或方法在制备抗炎制剂中的应用。
本发明相对于现有技术具有如下的优点及效果:
本发明提供了一组生物标记物,包括经黏液真杆菌属(Blautia)、毛螺菌科ND3007组(Lachnospiraceae ND3007 group)、小类杆菌属(Dialister)阿加杆菌属(Agathobacter)、二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚、乙酸、丁酸和乳酸,可以用于筛选高抗炎活性的β葡聚糖,且步骤简单,易于实现,有利于降低实验和检测成本;
在本申请所述的体外厌氧发酵条件下,获得的β葡聚糖发酵细菌生物标志物和代谢物生物标志物丰度可以用于快速判断未知β葡聚糖的抗炎活性,有利于节约β葡聚糖抗炎的研究和筛选周期,促进以β葡聚糖为来源的医药、食品、饲料等产品的快速研发和推广应用。
附图说明
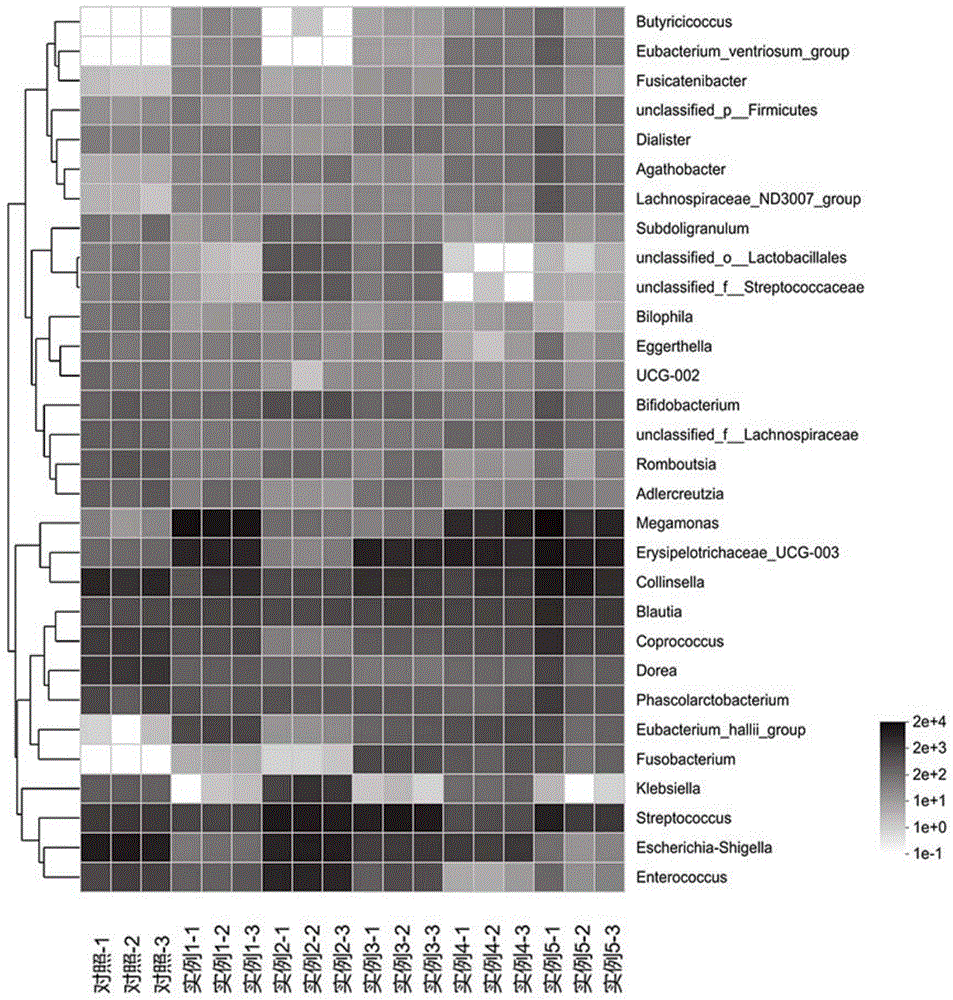
图1是样品组和对照组在属水平上(前30)菌群相对丰度的热图。
图2是阴离子或阳离子模式下不同样品与对照组中不同代谢物基于多维统计分析OPLS-DA模型的S图;其中,纵坐标表示主成分与代谢物的相关系数,横坐标表示主成分与代谢物的协相关系数,浅灰色的点表示这些代谢物的VIP值大于等于1。
图3是不同样品与对照组的差异代谢物火山图;其中,横坐标为代谢物在两组间表达差异的倍数变化值,即log2FC,纵坐标为代谢物表达量变化差异的统计学检验值,即-log10(p value)值。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。本发明中涉及的化学试剂均为分析纯。
酵母β葡聚糖购自上海源叶生物科技有限公司,CAS号:9041229;α高温淀粉酶自上海源叶生物科技有限公司,CAS号:9001198;小鼠单核巨噬细胞白血病细胞(RAW264.7细胞)购自武汉普诺赛生命科技有限公司;蛋白酶磷酸酶抑制剂混合物(通用型,50X)购自上海碧云天生物技术有限公司。
所述的粪便取自三名健康成年志愿者,志愿者无消化疾病或饮食限制,并在过去3个月内未服用任何抗生素,以及过去2周内未服用任何益生菌产品。在每个实施例中均用来自这三名健康成年志愿者的粪便样品进行接种,得到的结果基本相同。
实施例1
(1)β葡聚糖的体外发酵:
按乙醇脱脂、热水浸提、淀粉酶处理、浓缩醇沉、sevage法除蛋白、透析冻干的步骤提取青稞中的青稞β葡聚糖,具体步骤如下
1)用80%(v/v)乙醇溶液浸泡青稞24h(料液比为1:4g:mL)脱脂,抽滤后将滤渣置于60℃烘箱处理1h;
2)按1g原料:20mL超纯水的比例将脱脂干燥后的青稞和超纯水混合,在80℃浸提2次,每次2h,第一次浸提后将水溶液用四层纱布过滤,得到的滤渣加水浸提,条件同第一次,合并两次滤液;
3)在滤液中加入α高温淀粉酶(终浓度为0.5%w/w)并在80℃下反应1h,随后采用旋转蒸发将水溶液浓缩至原溶液体积的1/3;
4)按浓缩液:无水乙醇=体积比1:4的配比加入无水乙醇,4℃过夜醇沉,收集沉淀,加水(添加量与原浓缩液体积相等)重新溶解沉淀得到多糖溶液;
5)sevage法(氯仿和正丁醇按体积比4:1混合,多糖溶液和氯仿/正丁醇混合液按体积比1:4混合,每次振摇30分钟,4000rpm离心1min)除3次蛋白,用旋转蒸发仪浓缩上清液并去除残余的氯仿及正丁醇,将上清液进行透析(透析袋的截留分子量为3500Da)和真空冷冻干燥,得到β葡聚糖。
按1g青稞β葡聚糖:100mL水的配比将青稞β葡聚糖和水混合,并加入酵母提取物(终浓度为2.0mg/mL)、蛋白胨(终浓度为2.0mg/mL)、胆汁盐(终浓度为0.5mg/mL)、血红素(终浓度为0.02mg/mL)、L半胱氨酸(终浓度为0.5mg/mL)、碳酸氢钠(终浓度为2.0mg/mL)、氯化钠(终浓度为0.1mg/mL)、六水合氯化钙(终浓度为0.01mg/mL)、七水合硫酸镁(终浓度为0.01mg/mL)、磷酸氢二钾(终浓度为0.04mg/mL)、磷酸二氢钾(终浓度为0.04mg/mL)、维生素K
(2)生物标志物测定:
1)提取微生物群落总DNA,使用琼脂糖凝胶电泳检测DNA的提取质量,使用Nanodrop测定DNA的浓度和纯度。
通过实时荧光定量PCR测定步骤(1)得到的发酵沉淀中细菌生物标志物的含量;
实时荧光定量PCR的引物为:
Blautia上游引物:5’-AGTCTGATGTGAAAGGCGGG-3’;
Blautia下游引物:5’-AGCCTCAACGTCAGTTACCG-3’;产物为168bp;
Lachnospiraceae ND3007 group上游引物:5’-GCGTAGACGGCAATGCAAG-3’;
Lachnospiraceae ND3007 group下游引物:5’-ACGCATTTCACCGCTACACT-3’;产物为123bp;
Dialister上游引物:5’-CTAGTGGCAAACGGGTGAGT-3’;
Dialister下游引物:5’-TCAGACGCAAACCCCTCTTC-3’;产物为165bp;
Agathobacter上游引物:5’-GCTAAATACGTGCCAGCAGC-3’;
Agathobacter下游引物:5’-AATGCAGTACCGGGGTTGAG-3’;产物为132bp;
此外采用通用引物序列对DNA样本进行扩增,用于计算特异菌群的相对丰度,包括:338F(5’-ACTCCTACGGGAGGCAGCAG-3’)、806R(5’-GGACTACHVGGGTWTCTAAT-3’)。
使用南京诺唯赞生物科技股份有限公司的ChamQ Universal SYBR qPCR MasterMix试剂盒进行实时荧光定量PCR,实时荧光定量PCR的体系如下:2×ChamQ UniversalSYBR qPCR Master Mix 10μL,上游引物(10μM)0.4μL,下游引物(10μM)0.4μL,模板DNA10ng,最后用ddH
实时荧光定量PCR的条件为:95℃预变性30s;95℃变性10s、60℃退火30s,40个循环;溶解曲线绘制条件为:95℃保持15s,60℃保持60s,95℃保持15s。
2)用气相色谱测定步骤(1)中发酵上清液中乙酸和丁酸的含量:上清液通过0.45μm膜过滤,然后将0.02mL浓度为6mol/L的盐酸溶液和0.03mL浓度为0.04mol/L的2-乙基丁酸添加到0.45mL过滤的发酵上清液中。用带有氢火焰离子化检测器的GC2010 Plus系统的气相色谱仪(日本岛津)以及DBWAX毛细管柱(30cm×0.25mm×0.25μm,安捷伦)。检测条件如下:载气为N
3)用乳酸试剂盒测定步骤(1)中发酵上清液中乳酸的含量,用全自动酶标仪(Multiskan MK3)测定530nm处的吸光度;
4)用液相色谱测定步骤(1)中发酵上清液中其余代谢物生物标志物的含量,使用标准品定量,标准品为二羟基苯乙酸、香兰素、2,3-二羟基苯甲酸、邻苯二酚、咖啡酸,具体步骤如下:
A、取100μL发酵上清液于1.5mL离心管中,加入400μL提取液(乙腈:甲醇=体积比1:1)涡旋混匀,低温超声(5℃,40KHz)提取30min后于20℃静置30min,然后于4℃,13000×g离心15min,移取上清液,氮气吹干后用120μL复溶液(乙腈:水=体积比1:1)复溶,低温超声萃取5min(5℃,40KHz),4℃、13000×g离心5min,收集上清液至进样小瓶中;
B、色谱柱:BEH C18色谱柱(100mm×2.1mm,1.8μm),进样量:10μL,流动相A:水(含0.1%v/v甲酸),流动相B:乙腈/异丙醇(体积比1:1,含0.1%v/v甲酸),流速为0.40mL/min,柱温为40℃;
C、分离梯度:0-3min,流动相A从线性95%降至80%,流动相B从线性5%升至20%;3-9min,流动相A从线性80%降至5%,流动相B线性从20%升至95%;9-13min,流动相A线性维持5%,流动相B线性维持95%;13.0-13.1min,流动相A线性从5%升至95%,流动相B线性从95%降至5%;13.1-16min,流动相A线性维持95%,流动相B线性维持5%。
(3)筛选评价:根据细菌生物标志物的丰度和多种代谢物生物标志物的差异代谢情况筛选评价不同来源β葡聚糖的抗炎活性。
结果如表1所示。实例1样品细菌生物标志物的总丰度T1为5.19±0.40%,乙酸、丁酸和乳酸的总浓度T2为22.46±0.60mM,二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚的总浓度T3为16.10±0.15mM,满足:1.1*TC1≤T1<1.6*TC1,1.3*TC2≤T2<2.1*TC2和(或)1.1*TC3≤T3<1.3*TC3,因此实例1样品抗炎效果较弱,即青稞β葡聚糖抗炎效果较弱。
表1实例1制备的β葡聚糖发酵液中生物标志物水平
实施例2基本同实施例1,区别在于β葡聚糖替换为购自上海源叶生物科技有限公司的酵母β葡聚糖。
(1)β葡聚糖的体外发酵:按1g酵母β葡聚糖:100mL水的配比加入水,并按所需浓度加入酵母提取物、蛋白胨、胆汁盐、血红素、L半胱氨酸、碳酸氢钠、氯化钠、六水合氯化钙、七水合硫酸镁、磷酸氢二钾、磷酸二氢钾、维生素K
(2)生物标志物测定:通过实时荧光定量PCR测定步骤(1)发酵沉淀中细菌生物标志物的含量;用乳酸试剂盒测定步骤(1)中发酵上清液中乳酸的含量;用气相色谱、液相色谱测定步骤(1)中发酵上清液中其余代谢物生物标志物的含量。
(3)筛选评价:根据细菌生物标志物的丰度和多种代谢物生物标志物的差异代谢情况筛选评价不同来源β葡聚糖的抗炎活性。
结果如表2所示。实例2样品细菌生物标志物的总丰度T1为4.40±0.27%,乙酸、丁酸和乳酸的总浓度T2为21.16±0.42mM,二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚的总浓度T3为17.46±0.08mM,满足:1.1*TC1≤T1<1.6*TC1,1.3*TC2≤T2<2.1*TC2和(或)1.1*TC3≤T3<1.3*TC3,因此实例2样品抗炎效果较弱,即酵母β葡聚糖抗炎效果较弱。
表2实例2制备的β葡聚糖发酵液中生物标志物水平
实施例3基本同实施例1,区别仅仅在于β葡聚糖来源替换为燕麦
(1)β葡聚糖的体外发酵:按乙醇脱脂、热水浸提、淀粉酶处理、浓缩醇沉、sevage法除蛋白、透析冻干的步骤提取燕麦中的燕麦β葡聚糖。按1g燕麦β葡聚糖:100mL水的配比加入水,并按所需浓度加入酵母提取物、蛋白胨、胆汁盐、血红素、L半胱氨酸、碳酸氢钠、氯化钠、六水合氯化钙、七水合硫酸镁、磷酸氢二钾、磷酸二氢钾、维生素K
(2)生物标志物测定:通过实时荧光定量PCR测定步骤(1)发酵沉淀中细菌生物标志物的含量;用乳酸试剂盒测定步骤(1)中发酵上清液中乳酸的含量;用气相色谱、液相色谱测定步骤(1)中发酵上清液中其余代谢物生物标志物的含量。
(3)筛选评价:根据细菌生物标志物的丰度和多种代谢物生物标志物的差异代谢情况筛选评价不同来源β葡聚糖的抗炎活性。
结果如表3所示。实例3样品细菌生物标志物的总丰度T1为5.82±0.82%,乙酸、丁酸和乳酸的总浓度T2为31.18±0.52mM,二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚的总浓度T3为19.15±0.07mM,满足:1.6*TC1≤T1<2.1*TC1,2.1*TC2≤T2<2.9*TC2和(或)1.3*TC3≤T3<1.5*TC3,因此实例3样品抗炎效果适中,即大麦β葡聚糖抗炎效果适中。
表3实例3制备的β葡聚糖发酵液中生物标志物水平
实施例4基本同实施例1,区别仅仅在于β葡聚糖来源替换为灵芝
(1)β葡聚糖的体外发酵:按乙醇脱脂、热水浸提、淀粉酶处理、浓缩醇沉、sevage法除蛋白、透析冻干的步骤提取灵芝中的灵芝β葡聚糖。按1g灵芝β葡聚糖:100mL水的配比加入水,并按所需浓度加入酵母提取物、蛋白胨、胆汁盐、血红素、L半胱氨酸、碳酸氢钠、氯化钠、六水合氯化钙、七水合硫酸镁、磷酸氢二钾、磷酸二氢钾、维生素K
(2)生物标志物测定:通过实时荧光定量PCR测定步骤(1)发酵沉淀中细菌生物标志物的含量;用乳酸试剂盒测定步骤(1)中发酵上清液中乳酸的含量;用气相色谱、液相色谱测定步骤(1)中发酵上清液中其余代谢物生物标志物的含量。
(3)筛选评价:根据细菌生物标志物的丰度和多种代谢物生物标志物的差异代谢情况筛选评价不同来源β葡聚糖的抗炎活性。
结果如表4所示。实例4样品细菌生物标志物的总丰度T1为7.23±0.80%,乙酸、丁酸和乳酸的总浓度T2为36.93±0.89mM,二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚的总浓度T3为22.39±0.07mM,满足:T1≥2.1*TC1,T2≥2.9*TC2和(或)T3≥1.5*TC3,因此实例4样品抗炎效果较强,即灵芝β葡聚糖抗炎效果较强。
表4实例4制备的β葡聚糖发酵液中生物标志物水平
/>
实施例5基本同实施例1,区别仅仅在于β葡聚糖来源替换为大麦
(1)β葡聚糖体外发酵:按乙醇脱脂、热水浸提、淀粉酶处理、浓缩醇沉、sevage法除蛋白、透析冻干的步骤提取大麦中的大麦β葡聚糖。按1g大麦β葡聚糖:100ml水的配比加入水,,并按所需浓度加入酵母提取物、蛋白胨、胆汁盐、血红素、L半胱氨酸、碳酸氢钠、氯化钠、六水合氯化钙、七水合硫酸镁、磷酸氢二钾、磷酸二氢钾、维生素K
(2)生物标志物测定:通过实时荧光定量PCR测定步骤(1)发酵沉淀中细菌生物标志物的含量;用乳酸试剂盒测定步骤(1)中发酵上清液中乳酸的含量;用气相色谱、液相色谱测定步骤(1)中发酵上清液中其余代谢物生物标志物的含量。
(3)筛选评价:根据细菌生物标志物的丰度和多种代谢物生物标志物的差异代谢情况筛选评价不同来源β葡聚糖的抗炎活性。
结果如表5所示。实例5样品细菌生物标志物的总丰度T1为7.99±1.85%,乙酸、丁酸和乳酸的总浓度T2为37.97±0.97mM,二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚的总浓度T3为23.01±0.08mM,满足:T1≥2.1*TC1,T2≥2.9*TC2和(或)T3≥1.5*TC3,因此实例5样品抗炎效果较强,即大麦β葡聚糖抗炎效果较强。
表5实例5制备的β葡聚糖发酵液中生物标志物水平
效果实施例:
(1)抗炎效果:将实例1-5的样品和对照样品过0.22μm滤膜,然后分别用DMEM完全培养基(含10%小牛血清的DMEM培养基)稀释成0.625%v/v的溶液,为待测样品,进行抗炎活力比较,具体步骤如下:
取状态较好的对数期生长的RAW264.7细胞,将细胞吹打下来并转移至15mL离心管,800rpm离心4min,去掉上清液后,加入新的DMEM完全培养液重悬细胞,轻轻地吹打细胞使其分散均匀。采用Countess全自动细胞计数仪对细胞进行计数,将细胞充分吹散,混匀,吸取10μL细胞液至离心管中,加入等量的0.4%台盼蓝染色液,充分吹打均匀后,吸取10μL至Countess细胞计数板中,静置30秒,将细胞计数板插入Countess细胞计数仪中,记下活细胞数量,该自动细胞计数仪要求测量时细胞密度不能太大,必要时可将细胞稀释或加入更多的培养液至密度适中。
根据细胞密度测定结果进行适当地稀释,将细胞浓度调整为1×10
继续培养24h后取出6孔板,弃去上清液,用预冷的磷酸盐缓冲液(0.01mol/L、pH7.4)清洗孔板,磷酸盐缓冲液清洗过程中要注意每个孔板的力度要适中,然后加入磷酸盐缓冲液吹打细胞,再1000×g离心5分钟后收集细胞。每10
按ELISA试剂盒说明书操作,酶标仪于450nm处测定吸光度,用标准品溶液的吸光度与浓度做标准曲线,计算各样品细胞裂解上清液中IL-1β、IL-6和TNFα的含量(pg/mL)。然后根据以下公式计算发酵上清液的炎症因子抑制表达评分。
抑制表达评分(%)=(Ac-As)/(Ac-Ab)×100%
As:实验孔(含有细胞的DMEM培养液、脂多糖、发酵上清液);
Ac:模型孔(含有细胞的DMEM培养液、脂多糖);
Ab:对照孔(含有细胞的DMEM培养液)。
以上所有的实验均重复三次以上。采用Origin 2023软件进行单因素方差分析(oneway ANOVA),各组数据使用均数±标准差(x±s)表示,采用Tukey检验比较组间差异,显著性水平p<0.05为差异显著。
结果如表6所示。从表6可以看出,实例1-5与对照组的炎症因子水平有显著性差异,其中实例1、2样品的抗炎活性较弱且两样品的抗炎活性无显著差异,实例3样品的抗炎活性适中,实例4、5的抗炎活性最强且两样品的抗炎活性无显著差异,即灵芝β葡聚糖和大麦β葡聚糖的抗炎活性最强,而青稞β葡聚糖和酵母β葡聚糖的抗炎活性最弱。
表6实例1-5制备的β葡聚糖发酵上清液的抗炎活性
注:带有不同字母的值之间存在显著差异,p<0.05。
实施例6生物标志物的筛选方法:
(1)采用16S rDNA测序分析测定发酵过程中细菌的相对丰度,通过如下步骤测定:
根据
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNAGel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus
使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH(http://www.cbcb.umd.edu/software/flash,version1.2.7)软件进行拼接:过滤reads尾部质量值20以下的碱基,设置50bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50bp以下的reads,去除含N碱基的reads;根据PE reads之间的overlap关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10bp;拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
使用UPARSE软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(version 138),设置比对阈值为70%。
(2)用气相色谱测定发酵上清液中短链脂肪酸(乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸)的含量:上清液通过0.45μm膜过滤,然后将0.02mL浓度为6mol/L的盐酸溶液和0.03mL浓度为0.04mol/L的2-乙基丁酸溶液添加到0.45mL过滤的发酵上清液中。用带有氢火焰离子化检测器的GC2010 Plus系统的气相色谱仪(日本岛津)以及DBWAX毛细管柱(30cm×0.25mm×0.25μm,安捷伦)。检测条件如下:载气为N
(3)采用非靶向代谢组学测定发酵上清液中的代谢物含量,通过如下步骤测定:
取100μL发酵上清液于1.5mL离心管中,加入400μL提取液(乙腈:甲醇=体积比1:1)涡旋混匀,低温超声(5℃,40KHz)提取30min后于20℃静置30min,然后于4℃、13000×g离心15min,移取上清液,氮气吹干后用120μL复溶液(乙腈:水=体积比1:1)复溶,低温超声萃取5min(5℃,40KHz),4℃、13000×g离心5min,收集上清液至进样小瓶中;取等体积的所有样本代谢物混合制备成质控样本(Quality control,QC),在仪器分析过程中,每8个样本中插入一个QC样本,以考察整个分析过程的重复性。
采用AB SCIEX公司的超高效液相色谱串联飞行时间质谱UPLC-TripleTOF系统进行LC-MS分析。10μL样本经BEH C18色谱柱(100mm×2.1mm,1.8μm)分离后进入质谱检测。色谱柱:BEH C18色谱柱(100mm×2.1mm,1.8μm),进样量:10μL,流动相A:水(含0.1%v/v甲酸),流动相B:乙腈/异丙醇(体积比1:1,含0.1%v/v甲酸),流速为0.40mL/min,柱温为40℃;分离梯度:0-3min,流动相A从线性95%降至80%,流动相B从线性5%升至20%;3-9min,流动相A从线性80%降至5%,流动相B线性从20%升至95%;913min,流动相A线性维持5%,流动相B线性维持95%;13.0-13.1min,流动相A线性从5%升至95%,流动相B线性从95%降至5%;13.1-16min,流动相A线性维持95%,流动相B线性维持5%。样品质谱信号采集采用正负离子扫描模式,质量扫描范围m/z:50-1000。离子喷雾电压,正离子电压5000V,负离子电压4000V,去簇电压80V,喷雾气50psi,辅助加热气50psi,气帘气30psi,离子源加热温度500℃,20-60V循环碰撞能。
上机完成之后,LC-MS原始数据导入代谢组学处理软件Progenesis QI(WatersCorporation,Milford,USA)进行基线过滤、峰识别、积分、保留时间校正、峰对齐,最终得到一个保留时间、质荷比和峰强度的数据矩阵,数据矩阵用80%规则来去除缺失值,即保留至少一组样品中非零值80%以上的变量,再进行填补空缺值(原始矩阵中最小值填补空缺值),为减小样品制备及仪器不稳定带来的误差,用总和归一化法对样本质谱峰的响应强度进行归一化,得到归一化后的数据矩阵。同时删除QC样本相对标准偏差(RSD)>30%的变量,并进行log10对数化处理,得到最终用于后续分析的数据矩阵。同时将MS和MSMS质谱信息与代谢公共数据库HMDB(http://www.hmdb.ca/)和Metlin(https://metlin.scripps.edu/)数据库进行匹配,得到代谢物信息。
预处理后的数据上传美吉生物云平台上(https://cloud.majorbio.com)进行数据分析。R软件包ropls(Version1.6.2)进行主成分分析(PCA)和正交最小偏二乘判别分析分析(OPLS-DA),并使用7次循环交互验证来评估模型的稳定性。此外,进行student’s t检验和差异倍数分析。显著差异代谢物的选择基于OPLS-DA模型得到的变量权重值(VIP)和student’s t检验p值来确定,VIP>1,p<0.05的代谢物为显著差异代谢物。
(4)筛选生物标志物:
各β葡聚糖发酵组与对照组中属水平相对丰度前30的细菌如图1所示,将属水平丰度前30的细菌与样品对LPS诱导的RAW264.7细胞中细胞炎症因子的抑制表达评分做相关性分析,结果如表7所示。
表7属水平丰度前30的细菌与细胞炎症因子抑制表达评分的相关性
注:*表示p<0.05;**表示p<0.01;***表示p<0.001。
从表7可以看出,经黏液真杆菌属(Blautia)、毛螺菌科ND3007组(Lachnospiraceae ND3007 group)、小类杆菌属(Dialister)、阿加杆菌属(Agathobacter)与三种细胞炎症因子抑制表达评分的相关性均大于0.70。
将短链脂肪酸及乳酸的浓度与样品对LPS诱导的RAW264.7细胞中细胞炎症因子的抑制表达评分做相关性分析,结果如表8所示。
表8发酵液中短链脂肪酸及乳酸水平与细胞炎症因子水平的相关性
注:*表示p<0.05;**表示p<0.01;***表示p<0.001。
从表8可以看出,乙酸、丁酸、乳酸与三种细胞炎症因子抑制表达评分的相关性均大于0.70。
采用多维统计分析OPLS-DA模型的S图分析各β葡聚糖发酵组及对照组的代谢物差异。在OPLS-DA模型的S图(图2)中,选择变量投影重要度(VIP)大于1的变量,然后进一步采用student’s t检验(图3),筛选倍数变化(FC值)大于1.3,有显著性差异(P<0.05)的变量作为上调的差异代谢物。在阳离子和阴离子模式下,分别从实例1-5中筛选出67、88、89、60、61种差异代谢物,取并集后一共有177种差异代谢物。取其中丰度前50的差异代谢物与样品对LPS诱导的RAW264.7细胞中细胞炎症因子的抑制表达评分做相关性分析,结果如表9所示。
表9发酵液中差异代谢物水平与细胞炎症因子水平的相关性
/>
注:*表示p<0.05;**表示p<0.01;***表示p<0.001。
从表9可以看出,二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚、1-磷酸核糖、同型瓜氨酸、3-脱氢喹酸酯、(2E)-3-(2,4-二羟基-5-甲氧基苯基)丙-2-烯酸、龙胆酸的水平与三种细胞炎症因子抑制表达评分的相关性均大于0.70,其中二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸、邻苯二酚与炎症因子抑制表达评分的相关性系数最高,且均大于0.85。
因此,本发明将经黏液真杆菌属(Blautia)、毛螺菌科ND3007组(LachnospiraceaeND3007 group)、小类杆菌属(Dialister)、阿加杆菌属(Agathobacter)、乙酸、丁酸、乳酸、二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸和邻苯二酚作为β葡聚糖抗炎活性的生物标志物。
此外,本发明对生物标志物的测定方法的进行优化,即采用实时荧光定量PCR测定经黏液真杆菌属(Blautia)、毛螺菌科ND3007组(Lachnospiraceae ND3007 group)、小类杆菌属(Dialister)、阿加杆菌属(Agathobacter)的含量,以及结合标准品采用液相色谱测定二羟基苯乙酸、香兰素、咖啡酸、2,3二羟基苯甲酸和邻苯二酚的浓度,步骤如下:
1)通过实时荧光定量PCR测定步骤(1)发酵沉淀中细菌生物标志物的含量;
实时荧光定量PCR的引物为:
Blautia上游引物:5’-AGTCTGATGTGAAAGGCGGG-3’;
Blautia下游引物:5’-AGCCTCAACGTCAGTTACCG-3’;产物为168bp;
Lachnospiraceae ND3007 group上游引物:5’-GCGTAGACGGCAATGCAAG-3’;
Lachnospiraceae ND3007 group下游引物:5’-ACGCATTTCACCGCTACACT-3’;产物为123bp;
Dialister上游引物:5’-CTAGTGGCAAACGGGTGAGT-3’;
Dialister下游引物:5’-TCAGACGCAAACCCCTCTTC-3’;产物为165bp;
Agathobacter上游引物:5’-GCTAAATACGTGCCAGCAGC-3’;
Agathobacter下游引物:5’-AATGCAGTACCGGGGTTGAG-3’;产物为132bp;
此外采用通用引物序列对DNA样本进行扩增,用于计算特异菌群的相对丰度,包括:338F(5’-ACTCCTACGGGAGGCAGCAG-3’)、806R(5’-GGACTACHVGGGTWTCTAAT-3’)。
使用南京诺唯赞生物科技股份有限公司的ChamQ Universal SYBR qPCR MasterMix试剂盒进行实时荧光定量PCR,实时荧光定量PCR的体系如下::2×ChamQ UniversalSYBR qPCR Master Mix 10μL,上游引物(10μM)0.4μL,下游引物(10μM)0.4μL,模板DNA10ng,最后用ddH
实时荧光定量PCR的条件为:95℃预变性30s;95℃变性10s、60℃退火30s,40个循环;溶解曲线绘制条件为:95℃保持15s,60℃保持60s,95℃保持15s。
2)用气相色谱测定步骤(1)中发酵上清液中乙酸和丁酸的含量:上清液通过0.45μm膜过滤,然后将0.02mL浓度为6mol/L的盐酸溶液和0.03mL浓度为0.04mol/L的2-乙基丁酸溶液添加到0.45mL过滤的发酵上清液中。用带有氢火焰离子化检测器的GC2010 Plus系统的气相色谱仪(日本岛津)以及DBWAX毛细管柱(30cm×0.25mm×0.25μm,安捷伦)。检测条件如下:载气为N
3)用乳酸试剂盒测定步骤(1)中发酵上清液中乳酸的含量,用全自动酶标仪(Multiskan MK3)测定530nm处的吸光度;
4)用液相色谱测定步骤(1)中发酵上清液中其余代谢物生物标志物的含量,使用标准品定量,标准品为二羟基苯乙酸、香兰素、2,3-二羟基苯甲酸、邻苯二酚、咖啡酸,具体步骤如下:
A、取100μL发酵上清液于1.5mL离心管中,加入400μL提取液(乙腈:甲醇=体积比1:1)涡旋混匀,低温超声(5℃,40KHz)提取30min后于20℃静置30min,然后于4℃,13000×g离心15min,移取上清液,氮气吹干后用120μL复溶液(乙腈:水=体积比1:1)复溶,低温超声萃取5min(5℃,40KHz),4℃,13000×g离心5min,收集上清液至进样小瓶中;
B、色谱柱:BEH C18色谱柱(100mm×2.1mm,1.8μm),进样量:10μL,流动相A:水(含0.1%v/v甲酸),流动相B:乙腈/异丙醇(体积比1:1,含0.1%v/v甲酸),流速为0.40mL/min,柱温为40℃;
C、分离梯度:0-3min,流动相A从线性95%降至80%,流动相B从线性5%升至20%;3-9min,流动相A从线性80%降至5%,流动相B线性从20%升至95%;9-13min,流动相A线性维持5%,流动相B线性维持95%;13.0-13.1min,流动相A线性从5%升至95%,流动相B线性从95%降至5%;13.1-16min,流动相A线性维持95%,流动相B线性维持5%。
然后将细菌生物标志物Blautia、Lachnospiraceae ND3007 group、Dialister和Agathobacter的总丰度记为T1,将乙酸、丁酸和乳酸的总浓度记为T2,将二羟基苯乙酸、香兰素、2,3二羟基苯甲酸、邻苯二酚和咖啡酸的总浓度记为T3。将对照组的细菌生物标志物的总丰度,乙酸、丁酸和乳酸的总浓度,二羟基苯乙酸、香兰素、2,3-二羟基苯甲酸、邻苯二酚和咖啡酸的总浓度分别记为TC1、TC2、TC3。
如表6显示,实例1、实例2样品抗炎效果较弱且没显著差异,如表10显示,实例1、实例2生物标志物的丰度均满足1.1*TC1≤T1<1.6*TC1,1.3*TC2≤T2<2.1*TC2和(或)1.1*TC3≤T3<1.3*TC3。实例3样品抗炎效果适中,且其生物标志物的丰度满足1.6*TC1≤T1<2.1*TC1,2.1*TC2≤T2<2.9*TC2和(或)1.3*TC3≤T3<1.5*TC3。实例4、实例5样品的抗炎活性最强且无显著差异,且两样品的生物标志物丰度均满足T1≥2.1*TC1,T2≥2.9*TC2和(或)T3≥1.5*TC3。
表10实例样品的生物标志物丰度与对照样品生物标志物丰度的比值
因此,当待测样品的T1≥2.1*TC1,T2≥2.9*TC2和(或)T3≥1.5*TC3,该样品抗炎效果较强;当待测样品的1.6*TC1≤T1<2.1*TC1,2.1*TC2≤T2<2.9*TC2和(或)1.3*TC3≤T3<1.5*TC3,该样品抗炎效果适中;当待测样品的1.1*TC1≤T1<1.6*TC1,1.3*TC2≤T2<2.1*TC2和(或)1.1*TC3≤T3<1.3*TC3,该样品抗炎效果较弱;当待测样品的T1<1.1*TC1,T2<1.3*TC2和(或)T3<1.1*TC3,该样品不具有缓解炎症的作用。
上述实施例为本发明较佳的实施方式,但本发明并不限制于以上描述的具体实施例。其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种用于类风湿性关节炎诊断的生物标志物及其应用
- 一种海藻多糖抗结肠癌活性的生物代谢标志物筛选方法及应用
- 用于视神经脊髓炎谱系疾病诊断的生物标志物及其应用
