一种基于双组分群体感应元件的枯草芽孢杆菌自诱导基因表达系统
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于基因工程技术领域,主要涉及一种基于双组分群体感应元件的枯草芽孢杆菌自诱导基因表达系统。
背景技术
随着基因工程、合成生物学的发展,人们通过在细胞中构建基因电路来实现对细胞进行遗传操作,这在合成生物学研究中具有重要的作用。传统的表达调控系统可以在转录水平实现调控,但需要外源添加诱导剂来进行调控,常见的诱导剂有由乳糖、异丙基硫代半乳糖苷(IPTG)、木糖等,不过,诱导型的表达系统种类依然很少,性能依然不能满足大规模工业生产的要求,并且外源添加的诱导剂会大幅度提高生产成本。此外,细胞内的所有代谢活动是动态而复杂的,而这种调控策略与底盘细胞的生长耦合,所以在细胞中构建人工静态调控系统往往会对底盘细胞造成干扰,例如,外源基因的过度表达可能造成宿主无法正常生长;中间有毒产物的大量积累可能对细胞产生毒害作用,甚至导致细胞死亡。有时需要生产特殊的化合物,例如在合成具有细胞毒性的产物时,通常需要宿主生长到较高的细胞密度时再从生长转换为生产模式,从而尽可能减少产物对细胞的毒害作用。因此,开发自诱导的基因表达调控电路对代谢工程及蛋白质工程依然十分重要。
发明内容
本发明的目的为了开发一种持久和高表达的自诱导基因表达系统。
本发明提供一种自诱导基因的表达元件,所述表达元件由组成型启动子和靶标启动子、agrA基因的RBS序列和/或agrD基因的RBS序列、编码应答调节蛋白基因agrA、编码信号分子AIP前体基因agrD、编码信号加工蛋白的基因agrB和编码与信号分子结合并启动信号传导的传感蛋白基因agrC组成。
进一步地限定,所述agrD基因的RBS序列如SEQ ID NO.16或SEQ ID NO.17所示;所述agrA基因的RBS序列如SEQ ID NO.18、SEQ ID NO.19、SEQ ID NO.20或SEQ ID NO.21。
进一步地限定,组成型启动子分别为组成型启动子Pveg和组成型启动子P43,靶标启动子为P3启动子,载体为pHT01。
进一步地限定,连接顺序为:组成型启动子P43与agrA基因RBS和agrA基因依次连接,P3启动子与多克隆位点连接,组成型启动子Pveg与agrD基因RBS和agrD基因依次连接,组成型启动子Pveg被置于P43启动子的上游,agrB基因和agrC基因与多克隆位点连接。
本发明提供上述的自诱导基因的表达元件的重组载体。
本发明提供一种制备上述的表达元件的方法,其特征在于,所述方法的具体步骤如下:将含有组成型启动子、agrA基因的RBS序列和/或agrD基因的RBS序列、编码应答调节蛋白基因agrA、编码信号分子AIP前体基因agrD的载体转化到整有agrB基因和agrC基因的微生物细胞。
本发明提供一种自诱导基因的表达系统,含有上述的自诱导基因的表达元件的微生物细胞。
进一步地限定,所述微生物细胞为革兰氏阳性菌的微生物细胞。
进一步地限定,微生物细胞为枯草芽孢杆菌。
本发明提供上述的表达元件或上述的表达系统在食品、化工和制药领域中的应用。
有益效果:金黄色葡萄球菌Agr系统是一种介导群体感应的双组分系统,通过受体组氨酸激酶感应环肽信号分子AIP,经过磷酸化级联激活靶标启动子,调控靶基因的表达时机。基于对Agr双组分信号系统的研究,可以在枯草芽孢杆菌中重构了Agr,将之设计成为自诱导基因表达系统。
枯草芽孢杆菌B.subtilis是重要的工业酶高效表达平台和代谢工程底盘微生物,在B.subtilis中构建与生长相偶联的动态基因表达系统在代谢工程中的应用十分重要。如果利用内源的群体感应系统对基因表达进行调控,会严重影响其细胞生长等重要的生理过程。所以异源重构正交性较好的人工群体感应系统具有重大的意义。
本发明首先在枯草芽孢杆菌中重构了金黄色葡萄球菌Agr双组分系统,构建出自诱导肽(AIP)驱动的自诱导基因表达系统AgrQS。并利用RBS工程对关键蛋白元件AgrA蛋白的表达水平进行单一以及与信号分子AgrD表达水平共同进行两基因组合调控,实现自诱导系统激活时机、时间动态以及表达输出水平的调节。本发明对设计基于枯草芽孢杆菌的重组蛋白表达体系提供了一种新的思路和方法。
附图说明
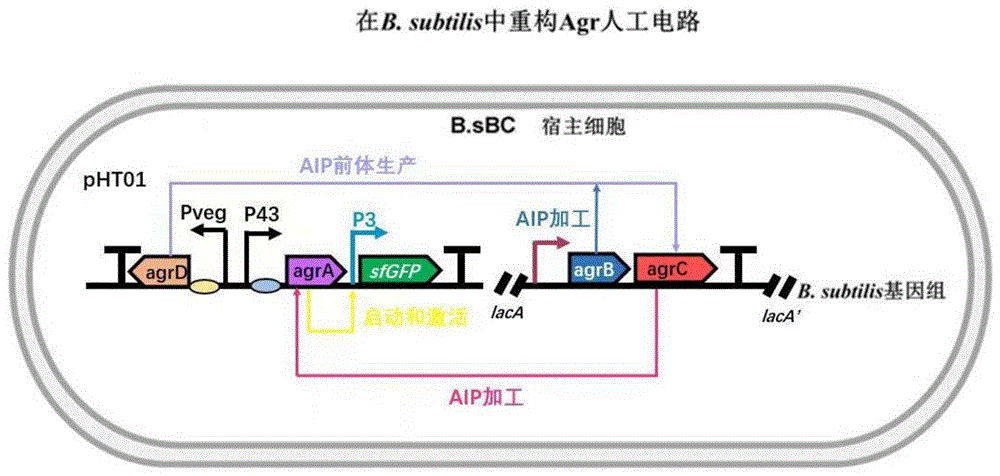
图1:基于agr群体感应元件的枯草芽孢杆菌自诱导AgrQS表达系统构建示意图。
图2:AgrQS的功能验证;a是异源构建AgrQS系统的荧光强度检测;b是SDS-PAGE蛋白表达检测;
图3:通过RBS工程,调节agrA的表达水平,并确证其对agrA表达水平的变化对AgrQS系统激活时间动态的影响;
图4:agrD和agrA表达水平共调节体系转化子第一次筛选;
图5:agrD和agrA表达水平共调节体系的转化子第二次筛选;
图6:验证agrD和agrA表达水平共调节对AgrQS系统时间动态的作用。
具体实施方式
下述实施例涉及的培养基如下:
1.培养基:
LB固体培养基:LB液体培养基中加入1.5-2%的琼脂粉用于菌体的筛选、活化和平板培养等。
SP-Ⅰ培养基(10mL):4.9mL SPA溶液,4.9mL SPB溶液,100μL 50%葡萄糖溶液,100μL 100×CAYE溶液混匀,现用现配。
SP-Ⅱ培养基(4mL):4.92mL SP-Ⅰ培养基,40μL 50mmol·L-1CaCl2溶液,40μL250mmol·L-1MgCl2溶液混匀,现用现配。
本发明中涉及的相关抗生素的终浓度:氨苄青霉素(Amp)100μg·mL-1氯霉素(Chl)10μg·mL-1
2.SDS-PAGE蛋白检测:
取出保藏的甘油菌,在LB琼脂培养基平板上分区划线,放置37℃培养箱中过夜培养。从平板上挑取单菌落接至含有3mL LB液体培养基的小试管中,37℃,200r·min-1过夜培养,再以1%接种量转接至含LB大试管中,37℃,200r·min-1培养12h。吸取200μL培养液,12,000r·min-1离心2min弃上清,用200μL的溶菌酶溶液将菌体充分重悬,置于37℃金属浴中孵育40-60min,直至溶液澄清透明。之后加入50μL的5×loading buffer,沸水浴煮沸10min,上样进行检测。
3报告基因sfGFP的表达检测
sfGFP表达水平:从平板上挑取单菌落至含有3mL LB培养基的小试管中,37℃,200r·min-1过夜培养;按照1%的接种量转接种子液至含LB大试管,37℃,200r·min-1培养,取不同时间的样品测定OD600和sfGFP荧光强度。在特定时间下取适量的发酵菌液,13,000r·min-1离心1min保留沉淀,用1×PBS溶液洗涤2~3次后等体积重悬菌体。取200μL菌液于96孔透光酶标板中,使用酶标仪检测荧光强度。程序设定:激发波长发射波长分别为495nm和525nm。
4.JM109感受态细胞的制备与化学转化
取一管60-90μL的大肠杆菌感受态细胞,加入约2-5μL的重组质粒,轻柔混匀,冰浴25-30min;42℃热激90s,立即冰浴2-3min;加入适量的复苏培养基,37℃,200r·min-1培养45-60min;离心后吸适量菌液涂布含有合适抗性的筛选平板。
5.B.subtilis 168感受态细胞的制备与化学转化
将保藏的甘油菌液或平板上的单菌落接至含有2mL SP-I的试管中,37℃,200r·min-1过夜培养,转接100μL种子液至含有5mL SP-I的试管中,37℃,200r·min-1培养4-6h,随后转接0.2mL培养液至含2mL SP-II的试管中,37℃,200r·min-1继续培养90min。加入10μL·mL-1 10m mol·L-1EGTA,摇床培养10min。将培养液以每份500μL分装至无菌的离心管中,加入适量DNA片段,于37℃,200r·min-1摇床培养90-120min,离心后将菌液涂布至含有抗性的平板。
6.质粒提取
具体操作流程参考
实施例1:AgrQS自诱导基因电路在枯草芽孢杆菌中的构建与验证
1.以含有agr群体感应系统(agrQS)的质粒为模板,将agrB和agrC两个元件扩增后,克隆入pAX01载体,然后转化B.subtilis 168,整合到枯草芽孢杆菌基因组的lacA位点,得到在lacA位点整合了agrB和agrC的重组枯草芽孢杆菌BsBC。
2.Agr系统中编码信号分子AIP前体的基因agrD置于组成型启动子Pveg下游,agrA置于组成型启动子P43下游,P3靶标启动子调控下游报告基因sfGFP的表达(连接到pHT01载体),构成重组质粒pHT-max-DA-P3-sfGFP。将重组质粒转化至整合有agrB和agrC的重组枯草芽孢杆菌BsBC,涂布含有氨苄的LB平板,通过菌落PCR筛选阳性转化子。(序列:P3、P43、Pveg、agrA、agrB、agrC、agrD和sfGFP序列如表1所示)。含有的原始的RBS序列是(5’-ACACGCACCTCGAACGCCACGCAATATATACGAAGGAGGTCCGAC-3’,SEQ ID NO.21)。
挑取构建好的转化子与原始菌株B.subtilis 168至3ml LB液体培养基的小试管中,37℃,200r·min
经SDS-PAGE电泳检测,结果如图1所示,含有重组质粒(pHT-agrD-agrA-P3-sfGFP)的整合菌株激活了sfGFP的表达,而没有整合基因的菌株中sfGFP不表达,荧光强度检测(图2-a)与SDS-PAGE(图2-b)的实验结果一致。说明在枯草芽孢杆菌中,异源AgrQS系统的各个组件都能如预期发挥作用,并且具有高效的异源蛋白表达水平。
表1P3、P43、Pveg、agrA、agrB、agrC、agrD和sfGFP核苷酸序列信息
/>
实施例2:通过调控转录调节蛋白AgrA的水平来优化AgrQS的信号输出动态
将已构建的含有agrD和agrA以及P3启动子调控下的报告基因sfGFP克隆入pHT01载体(pHT-max-DA-P3-sfGFP)质粒作为模板,用表2中的引物P43-RBSm-A-F/R做全质粒PCR构建agrA的RBS文库并以含sfCFP的质粒为表达体系(构建引物见表2)。
将构建好的重组质粒(以pHT-max-DA-P3-sfGFP为模板,以表2的引物进行反向扩增,获得含有RBS序列简并的扩增产物,DpnI消化去除模板后,获得重组质粒),转入大肠杆菌进行扩增,扩增后提取质粒,将质粒库转化至整合了agrB、agrC的B.subtilis 168重组菌株BsBC中,涂布到LB固体培养基,得到含有表达AgrA的RBS突变体文库。从文库中挑选显绿色荧光的单菌落于小试管过夜培养,进行荧光强度检测,挑选10个高表达强度的转化子转接大试管培养12小时,分别于4h、6h、8h、10h、12h测相对荧光强度。
结果如图2和表3所示,RA2和RA7调控AgrA的AgrQS系统时间动态被拓宽,激活时间点从原始系统的4h延迟至6-8h,能够实现高菌体密度下的自诱导基因表达。
RA2的RBS序列:CTATGTGAGT(SEQ ID NO.20);RA7的RBS序列:GTTTGTCAGT(SEQ IDNO.21)。
表2agrA的RBS突变引物
注:表中的B表示包含C、G、T的简并序列;D包含A、G、T的简并序列;V包含A、C、G的简并序列;H包含A、C、T的简并序列;V包含A、C、G的简并序列;S包含C、G的简并序列;R包含A、G的简并序列;Y包含C、T的简并序列;M包含A、C的简并序列。
表3大试管培养的10个转化子与WT培养后的总荧光强度
注意:原始RBS(WT)指实施例1构建的系统转化得到的转化子。
实施例3:同时对Agr元件中的信号合成基因agrD和信号传感基因agrA进行RBS工程化设计来优化AgrQS的信号输出动态
将pHT-max-DA-P3-sfGFP质粒作为模板,用表4中的引物vegRBSmut-DA-F/R做全质粒PCR构建agrD的RBS文库并以含sfGFP的质粒为表达体系(构建引物见表4)。
将构建好的重组质粒(以pHT-max-DA-P3-sfGFP为模板,以表4的vegRBSmut-DA-F/R引物进行反向扩增,克隆到pHT01载体,获得含有简并RBS的重组质粒,pHT-veg-RBS-mut-DA)转入大肠杆菌进行扩增,提取质粒pHT-veg-RBS-mut-DA(各种序列的混合物)后,作为模板,用表4中的引物P43-RBS-mut-DA-F/R做全质粒PCR构建agrA的RBS突变体文库并表达sfGFP的质粒(以pHT-veg-RBS-mut-DA为模板,以表4的P43-RBS-mut-DA-F/R引物扩增,含有RBS突变的质粒库,DpnI消化去除模板后,获得重组质粒1)。
将构建好的重组质粒1转化至整合了agrB和agrC的重组B.subtilis 168中,将获得的重组枯草芽孢杆菌在LB培养基中,37℃下培养,将显绿色荧光的近200个单菌落挑出在96孔深孔板中37℃,300rpm培养24小时,检测相对荧光强度,结果如图3和表5所示。初步筛选得到15个高表达强度的转化子,转接小试管进一步培养过夜,再次进行荧光强度检测。
结果如图3和表6所示,从该组中又挑选出7个表达更高的转化子再次转接至大试管,培养12小时,分别于4h、6h、8h、10h、12h测相对荧光强度。结果如图3和表7所示,其中,1-B11和1-E2突变株P3介导的基因表达强度产生高低不同的变化,提示信号输出强度实现了调节。同时,表达时间动态有不同程度延迟,其介导的AgrQS自诱导系统表达动态得到了改变,实现了高密度条件下的自发诱导。
图4是agrD和agrA表达水平共调节体系转化子第一次筛选;实施例三,为了探讨同时调节agrD和agrA双基因表达体系对系统输出性能的影响。作为在深孔板中进行的初始筛选,获得了激活水平有显著差异的一系列双基因组合表达体。
图5是agrD和agrA表达水平共调节体系的转化子第二次筛选;对上述组合体进行筛选,获得了15个潜在功能符合需求的组合表达体,其作用水平有差异。
图6是验证agrD和agrA表达水平共调节对AgrQS系统时间动态的作用;对上述15种组合体进行筛选,确定6种组合体,进一步在三角瓶中放大培养。确定组合体表达的时间动态。结果表明,同时调节两个基因的表达能够影响AgrQS的输出表达水平,并使系统激活时间点由原始的接种后4h延后至6-8h。
将逐级扩大培养得到的高表达突变株1-B11和1-E2进行测序鉴定获得其RBS序列(表8)表4agrA和agrD的RBS突变引物
注:表中的B表示包含C、G、T的简并序列;D包含A、G、T的简并序列;V包含A、C、G的简并序列;H包含A、C、T的简并序列;V包含A、C、G的简并序列;S包含C、G的简并序列;R包含A、G的简并序列;Y包含C、T的简并序列;M包含A、C的简并序列。
表5 96孔板培养筛出的15个转化子过夜培养后的总荧光强度
表6小试管培养培养筛选出的15个转化子与WT过夜培养后的总荧光强度
表7大试管培养筛出的7个转化子与WT培养后的总荧光强度
注意:WT指实施例1构建的系统转化得到的转化子
表8高表达突变体RBS序列
/>
实施例4.双组分群体感应元件的枯草芽孢杆菌自诱导基因表达系统
1.以含有agr群体感应系统(agrQS)的质粒为模板,将agrB和agrC两个元件扩增后,克隆入pAX01载体,然后转化B.subtilis 168,整合到枯草芽孢杆菌基因组的lacA位点,得到在lacA位点整合了agrB和agrC的重组枯草芽孢杆菌BsBC。
2.Agr系统中编码信号分子AIP前体的基因agrD置于组成型启动子Pveg下游,agrA置于组成型启动子P43下游,P3靶标启动子调控下游待表达的基因,克隆到pHT01载体构成重组质粒pHT-max-DA-P3-sfGFP(将待表达的蛋白替换sfGFP实现高表达)。
3.1以pHT-max-DA-P3-sfGFP为模板,通过引物B11D-F/R进行反向扩增,获得含有1-B11突变株中表达agrD的RBS(SEQ ID NO.16)的重组质粒,转入大肠杆菌进行扩增,提取质粒后,作为模板,用B11A-F/R引物,获得含有SEQ ID NO.18所示的RBS的质粒,DpnI消化去除模板后,获得重组质粒。
将重组质粒转化至整合有agrB和agrC的重组枯草芽孢杆菌BsBC,涂布含有氨苄的LB平板,通过菌落PCR筛选阳性转化子。(序列:P3、P43、Pveg、agrA、agrB、agrC、agrD和sfGFP序列如表1所示)。
表9克隆1-B11突变体重组质粒克隆引物
或3.2以pHT-max-DA-P3-sfGFP为模板,以引物E2D-F/R进行反向扩增,获得含有1-E2突变株中表达agrD的RBS(SEQ ID NO.17)的重组质粒,转入大肠杆菌进行扩增,提取质粒后,作为模板,用E2A-F/R引物,获得含有SEQ ID NO.19所示的RBS的质粒,DpnI消化去除模板后,获得重组质粒。
将重组质粒转化至整合有agrB和agrC的重组枯草芽孢杆菌BsBC,涂布含有氨苄的LB平板,通过菌落PCR筛选阳性转化子。(序列:P3、P43、Pveg、agrA、agrB、agrC、agrD和sfGFP序列如表1所示)
表10 1-E2突变体菌株重组质粒克隆引物
/>
- 基于人工串联启动子的枯草芽孢杆菌高效诱导表达系统
- 一种N端序列元件在调控枯草芽孢杆菌表达蛋白中的应用
- 一种基于Lux群体感应元件的枯草芽孢杆菌自诱导基因表达系统
- 基于枯草芽孢杆菌生物素连接酶的外源基因诱导表达调控系统及其构建方法
