医用图像处理装置和医用图像处理方法
文献发布时间:2023-06-19 19:28:50
技术领域
实施方式涉及医用图像处理装置和医用图像处理方法。
背景技术
目前,X射线摄影装置、CT装置、超声波检测装置等医用图像采集装置被大量应用于癌症和异常的解剖结构等病变部位的早期发现。利用医用图像采集装置对被检体进行拍摄而取得医用图像,通过医师对医用图像进行阅片,有助于找到图像上的病变部位的临床特征。
在这种诊断中,针对病变部位的性质判断尤为重要,例如在针对肿瘤部位的良恶性鉴别时,目前发现恶性的风险或者可能性往往与某些病理特征有关。医师能够通过阅片,根据经验而对疑似部位制作病理特征的描述,将这些特征作为临床特征加以记录,其中,有些临床特征能够被量化而用于分级评估,被称为临床可解释特征。这些临床可解释特征目前往往通过临床指南等标准进行规定。临床指南例如有乳腺影像报告和数据系统BI-RADs(Breast Imaging-Reporting and Data System),在这种临床指南中规定了基于临床可解释特征的病变定级标准,从而医师能够将医用图像的阅片结果对照病变定级标准而对病灶性质进行定级评估。
目前,除了人工阅片的方法,为了提高癌症等疾病的筛查准确性和标准化,已有采用人工智能或机器学习系统来辅助医师进行阅片的决策的技术。例如,采用人工智能/机器学习系统辅助人类专家进行决策。
通过图像处理装置从医用图像中提取与肿瘤等特定部位对应的区域的经典形态/纹理特征或动力学特征等图像基本特征,基于所提取的图像基本特征而利用支持向量机、随机森林等机器学习算法对肿瘤进行良恶性鉴别。或者,利用卷积神经网络提取的深层特征结合经典特征鉴别良恶性肿瘤。其中,例如使用有无病变/病变程度的训练数据来学习基于各种图像特征量判断有无病变/病变程度的判断器。并且,还有将图像特征的人工视觉判断作为训练数据来学习临床可解释特征的特征量的方法。也考虑到以上方法简单组合的方法。
但是,在现有的人工阅片中,肿瘤的一些临床可解释特征例如边缘、边缘强化、异质性等对于医生的诊断很有用,但存在不同阅片者之间变动较大的问题。在将医师得到的临床可解释特征的评价结果作为训练数据进行学习的情况下,这种阅片者之间的变动成为所得到的判断器的判断精度的制约,存在难以实现较高判断精度的问题。
另一方面,利用医用图像中的图像基本特征对病灶进行判断的方法中,由于图像基本特征的限制,也很难得到准确的结果。
并且,利用深度学习提取深度特征的方法中,所提取的特征是不可解释的,也不利于对肿瘤等病灶的量化分析。在将有无病变/病变程度作为训练数据进行学习的情况下,判断器的中间特征量不能进行临床解释,因此即使将该中间特征量进行显示,用户也无法判断其的妥当性。在组合的方法中,如果显示将图像特征的人工视觉判断作为训练数据学习而成的特征量,则用户能够确认该特征量是否妥当或者对该特征量进行修改,但是由于如上所述的临床可解释特征的阅片者依存性,存在对于有无病变/病变程度的判断未必是优良的学习结果的问题。
发明内容
本发明就是鉴于以上问题而完成的,其目的在于提供一种能够提高医用图像的量化分析准确性的医用图像处理装置和医用图像处理方法。
实施方式的医用图像处理装置具备:生成单元,从包含感兴趣区域的医用图像生成表示图像特征的第一特征;显示单元,显示所述第一特征;以及鉴别单元,基于所述第一特征,对所述医用图像中的所述感兴趣区域进行鉴别,输出与所述感兴趣区域有关的鉴别结果。
此外,实施方式的医用图像处理装置中的医用图像处理方法包括:生成步骤,从包含感兴趣区域的医用图像生成表示图像特征的第一特征;显示步骤,显示所述第一特征;以及鉴别步骤,基于所述第一特征,对所述医用图像中的所述感兴趣区域进行鉴别,输出与所述感兴趣区域有关的鉴别结果。
根据本发明的医用图像处理装置和医用图像处理方法,不会受到主观影响而能够提高医用图像的量化分析准确性。
此外,也可以是,在所述医用图像处理装置中,所述生成单元具备:分割单元,取得所述医用图像,并对所述医用图像进行规定的分割处理,确定所述医用图像中的所述感兴趣区域;以及临床可解释特征生成单元,利用将包含所述感兴趣区域的所述医用图像作为输入而输出临床可解释特征的第二判断模型,从包含所述感兴趣区域的所述医用图像生成所述感兴趣区域的所述临床可解释特征,所述鉴别单元利用将图像特征作为输入而输出与所述感兴趣区域有关的鉴别结果的第一判断模型,将所述临床可解释特征生成单元生成的所述临床可解释特征作为所述图像特征输入所述第一判断模型,从而输出与所述感兴趣区域有关的鉴别结果。
在使所述医用图像处理装置进行学习时,作为第一阶段,学习根据所述图像特征以及所述临床可解释特征计算鉴别结果的第一判断模型,作为第二阶段,学习输出临床可解释特征的第二判断模型。在第一阶段,将从图像算出的图像特征和医师判断的视觉判断图像特征输入判断模型,使用良性或者恶性的确诊结果作为训练数据,来学习第一判断模型。在第二阶段,将从图像算出的图像特征和作为第二判断模型的输出的临床可解释特征输入第一判断模型,使用良性或者恶性的确诊结果作为训练数据,来学习第二判断模型。
根据以上的医用图像处理装置,在作为最终学习的第二判断模型的学习中,在临床可解释特征的学习中不使用视觉判断的特征量,所以不会受到主观影响,能够优化有无病变/病变程度的判断精度。并且,由于能够进行临床解释,所以通过将特征显示于画面上,用户就能判断妥当性,能够在必要的时候进行修正。
此外,也可以是,在所述医用图像处理装置中,所述生成单元具备:分割单元,取得所述医用图像,并对所述医用图像进行规定的分割处理,确定所述医用图像中的所述感兴趣区域;图像基础特征提取单元,从包括所述感兴趣区域的医用图像中提取图像基础特征;以及临床可解释特征生成单元,利用将所述图像基础特征与临床可解释特征建立了关联的转换模型,根据所述图像基础特征提取单元提取的所述图像基础特征,生成所述感兴趣区域的所述临床可解释特征,所述鉴别单元根据所述临床可解释特征生成单元生成的所述临床可解释特征,对所述感兴趣区域进行分类,输出与所述感兴趣区域有关的分类结果作为鉴别结果。
根据以上的医用图像处理装置,与医生的主观判断相比,能够从医用图像中自动提取临床可解释特征,减少了主观因素而提高了所提取的临床可解释特征的准确度,从而提高了量化分析的准确度,使阅片工作可重复化和标准化。
此外,与基于深度学习方法对图像进行分析的方法相比,本发明的分类结果是基于临床指南中规定的临床可解释特征而得到的,因此,理解更加直观,具有解释性的优势。
附图说明
图1是表示第一实施方式的医用图像处理装置的功能构成的一例的框图。
图2是表示第一实施方式的医用图像处理装置中的模型生成单元所进行的学习过程的示意图。
图3是表示第一实施方式中的模型应用过程的示意图。
图4是表示第一实施方式的医用图像处理装置中的显示单元所显示的画面的一例的图。
图5是用于说明第一实施方式的医用图像处理装置中的模型生成过程的流程图。
图6是用于说明第一实施方式的医用图像处理装置中的图像鉴别处理方法的流程图。
图7是表示第二实施方式的医用图像处理装置的功能构成的一例的框图。
图8是表示第二实施方式中的临床可解释特征的生成过程的示意图。
图9是表示第二实施方式的医用图像处理装置中的显示单元所显示的示出所生成特征的画面的一例的图。
图10是用于说明第二实施方式的医用图像处理装置中的图像鉴别处理方法的流程图。
图11是表示第三实施方式的医用图像处理装置的功能构成的一例的框图。
图12是表示第三实施方式中的基于迭代方法的优化处理过程的示意图。
图13是用于说明第三实施方式的医用图像处理装置中的图像鉴别处理方法的流程图。
附图标记说明
100、100a、100b医用图像处理装置;10、10a生成单元;11分割单元;12、12a临床可解释特征生成单元;20显示单元;30、30a鉴别单元;40修正单元;50、50a模型生成单元;13图像基础特征提取单元;60优化单元。
具体实施方式
以下,参照附图,详细地说明本发明的医用图像处理装置和医用图像处理方法的优选实施方式。
本发明涉及的医用图像处理装置由多个功能模块构成,能够作为软件而安装在独立的计算机等具有CPU(central process unit:中央处理器)和存储器的设备中,或者分散安装于多个设备中,通过某个处理器执行保存在存储器中的医用图像处理装置的各个功能模块来实现。也可以作为能够执行医用图像处理装置的各个功能的电路而以硬件的方式实现。实现医用图像处理装置的电路能够经由互联网等网络进行数据的收发或数据的采集。此外,本发明涉及的医用图像处理装置也可以作为CT装置或磁共振成像装置等医用图像采集装置中的一部分而直接安装在医用图像采集装置中。
此外,在如下说明中,以将乳腺作为对象而拍摄得到的医用图像为例,说明了实施方式中的医用图像处理装置对该类医用图像中存在的结节或肿瘤进行分类(有无病变)或分级(病变程度)等鉴别处理时的动作。但本发明并不限定于此,当然也可以应用于其他医用图像中的特定部位的分类或者分级等鉴别处理中。
(第一实施方式)
首先,参照图1至图6对本发明的第一实施方式进行说明。
图1是表示第一实施方式的医用图像处理装置的功能构成的一例的框图。如图1所示,第一实施方式的医用图像处理装置100具有生成单元10、显示单元20、鉴别单元30、修正单元40以及模型生成单元50。
其中,模型生成单元50用于生成在医用图像处理装置100中使用的处理模型。在第一实施方式中,模型生成单元50取得医用图像中有无病变/病变程度等鉴别结果已经被验证的样本图像数据和该样本图像数据所对应的包括视觉判断图像特征在内的图像特征作为第一训练数据,利用神经网络学习等深度学习方法,进行训练来生成将图像特征作为输入而输出与感兴趣区域有关的鉴别结果的判断模型1。
并且,模型生成单元50还将第一训练数据中的样本图像数据以及鉴别结果所对应的临床可解释特征作为第二训练数据,利用神经网络学习等深度学习方法,进行训练来生成将包含感兴趣区域的医用图像作为输入而输出临床可解释特征的判断模型2。
其中,视觉判断图像特征是医师等具有临床经验的人员通过观察医用图像的阅片行为而从医用图像上看到或者推断出的临床方面的图像特征。可以说,视觉判断图像特征是基于人工判断而量化的图像特征。例如对肿瘤的形状或者边缘状态有关的判断等图像特征。
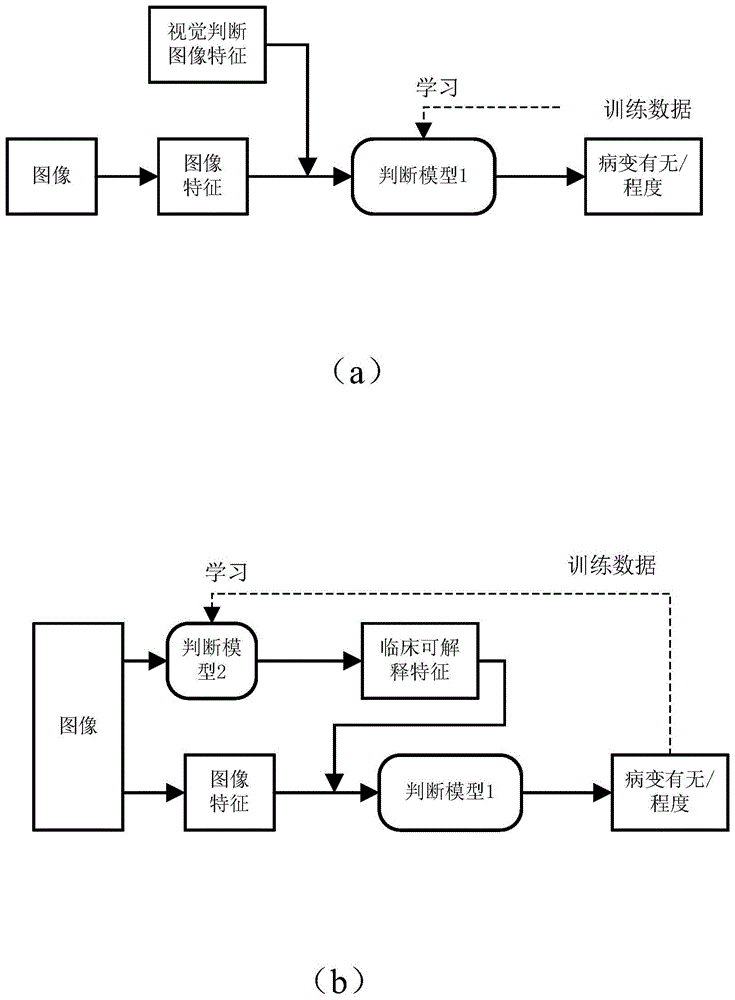
在模型生成单元50的判断模型1的学习中,将这种视觉判断图像特征包含在训练数据中进行训练。图2是表示第一实施方式的医用图像处理装置中的模型生成单元所进行的学习过程的示意图。其中,图2的(a)示出了学习判断模型1时的示意图。
如图2的(a)所示,在学习判断模型1时,取得已经得出有无病变/病变程度的判断结果的样本图像数据,并且获得作为样本图像数据的医用图像的特征以及利用视觉而从医用图像中得到的视觉判断图像特征等图像特征,将表示这些图像特征的特征量与有无病变/病变程度的判断结果作为训练数据,从而利用神经网络等深度学习的方法来学习判断模型1。由此,获得将图像特征作为输入而输出与感兴趣区域有关的鉴别结果的判断模型1。
此外,图2的(b)示出了学习判断模型2时的示意图。
判断模型2的学习是在学习了判断模型1的基础上,在图2的(a)中的视觉判断图像特征的部分处替换为判断模型2,将学习判断模式1时使用的训练数据中的样本图像数据和有无病变/病变程度的判断结果作为训练数据,利用神经网络等深度学习的方法来学习判断模型2。在学习判断模型2时,模型生成单元50能够根据样本图像数据和有无病变/病变程度的判断结果而得到样本图像数据和有无病变/病变程度的判断结果所对应的临床可解释特征,从而通过将这样的样本图像数据和有无病变/病变程度的判断结果作为训练数据,能够学习出将包含感兴趣区域的医用图像作为输入而输出临床可解释特征的判断模型2。或者,模型生成单元50也可以将训练判断模型1时产生的视觉判断图像特征设为判断模型2输出的临床可解释特征进行训练,从而学习出将包含感兴趣区域的医用图像作为输入而输出临床可解释特征的判断模型2。如图2的(b)所示,通过将判断模型2输出的临床可解释特征代替视觉判断图像特征输入判断模型1,能够获得准确的有无病变/病变程度的判断结果。
临床可解释特征是指临床上针对特定部位进行描述且能够量化的特征,这种能够量化的特征便于进行解释,因此常应用于分级评估或者打分等阅片相关处理中。临床可解释特征作为用于描述的特征,具体内容能够通过行业内的指南或者标准来确定和解释,以乳腺相关领域来说,能够参照乳腺影像报告和数据系统BI-RADs(Breast Imaging-Reporting and Data System)来确定临床可解释特征,例如包括圆形、椭圆形、分叶形、不规则形等对肿瘤形状进行描述的特征、光滑、针状、不规则等对边界进行描述的特征、同质性(Homogeneous)、异质性、环状强化等对增强模式进行描述的特征等。这些特征都能够量化来表现。
在第一实施方式中,模型生成单元50如上所述生成判断模型1和判断模型2。从而生成单元10和鉴别单元30能够分别使用模型生成单元50生成的模型进行医用图像的处理。
生成单元10用于从包含感兴趣区域的医用图像生成表示图像特征的各种特征。这里,生成单元10所生成的各种特征对应于“第一特征”。具体来说,生成单元10包括分割单元11和临床可解释特征生成单元12。其中,分割单元11取得医用图像,并对所取得的医用图像进行分割处理,确定感兴趣区域。在本实施方式中,医用图像是乳腺的透视图像等医用图像,并且,需要分析的图像中都存在结节或肿瘤的阴影部分。分割单元11对所取得医用图像进行常规的分割处理,分割出乳腺部分以及乳腺中存在结节或肿瘤的阴影部分,将该阴影部分作为感兴趣区域。具体的分割方法可以采用现有的任意分割方法,因此这里省略说明。
临床可解释特征生成单元12利用将包含感兴趣区域的医用图像作为输入而输出临床可解释特征的判断模型2,将分割单元11分割后的包含感兴趣区域的医用图像输入判断模型2,从而从判断模型2输出对该医用图像中的感兴趣区域的临床上的特征进行可解释地描述的临床可解释特征,由此,临床可解释特征生成单元12生成该医用图像的感兴趣区域的临床可解释特征作为第一特征。
显示单元20对临床可解释特征生成单元12生成的临床可解释特征进行显示。例如,显示单元20可以显示排列示出了医用图像的临床可解释特征的量化数据和相关信息的画面。或者显示将判断模型2输出的多个临床可解释特征按照数值的高低或者概率的高低依次显示的画面。对临床可解释特征的量化显示既可以用具体数据显示,也可以用于数据对应的柱状图等图形进行显示。
此外,显示单元20也可以将临床可解释特征显示于用户交互界面中,从而用户能够通过观察图像而在交互界面上输入对临床可解释特征的描述或数值进行的变更。
修正单元40用于受理用户的输入,从而能够基于用户的输入,对显示单元20显示的临床可解释特征进行修正。
鉴别单元30利用将图像特征作为输入而输出与感兴趣区域有关的鉴别结果的判断模型1,将临床可解释特征生成单元12输出的临床可解释特征输入判断模型1,从判断模型1输出感兴趣区域有无病变/病变程度等的判断结果,由此,从而输出与所述感兴趣区域有关的鉴别结果。
图3是表示第一实施方式中的模型应用过程的示意图。在医用图像处理装置100需要对医用图像的感兴趣区域判断是否存在病变或者病变程度时,在临床可解释特征生成单元12将医用图像输入判断模型2而输出临床可解释特征,其中,显示单元20和修正单元40能够对临床可解释特征进行显示/修正。将临床可解释特征作为图像特征输入判断模型1,从而输出针对病变有无/病变程度的判断结果。通过利用判断模型1和判断模型2这两个模型,在图3所示的应用过程中不会出现视觉判断图像特征这样的主观特征,从而减少主观影响。具体来说,判断模型2是最终将鉴别结果作为训练数据进行学习而得到的,所以判断模型2输出的临床可解释特征中,视觉判断图像特征所包含的阅片者依存的影响相对较少。因此,根据本构成,存在鉴别结果难以受到主观影响的特点。
此外,显示单元20也可以在显示画面上同时显示临床可解释特征和鉴别单元30基于判断模型1的输出结果。在修正单元40变更了临床可解释特征的大小的情况下,判断模型1的有无病变/病变程度的判断结果也会被更新。
例如,在判断模型1为利用机器学习算法而得到的、用各个图像特征构建分类尺度向量而成的模型的情况下,判断模型1能够输出医用图像中的图像特征所构成的分类尺度向量对应的病变预测阳性率。显示单元20可以预先存储有与作为图像特征的临床可解释特征相关的参考信息,例如该临床可解释特征的名称、该临床可解释特征在图像组中概率信息等。显示单元20可以将这些参考信息与所生成的临床可解释特征的数据以及病变预测阳性率一起显示在显示画面上,以便于用户参考。
例如,图4是表示第一实施方式的医用图像处理装置中的显示单元所显示的画面的一例的图。在图4的画面区域R100a中具有多个区域R110、R120、R160、R170、R180。区域R110中显示需要判断其中的肿瘤部分是否病变(良性或者恶性)的医用图像。区域R120示出ID、姓名等患者信息。在图4所示的例子中,在区域R160、R170、R180分别示出了临床可解释特征的描述(名称)以及其对应的判断模型1的输出结果。
例如,在区域R1160表示在具有边缘平滑的临床可解释特征的情况下,基于该临床技术特征算出的预测阳性率为27.0%。并且,作为参照信息,区域R1160还示出了作为识别妥当性尺度的置信区间为20.4%~34.3%,该特征在作为参照组的由良性肿瘤的医用图像构成的良性组中出现的概率为83.0%、在作为参照组的由恶性肿瘤的医用图像构成的恶性组中出现的概率为45.1%。
在区域R170表示在具有边缘平滑和非廓清这两种临床可解释特征的情况下,基于该临床技术特征算出的预测阳性率为1.9%。并且,作为参照信息,区域R170还示出了置信区间为0.2%~6.5%,该组合的特征在作为参照组的由良性肿瘤的医用图像构成的良性组中出现的概率为72.1%、在作为参照组的由恶性肿瘤的医用图像构成的恶性组中出现的概率为2.5%。
在区域R180表示在具有边缘平滑、非廓清以及均匀这三种临床可解释特征的情况下,基于该临床技术特征算出的预测阳性率为3.2%。并且,作为参照信息,区域R180还示出了置信区间为0.1%~6.7%,该组合的特征在作为参照组的由良性肿瘤的医用图像构成的良性组中出现的概率为20.4%、在作为参照组的由恶性肿瘤的医用图像构成的恶性组中出现的概率为1.2%。
通过以上这样的显示,图4中表现出了作为对象的医用图像示出了怎样的图案,并且体现了良性/恶性的程度。
显示单元20还可以根据识别妥当性尺度来决定是否进行显示。例如在图4中区域R180中的置信区间上限(预测阳性率上限)为16.7%,数值介于区域R160与区域R170之间,可见区域R180的情形的参考价值低于区域R160与区域R170,因此显示单元20也可以根据该情况而决定不显示区域R180。
图4的显示画面仅是一个例子,本发明并不限于此,也可以配合判断模型2输出的临床可解释特征的特点而以其他方式进行显示。
图5是用于说明第一实施方式的医用图像处理装置中的模型生成过程的流程图。
在模型生成单元50进行模型的制作时,首先,取得样本图像集,该样本图像集包括已经验证过有无病变/病变程度的鉴别结果(步骤S501),模型生成单元50将根据样本图像集而生成的包括视觉判断图像特征的图像特征和病变有无/程度的鉴别结果作为训练数据进行训练,生成判断模型1(步骤S502)。
并且,在步骤S503,模型生成单元50仅将步骤S502中的训练中使用的训练数据中的病变有无/程度的鉴别结果作为训练数据,将训练判断模型1时产生的视觉判断图像特征设为判断模型2输出的临床可解释特征进行训练,生成判断模型2。
由此,生成将图像特征作为输入而输出与感兴趣区域有关的鉴别结果的判断模型1和将包含感兴趣区域的医用图像作为输入而输出临床可解释特征的判断模型2,并将判断模型1和判断模型2部署到医用图像处理装置100中(步骤S504)。
下面对第一实施方式的医用图像处理装置100所进行的处理的整体流程进行说明。图6是用于说明第一实施方式的医用图像处理装置中的图像鉴别处理方法的流程图。
首先,分割单元11取得待处理的医用图像(步骤S601),并对医用图像进行器官分割以及肿瘤分割,分割出乳腺以及乳腺中的肿瘤部分,将分割出的肿瘤区域作为感兴趣区域(步骤S602)。
接着,在步骤S603,临床可解释特征生成单元12将分割后的医用图像输入判断模型2,从而输出医用图像的临床可解释特征。并且,显示单元20显示所生成的临床可解释特征(步骤S604),修正单元40判断是否受理到对临床可解释特征的修正(步骤S605)。
当在预先设定的一定期间内没有受理到对临床可解释特征的修正(步骤S605:否),进入步骤S606,鉴别单元30将临床可解释特征输入判断模型1,从而输出表示感兴趣区域有无病变或者病变程度的鉴别结果。
另一方面,当在预先设定的一定期间内受理到对临床可解释特征的修正(步骤S605:是),进入步骤S607,鉴别单元30将修正后的临床可解释特征输入判断模型1,从而输出表示感兴趣区域有无病变或者病变程度的鉴别结果。
根据第一实施方式,在进行医用图像的鉴别时使用临床可解释特征而不是视觉判断图像特征,从而能够避免主观影响而提高鉴别的精度。并且,由于临床可解释特征的临床可解释性,不同于以前的神经网络学习中产生的中间特征那样的不可解释特征,因此通过将临床可解释特征显示给用户,用户能够更容易判断该特征的妥当性并能够进行修正,进一步保证鉴别处理的可靠性。此外,通过利用能够从医用图像直接获得便于理解的临床可解释特征的判断模型,能够提高阅片的效率。
(第一实施方式的变形例)
在第一实施方式中,在医用图像处理装置100中具备模型生成单元50,通过模型生成单元50生成判断模型1和判断模型2后部署于医用图像处理装置100中。但是本发明不限于此,也可以是医用图像处理装置100从外部直接获得已生成的判断模型1和判断模型2来进行处理,从而在医用图像处理装置100中也可以不具有模型生成单元50。
此外,在第一实施方式中,通过具有修正单元40来受理对临床可解释特征的修正。但是本发明不限于此,医用图像处理装置100也可以不具有修正单元40从而不容许对临床可解释特征的修正,直接使用判断模型2生成的临床可解释特征进行感兴趣区域的鉴别。
(第二实施方式)
下面参照图7至图10对本发明的第二实施方式进行说明。第二实施方式的医用图像处理装置的构成与第一实施方式相比较,不同点主要在于生成单元与鉴别单元所进行的处理不同,并且,不具有模型生成单元。以下主要针对不同点来进行说明,并对相同或类似的构成标注同样的标号而适当省略重复的说明。
图7是表示第二实施方式的医用图像处理装置的功能构成的一例的框图。如图7所示,第二实施方式的医用图像处理装置100a具有生成单元10a、显示单元20、鉴别单元30a、以及修正单元40。
其中,生成单元10a具有分割单元11、图像基础特征提取单元13以及临床可解释特征生成单元12a。分割单元11取得医用图像,并对所取得的医用图像进行分割处理,确定感兴趣区域。在本实施方式中,医用图像是乳腺的透视图像等医用图像,并且,需要分析的图像中都存在结节或肿瘤的阴影部分。分割单元11对所取得医用图像进行常规的分割处理,分割出乳腺部分以及乳腺中存在结节或肿瘤的阴影部分,将该阴影部分作为感兴趣区域。具体的分割方法可以采用现有的任意分割方法,因此这里省略说明。
图像基础特征提取单元13从分割后的医用图像中提取图像的基础特征。所谓图像的基础特征是指能够通过测量而从图像上准确获得的图像特征,例如包括传统的形态学特征、纹理特征和动力学特征。其中,基础形态学特征表示图形的形态结构,例如轮廓的外边界尺寸、区域大小等。基础纹理特征表示图像或感兴趣区域的表面特征,例如图像纹理的粗细、稠密等特征。
基础动力学特征是图像上的动态的特征,例如在对多期造影图像提取基础动力学特征时,存在造影图像与造影前图像相比较的增强比例、从增强后的第一个期像至达到最亮的期像的时间差、最亮时的图像增强比例等动力学特征。
临床可解释特征生成单元12a从图像基础特征提取单元13取得图像基础特征,利用预先生成的、将图像基础特征与临床可解释特征建立了关联的转换模型,根据该图像基础特征,生成描述图像中的感兴趣区域的临床可解释特征。
所谓临床可解释特征是指临床上针对特定部位进行描述且能够量化的特征,这种能够量化的特征便于进行解释,因此常应用于分级评估或者打分等阅片相关处理中。临床可解释特征作为用于描述的特征,具体内容能够通过行业内的指南或者标准来确定和解释,以乳腺相关领域来说,能够参照乳腺影像报告和数据系统BI-RADs(Breast Imaging-Reporting and Data System)来确定临床可解释特征,例如包括圆形、椭圆形、分叶形、不规则形等对肿瘤形状进行描述的特征、光滑、针状、不规则等对边界进行描述的特征、同质性(Homogeneous)、异质性、环状强化等对增强模式进行描述的特征等。这些特征都能够量化来表现。临床可解释特征还包括对特定部位的动态进行描述的临床可解释动力学特征,例如在使用了造影剂的情况下,存在造影剂在被检体内被注入和吸收的过程,在该过程中,特定部位例如乳腺肿瘤部位会呈现不同的“亮度”,而且,“亮度”变化的方式也可能不同。在BI-RADs中规定了例如先变亮后慢慢变暗的特征(washout)、开始时增强快的特征(fast)、开始时增强慢的特征(Slow)等临床可解释动力学特征。
临床可解释特征生成单元12a所使用的将图像基础特征与临床可解释特征建立了关联的转换模型也称为临床可解释特征生成模型,是利用以前已完成阅片的图像案例作为样本数据而利用机器学习预先生成的模型。这种机器学习生成的模型中对各个图像基础特征分别赋予权重而利用规定的算法得到临床可解释特征。例如该临床可解释特征生成模型可以是如下式(1)那样的线性多项式。
(式1)
y=w
其中,χ
其中,χ
此外,以上所示的多项式是临床可解释特征生成模型的一个例子,但本发明并不限于此,也可以是其他算法,只要是利用样本数据而通过机器学习的方法生成的模型都可以,例如还可以是如下式(2)那样的非线性的形式。
(式2)
在式(2)中,χ
临床可解释特征生成单元12a利用如上所述的式(1)、式(2)那样构成的转换模型,将图像基础特征χ
图8是表示第二实施方式中的临床可解释特征的生成过程的示意图。图8的左侧示出了分割单元11取得了12个被检体的医用图像并将其中的乳腺肿瘤进行了分割的各个图像,这些乳腺肿瘤的图像被输入图像基础特征提取单元13,从而图像基础特征提取单元13从这些图像中提取肿瘤部分的体积、周长、长轴、平直度等图像基础特征。这些图形基础特征能够从图像上直接测量得到,例如通过测量肿瘤部分的长轴的长度,得到长轴的图像基础特征。
图像基础特征提取单元13将这些图像基础特征输入到临床可解释特征生成单元12a中,从而临床可解释特征生成单元12a利用临床可解释特征生成模型,生成临床可解释特征并输出。
鉴别单元30a根据临床可解释特征生成单元12a生成的各个临床可解释特征,对感兴趣区域进行分类,输出与感兴趣区域有关的分类结果。
具体来说,在感兴趣区域为乳腺的肿瘤部分的情况下,通过如图8所示的动作,临床可解释特征生成单元12a能够输出各个肿瘤部分的临床可解释特征。鉴别单元30a将这些临床可解释特征与乳腺影像报告和数据系统BI-RADs(Breast Imaging-Reporting andData System)中规定的分级标准进行对照,获得与肿瘤部分的临床可解释特征对应的肿瘤是良性还是恶性的判断结果,或者肿瘤的分级结果。
此外,鉴别单元30a也可以预先存储有临床可解释特征的数值范围与分类结果建立了关联而成的对应表,从而在获得临床可解释特征时,鉴别单元30a根据这些临床可解释特征检索对应表来获得相应的分类结果。
鉴别单元30a不仅限于对恶性肿瘤进行的判断,也可以用于细化良性肿瘤的种类。
显示单元20对临床可解释特征生成单元12a生成的临床可解释特征进行显示。
修正单元40用于受理用户的输入,从而能够基于用户的输入,对显示单元20显示的临床可解释特征进行修正。
此外,显示单元20也可以在显示画面上同时显示临床可解释特征和鉴别单元30的输出结果。在修正单元40变更了临床可解释特征的大小的情况下,鉴别单元30a的有无病变/病变程度的判断结果也会被更新。
例如,图9是表示第二实施方式的医用图像处理装置中的显示单元所显示的示出所生成特征的画面的一例的图。在图9的画面区域R100中具有多个区域R110、R120、R130、R131、R140、R150。区域R110中显示需要判断其中的肿瘤部分是否病变(良性或者恶性)的医用图像。区域R120示出ID、姓名等患者信息。在图9所示的例子中,在区域R130、R140、R150分别示出了临床可解释特征生成单元12a生成的三种临床可解释特征的描述以及相关参照组的概率范围。在区域R130、R140、R150左下侧示出了临床可解释特征生成单元12a生成的特征量的具体量化数值。
例如,在区域R130表示边缘平滑的特征,该特征在作为参照组的由良性肿瘤的医用图像构成的良性组中出现的概率为83.0%、在作为参照组的由恶性肿瘤的医用图像构成的恶性组中出现的概率为45.1%。在区域R140表示边缘平滑并且非廓清(Non-washout)的特征,该特征在作为参照组的由良性肿瘤的医用图像构成的良性组中出现的概率为72.0%、在作为参照组的由恶性肿瘤的医用图像构成的恶性组中出现的概率为2.5%。在区域R150表示边缘平滑、非廓清(Non-washout)且不均匀的特征,该特征在作为参照组的由良性肿瘤的医用图像构成的良性组中出现的概率为20.0%、在作为参照组的由恶性肿瘤的医用图像构成的恶性组中出现的概率为1.5%。
并且,各个特征量的上方还设置有复选框R1、R2、R3。用户可以通过选择复选框R1、R2、R3来选择利用哪个临床可解释特征作为图像特征进行鉴别,即将哪个特征的特征量用于鉴别单元30a的处理。例如在图9中复选了复选框R1,从而在区域R131中示出鉴别单元30a输出的鉴别结果:“恶性肿瘤的概率是0.3”。
图9的显示画面仅是一个例子,本发明并不限于此,也可以配合临床可解释特征生成单元12a生成的临床可解释特征的特点而以其他方式进行显示。例如也可以将临床可解释特征生成单元12a生成的所有临床可解释特征都用于鉴别单元30a的处理而直接列出临床可解释特征生成单元12a生成的多个临床可解释特征的特征量。并且,也可以通过直接更改临床可解释特征的特征量的方式来受理用户的输入。
例如,显示单元20可以显示排列示出了医用图像的临床可解释特征的量化数据和相关信息的画面。或者显示将临床可解释特征生成单元12a生成的多个临床可解释特征按照数值的高低或者概率的高低依次显示的画面。对临床可解释特征的量化显示既可以用具体数据显示,也可以用于数据对应的柱状图等图形进行显示。
下面对第二实施方式的医用图像处理装置100a所进行的处理的整体流程进行说明。图10是用于说明第二实施方式的医用图像处理装置中的图像鉴别处理方法的流程图。
首先,分割单元11取得医用图像(步骤S301),并对医用图像进行器官分割以及肿瘤分割,分割出乳腺以及乳腺中的肿瘤部分,将分割出的肿瘤区域作为感兴趣区域(步骤S302)。
接着,图像基础特征提取单元13如图8所示从分割后的医用图像中提取基础形态学特征和基础动力学特征(步骤S303),接着,进入步骤S304。
在步骤S304,临床可解释特征生成单元12a利用预先通过机器学习生成的转换模型,根据图像的基础形态学特征生成临床可解释形态学特征,根据图像的基础动力学特征生成临床可解释动力学特征。
并且,显示单元20显示所生成的临床可解释特征(步骤S305),修正单元40判断是否受理到对临床可解释特征的修正(步骤S306)。
当在预先设定的一定期间内没有受理到对临床可解释特征的修正(步骤S306:否),进入步骤S307,鉴别单元30a将各个临床可解释特征与临床指南的分级范围进行对照,由此将肿瘤区域分类为相应的临床级别并输出分类结果。
另一方面,当在预先设定的一定期间内受理到对临床可解释特征的修正(步骤S306:是),进入步骤S308,鉴别单元30a将修正后的各个临床可解释特征与临床指南的分级范围进行对照,由此将肿瘤区域分类为相应的临床级别并输出分类结果。
此外,在第二实施方式中,以包括乳腺肿瘤的图像的分类为例进行了本发明的医用图像处理装置的说明,但是本发明的医用图像处理装置不仅限于对乳腺肿瘤的图像进行处理,能够取得任意部位的影像来对该部位进行分类处理。
根据第二实施方式,通过将从图像上获得的图像基础特征转换为临床可解释特征,根据临床可解释特征对感兴趣区域进行分类,从而与医生的主观判断相比,能够从医用图像中自动提取临床可解释特征,减少了主观因素而提高了所提取的临床可解释特征的准确度,从而提高了量化分析的准确度,使阅片工作可重复化和标准化。
(第三实施方式)
下面参照图11至图13对本发明的第三实施方式进行说明。第三实施方式的医用图像处理装置的构成基于第二实施方式,与第二实施方式相比较,不同点主要在于还具有模型生成单元50a和优化单元60,并且不具有修正单元40。以下主要针对不同点来进行说明,并对相同或类似的构成标注同样的标号而适当省略重复的说明。
图11是表示第三实施方式的医用图像处理装置的功能构成的一例的框图。
如图11所示,第三实施方式的医用图像处理装置100b具有生成单元10a、显示单元20、鉴别单元30a、优化单元60以及模型生成单元50a。
其中,模型生成单元50a在被输入例如已有的图像阅片案例等样本数据的情况下,利用机器学习生成临床可解释特征生成模型。具体来说,例如样本数据包括医用图像数据以及医师对该医用图像进行阅片而描述的该医用图像的临床可解释特征的数据,模型生成单元50a利用这样的样本数据,能够从医用图像数据中提取图像基础特征,使用所提取的该图像基础特征和医用图像数据所对应的临床可解释特征进行机器学习,从而建立如第二实施方式中所述的式(1)或式(2)那样的将图像基础特征与临床可解释特征建立了关联的转换模型。
例如,为了针对3D医用图像生成能够得出肿瘤部分的形状相关的临床可解释特征的转换模型,也可以将χ
此外,例如为了针对多期像造影图像生成能够得出造影剂在被检体内注入和吸收的过程中肿瘤部分的亮度变化方式的临床可解释动力学特征的转换模型,也可以将χ
此外,例如为了生成能够得出肿瘤部位的边界模糊程度的临床可解释特征的转换模型,也可以将χ
以上列举了几个模型生成的例子,但是模型生成单元50a所生成的转换模型不仅限于以上的例子,可以根据样本数据的内容进行设定。
分割单元11取得未进行分类的医用图像,对所取得的医用图像进行分割处理,确定感兴趣区域。在本实施方式中,医用图像是乳腺的透视图像等医用图像,分割单元11对所取得医用图像进行常规的分割处理,分割出乳腺部分以及乳腺中存在结节或肿瘤的阴影部分,将该阴影部分作为感兴趣区域。
图像基础特征提取单元13从分割后的医用图像中提取图像的基础特征。
临床可解释特征生成单元12a从图像基础特征提取单元13取得图像基础特征,利用模型生成单元50a生成的转换模型,代入该图像基础特征,生成描述图像中的感兴趣区域的临床可解释特征。
鉴别单元30a根据临床可解释特征生成单元12a生成的各个临床可解释特征,对感兴趣区域进行分类,输出与感兴趣区域有关的分类结果。例如,鉴别单元30a中针对临床可解释特征预先设定有分类阈值,关于乳腺肿瘤,例如在量化后的临床可解释特征到达或超过所设定的分类阈值的情况下分类为恶性肿瘤,在量化后的临床可解释特征低于所设定的分类阈值的情况下分类为良性肿瘤。该分类阈值也可以根据BI-RADs那样的指南中的记载来设定。
优化单元60能够对感兴趣区域的分类处理进行优化,以便取得准确度更高的分类结果。具体来说,优化单元60取得医用图像所对应的被检体的活检结果作为鉴别单元30a输出的分类结果的临床验证数据,以使分类结果接近该临床验证数据的方式,反复调整临床可解释特征的分类阈值和转换模型的权重,直到最后得到的分类结果收敛为止。
其中,也可以使用例如医生的判断等其他检验数据作为临床验证数据,但是被检体的活检结果相当于真实值,识别性能优于医生的主观判断。
另外,分类结果的收敛不限于分类结果与临床验证数据完全一致,只要达到预先设定的准确度的目标即可。
图12是表示第三实施方式中的基于迭代方法的优化处理过程的示意图。在图12中,按照从左到右的方向,多个医用图像例如12张医用图像的基础特征被提取而输入转化模型,从而在步骤S51中生成各自的临床可解释特征。其中转换模型包括式(1)中的w
该良性/恶性预测结果被输入优化单元60,并且,优化单元60取得分类结果的准确度的目标值例如80%以及这12张图像的被检体的活检结果等良性/恶性检验结果。
优化单元60将预测结果与检验结果进行比较,计算这些医用图像的良性/恶性预测结果的准确度,例如其中有9张医用图像的预测结果和检验结果相同,准确度为75%而低于目标值的80%,则优化单元60分别调整步骤S51中使用的模型权重以及步骤S52中使用的分类阈值,利用调整后的各值再执行一次分类处理,再一次获得新的预测结果。
优化单元60对新获得的预测结果再一次与检验结果进行比较,获得准确度,如果获得的准确度为目标值以上,则停止优化动作,如果获得的准确度低于目标值,则再一次对模型权重和阈值进行调整。如此反复迭代执行对模型权重和阈值的调整,直到新得到的准确度为目标值以上,或者新得到的准确度以无法再进一步接近目标值(准确度收敛)为止。
通过这样的迭代调整,可以优化转化模型中使用的权重和鉴别单元30a使用的分类阈值,从而提高分类结果的准确度。
此外,显示单元20对临床可解释特征生成单元12a生成的临床可解释特征进行显示。并且,显示单元20也可以显示预测结果。
下面对第三实施方式的医用图像处理装置100b所进行的处理的整体流程进行说明。图13是用于说明第三实施方式的医用图像处理装置中的图像鉴别处理方法的流程图。
首先,模型生成单元50a取得样本数据,利用机器学习生成临床可解释特征生成模型(步骤S901)。
接着,分割单元11取得医用图像(步骤S902),并对医用图像进行器官分割以及肿瘤分割,分割出乳腺以及乳腺中的肿瘤部分,将分割出的肿瘤区域作为感兴趣区域(步骤S903)。
接着,图像基础特征提取单元13从分割后的医用图像中提取图像基础特征(步骤S904)之后,进入步骤S905。
在步骤S905,临床可解释特征生成单元12a利用模型生成单元50a生成的转换模型,代入图像基础特征而生成临床可解释特征,并对临床可解释特征加以显示。从而,在步骤S906,鉴别单元30a通过对比临床可解释特征与分类阈值,对肿瘤区域进行分类并输出分类结果。
接着,进入步骤S907,优化单元60取得医用图像所对应的检验结果,从而计算转换模型的准确度。并且,步骤S908,优化单元60判断转换模型的准确度是否高于预先设定的目标值或者准确度是否已收敛,在步骤S908的判断为是,即转换模型的准确度高于预先设定的目标值,或者准确度已经无法再进一步优化即已经收敛,则结束优化单元60的优化动作。
在步骤S908的判断为否,即转换模型的准确度不高于预先设定的目标值,且准确度大于上一次计算的准确度即没有收敛,则进入步骤S909,优化单元60调整步骤S901中生成的转换模型的权重,并且调整步骤S906中使用的临床可解释特征的分类阈值,从而对同一组医用图像再次执行医用图像处理装置100b进行的分类处理,重复执行步骤S903~步骤S908,从而在步骤S908中再次进行判断。如此进行迭代处理,直到所计算出的转换模型的准确度高于目标值或者准确度已收敛为止。
根据第三实施方式,通过将从图像上获得的图像基础特征转换为临床可解释特征,根据临床可解释特征对感兴趣区域进行分类,能够取得与第二实施方式相同的技术效果。
并且,在第三实施方式中,利用活检结果等准确的验证结果对转换模型的权重和临床可解释特征的分类阈值逐步进行迭代优化,能够取得在同类图像的分类处理中更加优良的模型和分类阈值,提高了分类的准确性。并且,识别性能将优于医生的主观判断。从而达到计算机辅助诊断的目的。
(第三实施方式的变形例)
在第三实施方式中,以2D的医用图像为例进行了说明,但是本申请中采集的医用图像也可以是3D的医用图像。
此外,在第三实施方式中,也可以省略模型生成单元50a而直接应用已经生成的转换模型进行处理,优化单元60直接针对已经生成的转换模型的权重进行优化。
此外,在第三实施方式中,优化单元60同时调整临床可解释特征的分类阈值和转换模型的权重,以便使分类的准确度向目标值收敛。但是,也可以固定权重而只调整临床可解释特征的分类阈值,或者也可以固定临床可解释特征的分类阈值而只调整转换模型的权重。或者在迭代的过程中组合这几种调节方式。
此外,本申请的医用图像处理装置还可以具有报告生成单元,根据鉴别单元的分类结果自动生成记载有医用图像的分类结果的报告,由此,能够更加方便地查阅分类结果。
此外,在第三实施方式中,优化单元60使用所计算的准确度与目标值的比较,来判断是否迭代。但是本申请不限于此,也可以建立例如下式(3)所示的损失函数,并预先设定损失函数的目标值,从而通过比较损失函数的结果与目标值来判断是否进行迭代处理。
(式3)
在式(3)中,y表示活检结果(真实值),取值0或者1,0代表良性,1代表恶性。y^表示预测结果,取值0或者1,0代表良性,1代表恶性。L的值越小,说明y^越接近于y。进行迭代处理,直到L的值为目标值以下为止。
上述的实施方式的各装置的各构成要素是功能概念性的,不需要一定在物理上如图示那样来构成。即,各装置的分散·综合的具体形态不限于图示的内容,能够将其全部或一部分对应于各种负荷及使用状况等而以任意单位在功能上或物理上分散·综合地构成。进而,在各装置中进行的各处理功能的全部或任意一部分可以通过CPU及由该CPU解析执行的程序来实现,或者,可以作为基于布线逻辑的硬件而实现。
此外,上述的实施方式中说明的医用图像处理装置和医用图像处理方法能够通过由个人计算机及工作站等计算机执行预先准备的程序来实现。该程序能够经由因特网等网络被分发。此外,该程序还能够记录在硬盘、软盘(FD)、CD-ROM、MO、DVD等计算机可读取的非暂时性记录介质中而由计算机从记录介质读出从而被执行。
对本发明的几个实施方式进行了说明,但这些实施方式是作为例子而提示的,并不意欲限定发明的范围。这些实施方式能够以其他各种各样的形态实施,在不脱离发明的主旨的范围内,能够进行各种省略、替换、变更。这些实施方式及其变形包含在发明的范围及主旨中,同样也包含在权利要求所记载的发明及其等同范围中。
- 面向医用CT的计算机图像处理方法和装置
- 图像处理装置、图像形成装置、图像处理方法以及记录介质
- 图像处理装置、图像处理方法、程序和图像处理系统
- 图像处理装置、学习装置、图像处理方法、识别基准的生成方法、学习方法和程序
- 图像处理装置、图像编辑系统以及图像处理方法
- 医用图像处理系统、医用图像处理装置、医用图像诊断装置、医用图像处理方法以及医用图像处理程序
- 医用图像处理装置、可安装到医用图像处理装置中的程序和医用图像处理方法
