C型利尿钠肽及其治疗癌症的方法
文献发布时间:2023-06-19 19:28:50
相关申请的交叉引用
本申请要求2020年6月12日提交的美国专利申请号63/038,606和2020年6月15日提交的美国专利申请号63/039,225的权益,其中每一个的披露内容都通过引用以其整体并入本文。
关于序列表的声明
与本申请相关的序列表以文本格式代替纸质副本提供,并特此通过引用并入说明书中。包含序列表的文本文件的名称是74048_Sequence.txt。文本文件大小为16KB,创建于2021年6月11日。
背景技术
现有的癌症疗法
癌症是全世界死亡的主要原因,自2004年以来每年造成7至800万人死亡(约占所有死亡人数的13%)。全球死于癌症的人数预计将继续上升,到2030年估计有1200万人死亡,其中肺癌、胃癌、肝癌、结肠癌和乳腺癌死亡人数最多。2019年,美国约有180万人被诊断出患有癌症,其中肺癌、结肠癌、胰腺癌、乳腺癌或前列腺癌以及肝癌占超过50万例。
现有的癌症治疗方法不足以降低这种死亡率,因此需要创新的治疗方法。现有的癌症治疗方法,如放射疗法或化学疗法与严重副作用关联,这些副作用增加患者的痛苦。最近治疗癌症的方法是通过激活癌症或肿瘤组织内的细胞毒性T细胞和/或通过减少或消除Treg免疫细胞以促进癌症或肿瘤组织中细胞毒性T细胞的增殖来激活患者自身的免疫系统攻击肿瘤或癌症,从而破坏或消除癌症或肿瘤组织。例如,免疫检查点蛋白抑制剂可用于直接结合免疫检查点蛋白或其相应的配体,从而通过以下激活免疫系统来攻击肿瘤或癌细胞从而破坏或消除癌症或肿瘤组织:激活癌症或肿瘤组织内的细胞毒性T细胞和/或通过减少或消除Treg免疫细胞以促进癌症组织或肿瘤中细胞毒性T细胞的增殖。另一种癌症治疗方法是激活自然杀伤细胞(NK细胞)和/或细胞毒性T细胞,同时抑制Treg细胞和/或髓系衍生的抑制细胞(MDSC)。
另一种治疗癌症的方法是嵌合抗原受体T细胞(CAR T细胞)疗法。在CAR T细胞疗法中,患者的T细胞(一种类型的免疫系统细胞)在实验室中被改变,以便它们可以被编程为攻击癌细胞。例如,T细胞取自患者的血液,然后在实验室中添加与患者癌细胞上某种蛋白质结合的特定受体的基因。这种特定受体称为嵌合抗原受体(CAR)。大量的CAR T细胞在实验室中生长,并通过输注给予患者。CAR T细胞疗法正在研究用于治疗某些类型的癌症。CART细胞疗法也称为嵌合抗原受体T细胞疗法。CAR特异性来自细胞外结构域,该结构域源自识别肿瘤的单克隆抗体的抗原结合位点,而细胞内结构域重现了激活T细胞的一系列正常事件,并包含刺激和共刺激结构域,例如CD28或4-1BB(CD137),以增强CAR T细胞的存活和增殖。由于CAR T细胞自身携带共刺激信号,理论上与未修饰的T细胞相比,它们不太可能被肿瘤细胞下调。CAR T细胞的副作用包括类似于流感样症状的细胞因子释放综合征,但有时会很严重并危及生命。其他副作用包括神经系统事件,如脑病(脑部疾病、损伤、功能障碍)、意识模糊、失语(难以理解或说话)、嗜睡、激动、癫痫、失去平衡和意识改变。
据信,任何可以激活免疫系统的细胞毒性细胞/杀伤细胞(例如,细胞毒性T细胞和NK细胞)以攻击肿瘤或癌症的药物都在多种癌症中有效。然而,使用细胞毒性T细胞或自然杀伤细胞免疫刺激剂,例如直接与免疫检查点蛋白或其配体结合以促进肿瘤破坏的免疫检查点抑制剂,也可能导致严重的自身免疫性疾病和/或对健康器官的损害。尽管存在风险,但食品和药物管理局已经开发并批准了几种细胞毒性细胞免疫刺激剂用于治疗各种癌症或恶性肿瘤,因为它们具有很高的益处(例如,存活)比风险(例如,免疫相关的副作用)比率。
例如,免疫检查点蛋白PD-1抑制剂如纳武单抗和/或派姆单抗(抗PD 1抗体)已被FDA批准用于治疗鳞状细胞头颈癌、恶性黑色素瘤、梅克尔细胞癌、肝细胞癌、晚期肾细胞癌、由于微卫星高度不稳定性(MSI-H)或错配修复缺陷(dMMR)引起的癌症、宫颈癌、小细胞肺癌、非小细胞肺癌、胃癌和GEJ癌(食管胃交界处腺癌)、PMBCL(原发性纵隔B细胞淋巴瘤,一种罕见的B细胞非霍奇金淋巴瘤)、经典霍奇金淋巴瘤、以及局部晚期或转移性尿路上皮癌。对多种癌症具有效用的细胞毒性细胞免疫刺激剂的一些代表性实例包括1)派姆单抗
CNP和NPRB受体
CNP由Sudoh等人于1990年首次从猪脑中分离出并且是由22个氨基酸残基组成的肽。参见,例如,Sudoh等人,Biochem.Biophys.Res.Commun.[生物化学与生物物理研究通讯]1989;159:1427-1434。CNP具有环状结构,在结构上与相关利尿钠肽、心房利尿钠肽(ANP)和B型利尿钠肽(BNP)相似,但缺少羧基末端延伸。参见,例如,Hunt等人,J.Clin.Endocrinol.Metab.[临床内分泌与代谢杂志]1994;78:1428-1435。CNP是各种物种中高度保守的利尿钠肽。参见,例如,Imura等人,Front.Neuroendocrinol.[神经内分泌学新领域]1992;13:217-249。例如,在人中,CNP基因(NPPC)位于2号染色体,而小鼠CNP基因位于1号染色体。CNP基因由两个外显子和一个内含子构成。参见,例如,Ogawa等人,TheJournal of Clinical Investigation.[临床研究杂志]1994;93:1911-192110;和Ogawa等人,Genomics.[基因组学]1994;15(24):383-387。它作为前激素原或126个氨基酸残基的亲本-CNP肽产生,在去除羧基末端的23个氨基酸残基后转化为103个氨基酸残基的原-CNP,并由弗林蛋白酶进一步加工为含有53个氨基酸残基的CNP-53和含有22个氨基酸残基的CNP。参见,例如,Lumsden等人,Curr.Pharm.Des.[当前药物设计]2010;16:4080-4088;Wu等人,J.Biol.Chem.[生物化学杂志]2003;278:25847-25852;和Chopra等人,IndianJ.Endocrinol.Metab.[内分泌与代谢杂志]2013;17:83-90。较高分子量的CNP-53(CNP 51-103)在组织中占主导地位,而CNP-22(CNP 82-103)主要存在于血浆和脑脊液中,但两者都含有所有利尿钠肽共有的17个氨基酸残基的环结构。与ANP和BNP相比,CNP的血浆半衰期相对较短,在人中为约2至3分钟。参见,例如,Potter LR.FEBS J.[欧洲生化学会联合会杂志]2011;278:1808-1817。正常血浆CNP浓度(两种形式)在低飞摩尔/毫升范围内。参见,例如,Das B.B.和Solinger R.,Cardiovasc Hematol Agents Med Chem.2009,7,29-42.CNP主要由血管和男性生殖腺的内皮细胞产生和分泌并且作为松弛肽起作用。参见,例如,Suga等人,Endocrinology.[内分泌学]1998;139:1920-1926。
CNP肽有两种已知的膜受体,即利尿钠肽受体B(NPRB)和利尿钠肽受体C(NPRC)。NPRB接收来自CNP的信息并激活下游信号通路,而NPRC主要是一种清除受体,其主要参与CNP的清除或降解。参见,例如,Itoh H和Nakao K,Nihon Rinsho.[日本临床医学杂志]1997;55:1923-1936;Koller等人,Science.[科学]1991;252:120-123;Suga等人,Endocrinology.[内分泌学]1992;130:229-239;及Potter LR和Hunter T.J.Biol.Chem.[生物化学杂志]2001;276:6057-6060。NPRB也有其他名称,例如鸟苷酸环化酶B(GC-B)或B型利尿钠肽受体2(NPR2)。
其余的利尿钠肽受体NPRA被心房利尿钠肽(ANP)和B型利尿钠肽(BNP)激活,但不被CNP激活。当ANP和BNP激活NPRA和NPRB时,CNP选择性地激活NPRB,并且所有三种利尿钠肽都与NPRC(其缺乏鸟苷酸环化酶活性)结合并进行清除和降解。参见,例如,Koller等人,Science.[科学]1991;252:120-123;Suga等人,Endocrinology.[内分泌学]1992;130:229-239;及Potter LR和Hunter T.J.Biol.Chem.[生物化学杂志]2001;276:6057-6060。激活一种受体相比于NPRA和NPRB两受体的生理后果的差异仍不清楚。此外,因CNP半衰期短(2-13分钟)以及推注施用与血压的急剧下降有关的事实而难以简单推注施用,CNP的体内效果的测试是混杂的。参见,例如,Kimura等人,J Surg Res.[外科研究杂志]2015,194(2);631-637。实际上,在本披露之前不知道NPRB激动剂或CNP是否可以作为推注给予以治疗癌症,也不知道NPRB激动剂或CNP是否可以作为推注剂量给予以与一种或多种免疫检查点抑制剂或CAR T细胞疗法组合治疗癌症。
细胞培养研究表明,CNP不抑制小细胞肺癌细胞的生长(参见,例如,Vesely等人,Eur J Clin Invest[欧洲临床研究杂志]2005,35(1),60-69)和乳腺癌细胞的生长(参见,例如,Vesely等人,Eur J Clin Invest[欧洲临床研究杂志]2005,35(6),388-398);并且在1μM时与其他利尿钠肽(例如长效利尿钠肽(LANP)、血管扩张剂、利钾尿肽和ANP)的1μM相比一般没有抗癌作用(参见,例如,Vesely,Curr Pharm Des.[当前药物设计],2010,p 1159-1166;美国专利号7,846,900)。当浓度增加时,观察到不太显著的效果。为了在细胞培养中产生效果,需要在培养基中浓度为100倍(即,培养基中为100μM或220μg/ml)。然而,血液中200μg/ml的浓度在体内使用是不切实际的,因为当考虑到大多数体内施用的肽常见的生物利用度损失和降解时,它需要超过200mg/Kg的不切实际剂量。
此外,众所周知,CNP不应用作推注剂量来破坏或阻止癌细胞,因为已知CNP会提高细胞内环状GMP,而细胞内环状GMP的升高可保护细胞免于凋亡,因此违背了癌症治疗的目标。细胞内环状GMP不能有效地从细胞中逸出,因此大多数研究测量细胞内隔室中的环状GMP。其他研究(参见,例如,美国专利号9,759,725)描述了抑制CNP产生来治疗癌症,因此与使用鸟苷酸环化酶C激动剂如CNP来破坏癌细胞相反。
EP 3189835 B1描述了通过连续输注天然CNP(一种利尿钠肽受体GC-B激动剂)以增加细胞内环状GMP来抑制恶性肿瘤的转移。然而,EP 3189835 B1没有描述通过施用长效CNP推注来增加血浆环状GMP。如本领域技术人员所理解的,连续输注被认为是不切实际的、不太方便的,并且当用作治疗方法时不会在不导致相应血压下降情况下增加血浆环状GMP。此外,CNP的推注施用被认为是不期望的,因为CNP的半衰期非常短(2分钟),因此推注剂量在产生任何效果之前会很快降解。此外,CNP的短暂掺入可导致对患者来说危险的急性低血压并且是一种负担。事实上,未知能在不引起血压下降的情况下通过推注CNP治疗癌症。例如,对于横纹肌肉瘤荷瘤小鼠的CNP治疗,CNP必须以2.5ug/kg/min的缓慢速率输注4周(参见,例如,Zenitani等人,Cancer Med.[癌症医学],2016 5(5)p 795-805)而不是推注剂量;其中功效有限。此外,这种治疗有显著局限性,并且需要必须仔细校准以降低严重血压下降的可能性的输注泵。
之前对健康人志愿者进行的一项研究表明,CNP推注导致收缩压和舒张压短暂但显著降低,心率显著增加,血浆环状GMP仅有限和短暂增加不到90分钟。Igaki等人,Hypertens Res[高血压研究]1998;21:7-13。一般而言,所有CNP都会在小鼠、非人灵长类动物、大鼠、狗和人中产生血液动力学效果或类似的降血压活性。参见,例如,Wendt等人,JPharmacol Exp Ther[药理学和实验治疗学杂志]353:132-149,2015年4月。目前正在开发中性内肽酶(NEP)抗性增加的CNP变体(BMN-111;序列PGQEHPNARK YKGANKKGLS KGCFGLKLDRIGSMSGLGC(SEQ ID NO.1))。BMN-111在动物和人体中的研究表明,随着剂量增加到所期望的治疗水平,动脉血压(BP)下降,心率(HR)增加。除了研究CNP的各种变体之外,还通过将CNP部分与PEG或蛋白质化合物缀合获得了不同的CNP缀合物。这些聚乙二醇化和嵌合的CNP表现出与非聚乙二醇化CNP变体所观察到的相似的血液动力学反应。先前研究的所有变体都显示出相似的降BP活性。参见,例如,Wendt,J.,Pharmacol Exp Ther[药理学与实验治疗学杂志]353:132-149,2015年4月。因此,不希望受理论的束缚,据信增加具有CNP活性的药物的推注剂量以增加药物暴露可能与不可接受的心血管副作用如低血压有关。
需要有效、安全和方便(例如,推注施用)的癌症治疗方法,其不会引起心血管副作用,例如低血压,同时维持或提高血液环状GMP水平。本披露试图满足这些需要并提供进一步的相关优势。
发明内容
提供该发明内容以简化形式介绍概念的选择,这些概念将在下面的具体实施方式中进一步描述。该发明内容并非旨在识别所要求保护的主题的关键特征,也不旨在用来帮助确定所要求保护的主题的范围。
在一方面,本披露的特征在于一种治疗在任何组织或器官中具有异常血管的受试者的方法,该方法包括向该受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂、超长效NPRB激动剂或其任何组合,其中施用该治疗有效推注剂量的该组合物提供血管正常化或外膜细胞包被指数增加至少10%(例如,至少15%,或至少20%),其中该组合物不会使血压降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%),其中基线血压测量值是施用组合物之前的平均血压,并且其中该组合物在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),并且基线血浆环状GMP水平是施用组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为受试者在施用组合物之前的平均血浆环状GMP水平)。受试者还可以具有低数量的细胞毒性T细胞、低数量的激活的NK细胞、或低数量的细胞毒性T细胞和低数量的激活的NK细胞两者。
在另一方面,本披露的特征在于增加细胞毒性T细胞和/或激活的NK细胞的方法,该方法包括向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂、超长效NPRB激动剂或其任何组合,
其中施用治疗有效推注剂量的组合物使细胞毒性T细胞和/或NK细胞的数量比施用组合物之前的水平或比健康受试者中的水平增加至少15%(例如,至少20%,或至少30%),其中施用治疗有效推注剂量的组合物不会使血压降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%),其中基线血压测量值是施用组合物之前的平均血压,并且其中该组合物在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),并且基线血浆环状GMP水平是施用组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为受试者在施用组合物之前的平均血浆环状GMP水平)。
在又一方面,本披露的特征在于一种治疗受试者的方法,该受试者在任何组织或器官中具有异常血管,并且该受试者具有病症(i)至(viii):(i)低数量的细胞毒性T细胞,(ii)低数量的激活的NK细胞,(iii)高数量的Treg细胞,(iv)TGFβ高水平表达,(v)Foxp3高水平或表达,(vi)高数量的髓系衍生的抑制细胞或MDSC,(vii)Bv8高水平或表达;或(viii)其任何组合;或受试者需要(ix)至(xvi):(ix)细胞毒性T细胞数量增加;(x)激活的NK细胞增加;(xi)Treg细胞数量减少;(xii)TGF-β表达降低;(xiii)Foxp3表达降低;(xiv)髓系衍生的抑制细胞(MDSC)数量减少;(xv)Bv8表达的减少,或(xvi)其任何组合;该方法包括向受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂、超长效NPRB激动剂或其任何组合,
其中施用该治疗有效推注剂量的该组合物提供血管正常化或外膜细胞包被指数增加至少10%(例如,至少15%或至少20%)、肿瘤存在时尺寸的减小、细胞毒性T细胞数量增加、激活的NK细胞数量增加、Treg细胞数量减少、TGFβ水平或表达降低、Foxp3水平或表达降低、髓系衍生的抑制细胞(MDSC)数量减少、Bv8水平或表达降低、存活/寿命改善,或其组合;其中该组合物不会使血压降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%),其中基线血压测量值是施用组合物之前的平均血压;并且其中该组合物在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),并且基线血浆环状GMP水平是施用组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为受试者在施用组合物之前的平均血浆环状GMP水平)。在一些实施例中,受试者还可以具有低数量的细胞毒性T细胞、低数量的激活的NK细胞、或低数量的细胞毒性T细胞和低数量的激活的NK细胞两者。
在另一方面,本披露的特征在于一种治疗患有一种或多种病症的受试者的方法,该病症选自肿瘤、肿瘤组织中的异常血管、低数量的细胞毒性T细胞,低数量的激活的NK细胞,高数量的Treg细胞,TGFβ高水平表达,Foxp3高水平或表达,高数量的髓系衍生的抑制细胞或MDSC和Bv8高水平或表达;或者受试者需要细胞毒性T细胞数量增加;激活的NK细胞增加;Treg细胞数量减少;TGF-β表达降低;Foxp3表达降低;髓系衍生的抑制细胞(MDSC)数量减少;Bv8表达的减少,或其任何组合;该方法包括向受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂、超长效NPRB激动剂或其任何组合;其中施用该治疗有效推注剂量的该组合物提供血管正常化或外膜细胞包被指数增加至少10%(例如,至少15%或至少20%)(例如,在肿瘤组织内)、肿瘤尺寸的减小、细胞毒性T细胞数量增加、激活的NK细胞数量增加、Treg细胞数量减少、TGFβ水平或表达降低、Foxp3水平或表达降低、髓系衍生的抑制细胞(MDSC)数量减少、Bv8水平或表达降低、存活/寿命改善,或其组合;并且其中该组合物不会使血压降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%),其中基线血压测量值是施用组合物之前的平均血压;并且其中该组合物在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),并且基线血浆环状GMP水平是施用组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为受试者在施用组合物之前的平均血浆环状GMP水平)。
在另一方面,本披露的特征在于一种治疗癌症或治疗异常血管的方法,该方法包括向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP衍生物或超长效CNP衍生物,该长效CNP衍生物或超长效CNP衍生物包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.11],或其任何组合;其中每个单独的大写字母,U除外,是由单字母氨基酸命名法表示的氨基酸残基,并且其中U是式(I)或(II)的部分,其中式(I)是
(脂肪族)
(I)
其中a是0或1(优选a是1);脂肪族是任选地经取代的C
式(II)是
(聚合物)
(II)
其中a是0或1(优选a是1);聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)、聚(N-乙烯基吡咯烷酮)或其衍生物;Y是:1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;含有氨基酸残基的接头,其中氨基酸残基共价连接至(聚合物)
其中该组合物不会使血压降低超过基线血压测量值的15%,其中基线血压测量值是施用组合物之前的平均血压;并且其中该组合物在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),并且基线血浆环状GMP水平是施用组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为受试者在施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,Y是接头(γE)
在一方面,本披露提供了包含长效CNP衍生物的组合物,该长效CNP衍生物包含下式的肽U-CFGLKLDRIGSxSGLGC[SEQ ID NO.30],其中x是天然或非天然氨基酸残基,条件是x不是甲硫氨酸残基;并且U具有式(I)的部分:
(脂肪族)
(I)
其中a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是接头(γE)
在另一方面,本披露的特征在于使用上述方法治疗受试者的方法,有或没有用一种或多种免疫刺激剂(包括一种或多种免疫检查点抑制剂和/或CAR T细胞疗法)的另外治疗。
附图说明
本披露的前述方面和许多附带优点将变得更容易理解,因为当结合附图参考以下详细描述时它们变得更好理解,其中:
图1A是在皮下施用2.0mg/Kg天然CNP、CNP衍生物(dCNP)和超长效CNP衍生物(VLA-dCNP)后的CD-1小鼠中血浆CNP[平均(SD);n=5]的图。插图是左下角的放大比例,以显示当施用天然CNP时CNP(菱形)的低血浆水平。误差棒表示n=5个血浆样品的标准偏差。施用前的基线CNP水平为1.74(0.6)ng/mL[平均(SD);n=15]。图1A显示了在小鼠中推注施用后dCNP和VLA-dCNP在血浆中的持续存在。
图1B是在皮下施用1.0mg/Kg天然CNP、CNP衍生物(dCNP)和超长效CNP衍生物(VLA-dCNP)后,使用来自CisBio[Codolet,法国]的cGMP试剂盒测量的雄性C57BL/6J小鼠中血浆cGMP的图。基线血浆cGMP水平为20(3.7)pmol/mL或7(1.3)ng/mL[平均值(SEM);n=8]。在2小时及以后,与基线相比,天然CNP的皮下施用没有显著升高血浆cGMP,而长效CNP(dCNP和VLA-dCNP)的类似施用显示cGMP显著升高至少24小时。图1B显示了与天然CNP相比,在小鼠中推注施用dCNP和VLA-dCNP后环状GMP的持续存在。
图2A的图显示本披露的超长效CNP衍生物(VLA-dCNP)增加血浆cGMP达3天而没有相关联的血压下降。该图显示了推注施用25ug/Kg超长效CNP衍生物(VLA-dCNP)、超长效BNP衍生物(VLA-dBNP)或超长效BNP衍生物(VLA-dANP)后监测的狗中[平均值(SEM);n=12]血浆cGMP的相应增加[平均值(SEM);n=12]。基线血浆cGMP水平为8(2)ng/mL[平均(SD);n=12],这是与健康人相似的水平(参见,例如,Igaki等人,Hypertens Res[高血压研究]1998;21:7-13,通过引用以其整体并入本文。利尿钠肽的所有超长效配制品都将cGMP增加超过8ng/ml的基线。cGMP AUC是VLA-dANP 3,483ng*h/mL、VLA-dBNP 2,585ng*h/mL、VLA-dCNP2,627ng*h/mL。超长效CNP衍生物(VLA-dCNP)增加血浆环状GMP达3天而没有相关联的血压下降。图2A显示与来自同一家族的另外两种超长效利尿钠肽相比,在推注施用VLA-dCNP之后环状GMP的持续存在。
图2B的图显示了推注施用25ug/Kg超长效CNP衍生物(VLA-dCNP)、超长效BNP衍生物(VLA-dBNP)或超长效BNP衍生物(VLA-dANP)后监测的狗中平均动脉压[平均值(SEM);n=12]。在以非常高的剂量施用后,VLA-dCNP不会导致血压从基线(0小时)显著下降。相比之下,其他超长效利尿钠肽如VLA-dBNP和VLA-dANP衍生物导致血压下降超过15%。对于VLA-dANP尤其如此,对于类似的cGMP增加,血压下降可高达50%。与之形成鲜明对比的是,超长效CNP衍生物(VLA-dCNP)增加血浆环状GMP达3天而没有相关联的血压下降。图2B显示在狗中推注施用高剂量VLA-dCNP后血压没有下降,而来自同一家族的另外两种超长效利尿钠肽显示出相似的血浆环状GMP升高,但血压显著下降(图2A)。这表明血浆环状GMP不是血压下降的原因。
图3A和3B的图和相关显微照片显示VLA-dCNP增加了乳腺肿瘤中的分化簇8阳性(CD8+)T细胞,表明VLA-dCNP促进了肿瘤杀伤细胞的进入、激活和/或针对肿瘤的免疫检查点抑制的阻遏。
图3A是图3B的显微照片中每个视野的CD8+T细胞数量的图。
图3B是一系列显微照片。图3A中计算了每个视野的CD8阳性细胞数;误差棒是SEM。通过以下进行统计分析:学生t检验,使用GraphPad Prism 6.0(n=4)。*P<0.05。
图4A-4C的一系列图显示VLA-dCNP增加了乳腺肿瘤中的激活的T细胞,表明VLA-dCNP促进了肿瘤杀伤细胞的进入、激活和/或针对肿瘤的免疫检查点抑制的阻遏。
图4A是显示对照小鼠组和用VLA-dCNP处理的组中CD8细胞量的柱形图。
图4B是显示对照小鼠组和用VLA-dCNP处理的组中激活的CD8细胞的量的柱形图。
图4C是显示对照小鼠组和用VLA-dCNP处理的组中激活的NK细胞的量的柱形图。
图5A的柱状图显示VLA-dCNP根除乳腺癌/肿瘤中的调节性T细胞,允许免疫系统抑制肿瘤生长。
图5B的柱形图显示VLA-dCNP减少乳腺癌细胞/肿瘤中的Tim3。
图6的图显示VLA-dCNP对具有或不具有分化簇8(CD8)耗竭的骨肿瘤体积生长的影响。
图7是显示VLA-dCNP抑制小鼠皮下植入模型中骨癌生长尺寸的图。
图8A的柱形图显示VLA-dCNP对小鼠原位植入(股骨)模型中具有或不具有分化簇8(CD8)耗竭的骨肿瘤体积生长的影响。
图8B-8D的一系列柱形图显示VLA-dCNP对骨癌皮下植入小鼠模型中免疫激活的影响。
图8B的柱形图显示在对照小鼠组中与用VLA-dCNP处理的组相比的TGF-β1表达。
图8C的柱形图显示在对照小鼠组中与用VLA-dCNP处理的组相比的Foxp3表达。
图8D的柱形图显示在对照小鼠组中与用VLA-dCNP处理的组相比的Bv8表达。
图9A和9B的一系列显微照片和柱形图显示VLA-dCNP使肿瘤血管结构正常化。
图9A显示了用对照配制品处理的样品和用BLA-dCNP处理的样品的红色CD31和绿色α-SMA的荧光显微镜图像。
图9B的柱形图显示外膜细胞包被的%指数。
图10A和10B的一系列显微照片和相关柱形图显示VLA-dCNP使肿瘤血管结构正常化。
图10A显示了用对照配制品处理的样品和用VLA-dCNP处理的样品的红色CD31和绿色凝集素的荧光显微镜图像。
图10B的柱形图显示每个视野的CD31计数和凝集素结构;误差棒是SEM。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.05相比于对照组(n=3)。
图11A-11B的一系列显微照片和相关柱状图显示VLA-dCNP减少了肿瘤组织中的缺氧状况。
图11A显示了红色哌莫硝唑的荧光显微镜图像。
图11B的柱形图显示红色哌莫硝唑的相对强度百分比;误差棒是SEM。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.05相比于对照组(n=4)。
图12的表显示用指定药剂处理不同天数的肿瘤尺寸;VLA-dCNP和抗小鼠细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体组合疗法抑制了小鼠皮下植入模型中结肠癌的生长。
图13A和13B的图和相关表显示VLA-dCNP和抗(细胞毒性T淋巴细胞相关蛋白4)CTLA-4抗体组合疗法抑制了小鼠皮下植入模型中结肠癌的生长。
图13A的图显示作为用指定药剂治疗天数的函数的肿瘤尺寸。
图13B的表显示用指定药剂处理选定天数的肿瘤尺寸。
图14的表显示用指定药剂处理选定天数的肿瘤尺寸;VLA-dCNP和抗小鼠程序性细胞死亡蛋白1(PD-1)抗体组合疗法抑制了小鼠皮下植入模型中结肠癌的生长。
图15的表显示用指定药剂处理选定天数的肿瘤尺寸;VLA-dCNP和抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体组合疗法在小鼠原位移植模型中抑制了皮肤癌的生长。
图16的表显示用指定药剂处理选定天数的肿瘤尺寸;VLA-dCNP或dCNP和抗小鼠程序性细胞死亡蛋白1(PD-1)抗体组合疗法在小鼠原位移植模型中抑制了小鼠乳腺癌。
图17的表显示用指定药剂处理选定天数的肿瘤尺寸;VLA-dCNP和抗小鼠PD-1(程序性细胞死亡蛋白1)抗体组合疗法在小鼠原位移植模型中抑制了乳腺癌的生长(体积),显示出剂量反应方式。
图18A和18B的图和相关表显示VLA-dCNP和抗程序性死亡配体(PD-L1)抗体组合疗法抑制了小鼠原位移植模型中乳腺癌的生长(体积)。
图18A的图显示作为用指定药剂治疗天数的函数的肿瘤尺寸。
图18B的表显示用指定药剂治疗选定天数的肿瘤尺寸。
图19A和19B的图和相关表显示VLA-dCNP和抗PD-1抗体组合疗法抑制了小鼠原位移植模型中乳腺癌的生长(体积)。
图19A的图显示作为用指定药剂治疗天数的函数的肿瘤尺寸。
图19B的表显示用指定药剂处理选定天数的肿瘤尺寸。
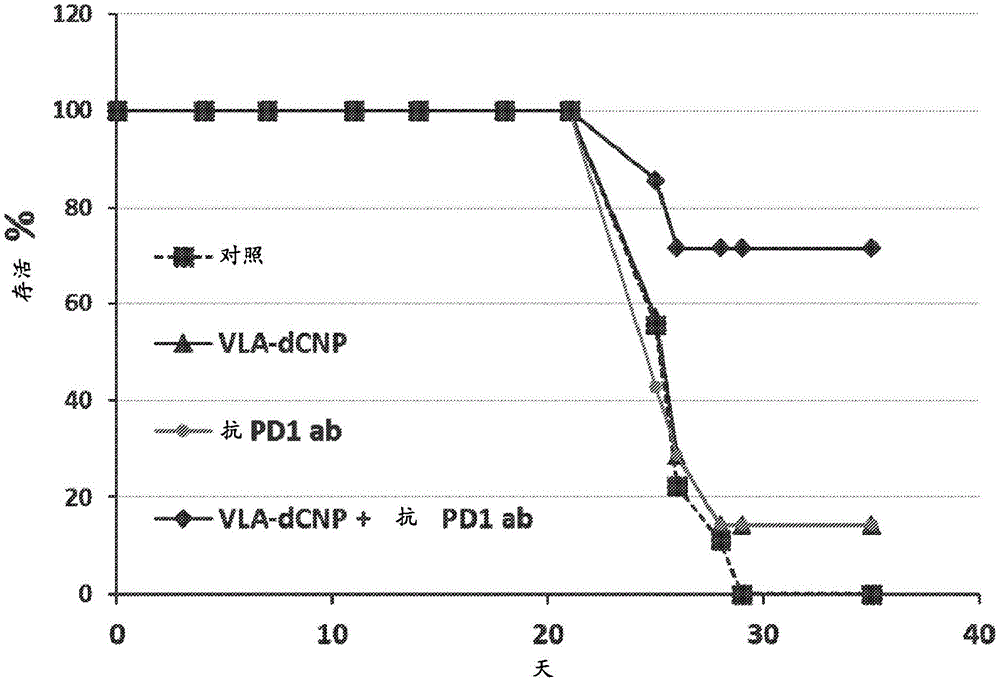
图20的图显示VLA-dCNP和抗PD-1抗体组合疗法抑制乳腺癌生长并改善小鼠存活。
图21的Kaplan-Meier曲线显示VLA-dCNP处理改善了胫骨骨肉瘤小鼠的存活。
图22的图显示dCNP以剂量依赖性方式增加暴露于培养的LM8小鼠骨肉瘤癌细胞系的脾细胞中干扰素γ(IFNg)产生。
图23A的柱形图显示从第6天开始用各种测试组合物处理14天后第20天的肿瘤尺寸。误差棒是SEM,单个点代表组中的单个动物。
图23B的表显示了治疗期间的肿瘤生长以及第20天的肿瘤根除。
图24A的柱形图显示dCNP的前列腺肿瘤消除作用,即使在很晚的阶段开始施用时(肿瘤尺寸为约70mm
图24B的表显示了治疗期间的前列腺癌生长以及第30天的肿瘤根除。
图25A的柱形图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如血液中T细胞(CD4)增加所见。
图25B的柱形图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如血液中细胞毒性(CD8)T细胞的增加所见。
图25C的柱形图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如血液中自然杀伤(NK)细胞的增加所见。
图25D的图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如脾中CD8基因表达的增加所见。
图25E的图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如脾中CD4基因表达的增加所见。
图25F的图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如脾中ICOS基因表达的增加所见。ICOS是诱导型T细胞共刺激因子并且是免疫检查点蛋白并且其表达表明免疫激活。
图25G的图显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如脾中CD86基因表达的增加所见。CD86与CD80一起提供T细胞激活和存活所必需的共刺激信号,并且其表达证实了免疫激活。
图26A显示了各种免疫细胞、它们针对免疫激活的机制性相互作用、以及干扰素γ(IFNg)细胞因子(其触发CD8和NK细胞抗肿瘤活性或攻击以消除癌细胞)的产生的图表。灰色箭头表示细胞数量增加(向上)或减少(向下),黑色箭头表示在IFNg存在的情况下发育的细胞。调节性T细胞(Treg)是特化的T细胞亚群,其可抑制T辅助细胞1(Th1)细胞免疫反应(由水平T表示),从而维持体内平衡和自我耐受。Treg抑制T细胞增殖和细胞因子产生,以通过抑制Th1发育成CD8+细胞毒性T细胞(CTL)来抑制免疫系统,并在正常情况下防止自身免疫。此外,Th1细胞为免疫系统的其他细胞(尤其是抗原呈递细胞(APC),如巨噬细胞、树突细胞和B细胞)提供辅助功能,并且对它们的激活和成熟很重要。
图26B的柱形图显示E0771小鼠乳腺癌模型中Treg细胞的抑制。
图26C的柱形图显示激活的Th1细胞增加,其中单独的VLA-dCNP比单独的抗-PD1显著更有效。
图26D的柱形图显示在E0771小鼠乳腺癌模型中Th1/Treg细胞比率,其中单独的VLA-dCNP比单独的抗PD1显著更有效。出人意料的是,当dCNP和抗PD1抗体组合使用时,观察到协同效应,该效应远大于单独施用dCNP和单独施用抗PD1的效应之和。
图27的柱形图显示在小鼠乳腺癌模型中当dCNP与佐剂CpG ODN-TLR9激动剂组合时显著的肿瘤抑制。
图28A-28D的柱状图显示dCNP、抗PD1抗体和两者的组合是有效的免疫激活剂,其在小鼠乳腺癌模型中可减少肿瘤体积和Treg细胞并增加CD69+细胞。
图28A的柱形图显示dCNP、抗PD1抗体和两者的组合是可以减少Treg的有效免疫激活剂。
图28B的柱形图显示dCNP、抗PD1抗体和两者的组合是可以增加B细胞中CD69+群体的有效免疫激活剂。
图28C的柱形图显示dCNP、抗PD1抗体和两者的组合是有效的免疫激活剂,其可以增加总细胞中的CD69+群体。
图28D的柱形图显示dCNP、抗PD1抗体和两者的组合是免疫激活剂,其可以降低肿瘤重量,Treg(左上)的抑制同时CD69+(右上和左下)细胞群的增加与导致肿瘤体积抑制的免疫激活(右下)一致。
图29A的柱形图显示dCNP而非多西他赛(DTX)或缓冲液对照抑制小鼠癌症模型的前列腺肿瘤内的α-平滑肌肌动蛋白基因表达。α-SMA是组织纤维化的标志物。TGFβ是众所周知的纤维化介质并且在纤维化疾病中上调和激活(参见,例如,Growth Factors[生长因子],2011 29(5),196-202)。
图29B的柱形图显示dCNP而非多西他赛(DTX)或缓冲液对照抑制小鼠癌症模型的前列腺肿瘤内的TGFβ基因表达。
图29C的柱形图显示dCNP而非多西他赛或缓冲液对照抑制小鼠癌症模型的前列腺肿瘤内的Ang 2基因表达。Ang 2通过拮抗Ang1/Tie2轴抑制肿瘤血管稳定。Ang 2表达的抑制使血管稳定、增强进入肿瘤的途径并改善药物递送(参见,例如,Cancer Cell[癌细胞],2016第30卷,953-967)。dCNP稳定(下图)肿瘤血管并为免疫系统创造更好的抗肿瘤肿瘤微环境。
图30是在皮下施用2.0mg/Kg CNP衍生物s1(dCNP-s1)和CNP衍生物s2(dCNP-s2)后CD-1小鼠中血浆CNP[平均值(SEM);n=5]的图。插图显示当施用天然CNP时CNP(菱形)的低血浆水平。误差棒表示n=5个血浆样品的平均值的标准误差。施用前的基线CNP水平为0.391(0.02)ng/mL[平均值(SEM);n=10]。当以相似的剂量重量/Kg剂量给予时,长效dCNP-s1和dCNP-s2以持续方式(至少8小时)提供比天然CNP高10倍的CNP血液水平。
具体实施方式
本披露涉及使用NPRB结合免疫激活剂通过以下来治疗在任何组织或器官中具有异常血管的受试者的方法:向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂、或其任何组合。在一些实施例中,受试者进一步具有低数量的细胞毒性T细胞、低数量的激活的NK细胞、或低数量的细胞毒性T细胞和低数量的激活的NK细胞两者。在一些实施例中,本披露涉及增加细胞毒性T细胞和/或激活的NK细胞的方法,该方法是通过向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。在一些实施例中,受试者具有病症(i)至(viii):(i)低数量的细胞毒性T细胞,(ii)低数量的激活的NK细胞,(iii)高数量的Treg细胞,(iv)TGFβ高水平表达,(v)Foxp3高水平或表达,(vi)高数量的髓系衍生的抑制细胞或MDSC,(vii)Bv8高水平或表达;或(viii)其任何组合;或受试者需要(ix)至(xvi):(ix)细胞毒性T细胞数量增加;(x)激活的NK细胞增加;(xi)Treg细胞数量减少;(xii)TGF-β表达降低;(xiii)Foxp3表达降低;(xiv)髓系衍生的抑制细胞(MDSC)数量减少;(xv)Bv8表达降低,或(xvi)其任何组合。在一些实施例中,受试者患有癌症。NPRB结合型免疫激活剂可以使血管化正常化或使外膜细胞包被指数增加至少10%(例如,增加至少15%,或增加至少20%)。在一些实施例中,NPRB结合免疫激活剂可以使血管化正常化(例如,在癌组织内),减小肿瘤尺寸,减少肿瘤组织内的缺氧,增加癌组织内细胞毒性T细胞的数量,增加癌组织内激活的NK细胞的数量,减少Treg细胞,减少髓系衍生的抑制细胞,降低TGFβ表达,降低Foxp3表达,降低Bv8表达,抑制癌组织内的免疫检查点活性,和/或改善存活,这是通过向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂、或其任何组合。
在一些实施例中,当施用给有需要的受试者时,治疗有效推注剂量的组合物使细胞毒性T细胞和/或NK细胞的数量比施用组合物之前的水平或比健康受试者中的水平增加至少15%(例如,至少20%,或至少30%)。当施用给受试者时,组合物不会使血压降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%),其中基线血压测量值是施用组合物之前的平均血压,并且组合物在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平是施用组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为受试者在施用组合物之前的平均血浆环状GMP水平)。组合物可以包括另外的一种或多种治疗剂,其也抑制免疫检查点蛋白活性。在一些实施例中,本披露的组合物可以在放射治疗、化学治疗、手术治疗、CAR-T细胞治疗和/或抗体治疗之前、同时和/或之后施用。
在一方面,本披露的特征在于一种治疗癌症的方法,其包括增加血浆中的环状GMP水平,以及减少或消除癌症。本领域没有表明化合物的推注施用可以持续激活利尿钠肽受体B(NPRB或NPR2)并可以激活免疫系统来攻击肿瘤或癌症,增加肿瘤组织内细胞毒性T细胞和/或激活的NK细胞的数量,减少免疫抑制细胞(Treg细胞)的数量,减少免疫抑制细胞因子(转化生长因子β或TGFβ),降低Foxp3(Treg标志物)表达,降低Bv8(髓系衍生的抑制细胞的标志物或MDSC标志物)表达,和/或导致在肿瘤组织中血管正常化或外膜细胞包被指数增加至少10%(例如,至少15%,或至少20%),这允许抗癌药物进入肿瘤组织并减少缺氧(缺氧促进肿瘤生长/恶性肿瘤和免疫抵抗)。
此外,本领域没有任何内容表明长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂的推注施用不会引起显著的降低血压,同时提供可用于治疗癌症的持续血浆环状GMP升高。本披露披露了一种癌症治疗方法,该方法包括施用推注剂量的长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂,不会引起显著血压下降,同时提供持续的血浆环状GMP升高。此外,通过推注长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂持续激活NPRB可激活免疫系统以攻击肿瘤组织和/或引起细胞毒性T细胞浸润肿瘤区域。
本领域没有任何建议本领域技术人员使用免疫检查点抑制剂或CAR T细胞疗法与长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂的组合来治疗癌症,以改善其他免疫检查点抑制剂或CAR T细胞疗法治疗癌症或恶性肿瘤的功效。在一些实施例中,本披露的特征在于使用长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂与其他一种或多种一般性免疫检查点抑制剂和/或一般性CAR T细胞疗法组合。例如,免疫检查点抑制剂可以来自CTLA-4、PD-1或PD-L1的阻断剂,例如但不限于伊匹单抗(ipilimumab)、曲美利木单抗(tremelimumab)、来利珠单抗(labrolizumab)、纳武单抗(nivolumab)、匹地利珠单抗(pidilizumab)、AMP-244、MEDI 4736、和/或MPDL3280A。
本披露的特征在于使用内源性肽的长效衍生物或长效NPRB激动剂。在使用中,内源性肽的长效衍生物或长效NPRB激动剂是安全的并且作为免疫系统的抗肿瘤功能和/或血管正常化的增强剂。本披露的方法提供了通过激活总体免疫系统来治疗癌症,而不将其限定于特定癌症。
与具有严重副作用且功效有限的放射疗法或化学疗法不同,本披露的长效NPRB激活剂没有可测量或可观察到的会加重癌症患者或恶性肿瘤患者痛苦的不良副作用。本披露证明推注施用长效CNP或长效NPRB激动剂在治疗各种癌症或恶性肿瘤中是有效的,并且当与其他免疫检查点抑制剂组合使用时,与没有推注施用长效CNP或长效NPRB激动剂的相同治疗相比,治疗的整体功效改善,无另外的副作用。据信,当免疫检查点抑制剂与本披露的推注施用的长效CNP或长效NPRB激动剂组合使用时,可以观察到协同作用,使得免疫检查点抑制剂与长效CNP或长效NPRB激动剂的组合治疗效果大于仅用免疫检查点抑制剂或仅用长效CNP或长效NPRB激动剂治疗的累加治疗效果(参见,例如,图13、14、16、17、18、19、20、26B-26D、和28A-28D)。在一些实施例中,免疫检查点抑制剂的剂量在与长效CNP或长效NPRB激动剂的推注施用联合使用时可以减少。此外,本披露证明推注施用长效CNP或长效NPRB激动剂可以改善CAR T细胞疗法在治疗各种癌症或恶性肿瘤中的总体功效,而在总体治疗中没有另外的副作用,这些中没有一个已经被现有技术所证明。
据信,当与推注剂量的长效CNP、长效CNP衍生物、超长效CNP、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂联合施用时,关于改善免疫检查点抑制剂(例如阻断CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD-1(程序性细胞死亡蛋白1)或PD-L1(程序性死亡配体1)的药物或抗体)的功效,目前还一无所知。本披露呈现以下出人意料的发现:1)可以对CNP进行修饰、衍生或配制,使得所得配制品在作为推注剂量施用时能以持续方式增加血浆环状GMP,该方式在治疗有效剂量或更高剂量下不会导致血压下降;2)NPRB激动剂(即长效CNP、长效CNP衍生物、超长效CNP、超长效CNP衍生物、长效NPRB激动剂或超长效NPRB激动剂)的推注施用能以持续方式增加血浆环状GMP至少6小时;3)如上定义的NPRB激动剂的推注施用可以使癌组织血管正常化,这可以减少缺氧炎症和免疫抵抗(缺氧促进肿瘤恶性和免疫抵抗);4)如上定义的NPRB激动剂的推注施用可以增加癌组织内可帮助消除癌症的杀癌细胞毒性T细胞的数量,5)如上定义的NPRB激动剂的推注施用可以减少免疫抑制因子细胞的数量(Treg细胞和髓系衍生的抑制细胞),这些细胞阻碍免疫系统消除癌症,6)如上定义的NPRB激动剂推注施用抑制TGFβ、Foxp3和Bv8(髓系衍生的抑制细胞或MDSC的标志物)的表达,这表明针对癌症的免疫抑制减少,以及7)与其他免疫检查点抑制剂组合推注施用如上定义的NPRB激动剂可以显著改善免疫检查点抑制的功效和抗癌功效。
定义
如本文所用,术语“癌症”是指恶性组织块。恶性肿瘤细胞可以通过血液和淋巴系统“转移”(即,扩散)到身体的其他部位。
如本文所用,术语“上皮癌”是指开始于皮肤或内衬或覆盖内部器官的组织的癌症。
如本文所用,术语“肉瘤”是指开始于骨骼、软骨、脂肪、肌肉、血管或其他结缔组织或支持组织的癌症。
如本文所用,术语“淋巴瘤”是指开始于免疫系统细胞的癌症。
如本文所用,术语“中枢神经系统或(CNS)癌症”是指开始于中枢神经系统组织的恶性肿瘤。
如本文所用,术语“血管正常化”是指在任何组织或器官中恢复到结构和功能正常的血管,与异常血管相比具有更有序的模式,而异常血管又以随机血管为特征,其中大量小动脉绕过毛细血管床直接与小静脉吻合,导致局部缺氧。在多种疾病(如癌症)中,新血管形成不受控制,导致微血管网络特征为血管不成熟,具有强烈的结构和功能异常,其改变微环境以促进或疾病进展,如癌症,并减弱对常规疗法的反应。血管正常化(例如,在肿瘤血管中)可以通过组织学染色检测。例如,外膜细胞和α-平滑肌肌动蛋白(α-SMA)和血管内皮的CD31的染色共定位可用于获得外膜细胞包被指数(参见,例如,实例和图9)。在一些实施例中,正常化定义为与治疗前的外膜细胞包被指数相比,外膜细胞包被指数增加至少20%;或定义为通过与治疗前取得或观察到的相比,通过每个显微镜视野的CD31阳性和凝集素阳性结构增加至少20%间接测量的肿瘤灌注。在一些实施例中,正常化定义为与治疗前的外膜细胞包被指数相比,外膜细胞包被指数增加至少10%(例如,至少15%,或至少20%)。灌注较高的血管具有较高的CD31和凝集素共染色。在一些实施例中,正常化定义为与治疗前取得或观察到的相比,微血管密度(MVD)增加至少20%。MVD可以通过几种方法测量。参见Goddard等人,Angiogenesis[血管再生]2002;5(1-2):15-20,通过引用以其整体并入本文。在一些实施例中,可以通过血管形态学和渗透性(通过使用诸如钆化合物的造影剂的MRI成像、超声、PET和CT扫描)来测量正常化。参见,Li等人,Cancer Management and Research[癌症管理与研究]2018:10 4163-4172,通过引用以其整体并入本文。在一些实施例中,血浆sVEGFR1的瞬时降低被用作预测肿瘤血管正常化的候选生物标志物。在某些实施例中,血浆血管生成素-1/血管生成素-1比率与血管正常化程度相关。在血管正常化过程中,肿瘤组织和血浆中的爱帕琳肽(Apelin)表达可以暂时降低。在用本披露的组合物治疗后,血管正常化可表现为以上参数中的一个或多个的增加或减少(视情况而定)。
如本文所用,术语“异常血管”是指任何组织或器官中的血管,其特征在于随机血管模式,其中许多小动脉直接与小静脉吻合,绕过毛细血管床导致局部缺氧。这是不受控制的新血管形成的结果,导致微血管网络特征为血管不成熟,具有强烈的结构和功能异常,其改变微环境以促进疾病进展,如癌症,并减弱对常规疗法的反应。
如本文所用,术语“细胞毒性T细胞”是指具有直接细胞毒性作用的T淋巴细胞(白细胞的一种类型)。细胞毒性T细胞杀伤癌症细胞、被感染的细胞(特别是病毒感染的细胞)或以其他方式受损的细胞。细胞毒性T细胞也称为T
如本文所用,术语“TIM-3”是指“糖蛋白T细胞Ig和含有粘蛋白结构域的蛋白3”,它在可以干扰T细胞(包括CAR T细胞)反应的肿瘤和病毒感染的细胞中上调。这种上调会逐渐削弱细胞毒性T细胞对癌症和慢性病毒感染(如HIV感染)的反应,导致T细胞耗竭。减少TIM-3有助于恢复CD8(+)T细胞的细胞毒性功能。参见,例如,J Immunol.[免疫学杂志]2014年1月15日;192(2):782-91。
如本文所用,术语“自然杀伤细胞”或“NK细胞”是指对先天免疫系统至关重要的一类细胞毒性淋巴细胞,类似于细胞毒性T细胞,但与细胞毒性T细胞不同,它不需要MHC和抗体。因此,NK细胞可以快速(约3天)对应激细胞、肿瘤形成和/或病毒感染细胞做出反应。此外,术语“低数量的激活的NK细胞”在癌症的背景下是指不到1.2%百分比的总NK1.1(或人的CD16或CD57)也对穿孔素呈阳性,尤其是在肿瘤组织中。参见,例如,图3、4和5及其相应的实例,如下。术语“增加激活的NK细胞的数量”是指与同一个癌症患者的治疗之前的数量相比,对穿孔素也呈阳性的总NK1.1(或人的CD16或CD57)的百分比至少增加20%。
如本文所用,术语“Treg细胞”或“Treg”是指维持对自身抗原的耐受性并降低自身免疫性疾病的可能性的调节性T细胞或免疫抑制性T细胞。Treg具有免疫抑制作用,通常抑制或下调效应T细胞(如细胞毒性T细胞)的诱导和增殖。Treg表达生物标志物CD4、FOXP3和CD25。最近的研究发现,细胞因子TGFβ对于Treg从天然CD4+细胞分化是必不可少的,并且对于维持Treg稳态很重要。术语“高数量的Treg细胞”是指大于2%的总CD4阳性细胞同时对CD25和Fox3呈阳性,尤其是在肿瘤组织中。术语“减少Treg细胞的数量”是指与同一个癌症患者的治疗之前的水平相比,同时对CD25和Fox3呈阳性的总CD4阳性细胞的百分比减少至少20%。
如本文所用,术语“TGFb”、“TGFβ”或“转化生长因子β”是指属于转化生长因子超家族的多功能细胞因子,其包括三种不同的哺乳动物亚型(TGFβ1至3,HGNC符号TGFB1、TGFB2、TGFB3)和多种其他信号传导蛋白。TGFβ由所有白细胞谱系表达。TGFβ表达的增加与许多癌症的恶性程度相关。此外,术语“高水平的TGFβ表达”指的是相对于正常组织中观察到的水平的至少1.2倍表达。高水平的TGFβ表达表明高水平的Treg细胞。术语“降低TGFβ表达”是指相对于同一癌症患者治疗之前的表达降低至少20%表达。
如本文所用,术语“Foxp3”或“叉头盒P3”是一种参与免疫系统反应的蛋白质,在调节性T细胞的发育和功能中充当主要调节剂,通常会降低免疫反应。在癌症中,过度的调节性T细胞活性可以抑制免疫系统破坏癌细胞。在自身免疫性疾病中,调节性T细胞活性的缺乏会导致其他自身免疫细胞攻击人体自身组织。术语“高水平的Foxp3表达”指的是相对于正常非癌组织中观察到的水平的至少1.2倍表达。高水平的Foxp3表达表明高水平的Treg细胞。术语“降低Foxp3表达”是指相对于同一癌症患者治疗之前的表达降低至少20%表达。
如本文所用,术语“髓系衍生的抑制细胞”或“MDSC”是指来自骨髓谱系的异质免疫细胞群,其在诸如慢性感染和癌症的病理情况下强烈扩增。MDSC高度浸润的癌组织与患者预后不良和对治疗的抗性有关。MDSC具有很强的免疫抑制活性而不是免疫刺激特性,并调节T细胞、树突细胞、巨噬细胞和自然杀伤细胞的功能。MDSC也可以在血液中检测到,并且在癌症中的水平可以比正常水平高10倍。如本文所用,术语“高数量的髓系衍生的抑制细胞”或“高数量的MDSC”是指相对于在正常健康组织中观察到的水平的MDSC数量的至少1.5倍。来自67名健康成人(对于年龄20-93岁且男女两性)血液的平均MDSC为每微升血液约50+/-30个MDSC细胞。参见,Apodaca等人,Journal for Immunotherapy of Cancer[癌症免疫疗法杂志](2019)7:230。术语“减少髓系衍生的抑制细胞数量”是指相对于同一癌症患者治疗之前的数量,髓系衍生的抑制细胞数量减少至少20%(优选50%)。
如本文所用,术语“Bv8”是指蛋白质,也称为前动力蛋白,其促进组织特异性血管生成和造血细胞动员。Bv8在肿瘤发展过程中调节骨髓中MDSC的动员并促进局部血管生成。Bv8是MDSC的替代标志物。术语“高水平的Bv8表达”是指相对于正常健康组织中观察到的水平的至少1.5倍的Bv8表达水平是指相对于没有癌症的正常人更高Bv8表达水平。类似地,术语“降低的Bv8表达水平”是指相对于同一癌症患者治疗之前观察到的水平,Bv8表达水平降低。
如本文所用,术语“一种或多种细胞毒性细胞免疫刺激剂”是指减少“Treg细胞”和/或“MDSC”数量并增加“细胞毒性T细胞”和/或“NK细胞”数量的一种或多种免疫刺激剂。细胞毒性细胞免疫刺激剂的实例包括免疫检查点抑制剂。免疫检查点抑制剂直接与免疫检查点蛋白结合,通过减少“Treg细胞”和/或“MDSC”的数量并增加“细胞毒性T细胞”和/或“NK细胞”(其破坏或导致癌细胞或组织受损)的数量来激活免疫系统。如本文所用,术语“免疫刺激剂”或“免疫刺激物”是指刺激或促进免疫系统任何组分激活的物质(药物和营养素)。
在本说明书的多个地方,披露的化合物的取代基以组或范围披露。特别旨在本披露包括此类组和范围的成员的每个成员和每个单独的子组合。例如,术语“C
本文使用氨基酸的单字母代码。例如丙氨酸是A,精氨酸是R,天冬酰胺是N,天冬氨酸是D,半胱氨酸是C,谷氨酸是E,谷氨酰胺是Q,甘氨酸是G,组氨酸是H,异亮氨酸是I,亮氨酸是L,赖氨酸是K,甲硫氨酸是M,苯丙氨酸是F,脯氨酸是P,丝氨酸是S,苏氨酸是T,色氨酸是W,酪氨酸是Y,缬氨酸是V,并且γE是谷氨酸,其中R基团(即,侧链)羧基(伽马,γ)是用于连接至肽的任何伯氨基基团或肽的N末端部分而不是α-羧基的部分。出于本申请的目的,氨基酸的单字母编码包括L和/或D氨基酸立体异构体。应当理解,当氨基酸组合形成肽时,氨基酸被称为去除了水元素的氨基酸残基。此外,当本披露涉及肽序列中的氨基酸时,应理解为氨基酸残基。
如本文所用,术语“脂肪族”是指含有以直链、支链或非芳香族环连接在一起的碳和氢的化合物或基团。脂肪族化合物或基团可以是饱和的(例如,烷烃如己烷和其他烷烃,烷基如己基和其他烷基)或不饱和的(例如,己烯和其他烯烃,以及炔烃、己烯基和其他烯基,以及炔基)。脂肪族化合物或基团(例如,烷基、烯基或炔基)可以被例如1、2、3、4、5、6、7或8个取代基例如(=O)、羟基、羧基、羰基和/或酯基取代。例如,脂肪族基团可以具有羧基作为取代基,其作为侧基和/或在末端。当脂肪族基团是化合物的一部分时,应理解脂肪族基团可以通过化学连接(例如羰基(C=O,也由C(O)或C(=O)表示)(例如,作为酰胺或酯连接的一部分)、硫醚、醚、硫醚、氨基甲酸酯部分、键等)共价结合到化合物上。应当理解,脂肪链中的碳数包括化学连接中的主链碳。例如,包含C(=O)连接的饱和C8脂肪族链,当线性时,可以表示为CH
如本文所用,术语“烷基”是指直链(例如,线性)或支链的饱和烃基。示例性烷基包括甲基(Me)、乙基(Et)、丙基(例如正丙基和异丙基)、丁基(例如正丁基、异丁基、叔丁基)、戊基(例如正戊基、异戊基、新戊基)等。烷基可含有1至约30、1至约24、2至约24、1至约20、2至约20、1至约10、1至约8、1至约6、1至约4或1至约3个碳原子。
如本文所用,术语“脂肪酸”是指被羧基取代的饱和或不饱和的脂肪族链。脂肪酸的实例包括辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山萮酸和/或木蜡酸。
如本文所用,术语“脂肪酸酯”是指在链的末端具有-C(=O)O-部分的长脂肪族链(饱和或不饱和的)。
如本文所用,术语“脂肪酸酰胺”是指在链的末端具有-C(=O)NR-部分的长脂肪族链(饱和或不饱和的)。
如本文所用,可互换使用的术语“个体”、“受试者”或“患者”是指任何动物,包括哺乳动物,优选地小鼠、大鼠、其他啮齿类动物、兔、狗、猫、猪、牛、绵羊、马或灵长类动物,并且最优选地人。
如本文所用,短语“治疗有效量”是指引起研究者、兽医、医师或其他临床医生在组织、系统、动物、个体或人中寻求的生物或药物反应的一定量的治疗剂(即药物,或治疗剂组合物),该反应包括以下中一项或多项:
(1)预防疾病;例如,对易患疾病、病症或障碍但尚未经历或显示疾病的病理学或症状学的个体的疾病、病症或障碍进行预防;
(2)抑制疾病;例如,抑制正在经历或显示疾病、病症或障碍的病理学或症状学的个体的疾病、病症或障碍;以及
(3)改善疾病;例如,改善正在经历或显示疾病、病症或障碍的病理学或症状学的个体的疾病、病症或障碍(即,逆转病理学和/或症状学),如降低疾病的严重性、延长存活时间和/或预防死亡。
如本文所用,“推注剂量”是在短时间内(例如,少于10分钟(例如,少于8分钟,少于5分钟、少于3分钟或少于1分钟))给予或施用的药物或其他物质的单剂量。在一些实施例中,推注剂量在少于5分钟内施用。在一些实施例中,推注剂量在少于3分钟内施用。在一些实施例中,推注剂量在少于1分钟内施用。施用包括以下之一:身体任何部位的注射(包括但不限于血管、皮下、鞘内或皮内),肠内(例如,口服,作为剂型),吸入(例如,通过气管内吸入施用,其中受试者暴露于高气溶胶浓度,使得活性药物成分直接沉积在下呼吸道),或经鼻(例如,作为气溶胶、液体或粉末)。
如本文所用,术语“血压下降”、“血压的下降”或“低血压”可互换使用,指的是受试者血压在统计学上显著降低小于基线血压。基线血压是在治疗或向受试者施用任何药物之前测量的平均血压,或正常健康受试者的平均血压。大多数血压测量设备的标准偏差可能在5%-15%之间,具体取决于测量方法和位置、精神状态或测量过程中受试者的移动。为了本说明书的清楚起见,血压的变化将表示为在药物或测试品施用之前血压相对于平均/均值基线血压的统计学上显著的百分比增加、减少或下降。统计学上显著意味着P<0.05,如统计学领域的技术人员所知。
如本文所用,术语“C型利尿钠肽”或“CNP”是一种肽,包括22个氨基酸残基,具有由二硫键形成的17个氨基酸残基的环结构,以及在N末端延伸的另外5个氨基酸残基(GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.10];其中字母与常规氨基酸命名法一致,氨基酸残基C-6(位置6)和C-22(位22)通过二硫键连接)。参见,例如,Sudoh等人,Biochem.Biophys.Res.Commun.[生物化学与生物物理研究通讯]1989;159:1427-1434。
如本文所用,“NPRB受体”、“利尿钠肽受体B(NPRB)”或“NPR2”、“鸟苷酸环化酶B(GC-B)”或“B型利尿钠肽受体2”(NPR2)是互换使用的。在人中,NPRB受体由NPR2基因编码,该基因位于9号染色体上,在小鼠中位于4号染色体上。参见,例如,Nuglozeh等人,Genome.[基因组]1997;8:624-625。NPRB的表达在心脏、脑、子宫、卵巢、肾、肺、肝和脂肪细胞等多种器官以及某些癌症中都有报道。Schulz等人,Cell.[细胞]1989;58:1155-1162;Nagase等人,J.Hypertens.[高血压杂志]1997;15:1235-1243;Chrisman,等人,J.Biol.Chem.[生物化学杂志]1993;268:3698-3703。NPRB选择性地被CNP激活,而不是被ANP或BNP(其他已知的利尿钠肽)激活。NPRB的遍在表达表明它在许多生理功能中的作用。另一种利尿钠肽受体NPRA被生理浓度的ANP和BNP激活,NPRA不被CNP激活。
如本文所用,术语“长效C型利尿钠肽”或“长效CNP”是指CNP配制品,当作为单次推注剂量施用给哺乳动物受试者(人、非人灵长类动物、狗、大鼠、小鼠等)时,由此产生的血浆中CNP水平升高或血浆环状GMP水平升高高于基线将持续超过4小时或超过6小时的持续时间,具体取决于物种。长效C型利尿钠肽或长效CNP包括超长效C型利尿钠肽或超长效CNP。血浆环状GMP的升高是CNP结构活性本身的结果,或者来自CNP与含有CNP的配制品的一种或多种组分的组合。血浆中的存在(或升高)是指可检测到的存在超过和高于分析基线水平,其中基线水平是在不存在长效CNP配制品施用的情况下测量的水平。血浆环状GMP持续升高的持续时间长度是CNP配制品生物活性的持续时间。CNP配制品是指包含CNP肽与一种或多种赋形剂或载剂例如聚合物、蛋白质、糖、去污剂和/或缓冲剂的组合物。CNP配制品中的CNP可以共价连接或不连接至赋形剂或载剂。施用后可通过药代动力学/药效学分析评估血液中的持续存在。
如本文所用,含有“超长效C型利尿钠肽”或“超长效CNP”的配制品是指含有22个氨基酸残基CNP的长效CNP配制品,其配制方式如下:当作为单次推注剂量施用给受试者时,将在血浆中持续存在或使血浆环状GMP持续升高高于基线24小时或更长时间(例如,多达2-3天或多达1-4周)。因此,超长效C型利尿钠肽或超长效CNP是长效C型利尿钠肽或长效CNP的子集。血浆中的存在是指可检测到的存在超过或高于在不施用治疗性CNP配制品的情况下受试者通常产生的内源性天然激动剂或分析基线水平。血浆环状GMP升高或可检测的CNP的存在超过基线的持续时间(即,时间长度)可以是24至192小时,或24至48小时,或48至72小时,或72至96小时,或96至120小时,或120至144小时,144至168小时,或168至192小时。如上所述,CNP配制品是包含CNP肽与一种或多种赋形剂或载剂例如聚合物、蛋白质、糖、去垢剂和/或缓冲剂的组合物。CNP配制品中的CNP可以共价连接或不连接至赋形剂或载剂。施用后可通过药代动力学/药效学分析评估血液中的持续存在。
如本文所用,术语“长效CNP衍生物”是这样的CNP衍生物,当其作为单一推注剂量施用给哺乳动物受试者或患者时在血浆中持续存在或使血浆环状GMP持续升高高于基线超过4小时或超过6小时,具体取决于物种。长效CNP衍生物包括超长效CNP衍生物。长效性质可来自CNP衍生物结构本身,或来自CNP衍生物与含有CNP衍生物的配制品的一种或多种组分的组合。血浆或血液中的存在是指可检测到的存在超过哺乳动物通常产生的内源性天然激动剂或高于不施用治疗性化合物、肽、蛋白质或配制品的情况下的分析基线水平。施用后可通过药代动力学/药效学分析评估血液中的持续存在。在一些实施例中,CNP衍生物是经修饰的CNP,其与天然CNP具有至少72%(例如,至少80%、至少85%、至少90%、至少95%或至少98%)的序列同源性或同一性。在一些实施例中,CNP衍生物是添加型衍生物,其中天然CNP通过在CNP肽的N末端处、C末端处或任何氨基酸残基的R基团中共价添加化学部分(例如一种或多种另外的氨基酸和/或脂肪酸和/或任何一个和/或多个化学部分)进行修饰。在一些实施例中,CNP衍生物包括取代衍生物,其中天然CNP中的1至6个氨基酸残基(或5%至28%的氨基酸残基)被不同或非天然氨基酸残基替代。在某些实施例中,CNP衍生物包括减法衍生物,其中天然CNP中的1至6个氨基酸残基(或5%至28%的氨基酸残基)被缺失。在某些实施例中,CNP衍生物包括减法衍生物,其中天然CNP中的1至6个氨基酸残基(或5%至28%的氨基酸残基)被缺失和/或取代。CNP衍生物配制品是指含有CNP衍生物与一种或多种赋形剂或载剂如聚合物、蛋白质、糖、洗涤剂或缓冲剂的组合物。
如本文所用,术语“超长效CNP衍生物”是指长效CNP衍生物或CNP衍生物,当其作为单一推注剂量施用给哺乳动物受试者或患者时在血浆中持续存在或使血浆环状GMP持续升高高于基线,持续时间为24小时或更长时间。因此,超长效CNP衍生物是长效CNP衍生物的子集。超长效CNP衍生物可来自CNP衍生物结构本身,或来自CNP衍生物与含有CNP衍生物的配制品的一种或多种组分的组合。血浆中的存在是指可检测到的存在超过在不施用超长效CNP衍生物的情况下的分析基线血浆水平。血浆环状GMP升高或可检测的CNP衍生物的存在超过基线的持续时间可以是24至192小时,或24至48小时,或48至72小时,或72至96小时,或96至120小时,或120至144小时,144至168小时,或168至192小时。施用后可通过药代动力学/药效学分析评估血液中的持续存在。在一些实施例中,CNP衍生物包括与天然CNP具有72%(例如,至少80%、至少85%、至少90%、至少95%或至少98%)序列同一性的经修饰的CNP。在一些实施例中,CNP衍生物是添加型衍生物,其中天然CNP通过在CNP肽的N末端处、C末端处或任何氨基酸残基的R基团中共价添加化学部分(例如另外的氨基酸和/或脂肪酸和/或任何一个和/或多个化学部分)进行修饰。在一些实施例中,CNP衍生物是取代衍生物,其中天然CNP中的1-6个氨基酸残基(或5%-28%的氨基酸残基)被不同或非天然氨基酸残基替代。在某些实施例中,CNP衍生物是减法衍生物,其中天然CNP中的1-6个氨基酸残基(或5%-28%的氨基酸残基)被缺失。在某些实施例中,CNP衍生物包括减法衍生物,其中天然CNP中的1至6个氨基酸残基(或5%至28%的氨基酸残基)被缺失和/或取代。CNP衍生物配制品是含有CNP衍生物与一种或多种赋形剂或载剂如聚合物、蛋白质、糖、洗涤剂或缓冲剂的组合物。
如本文所用,“CNP配制品”或“CNP衍生物配制品”是指含有CNP肽或其衍生物的组合物,该CNP肽或其衍生物可以共价连接或不共价连接至赋形剂或载剂,例如聚合物、蛋白质和/或脂质。
如本文所用,术语“NPRB激动剂”或“NPR2激动剂”是指的以下任何化合物、肽或蛋白质:在其结构中不包含22个氨基酸残基CNP序列并且可以结合细胞催化受体NPRB,并且刺激其细胞内鸟苷酸环化酶活性以增加细胞内或血液中的环状GMP水平,但结合和刺激NPRA受体的能力有限或没有。由于并非所有细胞都表达相似水平的NPRB,因此NPRB激动剂经过专门设计以主要影响那些表达NPRB的细胞。通过测量表达NPRB的细胞中的活性,与表达NPRA的细胞中的活性相比,本领域技术人员可以容易地测量这种选择性。
如本文所用,术语“长效NPRB激动剂”是指上文定义的NPRB激动剂,当其作为单一推注剂量施用给哺乳动物受试者或患者时在血浆中持续存在或使血浆环GMP持续升高高于基线超过4小时或超过6小时,具体取决于物种。长效NPRB激动剂包括超长效NPRB激动剂。NPRB激动剂的长效特性可来自NPRB激动剂结构本身,或来自NPRB激动剂与含有NPRB激动剂的配制品的一种或多种组分的组合。血浆中的存在是指可检测到的存在超过在不施用长效NPRB激动剂的情况下的分析基线水平。长效NPRB激动剂的配制品或长效NPRB激动剂配制品是包含长效NPRB激动剂,或长效NPRB激动剂与一种或多种赋形剂或载剂(例如聚合物、蛋白质、糖、脂质、或缓冲剂)的组合物。长效NPRB激动剂可以共价连接或不连接至赋形剂或载剂。施用后可通过药代动力学/药效学分析评估血液中的持续存在。环状GMP在基线以上的持续血浆升高可以通过施用后的药效学分析来评估。
如本文所用,术语“超长效NPRB激动剂”是指长效NPRB激动剂,当其作为单一推注剂量施用给哺乳动物受试者或患者时将在血浆中持续存在或使血浆环状GMP持续升高高于基线24小时或更长时间。超长效NPRB激动剂是长效NPRB激动剂的子集。NPRB激动剂的超长效特性可来自NPRB激动剂结构本身,或来自NPRB激动剂与含有NPRB激动剂的配制品的一种或多种组分的组合。血浆中的存在是指其可检测到的存在超过在不施用超长效NPRB激动剂的情况下的分析基线水平。血浆环状GMP升高或可检测的NPRB激动剂的存在超过基线的持续时间可以是24至192小时,24至48小时,或48至72小时,或72至96小时,或96至120小时,或120至144小时,144至168小时,或168至192小时。超长效NPRB激动剂的配制品或超长效NPRB激动剂配制品是指包含超长效NPRB激动剂,或超长效NPRB激动剂与一种或多种赋形剂或载剂(例如聚合物、蛋白质、糖、脂质、或缓冲剂)的组合物。超长效NPRB激动剂可以共价连接或不连接至赋形剂或载剂。施用后可通过药代动力学/药效学分析评估血液中的持续存在。施用后可通过药代动力学/药效学分析评估血液中的持续存在。环状GMP在基线以上的持续血浆升高可以通过施用后的药效学分析来评估。
如本文所用,短语“对NPRA具有有限或无激动活性的NPRB激动剂”是指对NPRB具有比NPRA高5倍的结合亲和力(或更低的EC50)的NPRB激动剂。
如本文所用,术语“聚合物”是指主要或完全由共价键合在一起的许多相似重复单元形成的大分子。术语聚合物包括纤维素衍生物、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)和聚(N-乙烯基吡咯烷酮)及其衍生物。这些聚合物可以是支链的或直链的。如本文所用,聚合物可通过酰胺、酯、醚、硫醚、硫酯或氨基甲酸酯键或通过含有这些键之一的接头连接至肽、蛋白质或接头基团。聚合物也可以相互接枝以制成受保护的接枝共聚物赋形剂,当与活性药物成分混合时,可以通过延长活性药物成分在体内施用后在血液或血浆中的存在来增强活性药物成分的药代动力学和药效学性能。
本文所用的术语“氨基酸”是指分子量小于500Da,含有氨基(-NH
本文所用的术语“衍生物”或“类似物”包括其核心结构与亲本化合物相同或非常相似,但具有化学或物理修饰,例如不同或额外的基团的化合物;该术语包括可以连接到其他原子或分子的亲本化合物的共聚物。该术语还包括与亲本肽或蛋白质具有至少72%(例如,至少80%、至少85%、至少90%、至少95%、或至少98%)序列同一性的肽或蛋白质。该术语还包括与亲本肽相比附接有另外基团的肽,例如另外标记或标签。该术语还包括与亲本聚合物相比附接有另外基团的聚合物,例如烷氧基或甲氧基基团。
如本文所用,“添加型衍生物”或“扩展型衍生物”是指肽衍生物,其中肽的主要主链氨基酸序列保持不变,但是使用主氨基酸序列中的一个或多个反应性部分将额外的官能团和/或氨基酸添加到主氨基酸序列中提供了添加型衍生物或扩展型衍生物。添加型衍生物或扩展型衍生物不同于截短和/或取代肽衍生物,其中肽的主链氨基酸残基序列中的一个或多个氨基酸残基已分别被去除和/或被不同的官能团和/或氨基酸残基替代。
如本文所用,术语“接头基团”或“连接基团”或“接头”是指将两个实体(例如,两个分子的部分)共价连接或键合在一起的原子或化学部分。例如,衍生自市售交联剂的接头前体例如氨基酸、肽或非氨基酸分子可以与两个实体反应,通过接头基团将两个实体连接在一起。一旦两个部分连接在一起,接头基团就是在最终连接的实体中从接头前体中保留下来的部分。例如,如果要将分子A连接到分子B,则接头基团可以具有两个化学官能团,其中一个官能团将与A反应,而另一个官能团将与B反应,从而产生“A-接头基团-B”。在这种情况下,接头基团是A和B共价连接后保留的接头前体的部分。
如本文所用,术语“多肽”是指氨基酸的聚合物。
如本文所用,术语“肽”是指具有三个或更多个氨基酸通过α氨基和α羧基经由酰胺键共价连接在一起的多肽。肽中的氨基酸数量可以是3到约100个单元。
如本文所用,术语“蛋白质”是指大到足以具有三维结构的多肽,例如β-桶或α-螺旋。
如本文所用,术语“抗体”是指由识别特定抗原的免疫细胞产生的蛋白质。它是响应血液中特定抗原而产生并且抵消其的蛋白质。抗体与身体识别为异物(例如细菌、病毒和血液中的外来物质)的物质发生化学结合
如本文所用,术语“人源化抗体”是指来自非人物种的抗体,其蛋白质序列已被修饰以增加它们与人中天然产生的抗体变体的相似性。
如本文所用,术语“皮下施用”、“s.c.”、“s.c.施用”、“SC”或“SC施用”是指将通常为液体形式的药物直接递送到皮肤正下方的脂肪组织中。递送通常通过直接注射进行。这些注射比注射到肌肉组织中的注射要浅。提供者经常对适合缓慢而稳定地吸收到血液中的药物使用皮下注射,
如本文所用,术语“静脉内施用”、“IV施用”或“IV注射”是指将通常以液体形式的药物直接递送到动物或人的静脉中。递送方法通常是通过直接注射。静脉内施用途径可用于注射(使用高压注射器);以及输注(例如,使用重力提供的压力)。
如本文所用,术语“肌内施用”、“IM施用”或“IM注射”是指将通常以液体形式的药物直接肌内递送至动物或人的肌肉中。递送通常通过直接注射进行。这样可以使药物迅速吸收到血液中。在某些情况下,个人也可以自行进行IM注射。在一些实施例中,可以使用IM注射代替静脉内注射,例如,当某些治疗剂刺激静脉时,或当无法定位合适的静脉时。
如本文所用,术语“经鼻施用”是指通过局部施用、以液体形式滴下、吹入(或吹或喷)动物或人的鼻子来递送治疗剂(例如,以凝胶、液体、气溶胶、气体或粉末的形式)。根据配制品的不同,这种施用形式可以用于例如将治疗剂递送至鼻腔或肺(取决于所使用的装置),和/或可能不会被全身吸收(纯局部施用),和/或可能完全被全身吸收(纯全身),和/或更频繁地部分吸收(局部和全身)。鼻喷雾剂可以包括局部作用的药物,例如用于感冒和过敏治疗的减充血剂,其全身作用通常很小。可用作鼻喷雾剂的全身活性药物的实例包括,例如,偏头痛药物、尼古丁替代品和激素治疗。
如本文所用,术语“肠胃外”或“非胃肠”施用是指不通过肠内或胃肠途径的施用途径。肠胃外施用的实例包括皮下(皮肤下面)、静脉内(进入静脉)、动脉内(进入动脉)、肌内(进入肌肉)、腹膜内(输注或注射进入腹膜)、吸入(例如,通过气管内吸入施用,其中受试者暴露于活性药物成分的高气溶胶浓度,使得活性药物成分直接沉积在下呼吸道)、经鼻施用(通过鼻子)、舌下和口腔施用、鞘内(进入椎管)、脑内(进入大脑)、脑室内(进入脑室)、皮内(进入皮肤本身)或任何其他不涉及胃肠道的施用途径。如本文所用,术语“肠内”是指施用至消化道的任何区域,包括嘴(口)、咽(喉)、食道、胃、小肠、大肠、直肠和肛门,或通过在这些区域中的任何一个区域中的人工开口。
如本文所用,术语“治疗剂”、“药物”或“活性药物成分”是指能够在疾病状态下产生治愈性效果的物质或分子。
如本文所用,术语“赋形剂”是指以下物质,该物质与活性药物成分一起配制或混合以达到长期稳定的目的,以使含有少量有效活性成分的配制品增重(因此通常称为作为“膨胀剂”、“填充剂”或“稀释剂”),和/或给最终剂型中的活性药物成分赋予治疗增强作用,例如促进药物吸收和/或效力/剂量、降低粘度,提高溶解度,和/或延长活性药物成分在血液中的作用或存在时间。合适赋形剂的选择取决于施用途径和剂型、活性药物成分和其他因素。赋形剂可以包括例如糖、氨基酸、缓冲剂、抗氧化剂、螯合剂、溶剂或媒剂,和/或在体外和/或体内结合和稳定活性药物成分的复合聚合物。尽管赋形剂曾一度被认为是“非活性”成分,但现在人们认为它们有时可以成为“剂型性能的关键决定因素”。换句话说,赋形剂对药效学和药代动力学的影响可能很重要并且可能需要进行广泛的研究和调查。赋形剂如何影响活性药物成分的递送通常是不可预测的。
如本文所用,术语“健康受试者”是指个体(人和/或哺乳动物)没有适应症或其他已知的显著健康问题,如由本领域技术人员(内科医生和/或临床医生)评估。出于本披露的目的,这些是经本领域技术人员(内科医生和/或临床医生)评估没有肿瘤癌症的个体。例如,健康的人受试者具有以下血液学测试结果的特征实验室值:中性粒细胞绝对计数(男性):1780-5380/μL(1.78-5.38x10
健康的人受试者具有以下血液、血浆和血清化学结果的实验室特征值。白蛋白,血清:3.5-5.5g/dL(35-55g/L);碱性磷酸酶,血清:36-92单位/L;甲胎蛋白,血清:0-20ng/mL(0-20μg/L);氨基转移酶,丙氨酸(ALT):0-35单位/L;氨基转移酶,天冬氨酸(AST):0-35单位/L;氨,血浆:40-80μg/dL(23-47μmol/L);淀粉酶,血清:0-130单位/L碳酸氢盐,血清:23-28meq/L(23-28mmol/L);胆红素,血清总计:0.3-1.2mg/dL(5.1-20.5μmol/L)直接:0-0.3mg/dL(0-5.1μmol/L);血液气体,动脉(环境空气)pH:7.38-7.44Pco2:35-45mm Hg(4.7-6.0kPa)Po2:80-100mm Hg(10.6-13.3kPa);氧饱和度:95%或更高;血尿素氮:8-20mg/dL(2.9-7.1mmol/L);C反应蛋白:0.0-0.8mg/dL(0.0-8.0mg/L);钙,血清:9-10.5mg/dL(2.2-2.6mmol/L);氯化物,血清:98-106meq/L(98-106mmol/L);胆固醇,血浆总计:150-199mg/dL(3.88-5.15mmol/L),期望的低密度脂蛋白(LDL):小于或等于130mg/dL(3.36mmol/L),期望;高密度脂蛋白(HDL):大于或等于40mg/dL(1.04mmol/L),期望;补体,血清C3:55-120mg/dL(550-1200mg/L);总计(CH50):37-55U/mL(37-55kU/L);肌酸激酶,血清:30-170单位/L;肌酐,血清:0.7-1.3mg/dL(61.9-115μmol/L);电解质,血清钠:136-145meq/L(136-145mmol/L),钾:3.5-5.0meq/L(3.5-5.0mmol/L),氯化物:98-106meq/L(98-106mmol/L),碳酸氢盐:23-28meq/L(23-28mmol/L);纤维蛋白原,血浆:150-350mg/dL(1.5-3.5g/L);叶酸,红细胞:160-855ng/mL(362-1937nmol/L);叶酸,血清:2.5-20ng/mL(5.7-45.3nmol/L);葡萄糖,血浆:空腹,70-100mg/dL(3.9-5.6mmol/L);γ-谷氨酰转移酶,血清:0-30单位/L;同型半胱氨酸,血浆男性:0.54-2.16mg/L(4-16μmol/L),女性:0.41-1.89mg/L(3-14μmol/L);免疫球蛋白球蛋白,总计:2.5-3.5g/dL(25-35g/L),IgG:640-1430mg/dL(6.4-14.3g/L),IgA:70-300mg/dL(0.7-3.0g/L),IgM:20-140mg/dL(0.2-1.4g/L),IgD:小于8mg/dL(80mg/L),IgE:0.01-0.04mg/dL(0.1-0.4mg/L);铁蛋白,血清:15-200ng/mL(15-200μg/L),铁,血清:60-160μg/dL(11-29μmol/L),铁结合能力,总计,血清:250-460μg/dL(45-82μmol/L),转铁蛋白饱和度:20%-50%;乳酸脱氢酶,血清:60-100单位/L;乳酸,静脉血:6-16mg/dL(0.67-1.8mmol/L);脂肪酶,血清:小于95单位/L;镁,血清:1.5-2.4mg/dL(0.62-0.99mmol/L);甲基丙二酸,血清:150-370nmol/L;渗透压,血浆:275-295mosm/kg H2O;磷酸酶,碱性,血清:36-92单位/L;磷,血清:3-4.5mg/dL(0.97-1.45mmol/L);钾,血清:3.5-5.0meq/L(3.5-5.0mmol/L);前列腺特异性抗原,血清-小于4ng/mL(4μg/L);蛋白质,血清总计:6.0-7.8g/dL(60-78g/L),白蛋白:3.5-5.5g/dL(35-55g/L),球蛋白,总量:2.5-3.5g/dL(25-35g/L);类风湿因子:小于40U/mL(40kU/L);钠,血清:136-145meq/L(136-145mmol/L);转铁蛋白饱和度:20%-50%;甘油三酯:小于150mg/dL(1.69mmol/L),期望;肌钙蛋白,血清肌钙蛋白I:0-0.5ng/mL(0-0.5μg/L),肌钙蛋白T:0-0.10ng/mL(0-0.10μg/L);尿素氮,血液:8-20mg/dL(2.9-7.1mmol/L);尿酸,血清:2.5-8mg/dL(0.15-0.47mmol/L);维生素B12,血清:200-800pg/mL(148-590pmol/L)。
健康的人受试者具有以下内分泌测试组结果的特征实验室值:促肾上腺皮质激素(ACTH),血清:9-52pg/mL(2-11pmol/L);醛固酮,血清仰卧位:2-5ng/dL(55-138pmol/L)静置:7-20ng/dL(194-554pmol/L);醛固酮,尿液:5-19μg/24小时(13.9-52.6nmol/24小时);儿茶酚胺肾上腺素,血浆(仰卧):小于75ng/L(410pmol/L),去甲肾上腺素,血浆(仰卧):50-440ng/L(296-2600pmol/L),儿茶酚胺,24小时,尿液:小于100μg/m2/24小时(591nmol/m
健康的人受试者具有以下尿液测试组结果的特征实验室值:白蛋白肌酐比:小于30mg/g;钙:100-300mg/24小时(2.5-7.5mmol/24小时),无限制饮食;肌酐:15-25mg/kg/24小时(133-221mmol/kg/24小时);肾小球滤过率(GFR)正常男性:130mL/min/1.73m
健康的人受试者具有以下胃肠道测试组结果的特征实验室值。胃泌素,血清:0-180pg/mL(0-180ng/L);大便脂肪:100克脂肪饮食小于5g/d;大便重量:小于200g/d。
健康人受试者具有以下肺部测试特征值。1秒用力呼气量(FEV1):大于预测的80%;用力肺活量(FVC):大于预测的80%;FEV1/FVC:大于75%。
健康的人受试者具有以下脑脊液测试组结果的特征实验室值:细胞计数:0-5/μL(0-5x10
健康人受试者具有以下特征性血液动力学测试值:心脏指数:2.5-4.2L/min/m2;左心室射血分数:大于55%;压力:肺动脉收缩压:20-25mm Hg,舒张压:5-10mm Hg平均值:9-16mm Hg;肺毛细血管楔:6-12mm Hg,右心房:平均0-5mm Hg,右心室收缩压:20-25mm Hg,舒张压:0-5mm Hg。
此外,一般正常的健康人受试者的静息脉搏率在50至90次/分钟的范围内,而对于非人受试者可以接受更宽的范围。
如本文所用,术语“治疗”是指在病症诊断之后进行的程序。
如本文所用,术语“减轻”是指执行以预防预期伤害或疾病或降低预期伤害或疾病的可能性的程序。
如本文所用,术语“免疫检查点蛋白”是指存在于正常细胞表面的蛋白质,其可以与免疫细胞中的相应配体结合以阻止免疫系统(通过细胞凋亡)破坏身体的正常细胞或组织,并且从而抑制或预防自身免疫性疾病。被靶向抑制以治疗癌症的众所周知的免疫检查点蛋白包括CTLA-4、PD1、PD-L1、PD-L2。除此之外,LAG-3、BTLA、B7H3、B7H4、TIM-3、MR也是本领域公认的以构成类似于CTLA-4和PD-1的免疫检查点蛋白(参见,例如,Pardoll,2012,Nature Rev Cancer[癌症自然评论]12:252-264;Mellman等人,2011,Nature[自然]480:480-489,通过引用以其整体并入本文)。这些免疫检查点蛋白存在于细胞表面,为免疫系统提供抑制信号,阻止免疫系统破坏身体的正常细胞或组织。然而,癌细胞也表达免疫检查点蛋白以逃避免疫系统并允许无限的肿瘤生长。使用免疫检查点抑制剂掩蔽或抑制免疫检查点蛋白可以激活免疫系统来破坏癌细胞。
如本文所用,术语“免疫检查点抑制剂”或“ICPI”是指以下任何化合物,其可以激活免疫系统以攻击肿瘤或癌症;和/或可以直接或间接抑制免疫检查点蛋白的整体功能,使细胞毒性T细胞在组织(或肿瘤)内被激活和/或减少Treg免疫细胞并导致细胞毒性T细胞在组织(或肿瘤)中增殖(或肿瘤)以损伤或消除组织(或肿瘤)。迄今为止开发的大多数ICPI直接与免疫检查点蛋白结合。有ICPI蛋白或多肽的许多实例,它们可以直接结合细胞表面的免疫检查点蛋白或其配体并促进免疫系统的激活。可被直接抗体或蛋白结合抑制的已知免疫检查点蛋白包括CTLA-4、PD1、PD-L1、PD-L2。除此之外,LAG-3、BTLA、B7H3、B7H4、TIM-3、MR也是本领域公认的以构成类似于CTLA-4和PD-1的免疫检查点蛋白(参见,例如,Pardoll,2012,Nature Rev Cancer[癌症自然评论]12:252-264;Mellman等人,2011,Nature[自然]480:480-489,全部并入本文)并且可能以类似的方式被抑制。还有ICPI可能不直接与这些免疫检查点蛋白结合,但可以激活肿瘤组织内的细胞毒性T细胞和/或引起肿瘤组织中Treg免疫细胞的减少和细胞毒性T细胞的增殖,从而破坏或消除肿瘤组织。本披露涉及后一类ICPI。
免疫检查点蛋白的直接阻断剂包括特异性结合或掩蔽免疫检查点蛋白作用的多肽或化合物,从而促进免疫或癌症的破坏。几种抗体检查点抑制剂已被美国食品和药物管理局批准用于治疗癌症,包括派姆单抗(针对PD-1;由默克公司(Merck)以Keytruda销售)、纳武单抗(针对PD-1,由百时美施贵宝公司(Bristol-Myers Squibb)以Opdivo销售(参见例如Topalian等人,2012,N.Eng.J.Med.[新英格兰医学杂志]366:2443-2454,美国专利号8,008,449B2))、伊匹单抗(针对CTLA4,由百时美施贵宝公司以Yervoy销售)、阿特利珠单抗(针对PD-L1,由罗氏公司(Roche)&基因技术公司(Genentech)以Tecentriq销售)、阿维鲁单抗(针对PD-L1,由默克雪兰诺公司(Merck Serono)&辉瑞公司(Pfizer)以Bavencio销售)、度伐鲁单抗(针对PD-L1,由阿斯利康公司(AstraZeneca)以Imfinzi销售)和西米普利单抗(针对PD-L1,由赛诺菲公司(Sanofi)以Libtayo销售)。其他免疫检查点抑制剂包括曲美利木单抗(抑制CTLA-4)(参见,例如,Ribas等人,2013,J Clin.Oncol.[临床肿瘤学杂志]31:616-22),兰博单抗(lambrolizumab)(抑制PD-1)(WO2008/156712;Hamid等人,2013,NEngl.J.Med.[新英格兰医学杂志]369:134-144),匹地利珠单抗(inhibits PD-1)(参见,例如,Rosenblatt等人,2011.J Immunother[免疫疗法杂志]:34:409-18)。其他PD-1抑制剂可能包括可溶性PD-1配体,包括但不限于PD-L2 Fc融合蛋白,也称为B7-DC-Igor AMP-244(参见,例如,Mkrtichyan M.等人J Immunol.[免疫学杂志]189:2338-47 2012)。免疫检查点抑制剂可包括但不限于阻断PD-L1的人源化或全人抗体,例如MEDI-4736(参见,例如,WO2011066389 A1)和MPDL3280A(美国专利号8,217,149B2)。其他PD-L1抑制剂目前正在研究中。
如本文所用,“液体”是在室温下自由流动的物质,因此其形状发生变化但其体积保持不变,例如,就像水或油一样。
如本文所用,“室温”表示约25℃的典型环境室内温度。
除非另有定义,否则本披露的任何方面或实施例中的任何特征可以与本发明的任何其他方面或实施例中的任何特征组合,并且这样的组合包含在本披露中。这也适用于但不排他地适用于本文披露的范围的端点。例如,如果给定物质被披露为以X%-Y%或A%-B%的浓度范围存在于组合物中,则本披露应理解为不仅明确披露了范围X%-Y%和A%-B%,而且还明确披露了范围X%-B%、A%-Y%以及尽可能以数字表示的Y%-A%和B%-X%。这些范围和范围组合中的每一个都被预期,并且应被理解为在本申请中被直接且明确地披露。
除非另有说明,否则本申请中使用连字符(“-”)分隔两个括号值X和Y或两个括号比率的范围的指定应理解为表示并披露指定的范围,其中两个端点值包括X和Y。这同样适用于表示为“从X到Y”的范围。因此,“X-Y”、“X到Y”、“从X到Y”、“X-Y”和“从X-Y”的范围的表述应被等同地理解为表示并披露涵盖末端值X、X和Y之间的所有值(包括小数)、以及末端值Y的范围。
如本文所用,术语“约”指的是特定值,例如,范围的一个或多个端点,除了具体列举的值本身之外,还涵盖并披露了围绕该具体列举的值的特定变化。例如,这种变化可能由正常测量可变性引起,例如通过本领域技术人员已知的方法称量或分配各种物质时的正常测量可变性。术语“约”应理解为涵盖和披露高于和低于指定的特定值的可变性范围,所述百分比值是相对于特定引用值本身,如下:术语“约”可涵盖并披露±5.0%的可变性。术语“约”可涵盖并披露±4.5%的可变性。术语“约”可涵盖并披露±4.0%的可变性。术语“约”可涵盖并披露±3.5%的可变性。术语“约”可涵盖并披露±3.0%的可变性。术语“约”可涵盖并披露±2.5%的可变性。术语“约”可涵盖并披露±2.0%的可变性。术语“约”可涵盖并披露±1.5%的可变性。术语“约”可涵盖并披露±1.0%的可变性。术语“约”可涵盖并披露±0.5%的可变性。术语“约”,指的是特定引用的值,可以涵盖并披露该确切的特定值本身,而不管任何明确提及包括该确切的特定值;即使没有明确指示术语“约”包括特定的确切的引用值,该确切的特定值仍包括在由术语“约”产生的变化范围内,因此在本申请中披露。除非另有说明,否则在数值范围的第一个端点之前而不是在该范围的第二个端点之前引用术语“约”时,该术语及其在范围和披露中暗示的可变性指的是范围的第一个端点和范围的第二个端点两者。例如,“约X到Y”的引用范围应该读作“约X到约Y”。这同样适用于列举的比率范围。例如,“约X:Y-A:B”的重量比的引用范围应理解为“(约X):(约Y)-(约A):(约B)”的重量比。
除非另有定义,本文使用的所有技术和科学术语具有与本领域普通技术人员通常所理解的相同的含义。虽然与本文描述的那些方法和材料类似或等同的方法和材料可以用于本披露的实践或测试,但是以下描述合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献通过引用以其整体并入本文。在有矛盾的情况下,将以本说明书(包括定义)为准。另外,材料、方法和实例仅是说明性的并不旨在是限制性的。易于理解的是,如在此总体所述的和在附图中示出的本披露的方面可以各种的不同构造方式进行布置、取代、组合、分隔和设计,所有这些都被明确地在本文中预期。
此外,图中所示的特定布置不应被视为限制性的。应当理解,其他实施例可以包括更多或更少的给定图中所示每个要素。此外,一些图示的要素可以组合或省略。此外,示例性实施例可以包括未在图中示出的要素。
治疗方法
本披露的方法通过以下出人意料的发现而成为可能:CNP可以以如下方式被修饰、衍生化和/或配制,该方式使得它可以诱导/导致增加和/或最大化环状GMP产生而没有相关的不利的血压下降。视肽而定,在施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平升高至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上)的治疗性推注剂量下,CNP的血压效应可被最小化或消除。在本披露中,基线血浆环状GMP水平定义为推注剂量施用前的血浆水平,在人中健康受试者的血浆水平为4+/-1pmol/ml,或约1.4mg/ml(但可能因物种而异)。参见,例如,Shotan等人,Plasma cyclic guanosine monophosphate in chronic heartfailure:hemodynamic and neurohormonal correlations and response to nitratetherapy[慢性心力衰竭中的血浆环磷酸鸟苷:血液动力学和神经激素相关性以及对硝酸盐治疗的反应].Clin Pharmacol Ther[临床药理学与治疗学],1993.54(6):第638-44页,以其整体并入本文。在优选的实施例中,基线水平是对提供治疗的同一受试者在药物施用之前测得的水平,并且该水平可以从一个受试者到下一个受试者变化。在实施本披露时,用作参考参数以评价治疗效果的任何基线参数通过治疗前的测量建立。通常但不完全是,基线血浆环状GMP水平根据一天中的时间而变化,白天清醒时水平较低,就寝后不久水平较高,并且人全天可能在2-8pmol/ml之间变化。因此,在施用组合物之前测量的基线血浆环状GMP水平和在施用本披露的组合物之后测量的血浆环状GMP水平可以每天在相同的预定时间发生。在描述平均基线的情况下,平均基线可以是给定受试者在24小时期间内对给定参数以至少4小时的间隔进行至少3次的平均基线测量。这控制了受试者间或个体间的可变性。在患有充血性心力衰竭的患者中,基线血浆环状GMP水平可能高2至3倍,并且基线是在每个个体受试者或受试者组的治疗之前建立的。与血压类似,将在药物施用前测量基线水平,并用作评估治疗效果的参考。没有任何已知健康病症症状的健康小鼠的基线cGMP水平为20(3.7)pmol/mL[平均值(SEM);n=8]或7(1.3)ng/mL[平均值(SEM);n=8]。没有任何已知健康病症症状的狗的基线cGMP水平为5-12ng/ml。
如将在实施例中证明的,当向患有癌症的受试者施用推注剂量的长效CNP衍生物时,癌症的生长停止和/或逆转,伴随着出人意料的血管正常化和抗癌免疫系统的激活。此外,当患有癌症的受试者通过施用推注剂量的长效CNP衍生物进行治疗时,观察到以下情况:血管正常化或外膜细胞包被指数增加至少10%(例如,至少15%,或至少20%)(例如,在肿瘤组织内),肿瘤尺寸减小,生存改善,肿瘤组织内的缺氧减少,癌症杀伤性细胞毒性T细胞的数量增加,激活的NK细胞数量增加,Treg细胞数量减少,髓系衍生的抑制细胞数量减少,TGFβ表达降低,Foxp3表达降低,肿瘤组织内的免疫检查点活性抑制,和/或Bv8表达降低。当患有对免疫检查点抑制剂有抗性或部分抗性的癌症的受试者用包含长效CNP衍生物和免疫检查点抑制剂的组合物共同治疗时,观察到功效显著改善,表明长效CNP衍生物可以增加免疫检查点抑制剂的功效。
本公开的特征在于治疗在任何组织或器官中具有异常血管的受试者(例如,哺乳动物受试者,需要其的患者)的方法,该方法是通过以下使血管正常化:向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。在一些实施例中,本披露涉及增加细胞毒性T细胞和/或激活的NK细胞的方法,该方法是通过向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。受试者还可以具有以下中的一项或多项:低数量的细胞毒性T细胞,低数量的激活的NK细胞,高数量的Treg细胞,TGFβ高水平表达,Foxp3高水平或表达,高数量的髓系衍生的抑制细胞或MDSC;和/或Bv8高水平或表达。例如,受试者可能具有异常的血管、低数量的细胞毒性T细胞和/或低数量的激活的NK细胞。在一些实施例中,受试者具有病症(i)至(viii):(i)低数量的细胞毒性T细胞,(ii)低数量的激活的NK细胞,(iii)高数量的Treg细胞,(iv)TGFβ高水平表达,(v)Foxp3高水平或表达,(vi)高数量的髓系衍生的抑制细胞或MDSC,(vii)Bv8高水平或表达;或(viii)其任何组合;或受试者需要(ix)至(xvi):(ix)细胞毒性T细胞数量增加;(x)激活的NK细胞增加;(xi)Treg细胞数量减少;(xii)TGF-β表达降低;(xiii)Foxp3表达降低;(xiv)髓系衍生的抑制细胞(MDSC)数量减少;(xv)Bv8表达降低,或(xvi)其任何组合。本披露的特征还在于通过以下来治疗患有癌症的受试者(例如,有需要的患者)的方法:激活受试者的免疫系统攻击肿瘤或癌症,增加细胞毒性T细胞和/或激活的NK细胞的数量,减少免疫抑制细胞(Treg细胞)的数量,减少免疫抑制细胞因子(转化生长因子β或TGFb或TGFβ),降低Foxp3(Treg标志物)和/或Bv8(髓系衍生的抑制细胞标志物或MDSC标志物),和/或使肿瘤组织中的血管正常化,这允许抗癌药物进入并减少缺氧(缺氧促进肿瘤生长/恶性肿瘤和免疫抵抗)。该方法包括向受试者施用治疗有效推注剂量的细胞毒性细胞免疫刺激剂组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。在一些实施例中,当施用给有需要的受试者时,治疗有效推注剂量的组合物使细胞毒性T细胞和/或NK细胞的数量比施用组合物之前的水平或比健康受试者中的水平增加至少15%(例如,至少20%,或至少30%)。治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过9%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平。
在一些实施例中,本公开的特征在于治疗在任何组织或器官中具有异常血管的受试者(例如,哺乳动物受试者,需要其的患者)的方法,该方法是通过以下使血管正常化:向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。在一些实施例中,本披露涉及增加细胞毒性T细胞和/或激活的NK细胞的方法,该方法是通过向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。受试者还可以具有以下中的一项或多项:低数量的细胞毒性T细胞,低数量的激活的NK细胞,高数量的Treg细胞,TGFβ高水平表达,Foxp3高水平或表达,高数量的髓系衍生的抑制细胞或MDSC;和/或Bv8高水平或表达。在一些实施例中,受试者可另外具有病症(i)至(viii):(i)低数量的细胞毒性T细胞,(ii)低数量的激活的NK细胞,(iii)高数量的Treg细胞,(iv)TGFβ高水平表达,(v)Foxp3高水平或表达,(vi)高数量的髓系衍生的抑制细胞或MDSC,(vii)Bv8高水平或表达;或(viii)其任何组合;或受试者需要(ix)至(xvi):(ix)细胞毒性T细胞数量增加;(x)激活的NK细胞增加;(xi)Treg细胞数量减少;(xii)TGF-β表达降低;(xiii)Foxp3表达降低;(xiv)髓系衍生的抑制细胞(MDSC)数量减少;(xv)Bv8表达降低,或(xvi)其任何组合。例如,受试者可能具有异常的血管、低数量的细胞毒性T细胞和/或低数量的激活的NK细胞。在一些实施例中,本披露的特征在于治疗患有具有以下一种或多种病症的癌症的受试者(例如,哺乳动物受试者,有此需要的患者)的方法:肿瘤;低数量的或不存在肿瘤组织内细胞毒性T细胞和/或激活的NK细胞;存在或高数量的免疫抑制细胞(例如,Treg细胞),存在或高水平的免疫抑制细胞因子(例如,转化生长因子β或TGFβ),高水平的Foxp3(例如,Treg标志物)阳性细胞,高水平的Bv8(髓系衍生的抑制细胞的标志物或MDSC标志物)阳性细胞,高数量的髓系衍生的抑制细胞或MDSC,和/或肿瘤组织中异常的血管,该方法允许抗癌药物进入并减少缺氧(缺氧促进肿瘤生长/恶性肿瘤和免疫抵抗)。该方法包括向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。在一些实施例中,当施用给有需要的受试者时,治疗有效推注剂量的组合物使细胞毒性T细胞和/或NK细胞的数量比施用组合物之前的水平或比健康受试者中的水平增加至少15%(例如,至少20%,或至少30%)。治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的血浆水平或健康受试者的血浆水平,其在人中为4+/-1pmol/ml或约1.4mg/ml,但在物种之间和所使用的分析中可以变化。参见,例如,Shotan等人,Plasma cyclic guanosinemonophosphate in chronic heart failure:hemodynamic and neurohormonalcorrelations and response to nitrate therapy[慢性心力衰竭中的血浆环磷酸鸟苷:血液动力学和神经激素相关性以及对硝酸盐治疗的反应].Clin Pharmacol Ther[临床药理学与治疗学],1993.54(6):第638-44页,以其整体并入本文。与未用治疗有效推注剂量的组合物治疗的受试者相比,用组合物治疗的受试者可具有增加的寿命或存活(参见,例如,图20)。
在优选的实施例中,给定标志物或参数的基线水平是药物施用前的测量水平,并且该水平可以因受试者变化。在实施本披露时,用作参考参数以评价治疗效果的任何基线参数通过治疗前的测量建立。通常但不完全是,基线血浆环状GMP水平根据一天中的时间而变化,白天清醒时水平较低,就寝后不久水平较高,并且人全天可能在2-8pmol/ml之间变化。因此,在施用组合物之前测量的基线血浆环状GMP水平和在施用本披露的组合物之后测量的血浆环状GMP水平可以每天在相同的预定时间发生。在描述平均基线的情况下,平均基线可以是给定受试者在24小时期间内对给定参数以至少4小时的间隔进行至少3次的平均基线测量。这控制了受试者间或个体间的可变性。在患有充血性心力衰竭的患者中,基线血浆环状GMP水平可能高2至3倍,并且基线是在每个个体受试者或受试者组的治疗之前建立的。与血压类似,将在药物施用前测量基线水平,并用作评估治疗效果的参考。没有任何已知健康病症症状的健康小鼠的基线cGMP水平为20(3.7)pmol/mL[平均值(SEM);n=8]或7(1.3)ng/mL[平均值(SEM);n=8]。没有任何已知健康病症症状的狗的基线cGMP水平为5-12ng/ml。
在一些实施例中,本公开的特征在于治疗在任何组织或器官中具有异常血管的受试者(例如,哺乳动物受试者,需要其的患者)的方法,该方法是通过以下使血管正常化:向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。在一些实施例中,本披露涉及增加细胞毒性T细胞和/或激活的NK细胞的方法,该方法是通过向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。受试者还可以具有以下中的一项或多项:低数量的细胞毒性T细胞,低数量的激活的NK细胞,高数量的Treg细胞,TGFβ高水平表达,Foxp3高水平或表达,高数量的髓系衍生的抑制细胞或MDSC;和/或Bv8高水平或表达。例如,受试者可能具有异常的血管、低数量的细胞毒性T细胞和/或低数量的激活的NK细胞。在一些实施例中,受试者可另外具有病症(i)至(viii):(i)低数量的细胞毒性T细胞,(ii)低数量的激活的NK细胞,(iii)高数量的Treg细胞,(iv)TGFβ高水平表达,(v)Foxp3高水平或表达,(vi)高数量的髓系衍生的抑制细胞或MDSC,(vii)Bv8高水平或表达;或(viii)其任何组合;或受试者需要(ix)至(xvi):(ix)细胞毒性T细胞数量增加;(x)激活的NK细胞增加;(xi)Treg细胞数量减少;(xii)TGF-β表达降低;(xiii)Foxp3表达降低;(xiv)髓系衍生的抑制细胞(MDSC)数量减少;(xv)Bv8表达降低,或(xvi)其任何组合。在一些实施例中,本披露的特征在于通过以下来治疗患有癌症的受试者(例如,有需要的患者)的方法:激活受试者的免疫系统攻击肿瘤或癌症,增加细胞毒性T细胞和/或激活的NK细胞的数量,减少免疫抑制细胞(例如,Treg细胞)的数量,减少免疫抑制细胞因子(例如,转化生长因子β或TGFβ),减少Foxp3(例如,Treg标志物),减少Bv8(髓系衍生的抑制细胞的标志物或MDSC标志物),减少髓系衍生的抑制细胞(MDSC)的数量,使肿瘤组织中的血管正常化,这允许抗癌药物进入并减少缺氧(缺氧促进肿瘤生长/恶性肿瘤和免疫抵抗)。与未用治疗有效推注剂量的组合物治疗的受试者相比,该治疗可增加受试者的寿命或存活。该方法包括向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),其包括超长效CNP衍生物。在一些实施例中,当施用给有需要的受试者时,治疗有效推注剂量的组合物使细胞毒性T细胞和/或NK细胞的数量比施用组合物之前的水平或比健康受试者中的水平增加至少15%(例如,至少20%,或至少30%)。治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,本公开的特征在于治疗在任何组织或器官中具有异常血管的受试者(例如,需要其的患者)的方法,该方法是通过以下使血管正常化:向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。在一些实施例中,本披露涉及增加细胞毒性T细胞和/或激活的NK细胞的方法,该方法是通过向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。受试者还可以具有以下中的一项或多项:低数量的细胞毒性T细胞,低数量的激活的NK细胞,高数量的Treg细胞,TGFβ高水平表达,Foxp3高水平或表达,高数量的髓系衍生的抑制细胞或MDSC;和/或Bv8高水平或表达。在一些实施例中,受试者可另外具有病症(i)至(viii):(i)低数量的细胞毒性T细胞,(ii)低数量的激活的NK细胞,(iii)高数量的Treg细胞,(iv)TGFβ高水平表达,(v)Foxp3高水平或表达,(vi)高数量的髓系衍生的抑制细胞或MDSC,(vii)Bv8高水平或表达;或(viii)其任何组合;或受试者需要(ix)至(xvi):(ix)细胞毒性T细胞数量增加;(x)激活的NK细胞增加;(xi)Treg细胞数量减少;(xii)TGF-β表达降低;(xiii)Foxp3表达降低;(xiv)髓系衍生的抑制细胞(MDSC)数量减少;(xv)Bv8表达降低,或(xvi)其任何组合。例如,受试者可能具有异常的血管、低数量的细胞毒性T细胞和/或低数量的激活的NK细胞。在一些实施例中,本披露的特征在于治疗患有具有以下一种或多种病症的癌症的受试者(例如,有此需要的患者)的方法:肿瘤;低数量的或不存在肿瘤组织内细胞毒性T细胞和/或激活的NK细胞;存在或高数量的免疫抑制细胞(例如,Treg细胞),存在或高水平的免疫抑制细胞因子(例如,转化生长因子β或TGFβ),高水平的Foxp3(例如,Treg标志物)阳性细胞,高水平的Bv8(髓系衍生的抑制细胞的标志物或MDSC标志物)阳性细胞,高数量的髓系衍生的抑制细胞或MDSC,和/或肿瘤组织中异常的血管,该方法允许抗癌药物进入并减少缺氧(缺氧促进肿瘤生长/恶性肿瘤和免疫抵抗)。该方法包括向受试者施用治疗有效推注剂量的细胞毒性细胞免疫刺激剂组合物,其包括长效CNP衍生物和/或超长效CNP衍生物。在一些实施例中,当施用给有需要的受试者时,治疗有效推注剂量的组合物使细胞毒性T细胞和/或NK细胞的数量比施用组合物之前的水平或比健康受试者中的水平增加至少15%(例如,至少20%,或至少30%)。治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,本披露的特征在于治疗患有与肿瘤相关的纤维化的受试者(例如,有此需要的患者)的方法,该方法是通过以下使血管正常化:向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合。与纤维化相关的标志物(例如,α-SMA、TGFβ和/或Ang 2)的表达可以在施用后降低。
在一些实施例中,具有异常血管的受试者(例如,哺乳动物受试者,有此需要的患者)可以患有癌症。在一些实施例中,患有癌症的受试者患有以下癌症中的一种或多种:套细胞淋巴瘤、原发性CNS淋巴瘤、伯基特淋巴瘤、边缘区B细胞淋巴瘤、真性红细胞增多症淋巴瘤、霍奇金病、非霍奇金病、实体瘤、肉瘤、上皮癌、纤维肉瘤、黏液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤(lymphangioendotheliosarcoma)、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠肉瘤、结直肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌(medullary carcinoma)、支气管源性癌、肾细胞癌、肝细胞癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、威尔姆斯瘤、宫颈癌、子宫癌、睾丸肿瘤、肺癌、小细胞肺癌、非小细胞肺癌、膀胱癌、上皮细胞癌、神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、黑色素瘤、成神经细胞瘤、视网膜母细胞瘤、鼻咽癌、食管癌、基底细胞癌、胆道癌、膀胱癌、骨癌、脑和中枢神经系统(CNS)癌、宫颈癌、绒毛膜癌、结直肠癌、结缔组织癌、消化系统癌、子宫内膜癌、食道癌、眼癌、头颈癌、胃部癌、上皮内肿瘤、肾癌、喉癌、肝癌、肺癌(小细胞和/或大细胞)、黑色素瘤、神经母细胞瘤;口腔癌(例如唇、舌、口和咽)、卵巢癌、胰腺癌、视网膜母细胞瘤、横纹肌肉瘤、直肠癌、呼吸系统癌、肉瘤、皮肤癌、胃癌、睾丸癌、甲状腺癌、子宫癌、和泌尿系统癌。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺、结肠、头、颈、肝、肾、子宫颈、肺、胃、尿道、膀胱、输尿管、肾盂、直肠、食道、淋巴结、胰腺、胃、卵巢、中枢神经系统、软组织和/或内分泌腺。向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺、结肠、头、颈、肝、肾、子宫颈、肺、胃、尿道、膀胱、输尿管、肾盂、直肠、食道、淋巴结、胰腺、胃、卵巢、中枢神经系统、软组织和/或内分泌腺。向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),其包括长效CNP衍生物。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺和/或结肠。向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺和/或结肠。向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),其包括长效CNP衍生物。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,上述方法中任一种中的癌症包括以下器官中的一个或多个中的实体瘤:胰腺、膀胱、结肠直肠、乳房、前列腺、肾、肝、肺、卵巢、子宫颈、胃、食道、头、颈、皮肤、内分泌腺、中枢神经系统、骨骼和/或软组织。
长效NPRB激动剂或超长效NPRB激动剂可包括多肽,例如抗体。在一些实施例中,长效NPRB激动剂或超长效NPRB激动剂包括分子量小于2kDa的分子。
在一些实施例中,在任何一种上述方法中,组合物对NPRA具有有限的或没有激动活性和/或对NPRB受体具有比NPRA受体高5倍的结合亲和力(或低5倍的EC50)。
在一些实施例中,本披露的组合物的治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,本披露的组合物的治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的15%的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,本披露的组合物的治疗有效推注剂量不会降低血压超过10%,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,本披露的组合物的治疗有效推注剂量不会降低血压超过5%,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,对于上述方法中的任何一种,向受试者施用包括诸如肠内(例如,口服)施用或肠胃外施用的施用方法。肠胃外施用的实例是皮下、静脉内、肌肉内、通过吸入、经鼻或其任何组合。在一些实施例中,上述方法可包括肠内(例如,口服)施用和/或皮下施用。在某些实施例中,上述方法包括静脉内施用。在一些实施例中,上述方法包括肌内施用。在一些实施例中,上述方法包括通过吸入施用(例如,通过气管内吸入施用,其中受试者暴露于高气溶胶浓度以使得活性药物成分直接沉积在下呼吸道中)。在某些实施例中,上述方法包括经鼻施用。在一些实施例中,上述方法包括肠内(例如,口服)施用。
在一些实施例中,对于上述方法中的任一种,向受试者施用基本上由以下组成或由以下组成:以推注剂量形式施用本披露的组合物。在一些实施例中,对于上述方法中的任一种,向受试者施用不包括在持续的时间段内通过输注施用本披露的组合物(例如,通过连续输注)。在一些实施例中,对于任何上述方法,向受试者施用不包括将本披露的组合物作为推注剂量施用然后在持续的时间段内输注。在一些实施例中,对于上述方法中的任一种,向受试者施用不包括本披露的组合物的肠内或口服施用。在一些实施例中,对于上述方法中的任一种,向受试者施用不包括口服施用本披露的组合物。
活性药物成分
对于上述任何方法,长效CNP衍生物或超长效CNP衍生物可包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2];U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3];GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4];和/或U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.12],其中U连接到N末端G、C和/或K残基的ε氨基。
在一些实施例中,以上序列中的U是式(I)或(II)的部分,其中式(I)是
(脂肪族)
(I)
其中:
a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);或者
X是接头(γE)
其中B是1-8个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自2-[2-(2-氨基乙氧基)乙氧基]乙酸残基、Gly、Ala、Leu、Ser、Arg、和Lys;
m是0、1、2或3;
n是0、1、2或3;以及
m和n之和至少为1,
并且式(II)是
(聚合物)
(II)
其中a是0或1(优选a是1);
聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)、聚(N-乙烯基吡咯烷酮)或其衍生物;
Y是:
1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;
含有氨基酸残基的接头,其中氨基酸残基共价连接至(聚合物)
不同于1-10个氨基酸残基或肽序列的肽接头。
在一些实施例中,在上式(II)中,Y是接头(γE)
在本披露中,小写字母“x”是指其出现的肽序列中的天然或非天然氨基酸残基。大写X是指式(I)和(II)中的接头。在一些实施例中,x不是甲硫氨酸残基(M),不是天冬酰胺残基(N),或既不是甲硫氨酸残基(M)也不是天冬酰胺残基(N)。在一些实施例中,x不是由哺乳动物遗传密码编码的20个天然氨基酸残基中的任何一个,例如氨基酸A、C、D、E、F、G、H、I、K、L、M、N、P、Q、R、S、T、V、W、和Y。在一些实施例中,x是非天然氨基酸残基(即,不是由哺乳动物遗传密码编码的氨基酸残基)。在一些实施例中,x是高谷氨酰胺(本文也称为homoQ)。
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2];其中U连接到GLSKGCFGLKLDRIGSMSGLGC的N末端G,并且U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC[SEQ ID NO.12]其中x是天然或非天然氨基酸残基且U具有式(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC[SEQ ID NO.30]其中x是天然或非天然氨基酸残基且前提是x不是M(甲硫氨酸);U具有式(脂肪族)
在一些实施例中,x不是甲硫氨酸残基,不是天冬酰胺残基,或既不是甲硫氨酸残基也不是天冬酰胺残基。在一些实施例中,x不是由哺乳动物遗传密码编码的20个天然氨基酸残基中的任何一个,例如氨基酸A、C、D、E、F、G、H、I、K、L、M、N、P、Q、R、S、T、V、W、和Y。在一些实施例中,x是非天然氨基酸残基(即,不是由哺乳动物遗传密码编码的氨基酸残基)。在一些实施例中,x是高谷氨酰胺(本文也称为homoQ)。
在一些实施例中,长效CNP衍生物或超长效CNP衍生物可包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2];U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3];GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4];和/或U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.12],或其任何组合;
其中:
U是式(I)的部分,其中式(I)是
(脂肪族)
(I)
其中
a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);或
X是接头(γE)
其中B是1-8个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自2-[2-(2-氨基乙氧基)乙氧基]乙酸残基、Gly、Ala、Leu、Ser、Arg、和Lys;
m是0、1、2或3;
n是0、1、2或3;以及
m和n之和至少为1。
在一些实施例中,U-CFGLKLDRIGSxSGLGC[SEQ ID NO.12]中的x不是甲硫氨酸残基,不是天冬酰胺残基,或既不是甲硫氨酸残基也不是天冬酰胺残基。在一些实施例中,x不是由哺乳动物遗传密码编码的20个天然氨基酸残基中的任何一个,例如氨基酸A、C、D、E、F、G、H、I、K、L、M、N、P、Q、R、S、T、V、W、和Y。在一些实施例中,x是非天然氨基酸残基(即,不是由哺乳动物遗传密码编码的氨基酸残基)。在一些实施例中,x是高谷氨酰胺(本文也称为homoQ)。
在一些实施例中,X是4-7个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G)。
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],
其中:
U是(脂肪族)
其中:
a是1;
脂肪族是任选地经取代的C
X是1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D)。
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC[SEQ ID NO.13],x是高谷氨酰胺;U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC[SEQ ID NO.14],x是高谷氨酰胺;U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC[SEQ ID NO.15],x是高谷氨酰胺;U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.12],其中U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC,其中x是高谷氨酰胺(homoQ)[SEQ ID NO.16],U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC,其中x是高谷氨酰胺(homoQ)[SEQ ID NO.17],U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC,其中x是高谷氨酰胺(homoQ)[SEQ ID NO.18],U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-CFGLKLDRIGSxSGLGC,其中x是高谷氨酰胺(homoQ)[SEQ ID NO.19],U是(脂肪族)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物U-CFGLKLDRIGSxSGLGC是HOC(=O)(CH
在一些实施例中,长效CNP衍生物或超长效CNP衍生物U-CFGLKLDRIGSxSGLGC是HOC(=O)(CH
在一些实施例中,在本文的任何定义中,脂肪族不包括以下中的一个或多个:直链或支链的任选地经取代的C
在一些实施例中,如上所述的U包括CH
在一些实施例中,本披露的长效CNP衍生物包括CH
在某些实施例中,本披露的长效CNP衍生物包括CH
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.27],或其任何组合;
其中U是式(II)的部分,其中式(II)是
(聚合物)
(II)
其中a是0或1(优选a是1);
该聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)或聚(N-乙烯基吡咯烷酮);
Y是:
4-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;或
接头(γE)
在一些实施例中,长效CNP衍生物或超长效CNP衍生物包括U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3],或其任何组合;
其中U是式(II)的部分,其中式(II)是
(聚合物)
(II)
其中a是0或1(优选a是1);
聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)、聚(N-乙烯基吡咯烷酮)或其衍生物;
Y是:
1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;
含有氨基酸残基的接头,其中氨基酸残基共价连接至(聚合物)
不同于1-10个氨基酸残基或肽序列的肽接头。
在一些实施例中,上式(II)中的Y是接头(γE)
在一些实施例中,该聚合物不包括聚(乙二醇)、MPEG、或聚(乙二醇)和MPEG两者。
在一些实施例中,Y是4-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G);或接头(γE)
在一些实施例中,Y是4-10个氨基酸残基的序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G)。
在一些实施例中,Y是接头(γE)
在一些实施例中,本披露的CNP或其衍生物不包括在SEQ ID NO.10的位置4和10处的赖氨酸残基处和/或在SEQ ID NO.10的CNP的N末端处经聚亚烷基二醇修饰的CNP。
在一些实施例中,包含本披露的长效CNP衍生物的配制品包括与聚合物赋形剂一起配制的一种或多种CNP或其衍生物,该聚合物赋形剂包括用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)。该聚合物适于螯合或非共价结合一种或多种CNP衍生物。
在一些实施例中,包含本披露的超长效CNP衍生物的配制品包括与聚合物赋形剂一起配制的一种或多种长效CNP衍生物,该聚合物赋形剂包括用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)。该聚合物适于螯合或非共价结合一种或多种CNP衍生物。
在一些实施例中,包含本披露的一种或多种长效NPRB激动剂的配制品包括与聚合物赋形剂一起配制的一种或多种CNP或其衍生物,该聚合物赋形剂包括用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)。该聚合物适于螯合或非共价结合一种或多种NPRB激动剂。
在一些实施例中,包含本披露的超长效NPRB激动剂的配制品包括与聚合物赋形剂一起配制的一种或多种长效CNP衍生物,该聚合物赋形剂包括用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)。该聚合物适于螯合或非共价结合一种或多种NPRB激动剂。
用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)可包括可具有D-或L-手性或两者且为直链均聚物的聚(氨基酸)。在一个具体的实施例中,直链均聚物包括聚赖氨酸、聚鸟氨酸、聚精氨酸、聚谷氨酸、聚天冬氨酸、聚丝氨酸、聚酪氨酸或由氨基酸制成的任何其他酰胺连接的均聚物。在另一个优选的实施例中,直链疏水均聚物包括聚丙氨酸、聚缬氨酸、聚亮氨酸、聚异亮氨酸、聚甘氨酸或聚苯丙氨酸。在一些实施例中,聚(氨基酸)是聚赖氨酸。
制备活性药物成分的方法
本披露的肽,例如长效CNP、长效CNP衍生物和长效NPRB激动剂,可以使用本领域普通技术人员已知的方法通过固相肽合成(SPPS)进行合成。例如,起始固体支持物,如H-Cys(Trt)-2-Cl-Trt树脂(毕得医药科技股份有限公司(BLDPharm),上海,中国)可用于肽合成仪中,如自动微波肽合成仪(例如,LibertyBlue HT12,CEM,马修斯(Matthews),北卡罗来纳州)。可以使用本领域普通技术人员已知的Fmoc化学将每个氨基酸、脂肪酸或受保护的烷基羧(二)酸依次锚定到肽树脂上,从而产生与树脂连接的线性的受保护的肽。线性粗肽可以通过在碳正离子清除剂和乙醚沉淀存在下用三氟乙酸酸解来脱保护并从树脂释放。得到的线性肽可以环化,例如通过溶解在DMSO和乙腈水溶液中并反应形成二硫键。最后,肽可以通过反相HPLC纯化和表征(例如,1260Infinity II制备型LC系统,圣克拉拉,加利福尼亚州)。可以收集最终肽产品纯度>90%的级分并干燥为白色粉末。
在一些实施例中,包含本披露的活性药物成分(“API”)的配制品具有的聚合物赋形剂相对于API的重量比使得所得混合物是长效或超长效的。例如,聚合物赋形剂与总API的重量比可为5:1至100:1、10:1至50:1或20:1至5:1。聚合物赋形剂适于螯合或非共价结合API。聚合物赋形剂的实例在以下中有所描述:例如Castillo等人,Pharm.Res.[药学研究],(2012)29(1);第306-18页;Castillo等人,PLoS One[公共科学图书馆·综合],(2017)12(2);e0171703;和美国专利号10,507,248;10,035,885和10,010,613,其各自通过引用以其整体并入本文中。聚合物赋形剂可以是但不限于以下聚赖氨酸:在ε氨基处用PEG接枝,其水平在总ε氨基酸的10-55%水平(例如,10-35%或30-55%),并且其余氨基基团接枝有烷基基团和/或阴离子部分,例如硫酸盐、磺酸盐、羧基、磷酸盐或膦酸盐。制备聚合物赋形剂的方法是本领域已知的。
简而言之,在一些实施例中,聚合物赋形剂是通过以下程序制备的聚合物。溶解聚-L-赖氨酸(20PL)、氢溴酸盐(21μmol或1g;西格玛公司(Sigma),平均Mw=26kDa;d.p.126),并通过TNBS滴定法确定NH
虽然上文描述了具有C
用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)可包括可具有D-或L-手性或两者且为直链均聚物的聚(氨基酸)。在一个具体的实施例中,直链均聚物包括聚赖氨酸、聚鸟氨酸、聚精氨酸、聚谷氨酸、聚天冬氨酸、聚丝氨酸、聚酪氨酸或由氨基酸制成的任何其他酰胺连接的均聚物。在另一个优选的实施例中,直链疏水均聚物包括聚丙氨酸、聚缬氨酸、聚亮氨酸、聚异亮氨酸、聚甘氨酸或聚苯丙氨酸。在一些实施例中,聚(氨基酸)是聚赖氨酸。
亲水性侧链的实例包括聚乙二醇,它可以被二羧酸酯化形成聚(乙二醇)单酯;甲氧基聚(乙二醇)单酯(MPEG)或聚(乙二醇)和聚(丙二醇)单酯以酯的形式与二羧酸的共聚物,该二羧酸给该共聚物的末端赋予羧基基团,该羧基基团可用于将该共聚物共价连接至聚(氨基酸)。其他形式包括聚(乙二醇)-羧基;甲氧基聚(乙二醇)-羧基;聚(乙二醇)-羧基甲基;甲氧基聚(乙二醇)-羧基甲基;聚(乙二醇)单胺;甲氧基聚(乙二醇)单胺;聚(乙二醇)酰肼;甲氧基聚(乙二醇)酰肼;甲氧基聚(乙二醇)咪唑啉;聚(乙二醇)和以聚氨基酸、多糖、聚酰胺胺、聚乙烯亚胺为代表的一种或几种聚合物的嵌段共聚物,其中这些嵌段交替以形成线性嵌段共聚物。在一个实施例中,保护链的总分子量可以大于300道尔顿但不超过10,000道尔顿。在一个实施例中,一条或多条保护链通过单个连接而连接至聚(氨基酸)主链。
不希望受理论的束缚,据信当将API组合物施用于受试者时,聚合物赋形剂与API的重量比越高,血浆中的存在越持久,并且血浆环状GMP高于基线的升高越持久。
在一些实施例中,包含本披露的长效CNP、长效CNP衍生物和/或长效NPRB激动剂的配制品具有的聚合物赋形剂相对于CNP、CNP衍生物和/或NPRB激动剂的重量比使得所得混合物是长效CNP、长效CNP衍生物和/或长效NPRB激动剂。例如,聚合物赋形剂与CNP、CNP衍生物和/或NPRB激动剂的重量比可为5:1至100:1、10:1至50:1或20:1至5:1。聚合物赋形剂可以包括用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)。参见,例如,Castillo等人,Pharm.Res.[药学研究],(2012)29(1);第306-18页;Castillo等人,PLoS One[公共科学图书馆·综合],(2017)12(2);e0171703;和美国专利号10,507,248;10,035,885;10,010,613,其各自通过引用以其整体并入本文中。聚合物赋形剂适于螯合或非共价结合CNP、CNP衍生物和/或NPRB激动剂。聚合物赋形剂可以是但不限于以下聚赖氨酸:在ε氨基处用PEG接枝,其水平在总ε氨基酸的30-55%或10-35%水平,并且其余氨基基团接枝有烷基基团和/或阴离子部分,例如硫酸盐、磺酸盐、羧基、磷酸盐或膦酸盐。制备聚合物赋形剂的方法是本领域已知的。不希望受理论的束缚,据信当将CNP、CNP衍生物和/或NPRB激动剂组合物施用于受试者时,聚合物赋形剂与CNP、CNP衍生物和/或NPRB激动剂的重量比越高,血浆中CNP、CNP衍生物或NPRB激动剂的存在越持久,并且血浆环状GMP高于基线的升高越持久。
在一些实施例中,超长效CNP、超长效CNP衍生物和/或超长效NPRB激动剂配制品包括CNP、CNP衍生物和/或NPRB激动剂和聚合物赋形剂,其中聚合物赋形剂相对于CNP、CNP衍生物和/或NPRB激动剂的重量比使得所得混合物是超长效CNP、超长效CNP衍生物和/或超长效NPRB激动剂。例如,聚合物赋形剂与CNP、CNP衍生物和/或NPRB激动剂的重量比可为5:1至100:1、10:1至50:1或20:1至5:1。聚合物赋形剂可以包括用聚乙二醇、脂肪酸和/或阴离子部分接枝的聚(氨基酸)。参见,例如,Castillo等人,Pharm.Res.[药学研究],(2012)29(1);第306-18页;Castillo等人,PLoS One[公共科学图书馆·综合],(2017)12(2);e0171703;和美国专利号10,507,248;10,035,885;10,010,613,其各自通过引用以其整体并入本文中。聚合物赋形剂适于螯合或非共价结合CNP、CNP衍生物和/或NPRB激动剂。聚合物赋形剂可以是但不限于以下聚赖氨酸:在ε氨基处用PEG接枝,其水平在总ε氨基酸的30-55%或10-35%水平,并且其余氨基基团接枝有烷基基团和/或阴离子部分,例如硫酸盐、磺酸盐、羧基、磷酸盐或膦酸盐。制备聚合物赋形剂的方法是本领域已知的。不希望受理论的束缚,据信当将CNP、CNP衍生物和/或NPRB激动剂组合物施用于受试者时,聚合物赋形剂与CNP、CNP衍生物和/或NPRB激动剂的重量比越高,血浆中CNP、CNP衍生物和/或NPRB激动剂的存在越持久,并且血浆环状GMP高于基线的升高越持久。
组合癌症治疗
在本发明的另一个实施例中,上述任一种治疗癌症的方法还包括施用一种或多种免疫检查点抑制剂。一种或多种免疫检查点抑制剂可包括结合和/或阻断以下中任一种的作用的一种或多种抗体/蛋白或化合物:CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD1(程序性细胞死亡蛋白1或CD279)、PD-L1(程序性死亡配体1)、PD-L2(程序性死亡配体2)、LAG-3(淋巴细胞激活基因3蛋白)、BTLA(B和T淋巴细胞衰减子)、B7H3((CD276,其是B7和CD28家族的免疫检查点成员)、B7H4(B7家族的分子,负调节T细胞免疫)和/或TIM-3(在产生IFN-γ的T细胞上表达的共抑制受体)。包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合的组合物的治疗有效推注剂量可以在一种或多种免疫检查点抑制剂之前、同时或之后施用。
在一些实施例中,本披露的任一种治疗癌症的方法进一步包括施用CAR-T细胞。组合物的治疗有效推注剂量包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂、或其任何组合;和/或一种或多种免疫检查点抑制剂可以在CAR-T细胞静脉内施用之前、同时或之后施用。
在一些实施例中,本披露的任一种治疗癌症的方法进一步包括施用抗体。例如,抗体可以是抗PD1抗体)。在一些实施例中,可以在包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合的组合物与抗体一起时观察到协同作用。
在一些实施例中,本披露的任一种治疗癌症的方法进一步包括施用一种或多种佐剂,例如CpG寡脱氧核苷酸(ODN)、Toll样受体9激动剂;或CpG寡脱氧核苷酸。在一些实施例中,可以在包含长效C型利尿钠肽(CNP)、CNP衍生物、长效CNP衍生物、长效CNP受体(NPRB)激动剂或其任何组合的组合物与佐剂一起时观察到协同作用。
在一些实施例中,本披露的特征在于一种治疗患有以下器官中的一种或多种癌症的受试者(例如,哺乳动物受试者,有需要的患者)的方法:皮肤、乳房、骨骼、前列腺、结肠、头、颈、肝、肾、子宫颈、肺、胃、尿道、膀胱、输尿管、肾盂、直肠、食道、淋巴结、胰腺、胃、卵巢、中枢神经系统、软组织和/或内分泌腺。该方法包括向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。该方法进一步包括施用免疫检查点抑制剂,例如结合和/或阻断以下中任一种的作用的一种或多种抗体/蛋白或化合物:CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD1(程序性细胞死亡蛋白1或CD279)、PD-L1(程序性死亡配体1)、PD-L2(程序性死亡配体2)、LAG-3(淋巴细胞激活基因3蛋白)、BTLA(B和T淋巴细胞衰减子)、B7H3((CD276,其是B7和CD28家族的免疫检查点成员)、B7H4(B7家族的分子,负调节T细胞免疫)和/或TIM-3(在产生IFN-γ的T细胞上表达的共抑制受体)。在一些实施例中,该方法进一步包括向受试者施用免疫佐剂,其中该免疫佐剂调节toll样受体,或细胞毒性细胞免疫刺激剂,该细胞毒性细胞免疫刺激剂包含靶向选自以下的免疫检查点蛋白的治疗剂(例如蛋白质和/或小分子化合物)或抗体:CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD1(程序性细胞死亡蛋白1或CD279)、PD-L1(程序性死亡配体1)、PD-L2(程序性死亡配体2)、LAG-3(淋巴细胞激活基因3蛋白)、BTLA(B和T淋巴细胞衰减子)、B7H3((CD276,B7和CD28家族的免疫检查点成员)、B7H4(B7家族的分子,负调节T细胞免疫)和TIM-3(在产生IFN-γ的T细胞上表达的共抑制受体);其中该细胞毒性细胞免疫刺激剂抑制免疫检查点蛋白;或进一步施用细胞毒性细胞免疫刺激剂,包括针对免疫检查点蛋白的抗体或抗体的一部分、免疫检查点蛋白的可溶性配体、派姆单抗、纳武单抗、伊匹单抗、阿特利珠单抗、阿维鲁单抗、度伐鲁单抗、西米普利单抗、曲美利木单抗、兰博单抗和/或匹地利珠单抗;或进一步施用免疫佐剂,其是toll样受体9激动剂;或者进一步施用免疫,其是CpG寡脱氧核苷酸。组合物的治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时、12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺、结肠、头、颈、肝、肾、子宫颈、肺、胃、尿道、膀胱、输尿管、肾盂、直肠、食道、淋巴结、胰腺、胃、卵巢、中枢神经系统、软组织和/或内分泌腺。该方法包括向受试者施用治疗有效推注剂量的组合物(例如,细胞毒性细胞免疫刺激剂组合物),该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。在一些实施例中,该方法进一步包括施用针对免疫检查点蛋白和/或免疫检查点蛋白的可溶性配体的抗体或抗体的一部分。例如,该方法进一步可包括施用一种或多种免疫检查点蛋白抗体,包括派姆单抗、纳武单抗、伊匹单抗、阿特利珠单抗、阿维鲁单抗、度伐鲁单抗、西米普利单抗、曲美利木单抗、兰博单抗和/或匹地利珠单抗。治疗有效推注剂量是不会降低或导致血压(或平均动脉压)降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%)的剂量,其中基线血压测量值是组合物施用前的平均血压,但该剂量可施用后1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时、12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),其中基线血浆环状GMP水平定义为推注剂量施用前的平均血浆水平或健康受试者的平均血浆水平(优选地,在给受试者施用组合物之前的平均血浆环状GMP水平)。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺、结肠、头、颈、肝、肾、子宫颈、肺、胃、尿道、膀胱、输尿管、肾盂、直肠、食道、淋巴结、胰腺、卵巢、中枢神经系统、软组织和/或内分泌腺。该方法包括向受试者施用治疗有效推注剂量的包括长效CNP衍生物的细胞毒性细胞免疫刺激剂组合物。该方法进一步包括施用免疫检查点抑制剂,该免疫检查点抑制剂选自结合和/或阻断以下中任一种的作用的一种或多种抗体/蛋白或化合物:CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD1(程序性细胞死亡蛋白1或CD279)、PD-L1(程序性死亡配体1)、PD-L2(程序性死亡配体2)、LAG-3(淋巴细胞激活基因3蛋白)、BTLA(B和T淋巴细胞衰减子)、B7H3((CD276,其是B7和CD28家族的免疫检查点成员)、B7H4(B7家族的分子,负调节T细胞免疫)、TIM-3(在产生IFN-γ的T细胞上表达的共抑制受体)。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺、结肠、头、颈、肝、肾、子宫颈、肺、胃、尿道、膀胱、输尿管、肾盂、直肠、食道、淋巴结、胰腺、胃、卵巢、中枢神经系统、软组织和/或内分泌腺。方法包括向受试者施用治疗有效推注剂量的包括长效CNP衍生物的细胞毒性细胞免疫刺激剂组合物。在一些实施例中,该方法进一步包括施用针对免疫检查点蛋白和/或免疫检查点蛋白的可溶性配体的抗体或抗体的一部分。例如,该方法进一步可包括施用一种或多种免疫检查点蛋白抗体,包括派姆单抗、纳武单抗、伊匹单抗、阿特利珠单抗、阿维鲁单抗、度伐鲁单抗、西米普利单抗、曲美利木单抗、兰博单抗和/或匹地利珠单抗。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺和/或结肠。该方法包括向受试者施用治疗有效推注剂量的细胞毒性细胞免疫刺激剂组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。该方法进一步包括施用免疫检查点抑制剂,该免疫检查点抑制剂选自结合和/或阻断以下中任一种的作用的一种或多种抗体/蛋白或化合物:CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD1(程序性细胞死亡蛋白1或CD279)、PD-L1(程序性死亡配体1)、PD-L2(程序性死亡配体2)、LAG-3(淋巴细胞激活基因3蛋白)、BTLA(B和T淋巴细胞衰减子)、B7H3((CD276,其是B7和CD28家族的免疫检查点成员)、B7H4(B7家族的分子,负调节T细胞免疫)和/或TIM-3(在产生IFN-γ的T细胞上表达的共抑制受体)。治疗有效推注剂量是如上所述的剂量。
在一些实施例中,患有癌症的受试者(例如,哺乳动物受试者,有此需要的患者)患有以下器官中的一种或多种癌症:皮肤、乳房、骨骼、前列腺和/或结肠。该方法包括向受试者施用治疗有效推注剂量的细胞毒性细胞免疫刺激剂组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂和/或超长效NPRB激动剂。在一些实施例中,方法进一步包括施用针对免疫检查点蛋白和/或免疫检查点蛋白的可溶性配体的抗体或抗体的一部分。例如,该方法进一步可包括施用一种或多种免疫检查点蛋白抗体,包括派姆单抗、纳武单抗、伊匹单抗、阿特利珠单抗、阿维鲁单抗、度伐鲁单抗、西米普利单抗、曲美利木单抗、兰博单抗和/或匹地利珠单抗。治疗有效推注剂量是如上所述的剂量。
在上述任一方法中,皮肤癌可包括梅克尔细胞癌、鳞状细胞癌和/或黑色素瘤;肝癌可包括肝细胞癌;肾癌可包括肾细胞癌;肺癌可包括小细胞或非小细胞肺癌;乳腺癌可包括三阴性乳腺癌;胃癌可包括胃部癌、食管交界处腺癌、和/或dMMR;淋巴结可包括霍奇金或非霍奇金PMBCL;胰腺癌和/或卵巢癌可各自包括dMMR;和/或肾盂区域周围器官的癌症可包括尿路上皮癌。
提供以下实例以说明而非限制本披露。
实例
实例中使用的所有肽均通过固相肽合成(SPPS)以H-Cys(Trt)-2-Cl-Trt树脂(0.54mmol/g)作为起始固体支持物(毕得医药科技股份有限公司(BLDPharm),上海,中国)在自动微波肽合成仪(LibertyBlue HT12,CEM,马修斯(Matthews),北卡罗来纳州)中合成。使用本领域普通技术人员已知的Fmoc化学将肽的每个组成分子,例如氨基酸、脂肪酸或受保护的烷基二酸依次锚定到肽树脂上,从而产生与树脂连接的线性的受保护的肽。线性粗肽可以通过在碳正离子清除剂和乙醚沉淀存在下用三氟乙酸酸解来脱保护并从树脂释放。通过溶解在10%DMSO和20%乙腈水溶液中使所得线性肽环化,并使其反应至少两天以提供二硫键形成。最后,使用含0.1%三氟乙酸(TFA)的10%乙腈水溶液和含0.1%TFA的乙腈的梯度,通过反相HPLC(1260Infinity II制备型LC系统,圣克拉拉,加利福尼亚州)纯化和表征肽。该梯度在Waters 30x150mm XBridge C18柱(P/N 186003284)和Waters C18柱(P/N186006893)上以40mL/min在室温运行24分钟,并在214nm处采集。收集纯度>90%的肽级分并干燥为白色粉末,以提供最终的肽产品。
实例1:当作为推注施用时,长效CNP的体内性能优于天然CNP
用于该研究的所有小鼠都保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食,东方酵母有限公司(Oriental Yeast Co.,Ltd.)东京,日本或PicoLab啮齿动物饮食20,LabDiet公司,圣路易斯,密苏里州)。
对于药代动力学研究,雌性CD-1小鼠(6-8周龄,来自查尔斯河实验室(Charlesriver laboratory))用2.0mg/Kg天然人CNP(Chempep公司(Chempep Inc.)惠灵顿,佛罗里达州)、长效CNP衍生物(dCNP,Chempep公司.惠灵顿,佛罗里达州)或超长效CNP衍生物(VLA-dCNP)通过肩胛骨之间的皮下施用进行处理。所有测试品均配制或溶解在100mM山梨糖醇、100mM甲硫氨酸、20mM组氨酸,pH 6.0中。不同时间(对于天然CNP为0、0.5、1、2、3、4、5和24;对于dCNP和VLA-dCNP为0、1、2、4、8、12、24、48和72)的血液采样是通过眼眶后抽血进行的,每只动物在两个不同的时间点抽血两次。血液样品在K
对于环状GMP反应研究的药效学研究,将雄性C57BL/6J小鼠(6周龄,来自Kyudo;佐贺,日本)用1.0mg/Kg的天然人CNP、长效CNP衍生物(dCNP)和超长效CNP衍生物(VLA-dCNP)通过肩胛骨之间的皮下推注施用进行处理。所有测试品均配制或溶解在100mM蔗糖、100mM甲硫氨酸、50mM组氨酸,pH 7.4中。不同时间(对于天然CNP和dCNP为0、1、4、8、12和24小时;对于dCNP和VLA-dCNP为0、1、2、4、8、5、24和48小时)的血液采样是通过剖腹手术后腹主动脉采血进行的,每个时间点每只动物一次抽血。为了获得血浆,将EDTA(终浓度1.5mg/mL(Dojindo,熊本,日本))和抑肽酶(终浓度500KIU/mL(西格玛奥德里奇公司(SigmaAldrich),密苏里州圣路易斯))添加到血液中并离心(x 2,000g;15分钟,4C)。收获上清液后,将血浆样品储存在-80℃。通过来自CisBio(Codolet,法国)的市售环状GMP试剂盒分析血浆样品。CNP是天然人CNP(GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.10])并且dCNP是具有以下序列的人CNP的添加型衍生物:CH
参见图1A,显示了在皮下施用2.0mg/Kg天然CNP、CNP衍生物(dCNP)和超长效CNP衍生物(VLA-dCNP)的量后的CD-1小鼠中的血浆CNP[平均(SD);n=5]。插图是左下角的放大比例,以显示当施用天然CNP时CNP(菱形)的低血浆水平。误差棒表示n=5个血浆样品的标准偏差。施用前的基线CNP水平为1.74(0.6)ng/mL[平均(SD);n=15]。图1B的图显示在皮下施用1.0mg/Kg天然CNP、长效CNP衍生物(dCNP)和超长效CNP衍生物(VLA-dCNP)的量后,使用来自CisBio[Codolet,法国]的环状GMP试剂盒测量的雄性C57BL/6J小鼠中的血浆环状GMP。基线血浆环状GMP水平为20(3.7)pmol/mL[平均值(SEM);n=8]或7(1.3)ng/mL[平均值(SEM);n=8]。在2小时及以后,与基线相比,天然CNP的皮下施用没有显著升高血浆环状GMP,而长效CNP(dCNP和VLA-dCNP)的类似施用显示环状GMP显著升高至少24小时。
实例2:推注施用高剂量超长效CNP衍生物(VLA-dCNP)可增加血浆环状GMP,但出人
在这项研究中,针对三种不同的长效利尿钠肽评估了心血管和血液动力学效应(这三种不同的长效利尿钠肽是超长效ANP衍生物或VLA-dANP;以与dCNP类似的方式修饰的ANP,其中VLA-ANP是CH
所有利尿钠肽都通过引起细胞质环状GMP生成增加来发挥作用,据信这会导致相应的血压下降。然而,参考图2A和2B,当比较3种主要利尿钠肽的超长效形式的推注剂量时,出人意料地发现本披露的超长效CNP衍生物的高推注剂量(足以使血液环状GMP增加3天)可以增加血浆环状GMP,而不会引起危险的血压下降;而类似开发的长效ANP和BNP衍生物,当作为推注剂量给予时(足以增加血液环状GMP3天),会导致血压显著下降。对于超长效ANP衍生物,血压下降高达45%,而对于超长效BNP衍生物,血压下降高达20%。对于所有3种长效利尿钠肽衍生物,环状GMP的增加超过基线的1.5倍并且多达6倍。环状GMP AUC是VLA-dANP3,483ng*h/mL、VLA-dBNP 2,585ng*h/mL、VLA-dCNP 2,627ng*h/mL。
图2A显示推注施用25ug/Kg超长效CNP衍生物(VLA-dCNP)、超长效BNP衍生物(VLA-dBNP)和超长效BNP衍生物(VLA-dANP)后监测的血浆环状GMP相应增加[平均值(SEM);n=12]。基线血浆环状GMP水平为8(0.2)ng/mL[平均值(SEM);n=12],类似于健康人的水平。参见,例如,Igaki,等人,Hypertens Res[高血压研究]1998;21:7-13。所有超长效利尿钠肽配制品都将环状GMP增加超过8ng/ml的基线。环状GMP AUC值是VLA-dANP 3,483ng*h/mL、VLA-dBNP 2,585ng*h/mL、VLA-dCNP 2,627ng*h/mL。超长效CNP衍生物(VLA-dCNP)增加血浆环状GMP达3天而没有相关联的血压下降。
图2B显示了推注施用25ug/Kg超长效CNP衍生物(VLA-dCNP)、超长效BNP衍生物(VLA-dBNP)或超长效BNP衍生物(VLA-dANP)后监测的狗中平均动脉压[平均值(SEM);n=12]。在以非常高的剂量施用后,VLA-dCNP不会导致血压从基线(0小时)显著下降。相比之下,其他超长效利尿钠肽如VLA-dBNP和VLA-dANP衍生物导致血压下降超过15%。对于VLA-dANP尤其如此,对于类似的环状GMP增加,血压下降可高达50%。超长效CNP衍生物(VLA-dCNP)增加血浆环状GMP达3天而没有相关联的血压下降。
实例3:VLA-dCNP增加了乳腺肿瘤中的分化簇8阳性(CD8+)T细胞,表明VLA-dCNP促
分化簇8(CD8)是一种跨膜糖蛋白,可作为T细胞受体(TCR)的辅助受体。与TCR一样,CD8与主要组织相容性复合体(MHC)分子结合,但对MHC I类蛋白具有特异性(参见,例如,Gao G,Jakobsen B(2000).Immunol Today.[今日免疫学]21(12):630-6,通过引用以其整体并入本文)。CD8是细胞毒性T细胞的标志物,它在肿瘤中大量存在意味着有大量的T细胞可以攻击肿瘤细胞。由于DAPI(4',6-二脒-2-苯基吲哚)无论细胞类型如何都会对细胞核进行染色,一些未被CD8染色的细胞表明CD8的特异性得到保证。这表明不仅免疫检查点抑制剂的潜在增强,而且还有可能增强其他免疫疗法的效果,例如嵌合抗原受体(CAR)-T细胞疗法。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=4/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入小鼠乳腺癌细胞系E0771(250,000个细胞/小鼠,左乳腺皮下植入)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例4:VLA-dCNP增加了乳腺肿瘤中的激活的T细胞,表明VLA-dCNP促进了肿瘤杀
图4A的柱形图显示对照小鼠组和用VLA-dCNP处理的组中CD8细胞量(实例1中描述),图4B的柱形图显示对照小鼠组和用VLA-dCNP处理的组中激活的CD8细胞的量,并且图4C的柱形图显示对照小鼠组和用VLA-dCNP处理的组中激活的NK细胞的量。参考图4A-4B,细胞毒性T细胞分化簇3阳性/分化簇8阳性(CD3+/CD8+),肿瘤免疫的中心,显示增加趋势。此外,激活的细胞毒性T细胞(CD3+/CD8+/干扰素γ阳性(IFNG+))显著升高。这表明VLA-dCNP增加了T细胞的数量并诱导了它们的激活。类似地,参考图4C,显示在肿瘤免疫中重要的激活的自然杀伤细胞(NK细胞)(NK1.1)的比例增加。NK细胞不需要其靶细胞具有MHC I类即可识别靶细胞抗原以进行破坏/杀伤(T细胞不能杀伤细胞,因为需要肿瘤细胞中的MHC I类来进行抗原识别和杀伤)。据此,认为VLA-dCNP诱导NK细胞和CD8阳性T细胞的激活意味着其免疫增强作用中只有小的盲点。不希望被理论束缚,据信乳腺中的CD8+细胞约为0.2%-2.8%(健康动物值为2.0(0.2;SEM范围为1.6-2.6%),乳腺中的CD8+/IFNg+为约3-4%(健康动物值为4.1(0.14;SEM)),乳腺中激活的NK为0.01-0.05%。
雌性C57BL/6J小鼠(6周龄,雌性,n=4/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入小鼠乳腺癌细胞系E0771(ATCC,马纳萨斯老城(Old TownManassas),弗吉尼亚州)(250,000个细胞/小鼠,左乳腺皮下植入)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例5:VLA-dCNP根除乳腺癌/肿瘤中的调节性T细胞,允许免疫系统抑制肿瘤生
已知在癌症/肿瘤中存在许多抑制肿瘤免疫的调节性T细胞(Treg;分化簇4阳性(CD4+)/分化簇25阳性(CD25+)/叉头盒P3(FOXP3+))。由于Treg被VLA-dCNP抑制,参考图5A和5B,发现VLA-dCNP也显示出部分抑制T细胞免疫球蛋白和含粘蛋白结构域-3(TIM-3),这是T细胞耗竭(免疫力下降的状态)的指标。这表明VLA-dCNP不仅可以增强免疫检查点抑制剂,还可以增强其他免疫疗法的效果,例如嵌合抗原受体T细胞(CAR-T)疗法,因为这些细胞是外源性生长和施用的,并且可能更容易耗竭。此外,单独使用VLA-dCNP具有用作免疫疗法的潜力。不希望被理论所束缚,据信乳腺中的Treg为约3%-4.3%,而乳腺中的Tim3为约290-350荧光强度。
雌性C57BL/6J小鼠(6周龄,雌性,n=4/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入小鼠乳腺癌细胞系E0771(ATCC,马纳萨斯老城(Old TownManassas),弗吉尼亚州)(250,000个细胞/小鼠,左乳腺皮下植入)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例6:VLA-dCNP对具有或不具有分化簇8(CD8)耗竭的骨肿瘤体积生长的影响表
对于这项研究,雄性Balb/c小鼠(6周)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。将小鼠骨肉瘤细胞K7M2(ATCC,马纳萨斯老城,弗吉尼亚州)植入小鼠(n=11、10和10)(50,000个细胞/小鼠,皮下植入右侧背部)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司,东京,日本);组氨酸50mM(东京化学工业有限公司,东京,日本);在H
参考图6,VLA-dCNP的抗肿瘤作用与CD8激活直接相关,因为CD8的中和导致VLA-dCNP的抗肿瘤作用丧失。
实例7:VLA-dCNP抑制小鼠皮下植入模型中骨癌生长尺寸。
在这项研究中,雄性Balb/c小鼠(6周)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。将小鼠骨肉瘤细胞K7M2(ATCC,马纳萨斯老城,弗吉尼亚州)植入小鼠(n=17/组)(50,000个细胞/小鼠,皮下植入右侧背部)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
参考图7,VLA-dCNP抑制小鼠皮下植入模型中骨癌生长尺寸。
实例8A:VLA-dCNP对骨肿瘤体积生长的影响
参考图8A,VLA-dCNP对小鼠原位植入(股骨)模型中具有或不具有分化簇8(CD8)耗竭的骨肿瘤体积生长的影响表明VLA-dCNP的抗肿瘤作用与CD8激活直接相关,因为CD8的中和导致VLA-dCNP的抗肿瘤作用的丧失。VLA-dCNP被证明是细胞毒性T细胞的免疫刺激剂,导致骨肿瘤体积生长减少。
在这项研究中,雄性CH3He小鼠(5周)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。将小鼠骨肉瘤细胞LM8(RCB,筑波,日本)(1000,000个细胞/小鼠,股骨原位植入)植入小鼠(n=8、8、6、6)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H2O(大冢制药公司(Otsuka Pharmaceutical),德岛,日本)中)或缓冲液(用于对照组)中的0.3mg/kg VLA-dCNP(如实例1中所述)的推注剂量处理(异氟醚麻醉下皮下注射,5次/周)。抗CD8组/抗CD8+VLA-dCNP组的小鼠从植入前4天起每周两次腹膜内施用5mg/kg抗CD8抗体(YTS 169.4BioX细胞公司;西黎巴嫩,新罕布什尔州)。在第15天用卡尺测量肿瘤尺寸。通过以下进行统计分析:学生t检验,使用GraphPad Prism*<0.01VLA-dCNP(n=8)相比于对照组(n=8),抗CD8(n=6)或抗CD8+VLA-dCNP(n=6);误差棒是SEM。
实例8B:VLA-dCNP对骨癌皮下植入小鼠模型中免疫激活的影响。
转化生长因子β1(TGF-β1)是参与免疫抑制的细胞因子。叉头盒P3(Foxp3)是参与抑制肿瘤免疫的调节性T细胞的标志物,Bv8(前动力蛋白)是由参与免疫抑制的髓系衍生的抑制细胞(MDSC)分泌的因子(Neoplasia[瘤形成]2014,16 501-510)。参考图8B-8D,所有三种标志物的表达都很低,表明几乎没有抑制免疫的细胞。因此,可以解释为由于免疫系统相对激活,肿瘤生长被VLA-dCNP的施用抑制。在这项研究中,使用了小肠。VLA-dCNP施用组中的许多小鼠的肿瘤完全消失。VLA-dCNP/PD-1的组合导致大部分肿瘤消失,因此没有样品可用于测量。因此,在作为免疫中心的肠道中替代性地评估免疫参数。不希望受理论束缚,据信肠中的TGF-β1为约8.5%-9.7%,肠中的Foxp3为约7%-13%,Bv8为约8%-48%。
在这项研究中,雄性Balb/c小鼠(6周)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。将小鼠骨肉瘤细胞K7M2(ATCC,马纳萨斯老城,弗吉尼亚州)植入小鼠(n=17/组)(50,000个细胞/小鼠,皮下植入右侧背部)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例9:VLA-dCNP标准化乳腺癌肿瘤血管结构
分化簇31(CD31)是血管内皮的标志物,α平滑肌肌动蛋白(α-SMA)是外膜细胞的标志物。在正常血管中,外膜细胞位于血管附近,因此可以通过外膜细胞的存在来评价是否存在正常血管。参考图9A,因为在VLA-dCNP施用组中每个荧光的重叠区域增加,这表明形成了具有足够功能(健康)的血管。理论上,正常健康的血管结构将具有100%外膜细胞包被指数。
雌性C57BL/6J小鼠(6周龄,雌性,n=4/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入小鼠乳腺癌细胞系E0771(ATCC,马纳萨斯老城(Old TownManassas),弗吉尼亚州)(250,000个细胞/小鼠,左乳腺皮下植入)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
图9A显示了红色CD31和绿色α-SMA的荧光显微镜图像。所有图像的放大率都是低倍视野x20。图9B显示了外膜细胞包被的%指数;误差棒是SEM。理论上,正常健康的血管结构将具有100%外膜细胞包被指数。使用α-SMA作为指数计算外膜细胞包被指数,(CD31+α-SMA+)/CD31+。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.05相比于对照组(n=4)。
实例10:VLA-dCNP标准化肿瘤血管结构
分化簇31(CD31)是一种血管内皮标志物,其指示血管的存在。凝集素指示血液是否真的流过血管(以排除肿瘤组织中存在的许多无功能血管)。换句话说,使用这两种染色,可以确定功能性血管的数量。如上实例所示,施用VLA-dCNP增加了功能性血管的数量。该实例证实了血液通过这些血管。
雌性C57BL/6J小鼠(6周龄,雌性,n=3/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入小鼠乳腺癌细胞系E0771(ATCC,马纳萨斯老城(Old TownManassas),弗吉尼亚州)(250,000个细胞/小鼠,左乳腺皮下植入)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
图10A显示了红色CD31和绿色凝集素的荧光显微镜图像。所有图像的放大率都是低倍视野x20。图10B显示每个视野的CD31计数和凝集素结构;误差棒是SEM。正常血管结构显示每个视野较高的结构数目。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.05相比于对照组(n=3)。
实例11:VLA-dCNP减少肿瘤中的缺氧条件
因为哌莫硝唑与缺氧蛋白的硫醇基团(-SH)结合,所以它被用作确定组织中氧气状态的标志物。参考图11A,缺氧区域通过对在解剖之前施用的哌莫硝唑用抗体染色来可视化。由于通过施用VLA-dCNP减少了该荧光,因此发现缺氧条件得到解决。除了结果之外,据了解血管形成并且氧气被充分输送。由于缺氧区与肿瘤恶性、抗癌药物抗性和肿瘤免疫抑制有关,因此认为基于VLA-dCNP可以减轻这些影响。
雌性C57BL/6J小鼠(6周龄,雌性,n=4/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入小鼠乳腺癌细胞系E0771(ATCC,马纳萨斯老城(Old TownManassas),弗吉尼亚州)(250,000个细胞/小鼠,左乳腺皮下植入)。从植入后的第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
图11A显示了红色哌莫硝唑的荧光显微镜图像。所有图像的放大率都是低倍视野x20。图11B显示红色哌莫硝唑的相对强度百分比;误差棒是SEM。理论上,健康组织不会缺氧,因此相对强度为0%。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.05相比于对照组(n=4)。
实例12:VLA-dCNP和抗小鼠细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体组合疗法
参考图12,显示了暴露于各种治疗剂后不同天数的结肠肿瘤尺寸。VLA-dCNP和抗小鼠细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体组合疗法大大地抑制了结肠癌的生长。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=9-10/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。小鼠皮下植入MC38小鼠结肠癌细胞(1×106个细胞/小鼠)(捐赠),并从第8天开始用以下推注剂量处理:超长效CNP衍生物或VLA-dCNP(如实例1所述)(0.3mg/kg s.c.)与抗CTLA-4 Ab(BioX细胞公司,克隆9H10;西黎巴嫩,新罕布什尔州)或与同种型对照Ab(BioX细胞公司,BE0087;西黎巴嫩,新罕布什尔州),天然C型利尿钠肽或CNP(0.3mg/kg s.c.)与抗CTLA-4 Ab或同种型对照Ab,CNP衍生物或dCNP(如实例1所述)(0.3mg/kg s.c.)与抗CTLA-4 Ab或同种型对照Ab,B型利尿钠肽或BNP(0.3mg/kg s.c.)与抗CTLA-4 Ab或同种型对照Ab。包括具有同种型对照Ab的缓冲液对照和具有抗CTLA-4 Ab的缓冲液。通过i.p.用2.5mg/kg抗CTLA-4 Ab或同种型对照Ab处理小鼠每周一次。用卡尺测量肿瘤尺寸。结果表明,单个处理(不使用抗小鼠CTLA-4抗体或单独使用抗小鼠CTLA-4抗体)在减小肿瘤体积方面不如组合处理(连同抗小鼠CTLA-4抗体)有效。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.01相比于对照组(n=10);1P<0.05相比于对照组(n=10)。
实例13:VLA-dCNP和抗小鼠(细胞毒性T淋巴细胞相关蛋白4)CTLA-4抗体组合疗法
参考图13A,作为各种治疗剂的函数的结肠肿瘤尺寸显示为图。图13B中显示了暴露于各种治疗剂后不同天数的肿瘤尺寸的对应表。VLA-dCNP和抗小鼠(细胞毒性T淋巴细胞相关蛋白4)CTLA-4抗体组合疗法大大地抑制了结肠癌的生长。可以观察到协同效应。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=5-7/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。小鼠皮下植入MC38小鼠结肠癌细胞(1×106个细胞/小鼠)(捐赠)。在第22天后,将对照组分为三组。从第22天起,小鼠用以下推注剂量处理:超长效CNP衍生物或VLA-dCNP(如实例1所述)(0.3mg/kg s.c.)与抗CTLA-4 Ab(BioX细胞公司,克隆9H10;西黎巴嫩,新罕布什尔州),天然C型利尿钠肽或CNP(0.3mg/kg s.c.)与抗CTLA-4 Ab,CNP衍生物或dCNP(如实例1所述)(0.3mg/kg s.c.)与抗CTLA-4 Ab。包括抗CTLA-4抗体的缓冲液对照。通过i.p.用2.5mg/kg抗CTLA-4 Ab处理小鼠,每周两次。用卡尺测量肿瘤尺寸。通过以下进行统计分析:学生t检验,使用GraphPad Prism 6.0(n=5)。*P<0.01(n=5-7)
实例14:VLA-dCNP和抗小鼠程序性细胞死亡蛋白1(PD-1)抗体组合疗法抑制了小
参考图14,显示了暴露于各种治疗剂后不同天数的结肠肿瘤尺寸。VLA-dCNP和抗小鼠程序性细胞死亡蛋白1(PD-1)抗体组合疗法大大地抑制了结肠癌的生长。可以观察到协同效应。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=10/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。小鼠皮下植入MC38小鼠结肠癌细胞(1×10
实例15:VLA-dCNP和抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体组合疗法在小
参考图15,显示了暴露于各种治疗剂后不同天数的皮肤肿瘤尺寸。VLA-dCNP和抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体组合疗法大大地抑制了皮肤癌的生长。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=8-10/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。小鼠皮下植入B16黑色素瘤癌细胞(25,000个细胞/小鼠)(ATCC公司,马纳萨斯,马萨诸塞州),并从第7天开始用以下推注剂量处理:超长效CNP衍生物或VLA-dCNP(如实例1所述)(0.3mg/kg s.c.)与抗CTLA-4 Ab(BioX细胞公司,9H10;西黎巴嫩,新罕布什尔州)或与同种型对照Ab(BioX细胞公司,BE0087;西黎巴嫩,新罕布什尔州),天然C型利尿钠肽或CNP(0.3mg/kg s.c.)与抗CTLA-4 Ab或同种型对照Ab,CNP衍生物或dCNP(如实例1所述)(0.3mg/kg s.c.)与抗CTLA-4 Ab或同种型对照Ab,B型利尿钠肽或BNP(0.3mg/kg s.c.)与抗CTLA-4 Ab或同种型对照Ab。包括具有同种型对照Ab的缓冲液对照和具有抗CTLA-4 Ab的缓冲液。通过i.p.用10mg/kg抗CTLA-4 Ab或同种型对照Ab处理小鼠每周一次。用卡尺测量肿瘤尺寸。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.05相比于CTLA-4组(n=8或10);
实例16:VLA-dCNP或dCNP和抗小鼠程序性细胞死亡蛋白1(PD-1)抗体疗法在小鼠
参考图16,显示了暴露于各种治疗剂后不同天数的乳腺肿瘤尺寸。VLA-dCNP或dCNP和抗小鼠程序性细胞死亡蛋白1(PD-1)抗体疗法大大地抑制了乳腺癌的生长。可以观察到协同效应。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=7或10/组)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在小鼠左侧乳腺中植入E0771乳腺癌细胞(250,000个细胞/小鼠)(科斯莫生物公司(Cosmo Bio),东京,日本)。从第4天起,小鼠用以下推注剂量处理:从第4天起,超长效CNP衍生物或VLA-dCNP(如实例1所述)(0.3mg/kg s.c.)与抗PD-1 Ab(BioX细胞公司;克隆RMP1-14,西黎巴嫩,新罕布什尔州)或与同种型对照Ab(BioX细胞公司,BE0089;西黎巴嫩,新罕布什尔州),天然C型利尿钠肽或CNP(0.3mg/kg s.c.)与抗PD-1Ab或同种型对照Ab,CNP衍生物或dCNP(如实例1所述)(0.3mg/kg s.c.)与抗PD-1 Ab或同种型对照Ab,B型利尿钠肽或BNP(0.3mg/kg s.c.)与抗PD-1 Ab或同种型对照Ab,抗肿瘤坏死因子α抗体或TNFa ab(BioX细胞公司;克隆XT3.11,西黎巴嫩,新罕布什尔州)(0.3mg/kgs.c.)与抗PD-1 Ab或与同型对照Ab,以及cGMP降解抑制剂或称为伐地那非的PDE5抑制剂(VDN,开曼化学公司(Cayman Chemicals),安阿伯,密歇根州)(0.3mg/kg s.c.)与抗PD-1Ab或与同型对照Ab。包括具有同种型对照Ab的缓冲液对照和具有抗PD-1 Ab的缓冲液。通过i.p.用5mg/kg抗PD1 Ab或同种型对照Ab处理小鼠每周两次。用卡尺测量肿瘤尺寸。结果表明,单个处理(不使用抗小鼠PD-1抗体或单独使用抗小鼠PD-1抗体)在减小肿瘤体积方面不如组合处理(连同抗小鼠PD-1抗体)有效。示例组参见VLA-dCNP组对VLA-dCNP+PD-1组和dCNP组对dCNP+PD-1。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.01相比于PD-1对照组(n=7或10);1P<0.05相比于对照组(n=7或10)
实例17:VLA-dCNP与抗小鼠PD-1(程序性细胞死亡蛋白1)抗体组合疗法在小鼠原
参考图17,显示了暴露于各种治疗剂后不同天数的乳腺肿瘤尺寸。VLA-dCNP与抗小鼠PD-1(程序性细胞死亡蛋白1)抗体组合疗法大大地抑制了乳腺癌的生长。可以观察到协同效应。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=7-9)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在小鼠左侧乳腺中植入E0771乳腺癌细胞(250,000个细胞/小鼠)(科斯莫生物公司(Cosmo Bio),东京,日本)。从第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例18:VLA-dCNP和抗小鼠程序性死亡配体1(PD-L1)抗体组合疗法抑制了小鼠原
适应性免疫系统通过外源性或内源性危险信号对与免疫系统激活相关的抗原作出反应。反过来,抗原特异性CD8+T细胞和/或CD4+辅助细胞的克隆扩增得以繁殖。PD-L1与抑制性检查点分子PD-L1的结合经由基于免疫受体酪氨酸的开关基序(ITSM)与磷酸酶(SHP-1或SHP-2)相互作用而传递抑制信号。这减少了淋巴结中抗原特异性T细胞的增殖,同时减少了调节性T细胞(抗炎、抑制性T细胞)的细胞凋亡—进一步由基因Bcl-2的更低调节介导。
PD-L1的上调可能允许癌症逃避宿主免疫系统。对来自肾细胞癌患者的196个肿瘤样本的分析发现,PD-L1的高肿瘤表达与肿瘤侵袭性增加和死亡风险增加4.5倍有关。PD-L1抑制剂的临床可用实例包括度伐鲁单抗、阿特利珠单抗和阿维鲁单抗。
参考图18A,作为各种治疗剂的函数的乳腺肿瘤尺寸显示为图。图18B中显示了暴露于各种治疗剂后不同天数的肿瘤尺寸的对应表。VLA-dCNP和抗小鼠程序性死亡配体1(PD-L1)抗体组合疗法抑制了乳腺癌的生长(体积)。可以观察到协同效应。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=8-9)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在小鼠左侧乳腺中植入E0771小鼠乳腺癌细胞(250,000个细胞/小鼠)(科斯莫生物公司(Cosmo Bio),东京,日本)。从第4天起,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例19:VLA-dCNP和抗PD-1抗体组合疗法抑制了小鼠原位移植模型中乳腺癌的生
在同基因小鼠中,EMT-6细胞形成肿瘤和自发转移,主要转移到肺。最近,EMT-6已成为三阴性乳腺癌免疫肿瘤学研究的有价值的临床前模型。EMT-6肿瘤表达PD-L1并且对免疫疗法有适度的反应。单个检查点抑制剂(抗CTLA-4或抗PD-L1)通常对肿瘤生长有适度影响,而组合疗法表现出更大的成功,使EMT6成为组合疗法研究的有益模型。
参考图19A,作为各种治疗剂的函数的乳腺肿瘤尺寸显示为图。图19B中显示了暴露于各种治疗剂后不同天数的肿瘤尺寸的对应表。VLA-dCNP和抗PD-1抗体组合疗法大大抑制了乳腺癌的生长(体积)。可以观察到协同效应。
在这项研究中,雌性Balb/c小鼠(6周龄,雌性,n=7-9)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入EMT-6乳腺癌细胞(ATCC公司,马纳萨斯,弗吉尼亚州)(200,000个细胞/小鼠,左乳腺皮下植入)。在植入后的第4天,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例20:VLA-dCNP和抗PD-1抗体组合疗法抑制乳腺癌生长并改善小鼠存活。
在这项研究中,雌性Balb/c小鼠(6周龄,雌性,n=7-9)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠植入EMT-6乳腺癌细胞(ATCC公司,马纳萨斯,弗吉尼亚州)(200,000个细胞/小鼠,左乳腺皮下植入)。在植入后的第4天,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
参考图20,VLA-dCNP和抗PD-1抗体组合疗法大大抑制乳腺癌生长并改善小鼠存活。可以观察到协同效应。
实例21:单独使用超长效NPRB激动剂(VLA-dCNP)处理可改善胫骨骨肉瘤小鼠在疾
图21的Kaplan-Meier曲线显示VLA-dCNP处理改善了胫骨骨肉瘤小鼠的存活。
在这项研究中,雄性CH3HeN小鼠(4周龄,雄性,n=8)购自Kyudo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在第0天,将LM8小鼠骨肉瘤细胞(1,000,000个细胞/小鼠)(捐赠,日本)植入小鼠的胫骨(原位植入)。从第15天开始,即被认为是疾病“末期”的开始,小鼠用在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
图21是27天的Kaplan-Meier曲线,显示单独用VLA-dCNP治疗改善了胫骨骨肉瘤小鼠的存活。LM8细胞的植入是在第0天。末期被认为是在第15天(黑色箭头)之后。
实例22:长效NPRB激动剂(dCNP)增强脾细胞中LM8诱导的IFNg产生
γ干扰素(IFNg)在激活细胞免疫和随后刺激抗肿瘤免疫反应中起着关键作用。IFN-g可抑制肿瘤组织中的血管生成,诱导调节性T细胞(免疫反应的抑制剂)凋亡和/或刺激M1促炎巨噬细胞的活性以克服肿瘤进展。
在这项研究中,小鼠骨肉瘤癌细胞系LM8(来自九州(Kyushu)捐赠)维持在补充有10%胎牛血清(FCS;西格玛奥德里奇公司(Sigma Aldrich),圣路易斯,密苏里州)的αMEM(富士公司(Fujifilm),东京,日本)中,并接种到96-孔板(10,000个细胞/孔,在补充有衍生自携带原位LM8的小鼠的1,000,000个脾细胞的RPMI 1640中)中,并且将细胞用不同浓度的长效CNP衍生物或dCNP(如实例1中所述)(0、0.5(1.6ng/mL)和5nM(16ng/mL)处理96小时。本研究中的阴性对照只有脾细胞没有dCNP,而对照有LM8和脾细胞但没有dCNP以确定基线。收获上清液并通过ELISA测定法(R&D系统公司(R&D Systems),明尼阿波利斯,明尼苏达州)测量IFNg水平。通过以下进行统计分析:学生t检验,使用GraphPad Prism*P<0.01相比于对照(n=3或4)。
图22显示dCNP以剂量依赖性方式增加暴露于培养的LM8小鼠骨肉瘤癌细胞系的脾细胞中干扰素γ(IFNg)产生。
实例23:长效NPRB激动剂(dCNP)的抗肿瘤作用由小鼠前列腺癌模型中的CD8活性
图23A显示了从第6天开始用各种测试品处理14天后在第20天的肿瘤尺寸图。图23B显示了处理期间的肿瘤生长进展以及第20天的肿瘤根除。误差棒是SEM,单个点代表组中的单个动物。图23A和23B显示0.3和1.0mg/kg的dCNP(在实例1中描述)在抑制小鼠前列腺癌生长方面显著有效,并且当在第20天评估时与细胞毒性化学治疗剂(多西他赛)一样有效。然而,在抗CD8抗体(Ab)存在的情况下,多西他赛的肿瘤生长抑制作用仍然存在,而dCNP的作用被中和,表明dCNP抗肿瘤活性的机制主要由细胞毒性CD8 T细胞介导。CD8作为T细胞受体(TCR)的辅助受体。与TCR一起,CD8辅助受体在T细胞信号传导中发挥作用,并有助于细胞毒性T细胞抗原相互作用以消除肿瘤。如果由CD8介导,那么抗CD8预计会中和dCNP所见的效果而不中和多西他赛所见的效果。因此,图23A和23B显示长效NPRB激动剂(dCNP)的抗肿瘤作用由小鼠前列腺癌模型中的CD8活性介导并且与非免疫介导的细胞毒性化学治疗剂一样有效。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=10)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠皮下植入TRAMPC-1小鼠前列腺癌细胞(1,000,000个细胞/小鼠)(ATCC公司,马纳萨斯,弗吉尼亚州)。从第6天(肿瘤生长的早期阶段)开始,小鼠用以下的推注剂量处理:在缓冲液(包含甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例24:长效NPRB激动剂(dCNP)在很晚的阶段施用对更大或更严重的前列腺肿瘤
图24A显示dCNP(在实例1中描述)的前列腺肿瘤消除作用的图,即使在很晚的阶段开始施用时(肿瘤尺寸为约70mm3;在第19天)。还表明,dCNP在消除肿瘤方面与细胞毒性化学治疗剂一样有效。图24B的表显示了治疗期间的前列腺癌生长以及第30天的肿瘤根除(下分图)。误差棒是SEM,单个点代表组中的单个动物。dCNP的作用机制是由细胞毒性CD8 T细胞介导的,因为它可以被抗CD8抗体中和,而毒性化学治疗剂的抗肿瘤作用不能被抗CD8中和,这与化学治疗剂对癌细胞的直接细胞毒性作用一致。此外,dCNP的致死性小于细胞毒性化学治疗剂(多西他赛)。CD8作为T细胞受体(TCR)的辅助受体。与TCR一起,CD8辅助受体在T细胞信号传导中发挥作用,并有助于细胞毒性T细胞抗原相互作用以消除肿瘤。如果由CD8介导,则预期抗CD8抗体会中和该作用。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=10)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠皮下植入TRAMPC-1小鼠前列腺癌细胞(1,000,000个细胞/小鼠)(ATCC公司,马纳萨斯,弗吉尼亚州)。从第19天(平均肿瘤尺寸为70mm3),小鼠用以下的推注剂量进行处理:在缓冲液[甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例25:即使在健康的正常动物中,长效NPRB激动剂(dCNP)也可以激活免疫系统,
图25A-25C显示即使在正常健康小鼠中,dCNP也可以激活免疫系统,如血液中T细胞(CD4)、细胞毒性(CD8)T细胞和自然杀伤(NK)细胞的增加所见。图25D-25G显示在脾中,CD4、CD8、ICOS和CD86基因表达相应增加,其显著升高表明免疫系统激活。ICOS是诱导型T细胞共刺激因子并且是免疫检查点蛋白并且其表达表明免疫激活。CD86与CD80一起提供T细胞激活和存活所必需的共刺激信号,并且其表达证实了免疫激活。
在这项研究中,雄性C57BL/6J小鼠(6周龄,n=3)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。小鼠用以下的推注剂量进行处理:在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例26:VLA-dCNP和抗PD1抗体组合在增加Th1细胞和减少免疫系统的Treg细胞方
图26A显示了各种免疫细胞、它们针对免疫激活的机制性相互作用、以及干扰素γ(IFNg)细胞因子(其触发CD8和NK细胞抗肿瘤活性或攻击以消除癌细胞)的产生的图表。灰色箭头表示细胞数量增加(向上)或减少(向下),黑色箭头表示在IFNg存在的情况下发育的细胞。调节性T细胞(Treg)是特化的T细胞亚群,其可抑制T辅助细胞1(Th1)细胞免疫反应(由水平T表示),从而维持体内平衡和自我耐受。Treg抑制T细胞增殖和细胞因子产生,以通过抑制Th1发育成CD8+细胞毒性T细胞(CTL)来抑制免疫系统,并在正常情况下防止自身免疫。此外,Th1细胞为免疫系统的其他细胞(尤其是抗原呈递细胞(APC),如巨噬细胞、树突细胞和B细胞)提供辅助功能,并且对它们的激活和成熟很重要。
图26B-26D显示了E0771小鼠乳腺癌模型中Treg细胞的抑制、激活的Th1细胞的增加(其中单独的VLA-dCNP比单独的抗PD1显著更有效(右上图))、以及Th1/Treg细胞的比例(其中单独的VLA-dCNP比单独使用抗PD1显著更有效)。出人意料的是,当dCNP(在实例1中描述)和抗PD1抗体组合时,它们具有比单独施用dCNP和单独施用抗PD1的效果之和大得多的协同效应。这些图表明dCNP和抗PD1抗体通过增加Th1、CD8+和NK细胞同时减少Treg细胞以出人意料的协同方式增强抗肿瘤免疫。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=6)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在小鼠左侧乳腺中植入E0771小鼠乳腺癌细胞(250,000个细胞/小鼠)(科斯莫生物公司(Cosmo Bio),东京,日本)。从第8天起,小鼠用以下的推注剂量进行处理:在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化成工业株式会社);组氨酸50mM(东京化成工业株式会社);在H
实例27:佐剂如CpG寡脱氧核苷酸(ODN),一种Toll样受体9激动剂,增强dCNP对乳
CpG ODN佐剂结合并激活Toll样受体9,启动先天免疫反应,支持适应性免疫的后续发展。TLR9激动剂改善抗原呈递和疫苗特异性细胞和体液反应的诱导。已经开展了利用CpG ODN的临床试验,评估了它们在预防或治疗过敏、传染病,尤其是癌症方面的效用(Immunopotentiatory in Modern Vaccines[现代疫苗中的免疫增强剂],2017 163-198;第9章;Nature reviews urology[自然评论泌尿学]201310 537-545;Npj Vaccines[Npj疫苗]2020第5卷文章编号50。
图27显示在小鼠乳腺癌模型中当dCNP与佐剂CpG ODN-TLR9激动剂组合时显著的肿瘤抑制。佐剂如CpG寡脱氧核苷酸(ODN),一种Toll样受体9激动剂,在小鼠模型中增强dCNP对乳腺癌的肿瘤体积抑制活性。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=6)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在小鼠左侧乳腺中植入E0771小鼠乳腺癌细胞(250,000个细胞/小鼠)(科斯莫生物公司(Cosmo Bio),东京,日本)。从第6天起,小鼠用以下的推注剂量进行处理:在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化成工业株式会社);组氨酸50mM(东京化成工业株式会社);在H
实例28:dCNP、抗PD1抗体以及两者的组合是有效的免疫激活剂,能够在小鼠乳腺
CD69是细胞表面糖蛋白并且是多种免疫细胞的激活标志物。与T细胞的一般激活一致,激活的肿瘤浸润B细胞(TIL-B)是CD69+,并与增加效应T细胞(IFNg+CD4+TIL)反应相关(Cancer Immunol Res.[癌症免疫研究]2017年10月5(10)898-907)。此外,CD69+B细胞与三级淋巴结构(TLS)相关,后者与NSCLC患者的长期存活相关(Cancer Immunol Res.[癌症免疫研究]2017年10月5(10)898-907)。T淋巴细胞和NK细胞在体内和体外的激活诱导CD69的表达(Immunity[免疫]2018 48 4 702-715)。
图28A-28D显示dCNP、抗PD1抗体以及两者的组合是有效的免疫激活剂,能够在小鼠乳腺癌模型中减少肿瘤体积和Treg细胞并增加CD69+细胞。在增加CD69+细胞群体的同时抑制Treg与导致肿瘤体积抑制的免疫激活一致。
在这项研究中,雌性C57BL/6J小鼠(6周龄,雌性,n=6)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。在小鼠左侧乳腺中植入E0771小鼠乳腺癌细胞(250,000个细胞/小鼠)(科斯莫生物公司(Cosmo Bio),东京,日本)。从第8天起,小鼠用以下的推注剂量进行处理:在缓冲液(甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化成工业株式会社);组氨酸50mM(东京化成工业株式会社);在H
实例29:当在更大或更发展的小鼠前列腺癌中评估时,dCNP抑制了肿瘤内纤维化
癌症相关的成纤维细胞和纤维化导致的细胞外基质过度产生表明癌症扩张增加。纤维化可通过排斥和抑制细胞毒性T细胞以及激活髓系衍生的抑制细胞(MDSC)而在肿瘤微环境中引起免疫抑制(Front.Immunol[免疫学前沿],2019年8月)。此外,纤维化还通过固体应激和抑制灌注引发化学耐药性(PNAS[美国国家科学院院刊]2019年2月116(6)2210-2219)。血管生成素-2(Ang2)通过拮抗Ang1/Tie2轴抑制肿瘤血管稳定。Ang 2表达的抑制使血管稳定、增强进入肿瘤的途径并改善药物递送(Cancer Cell[癌细胞],2016第30卷,953-967)。
图29A-29C显示dCNP而非多西他赛或缓冲液对照抑制小鼠癌症模型的前列腺肿瘤内的α-平滑肌肌动蛋白(α-SMA;左上图)、TGFβ(右上图)和Ang 2基因表达。这些基因表达的减少表明纤维化过程的减少,并且这种减少改善了免疫系统的抗肿瘤活性。α-SMA是组织纤维化的标志物,并且TGFβ是众所周知的纤维化介质并且在纤维化疾病中上调和激活(Growth Factors[生长因子],2011 29(5),196-202)。Ang 2通过拮抗Ang1/Tie2轴抑制肿瘤血管稳定。Ang 2表达的抑制使血管稳定、增强进入肿瘤的途径并改善药物递送(CancerCell[癌细胞],2016第30卷,953-967)。如图29C所示,dCNP稳定了肿瘤血管并为免疫系统创造了更好的抗肿瘤肿瘤微环境。
在这项研究中,雄性C57BL/6J小鼠(6周龄,雄性,n=10)购自Kyodo(佐贺,日本),并保持在12小时光照/12小时黑暗循环下,可自由饮水和标准小鼠饮食(MF饮食;东方酵母有限公司,东京,日本)。给小鼠皮下植入TRAMPC-1小鼠前列腺癌细胞(1,000,000个细胞/小鼠)(ATCC公司,马纳萨斯,弗吉尼亚州)。从第19天(平均肿瘤尺寸为70mm3),小鼠用以下的推注剂量进行处理:在缓冲液[甲硫氨酸100mM(东京化学工业有限公司,东京,日本);蔗糖100mM(东京化学工业有限公司);组氨酸50mM(东京化学工业有限公司);在H
实例30:来自推注施用的长效CNP衍生物s1(dCNP-s1)和CNP衍生物s2(dCNP-s2)的
参考图30,显示了在皮下推注施用2.0mg/Kg CNP衍生物s1(dCNP-s1)和CNP衍生物s2(dCNP-s2)后CD-1小鼠中血浆CNP[平均值(SEM);n=5]。为了进行比较,插图显示当施用天然CNP时CNP(菱形)的低血浆水平。误差棒表示n=5个血浆样品的平均值的标准误差。施用前的基线CNP水平为0.391(0.02)ng/mL[平均值(SEM);n=10]。当以相似的剂量重量/Kg剂量施用时,长效dCNP-s1和dCNP-s2以持续方式(至少8小时)提供比天然CNP高10倍的CNP血液水平。
对于这项药代动力学研究,这项研究的所有动物(小鼠)都保持在12小时光照/12小时黑暗循环下,可以自由获取水和标准小鼠饮食(Lab Pico啮齿动物#5053;动物特食(Animal Specialties),伍德伯恩(Woodburn),俄勒冈州)。用2.0mg/Kg的CNP衍生物s1(dCNP-s1;法曼公司(PharmaIN Corp),博瑟尔(Bothell),华盛顿州)和CNP衍生物s2(dCNP-s2;法曼公司,博瑟尔,华盛顿州)通过肩胛骨之间的皮下推注施用处理雄性CD-1小鼠(6-8周龄;查尔斯河,霍利斯特(Hollister),加利福尼亚州)。所有测试品均配制或溶解在100mM蔗糖、100mM甲硫氨酸、50mM组氨酸,pH 7.4中。通过眶后采血在不同时间(0小时、0.5小时、1小时、2小时、4小时、6小时、8小时和24小时)进行血液采样,每只动物在两个不同的时间点抽血两次。血液样品在K2EDTA管中处理以获得血浆。通过来自凤凰制药公司(PhoenixPharmaceuticals)(cat#EKE-012-03)的市售CNP ELISA试剂盒分析血浆。CNP是天然人CNP(GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.10])并且dCNP-s1和dCNP-s2是具有以下序列的人CNP的衍生物:HOC(=O)(CH
通过示例而非限制,根据以下列举的段落披露实施例:
A1.一种治疗在任何组织或器官中具有异常血管的受试者的方法,该方法包括向该受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂、超长效NPRB激动剂或其任何组合,
其中施用该治疗有效推注剂量的该组合物提供血管正常化或外膜细胞包被指数增加至少10%,
其中该组合物不会使血压降低超过基线血压测量值的20%(例如,超过15%、超过10%或超过5%),其中该基线血压测量值是施用该组合物之前的平均血压,并且
其中该组合物在施用后1小时至12小时使血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上,并且该基线血浆环状GMP水平是施用该组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选为该受试者在施用该组合物之前的平均血浆环状GMP水平)。
A2.一种增加细胞毒性T细胞的数量和/或激活的NK细胞的数量的方法,该方法包括向有需要的受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP、超长效CNP、长效CNP衍生物、超长效CNP衍生物、长效NPRB激动剂、超长效NPRB激动剂或其任何组合,
其中该治疗有效推注剂量的该组合物使细胞毒性T细胞和/或NK细胞的数量比施用该组合物之前的水平或比健康受试者中的水平增加至少15%,
其中施用该治疗有效推注剂量的该组合物不会使血压降低超过基线血压测量值的20%,其中该基线血压测量值是施用该组合物之前的平均血压;并且
其中该组合物在施用后1小时至12小时使血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上,并且该基线血浆环状GMP水平是施用该组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选为该受试者施用该组合物之前的平均血浆环状GMP水平)。
A3.如段落A1或段落A2所述的方法,其中:
该受试者具有病症(i)至(viii):
(i)低数量的细胞毒性T细胞,
(ii)低数量的激活的NK细胞,
(iii)高数量的Treg细胞,
(iv)TGFβ高水平表达,
(v)Foxp3高水平或表达,
(vi)高数量的髓系衍生的抑制细胞或MDSC,
(vii)Bv8高水平或表达;或
(viii)其任何组合;或
该受试者需要(ix)至(xvi):
(ix)细胞毒性T细胞数量增加;
(x)激活的NK细胞增加;
(xi)Treg细胞数量减少;
(xii)TGF-β表达降低;
(xiii)Foxp3表达降低;
(xiv)髓系衍生的抑制细胞(MDSC)数量减少;
(xv)Bv8表达降低,或
(xvi)其任何组合,
其中施用该治疗有效推注剂量的该组合物提供肿瘤存在时尺寸的减小、细胞毒性T细胞数量增加、激活的NK细胞数量增加、Treg细胞数量减少、TGFβ水平或表达降低、Foxp3水平或表达降低、髓系衍生的抑制细胞(MDSC)数量减少、Bv8水平或表达降低、存活/寿命改善,或其组合。
A4.一种治疗如段落A1至A3任一项所述的受试者的方法,其中在施用该治疗有效推注剂量的该组合物之前,该受试者进一步具有低数量的细胞毒性T细胞、低数量的激活的NK细胞、或低数量的细胞毒性T细胞和低数量的激活的NK细胞两者。
A5.如段落A1至A4任一项所述的方法,其中该长效CNP衍生物或超长效CNP衍生物包含U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ IDNO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.11],或其任何组合,
其中:
U是式(I)或(II)的部分,其中式(I)是
(脂肪族)
(I)
其中
a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);或
X是接头(γE)
其中B是1-8个氨基酸残基的序列,其中每个氨基酸残基独立地选自2-[2-(2-氨基乙氧基)乙氧基]乙酸残基、Gly、Ala、Leu、Ser、Arg、和Lys;
m是0、1、2或3;
n是0、1、2或3;并且
m和n之和至少为1,
并且式(II)是
(聚合物)
(II)
其中
a是0或1(优选a是1);
聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)、聚(N-乙烯基吡咯烷酮)或其衍生物;
Y是:
1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;
含有氨基酸残基的接头,其中该氨基酸残基共价连接至(聚合物)
不同于该1-10个氨基酸残基或肽序列的肽接头。
A6.如段落A5所述的方法,其中Y是接头(γE)
A7.如段落A5或段落A6所述的方法,其中该长效CNP衍生物或该超长效CNP衍生物包含U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ IDNO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.12],或其任何组合;并且;
其中:
U是式(I)的部分,其中式(I)是
(脂肪族)
(I)
其中
a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);或
X是接头(γE)
其中B是1-8个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自2-[2-(2-氨基乙氧基)乙氧基]乙酸残基、Gly、Ala、Leu、Ser、Arg、和Lys;
m是0、1、2或3;
n是0、1、2或3;并且
m和n之和至少为1。
A8.如段落A5至A7任一项所述的方法,其中X是4-7个氨基酸的序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G),或
X是接头(γE)
A9.如段落A5至A8任一项所述的方法,其中该长效CNP衍生物或超长效CNP衍生物包含U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],
其中:
U是(脂肪族)
其中
a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是1-10个氨基酸的序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);或
X是接头(γE)
A10.如段落A5至A9中任一项所述的方法,其中脂肪族不包含直链或支链的任选地经取代的C
A11.如段落A1至A10中任一项所述的方法,其中该长效CNP衍生物选自
CH
CH
CH
CH
CH
HOC(=O)(CH
HOC(=O)(CH
A12.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是CH
A13.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是CH
A14.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是CH
A15.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是CH
A16.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是CH
A17.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是HOC(=O)(CH
A18.如段落A1至A11中任一项所述的方法,其中该长效CNP衍生物是HOC(=O)(CH
A19.如段落A1至A6中任一项所述的方法,其中该长效CNP衍生物或超长效CNP衍生物包含U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQID NO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.27],或其任何组合;
其中:
U是式(II)的部分,其中式(II)是
(聚合物)
(II)
其中
a是0或1(优选a是1);
该聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)或聚(N-乙烯基吡咯烷酮);
Y是:
4-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;或
接头(γE)
A20.如段落A1至A6和A19中任一项所述的方法,其中该长效CNP衍生物或该超长效CNP衍生物包含U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.27],或其任何组合;
其中:
U是式(II)的部分,其中式(II)是
(聚合物)
(II)
其中
a是0或1(优选a是1);
聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)、聚(N-乙烯基吡咯烷酮)或其衍生物;
Y是:
1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;
含有氨基酸残基的接头,其中该氨基酸残基共价连接至(聚合物)
不同于该1-10个氨基酸残基或肽序列的肽接头;或
接头(γE)
A21.如段落A1至A6、A19和A20中任一项所述的方法,其中该聚合物不包括聚(乙二醇)、MPEG、或聚(乙二醇)和MPEG两者。
A22.如段落A1至A6和A19至A21中任一项所述的方法,其中Y是:
4-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)和甘氨酸(G);或
接头(γE)
A23.如段落A1至A22中任一项所述的方法,其中推注剂量施用每天最多进行两次,并且施用途径包括皮下、静脉内、吸入、肌内、经鼻、肠内或其任何组合,或
其中该施用途径是皮下;或
其中该施用途径是静脉内;或
其中该施用途径是肌内;或
其中该施用途径是吸入;或
其中该施用途径是经鼻;或
其中肠内施用途径是口服。
A24.如段落A1至A23中任一项所述的方法,其中该受试者患有癌症。
A25.如段落A24所述的方法,其中该癌症选自乳腺癌;骨癌(例如,骨肉瘤);前列腺癌(例如,早期前列腺癌、晚期前列腺癌);结肠癌、头癌、颈癌、肝癌、肾癌、宫颈癌、肺癌、胃癌、尿道癌、膀胱癌、输尿管癌、肾盂癌、直肠癌、食道癌、淋巴结癌、胰腺癌、胃癌、卵巢癌;中枢神经系统癌、软组织癌、内分泌腺癌;或其任何组合,或
其中该受试者患有皮肤癌;或
其中该受试者患有结肠癌;或
其中该受试者患有乳腺癌;或
其中该受试者患有骨癌(例如,骨肉瘤);或
其中该受试者患有前列腺癌。
A26.如段落A24或段落A25所述的方法,其中该癌症对细胞毒性细胞免疫刺激剂有反应。
A27.如段落A24至A26中任一项所述的方法,其中该癌症选自头颈癌,皮肤癌,肝癌,肾癌,宫颈癌,肺癌,乳腺癌,胃癌,结肠癌,淋巴结癌,胰腺癌,卵巢癌如dMMR,尿道、膀胱、输尿管、肾盂及周围器官的癌症。
A28.如段落A25至A27中任一项所述的方法,其中
该皮肤癌包括梅克尔细胞癌、鳞状细胞癌、黑色素瘤或其任何组合;
该肝癌包括肝细胞癌;
该肾癌包括肾细胞癌;
该肺癌包括小细胞或非小细胞肺癌;
该乳腺癌包括三阴性乳腺癌;
该胃癌包括胃部癌、食管交界处腺癌、或dMMR;
该淋巴结癌包括霍奇金或非霍奇金PMBCL;
该胰腺癌和卵巢癌各自独立地包括dMMR;以及
肾盂区域周围器官的癌症包括尿路上皮癌。
A29.如段落A1至A28中任一项所述的方法,其进一步包括
向该受试者施用免疫佐剂,其中该免疫佐剂调节toll样受体,或细胞毒性细胞免疫刺激剂,该细胞毒性细胞免疫刺激剂包含靶向选自以下的免疫检查点蛋白的治疗剂(例如,蛋白质和/或小分子化合物)或抗体:CTLA-4(细胞毒性T淋巴细胞相关蛋白4)、PD1(程序性细胞死亡蛋白1或CD279)、PD-L1(程序性死亡配体1)、PD-L2(程序性死亡配体2)、LAG-3(淋巴细胞激活基因3蛋白)、BTLA(B和T淋巴细胞衰减子)、B7H3((CD276,B7和CD28家族的免疫检查点成员)、B7H4(B7家族的分子,负调节T细胞免疫)和TIM-3(在产生IFN-γ的T细胞上表达的共抑制受体);其中该细胞毒性细胞免疫刺激剂抑制免疫检查点蛋白;或
其中细胞毒性细胞免疫刺激剂包含针对免疫检查点蛋白的抗体或抗体的一部分、免疫检查点蛋白的可溶性配体、派姆单抗、纳武单抗、伊匹单抗、阿特利珠单抗、阿维鲁单抗、度伐鲁单抗、西米普利单抗、曲美利木单抗、兰博单抗和/或匹地利珠单抗;或
其中该免疫佐剂包含Toll样受体9激动剂;或
其中该免疫佐剂包含CpG寡脱氧核苷酸。
A30.如段落A1至A29中任一项所述的方法,其进一步包括向该受试者施用CAR T细胞。
A31.如段落A1至A28中任一项所述的方法,其中该组合物包含长效CNP组合物或超长效CNP衍生物组合物,该长效CNP组合物或超长效CNP衍生物组合物包含CNP、CNP衍生物或长效CNP衍生物和聚合物赋形剂,该聚合物赋形剂包含用聚乙二醇、脂肪酸、阴离子部分或其任何组合接枝的聚(氨基酸);其中该聚合物赋形剂适于螯合或非共价结合这些CNP或CNP衍生物中的任何。
A32.如段落A1至A31中任一项所述的方法,其中该组合物包含超长效CNP衍生物组合物,该超长效CNP衍生物组合物包含长效CNP衍生物和聚合物赋形剂,该聚合物赋形剂包含用聚乙二醇、脂肪酸、阴离子部分或其任何组合接枝的聚(氨基酸);并且其中该聚合物赋形剂适于螯合或非共价结合该长效CNP衍生物。
A33.如段落A1至A4和A23至A30中任一项所述的方法,其中该长效NPRB激动剂或该超长效NPRB激动剂包含多肽。
A34.如段落A33所述的方法,其中该多肽包含抗体。
A35.如段落A1至A4和A23至A33中任一项所述的方法,其中该长效NPRB激动剂或该超长效NPRB激动剂包含分子量小于2kDa的分子。
A36.如段落A1至A35中任一项所述的方法,其中该组合物不会使血压降低超过基线血压测量值的15%。
A37.如段落A1至A35中任一项所述的方法,其中该组合物不会使血压降低超过基线血压测量值的10%。
A38.一种治疗患有癌症的受试者的方法,该方法包括
向有需要的该受试者施用治疗有效推注剂量的组合物,该组合物包含长效CNP衍生物或超长效CNP衍生物,该长效CNP衍生物或超长效CNP衍生物包含U-GLSKGCFGLKLDRIGSMSGLGC[SEQ ID NO.2],U-GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.3],GLSKGCFGLK(U)LDRIGSMSGLGC[SEQ ID NO.4],U-CFGLKLDRIGSxSGLGC,其中x是天然或非天然氨基酸残基[SEQ ID NO.11],或其任何组合,
其中:
U是式(I)或(II)的部分,其中式(I)是
(脂肪族)
(I)
其中
a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);或
X是接头(γE)
并且式(II)是
(聚合物)
(II)
其中
a是0或1(优选a是1);
聚合物是纤维素、聚(乙二醇)(PEG)、甲氧基聚(乙二醇)(MPEG)、聚(乳酸-共-乙醇酸)、聚(N-乙烯基吡咯烷酮)或其衍生物;
Y是:
1-10个氨基酸残基或肽序列,其中每个氨基酸残基独立地选自赖氨酸(K)、精氨酸(R)、甘氨酸(G)、丙氨酸(A)、谷氨酸(E)和天冬氨酸(D);
包含酯、酰胺、硫醚、醚、硫醚、氨基甲酸酯部分或其组合的非氨基酸接头;
含有氨基酸残基的接头,其中该氨基酸残基共价连接至(聚合物)
不同于该1-10个氨基酸残基或肽序列的肽接头;
其中该组合物不会使血压降低超过基线血压测量值的15%(例如,超过15%,或超过10%),其中该基线血压测量值是该组合物施用前的平均血压;并且
其中该组合物在1小时至12小时(例如,2至12小时、4至12小时、1至24小时、2至24小时、4至24小时、1至84小时、2至84小时、4至84小时、12至84小时、1至168小时、2至168小时、4至168小时或12至168小时)将血浆环状GMP水平增加至基线血浆环状GMP水平的1.5x以上(例如,2x以上、3x以上、4x以上或5x以上),并且该基线血浆环状GMP水平是施用该组合物之前的平均血浆环状GMP水平或健康受试者的平均血浆环状GMP水平(优选地为该受试者在施用组合物之前的平均血浆环状GMP水平)。
A39.如段落A38所述的方法,其中Y是接头(γE)
A40.如段落A38或段落A39所述的方法,其中该长效CNP衍生物选自:
CH
CH
CH
CH
CH
HOC(=O)(CH
HOC(=O)(CH
A41.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是CH
A42.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是CH
A43.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是CH
A44.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是CH
A45.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是CH
A46.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是HOC(=O)(CH
A47.如段落A38至A40中任一项所述的方法,其中该长效CNP衍生物是HOC(=O)(CH
A48.如段落A38至A47中任一项所述的方法,其中该组合物包含超长效CNP衍生物组合物,该超长效CNP衍生物组合物包含长效CNP衍生物和聚合物赋形剂,该聚合物赋形剂包含用聚乙二醇、脂肪酸、阴离子部分或其任何组合接枝的聚(氨基酸);其中该聚合物赋形剂适于螯合或非共价结合该长效CNP衍生物。
A49.如段落A1至A48中任一项所述的方法,其中该受试者患有肿瘤并且向该受试者施用该治疗有效推注剂量的该组合物在肿瘤组织内增加血管正常化或使外膜细胞包被指数增加至少20%。
A50.如段落A1至A49中任一项所述的方法,其中该受试者患有肿瘤并且向该受试者施用该治疗有效推注剂量的该组合物减小该肿瘤的尺寸。
A51.如段落A1至A50中任一项所述的方法,其中该受试者患有肿瘤并且向该受试者施用该治疗有效推注剂量的该组合物改善该受试者的存活。
A52.如段落A1至A51任一项所述的方法,其中该受试者患有肿瘤并且向该受试者施用该治疗有效推注剂量的该组合物增加该肿瘤内的细胞毒性T细胞的数量。
A53.如段落A1至A52中任一项所述的方法,其中该受试者患有肿瘤并且向该受试者施用该治疗有效推注剂量的该组合物增加该肿瘤内的激活的NK细胞的数量。
A54.如段落A1至A53中任一项所述的方法,其中该受试者患有肿瘤并且向该受试者施用该治疗有效推注剂量的该组合物增加该肿瘤内的血管正常化、减小该肿瘤的尺寸、改善存活、增加该肿瘤内的细胞毒性T细胞的数量和/或增加该肿瘤内的激活的NK细胞的数量。
A55.一种包含长效CNP衍生物的组合物,该长效CNP衍生物包含式U-CFGLKLDRIGSxSGLGC[SEQ ID NO.30],其中
x是天然或非天然氨基酸残基,条件是x不是甲硫氨酸残基;并且
U具有式(I)的部分:
(脂肪族)
(I)
其中a是0或1(优选a是1);
脂肪族是任选地经取代的C
X是接头(γE)
A56.如段落A55所述的组合物,其中x是高谷氨酰胺,脂肪族是支链或直链的任选地经取代的通过羰基(例如,CH
A57.如段落A55所述的组合物,其中x是高谷氨酰胺,脂肪族是支链或直链的任选地经取代的通过羰基(例如,CH
A58.如段落A55所述的组合物,其中x是高谷氨酰胺,脂肪族是支链或直链的任选地经取代的通过羰基(例如,CH
A59.如段落A55所述的组合物,其中x是高谷氨酰胺(homoQ)[SEQ ID NO.16],U是(脂肪族)
A60.如段落A55所述的组合物,其中x是高谷氨酰胺(homoQ)[SEQ ID NO.17],U是(脂肪族)
A61.如段落A55所述的组合物,其中x是高谷氨酰胺,脂肪族是CH
A62.如段落A55所述的组合物,其中x是高谷氨酰胺,脂肪族是CH
A63.如段落A55所述的组合物,其中x是高谷氨酰胺,脂肪族是CH
A64.如段落A55所述的组合物,其中该长效CNP衍生物是HOC(=O)(CH
A65.如段落A55所述的组合物,其中该长效CNP衍生物是HOC(=O)(CH
A66.如段落A5至A54中任一项所述的方法,其中a是1。
A67.如段落A55至A65中任一项所述的组合物,其中a是1。
虽然已经说明和描述了说明性实施例,但是应当理解,在不脱离本披露的精神和范围的情况下可以在其中进行各种改变。
- 利尿钠肽、利尿肽或血管舒张肽用于治疗心血管适应症的方法
- C型利尿钠肽及其治疗急性肺损伤的方法
