用于胃癌相关基因甲基化检测的引物探针组合、试剂盒、方法与应用
文献发布时间:2023-06-19 19:28:50
技术领域
本公开涉及生物医学领域,尤其涉及用于胃癌相关基因甲基化检测的引物探针组合、试剂盒、方法与应用。
背景技术
据统计,全球每年有超过95万新发胃癌病例,且年死亡病例超过72万;在中国,胃癌是最常见的恶性肿瘤之一,其发病率在恶性肿瘤中排名第四。2015年,我国新增67.91万胃癌患者,死亡49.8万人。
我国胃癌的发病率和死亡率均排在所有癌症类型中的前几位,发病人数多,预后不佳。研究表明,胃癌的预后与诊治时机密切相关,早期胃癌5年生存率可达84%~99%;而进展期胃癌即使接受手术治疗,5年生存率仍低于30%;早期胃癌诊断标准是病灶浸润达黏膜层或者黏膜下层,无论是否有淋巴结转移,80%的早期胃癌往往没有明显症状,易被忽视。40岁以上、有胃癌家族史、幽门螺杆菌感染、慢性胃病、喜食腌制熏烤类食物、吸烟酗酒、压力大、生活不规律等是患胃癌的高危因素,建议相关人群进行预防性筛查。
目前,早期胃癌的诊断“金标准”仍为内镜下组织活检,而在我国大规模开展胃癌筛查条件尚不具备,同时也缺乏理想的生化或者生物学标志物检测作为筛查或普查胃癌的手段,虽然内镜下组织活检敏感度及特异度均较高,但由于其有创性、费用较高且部分地区医疗资源有限,故不能作为大规模人群的筛查手段。因此,亟需一种简单、易于实施的方法来判断是否需要进行大胃镜筛查。
发明内容
(一)发明目的
鉴于上述问题,为了能够通过简单、易于实施的手段来判断是否需要进行大胃镜筛查,本公开提供了以下技术方案。
(二)技术方案
本公开实施例的第一方面,提供了一种用于胃癌相关基因甲基化检测的引物探针组合,上述相关基因包括:RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因、NKD2基因和内参基因ACTB基因;
其中,检测上述RNF180基因的引物对序列如SEQ ID NO.1和SEQ ID NO.2所示,检测上述RNF18基因的探针序列如SEQ ID NO.3所示;
检测上述SEPTIN9基因的引物对序列如SEQ ID NO.4和SEQ ID NO.5所示,检测上述SEPTIN9基因的探针序列如SEQ ID NO.6所示;
检测上述DACT2基因的引物对序列如SEQ ID NO.7和SEQ ID NO.8所示,检测上述DACT2基因的探针序列如SEQ ID NO.9所示;
检测上述SDC2基因的引物对序列如SEQ ID NO.10和SEQ ID NO.11所示,检测上述SDC2基因的探针序列如SEQ ID NO.12所示;
检测上述NKD2基因的引物对序列如SEQ ID NO.13和SEQ ID NO.14所示,检测上述NKD2基因的探针序列如SEQ ID NO.15所示;
检测上述ACTB基因的引物对序列如SEQ ID NO.16和SEQ ID NO.17所示,检测上述ACTB基因的探针序列如SEQ ID NO.18所示。
本公开实施例的第二方面,提供了一种用于胃癌相关基因甲基化检测的试剂盒,包括上述用于胃癌相关基因甲基化检测的引物探针组合。
在一些可能的实施方式中,上述试剂盒还包括:PCR预混液和Taq DNA聚合酶扩增体系。
本公开实施例的第三方面,提供了一种胃癌相关基因甲基化检测方法,包括以下步骤:
S1、采集并分离静脉血得到血浆,提取上述血浆中的游离RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因的基因片段,备用;
S2、将提取的游离RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因的基因片段进行亚硫酸盐转化,设计包含上述引物探针组合的荧光PCR反应体系,利用上述荧光PCR反应体系对亚硫酸盐转化后的游RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因的基因片段进行基因扩增;
S3、对步骤S2获取的基因扩增结果CT值与临界值进行比较分析,当CT值小于或等于临界值时为阳性,表明收集的血浆中含有甲基化的RNF18基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因中的至少一种。
在一些可能的实施方式中,上述采集并分离静脉血得到血浆,包括:
采集静脉血;
将上述静脉血进行两次离心后得到血浆。
在一些可能的实施方式中,步骤S2中进行基因扩增时RNF180基因选择FAM荧光通道,SEPTIN9基因选择JOE荧光通道,DACT2基因选择FAM荧光通道,SDC2基因选择JOE荧光通道,NKD2基因选择Texas Red荧光通道,ACTB基因选择CY5荧光通道。
在一些可能的实施方式中,步骤S2中基因扩增的条件为95℃,300s,预变性;95℃,15s,变性;55℃,35s,运行45个循环进行退火、延伸及检测荧光。
在一些可能的实施方式中,步骤S3包括:
当内参基因ACTB基因的Ct值≤30,RNF18基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,RNF18基因发生了甲基化;
当SEPTIN9基因的Ct值≤32且有“S”扩增曲线,表明检测结果为阳性,SEPTIN9基因发生了甲基化;
当DACT2基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,DACT2基因发生了甲基化;
当SDC2基因的Ct值≤32且有“S”扩增曲线,表明检测结果为阳性,SDC2基因发生了甲基化;
当NKD2基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,NKD2基因发生了甲基化。
在一些可能的实施方式中,当内参基因ACTB基因的Ct值>30或无扩增,表示基因扩增结果无效。
本公开实施例的第四方面,提供了一种用于胃癌相关基因甲基化检测的引物探针组合在检测胃癌相关基因甲基化中的应用,上述相关基因包括:RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因、NKD2基因。
(三)有益效果
本公开实施例与现有技术相比存在的有益效果是:
在疑似病例中,先进行本公开的胃癌基因甲基化检测,阳性者,判断需胃镜进一步检查,阴性者,表明肠道症状非癌症引起,低风险,避免胃镜检查。可见,通过采用本公开的引物探针组合在进行检测时,能够避免不必要的大胃镜检查,整个过程可以简便的采用外周血体外检测,无创伤、简便易行。
附图说明
为了更清楚地说明本公开实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本公开的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
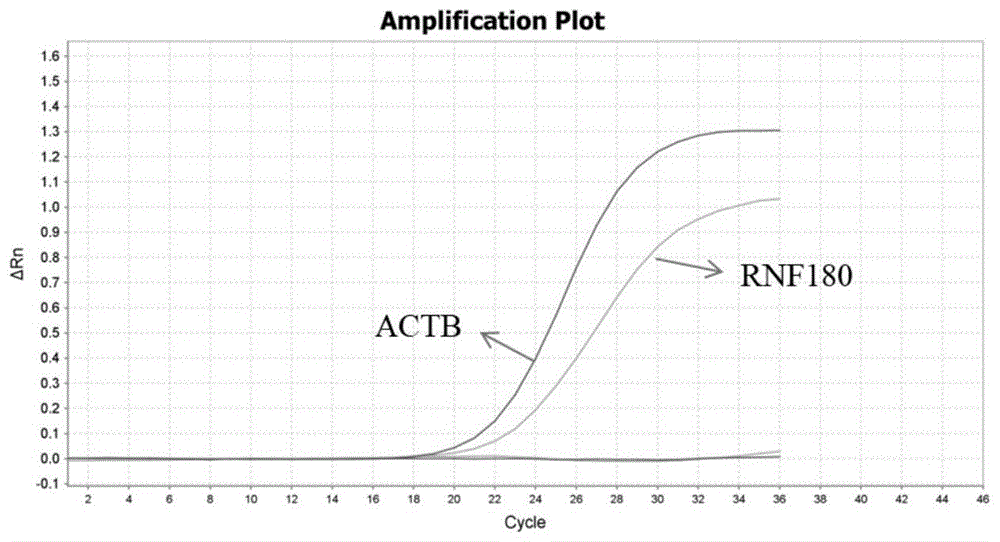
图1是RNF18基因甲基化阳性图;
图2是SEPTIN9基因甲基化阳性图;
图3是DACT2基因甲基化阳性图;
图4是SDC2基因甲基化阳性图;
图5是NKD2基因甲基化阳性图。
具体实施方式
下面结合具体实施方式对本公开进行进一步的详细描述,给出的实施例仅为了阐明本公开,而不是为了限制本公开的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本公开的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本公开实施例的第一方面,提供了一种用于胃癌相关基因甲基化检测的引物探针组合,上述相关基因包括:RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因、NKD2基因和内参基因ACTB基因;
其中,检测上述RNF180基因的引物对序列如SEQ ID NO.1和SEQ ID NO.2所示,检测上述RNF18基因的探针序列如SEQ ID NO.3所示;
检测上述SEPTIN9基因的引物对序列如SEQ ID NO.4和SEQ ID NO.5所示,检测上述SEPTIN9基因的探针序列如SEQ ID NO.6所示;
检测上述DACT2基因的引物对序列如SEQ ID NO.7和SEQ ID NO.8所示,检测上述DACT2基因的探针序列如SEQ ID NO.9所示;
检测上述SDC2基因的引物对序列如SEQ ID NO.10和SEQ ID NO.11所示,检测上述SDC2基因的探针序列如SEQ ID NO.12所示;
检测上述NKD2基因的引物对序列如SEQ ID NO.13和SEQ ID NO.14所示,检测上述NKD2基因的探针序列如SEQ ID NO.15所示;
检测上述ACTB基因的引物对序列如SEQ ID NO.16和SEQ ID NO.17所示,检测上述ACTB基因的探针序列如SEQ ID NO.18所示。
其中,RNF180(ring finger protein 180)是肿瘤抑制因子,RNF180启动子甲基化在胃癌组织中可导致RNF180低表达或不表达,通过HGF、CCR-7、MMP-2、VEGF等多条信号通路促进胃癌细胞的进展和增殖。Septin9是Septin基因家族的一个成员,该基因家族至少由13个基因组成,它们编码保守的GTPase结构域,可以结合细胞骨架相关的蛋白,与细胞分裂与肿瘤发生相关。胃癌患者血浆样本中甲基化的RNF180及Septin9基因含量特征性增高。SDC2黏结蛋白聚糖2(syndecan 2,SDC2)参与肿瘤细胞活化、肿瘤血管生成及侵袭、转移。SDC2属于转化生长因子β通路相关基因,其与免疫监控及细胞增殖、侵袭、转移等密切相关;在结直肠癌中,SDC2主要调节细胞与肿瘤微环境的相互作用,使基质金属蛋白酶活化,分解细胞外基质,同时还参与了间质-上皮转化过程等生物学进程,促进肿瘤细胞的增殖和转移。SDC2基因甲基化与胃癌关系密切,MethHC数据库可知,SDC2基因启动子在胃癌组织中的甲基化水平明显高于正常组织,是胃癌筛查的潜在标志物。有良好的应用前景。DACT(Homosapiens dapper,antagonist of beta-catenin),又名frodo或dapper,是Wnt/β-catenin信号通路的负性调节基因家族。DACT2都是Dapper家族成员之一,定位于人染色体6q27区域。有研究推测DACT2的作用机制主要是促进ALK5通过溶酶体途径降解来调节细胞膜表面受体,从而来调控TGF-β信号转导。DACT2在人肺癌和肝癌中表达降低可能与其启动子区异常甲基化有关。Dact2启动子区甲基化在胃癌中有特异性,同正常胃的甲基化结果相比,具有成为胃癌早期监测标志物的可能性。NKD2位于染色体的5P15.3位点,该位点在结直肠癌和胃癌中频发杂合性缺失。NKD2甲基化可能是一个胃癌预后不良和对多西他赛耐药的标志物。NKD2在胃癌中的表达受启动子区甲基化调控,它可通过调控SOX18及其下游基因的表达而抑制胃癌的转移。
本引物探针组合选择TaqMan-MGB探针,MGB探针包括一个不发荧光的淬灭基团(NFQ),极大消除传统淬灭基团产生的背景荧光,提高信噪比,从而提高检验灵敏性,另外MGB(小沟结合物)分子结合到DNA螺旋小沟,通过稳定MGB探针/模板提高杂交稳定性,增加Tm值,使短至13个碱基的探针获得高错配区分辩别能力。
本公开实施例的第二方面,提供了一种用于胃癌相关基因甲基化检测的试剂盒,包括上述用于胃癌相关基因甲基化检测的引物探针组合。
在一些实施例中,上述试剂盒还包括:PCR预混液和Taq DNA聚合酶扩增体系。
进一步,上述试剂盒还包括阳性质控品、阴性质控品和空白质控品。
在一些实施例中,作为示例:试剂盒成分如下表:
Methylight PCR Mix试剂配制表如下:
2.5*RNF180/Septin9 Methylight PCR Mix试剂配置表如下:
2.5*DACT2/SDC2/NKD2 Methylight PCR Mix试剂配置表如下:
上述试剂盒在-20±5℃存储,有效期为12个月;开封后有效期为6个月;反复冻融3次有效。
本公开实施例的第三方面,提供了一种胃癌相关基因甲基化检测方法,包括以下步骤:
S1、采集并分离静脉血得到血浆,提取上述血浆中的游离RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因的基因片段,备用;
S2、将提取的游离RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因的基因片段进行亚硫酸盐转化,设计包含权利要求1上述引物探针组合的荧光PCR反应体系,利用上述荧光PCR反应体系对亚硫酸盐转化后的游RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因的基因片段进行基因扩增;
S3、对步骤S2获取的基因扩增结果CT值与临界值进行比较分析,当CT值小于或等于临界值时为阳性,表明收集的血浆中含有甲基化的RNF18基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因中的至少一种。
在一些可能的实施方式中,上述采集并分离静脉血得到血浆,包括:
采集静脉血;
将上述静脉血进行两次离心后得到血浆。
在一些可能的实施方式中,步骤S2中进行基因扩增时RNF180基因选择FAM荧光通道,SEPTIN9基因选择JOE荧光通道,DACT2基因选择FAM荧光通道,SDC2基因选择JOE荧光通道,NKD2基因选择Texas Red荧光通道,ACTB基因选择CY5荧光通道。
在一些可能的实施方式中,步骤S2中基因扩增的条件为95℃,300s,预变性;95℃,15s,变性;55℃,35s,运行45个循环进行退火、延伸及检测荧光。
在一些可能的实施方式中,步骤S3包括:
当内参基因ACTB基因的Ct值≤30,RNF18基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,RNF18基因发生了甲基化;
当SEPTIN9基因的Ct值≤32且有“S”扩增曲线,表明检测结果为阳性,SEPTIN9基因发生了甲基化;
当DACT2基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,DACT2基因发生了甲基化;
当SDC2基因的Ct值≤32且有“S”扩增曲线,表明检测结果为阳性,SDC2基因发生了甲基化;
当NKD2基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,NKD2基因发生了甲基化。
在一些可能的实施方式中,当内参基因ACTB基因的Ct值>30或无扩增,表示基因扩增结果无效。
本公开实施例的第四方面,提供了一种用于胃癌相关基因甲基化检测的引物探针组合在检测胃癌相关基因甲基化中的应用,上述相关基因包括:RNF180基因、SEPTIN9基因、DACT2基因、SDC2基因、NKD2基因。
下面通过具体实施例来说明本公开提供的胃癌相关基因甲基化检测方法。1实施例一、样本采集及预处理
1、样本的采集:
使用K2EDTA或游离核酸采血管,采血10mL,血样应该立即处理。K2EDTA采血管在血浆制备前,血液保存在2-8℃,不超过24小时,不要冰冻血样。游离核酸采血管在血浆制备前,可以保存在15-25℃,不超过72小时,不要冰冻血样。
2、血浆的制备和保存:
将采血管放入离心机进行离心,转速1350±150rcf,离心12分钟(禁止使用离心机的刹车功能,以防止血细胞层的破坏);从离心机中取出采血管,用新的一次性移液管把血浆转移到聚丙烯材质,圆锥底的15mL离心管中,再次离心,转度1350±150rcf,离心12分钟。用新的一次性移液管或者血清移液管把3.5mL的血浆加入新的离心管中,标记好样本号。血浆样本可以立即用于检测,或2℃-8℃保存(不超过24h),-15至-25℃条件下样本可保存一个月,低于-70℃条件下样本可保存六个月。参考离心机操作手册将rpm换算为rcf。
3、样本用量:3.5mL。
实施例二、试剂准备
1、从试剂盒中取出PCR反应液,室温解冻,充分融化后,轻轻振荡混匀,并作短暂离心备用。
2、根据待检样本数(n),每个反应分装PCR反应液各20μl。
实施例三、样本处理
1、血浆解冻
如果是冰冻的血浆样本,放置于室温(15-30℃),融化约30分钟,上述样本必须在融化60分钟内进行裂解程序。
2、核酸提取及亚硫酸盐转化
参考所购买的商用试剂盒说明书进行操作核酸提取或纯化试剂盒,用于血浆游离核酸提取及核酸亚硫酸盐转化。
如果处理后的DNA不能立即使用,2到8度可以储存24小时,-25℃到-15℃可以储存72小时。
实施例四、加样
在准备好试剂的PCR反应管中分别加入待测样本DNA。每个PCR反应中各加30μLDNA,盖紧管盖后,瞬时低速离心。注意:密封后的PCR板可在2-8℃最多放置4小时。
实施例五、PCR扩增
1、样品设置:根据样本类型设置样本编号,PCR仪的96孔加样布局见下表。表中PC代表阳性质控品(Positive Control),NC代表阴性质控品(Negative Control),NTC代表无模板对照(No Template Control),S代表检测样本(sample)。
/>
2、荧光通道选择:RNF180基因选择FAM荧光通道,SEPTIN9基因选择JOE荧光通道,DACT2基因选择FAM荧光通道,SDC2基因选择JOE荧光通道,NKD2基因选择Texas Red荧光通道,ACTB基因选择CY5荧光通道;参比荧光(Passive Reference)设置为none。
3、反应条件设定(反应体积设定为50μL):
4、保存文件,运行程序。
实施例六、结果分析
反应结束后自动保存结果,使用仪器配套软件自动分析结果,根据分析后图像调节Baseline的Start值、End值以及Threshold值(用户可根据实际情况自行调整,Start值可以在2~8、End值可设在10~20,荧光阈值(Threshold)设定原则以阈值线刚好超过阴性质控品品扩增曲线(无规则的噪音线)的最高点,且Ct值显示为undet),点击Analysis自动获得分析结果。
实施例七、结果判定标准。
PCR反应结果解释根据下表所示。如果内参ACTB基因显示单个中加入DNA的量足够的话(ACTB Ct值见下表),那么RNF18基因、SEPTIN9基因、DACT2基因、SDC2基因和NKD2基因结果视为本次PCR反应结果。如果ACTB的Ct值大于表中所设的阈值,那么定义该PCR反应为“无效”。
/>
1)若内参基因ACTB的Ct值≤30,RNF18基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,RNF18基因发生了甲基化;SEPTIN9基因的Ct值≤32且有“S”扩增曲线,表明检测结果为阳性,SEPTIN9基因发生了甲基化;DACT2基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,DACT2基因发生了甲基化;SDC2基因的Ct值≤32且有“S”扩增曲线,表明检测结果为阳性,SDC2基因发生了甲基化;NKD2基因的Ct值≤35且有“S”扩增曲线,表明检测结果为阳性,NKD2基因发生了甲基化;其中任意一个阳性则检测结果为甲基化阳性;
2)若内参基因的Ct值>30或无扩增,实验无效,提示加入的DNA含有PCR抑制剂,需要重新提取DNA并进行亚硫酸盐处理后检测
3)若内参基因的Ct值≤30,RNF18基因的Ct值>35且无扩增曲线,表明检测结果为阴性,RNF18基因未发生甲基化;SEPTIN9基因的Ct值>32且无扩增曲线,表明检测结果为阴性,SEPTIN9基因未发生甲基化;DACT2基因的Ct值>35且无扩增曲线,表明检测结果为阴性,DACT2基因未发生甲基化;SDC2基因的Ct值>32且无扩增曲线,表明检测结果为阴性,SDC2基因未发生甲基化;NKD2基因的Ct值>35且无扩增曲线,表明检测结果为阴性,NKD2基因未发生甲基化;
4)若判读结果为阴性,胃癌的风险较低,建议定期随访;若判读结果为阳性,患胃癌的风险较高,建议镜检或组织活检确认。
实施例8、选取40例已知临床信息进行样本测试,结果如下:
/>
试剂盒各样本基因检测结果
试剂盒各样本基因检测结
从上述具体实施例和应用可知:使用本发明试剂盒共检测40例样本,其中胃癌19例,均经过胃镜检查。19例胃癌样本中,检测为阳性的17例;21例正常人样本中,检测为阴性的19例。表明试剂盒检测灵敏度为89.47%,特异为90.48%,各基因甲基化阳性图分别见图1-图5,其中,图1是RNF18基因甲基化阳性图;图2是SEPTIN9基因甲基化阳性图;图3是DACT2基因甲基化阳性图;图4是SDC2基因甲基化阳性图;图5是NKD2基因甲基化阳性图。
以上描述仅为本公开的一些较佳实施例以及对所运用技术原理的说明。本领域技术人员应当理解,本公开的实施例中所涉及的发明范围,并不限于上述技术特征的特定组合而成的技术方案,同时也应涵盖在不脱离上述发明构思的情况下,由上述技术特征或其等同特征进行任意组合而形成的其它技术方案。例如上述特征与本公开的实施例中公开的(但不限于)具有类似功能的技术特征进行互相替换而形成的技术方案。
- 一种用于检测多靶点基因突变、甲基化修饰和/或羟甲基化修饰的检测探针、方法和试剂盒
- 用于检测PIK3CD基因E1021K位点突变的探针和引物组合及试剂盒
- 一种转基因玉米MON810的RPA检测引物与探针组合、试剂盒及检测方法
- 用于肿瘤基因变异检测的试剂盒、引物、探针和检测剂
- 用于检测A型猪轮状病毒的引物及探针、荧光定量PCR试剂盒及方法和应用
- 一种用于宫颈癌相关基因甲基化检测的引物探针组合和试剂盒及其应用
- 一种用于宫颈癌相关基因甲基化检测的引物探针组合和试剂盒及其应用
