一种调控丹参挥发性萜类化合物合成的MYC转录因子及其编码基因和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及植物次生代谢技术领域,尤其涉及一种调控丹参挥发性萜类化合物合成的MYC转录因子及其编码基因和应用。
背景技术
丹参(Salvia miltiorrhiza)作为我国的传统中药,为唇形科鼠尾草属,以根和根茎入药。药理学研究表明丹参中丹参酮类和酚酸类化合物对于治疗心脑血管疾病具有显著疗效,作为重要的药用植物,其体内的挥发性萜类的研究较少,挥发性萜类普遍具有抗氧化和抗菌的功能,可保护植物免受病菌的侵害,同时挥发性萜类也可通过吸引害虫的天敌实现间接防御反应。
萜类化合物是植物次生代谢产生的一类天然产物,其合成途径有甲羟戊酸途径(mevalonate pathway,MVA)和2-甲基赤藓糖醇-4-磷酸(2-methyl-D-erythritol-4-phosphate pathway,MEP)两种。萜类合成酶肽链的长度通常有550-850个氨基酸残基,倍半萜合酶肽链的长度为550-580个氨基酸。按照萜类合成酶的结构与反应机制的不同,可分为Class I类和Class II类两类,I类酶的催化活性位点有α结构域,有两个高度保守的基序DDXXD和NSE/DTE,II类酶的活性位点有β结构域,含有1个保守基序DXDD。然而目前,还未有见研究调控丹参挥发性萜类化合物合成的转录因子的报道。
发明内容
本发明的主要目的在于提供一种能够调控丹参挥发性萜类化合物合成的MYC转录因子及其编码基因和应用。
为实现上述目的,本发明提供了一种调控丹参挥发性萜类化合物合成的MYC转录因子,其氨基酸序列如SEQ ID NO.1所示。以下记作转录因子SmMYC10。
本发明还提供一种编码上述MYC转录因子的基因,其核苷酸序列如SEQID NO.2所示。以下记作编码基因SmMYC10。
本发明还提供一种上述MYC转录因子的靶基因,其核苷酸序列如SEQ IDNO.3所示。以下记作靶基因SmTPS1。
本发明还提供一种含有上述编码基因的过表达载体。
本发明还提供一种含有上述编码基因的干涉载体。
本发明还提供一种含有上述过表达载体或上述干涉载体的宿主菌。
本发明还提供一种含有上述靶基因的表达载体。
本发明还提供一种含有上述表达载体的宿主菌。
本发明还提供一种上述编码基因在调控丹参萜类化合物合成中的应用。
本发明还提供含有上述过表达载体或上述干涉载体的宿主菌瞬时侵染丹参花的方法,包括以下步骤:
(1)将农杆菌在含有卡那和利福平的抗性板上进行划线,两天之后挑取单菌落去进行菌落PCR,将鉴定结果正确的菌液扩大培养,至OD
(2)使用蘸花法将丹参花在侵染液中蘸取1min30s,侵染后暗处理三天。
本发明的有益效果体现在:
本发明利用基因组及转录组数据,筛选、克隆丹参中的一个MYC转录因子,并通过实验验证了其与靶基因启动子的特定顺式作用原件结合,来激活靶基因的活性,从而调控萜类化合物的合成。本发明通过酵母单杂交和荧光素酶实验,证明SmMYC10可以与proSmTPS1互作,推测SmTPS1可能为SmMYC10的下游靶基因。对靶基因SmTPS1进行体外酶活分析,之后为了验证SmMYC10能否调控丹参SmTPS的表达,对丹参花进行瞬时表达SmMYC10-OE和SmMYC10-RNAi,采用GC-MS测定它们与对照组中挥发性萜烯的含量变化。可见,该转录因子在丹参萜类化合物合成途径中具有广泛应用。
附图说明
图1为转录因子SmMYC与丹参萜类合成酶基因SmTPS1共表达网络图。
图2为编码基因SmMYC10琼脂糖凝胶电泳图。
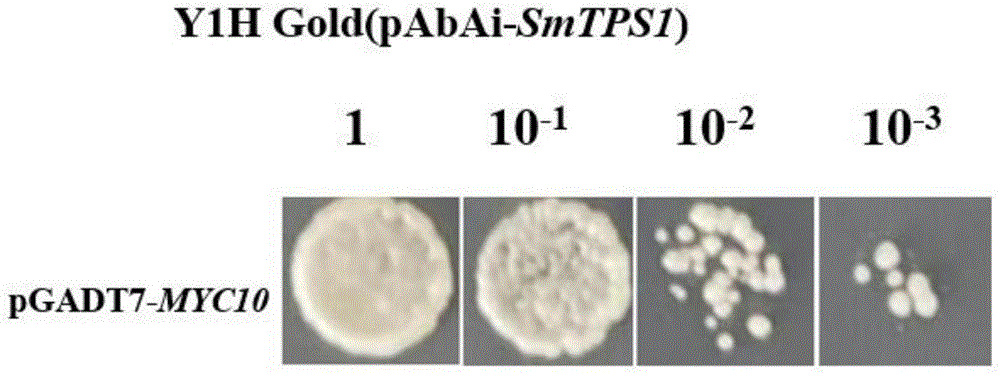
图3为酵母单杂交验证转录因子SmMYC10与proSmTPS1互作。
图4为双荧光素酶实验验证转录因子SmMYC10与proSmTPS1互作(注:左边为实验组SmMYC10+proSmTPS1,右边为对照组EV+proSmTPS1)。
图5为SmTPS1染色体定位图。
图6为SmTPS1琼脂糖凝胶电泳图。
图7为SmTPS1体外酶活分析图。
图8为转录因子编码基因SmMYC10瞬时转化丹参花GC-MS分析图。
具体实施方式
下面结合实施例对本发明作进一步描述,以下实施例所使用的各种原料和设备,如未作特别说明,均为本领域公知的市售产品。
实施例1
丹参SmMYC基因的筛选及编码基因SmMYC10全长cDNA的扩增
取盛花期的丹参花朵送诺禾致源公司进行转录组测序,根据前期所筛选到的丹参中的SmMYC基因和SmTPS基因以及转录组中所提供的丹参各个基因的表达量,构建了丹参SmMYC转录因子与萜类合成酶基因SmTPS1的共表达网络图,筛选到转录因子SmMYC10与萜类合成酶基因SmTPS1相关性较高。
使用植物RNA提取试剂盒提取紫花丹参总RNA,1%琼脂糖凝胶电泳检测RNA的完整性,使用分光光度计测定总RNAOD260/280检测RNA质量。按照逆转录试剂盒说明书,以提取的丹参总RNA为模板,逆转录合成得到cDNA。。
以丹参cDNA为模板,根据SmMYC10的CDS序列通过Primer Premier 5软件设计特异性引物,交由上海生工生物工程股份有限公司进行引物合成,之后通过PCR扩增,克隆得到目的基因。具体步骤如下:
以所提取的RNA为模板,采用两步法反转录成cDNA:
第一步:基因组DNA去除污染,反应体系如下表1所示:
表1
PCR反应条件如下:37℃温浴2min;55℃温浴5min;4℃2min。
第二步:cDNA合成,反应体系如下表2所示:
表2
PCR反应条件如下:50℃温浴15min:85℃温浴5min;4℃2min。反应结束后将反转录产物放-40℃保存。
SmMYC10引物设计序列如下表3所示:
表3
SmMYC10全长cDNA序列的获得:
以丹参cDNA为模板利用特异性引物扩增全长片段,PCR反应体系如下表4所示:
表4
PCR反应条件如下:
PCR结束之后,对目的基因条带进行胶回。
图1为转录因子SmMYC与丹参萜类合成酶基因SmTPS1共表达网络图,与其他SmMYC转录因子相比,SmMYC10转录因子的表达量与SmTPS1表达量相关性较高,因此选则SmMYC10转录因子做后续实验。
图2为编码基因SmMYC10琼脂糖凝胶电泳图,以丹参花cDNA为模板,对SmMYC10的CDs区域序列设计特异性引物进行PCR扩增,之后用琼脂糖凝胶电泳分离目的条带,条带大小为1506bp。
实施例2
酵母单杂交实验:通过实施例1发现SmTPS1与转录因子SmMYC10的表达量相关性较高,因此对SmMYC10与SmTPS1的启动子进行互作分析,具体步骤如下:
将实施例1得到的基因胶回产物,连接pMD18-T载体,转化大肠杆菌DH5α后选取菌落PCR有目的基因条带的菌进行测序,结果表明,所克隆的条带为所需要的目的条带。之后提取质粒,设计带有酶切位点EcoR I和BamHI的同源重组引物对质粒进行PCR扩增并胶回。同时对酵母单杂交载体PGADT7进行双酶切,酶切位点也为EcoR I和BamH I,反应条件为37℃反应3h,反应体系如下表5所示:
表5
之后将双酶切产物进行胶回,使用同源重组连接酶将胶回产物进行连接,连接反应体系如下表6所示:
表6
连接反应条件为50℃,反应15min。反应结束后,将连接产物转化大肠杆菌DH5α,之后涂布于带有氨苄抗生素的固体LB培养基上过夜培养,第二天挑取直径2mm左右的菌落进行PCR鉴定,选取阳性克隆菌液以1:1比例加入30%甘油放入-80℃冰箱进行保菌。
对与SmMYC10相关性较高的proSmTPS1进行克隆,测序正确后将启动子进行截短,连接pAbAi载体之后使用BstBⅠ酶将连接好的载体进行单酶切,使其线性化。
转录因子与启动子构建好载体之后,酵母单杂交分析具体步骤如下:
(1)酵母感受态的制备:将在-80℃保存的Y1Hgold菌液在YPDA固体培养基上进行划线,之后在28℃培养箱中培养3-4天至菌斑直径长至2mm左右。挑取2-3个直径2mm左右的菌株至1mL YPDA液体培养基中在28℃摇床中过夜小摇,第二天将小摇后的菌液在25mL的液体培养基中大摇,直至OD值达到0.4-0.6。在室温条件下将菌液以6000rpm/10min进行收菌,弃上清,加入10mL灭菌水重悬菌体,在离心机中6000rpm离心5min,弃上清,加入1.5mL的0.1M LiAc重悬菌体,转至2.0mL离心管,离心5分钟,去上清,加入600uL的0.1M LiAc即为感受态细胞。
(2)启动子在酵母菌Y1Hgold中的本底水平验证:将构建到pAbAi载体之后线性化的启动子转化酵母感受态细胞,涂布在SD/-Ura平板上,在28℃培养2-3天,待菌落长至2mm左右,进行菌落PCR鉴定,将验证成功的菌株使用0.9%NaCl调OD600值达到0.002,之后涂布在含有不同浓度的AbA的SD/-Ura平板上进行本地水平表达验证,确定能够抑制菌体生长的最低的AbA浓度。
(3)酵母单杂交实验:将上述含有启动子的酵母菌株制备感受态细胞,制备过程同步骤(1),将已经克隆好的并且成功构建pGADT7载体的转录因子重组质粒转化启动子酵母感受态,之后涂布于SD/-Leu平板上,在28℃培养箱中培养2-3天,后取单菌落进行菌落PCR鉴定,将鉴定正确的菌落用SD/-Leu液体培养基培养,之后将菌液进行稀释,分别稀释成1/10,1/100,1/1000三个不同浓度梯度的菌液,在能够抑制菌体生长的最低AbA浓度的SD/-Leu平板上进行点板,两天之后进行观察。
图3为酵母单杂交验证SmMYC10与proSmTPS1互作图,将构建pGADT7载体的SmMYC10转录因子重组质粒转化启动子酵母感受态,之后可以在AbA浓度为250ng/mL的SD/-Leu平板上随着菌液浓度的稀释正常生长,说明SmMYC10可与proSmTPS1序列结合。
实施例3
荧光素酶报告基因实验:
为了进一步验证SmMYC10与SmTPS1的启动子互作,通过将截断的启动子proSmTPS1构建到pGreenII0800-LUC载体的两个酶切位点(Hind III和XmaI)之间,将SmMYC10构建到pGreenⅡ62-SK载体的两个酶切位点(BamHI和EcoRI)之间。将构建好的载体以及空载体pGreenⅡ62-SK转入农杆菌GV3101。将阳性克隆的菌株在带有Kan和Rif的液体LB中进行扩大培养至菌株生长对数期,在离心机中以6000x离心10min,去除上清后用配置好的侵染液去重悬菌体,将OD调至OD
图4为双荧光素酶实验验证SmMYC10与proSmTPS1互作图,将含有启动子的菌液和含有转录因子的菌液以1:9的比例混合注射在烟草背面左侧,在烟草叶片右侧注射对照组,为空载体pGreenⅡ62-SK+proSmTPS1。由图4结果显示,叶片左测比右测荧光程度更亮,进一步说明SmMYC10对SmTPS1表达量有调控作用。
实施例4
通过生物信息学软件,预测出了51条萜类合成酶基因,并对其在染色体上的位置进行分析。之后对靶基因SmTPS1全长cDNA扩增及体外酶活检测:以紫花丹参cDNA为模板利用特异性引物扩增靶基因SmTPS1全长cDNA片段,引物设计如下表7所示:
表7
PCR之后得到胶回产物,连接pMD18-T载体进行测序分析,结果表明,所克隆的条带为所需要的目的条带。之后提取质粒,进行双酶切,并对原核表达载体PMAL-c2X也进行双酶切,酶切位点为xba1和pst1,反应条件为37℃反应3h。之后将双酶切产物进行胶回,使用T4连接酶将胶回产物进行连接,连接反应体系如下表8所示:
表8
连接反应条件为22℃,反应3h。反应结束后,将连接产物转化大肠杆菌DH5α,之后涂布于带有氨苄抗生素的固体LB培养基上过夜培养,第二天挑取直径2mm左右的菌落进行PCR鉴定,选取阳性克隆菌液以1:1比例加入30%甘油放入-80℃冰箱进行保菌。
对得到的pMAL-c2x-SmTPS1、pMAL-c2x-SmTPS4重组质粒,将其转化大肠杆菌表达菌株BL21,之后进行菌落PCR鉴定,对成功导入BL21菌株的阳性克隆菌液进行扩大培养,待菌液浑浊后使用分光光度计测定并调节OD
图5为SmTPS1染色体定位图,对预测出的51条萜类合成酶基因在染色体上的位置进行分析,由图可知,SmTPS1定位于第四条染色体上。
图6为SmTPS1琼脂糖凝胶电泳图,以丹参花cDNA为模板,对SmTPS1的CDs区域序列设计特异性引物进行PCR扩增,之后用琼脂糖凝胶电泳分离目的条带,条带大小为1671bp。
图7为SmTPS1体外酶活分析图,从图可以看出SmTPS1为多功能基因,SmTPS1的表达产物主要是Caryophyllene和α-Humulene。
实施例5
将转录因子SmMYC10的编码基因构建过表达载体和干涉载体瞬时侵染丹参花:将编码基因SmMYC10构建到真核表达载体pCAMBIA 1301a的两个酶切位点(kpnI和XbaI)之间。设计带有酶切位点的SmMYC10-RNAi序列,交由上海生工进行合成,用于构建SmMYC10 RNA干涉载体(SmMYC10-RNAi),将构建好的载体重组质粒分别转化根癌农杆菌GV3101。
农杆菌转化步骤如下:
(1)取-80℃保存的GV3101根癌农杆菌感受态于冰中融化。
(2)吸取30u感受态到1.5mL离心管,加入1u质粒DNA后吸打混匀,依次放于冰中静置5分钟、液氮5分钟、37℃水浴5分钟、冰浴5分钟。
(3)冰浴之后在超净工作台中加入600μL无抗生素的LB液体培养基,于28℃摇床中培养3小时。
(4)培养3小时之后在离心机中以6000rpm/10min进行收菌,吸出400u,将剩下的200u上清轻轻吸打菌体,吸打混匀之后涂布于含kan+与RIF+抗生素的固体LB培养基上,倒置放于28℃烘箱中培养2天。挑取单菌落于300uL卡那、利福平抗性的液体LB中进行过夜小摇。第二天进行菌液PCR鉴定。将鉴定正确的菌液300μL加入30%甘油300μL置于-80℃保存。
农杆菌活化及瞬时侵染丹参花,步骤如下:
(1)将上述农杆菌在含有卡那和利福平的抗性板上进行划线,两天之后挑取单菌落去进行菌落PCR,将鉴定结果正确的菌液去扩大培养,至OD
(2)使用蘸花法将丹参花在侵染液中蘸取1min30s,侵染后暗处理三天,同时将含有空载的根癌农杆菌做对照,之后采用GC-MS测定它们与对照组中的萜烯含量变化。
表9侵染液配方:(1L)
图8SmMYC10瞬时转化丹参花GC-MS分析图,将目的基因SmMYC10对丹参花进行瞬时表达SmMYC10-OE和SmMYC10-RNAi,GC-MS分析之后发现,SmMYC10-OE组与对照相比,SmTPS1主产物石竹烯(Caryophyllene)含量略有升高,而SmMYC10-RNAi中石竹烯含量与对照组相比明显下降,说明SmMYC10对SmTPS1表达量有上调作用。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 大戟二萜类化合物合成基因CYP71D452、其编码的蛋白质与应用
- 大戟二萜类化合物合成基因CYP726A33、其编码的蛋白质与应用
- 一种调控植物类黄酮合成的转录因子基因及其用途
- 丹参NAC1转录因子及其编码基因在调控丹参中丹酚酸类化合物含量方面的应用
- 丹参NAC1转录因子及其编码基因在调控丹参中丹酚酸类化合物含量方面的应用
