一种新型果胶寡糖及其制备方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及食品加工技术领域,具体地,涉及一种新型果胶寡糖及其制备方法和应用。
背景技术
果胶是一种来源于果蔬皮渣中的副产物,具有良好的凝胶性和乳化性,可作为凝胶剂、乳化剂和增稠剂应用于食品中;同时具有抗炎、提高免疫力以及抗癌等生物活性。果胶寡糖是基于果胶的低分子量组分,近些年来的研究表明,果胶寡糖因其分子量小,更容易被机体吸收从而具有更好的生物活性和多种促进健康的功能,如抑制病原体、诱导癌细胞凋亡、免疫调节、心血管保护作用和抗炎等作用,可用于保健食品中。果胶寡糖因安全、无诱变,也可用于儿童食品如奶粉中。另外,果胶寡糖作为一种新型的益生元,其对肠道微生物的调节功能也受到广泛关注。
目前制备果胶寡糖的方法主要有物理法、化学法和生物酶解法等。其中物理法即使用超声、微波等方式,利用超声空化及高频使果胶分子中的糖苷键断裂,从而使其分子量降低;化学法即使用酸水解(三氟乙酸、盐酸)、氧化还原反应,如Smith降解、高碘酸氧化、芬顿反应(过氧化氢和Fe
发明内容
本发明的目的是提供一种新型果胶寡糖及其制备方法和应用,该果胶寡糖富含半乳糖侧链,且分子量低、甲酯度低,可以提高发酵过程中的短链脂肪酸含量,具有调节肠道微生物的益生功能。
为了实现上述目的,本发明第一方面提供一种新型果胶寡糖,所述新型果胶寡糖的结构式如式(1)所示:
式(1)。
可选地,所述新型果胶寡糖的分子量为500~3500 g/mol。
本发明第二方面提供一种适用于前述的新型果胶寡糖的制备方法,该方法包括如下步骤:
S1、将果胶原料溶解在缓冲液中,得到第一原料液;
S2、在第一原料液中加入酶制剂进行酶解反应得到酶解液;将所述酶解液灭活后进行第一离心处理,得到第一上清液;
S3、将所述第一上清液进行第一浓缩处理得到第一浓缩液,将所述第一浓缩液进行第一半透膜透析,得到第一透析液和第一截留物;将所述第一截留物进行第二浓缩处理得到第二浓缩液,将所述第二浓缩液经过第二半透膜透析,得到第二透析液和第二截留物;
S4、将所述第二透析液分别进行第三浓缩处理和冷冻干燥;
其中,所述缓冲液的pH为4.0~5.0,所述缓冲液选自柠檬酸盐-磷酸盐缓冲液、醋酸-醋酸钠缓冲液、磷酸盐缓冲液和邻苯二甲酸氢钾-氢氧化钠中的至少一种;所述第一半透膜的截留分子量为500~1000Da,所述第二半透膜的截留分子量为3500~4000Da。
可选地,所述果胶原料选自柑橘果胶原料、苹果果胶原料、甜菜果胶原料和无花果果胶原料中的至少一种,优选为柑橘果胶原料;进一步优选地,所述柑橘果胶原料的制备方法包括:将橘皮粉碎,将粉碎后的橘皮进行过筛处理,得到第一橘皮原料;将第一橘皮原料中加入去离子水,所述第一橘皮原料的重量与去离子水的体积的比例为1:20~35,并调整pH为1.5~3,得到第一混合液;将所述第一混合液搅拌后进行第二离心处理,得到第二上清液;在所述第二上清液中加入乙醇,所述第二上清液与乙醇的体积比为1:2~3,得到第二混合液;将所述第二混合液进行沉淀处理后再进行抽滤处理,得到第一沉淀物;将所述第一沉淀物进行烘干处理和粉碎处理。
可选地,步骤S2中,所述酶制剂为复合果胶酶制剂,所述酶制剂中含有聚半乳糖醛酸酶、β-半乳糖苷酶、阿拉伯聚糖酶和阿拉伯呋喃糖苷酶;所述聚半乳糖醛酸酶、β-半乳糖苷酶、阿拉伯聚糖酶和阿拉伯呋喃糖苷酶的质量比为23~28:10~15:10~15:20~25。
可选地,所述酶制剂的酶活力为7700U/mL;相对于每升所述第一原料液,所述酶制剂的添加量为0.2~0.6mL。
可选地,步骤S2中,所述酶解反应的条件包括:温度为40~50℃,优选为43~47℃;时间为2~3h,优选为2.5~3h;所述灭活的步骤包括:将所述酶解液沸水浴加热10~15 min后冷却至20~30℃;所述第一离心处理的条件包括:转数为8000-10000 r/min;时间为10~20min。
可选地,所述缓冲液为柠檬酸盐-磷酸盐缓冲液;所述缓冲液的pH为4.3~4.7;
可选地,所述柠檬酸盐-磷酸盐缓冲液中的柠檬酸盐选自柠檬酸、柠檬酸钠、柠檬酸一水合物中的一种或几种;磷酸盐选自磷酸氢二钠、磷酸氢二钾、二水合磷酸氢二钠、二水合磷酸氢二钾中的一种或几种。
可选地,步骤S3中,所述第一浓缩处理为真空低温浓缩,所述第一浓缩处理的温度45~55℃,所述第一浓缩液与所述上清液的体积比1:3~5,优选为1:4;所述第二浓缩处理为真空低温浓缩,所述第二浓缩处理的温度为45~55℃,所述第二浓缩液与所述上清液的体积比1:5~15,优选为1:10;所述第三浓缩处理为真空低温浓缩,所述第三浓缩处理的温度为45~55℃,所述第三浓缩处理得到的第三浓缩液与所述上清液的体积比1:5~15,优选为1:10;所述冷冻干燥的条件包括:温度为-60~-50℃,时间为36~72 h。
本发明第三方面提供一种前述的新型果胶寡糖在增加肠道短链脂肪酸、提升肠道益生功能产品中的应用;可选地,所述产品选自食品、饮料、保健品和药品中的至少一种。
通过上述技术方案,本发明提供一种新型果胶寡糖及其制备方法和应用。该方法制备的果胶寡糖分子量为500-3500 Da,且富含半乳糖侧链,该新型果胶可以显著提高发酵过程中的短链脂肪酸含量,能够调节肠道微生态,增加拟杆菌属、柯林斯菌属、狄氏副拟杆菌和另枝菌属等有益菌的相对丰度。具有调节肠道微生物的益生功能;同时该方法操作简单,生产成本低,有利于充分利用果蔬废弃物,提高其附加值,实现果胶寡糖的绿色生产和高效制备,易于实现工业化生产并提高经济效益。
本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
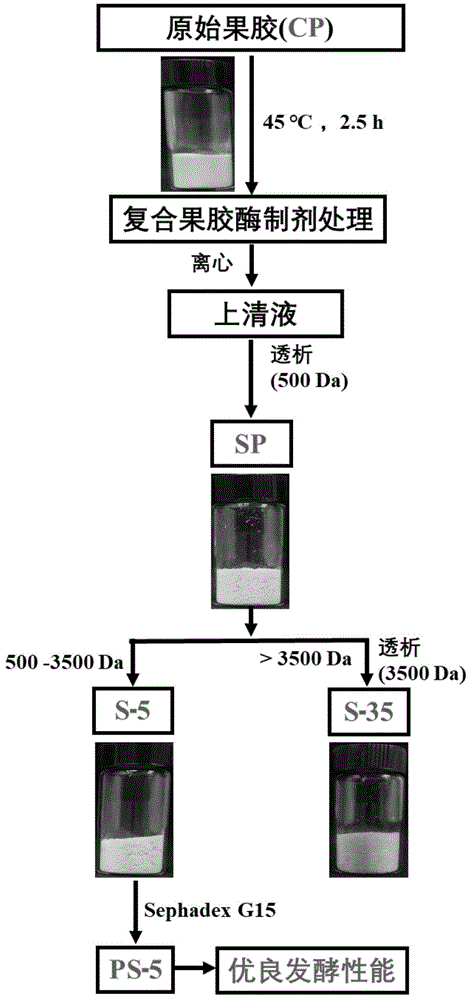
图1为本发明中制备不同果胶酶解产物的步骤流程图。
图2为本发明中使用的复合果胶酶SDS-PAGE图;其中:多聚半乳糖醛酸酶、β-半乳糖苷酶、阿拉伯糖苷酶、阿拉伯呋喃糖苷酶以及鼠李半乳糖醛酸裂解酶的分子量分别为25-50 kDa、125 kDa、37 kDa、62 kDa及76.14 k Da。
图3为本发明的实施例1中使用酶制剂的酶解过程。
图4为本发明的实施例1中S-5的洗脱曲线图。
图5为所述果胶酶解产物的红外光谱图。
图6为所述果胶酶解产物体外发酵的乙酸含量图。
图7为所述果胶酶解产物体外发酵的丙酸含量图。
图8为所述果胶酶解产物体外发酵的丁酸含量图。
图9为所述果胶酶解产物体外发酵的总短链脂肪酸酸含量图。
图10为所述果胶酶解产物体外发酵过程中在属分类学水平肠道微生物变化。
图11为所述果胶酶解产物中具有最高产短链脂肪酸性能的组分S-5的核磁氢谱图。
图12为所述果胶酶解产物中具有最高产短链脂肪酸性能的组分S-5的核磁碳谱图。
图13为所述果胶酶解产物中具有最高产短链脂肪酸性能的组分S-5的HMQC谱图。
图14为所述果胶酶解产物中具有最高产短链脂肪酸性能的组分S-5的COSY谱图。
图15为所述果胶酶解产物中具有最高产短链脂肪酸性能的组分S-5的HMBC谱图。
图16为所述果胶酶解产物中具有最高产短链脂肪酸性能的组分S-5的结构。
具体实施方式
以下结合附图对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
本发明第一方面提供一种新型果胶寡糖,所述新型果胶寡糖的结构式如式(1)所示:
式(1)。
其中,“α-Gal
在本发明的一种实施方式中,所述新型果胶寡糖的分子量为500~3500 g/mol。
本发明中,所述新型果胶寡糖由半乳糖、半乳糖醛酸和鼠李糖组成。
本发明的新型果胶寡糖分子量低、甲酯度低,能够显著提高发酵过程中的短链脂肪酸含量,在体外发酵72 h后,总短链脂肪酸浓度为123.49±1.10mmol/L,远高于公认的益生元菊粉(93.32±0.74 mmol/L)和原始果胶(40.55±1.83 mmol/L)。同时能够调节肠道微生态的结构,增加拟杆菌属、柯林斯菌属、狄氏副拟杆菌和另枝菌属等有益菌的相对丰度,具有调节肠道微生物的益生功能。在本发明中使用的酶为复合果胶酶,该酶中含有的聚半乳糖醛酸酶可以将果胶HG区的半乳糖醛酸之间的α-糖苷键断裂,从而产生富含RG-I的组分;该酶中还含有阿拉伯糖苷酶以及半乳糖苷酶(图2),可以将果胶RG-I中的阿拉伯糖侧链和半乳糖侧链断裂,产生富含RG-I侧链的新型果胶寡糖。
本发明第二方面提供一种适用于前述的新型果胶寡糖的制备方法,该方法包括如下步骤:
S1、将果胶原料溶解在缓冲液中,得到第一原料液;
S2、在第一原料液中加入酶制剂进行酶解反应得到酶解液;将所述酶解液灭活后进行第一离心处理,得到第一上清液;
S3、将所述第一上清液进行第一浓缩处理得到第一浓缩液,将所述第一浓缩液进行第一半透膜透析,得到第一透析液和第一截留物;将所述第一截留物进行第二浓缩处理得到第二浓缩液,将所述第二浓缩液经过第二半透膜透析,得到第二透析液和第二截留物;
S4、将所述第二透析液分别进行第三浓缩处理和冷冻干燥;
其中,所述缓冲液的pH为4.0~5.0,所述缓冲液选自柠檬酸盐-磷酸盐缓冲液、醋酸-醋酸钠缓冲液、磷酸盐缓冲液、和邻苯二甲酸氢钾-氢氧化钠中的至少一种;所述第一半透膜的截留分子量为500~1000 Da,所述第二半透膜的截留分子量为3500~4000 Da。
本发明提供的新型果胶寡糖的制备方法采用了酶解法,具体方法如图1所示,该方法操作简单、生产成本低,并且该方法能够实现不同分子量柑橘果胶寡糖的制备,适合实现工业化生产并提高经济效益;制备得到的新型果胶寡糖具有提升肠道益生的功能在体外发酵72h后,总短链脂肪酸浓度为123.49±1.10 mmol/L,同时能够调节肠道微生态的结构,增加拟杆菌属、柯林斯菌属、狄氏副拟杆菌和另枝菌属等有益菌的相对丰度。本发明中,该酶解流程如图3所示;在本发明的一种具体实施方式中,如图4所示,将得到的酶解产物进行纯化,该酶制剂中含有的聚半乳糖醛酸酶可以将果胶HG区的半乳糖醛酸之间的α-糖苷键断裂;该酶制剂中含有的阿拉伯聚糖酶、β-半乳糖苷酶和阿拉伯呋喃糖苷酶,可以将果胶RG-I中的阿拉伯糖侧链和半乳糖侧链断裂,按照分子量分级后产生富含鼠李半乳糖醛酸聚糖I(简称RG-I)侧链的果胶寡糖。
在本发明的一种实施方式中,所述果胶原料中,果胶的浓度可以为0.5~1.5wt%;例如可以为0.5%、1.0%、1.5%或者它们之间任意的数值。可选地,所述果胶原料选自柑橘果胶原料、苹果果胶原料、甜菜果胶原料和无花果果胶原料中的至少一种,优选为柑橘果胶原料;在本发明的一种优选具体实施方式中,所述柑橘果胶原料的制备方法包括:将橘皮粉碎,将粉碎后的橘皮进行过筛处理,得到第一橘皮原料;将第一橘皮原料中加入去离子水,所述第一橘皮原料的重量与去离子水的体积的比例为1:20~35,并调整pH为1.5~3,得到第一混合液;将所述第一混合液搅拌后进行第二离心处理,得到第二上清液;在所述第二上清液中加入乙醇,所述第二上清液与乙醇的体积比为1:2~3,得到第二混合液;将所述第二混合液进行沉淀处理后再进行抽滤处理,得到第一沉淀物;将所述第一沉淀物进行烘干处理和粉碎处理。
本发明中,优选以柑橘皮为原料来制备果胶原料,经过酸提法制备得到的高酯果胶,该果胶具有良好的凝胶性能,其制备方法与在食品工业中广泛应用的商业果胶制备方法相同,有利于工业化生产和应用。在上述实施方式中,可以使盐酸来调整pH,盐酸的浓度可以为0.1mol/L。
在本发明的一种具体实施方式中,步骤S2中,所述酶制剂为复合果胶酶制剂,所述酶制剂中含有聚半乳糖醛酸酶、β-半乳糖苷酶、阿拉伯聚糖酶和阿拉伯呋喃糖苷酶;所述聚半乳糖醛酸酶、β-半乳糖苷酶、阿拉伯聚糖酶和阿拉伯呋喃糖苷酶的质量比为23~28:10~15:10~15:20~25。
本发明中,使用的复合果胶酶制剂是一种新型酶制剂,主要由多聚半乳糖醛酸酶、β-半乳糖苷酶、阿拉伯糖苷酶以及阿拉伯呋喃糖苷酶等果胶酶组成(如图2),酶活力为7700U/mL。本发明的发明人发现,使用本申请提供的复合酶制剂酶解后得到的酶解液中含有RG-I半乳聚糖结构域。
在本发明的一种具体实施方式中,相对于每升所述第一原料液,所述酶制剂的添加量为0.2~0.6mL。
在本发明的一种具体实施方式中,步骤S2中,所述酶解反应的条件包括:温度为40~50℃,优选为43~47℃;时间为2~3h,优选为2.5~3h;
所述灭活的步骤包括:将所述酶解液沸水浴加热10~15 min后冷却至20~30℃;
所述第一离心处理的条件包括:转数为8000-10000 r/min;时间为10~20min。
在本发明的一种实施方式中,所述缓冲液为柠檬酸盐-磷酸盐缓冲液;所述缓冲液的pH为4.3~4.7;在本发明的一种优选实施方式中,所述柠檬酸盐-磷酸盐缓冲液中的柠檬酸盐选自柠檬酸、柠檬酸钠、柠檬酸一水合物中的一种或几种;磷酸盐选自磷酸氢二钠、磷酸氢二钾、二水合磷酸氢二钾、二水合磷酸氢二钠中的一种或几种。
在本发明的一种具体实施方式中,步骤S2中,所述酶解反应的条件包括:温度为40-50℃,优选为43~47℃;时间为2-3 h,优选为2.5~3h;所述灭活的步骤包括:将所述酶解液沸水浴加热10~15 min后冷却至20~30℃;所述离心处理的条件包括:转数为8000-10000r/min;时间为10~20 min。
本发明中,在酶解反应结束后,将反应后的料液置于沸水浴中进行保温能够使使用的果胶酶制剂失活。所述“离心”可以采用本领域常规的离心机进行离心。
在本发明的一种具体实施方式中,步骤S3中,所述第一浓缩处理为真空低温浓缩,所述第一浓缩处理的温度为45~55℃,所述第一浓缩液与所述上清液的体积比1:3~5,优选为1:4;所述第二浓缩处理为真空低温浓缩,所述第二浓缩处理的温度为45~55℃,所述第二浓缩液与所述上清液的体积比1:5~15,优选为1:10。
在本发明的一种具体实施方式中,所述第三浓缩处理为真空低温浓缩,所述第三浓缩处理的温度为45~55℃,所述第三浓缩处理得到的第三浓缩液与所述上清液的体积比1:5~15,优选为1:10;所述冷冻干燥的条件包括:温度为-60~-50℃,时间为36~72 h。
本发明第三方面提供一种前述的新型果胶寡糖在增加肠道短链脂肪酸、提升肠道益生功能产品中的应用;在本发明的一种具体实施方式中,所述产品选自食品、饮料、保健品和药品中的至少一种。
下面通过实施例来进一步说明本发明,但是本发明并不因此而受到任何限制。
实施例和对比例中所用的原料无特殊说明均通过商购途径获得。
本发明中离心采用常规的离心机。
本发明中高效排阻色谱仪的型号为L2130 (日本日立公司)。
本发明中离子色谱仪的型号为ICS-3000 (美国Sunyvale公司)。
本发明中氮吹仪的型号为DCY-24B (申贝科学仪器(苏州)有限公司)。
本发明中傅里叶红外光谱仪的型号为TENSOR 27 FTIR (德国Bruker公司)。
实施例1
本实施例用于说明分子量在500~3500 Da的果胶寡糖的制备。
(1)果胶酶解:以果胶为原料,将其溶解在1L、0.1 mol/L,pH为4.5的柠檬酸-磷酸氢二钠缓冲液中,使果胶的浓度为1.0%。在体系中加入复合果胶酶制剂(酶活7700 U/mL)进行酶解,酶的用量为每1000 mL 浓度为1%的果胶溶液中加入0.2 mL复合果胶酶,酶解温度为45℃,酶解时间为2.5 h。酶解结束后将体系放入沸水浴加热温10 min使酶失活,冷却至室温后,反应体系于8000 r/min的转速下离心15 min取上清液。
(2)酶解产物分级:将离心后的上清液于50 ℃条件下真空旋转浓缩至原体积的1/4,得到浓缩液,用截留分子量为500 Da的半透膜透析,以除去缓冲液体系中的无机盐和酶解过程中产生的小分子寡糖,透析结束后,将透析袋内的溶液浓缩至原体积的1/10后继续使用截留分子量为3500 Da的半透膜透析,透析结束后收集透析袋外的溶液,将其浓缩至原体积的1/10后冷冻干燥得到分子量处于500~3500 Da之间的果胶寡糖,命名为S-5。
实施例2
本实施例用于说明分子量在500~3500 Da的柑橘果胶寡糖的分离纯化。
果胶寡糖分离纯化:将上述实施例1制备的分子量在500~3500 Da的柑橘果胶寡糖S-5使用Sephadex G-15凝胶柱(10mm × 40cm)进一步分离纯化。将50 mgS-5样品用2mL超纯水溶解,使其浓度为25 mg/mL。将其装载于活化后的凝胶柱上,用超纯水以1.5 mL/min的流速洗脱,每2min收集1管洗脱液,采用苯酚硫酸法于490 nm处测定吸光度,收集吸光度大于0.3的组分,混合后冻干即得到分离纯化后的果胶寡糖,命名为PS-5,以备后续的精细结构鉴定。
对比例1
本对比例用于说明分子量大于500 Da的低分子量果胶的制备。
(1)果胶酶解:以果胶为原料,将其溶解在1L、0.1 mol/L,pH为4.5的柠檬酸-磷酸氢二钠冲液中,使果胶的浓度为1%。在体系中加入筛选后的果胶酶制剂(复合果胶酶制剂,酶活7700 U/mL)进行酶解,酶的用量为每1000 mL浓度为1%的果胶溶液中加入0.2 mL复合果胶酶制剂,酶解温度为45 ℃酶解时间为2.5 h。酶解结束后将体系放入沸水浴加热温10min使酶失活,冷却至室温后,反应体系于8000 r/min的转速下离心15 min取上清液。
(2)酶解产物分级:将离心后的上清液于50 ℃条件真空下旋转浓缩至原体积的1/4,得到浓缩液,用截留分子量为500 Da的半透膜透析,以除去缓冲液体系中的无机盐和酶解过程中产生的小分子寡糖,透析结束后,将透析袋内的溶液浓缩至原体积的1/10后冷冻干燥得到分子量大于500 Da的低分子果胶酶解产物,命名为SP。
对比例2
本对比例用于说明分子量大于3500 Da的低分子量果胶的制备。
(1)果胶酶解:以果胶为原料,将其溶解在1L、0.1mol/L,pH为4.5的柠檬酸-磷酸氢二钠缓冲液中,使果胶的浓度为1%。在体系中加入果胶酶(复合果胶酶制剂,酶活7700 U/mL)进行酶解,酶的用量为每1000 mL 浓度为1%的果胶溶液中加入0.2 mL复合果胶酶制剂r,酶解温度为45℃,酶解时间为2.5 h。酶解结束后将体系放入沸水浴加热温10 min使酶失活,冷却至室温后,反应体系于8000 r/min的转速下离心15 min取上清液。
(2)酶解产物分级:将离心后的上清液于50 ℃条件下真空旋转浓缩至原体积的1/4,得到浓缩液,用截留分子量为500 Da的半透膜透析,以除去缓冲液体系中的无机盐和酶解过程中产生的小分子寡糖,透析结束后,将透析袋内的溶液浓缩至原体积的1/10后继续使用截留分子量为3500 Da的半透膜透析,透析结束后收集透析袋内的溶液,将其浓缩至原体积的1/10后冷冻干燥得到分子量大于3500 Da的低分子果胶酶解产物,命名为S-35。
对比例3
本对比例用于说明使用聚半乳糖醛酸酶酶解果胶产物的制备。
制备方法与实施例1相同,不同之处在于,步骤S2中的酶制剂为聚半乳糖苷酶。
酶解产物分级:将离心后的上清液于50 ℃条件下真空旋转浓缩至原体积的1/4,得到浓缩液,用截留分子量为3500 Da的半透膜透析,得到分子量为3500 Da的果胶产物3。
对比例4
本对比例用于说明使用β-葡聚糖苷酶酶解果胶产物的制备。
制备方法与实施例1相同,不同之处在于,步骤S2中的酶制剂为β-葡聚糖苷酶。
酶解产物分级:将离心后的上清液于50 ℃条件下真空旋转浓缩至原体积的1/4,得到浓缩液,用截留分子量为3500 Da的半透膜透析,得到分子量为3500 Da的果胶产物4。
测试例1
本测试例用于说明该果胶寡糖的结构表征。
理化性质表征:果胶酶解产物的得率=M1/M0×100%,其中M1为果胶酶解产物的质量,M0为原始果胶的质量。
将5 mg的样品用0.1M NaCl溶解为1mg/mL的溶液并用0.22 μm微孔滤膜过滤后上样,采用高效排阻色谱法测定分子量。
采用离子色谱法测定果胶酶解产物的单糖组成,将10 mg的样品,加入浓度为2 M的三氟乙酸5mL,充氮气于120℃下水解1.5 h。水解结束后用氮吹仪吹干,将其水解产物用超纯水复溶至1mg/mL,稀释10倍后过0.45 μm微孔滤膜,上机检测,结果如表1所示。将样品与溴化钾粉末以1:50(m/m)混匀后充分研磨并压片后,采用傅里叶红外光谱仪测定在4000-400 cm
表1
果胶酶解产物的单糖组成和分子量如表1所示,且本发明实施例1中的果胶酶解产物RG-Ⅰ含量可以高达83.95%,为分子量低且富含RG-Ⅰ结构域的果胶酶解产物。红外光谱(图5)表明其含有-OH、-CH
测试例2
所述果胶酶解产物的体外发酵特性研究方法如下:
发酵性能表征:从4名健康志愿者(年龄22-30岁,在四个月内没有抗生素使用史,没有胃肠道疾病)采集新鲜粪便样本,并等量混合。将粪便以1:9的比例用无菌PBS(0.1M,pH7.2)稀释并均质化,将混合物离心(300×g,4◦C,5min),收集上清液作为接种物。将300mg的样品(商业果胶、SP、S-5、S-35以及阳性对照菊粉)溶于27 mL无菌培养基中(121◦C、15min),在无菌厌氧培养箱中将3 mL粪便接种物添加到含有27 mL发酵培养基的100 mL无菌厌氧瓶中,其中无额外碳源的基础培养基用来空白对照(CK),每个样品进行三次实验,在0、6、12、24、48、72 h收集5 mL发酵样品,并迅速转移到冰浴中停止发酵,然后在13000×g,4°C下离心15 min。将上清液和沉淀在液氮中冷冻,并保持在-80°C冰箱中进行进一步分析。其中上清液使用气相色谱法测定短链脂肪酸含量;沉淀物采用16S rRNA对微生物进行测序。短链脂肪酸(图6-9)结果表明,与原始的商业果胶相比,本发明制备的柑橘果胶酶解产物在体外发酵过程中,其乙酸、丙酸和总短链脂肪酸含量显著增加,尤其是分子量最低的果胶寡糖S-5其乙酸和总短链脂肪酸含量显著高于公认的益生元—菊粉,说明低分子量果胶酶解产物具有更好的发酵性能,有作为益生元的潜力。肠道微生物组成结果(图10)表明果胶酶解产物可在不同分类学水平上改变肠道微生物的结构,从而对机体发挥影响。
所述具有高产短链脂肪酸性能的果胶寡糖的精细结构解析方法如下:
精细结构表征:将S-5使用Sephadex G-15柱层析分析纯化后,采用一维核磁(氢谱和碳谱)和二维核磁(COSY、HMQC和HMBC)表征果胶寡糖S-5的精细结构。将30 mg样品完全溶解在1.5mL重水(D
以上结合附图详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 一种甘露糖醛酸寡糖的制备方法及其在制备抑制耐药菌的联用抗菌剂中的应用
- 一种以咖啡加工副产品制备的果胶及其制备方法与应用
- 一种壳寡糖锌螯合物及其制备方法和应用
- 一种果胶酸性寡糖的制备方法
- 一种汉麻果胶的制备方法及根据该方法制备的新型汉麻果胶粉
