一种溶血性曼氏杆菌A6血清型白细胞毒素抗原蛋白、其抗体及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物技术领域,涉及一种截短的溶血性曼氏杆菌(Mannheimiahaemolytica)A6血清型白细胞毒素蛋白(ΔLKT),本发明还涉及由该截短蛋白衍生的杂交瘤细胞株、单克隆抗体及其应用。
背景技术
溶血性曼氏杆菌是引起牛呼吸综合征(Bovine respiratory disease,BRD)的重要病原之一,在世界范围内的牛群中广泛存在,严重影响牛群健康和牛养殖业的发展。牛只感染溶血性曼氏杆菌后表现为食欲降低、精神沉郁、咳嗽、呼吸困难、流鼻涕,严重患病个体通常在出现呼吸道综合征的48h后出现死亡。溶血性曼氏杆菌A6和A1血清型是临床上致病的优势型,所泌的白细胞毒素蛋白(Leukotoxin,LKT)是导致肺部损伤、产生纤维蛋白坏死性胸膜肺炎的关键毒力因子。由于LKT蛋白在溶血性曼氏杆菌的致病性和免疫原性中发挥重要作用,常常作为牛溶血性曼氏杆菌疫苗的重要组分。
溶血性曼氏杆菌LKT蛋白在运输热的致病机制中具有重要作用。LKT属于RTX穿孔毒素,是一个分子质量约102-105KDa的多肽,产生于细菌的对数生长期。LKT蛋白的作用是能够特异性识别并引起反刍动物的巨噬细胞、淋巴细胞、中性粒细胞和血小板病变。研究表明,在气管内接种溶血性曼氏杆菌LKT蛋白基因缺失株的犊牛,其死亡率和肺部损伤低于气管内接种LKT蛋白基因非缺失菌株。
定量检测LKT蛋白浓度对评价菌株毒性高低或疫苗质量必不可少。但是,目前尚未有商品化定量检测牛溶血性曼氏杆菌疫苗中LKT蛋白含量的试剂盒,因此急需研究一种简便、稳定、可靠的LKT蛋白定量检测ELISA试剂盒。
发明内容
本发明的目的在于提供一种溶血性曼氏杆菌A6血清型的截短LKT蛋白以及利用该蛋白制备的单克隆抗体。该单克隆抗体能够与溶血性曼氏杆菌A1和A6血清型的LKT蛋白特异性结合,可用于定量检测LKT蛋白。同时,该单克隆抗体还可中和溶血性曼氏杆菌A1或A6血清型的LKT蛋白,因此在制备防治溶血性曼氏杆菌所致疾病的药物中也具有应用潜力。该抗原和抗体为溶血性曼氏杆菌疫苗和诊断试剂盒的研制提供了有力技术支持。
实现本发明目的的技术方案如下:
鉴于定量检测LKT蛋白浓度对评价菌株毒性高低或疫苗质量必不可少,但是目前缺少对LKT蛋白进行定量检测的试剂盒。因此,申请人将溶血性曼氏杆菌A1和A6血清型的LKT蛋白核苷酸序列和氨基酸序列进行比对,发现核苷酸序列中第2514位碱基分别为A和G,导致氨基酸序列中第838位氨基酸分别为N和D。基于上述发现,申请人将严重危害牛只健康的溶血性曼氏杆菌A6血清型LKT基因截短并克隆至原核表达系统,在大肠杆菌中成功表达了LKT截短蛋白(ΔLKT)。进一步以表达的截短ΔLKT重组蛋白作为免疫原免疫小鼠,利用杂交瘤细胞技术,筛选了一株杂交瘤细胞系能够产生针对ΔLKT的高效价单克隆抗体,该单克隆抗体对溶血性曼氏杆菌A1和A6血清型菌株分泌的LKT蛋白具有较强的交叉反应,但是与其他血清型菌株分泌的LKT蛋白无交叉反应,因此该单克隆抗体能特异性检测溶血性曼氏杆菌A1或A6血清型。利用该单克隆抗体制备了双抗夹心ELISA试剂盒,能够精确检测溶血性曼氏杆菌A1和A6血清型菌株所产LKT蛋白的含量。
更加意外的是,该单克隆抗体不仅能够识别抗原,同时还具有LKT毒素中和作用,可通过中和毒素降低病原的致病性。因此,所获得的单克隆抗体不仅可用于制备LKT毒素蛋白的检测试剂盒,而且还可用于制备抗溶血性曼氏杆菌的药物,进而在溶血性曼氏杆菌感染疾病的防控中发挥重要作用。
详细的技术方案如下:
一种溶血性曼氏杆菌A6血清型白细胞毒素抗原蛋白,其氨基酸序列如SEQ ID NO:2所示,编码基因的核苷酸序列如SEQ ID NO:1所示。尽管LKT蛋白的序列已为本领域所公知,但本申请中的截短蛋白是申请人首次从溶血性曼氏杆菌A6血清型基因组中克隆至原核表达系统并验证其功能,在此之前,从未有人获得过该截短蛋白。
由于该截短蛋白具有免疫原性,因此可用于制备抗溶血性曼氏杆菌白细胞毒素的抗体,包括单克隆和多克隆抗体。
进一步地,本发明提供一种单克隆抗体,所述单克隆抗体是用以上所述的抗原蛋白免疫小鼠,对小鼠脾细胞进行融合,然后经过亚克隆筛选得到保藏编号为CCTCC NO:C2022206的杂交瘤细胞株5D12,再采用体内诱生腹水法而获得。
一种杂交瘤细胞株5D12,保藏在中国典型培养物保藏中心,保藏编号为:CCTCCNO:C2022206。
所述的单克隆抗体能特异性识别溶血性曼氏杆菌A1和A6血清型菌株分泌的LKT蛋白,因此可用于溶血性曼氏杆菌A1和A6血清型所致疾病的诊断。同时,该单克隆抗体也能用于以非疾病诊断为目的的溶血性曼氏杆菌A1和A6血清型的实验室筛查鉴定。
进一步地,本发明还提供一种含有所述单克隆抗体的试剂盒。
优选地,该试剂盒是用于定量检测溶血性曼氏杆菌A1或A6血清型白细胞毒素的双抗夹心ELISA试剂盒。
进一步地,该试剂盒中还含有用于包被所述单克隆抗体的酶标板、生物素标记的单克隆抗体以及链霉亲和素、稀释液、显色液、洗涤液和终止液。
本发明还提供一种定量检测溶血性曼氏杆菌A1或A6血清型白细胞毒素的双抗夹心ELISA方法,包括以下步骤:
(1)将以上所述的单克隆抗体稀释后包被酶标板;
(2)向酶标板中加入待测样品溶液进行孵育;
(3)将以上所述的单克隆抗体用生物素进行标记和稀释,洗涤酶标板后加入生物素标记单克隆抗体进行孵育;
(4)加入链霉亲和素进行孵育,洗涤后加入显色液,避光反应后用终止液终止反应,630nm处读取吸光值。
优选地,所述单克隆抗体的包被浓度为4μg/mL,所述生物素标记单克隆抗体的稀释倍数为1:10000。
本发明还提供了所述的单克隆抗体在制备防治溶血性曼氏杆菌所致疾病的药物中的应用,利用所述单克隆抗体中和溶血性曼氏杆菌A1或A6血清型所产生的白细胞毒素,从而降低溶血性曼氏杆菌的致病性。
更加详细的技术方案参见具体实施例。
附图说明
图1:溶血性曼氏杆菌A1和A6血清型LKT基因序列比对结果。
图2:溶血性曼氏杆菌A1和A6血清型LKT氨基酸序列比对结果。
图3:重组质粒pET-30a-LKTa图谱。
图4:截短LKT蛋白(ΔLKT)表达结果。M:marker;1~3:IPTG 1mmoL/L诱导0h、2h、4h上清液;4~5:2h、4h沉淀;6~7:BL21(DE3)pLysS空载体、PET-30A。
图5:SDS-PAGE胶图验证不同血清型溶血性曼氏杆菌上清LKT蛋白。M:marker;1:溶血性曼氏杆菌A1血清型菌株上清;2:溶血性曼氏杆菌A2血清型菌株上清;3、4:溶血性曼氏杆菌A6血清型菌株上清。
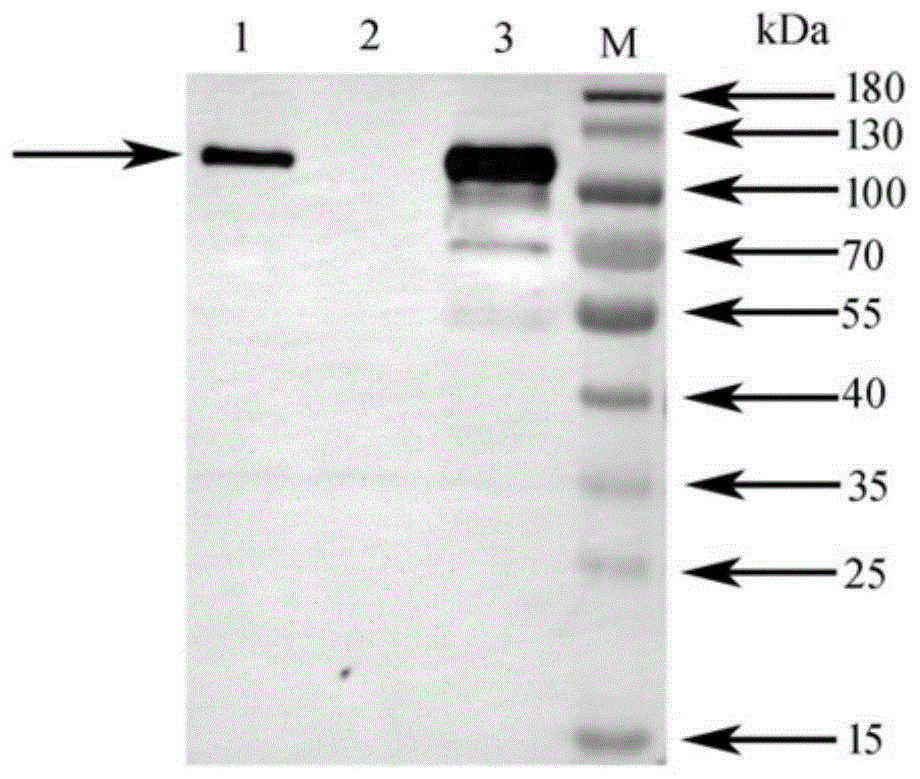
图6:Western Blot验证单克隆抗体与不同血清型菌株LKT蛋白反应特异性。1:溶血性曼氏杆菌A1血清型菌株上清;2:溶血性曼氏杆菌A2血清型菌株上清;3:溶血性曼氏杆菌A6血清型菌株上清。
图7:单克隆抗体与LKT蛋白中和反应结果。
具体实施方式
1.将严重危害牛只健康的溶血性曼氏杆菌A1和A6血清型LKT基因序列和氨基酸序列做比对,发现第2514位碱基分别为A和G,导致第838位氨基酸分别为N和D。本发明以A6血清型菌株基因组做模板,将LKT基因截短克隆至原核表达系统,成功表达截短蛋白ΔLKT。
2.以表达的截短ΔLKT蛋白作为免疫原免疫小鼠,制备了4株杂交瘤细胞系,并都能够产效价高达1:100000的抗ΔLKT单克隆抗体。产生的5D12株单克隆抗体在溶血性曼氏杆菌A1和A6血清型菌株分泌的LKT蛋白中具有较强的交叉反应,但是与其他血清型菌株分泌的LKT蛋白无交叉反应,因此生产的单克隆抗体特异性较强。
3.利用产生的5D12株单克隆抗体,以及相应标记生物素的单克隆抗体,制备了夹心ELISA试剂盒,用于精确检测溶血性曼氏杆菌A1和A6血清型菌株产LKT蛋白的含量。同时验证该方法的敏感性、特异性和重复性。
4.LKT蛋白是构成溶血性曼氏杆菌疫苗的重要组分。当前国内外没有用于定量检测LKT蛋白的方法。因此,本发明的夹心ELISA检测试剂盒可用于定量LKT蛋白的含量。进而为溶血性曼氏杆菌疫苗研制中的疫苗质量控制环节发挥重要作用。
实施例1:牛溶血性曼氏杆菌A6血清型LKT蛋白截短表达
牛溶血性曼氏杆菌A6血清型LKT蛋白截短表达和重组蛋白制备的方法,主要包括如下步骤;
溶血性曼氏杆菌A1和A6血清型LKT基因序列的比对,其中第2514位碱基分别为A和G,结果如图1。
溶血性曼氏杆菌A1和A6血清型LKT氨基酸序列比对,其中第838位氨基酸分别为N和D,结果如图2。
溶血性曼氏杆菌LKT基因截短序列的克隆表达:
以实验室保存病死牛肺脏分离河南泌阳菌株基因组为模板,在LKT基因组C端设计引物克隆表达,PCR反应体系如下:Takara PrimerSTAR Max DNA Polymerase 20μL,水23μL,引物F、R各2μL,模板3μL。反应条件:95℃预变性5min;94℃变性30s;50℃退火30s;72℃延伸1min,30个循环;接着72℃延伸10min,最后再降至4℃。
表1 LKT基因截短表达序列引物
将ΔLKT基因扩增产物,用BamHⅠ和SalⅠ酶切,同时将pET-30a质粒(购自默克中国有限公司)用BamHⅠ和SalⅠ进行双酶切。将酶切后的LKTa基因和pET-30a质粒用DNA连接酶(T4 DNA ligase,购自NEB公司)进行连接,得到重组质粒pET-30a-LKTa(图谱见图3)。用该重组质粒pET-30a-LKTa转化大肠杆菌DH5α后,置于37℃摇床在180r/min下培养12小时,提取质粒,用通用载体T7经过测序,确定插入序列正确后转化大肠杆菌BL21(DE3)pLysS。将所得的重组大肠杆菌BL21(DE3)pLysS在LB液体培养基中培养至OD=0.6时,取1mL菌液作为诱导前对照,同时加入异丙基硫代半乳糖苷(IPTG)至终浓度为1mmol/L,在37℃摇床上诱导表达4小时。取1mL菌液进行下一步处理:样品处理方法为12000r/min离心1min后弃掉上清,加入1mL磷酸盐缓冲液即PBS(配方:KCl 0.2g,NaCl8g,Na
ΔLKT的核苷酸序列如Sequence 1所示。
ΔLKT的氨基酸序列如Sequence 2所示。
实施例2:ΔLKT蛋白的纯化
将重组的大肠杆菌BL21(DE3)pLysS用1mmol/LIPTG按上述实施例1的方法诱导表达后,取菌液8000r/min离心10min后弃掉上清,用500mL的PBS洗一次后在8000r/min离心10min,再重复用500mL的PBS洗一次。弃掉上清后加入30mL的PBS重悬,加入蛋白酶抑制剂(购自上海罗氏制药有限公司),使用液压破碎仪破碎。破碎后以12000r/min离心30min,取40μL上清加入10μL上样缓冲液,在沸水中煮沸10min作为上清组。取少许沉淀加入30μL的PBS和30μL上样缓冲液煮沸10min作沉淀组。经过SDS-PAGE凝胶电泳后,确定ΔLKT蛋白大部分表达于上清中。如图4所示。
ΔLKT蛋白具体纯化步骤如下:
(1)向亲和层析柱中加入1mL Ni-NTA金属螯合His蛋白纯化介质填料(购自GE公司);
(2)向亲和层析柱中加入12mL ddH
(3)加入12mL的binding buffer(20mM Na
(4)加入经过0.45μm孔径滤器过滤的蛋白表达上清,收集前几滴滤出的液体;
(5)加入50mL binding buffer缓冲液平衡柱子,收集前几滴液体;
(6)加入50mL washing buffer缓冲液(20mM Na
(7)加入12mL elute buffer缓冲液(20mM Na
(8)将编号为1到4的管中各加入50μL上样缓冲液煮沸10min;
(9)配置12%SDS-PAGE聚丙酰胺凝胶,将处理好的样品加入孔中(20μL/每孔),电泳(浓缩胶电泳条件为直流电压为80V,分离胶电泳条件为直流电压为120V),电泳完成后,取下凝胶用考马斯亮蓝染色过夜。然后脱色,确定得到纯化的目的蛋白。
实施例3:ΔLKT蛋白单克隆抗体的制备
1.溶血性曼氏杆菌ΔLKT蛋白疫苗的制备与Balb/c小鼠免疫:
使用BCA试剂盒(购自碧云天生物技术有限公司)测量蛋白浓度,定量至200μg加入等体积的弗氏完全佐剂为免疫抗原,采用多点注射方式至6~8周龄小鼠颈背部,此后每次间隔2周,使用等体积弗氏不完全佐剂免疫小鼠,共免疫4次,第三次免疫后7~10天,断尾采血。将表达的截短ΔLKT蛋白包被酶标板,每孔蛋白100ng,采用间接ELISA法测定采集血清效价,选取效价高于1:10000的小鼠在融合前三天加强免疫,加强免疫采用腹腔注射截短ΔLKT蛋白,剂量为200μg/只。加强免疫第三天取小鼠脾细胞用于细胞融合。
2.Balb/c小鼠SP2/0细胞融合与杂交瘤细胞株的筛选
将复苏的SP2/0细胞与免疫后的小鼠脾细胞在浓度为50%的PEG4000作用下进行融合,同时使用截短ΔLKT蛋白和河南泌阳菌株分泌至培养上清中的LKT包被酶标板,采用间接ELISA法筛选融合后的阳性杂交瘤细胞,并利用有限稀释法进行5次亚克隆,得到4株杂交瘤细胞株,分别命名为4A1、5A7、5D3和5D12。申请人将其中的5D12杂交瘤细胞株于2022年7月5日保藏于中国典型培养物保藏中心(武汉),地址为:湖北省武汉市武昌珞珈山,保藏编号为:CCTCC NO.C2022206。
3.ΔLKT蛋白腹水型单克隆抗体的制备
饲养6~8周龄雌性Balb/c小鼠,腹腔注射弗氏不完全佐剂活化,0.5mL/只,4天后注射杂交瘤细胞,将编号为5D12的杂交瘤细胞株调整至1×10
4.ΔLKT蛋白腹水型单克隆抗体的纯化
使用Protein G Beads 4FF SA20025亲和柱纯化腹水,纯化步骤如下:
样品准备:上柱前确保腹水溶液中有合适的离子强度和pH值,可以用平衡/洗杂液对腹水稀释,或者用平衡液透析。样品在上样前离心或者用0.22μm或者0.45μm滤膜过滤,减少杂质,以防止堵塞柱子同时提高纯化效率。
装柱和置换:将下垫片加入重力层析柱,加入适量纯水润洗柱管,将Protein GBeads 4FF混合均匀后加入柱管内并加入上垫片,打开下出口流干保护液,再加入适量纯水冲洗,然后用结合缓冲液置换填料中20%酒精,保持流速为2s/滴。
上样:先用结合缓冲液稀释腹水(10~20倍于腹水体积)并上样至柱管内。保持流速为2s/滴。
洗杂:用20倍于填料体积的洗杂缓冲液洗杂。保持流速为2s/滴。
洗脱:用10倍于填料体积的甘氨酸(100mM,pH3.0)溶液洗脱单克隆抗体。保持流速为2s/滴。
接样:预先在EP管中加入Tris-HCl缓冲液,用于中和甘氨酸。
平衡:依次用3倍于填料体积的Buffer和5倍于填料体积的去离子水平衡填料,最后再用5倍于填料体积的20%乙醇平衡,最后置于4℃保存。
实施例4:单克隆抗体与不同血清型溶血性曼氏杆菌分泌LKT蛋白的Western-Blot反应
将溶血性曼氏杆菌A1和A6血清型菌株以及其他血清型菌株培养液上清取40μL上样,另外加入5×SDS-PAGE蛋白上样缓冲液10μL,总量均50μL,沸水加热10分钟,使蛋白充分变性。冷却到室温后,分别把蛋白样品15μL直接上样到两块10%SDS-PAGE胶加样孔。上层胶电泳电压为80V,下层胶电泳电压为120V。电泳完成后,其中一块胶考马斯亮蓝染色后脱色。另外一块胶采用湿转法使用硝酸纤维素膜转印蛋白,电压为100V,转膜时间为1小时。转膜完毕后,使用5%脱脂牛奶封闭膜,置于4℃封闭过夜。使用TBST(10mM Tris-HCl,150mMNaCl,Tween-20(0.05%(v/v)),pH 7.4)洗膜三次,每次间隔5分钟,然后与使用TBST稀释的5D12株单克隆抗体(体积比为1:1000)于室温孵育3小时。使用TBST洗膜五次,每次间隔5分钟,然后与使用TBST稀释的抗小鼠IgG抗体(Southern Biotech)(体积比为1:5000)于室温孵育1小时。孵育完成后,用TBST洗膜五次,每次间隔5分钟,并使用化学发光显色和图像获取。结果表明,该单克隆抗体与溶血性曼氏杆菌A1和A6血清型菌株上清能够反应,与溶血性曼氏杆菌其他血清型菌株上清不反应。如图5、6所示。
实施例5溶血性曼氏杆菌LKT蛋白检测试剂盒
包括包被5D12株单克隆抗体的酶标板和生物素标记的5D12株单克隆抗体;检测抗体的包被用的是pH9.6的碳酸钠缓冲液将5D12株单克隆抗体稀释至1μg/mL~4μg/mL浓度包被酶标板。
另外捕获抗体生物素标记5D12株单克隆抗体是通过福因德科技(武汉)有限公司生物素快速标记试剂盒ARL0020K标记。此外检测试剂盒还包括链霉亲和素、阴性对照、标准品阳性对照、稀释液、TMB显色液、洗涤液和终止液;阴性对照为大肠杆菌菌体蛋白、溶血性曼氏杆菌菌体蛋白以及其他蛋白。LKT蛋白标准品是通过SDS-PAGE胶切胶后电洗脱获得。上述稀释液为pH7.2~7.4PBS缓冲液;洗涤液为含有万分之五Tween-20的pH7.2~7.4PBST缓冲液。
实施例6溶血性曼氏杆菌LKT蛋白定量检测方法
1.生物素标记单克隆抗体的制备:
(1)取1mg待标记单克隆抗体于超滤管中,加入相应体积的标记缓冲液,使抗体的终浓度为2mg/mL,12,000g离心10min。
(2)加入13.3μL生物素溶液和适量标记缓冲液至上述超滤管中,使终体积为0.5mL,并轻轻吹打混匀。放入37℃恒温箱中避光温育30min。
(3)12,000g离心10min。
(4)加入适量适量标记缓冲液至上述超滤管中,并轻轻吹打混匀,12,000g离心10min,如此重复多次。
(5)收集超滤管中的溶液(即生物素标记抗体),加入等体积保存液,-20℃保存。
2.ELISA检测条件的确定
2.1单克隆抗体和生物素标记单克隆抗体的最佳工作浓度
(1)用PBS溶液将单克隆抗体稀释至4μg/mL、2μg/mL、1μg/mL,包被酶标板,100μL/孔,4℃包被12h后,用PBST洗涤三次后,加入含1%鱼明胶的PBST溶液作为封闭液200μL/孔,37℃封闭1h;
(2)用PBST溶液洗涤3次后将96孔酶标板拍干,置于-20℃保存备用。
(3)从-20℃冰箱取出包被好96孔酶标板,置于室温30min,加入电洗脱获得的LKT蛋白标准品,稀释液选用PBS,稀释度依次为原液、2-1、2-2、2-3、2-4、2-5、2-6、2-7、2-8、2-9、2-10,100μL/孔,同时加入100μLPBS作为空白对照,37℃孵育30min。
(4)用PBST溶液洗涤3次,加入生物素标记单克隆抗体,稀释液选用PBS,浓度为1:2500、1:5000、1:10000,100μL/孔,37℃孵育30min。
(5)加入PBS缓冲液1:20000体积比稀释的链霉亲和素,37℃孵育30min,PBST溶液洗涤3次。
(6)最后加入TMB显色液A液和B液各50μL/孔,室温条件避光反应10min,用2M H
表2包被抗体浓度与生物素标记抗体稀释度确定
表3包被抗体浓度与生物素标记抗体稀释度确定
/>
表4包被抗体浓度与生物素标记抗体稀释度确定
由表2、表3和表4所示,包被单克隆抗体浓度最佳为4μg/mL,生物素标记单克隆抗体最佳稀释度为1:10000。
2.2结果判定标准的确定
运用建立的夹心ELISA检测不同血清型溶血性曼氏杆菌培养上清中的LKT蛋白,同时设立标准品为阳性对照,和空白阴性对照,测定OD630,以阳性/阴性(P/N)>2.1作为判定阳性的标准。同时设立夹心ELISA法的检测限(空白对照的平均值×2.1),确定LKT蛋白线性检测范围。
3.夹心ELISA检测试剂盒的特异性检测
以溶血性曼氏杆菌菌体蛋白(P1)、溶血性曼氏杆菌外膜蛋白PlpF(P2)、外膜转运蛋白LolA(P3)、大肠杆菌菌体蛋白(P4),巴氏杆菌菌体蛋白(P5)、山羊痘疫苗蛋白(P6)、Control:空白对照、LKT蛋白标准品作为对照进行夹心ELISA检测。
表5夹心ELISA检测试剂盒的特异性试验
表6夹心ELISA检测试剂盒的特异性试验OD值
由表可知,以上6种蛋白OD值与LKT蛋白OD值差异非常大,以阳性/阴性(P/N)>2.1作为判定阳性的标准。由此可知本发明单克隆抗体初步制备的试剂盒与其他蛋白无交叉反应。
4.夹心ELISA检测试剂盒的敏感性试验
将LKT蛋白标准品按照2倍倍比稀释,从原液一直稀释到1:1024,夹心ELISA检测LKT蛋白检测限为3.9-7.8ng/mL。线性检测范围为1.95ng/mL-62.5ng/mL。拟合方程为y=0.0202x+0.3921,R
实施例7单克隆抗体与LKT毒素的中和反应
将5D12株单克隆抗体以及实验室获得的另外三株单克隆抗体与LKT蛋白进行中和试验,考察抗体是否具有中和毒素的能力,具体如下:
用含20%胎牛血清、1%L-谷氨酰胺、1%丙酮酸钠、1%羟乙基哌嗪乙硫磺酸的RPMI1640培养基将牛淋巴细胞系BL-3细胞悬浮培养于37℃、5%CO
- 溶血性曼氏杆菌PlpE蛋白原核表达载体的构建方法及检测溶血性曼氏杆菌的试剂盒
- 一种牛溶血性曼氏杆菌抗体检测的间接ELISA试剂盒及其应用
- 一种溶血性曼氏杆菌PLPE蛋白单克隆抗体及其制备方法和应用
- 一种牛溶血性曼氏杆菌抗体检测的间接ELISA试剂盒及其应用
