一种自主进化系统及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及合成生物学领域,具体涉及一种自主进化系统及其应用。
背景技术
L-缬氨酸是优良的营养增补剂,主要依赖于微生物发酵生产。L-缬氨酸的生产菌株主要包括谷氨酸棒状杆菌(Corynebacterium glutamicum)、大肠杆菌(Escherichiacoli)以及酿酒酵母(Saccharomyces cerevisiae)等。高产L-缬氨酸菌株C.glutamicum代谢网络复杂,由于遗传信息的匮乏而导致菌株改造步履维艰。在以S.cerevisiae为宿主菌的体系中代谢改造L-缬氨酸,缺乏强有力的受严格调控的启动子,发酵周期较长,营养要求复杂,不适于高密度培养,发酵后期的营养盐及单糖组分增加了分离纯化成本。E.coli因其遗传背景清晰、发酵周期短、葡萄糖消耗率高、成熟的基因操作工具而成为优良的氨基酸生产模式菌株。葡萄糖是微生物发酵生产L-缬氨酸的主要糖质原料,发酵过程中葡萄糖供应不足导致菌体生长缓慢和产物产量较低,而葡萄糖浓度过高则会增加培养基渗透压力、阻碍葡萄糖和营养物质吸收、限制菌体生长及产物合成。野生型E.coli对葡萄糖耐受性差、代谢合成能力低,生物系统固有的复杂性对E.coli新表型提出挑战。
工业上主要通过微生物发酵法生产L-缬氨酸,获取耐受高糖胁迫且高产L-缬氨酸的目标表型成为制约L-缬氨酸规模化应用的瓶颈。存在问题主要包括:(1)多数野生型菌株不具备大量生产L-缬氨酸的能力,其产量主要由于菌株耐受性等因素的限制;(2)传统诱变育种是L-缬氨酸工业生产菌主要来源,但传统育种方式获得的菌株遗传背景不明确、遗传特性不稳定,L-缬氨酸生产菌株的诱变育种存活率低;(3)L-缬氨酸合成代谢网络复杂,繁琐地敲除或过表达L-缬氨酸合成路径依赖型基因,会对细胞造成损伤或增加其负荷,单一代谢工程改造导致产品产量提升有限。耐受性工程调控微生物细胞工厂胁迫抗性可通过巩固细胞屏障增强胁迫防御能力,加快应激反应提高损伤修复能力,但由于微生物系统代谢和调控网络的复杂性,难以获得鲁棒性较好的表型,因而耐受进化工程在筛选鲁棒性增强的微生物细胞工厂中愈发关键。耐受进化工程是指利用微生物基因组的可塑性,微生物种群在一定选择压力条件下不断进化,通过精密的调控机制与复杂的抵抗策略使微生物进化以生存和适应多种胁迫压力,获得有益突变的方法,可用于改善微生物细胞生长,提高化学品的浓度、得率和生产强度,发现未知的生物调控机制。
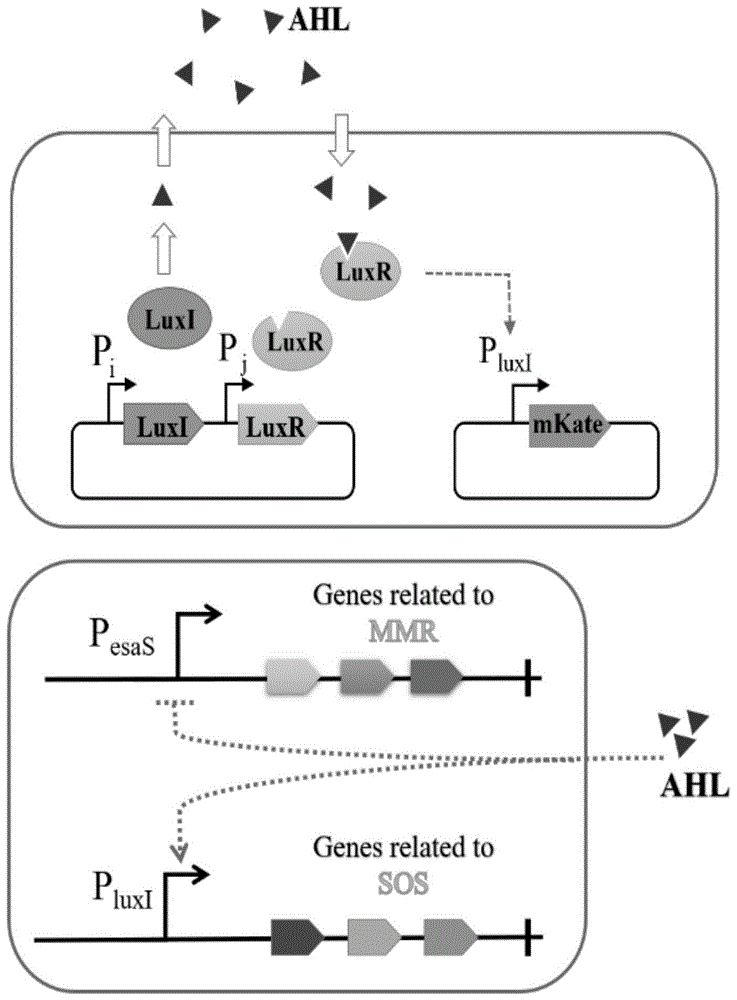
已有前人使用了合成生物学来构建大肠杆菌中的“群体感应”基因电路。LuxI、LuxR和酰基高丝氨酸内酯(AHL)在该回路中具有重要作用。LuxI酶催化AHL分子的合成,而LuxR则是AHL受体蛋白,可激活细菌群体感应转录效应。当细菌种群密度低,LuxR表达水平较低,合成的AHL分子不会在细胞积聚,而是迅速扩散到胞外。当细菌密度增加时,由于胞外AHL浓度梯度,导致AHL在细胞内积累。一旦胞内AHL浓度达到一定阈值,AHL分子与LuxR结合。反过来,LuxR激活PluxI启动子,从而启动靶基因的表达。因为AHL可以穿过细胞膜扩散,所以群体细菌中的AHL浓度基本相同,确保了细菌群体中基因表达程序的同步执行。
发明内容
发明目的:本发明的第一目的是提供一种自主进化系统,以遗传背景清晰的E.coli为研究模型,E.coli存活率的增加将导致新表型的进化,提高E.coli的存活率和进化效率可提升E.coli细胞工厂的耐受性和生产性能。
本发明第二目的是提供一种包括自主进化系统的基因工程菌或细胞。
本发明第三目的是提供一种耐高糖产缬氨酸大肠杆菌的构建方法。
技术方案:为了实现上述发明目的,本发明提供了一种自主进化系统,包括调控元件、突变模块和保真模块,所述调控元件包括LuxI、LuxR和报告基因;所述保真模块包括错配修复蛋白基因mutH、mutL、mutS和解旋酶基因recG中的一种或几种,突变模块包括DNAPol IV基因dinB、编码应激因子基因rpoS、rpoD、编码损伤反应蛋白基因recA中的一种或几种;
所述基因mutH序列Gene ID是947299;所述基因mutL序列Gene ID是948691;所述基因mutS序列Gene ID是947206;所述基因recG序列Gene ID是948162;所述基因dinB序列Gene ID是944922;所述基因rpoS序列Gene ID是947210;所述基因rpoD序列Gene ID是947567;所述基因recA序列Gene ID是947170。
优选的,所述突变模块由启动子PluxI调控,所述保真模块由启动子PesaS调控。
优选的,所述保真模块的基因序列如SEQ ID NO:1所示。
优选的,所述突变模块的基因序列如SEQ ID NO:2所示。
本发明还提供了一种基因工程菌或细胞,包括所述的自主进化系统。
优选的,所述基因工程菌为大肠杆菌。
本发明还提供了所述的自主进化系统、基因工程菌或细胞在生产L-缬氨酸中的应用。
本发明还提供了一种耐高糖产缬氨酸大肠杆菌的构建方法,包括以下步骤:
(1)分别过表达错配修复蛋白基因mutH、mutL、mutS和解旋酶基因recG,以葡萄糖浓度梯度作为筛选压力,得到保真模块的候选基因;
(2)分别敲除DNA Pol IV基因dinB、编码应激因子基因rpoS、rpoD、编码损伤反应蛋白基因recA,以葡萄糖浓度梯度作为筛选压力,得到突变模块的候选基因;
(3)将步骤(1)所述保真模块的候选基因构建保真模块,将步骤(2)所述突变模块的候选基因构建突变模块;
(4)构建L-缬氨酸合成途径酶表达质粒;
(5)以大肠杆菌为宿主菌,引入所述的调控元件、步骤(3)所述保真模块和突变模块、步骤(4)所述L-缬氨酸合成途径酶表达质粒,即得。
优选的,所述保真模块基因序列如SEQ ID NO:1所示,所述突变模块基因序列如SEQ ID NO:2所示。
优选的,所述L-缬氨酸合成途径酶表达质粒包括编码乙酰乳酸合酶、酮醇酸还原异构酶、二羟酸脱水酶和支链氨基酸转氨酶基因中的一种或几种。
本发明还提供了一种产L-缬氨酸的方法,所述方法包括将所述耐高糖产缬氨酸大肠杆菌发酵获得。
本发明基于群体感应(quorum sensing,QS)构建自主进化系统调控元件,调控元件包括重组质粒P15A-LuxI-LuxR和PluxI-mKate2。P15A-LuxI-LuxR中LuxI和LuxR分别由启动子Pi和Pj调控,Pi和Pj组合优化控制AHL和LuxR浓度及两者的结合能力;借助启动子工程或RBS调控策略优化基因的表达强度。采用满足QS响应特性的启动子PluxI,以编码远红外红色荧光蛋白mkate2作为报告基因,得到重组质粒PluxI-mKate2。将构建的重组质粒P15A-LuxI-LuxR、PluxI-mKate2采用电转法转入E.coli JM109,获得重组菌株。
以葡萄糖压力筛选得到的mutH作为候选基因,候选基因片段从基因组上扩增,连接质粒得到保真模块;以葡萄糖压力筛选得到的rpoD作为候选基因,候选基因片段从基因组上扩增,连接质粒得到突变模块。保真模块和突变模块分别由启动子PesaS和PluxI调控,保真模块和突变模块转入上述重组菌株中,得到具有自主进化系统的大肠杆菌EC12-G60。采用电转法将L-缬氨酸合成途径酶串联表达双质粒(pEtac-ilvBN-ilvC,ptet-ilvE-ilvD)导入大肠杆菌EC12-G60中,即得产缬氨酸耐高浓度葡萄糖大肠杆菌。本发明获得的具有自主进化系统的大肠杆菌,在不分泌信号分子AHL的情况下,启动子PesaS被激活转录,处于高保真状态。当细胞达到对数生长期时,分泌AHL,PesaS启动子失活;AHL与LuxR结合诱导PluxI启动突变模块基因的表达。当菌株达到一定突变率可耐受高浓度葡萄糖时,突变模块转变至保真模块富集有益突变。借助葡萄糖压力平板,筛选优良表型,评估转换效果。基于QS构建包括保真模块和突变模块的自主进化系统,实现单一层级的自我调控和双层级间的转换调控。
有益效果:与现有技术相比,本发明具有如下显著优点:(1)聚焦易导致突变基因和错配修复基因,利用高糖适应性培养并结合代谢改造筛选优良表型,增加应激细胞的自发高存活率及正向突变的富集;选育获得葡萄糖耐受性好、氨基酸发酵能力增强、传代稳定性强的L-缬氨酸生产菌株E.coli;(2)可为高产氨基酸且耐受环境胁迫的E.coli菌株选育提供普适性的研究基础,突破制约L-缬氨酸规模化生产的瓶颈,具有重要的理论和实践意义;(3)微生物细胞通过自我调节,具有高度适应环境和自我繁殖的能力,可通过突变或基因重组而导致变异。在高浓度葡萄糖条件下,E.coli对高浓度葡萄糖的耐受性增强,获得存活率显著提升的E.coli。
附图说明
图1为本发明自主进化系统的示意图;
图2为pTargetF-N20-mutH、pTargetF-N20-mutL、pTargetF-N20-mutS、pTargetF-N20-recG质粒结构示意图;
图3为pEtac-dinB、pEtac-rpoS、pEtac-rpoD、pEtac-recA质粒结构示意图;
图4为pEtac-ilvBN-ilvC、ptet-ilvE-ilvD串联表达双质粒结构示意图;
图5为pCDFDuet-1-PluxI-rpoD、pEM-PesaS-mutH质粒结构示意图。
具体实施方式
下面结合附图对本发明的技术方案作进一步说明。
mutH Gene ID:947299;mutL Gene ID:948691;mutS Gene ID:947206;recG GeneID:948162;dinB Gene ID:944922;rpoS Gene ID:947210;rpoD Gene ID:947567;recAGene ID:947170。
实施例1
为了获得高保真基因,以葡萄糖的耐受性为检验指标,检验了三种编码错配修复蛋白基因mutL、mutS、mutH和一种解旋酶基因recG缺失的情况下,对菌株存活率的影响。本实施例采用CRISPR/Cas9敲除方法,设计目的基因的pTargetF-sgRNA和敲除框,通过pTargetF-sgRNA将敲除框引导到目的基因上,实现定向敲除。以mutS的敲除菌株为例,具体步骤如下:
(1)构建pTargetF-sgRNA(mutS)质粒:设计扩增引物KZ-sgRNA-A和pTargetF-sgRNA(mutS)-S,以pTargetF为模板,配置Prime Star体系见表1,P1为KZ-sgRNA-A,P2为pTargetF-sgRNA(mutS)-S,PCR扩增程序见表2。切胶回收后DpnⅠ消化。
(2)构建mutS敲除框:扩增待敲除基因mutS的两侧翼序列,上游序列和下游序列各500bp,分别作为敲除框左臂和右臂,通过融合PCR的方法将左臂和右臂序列融合,得到敲除框序列。融合体系见表3,其中不加模板,引物为KZ-mutS(u)-S和KZ-mutS(d)-A,融合PCR程序如表4所示。
表3 50μL Prime Star融合体系表4融合PCR程序设置
(3)将Cas9质粒、mutS敲除框和pTargetF-sgRNA(mutS)质粒导入E.coli JM109感受态细胞中,敲除框片段替换原来基因组上的待敲除基因mutS。挑取单菌落进行PCR验证,得到单基因敲除菌株E.coli JM109-ΔmutS。
E.coli JM109-ΔmutH、E.coli JM109-ΔmutL和E.coli JM109-ΔrecG菌株构建方法同上,所采用的引物见表7,不同基因的pTargetF-sgRNA质粒结构示意图如图2所示。
将得到的基因敲除菌株E.coli JM109-ΔmutH、E.coli JM109-ΔmutL、E.coliJM109-ΔmutS和E.coli JM109-ΔrecG,标记为EC01、EC02、EC03、EC04。高浓度葡萄糖培养基筛选菌株过程如下:
(1)将含有30g/L、40g/L、50g/L、60g/L、70g/L、80g/L葡萄糖的固体筛选培养基记为LB-G30、LB-G40、LB-G50、LB-G60、LB-G70、LB-G80,以加入0g/L葡萄糖的LB培养基为空白对照。
如表5所示,对于单基因敲除菌,在LB培养基中存活率较高的菌株为EC03、EC04,存活率均为2.0;在LB-G30培养基中,存活率较高的菌株为EC01,存活率为12.5;在LB-G40培养基中,存活率较高的菌株为EC02、EC04,存活率分别为0.7、0.8;在LB-G50培养基中,存活率较高的菌株为EC01、EC04,存活率分别为2.0、3.6;在LB-G60培养基中,存活率较高的菌株为EC03,存活率为4.8,在LB-G70培养基中,存活率较高的菌株为EC01、EC03,存活率分别为3.3、3.7。
采用30-80g/L的葡萄糖作为筛选压力,以较高存活率为指标EC01、EC02、EC03、EC04四种单基因敲除菌株耐受葡萄糖的存活率分别比E.coli JM109提高了7.2倍,5.0倍,1.8倍和5.3倍。
其中存活率及存活率提高倍数计算方式为,以EC01为例:
将大肠杆菌EC01在固体筛选培养基上培养5d,以培养基上葡萄糖耐受株数量的增加率来表示菌株产生耐受性的存活率;
A:E.coli JM109第2天长出的总耐受菌落数;B:E.coli JM109第5天长出的总耐受菌落数;C:EC01第2天长出的总耐受菌落数;D:EC01第5天长出的总耐受菌落数;E.coliJM109菌落增加数目:B-A;EC01菌落增加数目:D-C;
EC01存活率=(D-C)/3;
由于在LB-G30条件下,EC01较其他突变株生存率高,取A和C的最小公倍数;
则EC01较E.coli JM109生存率提高了[A(D-C)-C(B-A)]/(AC最小公倍数)。
上述结果表明,mutH、mutL、mutS和recG四个基因均能不同程度的影响E.coliJM109体内的错配修复作用,单基因mutH敲除菌平均存活率较高且波动较其他菌株小,该突变株葡萄糖耐受性较好。在相对高浓度的葡萄糖培养基中(60g/L)敲除mutH基因的菌株存活率最高。
表5单基因敲除菌及E.coli JM109的存活率
(2)通过高浓度葡萄糖培养基的富集培养,得到了对高浓度葡萄糖环境具有良好适应性的菌株,强化了菌株的耐高糖性能。在高浓度葡萄糖平板上划线分离经过适应性培养的菌株,最终从最高浓度60g/L葡萄糖平板上挑选出生长良好的菌落,并摇瓶液体培养,得到菌株EC01-G60。
表6本实例使用的菌株和质粒
表7本实例所用的引物
实施例2
为了获得易导致突变的基因,以葡萄糖的耐受性为检验指标,检验了DNA Pol IV基因dinB,编码应激因子基因rpoS、rpoD,以及编码损伤反应蛋白基因recA对菌株存活率的影响,以pEtac-dinB为例,具体构建步骤如下:
(1)以E.coli MG1655基因组DNA为模板,以引物KZ-dinB-S和KZ-dinB-A扩增得到目的基因dinB。
(2)构建200μL的双酶切体系,如表8所示,Enzyme1为EcoR I,Enzyme 2为Sac I。将双酶切体系置于PCR仪中,37℃,反应3h。将双酶切pEtac载体得到的片段与其对应的目的片段dinB按表9所示体系进行同源重组,将构建好的10μL的同源重组体系于PCR仪中,50℃,反应30min,得到过表达质粒pEtac-dinB。
/>
pEtac-rpoS、pEtac-rpoD和pEtac-recA的构建方法同pEtac-dinB,质粒结构如图3所示。
将重组质粒利用化学转化法分别转入E.coli JM109,获得单基因过表达的重组菌株E.coli JM109-dinB、E.coli JM109-rpoS、E.coli JM109-rpoD和E.coli JM109-recA,分别命名为EC05、EC06、EC07、EC08。高浓度葡萄糖培养基筛选菌株过程如下:
(1)将获得的单基因过表达重组菌株记为EC05、EC06、EC07、EC08,将含有30g/L、40g/L、50g/L、60g/L、70g/L、80g/L葡萄糖的固体筛选培养基记为LB-G30、LB-G40、LB-G50、LB-G60、LB-G70、LB-G80,以加入0g/L葡萄糖的LB培养基为空白对照。
如表10所示,E.coli单基因过表达菌在LB培养基中存活率较高的菌株为EC07,存活率为0.8;在LB-G30培养基中,存活率较高的菌株为EC06,存活率为1.5;在LB-G40培养基中,存活率较高的菌株为EC07,存活率为1.5;在LB-G50培养基中存活率较高的菌株为EC08,存活率为1;在LB-G60培养基中存活率较高的菌株为EC07,存活率为2.3;在LB-G70培养基中和在LB-G80中存活率较高的菌株为EC05,但E.coli JM109-dinB菌株生长缓慢。
采用30-80g/L的葡萄糖作为筛选压力,四种单基因过表达菌株EC05、EC06、EC07、EC08产生葡萄糖耐受性的存活率分别比E.coli JM109提高了2.0倍、2.2倍,3.5倍和1.0倍。
其中存活率及存活率提高倍数计算方式为,以EC05为例:
将大肠杆菌EC05在固体筛选培养基上培养5d,以培养基上葡萄糖耐受株数量的增加率来表示菌株产生耐受性的存活率;
A:E.coli JM109第2天长出的总耐受菌落数;B:E.coli JM109第5天长出的总耐受菌落数;C:EC05第3天长出的总耐受菌落数;D:EC05第5天长出的总耐受菌落数;E.coliJM109菌落增加数目:B-A;EC05菌落增加数目:D-C;
EC05存活率=(D-C)/3;
由于在LB-G30条件下,EC05较其他突变株生存率高,取A和C的最小公倍数;
则EC05较E.coli JM109生存率提高了[A(D-C)-C(B-A)]/(AC最小公倍数)。
上述结果表明,dinB、recA、rpoD和rpoS四个基因均能不同程度的影响E.coliJM109体内的SOS反应,以较高存活率为指标,E.coli JM109-rpoD出现次数最多,平均存活率较高且波动较其他菌株小。综上所述,存活率较高的单基因过表达菌为E.coli JM109-rpoD,该突变株葡萄糖耐受性较好。
(2)通过高浓度葡萄糖培养基的富集培养,得到了对高浓度葡萄糖环境具有良好适应性的菌株,强化了菌株的耐高糖性能。在高浓度葡萄糖平板上划线分离经过适应性培养的菌株,最终从最高浓度60g/L葡萄糖平板上挑选出生长良好的菌落,并摇瓶液体培养,得到菌株EC07-G60。
表10本实施例各菌株存活率
/>
表11本实例使用的菌株和质粒
表12本实例所用的引物
实施例3
E.coli利用葡萄糖生产L-缬氨酸的生物合成中,丙酮酸是形成缬氨酸的直接前体物,从丙酮酸代谢合成L-缬氨酸是L-缬氨酸生物合成途径的关键,涉及到的关键酶为乙酰乳酸合酶(ilvBN)、酮醇酸还原异构酶(ilvC)、二羟酸脱水酶(ilvD)和支链氨基酸转氨酶(ilvE)。以Ptet-ilvE-ilvD为例,L-缬氨酸合成途径酶串联表达质粒如下:
(1)用引物KZ-ilvD-S和KZ-ilvD-A扩增ilvD基因,用KZ-ilvE-S和KZ-ilvE-A扩增ilvE基因。
(2)构建200μL的双酶切体系,如表8所示,将双酶切体系置于PCR仪中,37℃,反应3h。将双酶切pEtac载体得到的片段与ilvD基因和ilvE基因的融合片段按表9所示体系进行同源重组,将构建好的10μL的同源重组体系于PCR仪中,50℃,反应30min,得到Ptet-ilvE-ilvD。
pEtac-ilvBN-ilvC的构建方法同Ptet-ilvE-ilvD,pEtac-ilvBN-ilvC和Ptet-ilvE-ilvD结构如图4所示。
采用电转法将双质粒导入耐受高浓度葡萄糖的EC01-G60和EC07-G60中,分别得到EC09和EC10,使E.coli成为具备高效L-缬氨酸生产力的菌种。重组质粒pEtac-ilvBN-ilvC,ptet-ilvE-ilvD导入野生型E.coli JM109,命名为EC11,作为空白对照。
EC09、EC10、EC11在0~12h生长速度快,性能优良,在12~48h生长延缓,并呈现下降趋势,EC09、EC010下降趋势较EC11不显著。发酵液中,EC09、EC10和EC11,在发酵初始时刻pH为5.5~5.6,随着发酵时间的延长,底物逐渐消耗,产物逐渐生成,pH逐渐下降,发酵终止时刻发酵液pH均为5.4。EC09、EC010和EC11摇瓶发酵L-缬氨酸,菌体对葡萄糖耐受性好,生长性能优良,L-缬氨酸产量分别可达6.62g/L、5.80g/L和3.58g/L。同时实验发现,未转入pEtac-ilvBN-ilvC、Ptet-ilvE-ilvD双质粒的E.coli JM109、EC01-G60、EC07-G60发酵几乎不产生L-缬氨酸。
综上,根据菌株存活率、葡萄糖的耐受性、生长曲线等指标,筛选出产缬氨酸耐高浓度葡萄糖的单基因过表达菌株优良表型EC10、产缬氨酸耐高浓度葡萄糖的单基因敲除菌株优良表型EC09。
表13本实例使用的菌株和质粒
表14本实例所用的引物
实施例4
具有自主进化系统的大肠杆菌的构建,具体步骤如下
(1)构建调控元件质粒P15A-LuxI-LuxR和PluxI-mKate2,构建方法参照文献(KimE-M,Woo HM,Tian T,Yilmaz S,Javidpour P,Keasling JD,Lee TS.Autonomous controlof metabolic state by a quorum sensing(QS)-mediated regulator for bisaboleneproduction in engineered E.coli.Metab Eng,2017,44:325-336.)。将构建的质粒P15A-LuxI-LuxR、PluxI-mKate2采用电转化法转入E.coli JM109,获得重组菌株,在96孔细胞培养板中培养,每30min检测荧光及细胞生长情况评估调控元件效果。
(2)保真模块pEM-PesaS-mutH的构建:以实施例1中葡萄糖压力筛选得到的mutH作为候选基因。用引物KZ-PesaS-S和KZ-PesaS-A扩增PesaS,用KZ-PesaS-mutH-S和KZ-PesaS-mutH-A扩增mutH基因,PesaS和mutH的融合片段与双酶切后的pEM载体同源重组,构建表15所示同源重组体系,将构建好的10μL的同源重组体系于PCR仪中,50℃反应30min得到保真模块pEM-PesaS-mutH的构建,结构如图5所示,序列如SEQ ID NO:1所示:
表15同源重组体系
(3)突变模块pCDFDuet-1-pluxI-rpoD的构建方法同pEM-PesaS-mutH,以实施例2中葡萄糖压力筛选得到的rpoD作为候选基因。候选基因rpoD从基因组上扩增,rpoD和启动子PluxI连接质粒pCDFDuet-1得到突变模块pCDFDuet-1-pluxI-rpoD,结构如图5所示,序列如SEQ ID NO:2所示。保真模块和突变模块分别由启动子PesaS和PluxI调控,保真模块和突变模块转入步骤(1)的重组菌株中,得到图1所示具有自主进化系统的大肠杆菌EC12-G60。经葡萄糖压力测试,EC12-G60存活率分别比E.coli JM109提高了8.3倍。
(3)采用电转法将L-缬氨酸合成途径酶串联表达双质粒(pEtac-ilvBN-ilvC,ptet-ilvE-ilvD)导入步骤(3)所述大肠杆菌EC12-G60中,进一步得到产缬氨酸耐高浓度葡萄糖大肠杆菌。摇瓶发酵L-缬氨酸,菌体对葡萄糖耐受性好,生长性能优良,L-缬氨酸产量可达8.62g/L。
表16本实例使用的菌株和质粒
表17本实例所用的引物
对比例1
L-缬氨酸发酵的种子培养基(每L)的配方为:葡萄糖20g、酵母提取物5g、(NH
从-80℃甘油管保藏的E.coli JM109(Invitrogen购买)取200μL接种于装有50mL种子培养基的500mL三角瓶中,37℃,200r/min培养12h,控制菌悬液OD600,然后取1mL接入装有50mL种子培养基的500mL三角瓶中,在37℃,120rpm(往复式摇床)转速下培养7-8h。
L-缬氨酸发酵的摇瓶发酵培养基(每L)的配方:葡萄糖20g,酵母提取物4g,胰蛋白胨3g,柠檬酸钠2g、KH
发酵培养基培养后,监测发酵液发现E.coli JM109发酵几乎不产生L-缬氨酸。
- 一种基于遗传进化的自主无人系统软件配置项调整方法
- 一种面向在线教育智能助教的自主进化方法及系统
