莫诺苷在制备增肌、防治骨骼肌萎缩和/或防治肌损伤的保健品和/或药物中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及保健、医药技术领域,尤其是涉及莫诺苷在制备增肌、防治骨骼肌萎缩和/或防治肌损伤的保健品和/或药物中的应用。
背景技术
莫诺苷是一种环烯醚萜苷类化合物,化学式为C
骨骼肌约占人体体重的40%。肌肉增加会使男性更阳刚、强壮,使女性线条更优美、身形更挺拔、性感。然而目前仍然缺乏直接作用于骨骼肌而增肌的保健品和/或药品。虽然人们目前主要通过健身和补充高蛋白、高碳水、高热量的膳食补充剂来达到增肌的目的,但效果有限且难以坚持。
骨骼肌萎缩(skeletal muscle atrophy)以肌肉质量和收缩功能的减退为特征,增加一系列不良后果的风险,包括虚弱、跌倒相关的骨折和创伤、肢体残疾、住院,给社会造成巨额的医疗保健花费。目前,临床上还没有任何药物获批用于对抗骨骼肌萎缩。抗阻力训练和营养补充是当前临床上主要的两种干预手段,但并不适用于所有肌萎缩病人,比如已经很虚弱需要休养的病人或者瘫痪的病人,并且治疗效果有限,且依从性差。
衰老、类风湿关节炎、恶病质、癌症、废用、失神经、杜氏肌营养不良、克罗恩病(Crohn's disease)、糖尿病等多种病理状况都会引起肌萎缩。尽管多家制药公司付出了巨大的努力来确定有效的药物靶点和化合物来抵消肌肉丢失,但临床上还没有成功的药物治疗肌萎缩。在临床研究中,包括依那西普(TNFα抑制剂)和阻断TNFα的中和抗体英夫利昔单抗在内的治疗干预均未能成功治疗恶病质引起的肌肉萎缩,其原因可能在于恶病质是一种多因素综合征,任何单一疗法均不足以阻止或预防肌肉丢失。
肌损伤在运动相关挫伤中所占比例最高。肌肉损伤的治疗与其损伤程度有关。临床上通常采用侧重于物理保守治疗的RICE原则(休息、冰敷、加压、抬高)。在组织撕裂的情况下,局部注射麻醉剂、抗炎剂,甚至手术修复。虽然应用非甾体抗炎药和抗血栓预防是合理的,但副作用限制了它们被使用。某些活血化瘀类中药虽然也被用于治疗肌肉拉伤,然而其治疗机制主要与改善局部血液循环有关。除上述疗法之外,临床上仍缺乏直接促进骨骼肌再生的药物。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供莫诺苷在制备增肌、防治骨骼肌萎缩和/或防治肌损伤的保健品和/或药物中的应用;研究发现,莫诺苷能够通过多种未知的作用机制来实现良好的增肌、骨骼肌萎缩防治和/或肌损伤防治功效。
本发明提供莫诺苷在制备增肌、防治骨骼肌萎缩和/或防治肌损伤的保健品和/或药物中的应用。
进一步地,莫诺苷通过促进骨骼肌干细胞存活増殖和/或分化来增肌、防治骨骼肌萎缩和/或防治肌损伤。
进一步地,莫诺苷通过促进骨骼肌干细胞分化和促进骨骼肌再生中的至少一种来增肌、防治骨骼肌萎缩和/或防治肌损伤;优选地,骨骼肌干细胞分化包括骨骼肌干细胞向肌纤维的分化。
进一步地,莫诺苷通过维持骨骼肌干细胞自我更新、维持成熟肌纤维的类型多样性和维持成熟肌纤维的饱满状态中的至少一种来增肌、防治骨骼肌萎缩和/或防治肌损伤。
进一步地,莫诺苷通过抑制经典和/或非经典的NF-κB信号传导来防治骨骼肌萎缩和/或防治肌损伤;优选地,抑制经典的NF-κB信号传导包括抑制NF-κB p65/RelA信号传导和/或抑制NF-κB p50信号传导;抑制非经典的NF-κB信号传导包括抑制NF-κB RelB信号传导和/或抑制NF-κB p52信号传导。
进一步地,莫诺苷通过抑制经典和/或非经典的NF-κB信号传导下游炎症因子表达来防治骨骼肌萎缩和/或防治肌损伤;优选地,炎症因子包括IL6、IL-1b、CRP、NIRP3、PTGS2和TNFα中的至少一种。
进一步地,莫诺苷通过激活IGF-1/IGF-1R/PI3K/Akt、激活BMP14/BMPR2/ALK2/3/Smad6/5/9信号通路和促进肌管蛋白合成中的一种来增肌。
进一步地,莫诺苷通过激活IGF-1/IGF-1R/IRS-1/PI3K/Akt、激活BMP14/BMPR2/ALK2/3/Smad5/9信号通路和促进肌管蛋白合成中的一种来防治骨骼肌萎缩和/或防治肌损伤。
进一步地,莫诺苷通过抑制Myostatin/activin蛋白降解通路、抑制泛素-蛋白酶体系统相关下游基因/蛋白质激活和抑制自噬-溶酶体系统相关下游基因/蛋白质激活中的至少一种来增肌、防治骨骼肌萎缩和/或防治肌损伤;优选地,抑制Myostatin/activin蛋白降解通路包括上调Follistatin/Smad7和下调Myostatin/Bmp11/Alk4/5/7/Smad2/3中的至少一种;抑制泛素-蛋白酶体系统相关下游基因/蛋白质激活包括抑制FoxO3、Atrogin-1和MuRF1表达中的至少一种;抑制自噬-溶酶体系统相关下游基因/蛋白质激活包括抑制Bnip3、LC3A和LC3B表达中的至少一种。
进一步地,莫诺苷通过抑制锌离子集聚信号(ZIP14)来增肌、防治骨骼肌萎缩和/或防治肌损伤。
在上述应用中,莫诺苷的纯度≥98%;莫诺苷的小鼠体内有效剂量为10-40μg/kg/d,优选为10-20μg/kg/d;经换算,莫诺苷在人体中增肌、防治骨骼肌萎缩和/或防治肌损伤的有效剂量为0.8-4.7μg/kg/d,优选为0.8-2.4μg/kg/d。
在本发明中,增肌包括但不限于预防、改善、治疗骨骼肌生长、发育、质量、力量、功能等相关的表型和/或疾病;防治骨骼肌萎缩和/或肌损伤包括但不限于预防、改善、治疗骨骼肌萎缩和/或肌损伤相关疾病;骨骼肌萎缩和/或肌损伤相关疾病包括但不限于衰老、类风湿关节炎、恶病质、癌症、废用、失神经、包括杜氏肌营养不良在内的各种肌营养不良、肌无力、肌炎、肌病、克罗恩病(Crohn's disease)、糖尿病等多种病理状况引起的肌萎缩和/或运动、创伤、挫伤、拉伤、撕裂、毒素、退行性疾病(如肌肉营养不良)和劳损等引起的肌损伤。
本发明经研究发现:莫诺苷能够促进骨骼肌干细胞存活増殖和/或分化(且高浓度莫诺苷(640μg/mL)对骨骼肌干细胞没有明显毒副作用),促进肌损伤后骨骼肌干细胞分化和骨骼肌再生,维持骨骼肌干细胞自我更新和成熟肌纤维的类型多样性和饱满状态,抑制经典和非经典NF-κB信号传导、炎症介质(IL6、IL-1b、CRP、NIRP3、PTGS2、TNFα)、锌离子集聚信号(Zip14)、蛋白质降解信号(Follistatin、Myostatin、Bmp11、ALK4/5/7、Smad7/3)、泛素-蛋白酶体分子(FoxO3、Atrogin-1、MuRF1)自噬-溶酶体分子(Bnip3、LC3A、LC3B),同时促进蛋白质合成信号(IGF-1/IGF-1R/IRS-1/PI3K/Akt、BMP14/BMPR2/ALK2/3/Smad6/5/9),对包括小鼠肝脏和肾脏在内的任何器官中均未发现明显的不良反应,从而实现良好的增肌、骨骼肌萎缩防治和/或肌损伤防治功效。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍。
图1为莫诺苷直接促进骨骼肌干细胞存活増殖和分化,且高浓度莫诺苷(640μg/mL)对骨骼肌干细胞没有明显毒副作用结果(*p<0.05;**p<0.01;***p<0.001);
图2为莫诺苷直接促进肌损伤后骨骼肌干细胞分化并推动骨骼肌再生结果(*p<0.05);
图3为莫诺苷直接促进C2C12肌管的蛋白合成信号通路结果(*p<0.05;**p<0.01;***p<0.001;****p<0.0001);
图4为莫诺苷直接抑制C2C12肌管的蛋白酶体和自噬降解信号通路和锌离子集聚信号结果(*p<0.05;**p<0.01;***p<0.001);
图5为TNFα在由去神经支配引起的萎缩的骨骼肌中增加并在体外诱导肌管萎缩结果(*p<0.05,**p<0.01,***p<0.001);
图6为莫诺苷在体外纠正TNFα诱导的肌管萎缩结果(*p<0.05,**p<0.01);
图7为莫诺苷阻止体内去神经支配引起的骨骼肌萎缩结果(*p<0.05,**p<0.01,***p<0.001,****p<0.0001);
图8为莫诺苷抑制TNFα处理的C2C12肌管和去神经小鼠肌肉中的经典和非经典NF-κB信号传导结果(*p<0.05,**p<0.01,***p<0.001,****p<0.0001);
图9为莫诺苷减弱用TNFα处理的C2C12肌管和去神经小鼠肌肉中的炎症介质和锌离子积蓄信号ZIP14结果(*p<0.05,**p<0.01,***p<0.001,****p<0.0001);
图10为莫诺苷改善TNFα处理的肌管中的蛋白质合成信号通路结果(*p<0.05,**p<0.01,***p<0.001);
图11为莫诺苷抑制用TNFα处理的C2C12肌管和/或去神经小鼠肌肉中的蛋白酶体和自噬降解信号通路结果(*p<0.05,**p<0.01,***p<0.001,****p<0.0001);
图12显示莫诺苷对去神经诱导的小鼠肝脏和肾脏没有明显的副作用;
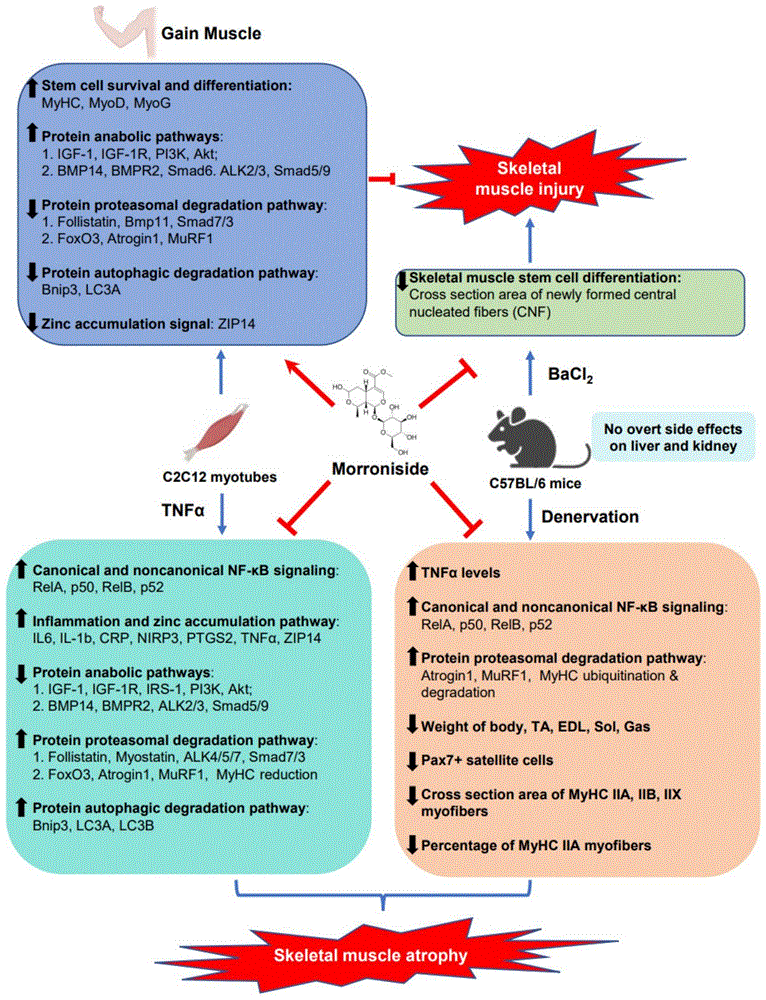
图13示意性说明莫诺苷促进骨骼肌生长及对骨骼肌萎缩、骨骼肌损伤的保护作用、机制和安全性。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一、实验材料
1、莫诺苷
纯度为99.57%,购自成都曼思特生物科技有限公司,CAS No.25406-64-8,货号A0349。
2、C2C12细胞系
来自于小鼠成肌细胞(骨骼肌干细胞),购于
3、试剂
C2C12完全基础培养基:10%FBS+1%P/S+DMEM;
C2C12分化培养基:2%HS+1%P/S+DMEM;
C2C12冻存液:10%DMSO+FBS。
4、动物
2月龄C57BL/6雄性小鼠,通过骨骼肌注射1.2%氯化钡诱导骨骼肌损伤,以研究肌肉再生的作用。实验性的肌损伤模型操作方法为:首先通过腹腔注射250-500mg/kg三溴乙醇(Avertin)来麻醉小鼠。然后用30G注射器肌肉注射(Intramuscular,IM)50μl 1.2%氯化钡(BaCl
实验性的肌萎缩模型操作方法为:将2个月大的雄性C57BL/6小鼠根据体重随机进行分组,并通过腹腔注射250-500mg/kg三溴乙醇(Avertin)麻醉。使用电动剃须刀剃掉后肢上的毛发。在后肢皮肤上剪开一个小切口,分离双腿的坐骨神经,用手术剪刀剪下约5毫米的神经,切口用缝线闭合。小鼠接受5mg/kg美洛昔康皮下注射每天一次,持续三天以控制疼痛。在假手术组中,小鼠接受了类似的外科手术,但没有进行坐骨神经横断。为了研究莫诺苷的作用,在术后第一天开始,假手术组和失神经组小鼠每天腹腔注射载体盐水;失神经低剂量治疗组每天腹腔注射10μg/kg莫诺苷,失神经高剂量治疗组每天注射20μg/kg莫诺苷,共注射12天。此后,通过安乐死处死小鼠,收集血液、各种骨骼肌组织、肝、肾组织进一步实验。将胫前肌(TA)肌肉组织放在30%蔗糖PBS溶液中脱水24小时,然后包埋在O.C.T(SakuraFinetek,货号4583)中,在干冰冷却的异戊烷中冷冻,并在-80℃下储存以进行后续切片和染色。
二、实验方法
1、细胞存活增殖及诱导肌管形成
存活增殖:将C2C12成肌细胞给予0-640μg/mL的莫诺苷处理48小时,细胞的存活增殖用CCK8试剂盒((Vazyme,货号A311-02)检测。
诱导肌管:将分离的肌原细胞(CD45
2、实时定量PCR
将腓肠肌放在TRIzol试剂(Invitrogen,Thermo Fisher Scientific)中,在Tissuelyser II(Qiagen,USA)中对其进行匀浆。使用TRIzol试剂从肌肉组织匀浆或C2C12肌管中提取总RNA。使用HiScript II cDNA合成试剂盒(Vazyme,货号R222-01)合成cDNA。使用ChamQ Universal SYBR qPCR Master Mix(Vazyme,货号Q711-02)在Jena Qtower384G机器中进行定量RT-PCR扩增。每个样品三个复孔,每个实验至少重复3次。使用2^-(ΔΔCt)方法计算基因表达倍数变化,针对Gapdh的表达进行标准化。
3、蛋白质印迹分析和免疫共沉淀
将腓肠肌放入蛋白质裂解液中(1x RIPA裂解缓冲液(Millipore,货号20-188)添加5mM NEM,1mM DTT,1mM PMSF和蛋白酶抑制剂(Roche,货号11836170001)),使用TissueLyser II仪器(Qiagen,USA)在30Hz条件下裂解肌肉组织。对于体外实验,将C2C12细胞重悬在蛋白质裂解缓冲液中。将肌肉匀浆和C2C12细胞裂解缓冲液在冰上摇动40分钟,并在4℃下以13,300r.p.m.离心15分钟。蛋白质浓度使用BCA蛋白质测定试剂盒(Thermofisher,货号23225)进行定量。将全细胞裂解物(10-30μg蛋白质/泳道)加载到4%-15% SDS-PAGE凝胶中电泳,再转移到PVDF膜上。免疫印迹使用TNFα抗体(1:1000,Cell Signaling,货号11948T),RelA(1:1000,Cell Signaling,货号8242),p50(1:1000,Cell Signaling,货号13586S),RelB(1:1000,Cell Signaling,货号10544S),p52(1:500,Santa Crus,货号sc-7386),MyHC(1:500,R&D,货号MAB4470)和GAPDH(1:3000,Goodhere,货号AB-P-R 001)。对于泛素化测定,将500μg含有103nM泛素-醛(South Bay Bio,CA,USA,货号SBB-PS0031)的蛋白质裂解物与MyHC抗体(1:500,R&D,货号MAB4470)一起孵育,沉淀的蛋白质使用Ub抗体(santa cruz,货号sc-8017)进行免疫印迹。使用ECL化学发光(Thermo Fisher,货号34577)使条带可视化。
4、免疫荧光染色
冷冻切片(10μm厚)用4% PFA固定10分钟,洗涤并用0.2% Triton-100和10%正常山羊血清在PBST中室温封闭30分钟,并用3%亲和纯Fab片段抗小鼠IgG(H+L)和抗小鼠IgM(Jackson Immuno Research,West Grove,PA,USA,货号115-007-003和115-006-020)在室温下孵育1小时。切片用一抗MyHC-IIA(1:40,DSHB,Iowa City,IA,USA,货号SC-71)、MyHC-IIB(1:40,DSHB,货号BF-F3)、Pax7(1:40,DSHB,货号Pax7)、层粘连蛋白laminin(1:1000,Sigma-Aldrich,St.Louis,MO,USA,货号L9393)在4℃下孵育过夜。第二天,将切片用Alexa Fluor 568/488结合的山羊抗小鼠IgG1/IgM二抗(1:400,Invitrogen,Carlsbad,CA,USA,货号A21124/A21042)在室温下孵育1小时。对于原代成肌细胞和C2C12细胞分化的肌管染色,MyHC一抗(1:100,R&D Systems,Minneapolis,MN,USA,货号MAB4470)在4℃孵育过夜。第二天,将Alexa Fluor 488结合的山羊抗小鼠IgG(1:200,Invitrogen,货号A11001)在室温下孵育1小时。染色的玻片用含或不含DAPI的VECTASHIELD Antifade Mounting Medium封片(Vector Laboratories,Burlingame,CA,USA,目录H-1200-10或H-1000-10),接着使用Olympus(Shinjuku,Japan)FV3000倒置共聚焦成像激光扫描显微镜拍摄成像。染色的培养板使用Olympus(Shinjuku,Japan)IX83倒置电动荧光显微镜进行成像。
5、血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、尿素氮和肌酐定量
通过安乐死处死小鼠并用1mL注射器从心脏抽取血液。根据制造商的说明(中国南京建成生物工程研究所)分离血清用于测量血清ALT(目录#C009-2-1)、血清AST(目录号#C010-2-1)、血清尿素氮(目录号#C013-2-1)和血清肌酐(目录号#C011-2-1)。
6、苏木精和伊红(HE)染色
将肝脏切成0.5c宽的块,将肾脏沿冠状轴切成两块相同的块,并在10%缓冲福尔马林中4℃固定1-2天。样品在一系列梯度乙醇和二甲苯溶液中脱水并包埋在石蜡中。将4μm厚的切片行HE染色。
7、统计分析
在实验研究中,所有结果均以平均值±标准差给出。使用GraphPad Prism8.0.1软件(GraphPad Software Inc.,San Diego,CA,USA)进行统计分析。未配对的双尾Student’st检验用于两组之间的比较。单因素方差分析和Turkey的多重比较检验用于3组或更多组之间的比较。双因素方差分析和Tukey的多重比较检验用于两个因素之间的多组比较。p值小于0.05被认为具有统计学意义。
三、实验结果
1、莫诺苷直接促进骨骼肌干细胞存活増殖和分化,且高浓度莫诺苷(640μg/mL)对骨骼肌干细胞没有明显毒副作用
为了检测莫诺苷直接对骨骼肌干细胞的增殖和分化作用,我们首先在体外给予C2C12成肌细胞0-640μg/mL莫诺苷处理48小时,结果显示,随着莫诺苷给药剂量的增加,细胞活性増殖能力明显增加,且当莫诺苷浓度为10-160μg/mL能够有效促进C2C12成肌细胞的存活增殖,莫诺苷浓度达到640μg/mL也没有对细胞有任何明显毒副作用(图1A)。接着C2C12细胞在诱导肌管形成的同时给予莫诺苷处理,免疫荧光染色结果显示,莫诺苷能够显著促进MyHC阳性的有三个核以上的成熟肌管分化,且有剂量依赖性(图1B);qPCR结果显示,莫诺苷能够显著促进肌管分化指标MyoD、MyoG的表达且有剂量依赖性(图1C)。
2、莫诺苷直接促进肌损伤后骨骼肌干细胞分化并推动骨骼肌再生
2月龄C57BL/6雄性小鼠,通过骨骼肌注射1.2%氯化钡诱导骨骼肌损伤,以研究肌肉再生的作用。从肌损伤第2天开始,给予莫诺苷20μg/kg/day,给药10天后,取小鼠后肢胫前肌,经O.C.T包埋后,进行冰冻切片,通过Laminin(绿色)和DAPI(蓝色)免疫荧光染色(图2A),观察分析新生的核在中央的肌纤维(CNF)的横截面积(CSA)(图2B)。核在中央的肌纤维为新生肌纤维,通过统计新生肌纤维的横截面积来观察骨骼肌损伤后骨骼肌干细胞分化形成肌纤维的能力和骨骼肌再生的能力;结果显示,在给予莫诺苷治疗后,核在中央的新生肌纤维的横截面积明显大于载体盐水组(Veh)(图2A,图2B)。由此说明,莫诺苷能够有效促进骨骼肌干细胞分化形成新的肌纤维,从而达到促进损伤后骨骼肌再生的治疗作用。
3、莫诺苷直接促进C2C12肌管的蛋白合成信号通路
蛋白质合成对于肌管形成、肌肉生长、发育、功能至关重要,IGF-1/IGF-1R/Akt和BMP通路是两条关键的骨骼肌蛋白质合成通路。莫诺苷直接对C2C12肌管IGF-1/IGF-1R/Akt蛋白质合成途径影响的结果表明:莫诺苷上调了IGF-1、IGF-1R、PI3K激酶催化亚基PIK3CA,Akt2 mRNA的表达(图3A-图3D)。
此外,莫诺苷直接对BMP蛋白质合成途径影响的研究结果表明:莫诺苷上调了BMP配体BMP14(图3E)、BMP II型受体BMPR2(图3F)的mRNA表达和1型受体ALK2/3的募集水平(图3G-图3H)。同时,莫诺苷减弱了BMP通路负调节剂Smad6的表达(图3I),并上调了Smad5/9mRNA水平(图3K-图3L)。
上述结果表明:莫诺苷直接促进C2C12肌管分化形成过程中IGF-1/IGF-1R/PI3K/Akt和BMP14/BMPR2/ALK2/3/Smad6/5/9信号通路,促进了蛋白质合成表达。
4、莫诺苷直接抑制C2C12肌管的蛋白酶体和自噬降解信号通路和锌离子集聚信号
泛素-蛋白酶体系统和自噬-溶酶体系统诱导肌肉蛋白降解。Myostatin/activin和GDF11(BMP11)与II型受体(如ActRIIB/IIA)结合并募集I型受体ALK4/5/7,后者通过Smad4激活转录因子Smad2/3,促进泛素化相关蛋白降解。Myostatin/activin配体在细胞外被细胞因子Follistatin抑制。Smad7在胞质中负调节Myostatin/activin信号通路。转录因子叉头盒O 3型(FoxO3)不仅可以上调泛素-蛋白酶体系统(Atrogin1和MuRF1),还可以激活自噬-溶酶体系统(BNIP3和LC3)。此外,恶病质中ZIP-14依赖性的锌离子集聚会导致MyHC的丢失(Wang et al.,2018)。
在莫诺苷的增肌作用中研究了蛋白质降解信号的参与,肌肉生长抑制素myostatin蛋白降解途径如图4A-图4E所示,莫诺苷直接显著增加C2C12肌管中myostatin通路抑制性细胞因子Follistatin和负调节剂Smad7的mRNA水平,降低配体Bmp11和效应器Smad3 mRNA表达(图4A-图4E)。
为了研究莫诺苷是否抑制FoxO3、Atrogin1和MuRF1的表达,进行了qPCR,结果发现:莫诺苷能够直接降低C2C12肌管中FoxO3以及Atrogin1和MuRF1 mRNA水平(图4F-图4H)。
为了研究另一种蛋白质降解途径(自噬-溶酶体系统);结果表明:C2C12肌管中的自噬相关蛋白Bnip3、LC3a的mRNA水平在莫诺苷处理后显著降低(图4I-图4J)。
此外,还研究了锌离子集聚信号,结果表明:莫诺苷显著降低了C2C12肌管中的Zip14 mRNA表达(图4L)。
上述结果表明:在C2C12肌管分化过程中,莫诺苷减弱了Myostatin/activin通路(上调Follistatin/Smad7,下调Bmp11/Smad3)、FoxO3以及与泛素-蛋白酶体系统(Atrogin1、MuRF1)、自噬-溶酶体系统(Bnip3、LC3a)和锌离子集聚信号(ZIP14)相关基因的激活(图4A-图4L),从而能够抑制肌球蛋白重链MyHC等的降解,与图1B结果一致。
5、TNFα在由去神经支配引起的萎缩的骨骼肌中增加并在体外诱导肌管萎缩
为了检查TNFα在去神经诱导的肌肉萎缩中的作用,去除了成年野生型(WT)小鼠的一部分坐骨神经,并比较了假手术和去神经小鼠腓肠肌中的TNFα水平;结果表明:去神经小鼠骨骼肌样本中TNFα的平均mRNA水平和蛋白质水平高于假手术小鼠(图5A和图5B)。比较了假手术和去神经支配小鼠的骨骼肌表型;结果表明:去神经支配小鼠的体重(BW)、胫骨前肌(TA)、趾长伸肌(EDL)、比目鱼肌(Soleus)和腓肠肌(Gas)的重量降低(图5C)。用TNFα处理鼠成肌细胞系C2C12并诱导细胞向肌管分化;统计MyHC阳性的有三个核以上的成熟肌管的数量,结果表明:TNFα以剂量依赖性方式显着抑制C2C12细胞肌管形成(图5D)。通过磁力细胞分选(MACS)在年轻C57BL/6小鼠的原代肌原细胞中发现了TNFα对肌管形成的类似抑制作用(图5E)。
6、莫诺苷在体外纠正TNFα诱导的肌管萎缩
用TNFα处理C2C12细胞,并在有或没有莫诺苷给药的情况下,诱导细胞向肌管分化。免疫荧光染色结果显示:与载体组相比,在肌管形成过程中,在TNFα处理的C2C12细胞中,单位面积的成熟肌管数量、平均每个肌管的核数和肌管的相对直径降低,而在用TNFα处理的细胞中加入低剂量莫诺苷或高剂量莫诺苷处理后的上述参数与载体组中的值相似,并且显著高于TNFα处理组(图6A和图6B)。由此说明,莫诺苷在体外纠正了TNFα诱导的肌管萎缩。
7、莫诺苷阻止体内去神经支配引起的骨骼肌萎缩
对成年雄性C57BL/6小鼠进行坐骨神经横断或假手术,将小鼠随机分为假手术(Sham)、去神经(Den)、Den+低剂量莫诺苷(Mor-L)、Den+高剂量莫诺苷组(Mor-H)。结果表明:去神经小鼠的体重随时间呈下降趋势,而低剂量莫诺苷给药倾向于将小鼠体重恢复到正常水平;与去神经组相比,高剂量莫诺苷给药甚至在术后第10天显著增加去神经小鼠的体重(图7A)。与图5C一致,去神经小鼠的胫骨前肌(TA)、趾长伸肌(EDL)、比目鱼肌(Soleus)和腓肠肌(Gas)肌肉的重量减少,但在高剂量莫诺苷处理的去神经小鼠中显着增加(图7A)。
Pax7是一种已建立的肌肉干细胞(MuSC)标志物,在调节MuSC增殖中起关键作用。免疫荧光染色显示Pax7+卫星细胞的数量在去神经小鼠胫前肌TA中显著低于假手术组,而用高剂量莫诺苷处理的去神经小鼠与假手术小鼠的Pax7阳性的骨骼肌干细胞数量相似并且显著高于去神经支配的小鼠(图7B);由此说明,莫诺苷维持了骨骼肌干细胞自我更新。
肌纤维类型的多样性与功能多样性有关,肌肉纤维类型的变化会影响肌肉的收缩,代谢和生化特性。去神经支配后TA中受影响的肌肉纤维的确切类型在很大程度上是未知的。肌纤维的平均横截面积(CSA)(图7B),特别是MyHC IIA、IIB和IIX肌纤维的平均CSA(图7C)、MyHC IIA肌纤维的数量百分比(图7C)在去神经小鼠胫前肌TA中显著低于假手术组,而用高剂量莫诺苷处理的去神经小鼠与假手术小鼠的上述参数相似,并且显著高于去神经支配的小鼠(图7B-图7C);由此说明,去神经后,莫诺苷维持了成熟肌纤维的类型多样性和饱满状态。
上述结果表明:莫诺苷可以通过维持骨骼肌干细胞自我更新,促进分化,维持成熟肌纤维的类型多样性和饱满状态,来缓解体内由去神经支配引起的骨骼肌萎缩。
8、莫诺苷抑制TNFα处理的C2C12肌管和去神经小鼠肌肉中的经典和非经典NF-κB信号传导
NF-κB信号通过两种不同的途径激活:经典途径和非经典途径;其中,卫星细胞中经典的NF-κB信号激活减弱了成年小鼠受伤后的骨骼肌再生;非经典NF-κB的激活会损害小鼠的成肌分化、肌肉干细胞功能和肌肉再生。在分化过程中用TNFα或TNFα加莫诺苷处理C2C12细胞;结果发现:TNFα刺激C2C12肌管中经典NF-κB RelA、p50和非经典NF-κB RelB、p52基因的转录和翻译(图8A-图8C)。与此类似,去神经诱导的小鼠在腓肠肌中的RelA、p50、RelB和p52的mRNA和蛋白质水平高于假手术小鼠(图4D-图4F)。与单独的TNFα处理相比,在用TNFα处理的C2C12细胞中,莫诺苷处理显著降低了RelA、RelB和p52的mRNA和蛋白质水平,但不降低p50的mRNA和蛋白质水平(图8A-图8C)。与去神经支配的小鼠相比,莫诺苷处理的去神经小鼠的RelA、RelB和p52 mRNA水平显着降低,并且在腓肠肌中RelA、p50、RelB和p52的蛋白质水平低于去神经支配小鼠(图8D-图8F)。
9、莫诺苷减弱用TNFα处理的C2C12肌管和去神经小鼠肌肉中的炎症介质和锌离子集聚信号
对莫诺苷在肌肉中抗炎作用的结果表明:TNFα增加了C2C12肌管中的IL-6、IL-1b、CRP、NLRP3、PTGS2 mRNA水平以及TNFαmRNA和蛋白质水平(图9A-图9F,图9H)。类似地,去神经诱导的小鼠在腓肠肌中具有比假小鼠更高的TNFαmRNA和蛋白质水平(图9I-图9J)。莫诺苷治疗显著降低了TNFα处理的C2C12肌管和来自去神经支配小鼠的腓肠肌中这些炎症因子的mRNA和/或蛋白质水平(图9A-图9F,图9H-图9J)。莫诺苷处理显著降低了TNFα处理的C2C12肌管中的ZIP14 mRNA水平(图9G)。
上述结果表明:莫诺苷在TNFα处理的C2C12肌管中的/或来自去神经支配小鼠的骨骼肌肉样本中,可以同时减弱经典(p65/RelA,p50)和非经典(RelB,p52)NF-κB信号传导和下游炎症因子(IL6,IL-1b,CRP,NIRP3,PTGS2、TNFα)表达,同时减弱锌离子集聚信号(ZIP14)。
10、莫诺苷改善TNFα处理的肌管中的蛋白质合成信号通路
蛋白质合成和降解之间的不平衡导致骨骼肌萎缩,IGF-1/IGF-1R/Akt和BMP通路是两条关键的骨骼肌蛋白质合成通路。莫诺苷对TNFα处理后IGF-1/IGF-1R/Akt蛋白质合成途径影响的结果表明:TNFα降低了IGF-1mRNA表达,这可以通过莫诺苷处理缓解(图10A)。莫诺苷缓解了TNFα诱导的IGF-1R mRNA水平的下调(图10B)。TNFα降低了IRS-1衔接蛋白(图10C)和下游PI3K调节亚基PIK3R1(图10D)和催化亚基PIK3CA(图10E)以及Akt1/2/3的mRNA水平(图10F-图10H)。在TNFα处理的C2C12肌管中,莫诺苷上调IRS-1、PIK3R1、PIK3CA和Akt1(图10C-图10F)。
此外,对BMP蛋白质合成途径的研究结果表明:TNFα降低BMP配体BMP14(图10I)、BMP II型受体BMPR2(图10J)的mRNA表达和1型受体ALK2/3的募集水平(图10K-图10L),这可以通过莫诺苷治疗逆转(图10I-图10L)。莫诺苷有趋势减弱TNFα诱导的BMP通路负调节剂Smad6的增加(图10M)和TNFα诱导的Smad1的减少(图10N)。莫诺苷显著减弱了TNFα诱导的Smad5/9mRNA水平的降低(图10O-图10P)。
上述结果表明:莫诺苷促进了IGF-1/IGF-1R/PI3K/Akt信号通路和BMP14/BMPR2/ALK2/3/Smad5/9信号通路,逆转了TNFa对C2C12肌管中的蛋白质合成的抑制作用,进而保护C2C12肌管免受TNFα诱导的萎缩。
11、莫诺苷抑制用TNFα处理的C2C12肌管和/或去神经小鼠肌肉中的蛋白酶体和自噬降解信号通路
泛素-蛋白酶体系统和自噬-溶酶体系统诱导肌肉蛋白降解。Myostatin/activin途径参与蛋白质降解。Myostatin/activin和GDF11(BMP11)与II型受体(如ActRIIB/IIA)结合并募集I型受体ALK4/5/7,后者通过Smad4激活转录因子Smad2/3,促进泛素化相关蛋白降解。Myostatin/activin配体在细胞外被细胞因子Follistatin抑制。Smad7在胞质中负调节Myostatin/activin信号通路。转录因子叉头盒O 3型(FoxO3)不仅可以上调泛素-蛋白酶体系统(Atrogin1和MuRF1),还可以激活自噬-溶酶体系统(BNIP3和LC3)。
在莫诺苷的保护机制中研究了蛋白质降解信号的参与,肌肉生长抑制素myostatin蛋白降解途径如图11A所示,TNFα显著降低肌肉生长抑制素myostatin通路抑制性细胞因子Follistatin和负调节剂Smad7的mRNA水平,增加配体肌肉生长抑制素myostatin、I型受体ALK4/5/7和效应器Smad3mRNA表达,上述参数都被TNFα处理的C2C12肌管中的莫诺苷处理逆转(图11A)。
为了研究莫诺苷是否抑制FoxO3、Atrogin1和MuRF1的表达以及肌肉中MyHC的减少,进行了qPCR和蛋白质印迹,结果发现:响应于TNFα,FoxO3 mRNA水平以及Atrogin1和MuRF1的转录和翻译在C2C12肌管中上调(图11B-图11C)。类似地,去神经支配的小鼠在腓肠肌中的Atrogin1和MuRF1 mRNA和蛋白质表达高于假手术小鼠(图11D-图11E)。莫诺苷显著降低了TNFα处理的C2C12肌管和来自去神经小鼠的腓肠肌中这些基因的mRNA和/或蛋白质水平(图11B-图11E)。与此一致,TNFα处理的C2C12肌管和去神经小鼠的腓肠肌中的MyHC蛋白水平显著低于对照载体处理的肌管和假手术小鼠组,而TNFα加莫诺苷处理的C2C12肌管和莫诺苷给药的去神经小鼠的腓肠肌样本中的MyHC水平与对照载体处理的肌管和假手术小鼠中的水平基本相似,并且分别显著高于TNFα处理的C2C12肌管和来自去神经支配的小鼠的腓肠肌中的水平(图11F-图11G)。
为了进一步研究莫诺苷阻止MyHC降解的机制,测量了MyHC泛素化水平,结果发现:它们在去神经小鼠的腓肠肌中高于假手术小鼠,但与去神经小鼠相比,莫诺苷治疗显著降低了这些值(图11H)。
此外,还研究了另一种蛋白质降解途径(自噬-溶酶体系统);结果表明:自噬相关蛋白Bnip3、LC3a和LC3b的mRNA水平被TNFα显着增加(图11I)。莫诺苷处理显著降低了TNFα诱导的Bnip3、LC3a和LC3b mRNA表达(图11I)。
上述结果表明:在TNFα处理的C2C12肌管或去神经小鼠肌肉中,莫诺苷减弱了Myostatin/activin通路(上调Follistatin/Smad7,下调Myostatin/Alk4/5/7/Smad2/3)、FoxO3以及与泛素-蛋白酶体系统(Atrogin1、MuRF1)和自噬-溶酶体系统(Bnip3、LC3a、LC3b)相关的下游基因/蛋白质的激活,从而抑制了肌球蛋白重链MyHC的降解,进而抑制TNFα诱导的肌管萎缩和去神经支配诱导的肌萎缩。
12、莫诺苷对去神经诱导的小鼠肝脏和肾脏没有明显的副作用
进一步研究了莫诺苷对小鼠是否有任何副作用,结果发现:假手术组、去神经(Den)组和Den+高剂量莫诺苷(Mor)组的血清ALT和AST水平(两种肝损伤标志物)没有显着差异(图12A)。同样,与假手术组和去神经支配组相比,莫诺苷也没有显著改变去神经支配小鼠的血清尿素氮和肌酐水平(两种肾损伤标志物)(图12B)。HE染色结果表明,与假手术组和去神经组相比,莫诺苷未诱导去神经小鼠肝脏和肾脏中的肝细胞和肾上皮细胞出现炎症浸润、变性或坏死等异常表型(图12C-图12D)。由此说明,莫诺苷对去神经诱导的肌萎缩小鼠的肝脏和肾脏没有明显的副作用。
综上所述,上述研究结果显示:莫诺苷直接促进骨骼肌干细胞存活増殖和分化,且高浓度莫诺苷(640μg/mL)对骨骼肌干细胞没有明显毒副作用(图1);莫诺苷直接促进肌损伤后骨骼肌干细胞分化并推动骨骼肌再生(图2);莫诺苷直接促进IGF-1/IGF-1R/PI3K/Akt和BMP14/BMPR2/ALK2/3/Smad6/5/9信号通路,促进C2C12肌管的蛋白合成(图3);莫诺苷直接抑制C2C12肌管的Myostatin/activin通路、FoxO3、泛素-蛋白酶体系统、自噬-溶酶体系统以及锌离子集聚信号相关基因的激活(图4);去神经支配诱导的萎缩肌肉中TNFα水平增加在体外显示抑制肌管形成(图5);莫诺苷在体外纠正了TNFα诱导的肌管萎缩(图6);接受莫诺苷注射的去神经小鼠显示出体重、肌肉重量、pax7+卫星细胞(骨骼肌干细胞)数量、肌肉横截面积(MyHC IIA、IIB和IIX)以及MyHC IIA+纤维百分比的改善(图7);莫诺苷在TNFα处理的C2C12肌管中的/或来自去神经支配小鼠的肌肉样本中,可以同时减弱经典(p65/RelA,p50)和非经典(RelB,p52)NF-κB信号传导和下游炎症因子(IL6,IL-1b,CRP,NIRP3,PTGS2、TNFα)以及锌离子集聚信号(ZIP14)表达(图8和图9);莫诺苷减弱了TNFα对IGF-1/IGF-1R/IRS-1/PI3K/Akt信号通路和BMP14/BMPR2/ALK2/3/Smad5/9通路的抑制,促进了C2C12肌管中的蛋白质合成(图10);在TNFα处理的C2C12肌管或去神经小鼠肌肉中,莫诺苷减弱了Myostatin/activin通路、FoxO3以及与泛素-蛋白酶体系统和自噬-溶酶体系统相关的下游基因/蛋白质的激活(图11);在莫诺苷治疗后,没有观察到小鼠的任何不良反应或外观、行为或饮食的显着变化,身体任何部位均未见红肿或水肿迹象,在包括肝脏和肾脏在内的任何器官中均未发现明显的毒性或病理,莫诺苷对小鼠无明显不良反应(图12)。莫诺苷介导的增肌、抗萎缩、抗肌损伤活性与促进骨骼肌干细胞存活増殖、分化,维持骨骼肌干细胞自我更新和成熟肌纤维的类型多样性和饱满状态,抑制经典和非经典NF-κB信号传导、炎症介质和锌积累信号、蛋白酶体和自噬蛋白降解途径,同时改善蛋白质合成信号通路有关(图13),为莫诺苷的增肌、抗萎缩、抗肌损伤功效、机制和安全性提供了强有力的初步证据,以支持进一步的保健品或药物开发。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 隐丹参酮在制备防治恶病质骨骼肌萎缩药物中的应用
- 维生素D在制备预防和/或改善增龄所致肌少症的药物或保健品中的应用
