一种精子DNA提取试剂盒及提取方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于分子生物学技术领域,具体地,涉及一种精子DNA提取试剂盒及提取方法。
背景技术
近年来,我国种业存在一定的结构性失衡,农作物育种相对领先,在多个领域与国际先进水平持平或差距较小,而畜牧业育种则相对落后,同时,不同畜种育种发展水平也存在不平衡。例如,我国商品猪种源大约八成依赖进口;国外奶牛种公牛冻精产品占我国冻精产品市场的50%以上。所以在建设种业强国的过程中,必须尽力补齐畜禽种业这块短板。
基因组DNA是动物遗传物质的主要载体,其在基因工程、环境检测、环境净化、农业、畜牧业、食品业、药品和基因治疗等领域都有广泛的应用。随着分子生物学和分子育种的发展,基因组DNA的提取与保存成为动物科学实验和育种生产过程中越来越重要的内容。
然而,常规的基因组DNA提取方法或DNA提取试剂盒无法获得高质量的精子DNA,导致精子DNA在消化中释放困难、抽提产率低、纯度低,难以满足高要求的分子生物学。
发明内容
为了解决上述技术问题中的至少一个,本发明采用的技术方案如下:
本发明第一方面提供一种精子DNA提取试剂盒,包括裂解液,所述裂解液中包括0.9~2.5%的SDS、0.156~0.267M的DTT,0.19~0.21mg/mL的蛋白酶和5~12ng/μL的RNaseA。
在本发明的一些具体实施方案中,所述裂解液中包括1.5%的SDS、0.2M的DTT,0.2mg/mL的蛋白酶和10ng/μL的RNase A。
在本发明的一些实施方案中,所述试剂盒还包括漂洗液和洗脱液。
在本发明的一些具体实施方案中,所述漂洗液为有机醇溶液,例如乙醇、丁醇等。在本发明的一些优选实施方案中,所述漂洗液为80%乙醇。
在本发明的一些具体实施方案中,所述洗脱液选自TE缓冲液、Tris-HCl缓冲液和水。在本发明的一些具体实施方案中,所述洗脱液为pH=8.0的Tris-HCl。
本发明第二方面提供利用本发明第一方面所述精子DNA提取试剂盒提取精子DNA的方法,包括以下步骤:
S1,将精液冻存样本进行融化,取200μL于2mL离心管,32℃~41℃水浴锅中孵育20~35min,至溶液不粘稠,280~350×g离心至产生沉淀,吸弃上清溶液,保留沉淀;
S2,向沉淀中加入所述裂解液,55℃~60℃金属浴中孵育2.5~4h,再在70℃孵育15~25min;
S3,向上清液中加入0.6×体积氯仿,颠倒混匀样本或于涡旋仪上涡旋混匀样本,直至溶液完全乳化成白色;
S4,12000~14000×g,室温离心8~15min,吸取800μL上清液转移至新的1.5mL离心管中;
S5,向步骤S4中新的1.5mL离心管中加入0.6×体积混合均匀的磁珠,用移液器轻轻吹打混匀10次以上,室温静置3~8min;
S6,将离心管置于磁力架上静置3~8min,直至溶液澄清,吸弃上清;
S7,保持离心管在磁力架上,加入200μL所述漂洗液,室温静置20~40s后,吸弃上清;
S8,瞬时离心,保持1.5mL离心管固定于磁力架上,吸弃漂洗液,室温干燥磁珠3~8min;
S9,将离心管从磁力架上取下,加入100μL所述洗脱液,用移液器轻轻吹打混匀,室温静置3~8min;
S10,将1.5mL离心管置于磁力架上,室温静置3~8min至溶液澄清,小心吸取上清液转移到对应的新的样本保存管中,得到含有精子DNA的溶液。
在本发明的一些实施方案中,在步骤S8之前,重复一遍步骤S7。
在本发明中,所述精液来自猪、牛、羊或狗。
本发明的有益效果
相对于现有技术,本发明取得了以下有益效果:
利用本发明的试剂盒和方法提取精子DNA,得到的DNA总量高、琼脂糖凝胶检测主条带完整、纯度高,能够用于研究精子来源物种的遗传特性,为分子育种提供技术支持。
附图说明
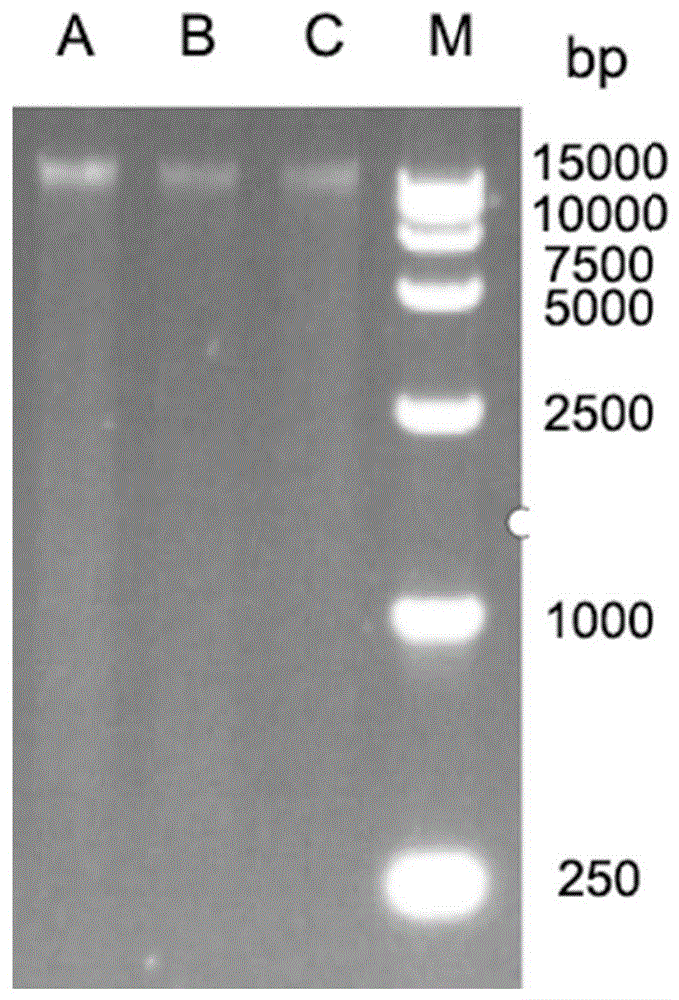
图1示出了3种裂解液提取精子DNA琼脂糖凝胶电泳结果。M:15000DNA Marker;A:裂解液A;B:裂解液B;C:裂解液C。
具体实施方式
除非另有说明、从上下文暗示或属于现有技术的惯例,否则本申请中所有的份数和百分比都基于重量,且所用的测试和表征方法都是与本申请的提交日期同步的。在适用的情况下,本申请中涉及的任何专利、专利申请或公开的内容全部结合于此作为参考,且其等价的同族专利也引入作为参考,特别这些文献所披露的关于本领域中的相关术语的定义。如果现有技术中披露的具体术语的定义与本申请中提供的任何定义不一致,则以本申请中提供的术语定义为准。
本申请中的数字范围是近似值,因此除非另有说明,否则其可包括范围以外的数值。数值范围包括以1个单位增加的从下限值到上限值的所有数值,条件是在任意较低值与任意较高值之间存在至少2个单位的间隔。对于包含小于1的数值或者包含大于1的分数(例如1.1,1.5等)的范围,则适当地将1个单位看作0.0001,0.001,0.01或者0.1。对于包含小于10(例如1到5)的个位数的范围,通常将1个单位看作0.1。这些仅仅是想要表达的内容的具体示例,并且所列举的最低值与最高值之间的数值的所有可能的组合都被认为清楚记载在本申请中。
术语“包含”,“包括”,“具有”以及它们的派生词不排除任何其它的组分、步骤或过程的存在,且与这些其它的组分、步骤或过程是否在本申请中披露无关。为消除任何疑问,除非明确说明,否则本申请中所有使用术语“包含”,“包括”,或“具有”的组合物可以包含任何附加的添加剂、辅料或化合物。相反,出来对操作性能所必要的那些,术语“基本上由……组成”将任何其他组分、步骤或过程排除在任何该术语下文叙述的范围之外。术语“由……组成”不包括未具体描述或列出的任何组分、步骤或过程。除非明确说明,否则术语“或”指列出的单独成员或其任何组合。
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
实施例
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用方式被并入。
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
实施例1精子DNA提取试剂的配制
1、裂解液
裂解液A制备:1.5% SDS,0.2M DTT,0.2mg/mL蛋白酶K,5~12ng/μL RNase A,以蒸馏水配制。
裂解液B制备(CN102296062A公开的裂解液配方):0.0125M EDTA(pH=8.0),0.0125M Tris-HCl(pH=8.0),1.25% SDS,3.625g/L NaCl,9.625g/L DTT,以蒸馏水配制。
裂解液C制备(CN112175942A公开的裂解液配方):2.12mL 6M硫氰酸胍溶液+60μL5M NaCl溶液+200μL 15%十二烷基肌氨酸钠溶液+450μL 1M DTT溶液+30μL20mg/mL蛋白酶K溶液+140μL无菌ddH
2、漂洗液
80%乙醇。
3、洗脱液
10mM Tris-HCl(pH=8.0)。
裂解液A、裂解液B和裂解液C任意一种与漂洗液和洗脱液制备成试剂盒,用于精子DNA提取。
实施例2精子DNA提取方法
利用实施例1制备的试剂盒进行精子DNA提取。
仪器设定1:提前开启水浴锅,设置温度为40℃。
仪器设定2:开启金属浴,设置温度为60℃,设置时间为4h,转速1400rpm。
(1)奶牛冷冻精液样本常温融化,分别取200μL样本于3个2mL离心管;
(2)水浴锅中孵育20~35min,至溶液不粘稠,可离心沉淀;
(3)300×g,5min离心,观察底部是否有沉淀,用移液器小心吸弃上清溶液,保留沉淀;
(4)三个离心管中分别加入裂解液A、裂解液B、裂解液C;
(5)金属浴中孵育3h;
(6)70℃孵育20min;
(7)向上清液中加入0.60×体积氯仿;
(8)颠倒混匀样本30s或于涡旋仪上涡旋混匀样本30s,直至溶液完全乳化成白色;
(9)13,000×g,室温离心10min;
(10)用移液器吸取800μL上清液转移至新的1.5mL离心管中;
(11)向上一步1.5mL离心管中加入上清液体积0.6×混合均匀的磁珠(杭州联川生物技术股份有限公司),用移液器轻轻吹打混匀10次以上,室温静置5min;
(12)将离心管置于磁力架上静置5min,直至溶液澄清,小心吸取并弃除上清,注意不要扰动磁珠;
(13)保持离心管在磁力架上,向管内加入200μL新鲜配置的漂洗液,室温静置30s后,小心吸取并弃除上清,注意不要扰动磁珠;
(14)重复上步骤一次;
(15)瞬时离心,然后保持1.5mL离心管固定于磁力架上,吸弃乙醇,室温干燥磁珠5min;
(16)将离心管从磁力架上取下,加入100μL洗脱液,用移液器轻轻吹打混匀,室温静置5min;
(17)将1.5mL离心管置于磁力架上,室温静置5min至溶液澄清,小心吸取上清液转移到对应的新的样本保存管中,保存于-20℃。
将提取好的DNA进行1%琼脂糖凝胶质检,结果如图1所示。
通过以下三个标准来判断3种裂解液提取精子DNA的结果,如表1所示。
表1 3种裂解液提取精子DNA结果
可以看出在DNA总量方面,由裂解液A处理后样本得到的DNA总量显著高于另外2种裂解液;在主带大小方面,由3种裂解液处理后都有完整的主带;在OD260/OD280方面由裂解液A处理后的纯度在3种裂解液中最高。
综上所述,裂解液A提取的精子DNA在各个方面均显著高于另外2种裂解液。
对比例
发明人为了证明实施例1中裂解液A在精子DNA提取中取得了预料不到的技术效果,对组分进行调整,并利用实施例2相同的方法进行精子DNA提取,结果如表2:
表2 裂解液A组合调整对精子DNA提取的影响
由此可见,实施例1中裂解液A的成份不能任意替换,否则,提取结果会显著下降,纯度变低。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 一种提取质粒DNA的菌体裂解液、试剂盒及提取质粒DNA的方法
- 一种提取水培植物基因组DNA的试剂盒及提取方法
- 一种磁珠法提取DNA的试剂盒及提取方法
- 一种磁珠法血浆游离DNA提取试剂盒及提取方法
- 用于游离循环肿瘤DNA提取的增强剂、提取外周血中游离循环肿瘤DNA的试剂盒及方法
- DNA提取试剂、DNA的提取方法及DNA提取试剂盒
- DNA提取试剂、DNA的提取方法及DNA提取试剂盒
