一种金藤清痹制剂的制备方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种金藤清痹制剂的制备方法,属于中药技术领域。
背景技术
《素问·痹论》曰:“风寒湿三气杂至合而为痹。”类风湿性关节炎在中医属痹证“历节病”、“尪痹”的范畴。其病程多反复发作缠绵难愈。
痹证:指感染风寒湿热之邪气,阻滞人体经络脏腑,血气运行失于畅通而致肢体关节、肌肉、筋骨等多处疼痛,或伴肿胀、酸楚、重着、麻木不仁、屈伸不力,甚至累及脏腑的一类疾患。内因:正气不足,是本。外因:风、寒、湿等邪气侵袭,是标。
正虚是发病的根本原因:因正虚而感受风寒湿热等外邪。因正虚无力驱邪外出,使病邪入里,阻滞气血经络。因正虚脏腑功能失调,使痰瘀等有形之邪自内而生,与外邪互结,胶着于关节、骨骱,加重血气经络阻滞。
类风湿性关节炎活动期常有关节灼痛,局部肿胀,皮色发红,触之灼热,或全身发热,或口干舌燥,或大便干结等征象。辨证总属邪实正虚。活动期多属邪实,治疗应以祛邪为主。“正气存内,邪不可干”,强调机体的自我抵抗力作用。
针对改善类风湿关节炎,金藤清痹颗粒以金银花、青风藤清热解毒,通痹止痛为君药;以白花蛇舌草、山慈菇、当归、白芍、鹿衔草解毒消肿,活血止痛,补肾强骨为臣药;佐以玄参、生地、甘草滋阴凉血,泻火解毒;以蜈蚣引药入经、直达病所为使药,全方共奏清热解毒,活血消肿,通痹止痛之功效,临床上广泛用于类风湿关节炎活动期,是《中成药临床应用指南—风湿病分册》推荐用药。相关实验数据显示:金藤清痹颗粒治疗类风湿关节炎总有效率可达89.13%。
发明内容
本发明的主要目的在于提供金藤清痹制剂的新的制备方法,以期获得治疗效果更好更优的金藤清痹制剂;
本发明所述金藤清痹制剂的制备方法主要包括以下步骤:
步骤A,取蜈蚣药材,加水蒸馏,蒸馏后的药渣,粉碎,蜈蚣粉末备用;
步骤B,取当归药材,加水蒸馏,蒸馏后的药渣和挥发油备用;
步骤C,取地黄、山慈菇、鹿衔草、玄参,浸泡,加入酶,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、步骤B所得蒸馏后的药渣、酶解后的药渣,加乙醇回流提取,提取液回收乙醇后,醇提液备用;
步骤D,将步骤C中所得醇提液、酶解液合并,浓缩成稠膏,粉碎,得提取物粉末备用;
步骤E,将步骤A所得蜈蚣粉末、步骤D所得提取物粉末混合,加入辅料,制粒,喷入步骤B所得挥发油,后按常规工艺制备成临床上可接受的剂型,即得。
具体的,步骤C中含有以下操作:取金银花、青风藤、白芍、白花蛇舌草、甘草、步骤B所得蒸馏后的药渣、酶解后的药渣,加40%-70%乙醇回流提取1-2次,每次1-2小时,合并提取液,回收乙醇后,醇提液备用。取地黄、山慈菇、鹿衔草、玄参,50-80℃热水浸泡1-3小时,冷却后加入酶,酶解液备用。
所述的步骤D中辅料选自糊精、β-环糊精、乳糖、蔗糖中的至少一种;
优选的,所述的辅料为β-环糊精。
上述步骤C中酶可以是木聚糖酶、纤维素酶、β-葡聚糖酶、木瓜蛋白酶、果胶酶中的一种或多种;
优选的,所述酶为β-葡聚糖酶、果胶酶的混合物。
鉴于以上优选的结果,所述的步骤C中含有以下操作,取地黄、山慈菇、鹿衔草、玄参,50-80℃热水浸泡1-3小时,冷却至室温后加入β-葡聚糖酶、果胶酶,酶解1-2小时,调节pH,酶解液备用。
进一步的,所述的β-葡聚糖酶、果胶酶的使用比例为3-10:1。
更进一步的,所述的β-葡聚糖酶、果胶酶的使用比例为5-8:1。
本发明还提供了上述金藤清痹制剂的具体组成成分,即所述的金藤清痹制剂主要由以下组分制备而成:
优选的,所述的金藤清痹制剂主要由以下组分制备而成:
本发明所述的金藤清痹制剂包括但不限于颗粒剂、片剂、胶囊剂、口服液体制剂。
与现有技术相比,本发明取得了显著的技术效果:
采用本发明制备方法制备而得的金藤清痹制剂,治疗类风湿性关节炎效果更优,可明显改善大鼠足跖肿胀度和关节组织损伤,降低血清中炎性因子TNF-α、IL-1β水平,且大鼠发生服药后呕吐的现象较少。
附图说明
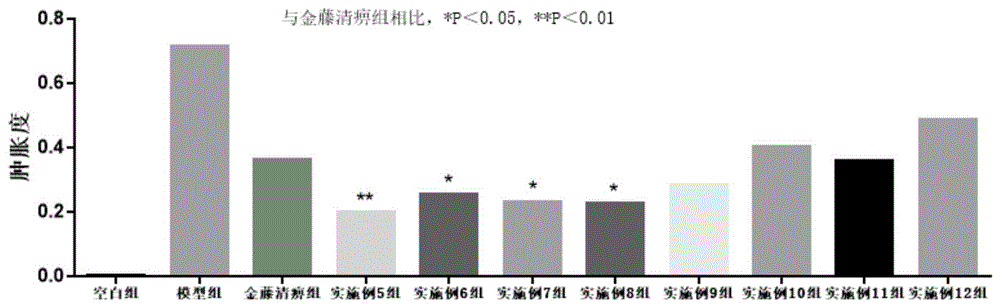
图1:各组大鼠足跖肿胀度比较
图2:各组大鼠关节病例评分比较
图3:各组大鼠血清TNF-α水平
图4:各组大鼠血清IL-1β水平
具体实施例
下面结合具体实施例进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。
实施例1胶囊剂制备
金银花400g、青风藤600g、白花蛇舌草300g、玄参300g、白芍450g、地黄550g、山慈菇150g、鹿衔草400g、当归230g、甘草200g、蜈蚣20g
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加80地水浸泡1小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为5:1),酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加40%乙醇回流提取2次,每次1小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(502)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β得环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,灌入胶囊,即得胶囊剂。
实施例2片剂制备
金银花550g、青风藤450g、白花蛇舌草400g、玄参200g、白芍600g、地黄450g、山慈菇200g、鹿衔草300g、当归300g、甘草150g、蜈蚣50g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加50℃水浸泡3小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为8:1),酶解1小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加70%乙醇回流提取1次,每次2小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(502)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β得环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,压片,即得片剂。
实施例3颗粒剂制备
金银花450g、青风藤500g、白花蛇舌草300g、玄参280g、白芍480g、地黄500g、山慈菇150g、鹿衔草350g、当归250g、甘草180g、蜈蚣30g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70℃水浸泡1.5小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为10:1),酶解1小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2小时,提取液减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(502)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β得环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例4颗粒剂制备
金银花500g、青风藤480g、白花蛇舌草350g、玄参230g、白芍500g、地黄450g、山慈菇180g、鹿衔草300g、当归300g、甘草150g、蜈蚣40g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70后水浸泡1.5小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为6:1),酶解1小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2小时,提取液减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(502)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β得环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例5颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70馏水浸泡2小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为6:1),酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(502)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β得环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例6颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70后水浸泡2小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为8:1),酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(502)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β得环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例7颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70℃水浸泡2小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为8:1),酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(50℃)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例8颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70℃水浸泡2小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为8:1),酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(50℃)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例9颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70℃水浸泡2小时,冷却至室温后,加入活化的纤维素酶,酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(50℃)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β-环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例10颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参,加70℃水浸泡2小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为12:1),酶解2小时,过滤,酶解液备用;取金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(50℃)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β-环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例11颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取当归药材,加水蒸馏,提取挥发油,蒸馏后的药渣和挥发油备用;取地黄、山慈菇、鹿衔草、玄参、金银花、青风藤、白芍、白花蛇舌草、甘草、蒸馏后的当归药渣、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(50℃)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β-环糊精,乙醇制粒,干燥,喷入当归挥发油,混匀,即得颗粒剂。
实施例12颗粒剂制备
金银花490g、青风藤495g、白花蛇舌草320g、玄参245g、白芍490g、地黄480g、山慈菇160g、鹿衔草330g、当归250g、甘草170g、蜈蚣35g;
制备方法:
取蜈蚣药材,加水蒸馏,蒸馏后的药渣,干燥,粉碎,过筛,得蜈蚣粉末备用;取地黄、山慈菇、鹿衔草、玄参,加70℃水浸泡2小时,冷却至室温后,加入活化的β-葡聚糖酶、果胶酶(比例为8:1),酶解2小时,过滤,酶解液备用;取当归、金银花、青风藤、白芍、白花蛇舌草、甘草、酶解后的药渣,加60%乙醇回流提取2次,每次1.5小时,合并两次提取液,减压浓缩回收乙醇,得醇提液备用;将以上所得醇提液、酶解液合并,过滤,浓缩至相对密度为1.25-1.30(50℃)的稠膏,干燥,粉碎,过筛,得提取物粉末备用;将以上所得蜈蚣粉末、提取物粉末混合,加入β-环糊精,乙醇制粒,干燥,即得颗粒剂。
二、药理学实验
为验证本发明所得金藤清痹制剂在治疗类风湿性关节炎中的治疗效果,发明人药效学实验,但应该理解的是,以下记载的实验内容仅用于举例说明技术效果,并不限制本发明。
以下实验研究均是在急性毒性试验、长期毒性试验证明药物安全性基础之上开展,实验研究中的给药剂量均在安全剂量范围之内。
1材料
1.1动物:
SD大鼠,体重180-220g,实验动物许可证号:SYXK(鲁)2018 0008,实验前适应性饲养一周。
1.2药物、试剂
1.2.1药物
市售金藤清痹颗粒及本发明实施例5、实施例6、实施例7、实施例8、实施例9、实施例10、实施例11、实施例12所得颗粒剂。
1.2.3用药剂量
SD大鼠用药组的用药量为2.7g/kg
2.造模、分组及给药
2.1造模方式
本发明类风湿性关节炎模型制备参考现有技术中已发表文献中方法进行,具体操作如下:
大鼠右后足趾处皮下注射Freund’s完全佐剂0.15ml诱导大鼠模型,首次注射10天后,相同部位重复注射1次,激发大鼠免疫反应。第2次注射后第3天观察大鼠足跖肿胀情况,以出现显著的炎性结节、表皮红肿症状视为造模成功。
2.2分组及给药
取造模成功的大鼠,随机分为模型组、金藤清痹组、实施例5组、实施例6组、实施例7组、实施例8组、实施例9组、实施例10组、实施例11组、实施例12组,每组10只;取正常大鼠10只(皮下注射生理盐水),作为空白组。
金藤清痹组及各实施例组,灌胃给予相应的药物;空白组及模型组灌胃给予等量的生理盐水。连续给药20天。
3观察指标
3.1足跖肿胀度
分别于给药前及末次给药1小时后,测量右后足跖体积,计算足跖肿胀度。
足跖肿胀度=末次给药1小时足跖体积-给药前足跖体积
3.2关节组织指数评分
取右后足跖处关节部位,石蜡包埋、固定脱水后进行HE染色,观察组织变化,按5级评分法评价关节病变程度。
0分:正常
1分:轻微局部炎性细胞浸润
2分:少于2/3的局部组织炎性细胞浸润
3分:大量的中性粒细胞及其他炎性细胞浸润,但未有血管翳的形成及坏死组织
4分:伴有血管翳的形成及局部组织的坏死
3.3炎性因子变化
末次给药1小时后,大鼠动脉采血,取血清,测定血清中TNF-α、IL-1β水平。
3.4统计学处理
采用SPSS 22.0软件对所得数据进行统计分析,计量资料用
4.结果及结论
4.1足跖肿胀度
造模后(即给药前)与空白组大鼠相比,足跖肿胀度明显偏高;给药治疗后,给药组大鼠足跖肿胀度明显下降,其中以实施例5组大鼠肿胀度下降最为明显,实施例6组、实施例7组、实施例8组、实施例9组次之,实施例10组、实施例11组、实施例12组与金藤清痹颗粒组相当。
4.2关节组织损伤
与空白组大鼠相比,模型组大鼠关节组织病理学评分明显偏高;给药治疗后,给药组大鼠关节组织病理学评分明显下降,其中以实施例5组大鼠评分最低,实施例6组、实施例7组、实施例8组、实施例9组次之,实施例10组、实施例11组、实施例12组与金藤清痹颗粒组相当。
4.3炎性因子
与空白组大鼠相比,模型组大鼠血清中TNF-α、IL-1β水平明显偏高;给药治疗后,给药组大鼠血清中TNF-α、IL-1β水平明显下降,其中以实施例5组大鼠最为明显,实施例6组、实施例7组、实施例8组、实施例9组次之,实施例10组、实施例11组、实施例12组与金藤清痹颗粒组相当。
4.4制剂评价
灌胃给药后,实施例7组6只,实施例8组4只出现大鼠呕吐现象,金藤清痹颗粒组大鼠5只出现干呕,但无呕吐现象。
三、临床使用观察
1.一般资料
选取某医院类风湿性关节炎患者26例作为研究对象,观察组13例,对照组13例。中医辨证,主症为关节肿胀冷痛,次症为恶风寒,肢体酸重。
2.治疗方法
对照组按照临床常规治疗方式加服市售金藤清痹颗粒,10g/袋,1袋/次,3次/天;
观察组按照临床常规治疗方式加服本发明实施例5所得颗粒剂,10g/袋,1袋/次,3次/天。
两组疗程均为15周。
3.观察指标
3.1观察患者晨僵时间、肿胀指数、压痛指数临床症状。
3.2在治疗前后检测C-反应蛋白(CPR)、血沉(ESR)、类风湿因子(RF)水平。
3.3治疗效果评价,显效为患者临床症状明显消失;有效为患者临床症状明显改善;无效为患者临床症状改善不明显,甚至进一步恶化。
总有效率(%)=(显效例数+有效例数)/总病例数×100%
4.结果评价
4.1临床症状比较
经治疗后的患者,其临床症状均得到显著的改善,其中观察组患者晨僵时间、肿胀指数、压痛指数与对照组相比,明显降低。
表1两组临床症状比较
4.2CPR、ESR、RF水平比较
经治疗后的患者,其CPR、ESR、RF水平均明显下降,观察组较对照组更优。
表2两组CPR、ESR、RF水平比较
4.3治疗效果比较
观察组显效7例,明显优于对照组的5例。
表3两组治疗效果比较
- 一种治疗类风湿性关节炎的清络通痹制剂及其制备方法
- 一种治疗类风湿性关节炎的清络通痹制剂及其制备方法
