检测细胞的上皮-间质转化的方法、试剂盒及用途
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物技术领域,具体涉及一种检测细胞的上皮-间质转化的方法。
背景技术
上皮-间质转化(the epithelial to mesenchymal transition,EMT)指上皮细胞向间质细胞转化,是重要的生物过程,对于研究细胞分化、胚胎发育、癌症转移和组织愈合等有重要的意义。EMT后细胞获得强的侵袭能力,细胞移动速度提高。目前常见的EMT的标志为:1、细胞形态变化由鱼鳞形变成梭形;2、细胞与细胞之间的连接标志—钙粘素(E-cadherin)减少;3、细胞骨架变化,出现明显的片状伪足;4、具有丰富的中间丝。因此常见的测定EMT的方式主要为测量细胞形态变化或者钙粘素变化。但是这两种方式目前没有能完美的区分出EMT诱导后的细胞。
细胞移动过程中,细胞与细胞外基质(ECM)之间的连接—粘着斑(FAS),发挥了重要作用。粘着斑是动态分子聚合,会不断的分解和聚合。其中整合素是组成粘着斑的重要部分,通过调节整合素与ECM的亲和力可以控制粘着斑的形成。整合素是一种跨膜蛋白,有激活和未激活两种状态,并在两种状态间切换。当它还未被激活时,会在细胞膜上进行运动。当它被激活时会招募Talin等蛋白将细胞外基质与肌动蛋白相连接,形成收缩单位。激活后整合素一端与外界相连,一端与肌动蛋白相连,会处于暂时固定的状态。而多个整合素形成的这种复合物经过成熟后会形成粘着斑(FAS)。在细胞移动过程中通过粘着斑处的这种物理连接拉动细胞向前运动。因此整合素是和细胞移动息息相关的重要蛋白。
目前已经对整合素标记、整合素运动进行了一系列研究,包括整合素在粘着斑内外的不同运动状态、整合素停顿与激活、整合素扩散行为等等。当前关于整合素的单分子研究大多集中于FAS的形成问题以及整合素的激活问题。另外,还有一些研究作为整合素体外单分子研究的体内延续,涉及在小尺度上的整合素如何参与粘着斑的行为,而不是针对细胞爬行这样的大尺度问题。目前,关于整合素和EMT的研究仅限于生物信号通路相关的研究,未有将整合素动力学与EMT结合的研究。
发明内容
本发明的一个目的是提供一种检测细胞的上皮-间质转化的新的方法。与之前通过与配体-量子点(QD)/GFP结合标记整合素的方法不同,本发明人出乎预料地发现,采用带有单个生物素的一抗与带有链霉亲和素的荧光探针结合的方式标记整合素,可以通过整合素的扩散运动来展示E型细胞和M型细胞的区别,进而实现对细胞的上皮-间质转化的检测。基于此发现,完成了本发明。
本发明的另一个目的是提供一种用于检测细胞的上皮-间质转化的试剂盒。
本发明的又一个目的是提供所述试剂盒的用途。
本发明的目的是通过以下技术方案实现的:
一方面,本发明提供了一种检测细胞的上皮-间质转化的方法,所述方法包括以下步骤:
1)将带有单个生物素的整合素抗体与待检测的细胞一起孵育,以特异性识别并结合所述细胞的细胞膜表面的整合素,孵育完成后去除未结合的带有单个生物素的整合素抗体;
2)向步骤1)的所得物中加入带有链霉亲和素的荧光探针并孵育,反应后去除未反应的多余的带有链霉亲和素的荧光探针,得到荧光探针标记的整合素;
3)通过对步骤2)得到的荧光探针标记的整合素的荧光探针进行成像,检测所述荧光探针标记的整合素的平均扩散速度相对于对照细胞的改变,其中所述荧光探针标记的整合素的平均扩散速度相对于对照细胞增加表明细胞发生上皮-间质转化。
优选地,相对于对照细胞,所述荧光探针标记的整合素的平均扩散速度增加40%-172%;更优选地,相对于对照细胞,所述荧光探针标记的整合素的平均扩散速度增加80%-172%。
优选地,在步骤1)之前还包括对细胞进行预处理的步骤。
优选地,所述细胞选自上皮细胞、间质细胞、肿瘤细胞、外周血单核细胞或淋巴细胞中的一种或多种;更优选地,所述细胞为上皮细胞或间质细胞;最优选地,所述细胞为正常乳腺细胞MCF10A或上皮-间质转化后的乳腺细胞MCF10A。
优选地,所述对照细胞选自相应的未发生上皮-间质转化的细胞;更优选地,所述对照细胞为上皮细胞;最优选地,所述对照细胞为正常乳腺细胞MCF10A。
优选地,在步骤1)中,所述孵育时间为10到18分钟,孵育温度为0到4℃;更优选地,所述孵育时间为15分钟,孵育温度为0℃。
优选地,所述带有单个生物素的整合素抗体选自带有单个生物素的抗β1整合素抗体、带有单个生物素的抗α5整合素抗体、带有单个生物素的抗β3整合素抗体、带有单个生物素的抗αv整合素抗体中的一种或多种;更优选地,所述带有单个生物素的整合素抗体为带有单个生物素的抗β1整合素抗体或抗α5整合素抗体;最优选地,所述带有单个生物素的整合素抗体为带有单个生物素的抗β1整合素抗体。
优选地,在步骤2)中,所述孵育时间为3到8分钟,孵育温度为0到4℃;更优选地,孵育时间为5分钟,孵育温度为0℃。
优选地,所述荧光探针选自荧光蛋白、聚合物染料或量子点中的一种或多种;更优选地,所述荧光探针为量子点;进一步优选地,所述量子点选自CdTe、CdSe和CdSe/ZnS核壳量子点,优选为CdSe/ZnS核壳量子点。
优选地,所述量子点选自最大发射波长为525nm-800nm的量子点中的一种或多种;更优选地,所述量子点为最大发射波长为600nm-800nm的量子点;最优选地,所述量子点为最大发射波长为655nm的量子点。
优选地,在步骤3)中,在步骤3)中,所述成像的发射波长为525nm-800nm;优选地,所述成像的发射波长为600nm-800nm;最优选地,所述成像的发射波长为655nm。
优选地,所述成像的激发波长小于所述成像的发射波长。
优选地,在步骤2)之前还包括对带有链霉亲和素的荧光探针进行离心的步骤。
优选地,所述离心在3000-7000g下进行2-5分钟;更优选地,所述离心在5000g下进行3-4分钟。
另一方面,本发明提供了带有单个生物素的整合素抗体和带有链霉亲和素的荧光探针在制备用于检测细胞的上皮-间质转化的试剂盒中的用途。
再一方面,本发明提供了一种用于检测细胞的上皮-间质转化的试剂盒,所述试剂盒包括:带有单个生物素的整合素抗体和带有链霉亲和素的荧光探针。
优选地,所述带有单个生物素的整合素抗体选自选自带有单个生物素的抗β1整合素抗体、带有单个生物素的抗α5整合素抗体、带有单个生物素的抗β3整合素抗体、带有单个生物素的抗αv整合素抗体中的一种或多种;优选地,所述带有单个生物素的整合素抗体为带有单个生物素的抗β1整合素抗体或抗α5整合素抗体;更优选地,所述带有单个生物素的整合素抗体为带有单个生物素的抗β1整合素抗体。
优选地,所述荧光探针选自荧光蛋白、聚合物染料或量子点中的一种或多种;更优选地,所述荧光探针为量子点;进一步优选地,所述量子点选自CdTe、CdSe和CdSe/ZnS核壳量子点,优选为CdSe/ZnS核壳量子点。
优选地,所述量子点选自最大发射波长为525nm-800nm的量子点中的一种或多种;更优选地,所述量子点为最大发射波长为600nm-800nm的量子点;最优选地,所述量子点为最大发射波长为655nm的量子点。本发明首次将整合素动力学与EMT结合并进行研究,明确了整合素扩散运动与细胞迁移能力之间的关系,对于EMT的相关研究具有重要的意义,可以扩展到其他的细胞研究领域,例如整合素动力学与细胞形态或细胞粘附等之间的关系的研究。与现有技术相比,本发明至少具有以下优点:
1、本发明的方法对现有技术的一抗与二抗标记整合素进行了改进,采用了亮度稳定且持久的量子点,使检测体系更加稳定,从而保持稳定而优秀的亮度。
2、本发明的方法与现有技术的一抗与二抗标记相比,能够保证被标记的整合素与量子点的1:1关系,避免出现一个一抗连接多个二抗的情况。
3、本发明的方法周期短,比常用的表达荧光方式更快,能够满足快速测定的需要。
4、本发明的方法适用于侵袭能力不同、移动能力不同的多种细胞。
5、本发明的方法是在活细胞中进行的,与传统方式相比,不改变细胞内部基因,不需要杀死细胞固定,并且能够在标记后仍然保留整合素的功能,标记后的整合素可以参与粘着班形成,对细胞影响小,结果更加准确。
6、本发明的方法相比于测量细胞形态变化的方法,灵敏度和准确度更高,可以有效地降低测量中的假阴性率。
7、本发明的方法相比于测量钙粘素的方法,用时少,实验步骤简单。
8、本发明的方法可以适用于标记各种整合素,对于各种类型的细胞中的整合素的扩散运动的研究具有指导意义。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1A显示MCF10A细胞在EMT后,细胞形态逐渐发生改变。
图1B显示统计的EMT前后细胞圆度和面积的变化。
图2A显示通过荧光显微镜拍摄的标记后的细胞表面的整合素的荧光图。
图2B显示连续拍摄2000帧(间隔0.1s)后得到的单个整合素的扩散轨迹图。
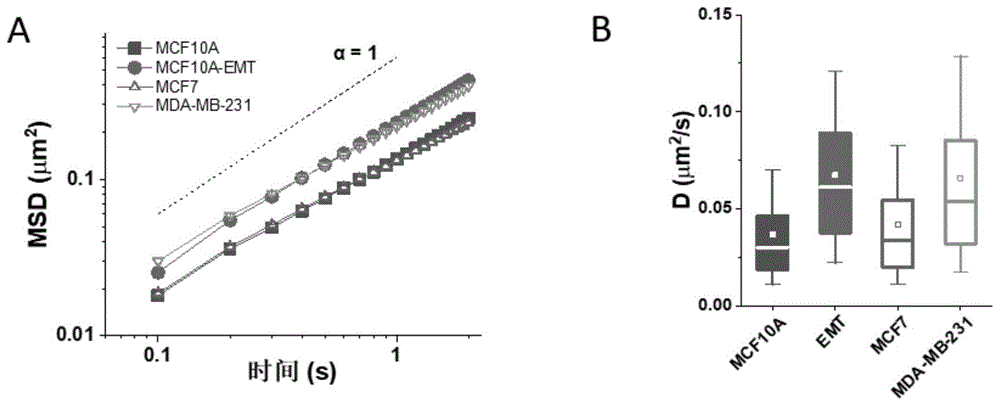
图3A显示E型细胞和M型细胞上整合素的平均MSD扩散曲线以及MCF7和MDA-MB-231细胞上整合素的平均MSD扩散曲线。
图3B显示由MSD扩散曲线得到的EMT诱导前后的MCF10A细胞、MCF7和MDA-MB-231细胞上整合素的扩散速度。
图4显示细胞上整合素扩散速度与细胞圆度的对应图以及这两者各自的分布图。
图5显示量子点标记的α5整合素的成像图。
图6A显示通过双通道成像系统对量子点标记的整合素和粘着斑内的talin蛋白进行荧光成像,得到两者荧光结合的图像。
图6B显示边缘处新生的talin蛋白的与量子点的相对光强。
图7显示Mn激活的量子点标记后的整合素的细胞固定轨迹的比例。
图8显示通过一抗以及带荧光蛋白的二抗标记整合素与通过本发明的方法标记整合素后,成像图的对比。
图9显示通过钙粘素实验研究细胞上皮-间质转化的钙粘素的成像图。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
实施例1
对无致癌性的MCF10A细胞进行EMT诱导,通过常用的方式加入TGF-β1,在37℃,5%CO
其中,通过以下公式计算圆度,当值越趋近1时,表示细胞越趋近圆形:
圆度=4π*面积/周长
实施例2
我们采用了量子点对β1-整合素进行标记实验。标记实验在冰上进行以暂停细胞的生理活动。先用带有单个生物素的单克隆抗体Anti-ITGB1(MEM-101)在冰上(约0℃)孵育细胞15min时间,以特异性结合细胞膜表面的β1整合素,用PBS洗净(三次)备用。将链霉亲和素-QD(655nm,Invitrogen)在50rpm下离心3分钟,吸取上层清液,加入上述结合一抗后的细胞中,在冰上(约0℃)孵育细胞5分钟以使其结合。洗去多余的QD后(PBS洗三次),在培养盒里(37℃,5%CO
结果如图2和图3所示。图2A显示了我们得到的量子点在单细胞表面上的荧光标记图,图2B显示了连续拍摄后得到的量子点-β1整合素1的扩散轨迹,提取这些轨迹的随时间的运动信息并进行分析。从整合素的扩散轨迹的均方位移(MSD)曲线以及扩散速度来看,M型细胞上整合素的扩散速度明显快于E型细胞。图3A显示M型细胞上整合素扩散的MSD曲线高于E型细胞,并且这两者的差异与我们用来验证的弱转移性癌细胞MCF7与强转移性癌细胞MDA-MB-231之间的差异一致。图3B显示由MSD曲线计算而得到的扩散运动速度。能更直观的看到E型(上皮)细胞与M型(间质)细胞上整合素的运动差异。平均扩散速度从0.037μm
实施例3
实验条件同实施例2,不同之处是将带有单个生物素的单克隆抗体换成抗α5整合素抗体。结果见图5。可以看出,用量子点标记的α5整合素从标记效果上来看,没有量子点标记的β1标记的多,原因是α5只能有一种整合素α5β1,但仍然可以很好的检测整合素的扩散运动轨迹。
实施例4
同时对β1整合素和粘着斑内的talin蛋白进行荧光成像。首先在培养皿的细胞培养液中加人GFP-talin放置培养箱过夜(12-18h)培养,之后用实施例2所述的方式用量子点标记整合素,对两者同时成像,用488nm的激光激发GFP-Talin,同时用561nm的激光激发量子点,可以得到两个通道的荧光图并将其结合(见图6)。通过长时间(2h)的荧光成像的视频观察到细胞的运动,并且能看到标记后的整合素到达细胞的最前缘,并且与最前缘新生的talin蛋白一起出现,这表示能够参与细胞爬行前端粘着斑的形成,这说明标记后的整合素依然可以实施整合素的功能,即与Talin蛋白共定位,参与粘着斑。
实施例5
用低转移性癌细胞MCF7和高转移性癌细胞MDA-MB-231进行验证。首先如实施例2所述,用量子点分别标记两种细胞上的整合素,然后进行荧光成像并进行分析,提取整合素扩散运动轨迹计算MSD值。结果如图3A和B所示,可以看出,MCF7细胞上整合素扩散的MSD曲线低于MDA-MB-231细胞,因而扩散速度也低于MDA-MB-231细胞。这表示MCF7上整合素的运动性弱于MDA-MB-231。这个实验验证了EMT上整合素的运动变化是真实的,这说明当细胞获得高侵袭性,或者强运动能力后,细胞膜上的整合素的扩散运动能力也会提高。因此,整合素的扩散运动与细胞的运动二者存在正相关的关系。
实施例6
已知Mn离子可以激活整合素,使整合素处于活性构象,此时整合素会被固定。因此可以用Mn来验证标记的整合素的功能。在荧光显微镜成像的时候,先对MCF10A细胞进行正常拍摄,后加入0.1mM的MnCl
对比例1
实验条件同实施例2,不同之处是先用一抗标记整合素后,洗去多余抗体,再与带绿色荧光蛋白Alex488(GFP)的二抗连接,然后利用488nm的激发光激发成像并进行分析。结果如图8所示,左图为该对比例的成像结果,右图为本发明的量子点标记整合素的成像结果。可以看出,荧光蛋白标记的整合素成像图(左图)不清楚,无法区分单个整合素,而本发明的量子点标记整合素成像图(右图)非常清晰,能够清晰地区分单个整合素,从而实现对单个整合素扩散轨迹的分析。
对比例2
室温下固定细胞1h(4%甲醛溶液),用PBS洗净后进行打孔10min(0.2%Triton X-100)。用PBS洗净后,加入1%BSA孵育1h,再加入抗E钙粘素单克隆抗体过夜孵育(12h,4℃)。第二天用PBS溶液洗净后加Alex488-抗小鼠IgG(1h,室温),再加入鬼笔环肽-594对肌动蛋白染色,之后用PBS洗净后成像,结果见图9。结果显示EMT后(右图)细胞与细胞之间边界的粘附蛋白—钙粘素减少。此方式虽然也可以分别E型细胞和M型细胞,但需要固定细胞,不能进行活细胞实验,并且用时很长,需要过夜(大于12小时),步骤繁琐,不适合快速分析细胞的状态。而本发明的方法在活细胞中进行,并且耗时通常在1小时以内,极大地提高了检测的效率。
- 间质型与间质上皮转化型循环肿瘤细胞检测试剂盒
- 上皮型与上皮间质转化型循环肿瘤细胞检测试剂盒
