一种裂解酶酶活性测定方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物技术领域,涉及一种能够有效检测裂解酶活性的方法及其应用。
背景技术
随着微生物病原体法的演化,以及抗生素药物的滥用,新型耐药机制正不断涌现,多种耐药菌和泛耐药菌的出现已成为21世纪主要的公共卫生威胁之一,严重危害了人们的生命健康安全。此外抗生素也逐渐暴露更多问题,如破坏有益菌群、破坏器官、产生免疫效应、过敏反应等。面对使用经典抗生素产生种种问题,人们迫切寻求一种可替代的治疗方案,而近年来各种来源的胞壁裂解酶走入了人们的视野。这类裂解酶具有降解肽聚糖的潜力,在外源添加时可作为有效的抗菌剂。
天然裂解酶往往具有高度的宿主特异性和强烈的裂解活性,能破坏细菌生物膜,而且具备绿色安全、不易产生耐药等优势。同时,裂解酶具有无限研究潜力,运用蛋白质工程技术、合成生物学技术将其重组改造,可增强其裂解活性、提高稳定性以及靶向性,这使其在成为新型抗菌药物方面拥有广阔的前景,而且做为大分子蛋白,法规监管路径也很清晰。裂解酶的优势主要在以下三点:
(1)不易引起细菌耐药性:裂解酶的结合结构域针对特定菌体的细胞壁,能够特异性识别并杀死菌体,使其很难产生耐受性。
(2)作用快、可穿透生物膜:裂解酶在体外与菌体接触的瞬间迅速破裂细胞,可使菌体浊度迅速下降,引起吸光值降低。
(3)不破坏有益细菌和生物菌群:研究发现,裂解酶反应时不会对人体的正常菌群产生影响,而抗生素在杀死病原菌的同时,却损伤了部分正常菌群。
目前主流的裂解酶活性测定主要靠抑菌试验完成。根据其应用场景不同,抑菌实验分成诸多种类,如基于生长菌落个数的涂布平板法、倾注平板法、预加菌液倾注平板法,以及基于抑菌圈大小的平板打孔法、滤纸片法(又称K-B法,Kirby-Bauer test)、牛津杯法等。
基于生长菌落个数的三种方法
①涂布平板法:将裂解酶与菌液混合孵育,倒在凝固的固体培养基上均匀涂开;
②倾注平板法:先往已灭菌的平板中接种混合孵育后的裂解酶与菌液,然后倾注已冷却至50 ℃左右的平板培养基,混合均匀,水平静置凝固后放入培养箱培养;
③预加菌液倾注平板法:往已冷却至50℃左右的平板培养基中注入一定量的混合孵育后的裂解酶与菌液,混合均匀,倾注平板,水平静置凝固后放入培养箱培养。
基于抑菌圈大小的三种方法
①平板打孔法:是指用已灭菌的打孔器或钢管在平板上打孔,往孔中注入一定量的待测样品,培养一段时间后测定抑菌圈大小;
②滤纸片法:选用质地均匀的滤纸,用打孔机打成直径相同的圆片,灭菌后烘干,浸泡于待测样品中,然后置于试验平板中培养一段时间后测定抑菌圈大小;
③牛津杯法:又称杯碟法,将已灭菌的牛津杯置于试验平板中,往杯中注入一定量的待测样品,培养一段时间后测定抑菌圈大小。
以上几种方法实验效果直观,但也存在诸多缺点。
首先,以上方法对于抑菌活性低的裂解酶难以分辨,如抑菌圈大小、平板法菌落个数变化难以测量,且可能在误差范围内;而裂解酶活性显著时,平板法生长菌落数量过低甚至无菌落生长,难以检测区分酶的活性差异;
其次,实验重复性差,不易定量,存在误差。平板法的菌落生长状态极易受到外界因素影响,如培养基倾倒不易定量、无法控制冷却时间,甚至部分菌体在未完全冷却的培养基倾倒过程中失活,涂布不均匀的情况下菌体生长也会受到很大影响,而抑菌圈法中滤纸片难以对酶进行定量,牛津杯以及打孔法也要考虑渗透因素、快速点样等;
在进行大量实验时成本高、周期长。不论是平板法还是抑菌圈法,完成整体流程也需要三天时间(底物菌种培养、混合孵育抑菌、平板培养),且在进行大规模筛选时实验操作耗费大量时间成本,且检测数据难以统计分析。
此外,国标GB/T30990-2014溶菌酶活性检测方法也是一种应用广泛的抑菌方案,然而其使用底物为溶壁微球菌,对菌种特异性的裂解酶并不适用。
发明内容
考虑到目前现有技术缺陷,本发明旨在开发一种基于比浊法原理的裂解酶活性快速测定方法。该方法具有准确快速且通量高、可重复性好、数据稳定线性等诸多优点,为裂解酶活性测定提供了切实可行的方案。
本发明提供一种能够有效检测裂解酶活性的方法,包括如下步骤:
第一步,将培养已过对数生长期的特异性底物菌离心,收集菌体,使用0.1M 磷酸盐缓冲液重悬;
第二步,将底物菌悬浊液加入测定板,使用酶标仪测量菌体吸光值,将其稀释至OD450nm=0.8~1.1;
第三步,将底物菌与裂解酶以15-25:1的比例混合加入多孔板,间隔测定吸光值,观察吸光值变化量;
第四步,计算裂解酶活性。
具体地,所述特异性底物菌包括但不限于金黄色葡萄球菌、大肠杆菌、产气荚膜菌,所述裂解酶包括但不限于金黄色葡萄球菌裂解酶(包括但不限于Lysostaphin、CF301、P128、lysK)、大肠杆菌裂解酶(如lysAB2)、产气荚膜菌裂解酶(如cps2);优选地,所述特异性底物菌培养已过对数生长期是指培养14-18h,优选为15-17h。
优选实施方式中,第三步中所述裂解酶的浓度稀释至0.2-0.6mg/mL,优选为0.4mg/mL。
进一步优选地,第三步中,底物菌与裂解酶以18-20:1的比例混合加入多孔板。
具体地,所述测定板是多孔板,例如48孔板、64孔板、96孔板、128孔板。
优选地,第四步中间隔测定吸光值每15s测一次吸光值,且观察10min内吸光值变化量。
具体实施方式中,其中用0.1M磷酸盐缓冲液作为空白对照。
优选地,第三步中间隔测定吸光值是在室温下进行,例如25℃室温下进行。
在一个实施方式中,第四步中计算裂解酶活性的方法如下:
一个裂解酶活力单位定义为25℃,pH7.5条件下,使用特异性底物菌悬浊液在450nm处每分钟引起吸光值变化为0.001所需裂解酶的量;则裂解酶活性X,按下式计算:
式中:
A1:试样在450nm处反应1min时的吸光度
A2:试样在450nm处反应n min时的吸光度
A0:空白对照在450nm处反应n min - 1 min的吸光度变化,及菌体自然沉降
t:反应时长,值为n-1
0.01:样品添加量10μL
0.001:由单位裂解酶每分钟引起的吸光度降低的值。
本发明通过研究和分析获得的一种稳定、快速、高效的裂解酶活性测定方法,所得数据具有良好的线性关系。且本发明评估了不同裂解酶样品,进行裂解酶活性测定,该方法均可以成功检测并计算裂解酶活性。因此,本发明提供了一种快速、稳定的裂解酶活性检测方法,从测量波长、测量总时长与时间间隔、底物菌培养条件、底物菌悬浊液初始吸光值、反应缓冲液、酶与底物添加比例等不同条件评估,发现了具有线性优势的裂解酶活性测定方法,提高了检测方法的高效性、稳定性,增加了现有裂解酶检测方法的多样性。可根据裂解酶不同的应用场景选择对应底物菌种进行酶活性测定,拓宽了应用场景。
附图说明
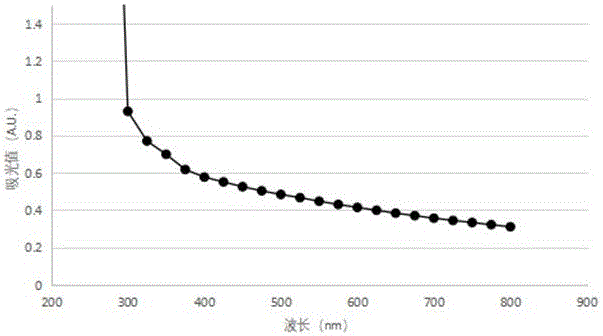
图1 底物菌悬浊液全波长扫描结果。
图2 稀释不同倍数的底物菌悬浊液在450nm与600nm下吸光值。
图3 稀释不同初始OD的底物菌悬浊液前5min反应情况。
图4 用0.1M 磷酸盐缓冲液稀释成不同初始OD的底物菌悬浊液前5min反应情况。
图5 稀释不同倍数的胞壁裂解酶与底物悬浊液混合10min反应情况。
图6 培养不同时长的底物菌悬浊液自然沉降情况。
图7 胞壁裂解酶反应情况。
具体实施方式
实施例1
全波长扫描菌体悬浊液确定测量波长
添加适量20mM Tris-HCl -150mMNaCl缓冲液调整金黄色葡萄球菌胞壁裂解酶的特异性底物金黄色葡萄球菌悬浊液浓度,分别稀释至其母液浓度的1/2、1/4、1/6、1/8、1/10。
调整酶标仪测量波长范围,选择通用波长范围250-800nm,每25nm测一次,对不同浓度底物悬浊液进行全波长扫描。
根据扫描结果(图1),发现随着波长升高,底物悬浊液吸光值数值下降,在350nm及以下测量数值超出量程,400nm以下数值不成线性变化。考虑到450nm以下蛋白质、芳香族化合物以及细胞器裂解,对比不同浓度的菌体,发现在450nm处和600nm处菌体吸光值呈规则线性(图2),方差小,由于450nm吸光值变化区间大于600nm,数据更加直观,能够捕捉更细微的变化,故实验选用450nm处进行实验。
实施例2
反应体系的确定
孔板内添加总量控制在200μL,由于酶促反应过程中酶浓度不宜过高、底物浓度不宜过低,两者混合比例应在1:9及以下。实验中发现裂解酶样品活性过高造成数值变化过快且不稳定,此外虽然该裂解酶与底物的溶解缓冲液相同,但考虑到普遍适用性,部分裂解酶有其特定缓冲液,应将酶添加量下调以保证反应体系稳定。因此将酶与底物比例定为1:19。裂解酶实际添加量为10μL,该数值也便于排枪添加,过低易造成实验误差。
向底物悬浊液中加入裂解酶后迅速开始测量,发现前30-60s数据会有所波动,其中高浓度裂解酶更为明显;60s以后吸光值呈线性趋势降低,低浓度裂解酶曲线较平缓。考虑到不同裂解酶酶活性的差异,故选择5-10min作为优选测量总时长,间隔定为15s。
在调整酶与底物添加比例的同时,也需要对底物初始浓度进行优化。向稀释成不同初始吸光值(包括但不限于OD
实施例3
优化缓冲溶液以及底物悬浊液初始OD
由于在实验过程中发现,尽管底物悬浊液自身吸光值变化较小,但在添加裂解酶反应的过程中经常出现数值波动的现象,如图3中在1~2min内出现的“平台期”。考虑到裂解酶在裂解菌体胞壁时可能影响了体系pH变化、粘稠度增加等,因此调整反应缓冲液进行实验。
使用实验常见缓冲液作为反应缓冲液溶解底物菌进行裂解酶活性测定,包括20mMTris-HCl 150mM NaCl缓冲液、20mM磷酸盐 150mM NaCl缓冲液与0.1M磷酸盐缓冲液。最终发现0.1M磷酸盐缓冲液作为反应缓冲液的数据呈明显线性关系,前5min反应情况如图4,其反应曲线R
考虑到换用0.1M磷酸盐缓冲液可能对反应初始体系产生一定影响,且之前底物初始浓度范围过广,因此我们对底物初始浓度进行进一步优化。向稀释成不同初始吸光值(包括但不限于OD
进一步对裂解酶的反应浓度进行优化,将母液浓度为1.6mg/mL的胞壁裂解酶用蛋白溶解缓冲液20mM Tris-HCl -150mMNaCl缓冲液稀释0.5、0.25、0.1、0.0625、0.05倍,与底物悬浊液混合反应后发现稀释0.25倍的线性最好,因此后续对该酶测量时的酶反应浓度选为0.4mg/mL,计算得出其酶活力在820U,其他裂解酶也可以参照该酶活力进行检测。
实施例4 底物菌培养时长的优化
在实验过程中发现,有时空白对照的底物悬浊液吸光值会有较大波动,考虑到可能与底物菌培养时长有关,进行了如下实验。
将底物菌在LB液体培养基中分别培养3、6、16h,分别添加0.1M磷酸盐缓冲液观察其10min内自然沉降的情况(图6),并添加裂解酶进行反应观察。发现培养3h与6h的底物菌反应波动较大,可能是由于菌体还在生长期,反应不稳定。而培养16h的菌体反应数据波动较小,数值浮动在10
实施例5 结合具体案例进行描述
根据上述发明优化的裂解酶活性检测方法,进行了实验验证,具体操作如下:
材料与用品
(1)试剂
0.1M 磷酸盐缓冲液:由磷酸二氢钠与磷酸氢二钠混合制成,调至pH为7.5,存于容量瓶,常温保存。具体剂量为称取甲液71.64g Na
20mM Tris-HCl -150mMNaCl缓冲液:由Tris-HCl添加氯化钠制成,调至pH为7.5,存于容量瓶,常温保存。具体剂量为20mL Tris-HCl、8.76g NaCl,定容至1L水中,调至pH为7.5;
LB液体培养基:由酵母提取物、胰蛋白胨与氯化钠混合制备,灭菌后放凉至室温存放。具体剂量为酵母提取物5g、胰蛋白胨10g、NaCl 10g,定容至1L水中,使用高压灭菌锅121℃灭菌20min。
(2)仪器
酶标仪、台式离心机、涡旋混合仪、移液器、恒温培养摇床
2、实验步骤
(1)对于底物菌的处理方式,具体操作如下:
①挑金黄色球菌单菌落或取适量甘油菌于5mL LB液体培养基中,37℃恒温培养16h,使其细胞个数约10
②取适量菌液于ep管中离心5000rpm 5min收集菌体,去上清,加入等比例0.1M磷酸盐缓冲液重悬;
③以0.1M磷酸盐缓冲液为对照,分别取200μL 0.1M磷酸盐缓冲液与菌体悬浊液加入96孔板,使用酶标仪测定底物吸光值,调整悬浊液浓度,使其于450nm处读数稳定在0.8-1.1之间,最终菌体悬浊液吸光值为1.0739,符合标准。
(2)待测裂解酶样品的准备
取20μL具有金黄色葡萄菌裂解活性的不同类别的裂解酶样品裂解酶Lysostaphin、P128、CF301与20μL溶解裂解酶的20mM Tris-HCl -150mMNaCl缓冲液于PCR连管中,静置备用。
(3)裂解酶活性测定
25℃室温下,吸取190μL底物悬浊液于孔板,用排枪吸取10μL溶解缓冲液、待测裂解酶A、B、C分别加入底物中,充分混合。
使用酶标仪记录10min吸光值变化,每15s测定一次吸光度值。
(4)裂解酶活性计算
一个裂解酶活力单位定义为25℃,pH7.5条件下,使用底物菌悬浊液在450nm处每分钟引起吸光值变化为0.001所需裂解酶的量。
酶活力X,按下式计算:
式中:
A1:试样在450nm处反应1min时的吸光度
A2:试样在450nm处反应n min时的吸光度
A0:空白对照在450nm处反应n min - 1 min的吸光度变化,及菌体自然沉降
t:反应时长,值为n-1
0.01:样品添加量10μL
0.001:由单位lysin每分钟引起的吸光度降低的值
测量误差:10
以缓冲液为空白对照,观察裂解酶吸光值下降趋势。空白对照在第1min吸光度值为1.0628,第10min吸光度值为1.0617,吸光值变化量为0.0011,其值远小于10
最终计算得出裂解酶Lysostaphin酶活力为1970U,裂解酶CF301酶活力为444.4U,裂解酶P128酶活力为1288.9U。
- 一种产单宁酶假丝酵母菌的筛选及其酶活性测定方法
- 一种腺苷脱氨酶活性测定方法及腺苷脱氨酶检测试剂盒
- 一种5`-核苷酸酶活性测定方法及5`-核苷酸酶检测试剂盒
- 一种平板培养基酶活性测定方法
- 一种甲硫氨酸γ-裂解酶酶活性的检测方法
- 一种新酶源的醇腈裂解酶催化合成光学活性氰醇化合物的方法
