一种超级增强子驱动的脂代谢相关长链非编码RNA及其在制备肝细胞癌治疗试剂盒中应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及肿瘤分子生物学与代谢领域,尤其涉及一种超级增强子驱动的脂代谢相关长链非编码RNA及其在制备肝细胞癌治疗试剂盒中应用。
背景技术
肝癌是最常见的癌症之一,最新的CA统计数据显示每年新增病例约906,000例,相关死亡病例约830,000例。肝癌是全球第六大最常见的癌症,也是癌症相关死亡的第三大原因。预计到2025年,肝癌的发病率将超过100万,给全球健康带来非常严峻的挑战。肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌类型,约占所有肝癌病例的90%。引起HCC的因素很多,主要包括乙型或丙型肝炎病毒感染、非酒精性脂肪性肝炎、过量饮酒、2型糖尿病和吸烟等。虽然随着医学的进步,肝癌的治疗效果有所提高,如美国食品药品监督管理局批准了几种口服酪氨酸激酶抑制剂治疗晚期肝癌,但治疗效果仍然有限,并且HCC患者的五年生存率依然很低。此外,HCC的病理发展是一个复杂的多步骤过程。我们之前的研究证实,HCCL5通过上皮间质转化促进HCC肿瘤的进展。迫切需要进一步研究HCC的发病机制和治疗靶点。
调节肿瘤进展的方法有很多,代谢变化是重要的调节因素。脂质代谢失调是癌症中最突出的代谢表型之一。增加的脂质合成或摄取可促进癌细胞的快速生长并诱导肿瘤形成。在结直肠腺癌、乳腺癌和食管腺癌中,肿瘤细胞中脂肪酸(fatty acid,FA)或脂质含量的增加会加剧肿瘤进展。脂质是疏水分子,主要包括甾醇、甘油单酯、甘油二酯、甘油三酯、磷脂和糖脂。许多脂质来源于FA,可根据其长度(碳原子数)和饱和度(双键数)进行分类。FA可以通过从头生物合成产生。通过限制FA在肿瘤中的使用,可以控制肿瘤生长以遏制肿瘤进展。此外,FA代谢在HCC中是必不可少的。具体而言,肿瘤细胞通过促进FA合成或抑制FA氧化来增加FA积累进而促进HCC的发生发展。相反,FA代谢的抑制限制了HCC的增殖和生长。然而,关于HCC中与FA代谢调控相关的表观基因组调控网络的知识是有限的,需要进一步的研究来阐明这个网络。
虽然只有不到2%的人类基因组编码蛋白质,但基因组中的大多数核苷酸都可以被转录,从而产生大量的非编码RNA转录物。这类RNA包括长非编码RNA(long noncodingRNA,lncRNA),它们是长度超过200个核苷酸的转录本。与mRNA类似,lncRNA由RNA聚合酶II转录,这种转录活性可以受顺式作用元件(包括增强子和超级增强子)和反式作用因子(包括转录因子)的调节。肿瘤中lncRNA表达的调控是微妙而复杂的,lncRNA通过与DNA、蛋白质和mRNA等生物大分子相互作用参与许多关键的癌症表型,从而在肿瘤的发生发展中发挥调控作用。但与mRNAs相比,lncRNAs的表达量相对较低,生物发生形式多样,结构特征复杂,非编码特征,普遍缺乏保守性;因此,大多数lncRNA功能尚未被研究。此外,包括超增强子在内的lncRNA的特定表观基因组调控网络在很大程度上并不清楚。
发明内容
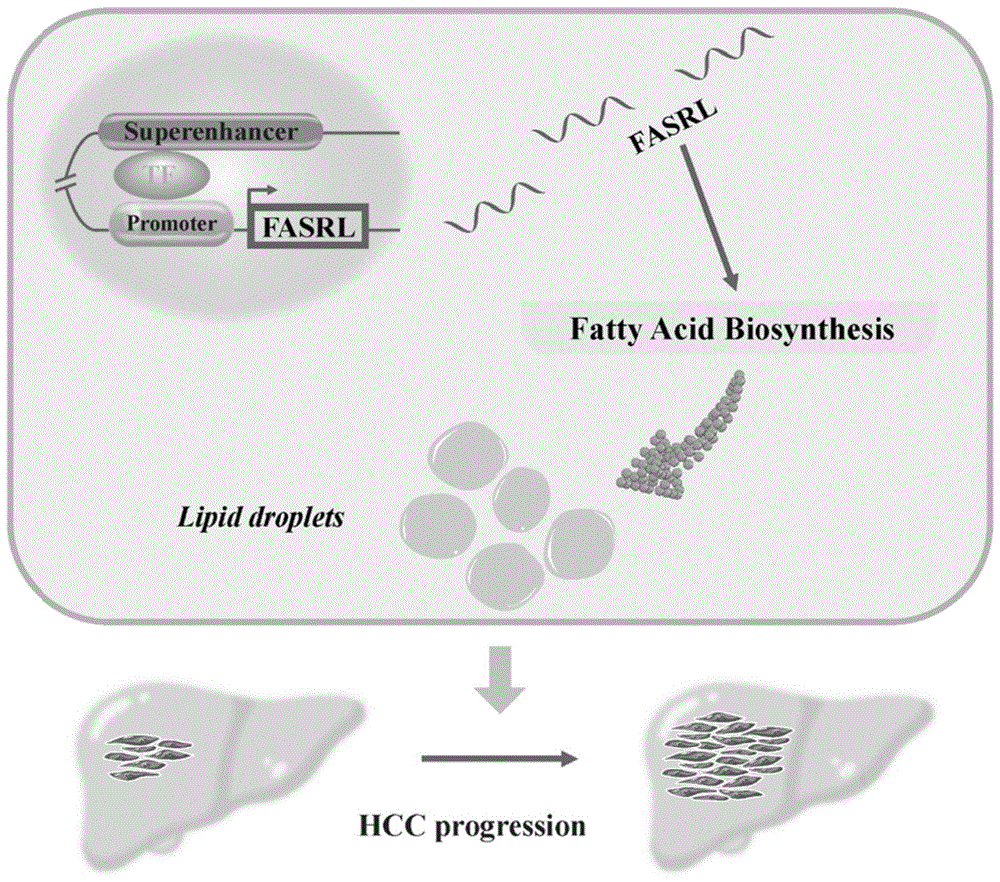
本发明提供了一种超级增强子驱动的脂代谢相关长链非编码RNA及其在制备肝细胞癌治疗试剂盒中应用,该lncRNA为肝细胞癌特异性超级增强子驱动的脂代谢相关lncRNA,具有促进肝细胞癌脂肪酸合成和恶性进程的功能,超级增强子可通过转录驱动该lncRNA的表达,从而促进肝细胞癌脂代谢及细胞恶性增殖。
为了解决上述技术问题,本发明目的之一提供了一种超级增强子驱动的脂代谢相关长链非编码RNA,所述长链非编码RNA为FASRL,其核苷酸序列如SEQ ID NO:1所示,或其DNA全长序列如SEQ ID NO:2所示。
申请人发现FASRL(fatty acid synthesis-related lncRNA,脂肪酸合成相关lncRNA)具有一定促进脂肪酸合成和癌症进程的作用,超级增强子通过转录驱动FASRL的表达,从而促进肝细胞癌的脂代谢和细胞增殖,进而加速癌症的进展和严重程度。
为了解决上述技术问题,本发明目的之二提供了一种FASRL作为分子标记物在制备肝细胞癌治疗、诊断或预后预测试剂盒中的应用。
作为优选方案,所述FASRL的过表达载体或重组子包含有SEQ ID NO:1、SEQ IDNO:2或SEQ ID NO:3所述的序列。为方便正向研究超级增强子驱动的脂肪酸合成相关长链非编码RNA,该FASRL过表达载体如序列表中SEQ ID No.3所示。
为了解决上述技术问题,本发明目的之三提供了一种肝细胞癌诊断或预后预测试剂盒,包括用于检测所述FASRL表达量的试剂。由于FASRL在肝癌细胞中高表达,在正常组织中低表达,因此,可通过检测其表达含量从而诊断检测对象是否患有肝细胞癌。
作为优选方案,所述检测FASRL表达量的试剂包括对FASRL具有特异性的标记物,所述标记物包括FASRL的引物组、荧光标记的FASRL的探针组或结合FASRL的化合物。
作为优选方案,所述检测FASRL表达量的试剂包括扩增引物,扩增正向引物序列如SEQ ID NO:24所示,扩增反向引物序列如SEQ ID NO:25所示。
为了解决上述技术问题,本发明目的之四提供了一种肝细胞癌治疗试剂盒,包括用于抑制或沉默所述FASRL表达量的试剂。经实验证实通过抑制肝癌细胞中FASRL的表达量可抑制肝癌细胞HepG2和LM3的增殖和迁移,以及加速肝癌细胞的凋亡;因此,抑制FASRL的表达量的试剂有望治疗肝细胞癌。
作为优选方案,所述抑制或沉默FASRL表达量的试剂为抑制FASRL的siRNA,所述siRNA的核心序列如SEQ ID NO:4-5、SEQ ID NO:6-7、SEQ ID NO:8-9、SEQ ID NO:10-11或SEQ ID NO:12-13所示。
作为优选方案,所述抑制或沉默FASRL表达量的试剂为抑制FASRL的siRNA,所述siRNA的核心序列如SEQ ID NO:14-15、SEQ ID NO:16-17、SEQ ID NO:18-19、SEQ ID NO:20-21或SEQ ID NO:22-23所示。
通过本申请针对FASRL设计的siRNAs能沉默FASRL的表达,从而降低FASRL的表达量;进一步地,为了增加其稳定性,在siRNAs序列中加了TT。
作为优选方案,所述抑制或沉默FASRL表达量的试剂为抑制FASRL的短发夹片段shRNA,所述短发夹片段shRNA的核心序列如SEQ ID NO:26或EQ ID NO:27所示。
相比于现有技术,本发明具有如下有益效果:
本申请首次发现了一个超级增强子驱动的脂肪酸合成相关长链非编码RNA基因,命名为FASRL,并通过实验证明该基因与肝细胞癌的异常脂代谢及恶性程度有关,该基因具有肝细胞癌基因治疗的用途;本申请还提供了该基因的siRNAs靶序列,具有抑制该基因表达的能力,具有肝细胞癌的基因治疗的用途。
附图说明
图1为实施例一在HCC中发现的超级增强子相关新lncRNA FASRL;图1A:Hockeystick图显示正常肝脏中的超级增强子相关lncRNAs;图1B:Hockey stick图显示HepG2细胞系中的超级增强子相关lncRNAs;图1C:Hockey stick图显示Huh7细胞系中的超级增强子相关lncRNAs;图1D:Hockey stick图显示PLC细胞系中的超级增强子相关lncRNAs;图1E:Hockey stick图显示LM3细胞系中的超级增强子相关lncRNAs;图1F:H3K27ac在正常肝脏、HepG2、Huh7、PLC和LM3细胞系中的ChIP-seq图谱,根据USF1和H3K27ac峰在HepG2 rep1-2细胞系中的超级增强子区域从左往右的峰分别划分为E1-E5和NC,NC和E1-E5分别代表阴性对照(negative control,NC)序列和5个增强子序列的基因组位置,蓝色箭头表示FASRL的转录方向;图1G:ChIA-PET数据分析揭示了染色质上超级增强子和FASRL启动子之间的空间相互作用;图1H:双荧光素酶报告基因实验显示NC和E1-E5在HepG2细胞系中的转录活性;图1I:双荧光素酶报告基因实验显示NC和E1-E5在LM3细胞系中的转录活性;***,p<0.001。
图2为实施例二中FASRL过表达对HCC细胞系增殖和迁移的影响;图2A:FARSL在HepG2细胞系中的过表达效果;图2B:FARSL在LM3细胞系中的过表达效果;图2C:CCK-8实验显示FARSL过表达对HCC细胞系HepG2生长的影响;图2D:CCK-8实验显示FARSL过表达对HCC细胞系LM3生长的影响;图2E:EdU实验检测显示FARSL过表达对HepG2细胞系DNA合成情况的影响,DNA合成情况反映细胞增殖能力;图2F:EdU实验检测显示FARSL过表达对LM3细胞系DNA合成情况的影响,DNA合成情况反映细胞增殖能力;图2G:Transwell实验测定FARSL过表达对HepG2细胞系迁移能力的影响;图2H:Transwell实验测定FARSL过表达对LM3细胞系迁移能力的影响;*,p<0.05;***,p<0.001。
图3为实施例三中siRNAs靶向HCC细胞中FASRL的干扰效果;图3A:5种不同siRNAs序列特异性靶向FASRL对HepG2细胞系中FASRL表达的影响;图3B:5种不同siRNAs序列特异性靶向FASRL对LM3细胞系中FASRL表达的影响;**,p<0.01;***,p<0.001。
图4为实施例四中FASRL敲低在体外抑制HCC的恶性进展;图4A:CCK-8实验分析显示分别转染siFASRL#1、siFASRL#5和siNC的HepG2细胞系的生长;图4B:CCK-8实验分析显示分别转染siFASRL#1、siFASRL#5和siNC的LM3细胞系的生长;图4C:EdU实验检测显示用siFASRL#1、siFASRL#5和siNC转染的HepG2细胞系增殖的代表性图像;图4D:EdU实验检测显示用siFASRL#1、siFASRL#5和siNC转染的LM3细胞系增殖的代表性图像;图4E、F:来自图4C和D中EdU实验的定量统计结果;图4G:Transwell实验显示转染siFASRL#1、siFASRL#5和siNC的HepG2细胞系的迁移能力;图4H:Transwell实验显示转染siFASRL#1、siFASRL#5和siNC的LM3细胞系的迁移能力;图4I:左,流式细胞仪检测转染siFASRL#1、siFASRL#5和siNC的HepG2细胞系的凋亡;右,相应的凋亡细胞的统计结果;**,p<0.01;***,p<0.001。
图5为实施例六中shRNA介导的FASRL敲低对体外HCC进展的影响;图5A:qRT-PCR检测稳定转染shFASRL#1、shFASRL#5及其对照shNC的HepG2细胞系中FASRL的表达;图5B:qRT-PCR检测稳定转染shFASRL#1、shFASRL#5及其对照shNC的LM3细胞系中FASRL的表达;图5C:CCK-8实验测定稳定转染shFASRL#5及其对照shNC的HepG2细胞系的生长曲线;图5D:CCK-8实验测定稳定转染shFASRL#5及其对照shNC的LM3细胞系的生长曲线;图5E:Transwell实验测定法检测稳定转染shFASRL#5及其对照shNC的HepG2细胞系的细胞迁移能力;图5F:图5E中结果的相应统计结果;图5G:Transwell实验测定法检测稳定转染shFASRL#5及其对照shNC的LM3细胞系的细胞迁移能力;图5H:图5G图中结果的相应统计结果;**,p<0.01;***,p<0.001。
图6为实施例七中FASRL敲低缓解体内HCC的进展;图6A:显示稳定转染shFASRL及其对照shNC的HCC细胞系HepG2的异种移植肿瘤代表性图像;图6B:显示稳定转染shFASRL及其对照shNC的HCC细胞系LM3的异种移植肿瘤代表性图像;图6C:来自稳定转染shFASRL和shNC的HCC细胞系HepG2的异种移植肿瘤生长曲线;图6D:来自稳定转染shFASRL和shNC的HCC细胞系LM3的异种移植肿瘤生长曲线;图6E:来自稳定转染shFASRL和shNC的HCC细胞系HepG2的异种移植肿瘤重量;图6F:来自稳定转染shFASRL和shNC的HCC细胞系LM3的异种移植肿瘤重量;*,p<0.05;***,p<0.001。
图7为实施例八中FASRL敲低抑制体内外HCC的脂质积累;图7A:用shFASRL及其对照shNC稳定转染的HepG2细胞系中的带有
图8为实施例九中FASRL敲低对HCC裸鼠存活的影响;图8A:来自HepG2细胞系异种移植肿瘤的shFASRL组及其对照shNC组小鼠的Kaplan-Meier存活曲线;图8B:来自LM3细胞系异种移植肿瘤的shFASRL组及其对照shNC组小鼠的Kaplan-Meier存活曲线。
图9为实施例十中FASRL的表达增加且其高表达与HCC患者的不良预后相关;图9A:在TCGA数据集中,FASRL在HCC样本和正常肝脏样本中的表达;图9B:在TCGA数据集中,FASRL在HCC样本及其配对正常样本中的表达;图9C:在TCGA数据集中,FASRL高低表达的HCC患者的预后;图9D:基于我们的发现集,FASRL在HCC样本和正常肝脏样本中的表达;图9E:基于我们的发现集,高和低FASRL表达的HCC患者的预后;图9F:基于我们的验证集,FASRL在HCC样本和正常肝脏样本中的表达;图9G:基于我们的验证集,高和低FASRL表达的HCC患者的预后。
图10为本申请的关键内容总结图;本发明公开了一种长链非编码RNA(lncRNA)FASRL,超级增强子可通过转录驱动该lncRNA的表达,从而促进肝细胞癌脂肪酸合成,进而促进其脂代谢及肝细胞癌的进展。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本申请提供一种长链非编码RNA(long noncoding RNA,lncRNA),该lncRNA为肝细胞癌特异性超级增强子驱动的脂代谢相关lncRNA,将其命名为FASRL(即fatty acidsynthesis-related lncRNA,也称脂肪酸合成相关lncRNA),具有促进肝细胞癌脂肪酸合成和恶性进程的功能,超级增强子可通过转录驱动FASRL的表达,从而促进肝细胞癌脂代谢及细胞恶性增殖,以下结合具体实施例的实验和结果进行机理分析。
实施例一:验证超级增强子驱动lncRNA FASRL的表达
(1)ChIP-seq鉴定FASRL附近存在超级增强子:使用染色质免疫共沉淀(Chromatinimmunoprecipitation sequencing,ChIP-seq)检测超级增强子的组蛋白标记物H3K27ac,发现肝细胞癌特异性超级增强子驱动的、且在正常肝组织不受超级增强子调控的一些已知和新的lncRNAs(图1A-E);从这些超级增强子驱动的lncRNAs中,进一步筛选到与脂肪酸合成相关的lncRNA FASRL存在一个超级增强子信号(图1F),且该超级增强子可能受到转录因子USF1的调控。
(2)ChIA-PET发现FASRL的超级增强子与其启动子之间相互作用:挖掘ENCODE数据库中肝癌细胞HepG2的ChIA-PET数据,发现FASRL的超级增强子与其启动子之间存在直接的相互作用(图1G)。
(3)双荧光素酶报告基因实验鉴定FASRL的超增强子活性:将图1F中超增强子区域从左往右的五个峰依次划分成五个组成性增强子(E1-E5),分别将其克隆到荧光素酶报告载体pGL3-promoter上,双荧光素酶报告基因实验分别检测HepG2和LM3细胞中的这五个增强子元件的荧光素酶活性(图1H、I),结果显示,E4的活性最强。(用于本项目的HepG2细胞购买于青旗(上海)生物技术发展有限公司,LM3细胞购买于上海富衡生物科技有限公司。)
实施例二:验证FASRL基因真核过表达载体的构建及其对肝癌细胞的影响
(1)FASRL基因真核过表达载体的构建:
使用UCSC比对出FASRL的RNA序列全长(序列表中SEQ ID NO.1)及其对应的DNA序列全长(序列表中SEQ ID NO.2)设计酶切位点,基因合成FASRL基因的全长与酶切位点,所得片段连接至pcDNA3.1(+)真核表达载体,获得的重组质粒(序列表中SEQ ID NO.3),经DNA测序进行确定,结果显示重组质粒正确,可以用于后续研究;
将成功构建的FASRL过表达载体及其对照载体转染至生长状态良好的肝癌细胞HepG2和LM3,HepG2和LM3细胞接种于24孔板中,置于37℃,5% CO
(2)CCK-8实验检测FASRL过表达对肝癌细胞增殖的影响:取对数生长期的过表达FASRL及其对照组的肝细胞癌HepG2细胞1500个和LM3细胞2500个分别加入96孔板中,1%血清的完全培养基培养,每孔加入10μL CCK-8溶液,孵育2h后测定450nm处的各孔吸光度,分别于第1、3、5天进行检测,分别进行统计分析;通过CCK-8实验分析发现FASRL过表达促进肝癌细胞HepG2和LM3的增殖速度(图2C、D)。
(3)EdU实验检测FASRL过表达对肝癌细胞增殖的影响:取FASRL过表达及其对照组的肝细胞癌HepG2和LM3细胞分别种入96孔板中,培养48小时以内,加入含1‰EdU的完全培养基,37℃孵育2小时,然后使用EdU试剂盒分别对EdU阳性细胞和细胞核进行染色,荧光显微镜进行随机拍照,计数每个视野的EdU阳性细胞和细胞核的数量以进行统计分析;通过EdU实验分析发现FASRL过表达显著升高肝癌细胞HepG2和LM3的增殖细胞比例,表明FASRL的过表达能促进肝癌细胞增殖(图2E、F)。
(4)Transwell实验检测FASRL过表达对肝癌细胞迁移的影响:取对数生长期的过表达FASRL的肝细胞癌HepG2和LM3细胞分别悬浮于200μL无血清培养基中,加至Transwell小室的上室中,下室24孔板每孔加入500μL的含有20%血清的完全培养基,连续培养24小时后染色观察细胞穿过Transwell小室的情况;通过Transwell实验明确显示FASRL过表达后肝癌细胞的转移能力明显增强(图2G、H)。
该实施例数据显示,FASRL过表达的增加促进了肿瘤的恶性程度,有作为临床诊断辅助指标的应用前景。
实施例三:FASRL的RNA干扰靶点序列设计
根据FASRL的序列,应用RNAi设计软件,寻找该FASRL的最佳靶点,得到5个最佳干扰靶点序列(序列表中SEQ ID NO.4-13),实际合成siRNA序列时,为了增加其稳定性,在干扰靶点序列后边加了TT(序列表中SEQ ID NO.14-23)见表1。
表1-FASRL的siRNA靶序列对应的序列表序号
按照以上靶点合成siRNA,使用转染试剂转染至肝癌细胞系HepG2和LM3细胞,设计FASRL的引物(表2),qPCR筛选有效的干扰靶点,最后确认siRNA#1、siRNA#4和siRNA#5均为有效干扰位点(图3A、B),该发明选择siRNA#1和siRNA#5用于进一步的实验研究。
表2-FASRL的引物序列对应的序列表序号
实施例四:验证siRNA介导的FASRL表达抑制对肝癌细胞的影响
将合成的FASRL的siRNA转染至生长状态良好的肝癌细胞HepG2和LM3,将HepG2和LM3细胞分别接种于六孔板中,细胞培养箱中,过夜培养细胞生长至30%融合度即可开始转染,实验使用商业化的转染试剂RNAimax按照标准的说明书进行转染。
(1)CCK-8实验检测siRNA介导的FASRL干扰对肝癌细胞生长的影响:取转染有siFASRL#1、siFASRL#5及其阴性对照siNC的肝细胞癌HepG2和LM3细胞分别种入96孔板中,使用含有1%血清的完全培养基培养,每孔加入10μL CCK-8溶液,孵育2h后测定450nm处的各孔吸光度,分别检测第1、3、5天,并进行统计;CCK-8实验分析发现可通过siRNA介导的抑制FASRL的表达降低肝癌细胞HepG2和LM3的生长速度(图4A、B)。
(2)EdU实验检测siRNA介导的FASRL干扰对肝癌细胞增殖的影响:取转染有siFASRL#1、siFASRL#5及其阴性对照siNC的肝细胞癌HepG2和LM3细胞分别种入96孔板中,培养48小时以内,加入含1‰EdU的完全培养基,37℃孵育2小时,然后使用EdU试剂盒分别对EdU阳性细胞和细胞核进行染色,荧光显微镜进行随机拍照,计数每个视野的EdU阳性细胞和细胞核的数量以进行统计分析;通过EdU实验分析发现siRNA介导的FASRL抑制显著减低肝癌细胞HepG2和LM3的增殖细胞比例,表明抑制FASRL的表达能抑制肝癌细胞增殖(图4C-F)。
(3)Transwell实验检测siRNA介导的FASRL干扰对肝癌细胞迁移的影响:取转染有siFASRL#1、siFASRL#5及其阴性对照siNC的肝细胞癌HepG2和LM3细胞分别悬浮于200μL无血清培养基中,加至Transwell小室的上室中,下室24孔板每孔加入500μL的含有20%血清的完全培养基,连续培养24小时后染色观察细胞穿过Transwell小室的情况;Transwell实验明确显示siRNA介导的FASRL表达抑制明显降低肝癌细胞的转移能力(图4G、H)。
(4)细胞凋亡实验检测siRNA介导的FASRL抑制对肝癌细胞凋亡的影响:转染siFASRL#1、siFASRL#5及其阴性对照siNC至六孔板中的肝细胞癌HepG2和LM3,使用AnnexinV凋亡试剂盒进行细胞凋亡检测,分别取培养上清、洗细胞的PBS及胰酶消化下来的细胞一起离心,PBS洗一遍,1×binding buffer充分重悬成单个细胞,分别加入Annexin V-FITC避光孵育15分钟,再加入7-AAD染料,流式细胞术检测活细胞、早期凋亡、晚期凋亡及坏死细胞比例,此实验按照惯例把早期凋亡与晚期凋亡的比例之和视为细胞凋亡比例;细胞凋亡实验分析发现siRNA介导的FASRL表达抑制明显升高肝癌细胞的凋亡比例(图4I)。
本实施例实验数据显示,siRNA介导的FASRL表达抑制能够抑制肝癌细胞的生长、增殖和迁移,促进肝癌细胞的凋亡,表明FASRL可以作为肝细胞癌的基因治疗靶点。
实施例五:FASRL的短发夹寡核苷酸序列设计
针对siRNA#1和siRNA#5干扰靶点,设计可形成发夹结构的寡核苷酸单链及其反向互补序列,两端分别带AgeI和EcoRI限制性酶切位点的DNA双链,所合成的各条寡核苷酸序列如表3所示。
表3-短发夹shRNA序列对应的序列表序号
将上述2条单链互补寡核苷酸序列形成双链DNA片段,并以合适的方法克隆到pLKO.1-puro空载体中,将得到的质粒转染生长状态良好的肝癌细胞HepG2和LM3中,筛选稳定转染的细胞系;成功转染shRNA#1(shFASRL#1)和shRNA#5(shFASRL#5)干扰质粒并筛选获得干扰lncRNA表达的细胞系用于后续实验(图5A、B)。
实施例六:shRNA介导的FASRL表达抑制对肝癌细胞的影响
以下shRNA介导的FASRL表达抑制对肝癌细胞的影响实验同实施例四中所列实验,实验证明shRNA介导的FASRL表达干扰能够抑制肝细胞癌的生长和转移能力;在shRNA介导的FASRL表达干扰后,利用CCK-8和Transwell实验研究FASRL抑制表达后对肝癌细胞生长与转移的影响,进而探讨以lncRNA为突破口进行基因治疗的可行性。
结果显示shRNA能显著降低FASRL的表达(图5A、B),CCK-8实验显示shRNA#5介导的FASRL表达抑制能减慢肝癌细胞的生长(图5C、D);Transwell实验均明显表明shRNA#5介导的FASRL表达抑制能明显降低肝癌细胞的转移能力(图5E-H)。
实施例七:动物实验研究FASRL干扰对肝癌细胞成瘤能力的影响
将32只BALB/c Nude鼠随机平均分为4组,分别为稳定转染FASRL shRNA#5干扰组(shFASRL#5)以及阴性对照组(shNC)的HepG2,及相同分组的LM3细胞系;分别通过皮下注射100μL分别含肝癌细胞HepG2和LM3的细胞悬液种植至小鼠皮下;每天观察裸鼠,每周测量并观察成瘤情况及肿瘤大小,通过动物实验进一步研究以lncRNA FASRL作为基因治疗靶点的可行性。
结果如图6所示,与阴性对照组(shNC)相比,FASRL干扰(shFASRL#5)组肿瘤生长速度明显减慢(图6A、B),尺寸明显减小(图6C、D),且肿瘤重量显著降低(图6E、F);这些结果表明FASRL干扰(shFASRL#5)作为肝细胞癌有效的基因治疗方法。
实施例八:shRNA#5介导的FASRL干扰对肝细胞癌脂代谢的影响
(1)代谢流结合质谱法检测shRNA#5介导的FASRL干扰对肝细胞癌从头合成脂肪酸含量的影响:将稳定转染shFASRL#5干扰质粒及其对照shNC质粒的HepG2细胞(5×10^
结果显示,与对照组(shNC)相比,FASRL干扰(shFASRL#5)组
(2)甘油三酯定量检测shRNA介导的FASRL干扰对肝癌细胞系及其移植瘤模型中甘油三酯含量的影响:
对于肝癌细胞系:取稳定转染有shFASRL#5及其阴性对照shNC的肝细胞癌HepG2和LM3细胞分别在无水乙醇中充分裂解,用甘油三酯测定试剂盒(南京建成生物工程研究所,A110-1-1)测定甘油三酯(triglyceride,TG)浓度,使用肿瘤细胞浓度将数据进行标准化;
对于肝癌移植瘤:取实施例七中的肝细胞癌移植瘤分别在无水乙醇中充分裂解,用甘油三酯测定试剂盒(南京建成生物工程研究所,A110-1-1)测定TG浓度,使用移植瘤重量将数据进行标准化;
结果如图7所示,与对照组(shNC)相比,FASRL干扰(shFASRL#5)组的肝癌细胞系(图7B)及其对应的移植瘤模型(图7C)中TG含量显著减少。
(3)油红O染色检测shRNA#5介导的FASRL干扰对肝癌细胞系及其移植瘤模型中脂滴含量的影响:稳定转染有shFASRL#5及其阴性对照shNC的肝癌细胞系或其对应的实施例七中移植瘤组织用4%多聚甲醛固定10分钟,洗涤5分钟,然后用油红O染料溶液染色10-15分钟(油红O染料溶液由红O饱和溶液和蒸馏水混合制成,比例为6:4);用60%异丙醇洗涤组织1分钟,用蒸馏水洗涤肝癌细胞系或移植瘤组织,用Mayer苏木精复染,用蒸馏水洗涤1-3分钟,然后用甘油明胶覆盖,显微镜(Nikon NI-U)用于捕获图像;
结果如图7所示,与对照组(shNC)相比,FASRL干扰(shFASRL#5)组的肝癌细胞系(图7D、E,上图)及其对应的移植瘤模型(图7D、E,下图)中脂滴含量显著减少。
(4)脂滴荧光检测shRNA#5介导的FASRL干扰对肝癌细胞系中脂滴含量的影响:用Lipid Droplet Assays Kit-Blue(Dojindo Laboratories,LD05)进行脂滴荧光检测;稳定转染有shFASRL#5及其阴性对照shNC的HepG2或LM3细胞分别用HBSS洗涤两次,将工作溶液加入细胞后,将细胞在37℃、5% CO2的培养箱中培养2小时,然后,将细胞用HBSS洗涤两次,并通过Leica超高分辨率显微镜(Leica SP8 STED 3X)捕获图像;
结果如图7所示,与对照组(shNC)相比,FASRL干扰(shFASRL#5)组的肝癌细胞系HepG2(图7F)和LM3细胞(图7G)中脂滴含量显著减少;该结果表明FASRL干扰(shFASRL)作为肝细胞癌基因治疗方法的机制是通过减少脂肪酸合成。
实施例九:动物实验研究FASRL干扰对肝细胞癌模型小鼠生存的影响
采用Kaplan-Meier存活曲线分析实施例七中的HepG2或者LM3细胞系的HCC异种移植肿瘤的shFASRL#5组及其对照shNC组小鼠的生存状况,并使用GraphPad software进行绘图和统计分析;
结果如示,与阴性对照组(shNC)相比,FASRL干扰(shFASRL#5)组移植瘤小鼠生存期延长(图8A、B);这些结果表明FASRL干扰(shFASRL)可明显延长肝细胞癌荷瘤小鼠的生存时间。
实施例十:生存曲线分析研究FASRL高表达与肝细胞癌患者预后的相关性
对于TCGA数据集:从TCGA网站(https://cancergenome.nih.gov/)下载了371例肝癌样本(无转移)和50个相邻正常肝组织的RNA-seq及临床数据,其中365例包含HCC患者的生存信息;对其分别进行两组之间FASRL表达的比较和FASRL高低表达与预后关系评估;
对于发现集和验证集两个数据集:使用实施例三中表2的FASRL引物进行qRT-PCR检测;同样地,对其分别进行两组之间FASRL表达的比较和FASRL高低表达与预后关系评估;
结果如示,与正常肝组织相比,FASRL表达在HCC组织中显着上调(图9A);同时,与成对的相邻正常组织相比,HCC组织中的FASRL表达显着增加(图9B);此外,高FASRL表达预测HCC患者更差的总体存活率(图9C);一致的是,在增加的独立数据集中得到了类似的结果(图9D-G);这些结果表明FASRL在HCC患者中表达上调,其高表达能预测患者的不良预后。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步的详细说明,应当理解,以上所述仅为本发明的具体实施例而已,并不用于限定本发明的保护范围。特别指出,对于本领域技术人员来说,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 血浆中长链非编码RNA MALAT1、HIF1A-AS1和XIST在非小细胞肺癌早期诊断试剂盒中的应用
- 一种长链非编码RNA在制备肝细胞癌诊断产品或治疗药物中的应用
- 一种针对人长链非编码RNA-DANCR的干扰序列及制备肝细胞癌治疗药物中的应用
