一种含有杜仲叶提取物的抗菌复合制剂及其在食物防腐保鲜中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于酶工程和食品领域,具体涉及一种含有杜仲叶提取物的抗菌复合制剂及其在食物防腐保鲜中的应用。
背景技术
天蚕素抗菌肽是世界上第一个被发现的抗菌肽,也是现在研究最多的一类抗菌肽,抗菌肽是无毒副作用、无药物残留、无环境污染的绿色添加剂、防腐剂,是抗生素理想的替代品,可以避免抗生素在肉奶蛋中残留,有利于禽畜产品质量的改善,有利于人的健康,又能避免诱发耐药性病菌的产生,防止交叉感染而引起的恶性循环,在农牧业可持续性发展及生态环境保护中均有长远的效益及社会效益。
溶菌酶广泛存在于人体多种组织中,以及鸟类和家禽的蛋清、哺乳动物的泪液、唾液、血浆、乳汁中。溶菌酶又称胞壁质酶或N-乙酰胞壁质聚糖水解酶,是一种能水解细菌中黏多糖的碱性酶,其主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂内容物逸出而使细菌溶解,进而具有抑菌作用。
抗菌多肽类产品适合于各种食品的防腐,同时也是安全的饲料添加剂,在饲料中添加可防止霉变,延长饲料的贮存期,减少不必要损耗。
但天然来源的溶菌酶一般活性较低,需要较高的添加量才会具有比较理想的效果,因此寻找或设计安全、抑菌效果好的溶菌酶是亟待解决的问题,进而获取防腐保鲜新产品,对食品领域具有重大的意义。
发明内容
本发明提供了一种含有杜仲叶提取物的抗菌复合制剂及其在食物防腐保鲜中的应用。本发明得到一种抗菌活性提高的融合抗菌多肽CLysM,其与杜仲叶提取物制成的抗菌复合制剂具有很好的食物防腐保鲜效果。
为了实现上述发明目的,本发明采用以下技术方案予以实现:
本发明提供了一种融合抗菌多肽CLysM,其氨基酸序列如SEQ ID NO:1所示。
进一步的,所述融合抗菌多肽CLysM能够耐受80℃以上的高温且无溶血性。
进一步的,所述融合抗菌多肽CLysM的氨基酸序列是由如SEQ ID NO:3所示的天蚕素突变体突变体CM1、如SEQ ID NO:4所示的连接肽和如SEQ ID NO:5所示的溶菌酶突变体LysM1的氨基酸序列组成的。
本发明还提供了一种编码基因,其为所述的融合抗菌多肽CLysM的编码基因,核苷酸序列如SEQ ID NO:2所示。
本发明还提供了一种重组工程菌,其包含所述的编码基因。
进一步的,所述基因工程菌为毕赤酵母、枯草芽胞杆菌、地衣芽胞杆菌。
本发明还提供了一种抗菌复合制剂,所述抗菌复合制剂是由所述的融合抗菌多肽CLysM的喷干粉与杜仲叶提取物混合后,溶于水而制成的。
进一步的,所述融合抗菌多肽CLysM的喷干粉与杜仲叶提取物的质量比为2~5:2。
进一步的,所述抗菌复合制剂中融合抗菌多肽CLysM的使用量为水体积的1%。
本发明还提供了所述的融合抗菌多肽CLysM在用于制备抑菌剂中的应用。
进一步的,所述抑菌剂抑制的致病菌为金黄色葡萄球菌、魏氏梭菌、无乳链球菌、大肠杆菌、沙门氏菌。
本发明还提供了所述的融合抗菌多肽CLysM或者所述的抗菌复合制剂在用于食品防腐保鲜中的应用。
进一步的,在用于食品防腐保鲜时,所述融合抗菌多肽CLysM或者所述抗菌复合制剂的浓使用度为1%~5%。
与现有技术相比,本发明的优点和技术效果是:
1、本发明分别将天蚕素和溶菌酶进行基因密码子优化和突变,通过筛选获得酶活性和抑菌活性提高的突变体后,再利用融合基因表达的方式将天蚕素抗菌肽和枯草芽孢杆菌溶菌酶进行融合表达,获得了抑菌活性明显提高了融合抗菌多肽CLysM,其能够耐受80℃以上的高温且无溶血性;并对金黄色葡萄球菌、魏氏梭菌、无乳链球菌、大肠杆菌、沙门氏菌有明显抑制作用。
2、本发明将融合抗菌多肽CLysM与杜仲叶提取物复配成抗菌复合制剂,实验验证,其具有很好的抑制食物杂菌生长的效果,进而达到食物防腐保鲜的目的,使其在食品等领域有具有良好的应用前景。
附图说明
图1是天蚕素、溶菌酶及融合基因PCR结果,其中编号1-3分别是天蚕素、溶菌酶及融合基因。
图2是融合抗菌多肽摇瓶发酵抑菌活性比较。
图3是融合抗菌多肽在15L发酵罐中的发酵曲线。
图4是融合抗菌多肽的耐热性结果。
图5是融合抗菌多肽溶血性实验,其中第1列是阴性对照;第2-3列是实验组;第4列是阳性对照。
具体实施方式
为了便于理解本发明,以下将结合附图及实施例对本文发明做更全面、详细地说明,但本发明的保护范围并不限于以下具体实施例。
以下实施例中未作具体说明的分子生物学实验方法,可以参照《分子克隆实验指南》(第三版)J.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。具体实施例中使用的试剂和生物材料如无特殊说明均可从商业途径获得。
本发明使用的培养基配方如下:
LB培养基:1%胰蛋白胨,0.5%酵母提取物,1%NaCl;
MD培养基:1.34%YNB,0.4mg/L生物素,2%葡萄糖;
YPD培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖;
BMGY培养基:1%酵母提取物,2%蛋白胨,100mmol/L磷酸钾缓冲液(pH6.0),1.34%YNB,0.4mg/L生物素,1%甘油;
BMMY培养基:1%酵母提取物,2%蛋白胨,100mmol/L磷酸钾缓冲液(pH6.0),1.34%YNB,0.4mg/L生物素,1%甲醇;
BSM培养基:26.7mL 85%的磷酸,0.93g二水硫酸钙,14.9g二水硫酸镁,4.13g氢氧化钾,18.2g硫酸钾,40g甘油,4.0mL PMT1。
以上培养基为固体培养基时,则向原配方中加入2%的琼脂粉即可。
酶活力测定:参照《南京建成-溶菌酶测定试剂盒》中溶菌酶的测定方法。
抑菌活性测定:按照琼脂扩散方法,以金黄色葡萄球菌为靶标菌,以金霉素抗生素作为参照。将适量的金黄色葡萄球菌加入到融化后的温热的LB琼脂培养基中,倒平板,等平板凝固后进行打孔,每个孔中加入等量的发酵液或者抗生素,放置于培养箱中静置培养,至产生抑菌圈,测量抑菌圈直径和抗生素进行比较获得对应的抑菌效价,即发酵液抑菌活性相当于对少ppm的抗生素。
实施例1:溶菌酶突变体基因构建和筛选
参考枯草芽孢杆菌来源的溶菌酶氨基酸序列(GenBank:AOR99681.1),翻译成对应的核苷酸序列,并经过基因序列优化后,由人工合成。设计如下引物,在5’端设计EcoR I限制性酶切位点,3’端设计Not I限制性酶切位点。
Lys-F:CCGGAATTCATGGCTGCCGCTGATTTC(SEQ ID NO:6);
Lys-R:ATAAGCGGCCGCTTATCTCAAAGTTTGCAACAATTG(SEQ ID NO:7)。
用GeneMorph II随机突变PCR试剂盒,以人工合成的基因为模版,进行随机突变,使用的引物序列为Lys-F和Lys-R。
将扩增好的随机突变PCR产物用EcoR I和Not I双酶切,纯化回收后连接到pET-21a(+)载体上,转化大肠杆菌BL21-DE3,氨苄青霉素抗性LB平板筛选阳性克隆,得到pET-LysMx。同样方法将合成的原始基因连接到pET-21a(+)载体上并转化大肠杆菌BL21-DE3,得到pET-Lys0。
将筛选的单菌落接种到96孔深孔板。每个平板接入2个表达Lys0的单菌落为对照。每孔装入300uL LB液体培养基(含有100μg/mL氨苄青霉素),37℃、200rpm震荡培养4小时后,转移50uL菌液到新的96孔平板保种,在平板剩余菌液中添加200uL含有IPTG的LB-Amp培养基,使IPTG终浓度为1mM,氨苄青霉素终浓度为100μg/mL,37℃、200rpm摇床培养10h诱导表达溶菌酶。
将诱导完成的菌液反复冻融进行破碎,将破碎后的细胞液离心取上清,然后检测溶菌酶的活性。将酶活高于对照的突变体基因进行测序。经过测序后获得融溶菌酶突变体LysM1,其氨基酸序列如SEQ ID NO:5所示,其对应核苷酸序列如SEQ ID NO:8所示。
实施例2:天蚕素突变体基因构建和筛选
参考天蚕素的氨基酸序列(NCBI PRF:2018170A),翻译成对应的核苷酸序列,去掉信号肽序列并经过基因序列优化后,由人工合成。设计如下引物,在5’端设计EcoR I限制性酶切位点,3’端设计Not I限制性酶切位点。
C-F:CCGGAATTCGCTCCAGAACCTAGATG(SEQ ID NO:9);
C-R:ATAAGCGGCCGCCTTACCAATAGCCTTAGCGCTAC(SEQ ID NO:10)。
用GeneMorph II随机突变PCR试剂盒,以人工合成的基因为模版,进行随机突变,使用的引物序列为C-F和C-R。
将扩增好的随机突变PCR产物用EcoR I和Not I双酶切,纯化回收后连接到pET-21a(+)载体上,转化大肠杆菌BL21-DE3,氨苄青霉素抗性LB平板筛选阳性克隆,得到pET-CMx。同样方法将合成的原始基因连接到pET-21a(+)载体上并转化大肠杆菌BL21-DE3,得到pET-C0。
将筛选的单菌落接种到96孔深孔板。每个平板接入2个表达C0的单菌落为对照。每孔装入300uL LB液体培养基(含有100μg/mL氨苄青霉素),37℃、200rpm震荡培养4小时后,转移50uL菌液到新的96孔平板保种,在平板剩余菌液中添加200uL含有IPTG的LB-Amp培养基,使IPTG终浓度为1mM,氨苄青霉素终浓度为100μg/mL,37℃、200rpm摇床培养10h诱导表达溶菌酶。
将诱导完成的菌液反复冻融进行破碎,将破碎后的细胞液离心取上清,然后检测天蚕素抗菌肽的抑菌活性。将抑菌活性高于对照的突变体基因进行测序。经过测序后获得突变体CM1,其氨基酸序列如SEQ ID NO:3所示,其对应核苷酸序列如SEQ ID NO:11所示。
实施例3:融合抗菌多肽CLysM基因构建和抑菌活性验证
参照实施例1和2获得的突变体LysM1和CM1,使用引物C-F和CL1-R扩增突变体CM1,使用引物CL2-F和Lys-R扩增突变体LysM1,再使用引物C-F和Lys-R通过重叠PCR扩增获得融合基因CLysM。经过电泳验证后,结果如图1所示,融合片段构建成功。
重叠PCR反应体系为50μL,先不加如引物,其他条件按相应的DNA聚合酶说明书进行。反应条件为2步循环:96℃预变性5min,94℃变性30sec,68℃退火(延伸)45sec,5个循环后,暂停PCR程序,取出PCR管,置于冰上,加入2μL上游引物和2μL下游引物,混匀。94℃变性30sec,68℃退火(延伸)45sec,循环30次,72℃,后延伸10min,15℃保存.
所用引物如下:
C-F:CCGGAATTCGCTCCAGAACCTAGATG(SEQ ID NO:9);
CL1-R:AGCCTTAGCGGCAGCTTCCTTAGCGGCAGCTTCGGCCTTACCAATAGCCTTAGCGC(SEQ IDNO:12);
CL2-F:GCCGAAGCTGCCGCTAAGGAAGCTGCCGCTAAGGCTATGGCTGCCGCTGATTTCAT(SEQ IDNO:13);
Lys-R:ATAAGCGGCCGCTTATCTCAAAGTTTGCAACAATTG(SEQ ID NO:7)。
将融合基因CLysM按照实施例1和2中的方法克隆入pET-21a(+)载体上,并转化大肠杆菌BL21-DE3,进行摇瓶发酵,验证抑菌活性。
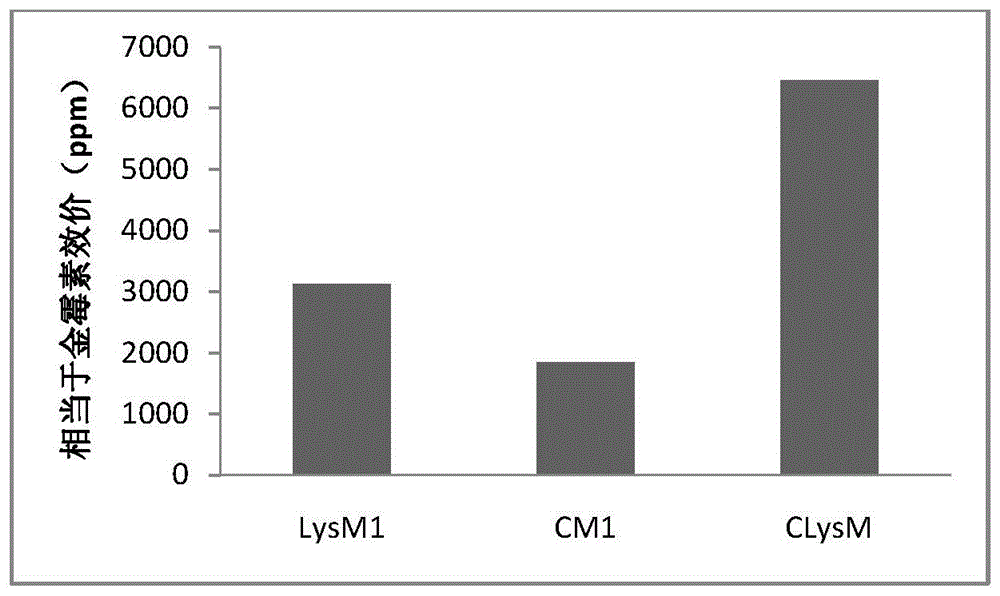
以金黄色葡萄球菌为靶标菌,以金霉素抗生素作为参照,取发酵液离心后的上清液分别验证其抑菌活性,经过测量其抑菌圈直径,换算成对应的效价。
结果如图2所示,经过融合后的抗菌多肽CLysM抑菌活性明显高于单独表达的天蚕素或者溶菌酶,其氨基酸序列如SEQ ID NO:1所示,核苷酸序列如SEQ ID NO:2所示。
综上,融合抗菌多肽CLysM的氨基酸序列分为3部分,第一段1-41氨基酸是如SEQID NO:3所示的由天蚕素突变体CM1,第二段序列42-53氨基酸是如SEQ ID NO:4所示的连接肽,第三段序列54-627氨基酸是如SEQ ID NO:5所示的溶菌酶突变体LysM1。
实施例4:融合抗菌多肽CLysM转化毕赤酵母SMD168
将融合抗菌多肽CLysM基因用EcoR I和Not I双酶切位点连接到pPIC9K质粒上并转化至大肠杆菌DH5α中,获得表达载体pPIC-CLysM,测序验证。将阳性表达载体用Sal I酶切线性化后电转入毕赤酵母SMD168中,MD平板筛选得到转化子并转接到YPD平板中活化(一般挑24-48个转化子)。活化后的转化子接于摇瓶进行发酵(每瓶含20mL BMGY培养基),30℃振荡培养18h后,加1%甲醇诱导,继续振荡培养,此后每24h添加培养体积1%的甲醇。诱导表达96h后,将培养液离心获得上清,测定发酵液上清的平均抑菌活性,融合抗菌多肽CLysM在摇瓶发酵条件下,在酵母SMD168中的抑菌活性约是大肠杆菌BL21中的3倍,抑菌活性进一步提升。
实施例5:融合抗菌多肽CLysM在15L发酵罐中发酵和制备
将融合抗菌多肽CLysM的基因工程菌分别划线于YPD平板上,30℃培养3天长出单菌落,挑取长势良好的单菌落继续在YPD平板上划线培养,如此活化三代得到的毕赤酵母单菌落接种于20mL BMGY培养基中,30℃、200rpm培养24h。以2%的接种量接种到300mL BMGY培养基中,30℃、200rpm培养至OD600为5,用作种子液接种发酵罐。发酵生产工艺:BSM培养基,pH4.8、温度30℃、搅拌速率500rpm、通风量1.5(v/v),溶氧控制在20%以上发酵过程分为三个阶段:(1)菌体培养阶段:按8%比例接入种子液,30℃培养20~24h,使发酵液中甘油耗尽;(2)饥饿阶段:当碳源甘油耗尽后,暂不补加任何碳源,待溶氧上升至80%饥饿阶段结束;(3)诱导表达阶段:用氨水或磷酸调节pH至所需值,流加甲醇诱导,并且保持溶氧在20%以上,诱导时间为160~200h;待发酵结束后,发酵液通过板框过滤机处理后经喷塔喷干成粉制剂,用于应用测试。
发酵过程曲线如图3所示:每隔8h取样,测定产酶水平,发酵168h后抑菌活性达到最高点。
实施例6:融合抗菌多肽对常见致病菌的MIC
采用MIC的方式测定融合抗菌多肽CLysM对常见致病菌的抑菌效果。具体方法如下。
融合抗菌多肽发酵液制备:将CLysM发酵液喷粉配制成0.1g/mL的浓度,并过滤除菌备用。于超净台中,无菌操作,取96孔板每孔加入100微升的LB,从第1列开始先取100微升0.1g/mL的CLysM加入到第1列稀释2倍后,再从第1列取出100微升加入到第2列,依次将CLysM进行稀释,最后一列(编号12)为空白,即第11列稀释后取100微升舍弃。
菌悬液制备:将以下常见的致病菌,接种LB培养基,过夜培养后,稀释一定倍数后备用。按照稀释的梯度加入到96孔板的CDEFGH行,AB行作为对照加入等量的无菌水。
将上述含有融合抗菌多肽和致病菌的96孔板于摇床中低速震荡培养,统计最低抑菌浓度。如下表所示,融合抗菌多肽对金黄色葡萄球菌、魏氏梭菌、无乳链球菌、大肠杆菌、沙门氏菌都有较好的抑菌效果。
表1:融合抗菌多肽对致病菌的影响
结果如表1所示,融合抗菌多肽CLysM对金黄色葡萄球菌、魏氏梭菌、无乳链球菌等革兰氏阳性菌,以及对大肠杆菌、沙门氏菌有较好的抑菌效果。
实施例7:融合抗菌多肽耐热性测定
将融合抗菌多肽酶液(0.1g/mL)进行适当稀释后备用,各取2只试管加入9mL无菌水分别在80℃和90℃的水浴锅中保温预热5分钟,然后各取1mL酶液加入到预热的试管中,同时计时,每隔5分钟取样检测剩余抑菌活性,以未处理的样品作为参照。
经过检测后,如图4所示,融合抗菌多肽CLysM经过80℃保温25分钟几乎没有损失,90℃保温20分钟,残留率在80%以上,说明该融合抗菌多肽具有较好的耐热性,为其产业化应用及产品推广奠定了基础。
实施例8:融合抗菌多肽溶血性测定
血细胞悬液的准备:取肉鸡新鲜血液立即加入终浓度为1%的柠檬酸钠混匀(抗凝),2000rpm,10min离心收集血细胞,用等体积0.9%氯化钠洗涤沉淀,再次2000rpm,10min离心去上清,洗3遍直至上层溶液澄清无红色。用10mM PBS(pH 7.4)对血细胞液重悬,混匀,使其终浓度为2%。取干净的96孔板,每孔加入200μL血细胞悬液,实验组再加入融合抗菌多肽的发酵液100μL,阴性对照组加入PBS 100μL,阳性对照组加入100μL 0.1% Triton X-100。将上述混合液37℃水浴1小时,2000rpm,10min离心取上清测定540nm处吸光度值。
结果如图5所示,只有阳性对照出现溶血现象即第4列,融合抗菌多肽的发酵液没有发生溶血作用,说明可以安全的应用于动物养殖领域。
实施例9:抗菌复合制剂的制备及其对扒鸡的防腐保鲜实验
杜仲叶提取物的制备方法为:取杜仲叶用水提取,提取温度55-65℃,提取时间2-4h,然后进行过滤,取滤液在60℃下真空浓缩至比重1.2(浓缩到这个比重的溶液,喷干所用时间最短,因为绿原酸高温分解,喷干用时短,绿原酸瞬间喷干,没有损失,而且节约能源),经喷雾干燥塔喷干制得所述杜仲叶提取物。
将60g杜仲叶提取物与40g融合抗菌多肽喷干粉混合后,溶于4L无菌水中,得到抗菌复合制剂,其中抗菌复合制剂中融合抗菌多肽的添加量为无菌水的1%。
采购新鲜日期的扒鸡,分为实验组、提取物组和对照组,每组各做3个重复,每个重复1只扒鸡。扒鸡于超净台中拆开包装,全程无菌操作,对照组无菌水浸泡1h,提取物组用等量的浓度为1%的杜仲叶提取物溶液浸泡1h,实验组用等量的抗菌复合制剂浸泡1h。将两组扒鸡室温阴凉条件下放置,盖2层纱布,每隔12h观察扒鸡防腐情况,同时取1cm的正方形扒鸡皮肤组织,加入到含有5mL无菌水的试管中,震荡,取200μL进行平板涂布,过夜培养后菌落计数。
结果如表2所示,放置第3天后,对照组的杂菌达到2000以上,而实验组的杂菌依然较少,虽然杜仲叶提取物起到一定的抑菌作用,但实验组的杂菌数量明显低于提取物组,说明使用抗菌复合制剂能够对食物的防腐保鲜起到很好的作用。
表2:抗菌复合制剂对扒鸡的防腐保鲜结果
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
- 一种白萝卜籽蛋白提取物及其在水产品防腐保鲜中的应用
- 一种白萝卜籽蛋白提取物及其在水产品防腐保鲜中的应用
