外泌体冻干保护剂和外泌体冻干制剂的制备方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及冻干技术领域,尤其是涉及一种外泌体冻干保护剂和外泌体冻干制剂的制备方法。
背景技术
外泌体是一类直径在50~150 nm,在生理或病理条件下,由细胞分泌的胞外囊泡。外泌体具有双层膜结构,主要成分包括蛋白质、RNA、DNA、氨基酸及各种代谢产物等。研究表明,外泌体中的核酸、蛋白质等成分具有传递遗传信息,调节生理功能等特性。不同来源的外泌体的功能不同,其中乳源外泌体作为乳汁重要成分之一,能够携带和传递miRNA等信号分子,已成为目前食源外泌体的研究热点。有研究对比分析了牛、猪、人和熊猫的乳源外泌体miRNA,发现乳源外泌体中富集的miRNA,都与增强免疫、调节代谢、抵抗疾病等事件相关。
随着外泌体应用的拓展,如何安全有效地保存外泌体变得非常重要。液态形式保存的外泌体保质期比较短,而且保存条件比较苛刻。一般-80℃冷冻条件下只能保存半年左右,极大地限制了外泌体的应用。因此,如何方便地保存外泌体,且保持其生物活性及稳定性是亟待解决的问题。
目前已有文献公开采用冻干工艺将外泌体冻干成固体以保存外泌体,冻干过程中最重要的是冻干保护剂及缓冲体系的选择,同时冻干工艺的参数也将影响冻干效率及冻干后外泌体的完整性。已授权的专利中“一种人间充质干细胞外泌体冻干粉的制备方法、使用方法”(公开号为CN107245472A的中国专利申请,首次公开日期为2017年10月13日)的专利中采用单组分甘露醇作为保护剂,溶液为培养基;“一种制备人羊膜间充质干细胞外泌体冻干粉的方法”(公开号为CN104488850A的中国专利申请,首次公开日期为2015年04月08日)采用单组分的海藻糖作为外泌体的保护剂,缓冲液为PBS。其他在申请的专利中采用复合组分的保护剂如富血小板因子、普鲁兰、右旋糖酐、葡萄糖、乳酸钠、白蛋白、甘氨酸、甘油等成分,溶液为无菌水或者PBS缓冲液。在这些专利中采用的单一组分的冻干保护剂无法有效保证外泌体在冻干前后的完整性,已有的多组分冻干保护剂由于没有能够在冻干过程中抑制外泌体聚集成分,会导致外泌体在冻干后有大量的聚集体,同时已公开的专利或文章中所使用的缓冲液均为PBS,其组分中含有的磷酸二氢钠和磷酸氢二钠的溶解度在低温条件下由有较大差异,导致在冻干过程中外泌体所处环境的pH有非常急剧的变化,最终导致外泌体的破损。
综上所述,目前外泌体冻干保护剂还无法满足实际的生产需要。
有鉴于此,特提出本发明。
发明内容
本发明的第一目的在于提供一种外泌体冻干保护剂,以缓解现有技术中存在的冻干保护剂无法有效的维持外泌体冻干后生物活性的技术问题。
本发明的第二目的在于提供一种外泌体冻干制剂的制备方法,该制方法利用上述外泌体冻干保护剂对外泌体进行冻干保护。
为解决上述技术问题,本发明特采用如下技术方案:
根据本发明的一个方面,提供了一种外泌体冻干保护剂,所述外泌体冻干保护剂以10~50 mmol/L的Tris缓冲液为缓冲体系;按照各物质在所述缓冲体系中的工作浓度计,还包括糖类物质1~5 %w/v、醇类物质1~5 %w/v、明胶水解物0.1~0.5 %w/v和精氨酸50~500mmol/L。
优选地,所述糖类物质包括:海藻糖、蔗糖、聚蔗糖、葡萄糖、葡聚糖、乳糖、棉子糖、果糖和麦芽糖中的一种或多种;
和/或,所述醇类物质包括:甘露醇、丙三醇、乙二醇和聚乙二醇中的一种或多种。
优选地,所述外泌体冻干保护剂以10~50 mmol/L的Tris缓冲液为缓冲体系;按照各物质在所述缓冲体系中的工作浓度计,还包括海藻糖1~5 %w/v、甘露醇1~5% w/v、明胶水解物0.1~0.5 %w/v和精氨酸50~500 mmol/L。
优选地,所述外泌体冻干保护剂以20 mmol/L的Tris缓冲液为缓冲体系;按照各物质在缓冲体系中的工作浓度计,还包括海藻糖5 %w/v、甘露醇5 %w/v、明胶水解物0.1 %w/v和精氨酸100 mmol/L;
或,所述外泌体冻干保护剂以20 mmol/L的Tris缓冲液为缓冲体系;按照各物质在缓冲体系中的工作浓度计,还包括海藻糖5 %w/v、甘露醇5 %w/v、明胶水解物0.5 %w/v和精氨酸400 mmol/L。
根据本发明的另一个方面,还提供了一种外泌体冻干制剂的制备方法,包括:冻干包含外泌体和上述外泌体冻干保护剂的混合体系。
优选地,冻干起始时,外泌体在冻干保护剂中的浓度为100~600 μg/mL。
优选地,所述冻干包括将所述混合体系依次进行冻干和干燥,所述冻干包括依次预冻、退火和冷冻;
所述预冻为先-8~-12℃冻干30~60mim,再-40~-60℃冻干1~2 h;
所述退火为-15~-25℃冻干0.5~2 h;
所述冷冻为-40~-60℃冻干1.5~2.5 h。
优选地,所述预冻为先-10℃冻干30 mim,再-50℃冻干2 h;所述退火为-20℃冻干1h;所述冷冻为-50℃冻干2 h。
优选地,所述干燥包括依次一次干燥和二次干燥;
所述一次干燥的条件为:温度-20℃~-30℃,时间15~20 h,真空度10~20pa;
所述二次干燥的条件为:温度20℃~25℃,时间2~5 h,真空度5~10 Pa。
优选地,所述外泌体来源于乳。
与现有技术相比,本发明具有如下有益效果:
本发明提供的外泌体冻干保护剂以Tris缓冲液作为缓冲体系,替代现有技术中的PBS缓冲液、注射水或培养基作为冻干保护剂基质,可以有效稳定外泌体在冻干过程中所处环境的pH,进而保护外泌体在冻干后的完整性和生物活性。本发明提供的冻干保护剂还添加了精氨酸和明胶水解物,可以在冻干过程中有效抑制外泌体的聚集,从而降低外泌体在冻干过程中由于聚集导致的对外泌体功效的破坏。
经实验验证,采用本发明提供的外泌体冻干保护剂对外泌体进行冻干保护,冻干后外泌体粒径在大粒径区域分布显著减少,说明本发明提供的冻干保护剂可以有效的减少外泌体在冻干过程中的聚集;将冻干后的外泌体进行活性检测,相比于未采用本发明冻干保护剂的试验组,细胞样本的ColⅠ转录水平显著升高,说明本发明提供的外泌体冻干保护剂能够在冻干过程中有效保护外泌体的生物活性。
本发明提供的外泌体冻干制剂的制备方法,采用上述外泌体冻干保护剂对外泌体进行冻干保护,因此该制备方法也具有上述外泌体冻干保护剂的有益效果。并且,在一些优选的方案中还优化了冻干工艺,通过增加退火步骤,可以有效将整个外泌体冻干时间缩短,显著的提高了生产效率。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1冻干后外泌体的粒径分布;
图2为本发明实施例1冻干后外泌体的形态;
图3为本发明实施例2冻干后外泌体的粒径分布;
图4为本发明实施例2冻干后外泌体的形态;
图5为本发明实施例3冻干后外泌体的粒径分布;
图6为本发明实施例3冻干后外泌体的形态;
图7为本发明实施例4冻干后外泌体的粒径分布;
图8为本发明实施例4冻干后外泌体的形态;
图9为本发明实施例5冻干后外泌体的粒径分布;
图10为本发明实施例5冻干后外泌体的形态;
图11为本发明实施例6冻干后外泌体的粒径分布;
图12为本发明实施例6冻干后外泌体的形态;
图13为本发明实施例7冻干后外泌体的粒径分布;
图14为本发明实施例7冻干后外泌体的形态;
图15为本发明对比例1冻干后外泌体的粒径分布;
图16为本发明对比例1冻干后外泌体的形态;
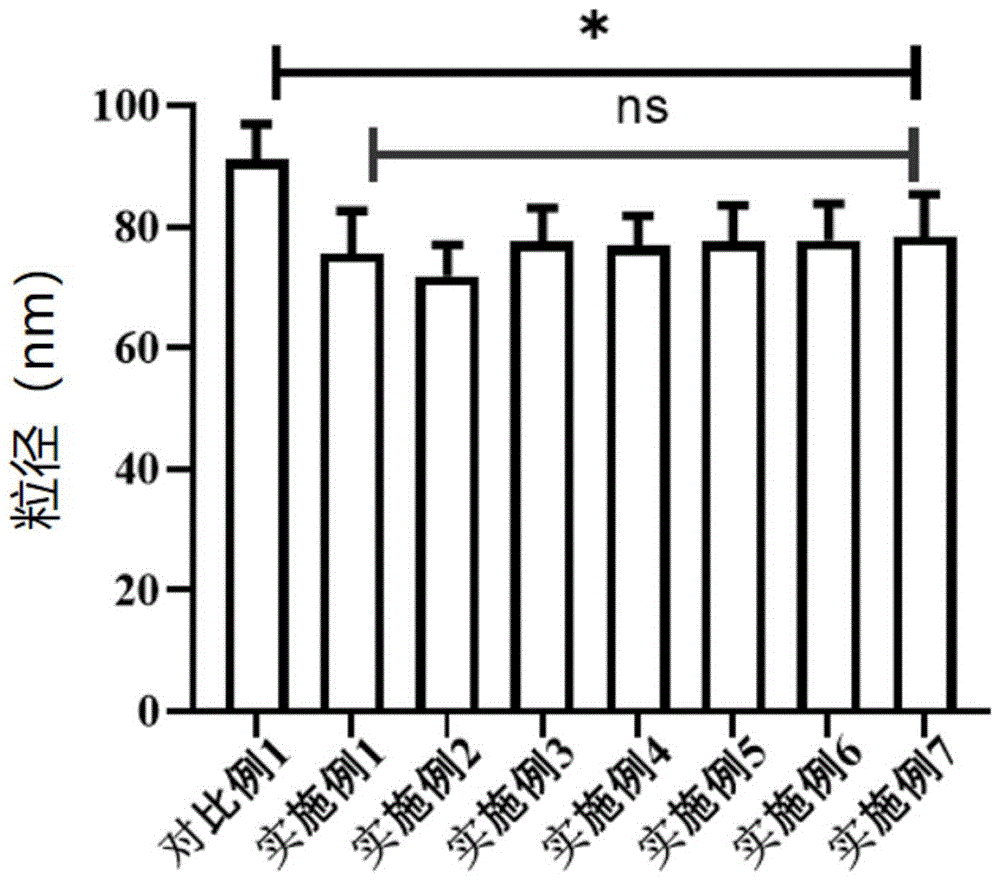
图17为本发明实施例1~7和对比例1粒径分布的统计比较结果;
图18为本发明实施例1~7和对比例1的ColⅠ转录水平统计结果。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是:
本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案;所有技术特征以及优选特征可以相互组合形成新的技术方案;所涉及的各组分或其优选组分可以相互组合形成新的技术方案。
本发明中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数;并且,所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
根据本发明的一个方面,本发明提供了一种外泌体冻干保护剂,该外泌体冻干保护剂以Tris缓冲液为缓冲体系,其中还添加有糖类物质、醇类物质、明胶水解物和精氨酸。
Tris缓冲液的浓度为10~50 mmol/L,例如可以为但不限于为10、15、20、25、30、35、40、45或50 mmol/L。
其他物质按照在缓冲体系中的工作浓度计,添加量如下:
糖类物质1~5%w/v,例如可以为但不限于为1、2、3、4或5 %w/v。糖类物质可选择本领域公知的,成熟的具有冻干保护功能的糖类,包括但不限于海藻糖、蔗糖、聚蔗糖、葡萄糖、葡聚糖、乳糖、棉子糖、果糖和麦芽糖中的一种或多种,优选海藻糖。
醇类物质1~5% w/v,例如可以为但不限于为1、2、3、4或5 %w/v。醇类物质可选择本领域公知的,成熟的具有冻干保护功能的糖类,包括但不限于甘露醇、丙三醇、乙二醇和聚乙二醇中的一种或多种,优选甘露醇。
明胶水解物(Cas No. 68410-45-7)0.1~0.5 %w/v,例如可以为但不限于为0.1、0.2、0.3、0.4或0.5 %w/v。
精氨酸50~500 mmol/L,例如可以为但不限于为50、100、150、200、250、300、350、400、450或500 mmol/L。
在一些优选的实施方式中,糖类物质采用海藻糖,醇类物质采用甘露醇,所述外泌体冻干保护剂的组成如下:以10~50 mmol/L的Tris缓冲液作为缓冲体系;按照各物质在缓冲体系中的工作浓度计,还包括海藻糖 1~5 %w/v、甘露醇1~5% w/v、明胶水解物0.1~0.5 %w/v和精氨酸50~500 mmol/L。
在一个优选的实施方式中,所述外泌体冻干保护剂的组成如下:以20 mmol/L的Tris缓冲液为缓冲体系;按照各物质在缓冲体系中的工作浓度计,还包括海藻糖5 %w/v、甘露醇5 %w/v、明胶水解物0.1 %w/v和精氨酸100 mmol/L。
在另一个优选的实施方式中,所述外泌体冻干保护剂的组成如下:以20 mmol/L的Tris缓冲液为缓冲体系;按照各物质在缓冲体系中的工作浓度计,还包括海藻糖5 %w/v、甘露醇5 %w/v、明胶水解物0.5 %w/v和精氨酸400 mmol/L。
需要说明的是,上述外泌体冻干保护剂中各物质的工作浓度为冻干保护剂在冻干起始时,冻干保护剂中各物质的浓度。可以理解的是,本发明提供的外泌体冻干保护剂还可以为倍数浓度的储备试剂,在使用时再稀释至上述工作浓度,因此以倍数浓度的储备试剂形式的所述外泌体冻干保护剂也属于本发明的保护范围。
根据本发明的另一个方面,本发明还提供了一种外泌体冻干制剂的制备方法,该制备方法包括冻干包含外泌体和上述外泌体冻干保护剂的混合体系。
在一些优选的实施方式中,冻干起始时,外泌体在冻干保护剂中的浓度为100~600μg/mL,例如可以为但不限于为100、150、200、250、300、350、400、450、500、550或600 μg/mL,优选为300 μg/mL。
在一些优选的实施方式中,所述冻干包括将所述混合体系依次进行冻干和干燥,所述冻干包括依次预冻、退火和冷冻。预冻、退火和冷冻的优选条件参数如下:
预冻:先-8~-12℃冻干30~60 mim,其中,冻干温度例如可以为但不限于为-8、-9、-10、-11或-12℃,以及上述任意两点组成的温度范围;冻干时间例如可以为但不限于为30、35、40、45、50、55或60min;再-40~-60℃冻干1~2 h,其中,冻干温度例如可以为但不限于为-40、-45、-50、-55或-60℃,以及上述任意两点组成的温度范围;冻干时间例如可以为但不限于为1、1.2、1.5、1.8或2h。预冻的更优选条件如下:先-10℃冻干30 mim,然后-50℃冻干2h。
退火:-15~-25℃冻干0.5~2 h,其中,冻干温度例如可以为但不限于为-15、-18、-20、-22或-25℃,以及上述任意两点组成的温度范围;冻干时间例如可以为但不限于为0.5、1或2h。退火的更优选条件如下:-20℃冻干1 h。
冷冻:-40~-60℃冻干1.5~2.5 h,其中,冻干温度例如可以为但不限于为-40、-45、-50、-55或-60℃,以及上述任意两点组成的温度范围;冻干时间例如可以为但不限于为1.5、1.8、2、2.2或2.5 h。冷冻的更优选条件如下:-50℃冻干2 h。
在一些优选的实施方式中,所述干燥依次包括一次干燥和二次干燥,所述一次干燥的条件优选为:温度-20℃~-30℃,时间15~20 h,真空度10~20 Pa。其中,温度例如可以为但不限于为-20、-22、-25、-28或-30℃,以及上述任意两点组成的温度范围;时间例如可以为但不限于为15、16、17、18、19或2 0h;真空度例如可以为但不限于为10、12、15、18或20Pa,以及上述任意两点组成的真空度范围。
所述二次干燥的条件优选为:温度20℃~25℃,时间2~5 h,真空度5~10Pa。其中,温度例如可以为但不限于为20、21、22、23、24或25℃,以及上述任意两点组成的温度范围;时间例如可以为但不限于为2、3、4或5;真空度例如可以为但不限于为5、6、7、8、9或10 Pa,以及上述任意两点组成的真空度范围。
本发明不限制提供的外泌体冻干保护剂和外泌体冻干制剂的制备方法适用的外泌体来源,任何细胞分泌的外泌体,或者来源于任何体液的外泌体均可使用上述外泌体冻干保护剂进行冻干保护。在一些可选的实施例中,采用上述冻干保护剂对来源于乳的外泌体进行冻干,能够使来源乳的外泌体在冻干后维持良好的生物活性,以及有效的缓解了冻干的外泌体聚集。
下面结合优选实施例进一步说明本发明的技术方案和技术效果。
实施例1
(1)牛奶外泌体缓冲液置换
将100mL 4FF分子筛层析柱使用pH 7.4 20 mmol/L TRIS缓冲液平衡完毕后,取30mL经层析纯化后的牛奶外泌体上样至层析柱上,收集外水峰样品,牛奶外泌体此时所处的缓冲液即为pH 7.4 20 mmol/L TRIS缓冲液。
(2)冻干前样品制备
向已完成缓冲液置换的牛奶外泌体中加入冻干保护剂海藻糖、甘露醇、明胶水解物及精氨酸,使其终浓度分别为5 %w/v、5 %w/v、0.1 %w/v及100 mmol/L,TRIS缓冲液浓度为20 mmol/L,牛奶外泌体浓度为300μg/mL。样品制备完成后使用移液枪向每瓶2 mL西林瓶中加入1 mL样品,胶塞半压塞后放入冻干机中。
(3)冷冻干燥
冻干工艺如表1所示:
表1. 实施例1冷冻干燥工艺
实施例2
(1)牛奶外泌体缓冲液置换
将100 mL 4FF分子筛层析柱使用pH 7.4 20mmol/L TRIS缓冲液平衡完毕后,取30mL经层析纯化后的牛奶外泌体上样至层析柱上,收集外水峰样品,牛奶外泌体此时所处的缓冲液即为pH 7.4 20 mmol/L TRIS缓冲液。
(2)冻干前样品制备
向已完成缓冲液置换的牛奶外泌体中加入冻干保护剂海藻糖、甘露醇、明胶水解物及精氨酸,使其终浓度分别为5 %w/v、5 %w/v、0.5 %w/v及400 mmol/L,TRIS缓冲液浓度为20 mmol/L,牛奶外泌体浓度为300 μg/mL。样品制备完成后使用移液枪向每瓶2 mL西林瓶中加入1 mL样品,胶塞半压塞后放入冻干机中。
(3)冷冻干燥
冻干工艺如表2所示:
表2. 实施例2冷冻干燥工艺
实施例3
(1)牛奶外泌体缓冲液置换
将100 mL 4FF分子筛层析柱使用pH 7.4 20 mmol/L TRIS缓冲液平衡完毕后,取30 mL经层析纯化后的牛奶外泌体上样至层析柱上,收集外水峰样品,牛奶外泌体此时所处的缓冲液即为pH 7.4 20 mmol/L TRIS缓冲液。
(2)冻干前样品制备
向已完成缓冲液置换的牛奶外泌体中加入冻干保护剂海藻糖、甘露醇、明胶水解物及精氨酸,使其终浓度分别为5 %w/v、5 %w/v、0.5 %w/v及400 mmol/L,TRIS缓冲液浓度为20 mmol/L,牛奶外泌体浓度为300 μg/mL。样品制备完成后使用移液枪向每瓶2 mL西林瓶中加入1 mL样品,胶塞半压塞后放入冻干机中。
(3)冷冻干燥
冻干工艺如表3所示:
表3. 实施例3冷冻干燥工艺
实施例4
实施例4与实施例1的区别仅在于,向已完成缓冲液置换的牛奶外泌体中加入冻干保护剂海藻糖、甘露醇、明胶水解物及精氨酸,使其终浓度分别为1 %w/v、5 %w/v、0.1 %w/v及500 mmol/L,TRIS缓冲液浓度为10 mmol/L,牛奶外泌体浓度为600 μg/mL。
实施例5
实施例5与实施例1的区别仅在于,向已完成缓冲液置换的牛奶外泌体中加入冻干保护剂海藻糖、甘露醇、明胶水解物及精氨酸,使其终浓度分别为5 %w/v、1 %w/v、0.5 %w/v及50 mmol/L,TRIS缓冲液浓度为50 mmol/L,牛奶外泌体浓度为100 μg/mL。
实施例6
实施例6与实施例1的区别仅在于,采用蔗糖替换海藻糖。
实施例7
实施例7与实施例1的区别仅在于,采用丙三醇替换甘露醇。
对比例1
(1)冻干前样品制备:
向经层析后的牛奶外泌体中加入冻干保护剂海藻糖、甘露醇,使其终浓度分别为5%w/v、5 %w/v,缓冲液为pH 7.4的20 mmol/L磷酸盐缓冲液,牛奶外泌体浓度为300 μg/mL。样品制备完成后使用移液枪向每瓶2mL西林瓶中加入1mL样品,胶塞半压塞后放入冻干机中。
(2)冷冻干燥
冻干工艺如表4所示:
表4. 对比例1冷冻干燥工艺
效果例1
冻干完成后检测各样品粒径及形态:实施例1~实施例7以及对比例1制备的冻干外泌体,样品粒径及形态结果分别如图1~图16所示,粒径分布结果对比如图17所示。从各实施例和对比例的样品粒径分布可以看出,实施例提供的冻干保护剂能够有效的预防外泌体聚集,其中实施例2提供的冻干保护剂能够使冻干的外泌体更多的分布于更小的粒径范围中;而对比例1提供的冻干保护剂使外泌体冻干后存在较多的大粒径颗粒,说明其不能有效的阻止外泌体在冻干过程中聚集,明胶水解物和精氨酸的添加,以及以Tris缓冲液作为缓冲体系能够有效的阻止外泌体在冻干过程中聚集。
效果例2
在人皮肤成纤维细胞的培养基中,添加冻干后的牛奶外泌体至终浓度0.067%(w/w),实验组分别添加实施例1~7和对比例1的冻干后的牛奶外泌体,以PBS作为空白对照样本。37℃,5%的CO
表5.
实施例和对比例冻干后外泌体粒径分布结果对比如图17所示,冻干后外泌体活性对比结果如图18所示。从图中可发现实施例与对比例在冻干后外泌体粒径和活性保护上具有统计学差异,可以说明在牛奶外泌体冻干工艺过程中添加不同浓度的明胶水解物及精氨酸可在冻干过程中有效抑制牛奶外泌体的聚集,以及保护牛奶外泌体的生物活性。
实施例2与实施例3相比,通过在冻干工艺中增加退火工艺,实施2可以将一次干燥的时间从30 h降低至15 h,极大的缩短了冻干工艺时间,整个工艺的冻干效率提高了41.1%,同时冻干后的牛奶外泌体在活性和粒径上没有差异。工艺时间的缩短有利于工业化生产及能耗的降低。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 无创超声处理细胞在制备外泌体中的应用、外泌体及其制备方法和应用
- 外泌体的制备及构建外泌体小RNA文库的方法
- 一种冻干保护剂、用其制备普洱茶用直投式冻干菌剂的方法与应用
- 一种冻干保护剂、用其制备普洱茶用直投式冻干菌剂的方法与应用
- 一种培养间充质干细胞提取外泌体的方法、外泌体冻干剂及制备方法
- 一种外泌体冻干保护剂和冻干粉复苏液及其应用
