制造双官能团化合物的方法、双官能团化合物的超纯形式以及包括所述双官能团化合物的剂型
文献发布时间:2023-06-19 19:30:30
相关申请交叉引用
本申请要求于2020年5月9日提交的美国临时申请第63/022,475号、于2021年2月12日提交的美国临时申请第63/149,143号以及于2021年4月20日提交的美国临时申请第63/177,378号的优先权和权益。这些申请出于所有目的通过引用整体并入本文。
技术领域
本申请涉及一种双官能团化合物,其已被证明是靶蛋白泛素化和通过泛素蛋白酶体系统进行降解的有用调节剂。具体地说,本申请涉及一种用于制造双官能团化合物的工艺。本申请进一步涉及双官能团化合物的结晶形式、无定形形式、超纯形式和稳定形式。本申请还涉及包括所述双官能团化合物的口服剂型(例如,片剂)及其制备方法,以及治疗癌症(例如,前列腺癌)的方法,所述包括向需要这种治疗的受试者施用治疗有效量的本发明剂型。
关于联邦政府资助研究的声明
本发明是在由美国国家癌症研究所授予的授权号1R44CA203199-01下由政府支持进行的。政府对本发明拥有某些权利。
背景技术
大多数小分子药物在紧密且明确限定的口袋中与酶或受体结合。相比之下,众所周知,蛋白质-蛋白质相互作用很难使用小分子进行靶向,因为它们的接触面很大,并且通常涉及浅凹槽或平坦的界面。E3泛素连接酶(其中数百种在人体中是已知的)赋予针对泛素化的底物特异性,并且由于其对某些蛋白质底物的特异性而成为有吸引力的治疗靶标。E3连接酶配体的开发已被证明具有挑战性,部分原因是它们必须破坏蛋白质-蛋白质相互作用。然而,最近的开发已经提供了与这些连接酶结合的特异性配体。例如,自从发现第一个小分子E3连接酶抑制剂努特林(nutlin)以来,已经报道了靶向E3连接酶的另外的化合物,尽管该领域尚未开发。
一种具有特殊治疗潜力的E3连接酶是小脑蛋白(cereblon),其是一种在人体中由CRBN基因编码的蛋白质。CRBN直系同源物从植物到人类都是高度保守的,这表明了其生理重要性。小脑蛋白与受损的DNA结合型蛋白1(DDB1)、Cullin-4A(CUL4A)和cullin调节剂1(ROC1)形成E3泛素连接酶复合物。此复合物使几种其它蛋白质泛素化。通过尚未完全阐明的机制,靶蛋白的小脑蛋白泛素化导致成纤维细胞生长因子8(FGF8)和成纤维细胞生长因子10(FGF10)的水平升高。FGF8进而调节几个发育过程,如肢体和听觉囊泡的形成。最终结果是,此泛素连接酶复合物对于胚胎中的肢体生长是重要的。在不存在小脑蛋白的情况下,DDB1与DDB2形成充当DNA损伤结合型蛋白的复合物。
已被批准用于治疗许多免疫学适应症的沙利度胺(thalidomide)还已被批准用于治疗某些赘生性疾病,包含多发性骨髓瘤。此外,沙利度胺及其几种类似物目前正在研究用于治疗各种其它类型的癌症。虽然沙利度胺抗肿瘤活性的确切机制仍在仍探明,但已知其抑制血管生成。论述酰亚胺生物学的近期文献包含Lu等人《科学(Science)》343,305(2014)和
值得注意的是,已知沙利度胺及其类似物(例如泊马度胺和来那度胺)结合小脑蛋白,并改变复合物的特异性,以诱导Ikaros(IKZF1)和Aiolos(IKZF3)——多发性骨髓瘤生长所必需的转录因子——的泛素化和降解。事实上,小脑蛋白的较高表达与酰亚胺药物治疗多发性骨髓瘤的功效增加提高有关。
雄激素受体(AR)属于核激素受体家族,其被如睾酮和二氢睾酮等雄激素活化(《药理学评论(Pharmacol.Rev.)》2006,58(4),782-97;《维生素和激素(Vitam.Horm.)》1999,55:309-52.)。缺乏雄激素时,AR被细胞溶质中的热休克蛋白90(Hsp90)结合。当雄激素结合AR时,其构形发生变化,从Hsp90释放AR并且暴露核定位信号(NLS)。NLS使得AR能够易位到细胞核中,其中AR充当转录因子以促进负责雄性性特征的基因表达(《内分泌学评论(Endocr.Rev.)》1987,8(1):1-28;《分子内分泌学(Mol.Endocrinol.)》2002,16(10),2181-7)。AR缺乏导致雄激素不敏感综合征,以前称为睾丸女性化症。
虽然AR负责雄性性特征的发育,但它也是某些癌症(包含前列腺癌)中有充分记录的致癌基因(《内分泌学评论》2004,25(2),276-308)。AR活性的常用测量靶标是分泌型前列腺特异性抗原(PSA)蛋白。前列腺癌的当前治疗方案涉及利用两种方法之一抑制雄激素-AR轴。第一种方法依赖于雄激素的减少,而第二种旨在抑制AR功能(《自然评论:药物发现(Nat.Rev.Drug Discovery)》,2013,12,823–824)。尽管开发了有效的靶向疗法,但大多数患者产生耐药性并且疾病进展。治疗前列腺癌的替代方法涉及消除AR蛋白。由于AR是多种形式的前列腺癌中肿瘤发生的关键驱动因素,因此消除它可能会产生治疗上有益的响应。
本发明制备和使用的双官能团化合物是化合物A,其分子式为C
化合物A作为
发明内容
本公开提供了N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]-6-[4-({4-[2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代-2,3-二氢-1H-异吲哚-5-基]哌嗪-1-基}甲基)哌啶-1-基]哒嗪-3-甲酰胺的超纯形式、结晶形式、无定形形式和调配物,其在本文中被称为化合物A,以及用于制造化合物A的方法:
在一方面,本申请涉及一种在有需要的受试者中治疗前列腺癌的方法,所述方法包括向所述受试者施用治疗有效量的化合物A化合物。在一个实施例中,所述方法进一步包括施用另外的抗癌剂。
在一方面,本公开提供了一种化合物A的结晶形式,其具有包括7.6°±0.2°2θ、11.5°±0.2°2θ和17.6°±0.2°2θ处的峰的粉末x射线衍射图,其中所述粉末x射线衍射图是使用Cu Kα辐射在
另一方面,本公开提供了一种化合物A的结晶形式,其具有包括11.0°±0.2°2θ、16.1°±0.2°2θ和17.9°±0.2°2θ处的峰的粉末x射线衍射图,其中所述粉末x射线衍射图是使用Cu Kα辐射在
另一方面,本公开提供了用于制造化合物A的工艺,其中所述工艺包括使N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-甲酰基哌啶-1-基)哒嗪-3-甲酰胺(中间体3)与2-(2,6-二氧代哌啶-3-基)-5-氟-6-(哌嗪-1-基)异吲哚啉-1,3-二酮盐酸盐(中间体5)和还原剂发生还原胺化,以提供化合物A:
另一方面,本公开提供了一种可用于合成化合物A的中间体,所述中间体是6-氯-N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)哒嗪-3-甲酰胺(中间体4),
另一方面,本公开提供了一种化合物A的超纯形式,具纯度大于约95wt%。
另一方面,本公开提供了用于制造化合物A的无定形形式的工艺,其中所述工艺包括以下步骤:
(1)将结晶化合物A溶解在溶剂中,得到化合物A的溶液;
(2)将来自步骤(1)的所述化合物A的溶液引入喷雾干燥机中,以产生化合物A的无定形形式;以及
(3)干燥所述化合物A的无定形形式以除去残留溶剂。
制备化合物A的无定形形式的替代方法可以包含冻干、热熔挤出、研磨或高剪切混合。
另一方面,本公开提供了一种口服剂型,其包括一种或多种药学上可接受的赋形剂和化合物A,其中所述口服剂型选自由片剂、小袋或胶囊组成的组。
在优选的方面,所述口服剂型包括一种或多种药学上可接受的赋形剂和化合物A的超纯形式。
另一方面,本公开提供了制造片剂化合物A的工艺,所述工艺包括以下步骤:
(1)将一种形式的化合物A与至少一种药学上可接受的赋形剂共混以产生粉末;
(2)将来自步骤(1)的所述粉末脱块,加入至少一种药学上可接受的赋形剂,并共混以产生第一共混物;
(3)将来自步骤(2)的所述共混物造粒,并使所得粉末通过筛网以产生多个颗粒;
(4)向来自步骤(3)的所述至少一个颗粒中加入至少一种药用赋形剂,并共混以产生第二共混物;以及
(5)将来自步骤(4)的所述第二共混物压缩成一个或多个片剂。
另一方面,本公开提供了在受试者中治疗癌症的方法,所述方法包括向需要这种治疗的受试者施用本公开的一种或多种单位剂型(例如,片剂)。在一个实施例中,所述方法进一步包括施用另外的抗癌剂。
前述通用应用领域仅以实例的方式给出并且不旨在限制本公开或所附权利要求的范围。根据本发明的权利要求、说明书和实例,本领域的普通技术人员将理解与本公开的组合物、方法和工艺相关的另外的目的和优点。例如,可以以多种组合利用本发明的各个方面和实施例,所有这些组合都由本说明书明确地加以考虑。这些另外的优点、目的和实施例明确地包含在本公开的范围内。通过引用并入用于阐明本发明的背景并且在特定情况下提供有关实践的另外的细节的本文所使用的出版物和其它材料。
在适用或未特别声明的情况下,考虑本文描述的任何一个实施例都能够与任何其它一个或多个实施例组合,即使实施例在本公开的不同方面下进行描述。
附图说明
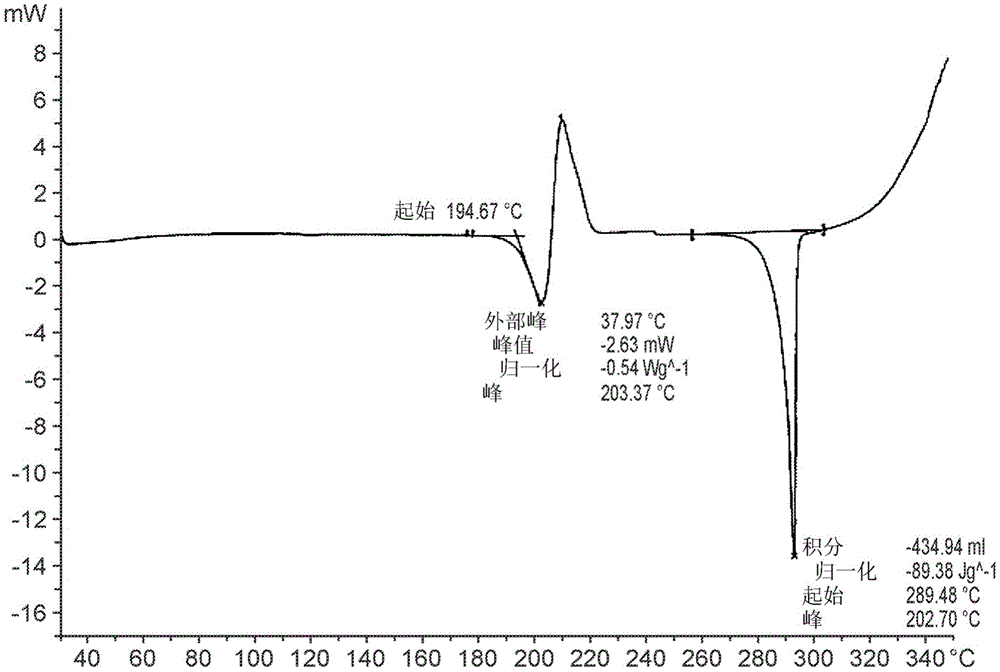
图1是化合物A的差示扫描量热图。
图2是在化合物A的实验室批次上得到的化合物A的动态蒸气溶液(DVS)等温线图,其粉末X射线衍射图与图3A中相同。
图3A是化合物A的形式2的粉末X射线衍射图,并且图3B是包含图3A中的衍射图的峰列表的表。
图3C是化合物A的晶型4的粉末X射线衍射图,并且图3D是包含图3C中的衍射图的峰列表的表。
图4是化合物A在氘代二甲亚砜(DMSO-d
图5是化合物A在氘代二甲亚砜(DMSO-d
图6是化合物A的高分辨率质谱图,化合物A的高分辨率质谱(MS)分析是在傅里叶变换模式下使用正离子电喷雾[高分辨率电喷雾电离质谱法(HR-ESI)]在Thermo OrbitrapMS上进行流动注射分析而进行的。
图7示出了由来自化合物A的高分辨率质谱图的812.308母离子的MS/MS碎裂产生的主峰,并且图8A和图8B是离子图和对应的表,其示出了观察到的MS/MS离子(MS
图9是在配备DuraSamplIR金刚石ATR探头的Bomem MB-102FTIR光谱仪上获得的化合物A的红外光谱。为化合物A的结构提供进一步支持的关键特征是2225cm
图10示出了通过筛分分析确定的纯喷雾干燥的化合物A的片剂的尺寸分布。
图11是一系列折线图,其示出了结晶对比无定形化合物A API的溶解度。API(1mg/mL)存在于胃部条件(pH=2),所述胃部条件在30分钟时用FaSSIF稀释2倍以将pH提高至6.5。(API=活性药物成分;FaSSIF=空腹状态模拟肠液)。
图12是一系列折线图,其示出了在多个尺度上产生的喷雾干燥的无定形化合物A的非下沉溶解。API(500μg/mL)存在于胃部条件(pH=2),所述胃部条件在30分钟时用FaSSIF稀释2倍以将pH提高至6.5。
图13是一系列折线图,其示出了原型片剂在900mL的37℃50mM Na
图14是无定形化合物A喷雾干燥中间产物的制造工艺的流程图。
图15是化合物A片剂的制造工艺的流程图。
图16A是第一代合成法生产的粗品化合物A的色谱图。色谱柱:Shim-pack XR-ODS,2.2μm 3.0x 50mm。流动相A:水/0.05%TFA。流动相B:乙腈/0.05%TFA。流速:1.2毫升/分钟。柱温40℃。检测器,UV 254nm。图16B是用于获得图16A中的色谱图的溶剂梯度。图16C是第一代合成法生产的通过制备型HPLC纯化后的化合物A的色谱图。色谱柱:Shim-pack XR-ODS,2.2μm 3.0x 50mm。流动相A:水/0.05%TFA。流动相B:乙腈/0.05%TFA。流速:1.2毫升/分钟。柱温40℃。检测器,UV 254nm。图16D是用于获得图16C中的色谱图的溶剂梯度
图17A是第二代合成法生产的粗品化合物A的色谱图。色谱柱:Atlantis T3,3μm,4.6×150mm。流动相A:0.1% TFA,于水中。流动相B:0.05%TFA,于75:25ACN/MeOH中。流速:1.0毫升/分钟。柱温45℃。检测器:260nm。图17B是第二代合成法生产的纯化的化合物A的色谱图。色谱柱:Atlantis T3,3μm,4.6×150mm。流动相A:0.1% TFA,于水中。流动相B:0.05% TFA,于75:25ACN/MeOH中。流速:1.0毫升/分钟。柱温45℃。检测器:260nm。图17C是用于获得图17A和图17B中的色谱图的溶剂梯度。
图18A是第三代合成法生产的粗品化合物A的色谱图。色谱柱:Atlantis T3,3μm,4.6×150mm。流动相A:水,带有0.1% TFA。流动相B:75:25乙腈/MeOH,带有0.05% TFA。柱温:45℃。检测器:260nm。图18B是用于获得图18A中的色谱图的溶剂梯度。
图19是第二代合成法生产的中间体4在氘代二甲亚砜(DMSO-d
图20是第二代合成法生产的中间体8在氘代二甲亚砜(DMSO-d
图21是第二代合成法生产的中间体9在氘代二甲亚砜(DMSO-d
图22是第二代合成法生产的中间体5在氘代二甲亚砜(DMSO-d
图23是第三代合成法生产的中间体2在氘代二甲亚砜(DMSO-d
图24是第三代合成法生产的中间体3在氘代二甲亚砜(DMSO-d
图25是第三代合成法生产的化合物A在氘代二甲亚砜(DMSO-d
图26是第五代合成法生产的纯化的化合物A的色谱图。
图27示出了5%、10%、20%和40% SDI片剂调配物之间的溶解度比较。竖直线表示当桨速从75RPM增加至250RPM时的“无限”旋转点。
图28示出了负载5%和20% SDI的片剂调配物(D1、D2、D3和D4)之间的溶解度比较。竖直线表示当桨速从75RPM增加至250RPM时的“无限”旋转点。
图29示出了D2、G1*和G2*片剂组合物(525mg片剂)之间的溶解度比较。归一化以进行可变测定,直至90分钟时间点。竖直线表示当桨速从75RPM增加至250RPM时的“无限”旋转点。
图30A和图30B示出了颗粒(A)和最终共混物(B)之间的颗粒尺寸比较
图31示出了在2.0和2.5MPa拉伸强度下压缩的D2片剂和G2预演示片剂(525mg片剂)之间的溶解度比较。归一化以进行可变测定,直至90分钟时间点。
图32示出了20% API的化合物A最终共混演示批次与预演示批次之间的颗粒尺寸比较。
图33示出了35mg、105mg和140mg演示批次片剂之间的溶解度比较。
具体实施方式
本公开在某些方面与以下各项相关:美国专利申请序列号15/730,728,作为美国专利第10,584,101号发布;美国专利申请序列号16/577,901,作为美国专利第10,844,021号发布;以及美国临时专利申请序列号62/528,385和62/406,888。本公开在某些方面与美国专利申请序列号17/075,808(现作为US 2021/0113557公开)和临时专利申请序列号US62/924,655、62/945,418、63/028,843和63/032,453相关。这些申请的每一个均出于所有目的通过引用整体并入本文。
定义
除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。本说明书所使用的术语仅旨在描述特定实施例,而不旨在限制本发明的范围。
在提供值范围的情况下,应当理解,所述范围包含该范围内的两个端点以及所有中间值。
以下术语用于描述本公开。在本文中未具体定义一个术语的情况下,该术语被普通技术人员赋予了本领域认可的含义,所述普通技术人员将该术语在上下文中应用于其在描述本发明中的用途。
如本文和所附权利要求中所使用的,冠词“一个和一种(a/an)”在本文中用于指代所述冠词的一个或多于一个(即,至少一个)语法对象,除非上下文清楚地另外指明。例如,“超纯形式”是指一种超纯形式或一种以上的超纯形式。
如本文在说明书和权利要求中所使用的,短语“和/或”应被理解为意指“其中之一或两者”。除了由“和/或”从句具体标识的要素之外,其它要素可以任选地存在。因此,作为非限制性实例,当与如“包括”等开放式语言结合使用时,对“A和/或B”的提及在一个实施例中可以仅指代A(任选地包含B以外的要素);在另一个实施例中仅指代B(任选地包含A以外的要素);在又一个实施例中指代A和B两者(任选地包含其它要素)。
如本文在说明书和权利要求中所使用的,“或”应被理解为具有与如上文所定义的“和/或”相同的含义。例如,当将列表中的项目分开时,“或”或“和/或”应被解释为包含性的,即,包含许多要素或要素列表中的至少一个要素、但是还包含多于一个要素,以及任选地其它未列出的项目。只有明确地指示相反的术语,如“……中的仅一个”或“……中的恰好一个”或者在权利要求中使用时,“由……组成”将指代包含多个要素或要素列表中的恰好一个要素。一般而言,当前面带有排他性术语,如“任一个”、“……中的一个”、“……中的仅一个”、或“……中的恰好一个”时,如本文所使用的,术语“或”应当仅被解释为指示排他性替代形式(即“一个或另一个,但非两者”)。
在权利要求以及说明书中,所有过渡性短语,如“包括”、“包含”、“携带”、“具有”、“含有”、“涉及”、“容纳”、“由……构成”等应当被理解为是开放式的,即是指包含但不限于。如美国专利局专利审查程序手册第2111.03节所述的,只有过渡性短语“由……组成”和“基本上由……组成”应分别是封闭式或半封闭式过渡性短语。
如本文在说明书和权利要求中所使用的,关于一个或多个要素的列表的短语“至少一个”意指选自要素列表中的任何一个或多个要素的至少一个要素,但不一定包含要素列表内具体列出的每个要素中的至少一个并且不排除要素列表中的要素的任何组合。该定义还允许除了在短语“至少一个”所指的要素列表内具体标识的要素之外,可以任选地存在无论与具体标识的那些要素相关还是不相关的要素。因此,作为非限制性实例,“A和B中的至少一个”(或等效地“A或B中的至少一个”或等效地“A和/或B中的至少一个”)在一个实施例中可以指代至少一个、任选地包含多于一个A,而不存在B(并且任选地包含除了B之外的要素);在另一个实施例中可以指代至少一个、任选地包含多于一个B,而不存在A(并且任选地包含除了A之外的要素);在又另一个实施例中可以指代至少一个、任选地包含多于一个A,以及至少一个、任选地包含多于一个B(并且任选地包含其它要素);等。
还应该理解,除非上下文明确相反地指出,否则在本文所描述的包含多于一个步骤或动作的某些方法中,方法的步骤或动作的顺序不一定限于叙述方法的步骤或动作的顺序。
术语“共同施用(co-administration)”和“共同施用(co-administering)”或“组合疗法”可以指代同时施用(同时施用两种或更多种治疗剂)和时变施用(在与施用另外的一种或多种治疗剂不同的时间施用一种或多种治疗剂),只要治疗剂在一定程度上同时存在于患者中,优选地以有效量存在于患者中。在某些优选的方面,本文所述的一种或多种本发明化合物与至少一种另外的生物活性剂(尤其包含抗癌剂的生物活性药剂)组合共同施用。在特别优选的方面,化合物的共同施用产生协同活性和/或疗法,如例如,抗癌活性。
术语“有效”可以意指但不限于活性药物成分的量/剂量,当在其预定用途的背景下使用时,其在需要此类治疗或接受此类治疗的受试者中实现或足以预防病状、病症或疾病状态,抑制其发生,改善、延迟或治疗其症状(在一定程度上,优选地完全缓解症状)。术语“有效”包括所有其它有效量或有效浓度术语,例如,“有效量/剂量”、“药学有效量/剂量”或“治疗有效量/剂量”,这些术语在本申请中以其它方式描述或使用。
有效量取决于年龄、体重、性别、既往患者病史或家族史、疾病的类型和严重程度、使用的组合物、施用途径、治疗阶段、正在治疗的哺乳动物的类型、所考虑的特定哺乳动物的物理特性、同时用药以及医学领域技术人员将识别的其它因素。确切的量可以由本领域技术人员根据临床数据和医学经验使用已知技术来确定(参见例如,Lieberman,《药物剂型(Pharmaceutical Dosage Forms)》(第1-3卷,1992);Lloyd,《药物配制的艺术、科学和技术(The Art,Science and Technology of Pharmaceutical Compounding)》(1999);Pickar,《剂量计算(Dosage Calculations)》(1999);以及《雷明顿:药学的科学与实践(Remington:The Science and Practice of Pharmacy)》,第20版,2003,编者:Gennaro,利平科特·威廉斯·威尔金斯出版公司(Lippincott,Williams&Wilkins))。
术语“药理学组合物”、“药物组合物”、“治疗组合物”、“治疗调配物”和“药学上可接受的调配物”是本领域已知的。
术语“药学上可接受的”和“药理学上可接受的”是本领域已知的。
术语“药学上可接受的载体”和“药理学上可接受的载体”意指但不限于与药物施用相容的任何和所有溶剂、赋形剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂以及吸收延迟剂等。合适的载体在《雷明顿氏药物科学(Remington's Pharmaceutical Sciences)》(该领域的标准参考教科书)的最新版本中有所描述,所述文献通过引用并入本文中。这种载体或稀释剂的优选实例包含但不限于水、盐水、林格氏溶液、右旋糖溶液和5%人血清白蛋白。也可以使用脂质体和非水性媒剂,如固定油。此类介质和药剂用于药物活性物质的用途在本领域中是众所周知的。除非任何常规介质或药剂与活性化合物不相容,否则考虑在组合物中使用它们。补充的活性化合物也可以并入这些组合物中。
术语“全身施用”是指例如肠内或肠胃外施用并导致药物在血流中的全身吸收或积累,然后分布在整个身体中的施用途径。合适的形式部分地取决于用途或进入途径,例如口服、透皮或通过注射。例如,注射到血流中的药理学组合物应该是可溶的。其它要避免的因素包含毒性,以及阻止组合物或调配物发挥其作用的任何形式。
在一个实施例中,化合物A可以通过使用环糊精溶解在适合肠胃外施用的媒剂中。适用于该工艺的示例性环糊精包含但不限于磺基苯醚-β-环糊精和(2-羟丙基)-β-环糊精。
导致全身吸收的施用途径是已知的并且包含但不限于:静脉内、皮下、腹膜内、吸入、口服、口腔、舌下、透皮、眼内、鼻内、肺内、直肠、阴道和肌肉内。药物进入循环的速率是分子量或分子大小的函数。使用脂质体或其它包括化合物A的药物载体可以潜在地定位药物,例如在某些组织类型中,如网状内皮系统(RES)的组织。可促进药物与细胞表面(如淋巴细胞和巨噬细胞)的结合的脂质体调配物也可能是有用的。
术语“局部施用”是指将药剂递送到病变或疾病部位近端(例如,在约10cm内)的部位施用途径。
本发明的调配物优选地提供如本文所使用的“口服施用”是指片剂、胶囊、糖浆、粉末、颗粒、锭剂、溶液、酊剂、酏剂、乳剂、水凝胶、茶、膜、崩解片、漱口水等形式的肠内、口腔、唇下或舌下药物。
用于口服施用的合适形式可以包含一种或多种药学上可接受的赋形剂,包含例如载体、填充剂、表面活性剂、稀释剂、甜味剂、崩解剂、粘合剂、润滑剂、助流剂、着色剂、香料、稳定剂、涂料或其任意混合物。
载体包含药学上可接受的赋形剂和稀释剂,并且意指材料、组合物或媒剂,如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,其涉及将药剂从一个器官或身体的一部分携带或运输到受试者的另一个器官或身体的另一部分。实例包含但不限于碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶和聚合物(如聚乙二醇)。
填充剂包含但不限于甘露醇、蔗糖、山梨醇、木糖醇、微晶纤维素、乳糖、硅酸、硅化微晶纤维素、羟丙基甲基纤维素、羟丙基纤维素、淀粉、支链淀粉和快速溶解型碳水化合物(如Pharmaburst
表面活性剂包含但不限于非离子、阴离子、阳离子、两性或两性离子表面活性剂。合适的非离子表面活性剂的实例包含乙氧基化甘油三酯;脂肪醇乙氧基化物;烷基酚乙氧基化物;脂肪酸乙氧基化物;脂肪酰胺乙氧基化物;脂肪胺乙氧基化物;脱水山梨糖醇链烷酸酯;乙基化脱水山梨糖醇链烷酸酯;烷基乙氧基化物;Pluronics
稀释剂包含但不限于:碳水化合物,如单糖(葡萄糖)、低聚糖(蔗糖和乳糖(包含无水乳糖和乳糖一水合物));淀粉,如玉米淀粉、马铃薯淀粉、大米淀粉和小麦淀粉;预胶化淀粉;磷酸氢钙;和糖醇(山梨醇、甘露醇、赤藓糖醇和木糖醇)。
甜味剂包含但不限于蔗糖、高果糖玉米糖浆、果糖、葡萄糖、阿斯巴甜、安赛蜜K、三氯蔗糖、甜蜜素、糖精钠、纽甜、莱鲍迪甙A和其它甜叶菊类甜味剂。
崩解剂包含但不限于淀粉乙醇酸钠、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲基纤维素钠、交聚维酮、壳聚糖、琼脂、海藻酸、海藻酸钙、甲基纤维素、微晶纤维素、粉状纤维素、低级烷基取代的羟丙基纤维素、羟丙基淀粉、低取代的羟丙基纤维素、聚克立林钾、淀粉、预胶化淀粉、海藻酸钠、硅酸镁铝、聚克立林钾、聚维酮、淀粉乙醇酸钠、它们的混合物等。
粘合剂包含但不限于羟丙基甲基纤维素(HPMC)、羟丙基纤维素(HPC)、聚维酮、共聚维酮(乙烯基吡咯烷酮与其它乙烯基衍生物的共聚物)、甲基纤维素、阿拉伯胶粉、明胶、阿拉伯树胶、瓜尔豆胶、卡波姆(如卡波尔)和聚甲基丙烯酸酯。
润滑剂包含但不限于硬脂酸钙、单硬脂酸甘油酯、山嵛酸甘油酯、棕榈硬脂酸甘油酯、六方氮化硼、氢化植物油、轻矿物油、硬脂酸镁、矿物油、聚乙二醇、泊洛沙姆、苯甲酸钠、十二烷基硫酸钠、富马酸硬脂基钠、硬脂酸、滑石、硬脂酸锌、它们的混合物等。
助流剂包含但不限于二氧化硅、胶体二氧化硅、硅酸钙、硅酸镁、三硅酸镁、滑石、淀粉、它们的混合物等。
香料包含但不限于薄荷醇、薄荷油、薄荷烈酒、香兰素和杏仁油。
术语“泛素连接酶”指代促进泛素向特异性底物蛋白转移从而靶向底物蛋白以进行降解的蛋白质家族。例如,小脑蛋白是E3泛素连接酶蛋白,其单独地或与E2泛素缀合酶组合导致几个泛素分子共价附着到靶蛋白上的可用赖氨酸残基,从而靶向蛋白质以通过蛋白酶体进行降解。因此,E3泛素连接酶,单独或与E2泛素缀合酶复合,导致泛素转移到靶蛋白。通常,泛素连接酶参与多泛素化,使得第二个泛素附着到第一个泛素;第三个泛素附着到第二个泛素;并且第四个泛素附着到第三个泛素。这种多泛素化标记蛋白质以通过蛋白酶体进行降解。
在整个说明书中使用术语“患者”或“受试者”来指代动物,优选地,哺乳动物,更优选地,人或驯养或伴侣动物,向所述动物提供用根据本公开的组合物进行的治疗,包含预防性治疗。为了治疗特定类型的动物(如人类患者)特有的那些病状或疾病状态,术语“患者”是指该特定类型的动物,包含驯养或伴侣动物(如狗或猫)或农场动物(如马、牛、羊等)。一般而言,在本公开中,术语“患者”是指人类患者,除非从术语的使用上下文中另有说明或暗示。
“药学上可接受的盐”,如本文中关于本公开的化合物所使用的,是指该化合物的盐形式,其中抗衡离子通常被认为对患者或受试者的治疗是安全的,或者以其它方式呈现可接受的风险/益处特征,从而允许对患者或受试者进行治疗性施用。术语“药学上可接受的盐”,如本文中关于化合物所使用的,还可以包含这种盐的溶剂化物(例如,水合物),以及它们的共晶体。
代表性的“药学上可接受的盐”包含例如,水溶性和水不溶性盐,如乙酸盐、氨芪磺酸盐(amsonate)(4,4-二氨基芪-2,2-二磺酸盐)、苯磺酸盐、苯甲酸盐、碳酸氢盐、硫酸氢盐、酒石酸氢盐、硼酸盐、溴化物、丁酸盐、钙、依地酸钙、樟脑磺酸盐、碳酸盐、氯化物、柠檬酸盐、克拉维酸盐(clavulariate)、二盐酸盐、乙二胺四乙酸盐、乙二磺酸盐、丙酸酯十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、葡糖酸盐、谷氨酸盐、乙醇酰基对氨基苯胂酸盐、六氟磷酸盐、己基间苯二酚盐、海巴明(hydrabamine)、氢溴酸盐、盐酸盐、羟基萘甲酸盐、碘化物、异硫代硫酸盐、乳酸盐、乳糖醛酸盐、月桂酸盐、镁、苹果酸盐、马来酸盐、扁桃酸盐、甲磺酸盐、甲基溴、甲基硝酸盐、甲基硫酸盐、粘酸盐、萘磺酸盐、硝酸盐、N-甲基葡糖胺铵盐、3-羟基-2-萘甲酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐(1,1-亚甲基-双-2-羟基-3-萘甲酸盐,依伯酸盐(einbonate))、泛酸盐、磷酸盐/二磷酸盐、苦味酸盐、多聚半乳糖醛酸盐、丙酸盐、对甲苯磺酸盐、水杨酸盐、硬脂酸盐、碱式醋酸盐、琥珀酸盐、硫酸盐、磺基水杨酸盐、苏拉明酸盐(suramate)、单宁酸盐、酒石酸盐、茶氯酸盐、甲苯磺酸盐、三乙基碘以及戊酸盐。
“溶剂化物”意指化合物A的溶剂添加形式,其含有化学计量或非化学计量的量的溶剂。一些化合物具有在结晶固态中捕获固定摩尔比的溶剂分子,从而形成溶剂化物的趋势。如果溶剂是水,则所形成的溶剂化物是水合物,当溶剂是醇时,所形成的溶剂化物是醇化物(alcoholate)。水合物通过一种或多种水分子与其中水保留其分子状态为H
共晶体代表适合掺入药物固体剂型的新型原料药,并且应该能够使调配物科学家能够克服传统调配物开发过程中遇到的各种问题。共晶体可被视为多晶型、溶剂形态和盐的替代品,因为共晶体代表了一种解决与溶解度、结晶度和吸湿性等相关的问题的不同方法。有关共晶体的进一步讨论,请参阅:Aitipaumula等人“多晶型、盐和共晶体:名字里有什么?(Polymorphs,Salts,and Cocrystals:What's in a Name?)”《晶体生长与设计(Crystal Growth Des.)》2012,12,5,2147-2152;和Brittain“药物共晶体:即将到来的新原料药浪潮(Pharmaceutical Cocrystals:The Coming Wave of New Drug Substances)”《药物科学杂志(J.Pharm.Sci.)》2013,102,2,311-317;两者均通过引用整体并入本文。
术语“粉末X射线衍射图”、“PXRD图”,“PXRD”、“粉末X射线衍射图”、“X射线衍射图”或“XRPD”是指实验观察到的衍射图或从中得出的参数。粉末X射线衍射图的特征在于峰位置(横坐标)和峰强度(纵坐标)。
术语“2θ值”或“2θ”是指基于X射线衍射实验的实验设置的峰位置(以度为单位),并且是衍射图中常见的横坐标单位。实验设置要求,如果当入射光束形成具有某个晶格平面的角度θ(θ)时衍射反射,则以角度2θ(2θ)记录反射光束。本文中对特定固体形式的特定2θ值的提及旨在意指使用本文所述的X射线衍射实验条件测量的2θ值(以度为单位)。
如本文所提到的,“同位素衍生物”涉及用一个或多个稳定同位素进行同位素富集或标记(关于化合物的一个或多个原子)的化合物。因此,在一个实施例中,化合物A用一个或多个原子(如氘)代替一个或多个氢进行同位素富集或标记。
转移性前列腺癌(metastatic prostate cancer)或转移瘤(metastases)是指已从前列腺扩散到身体其它部位或器官(例如,骨骼、淋巴结、肝、肺、脑)的前列腺癌。
去势抵抗性前列腺癌(castrate-resistant prostate cancer或castration-resistant prostate cancer)(或对去势具有抵抗性的前列腺癌)是一种前列腺癌,即使体内睾酮的含量降低到非常低的水平,它也会继续生长。
转移性去势抵抗性前列腺癌是一种已经转移并且即使体内的睾酮含量降低到非常低的水平仍继续生长的前列腺癌。
如本文所使用的,“治疗(treating、treatment等)”描述将本发明的药物组合物施用于受试者或患者,用于对抗疾病、病状或病症的目的,其包含减少、减轻或消除疾病、病状或病症的一种或多种症状或并发症,或减少、减轻或消除所述疾病、病状或病症。
如本文所使用的,“预防(prevent、preventing等)”描述停止疾病、病状或病症的发作,或其一种或多种症状或并发症。
如本文所使用的,“C
如本文所使用的,“AUC”是指血浆浓度-时间曲线下的总面积,其是目标化合物的暴露的量度,并且是单剂量后或稳态下的浓度-时间曲线的积分。AUC以ng*H/mL(ng x H/mL)为单位表示,其中“H”是指小时。
如本文所使用的,“AUC
“AUC
如本文所使用的,关于口服剂型的“受控释放”或“CR”是指本公开的化合物根据预定的曲线从剂型中释放,而不是在立即释放曲线中释放,所述预定的曲线可以包含口服施用后在何时和何处发生释放和/或在特定时间段内的特定释放速率
如本文所使用的,关于本公开的口服剂型的“受控释放药剂”是指从剂型中修改本发明化合物的释放曲线的一种或多种物质或材料。受控释放药剂可以是有机的或无机的、天然存在的或合成的,如聚合物材料、甘油三酯、甘油三酯的衍生物、脂肪酸和脂肪酸的盐、滑石、硼酸、胶体二氧化硅、纤维素衍生物及其组合。
如本文所使用的,关于本公开的剂型的“肠溶包衣”是指围绕包括本公开化合物的核心并且在胃的酸性环境中保持基本完整但随后溶解在肠道的pH环境中的pH依赖性材料。
如应用于本文所述的CR口服剂型的“胃耐受”或“GR”是指本公开的化合物在受试者胃中的释放不应超过该剂型中的本公开的化合物的总量的5%、2.5%、1%或0.5%。
“干燥失重”是指在指定条件下由可被驱除的水和任何类型的挥发性物质引起的重量损失,以w/w/百分比表示。干燥失重可由本领域技术人员使用标准方法确定,包含例如,USP<731>。
“灼烧残渣(Residue on Ignition)”测试(也被称为硫酸化灰分测试)使用一种程序来测量在存在硫酸的情况下根据下述程序点燃样品时未从样品中挥发的残留物质的量。该测试通常用于确定有机物质中无机杂质的含量。灼烧残渣可由本领域技术人员使用标准方法测定,包含例如,USP<281>。
“COA”代表分析证书。
如本文所使用的,“口服剂型”是指含有特定量(剂量)的作为活性成分的本公开的化合物或其药学上可接受的盐和/或溶剂化物,以及非活性组分(赋形剂)的药物成品药,所述成品药被配制成适于口服施用的特定构型,如口服片剂、液体或胶囊。在一个实施例中,口服剂型包括片剂。在一个实施例中,口服剂型包括可评分的片剂。在一个实施例中,口服剂型包括舌下片剂。在一个实施例中,口服剂型包括胶囊,其可以完整地服用或用作洒在食物上(例如,苹果酱或酸奶)。在一个实施例中,口服剂型包括小袋。
如本文中所使用,术语“约”等,与数值或范围结合时,反映了由于实际和/或理论限制而存在本领域中已认知且容许的一定偏差水平的事实。例如,由于某些装置操作和/或进行测量的方式存在固有的差异,因此容许微小偏差。因此,术语“约”通常用于涵盖标准误差内的值。在一个实施例中,术语“约”作为如“约X”等定量表达的一部分,包含至多高于或低于X的10%的任何值,并且还包含落在X-10%与X+10%之间的任何数值(例如,X-5%和X+5%,或X-3%和X+3%)。因此,例如,约40g的重量可以包含36至44g的重量,包含端点;约100℃的温度可以包含90℃至110℃的温度,包含端点;并且约90–100℃的温度范围可以包含81–110℃的范围,包含端点。因此,例如,约50%的百分比组合物可以包含45%至55%之间的百分比组合物,包含端点。
如本文所使用的,“约0℃”包含-2℃至2℃的温度,包含端点。
如本文所使用的,术语“CDK抑制剂”是指在人体中抑制被称为细胞周期蛋白依赖性激酶(CDK)的酶的化合物。在一个实施例中,CDK抑制剂是CDK4/6抑制剂。如本文所使用的,术语“CDK4/6抑制剂”是指抑制CDK 4和/或6的化合物。CDK抑制剂的实例包含但不限于SHR6390、曲拉西利(trilaciclib)、lerociclib、AT7519M、迪纳西利(dinaciclib)、瑞博西利(ribociclib)、阿贝西利(abemaciclib)、哌柏西利(palbociclib)或其任何药学上可接受的盐。在一个实施例中,CDK抑制剂是哌柏西利或其药学上可接受的盐。
如本文所使用的,术语“PARP抑制剂”是指在人体中抑制被称为聚ADP核糖聚合酶(PARP)的酶的化合物。PARP抑制剂的实例包含但不限于奥拉帕尼(olaparib)、鲁卡帕尼(rucaparib)、他拉唑帕尼(talazoparib)、尼拉帕尼(niraparib)、维利帕尼(veliparib)、帕米帕尼(pamiparib)、CEP 9722、E7016、3-氨基苯甲酰胺、美呋帕尼(mefuparib)和AZD2281。
如应用于本文所述或要求保护的特定剂型、组合物、用途、方法或工艺的“包括(comprising或comprises)”意指所述剂型、组合物、用途、方法或工艺包含具体描述或权利要求中所述的所有要素,但不排除其它要素。“基本上由...组成(consists essentiallyof和consisting essentially of)”意指所述或要求保护的组合物、剂型、方法、用途或工艺不排除对所述组合物、剂型、方法、用途或工艺的物理、药理学、药代动力学性质或治疗效果不产生实质影响的其它材料或步骤。“由...组成(consists of和consisting of)”意指排除超过微量元素的其它成分和实质性方法或工艺步骤。
用于描述受试者的“禁食状况(Fasted condition)”或“禁食状态(fastedstate)”是指受试者在目标时间点(如施用化合物A的时间)之前至少4小时没有进食。在实施例中,处于禁食状态的受试者在施用本公开的化合物之前至少6小时、8小时、10小时或12小时中的任一者内没有进食。
本文用于描述受试者的“进食状况(fed condition)”或“进食状态(fed state)”意指受试者已经在目标时间点(如施用本公开的化合物的时间)之前少于4小时内进食。在一个实施例中,处于进食状态的受试者已经在施用本公开的化合物之前至少3小时、2小时、1小时或0.5小时中的任一者内进食。
如本文所使用的,“抗酸药物”是指在受试者中中和胃酸的物质。抗酸剂包含但不限于次水杨酸铋、法莫替丁(famotidine)和含有氢氧化铝和氢氧化镁的调味液体
除非另有说明,否则本文提供的所有百分比均为重量百分比,可以缩写为wt%或(w/w)。
在一个实施例中,如本文中提及化合物A所使用的,术语“超纯”是指本文描述的化合物A的任何结晶或无定形形式,其纯度等于或大于约95%、96%、97%、98%、99%、99.5或99.9wt%。
在一个实施例中,如本文中提及化合物A所使用的,术语“超纯”是指本文描述的化合物A的任何结晶或无定形形式,其含有少于约5%、4%、3%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%或0.1%的一种或多种杂质。
在一个实施例中,如本文中提及化合物A所使用的,术语“超纯”是指本文描述的化合物A的任何结晶或无定形形式,其纯度等于或大于约95%、96%、97%、98%、99%、99.5或99.9wt%,并且还含有少于约5%、4%、3%、2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%或0.1%的一种或多种杂质。
如本文所使用的,术语“杂质”是指不需要的化合物、痕量金属或溶剂,其污染化合物A。在一个实施例中,杂质是选自由以下组成的组的化合物:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。在一个实施例中,杂质是选自由以下组成的组的溶剂:二氯甲烷、甲醇和乙腈。
如本文中提及化合物A所使用的,“稳定”是指化合物A的形式,包含超纯形式、结晶形式、超纯结晶形式、非晶形式和超纯非晶形式,这些形式在一段时间(如6个月、12个月或24个月)内和特定条件(例如,温度和湿度)(如4℃、25℃或40℃)下稳定地保持纯度等于或大于95%、96%、97%、98%、99%、99.5%或99.9%。
化合物A是指以下化合物:N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]-6-[4-({4-[2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代-2,3-二氢-1H-异吲哚-5-基]哌啶-1-基}甲基)哌嗪-1-基]p哒嗪-3-甲酰胺,其具有分子式C
如本文所使用的,中间体1是指具有以下结构式的化合物:
如本文所使用的,中间体2是指具有以下结构式的化合物:
如本文所使用的,中间体3是指具有以下结构式的化合物:
如本文所使用的,中间体4是指具有以下结构式的化合物:
如本文所使用的,中间体5是指具有以下结构式的化合物:
如本文所使用的,中间体6是指具有以下结构式的化合物:
如本文所使用的,中间体7是指具有以下结构式的化合物:
如本文所使用的,中间体8是指具有以下结构式的化合物:
如本文所使用的,中间体9是指具有以下结构式的化合物:
如本文所使用的,中间体10是指具有以下结构式的化合物:
如本文所使用的,杂质1是指具有以下结构式的化合物:
如本文所使用的,杂质2是指具有以下结构式的化合物:
如本文所使用的,杂质3是指具有以下结构式的化合物:
如本文所使用的,杂质4是指具有以下结构式的化合物:
化合物A
化合物A中的原子可以如下进行编号:
中心碳10和7是介观,并且根据定义不具有手性并且根据定义不具有立体性。酰胺和醚分别在碳10和7上的1,4-反式关系由
化合物A在碳36处具有立体中心(下面用*表示)。化合物A的起始材料来自外消旋前体,因此该分子是外消旋的。因此,在一个实施例中,化合物A是指对映异构体(ent-1和ent-2)的50/50混合物,其具有以下结构:
如本文所使用的,化合物A是指作为完全ent-1、完全ent-2或ent-1和ent-2的任意混合物的化合物,包含例如,ent-1和ent-2的50/50(外消旋)混合物。
化合物A最初公开于美国专利申请第15/730,728号中,其被授予为美国专利第10,584,101号,并且通过引用整体并入本文。
化合物A的制造工艺
第一代工艺
用于化合物A的第一代制造工艺描述于美国专利第10,584,101号中,所述美国专利通过引用并入本文。该工艺在下面的方案1和本文的实例部分中进行了总结。
方案1.化合物A的第一代制造工艺
第二代、第三代、第四代和第五代工艺。
第二代、第三代、第四代和第五代工艺在下文和本文的实例中公开。与第一代合成相比,这些工艺具有有利的性质。例如,第一代工艺生产的化合物A纯度约为98%。相比之下,后代工艺产生的化合物A纯度更高,例如大于98%、大于99%、大于99.5%等。
第二代工艺
用于化合物A的第二代制造工艺在下面的方案2-4和本文的实例中描述。
用于制造中间体4的合成示于下面的方案2中。
方案2.用于制造中间体4的合成工艺。
步骤1涉及在45℃下将市售的含2,4-二氯苯腈和((1r,4r)-4-羟基环己基)氨基甲酸叔丁酯的二甲基乙酰胺(DMA)与氢化钠进行SnAr反应,以得到中间体1。用水处理反应,并将沉淀物干燥,得到中间体1。在第二步中,通过在室温下在甲醇中加入乙酰氯,从中间体1中除去Boc保护基团,并将产物在甲基叔丁基醚中重结晶以得到中间体7。第三步涉及将中间体7和含6-氯哒嗪-3-羧酸的乙酸乙酯与三乙胺和丙烷膦酸酐(T3P)进行酰胺偶联,以提供中间体4。将反应用1N水性HCl淬灭,并将粗品中间体4用乙酸乙酯冲洗,过滤并干燥。将中间体4加入乙酸异丙酯和二甲基乙酰胺中,过滤,并用IPAc冲洗。
用于制造中间体5的合成示于下面的方案3中。
方案3.用于制造中间体5的合成工艺。
在第一步中,将市售的4,5-二氟邻苯二甲酸和3-氨基哌啶-2,6-二酮在乙酸/乙酸酯中回流,并将反应在水中淬灭,将沉淀物洗涤并干燥,得到中间体8。第二步涉及在90℃下将中间体8和市售的含Boc-哌嗪的N-甲基-2-吡咯烷酮(NMP)与碳酸氢钠进行SnAr反应,以得到中间体9。将反应混合物用水/乙腈处理,过滤,用水洗涤,并干燥,以得到中间体9。在第三步中,用甲醇和二氯甲烷中的HCl从中间体9中除去Boc保护基团。将反应混合物过滤并用甲醇和二氯甲烷冲洗,得到粗品中间体5作为盐酸盐。将中间体5溶解在水和二甲基乙酰胺中,并在异丙醇中重结晶。
方案4.化合物A的第二代制造工艺
该工艺中的步骤1包含在90–100℃下将中间体4和市售的含哌啶-4-基甲醇的二甲基乙酰胺(DMA)与N,N-二异丙基乙胺进行SnAr反应,以得到中间体2。将反应混合物用水处理并用乙酸异丙酯(IPAc)萃取。将异丙基乙酸酯层用水洗涤并浓缩,得到呈灰白色结晶固体的中间体2。
在一些实施例中,步骤1进一步包括通过在有机溶剂中重结晶来纯化中间体2的步骤。在一些实施例中,所述重结晶进一步包括以下步骤:
i)将有机溶剂中的粗品中间体2与促进结晶的药剂组合;
ii)减少有机溶剂的体积;
iii)添加额外量的有机溶剂;
iv)将来自第iii)部分的混合物在高于30℃的温度下搅拌约30至约60分钟或更长时间;
v)将来自第iii)部分的混合物冷却至低于25℃的温度,持续约30至约60分钟或更长时间;
vi)减少有机溶剂的体积;
vii)将来自第vi)部分的混合物在低于25℃的温度下搅拌约30分钟、约45分钟、约60分钟、约75分钟、约90分钟、约105分钟或约120分钟或更长时间;以及
vii)过滤混合物,得到纯化的中间体2。
在一些实施例中,有机溶剂是乙酸异丙酯。在一些实施例中,促进结晶的药剂是中间体2的籽晶。在一些实施例中,步骤ii)中有机溶剂体积的减少是通过真空蒸馏进行的。在一些实施例中,步骤iv)的温度为约50℃。在一些实施例中,步骤v)的温度为约20℃。在一些实施例中,步骤vii)的温度为约10℃。
步骤2是在<10℃下将中间体2与0.01当量的TEMPO(2,2,6,6-四甲基哌啶-1-基)氧基和1当量的次氯酸钠(4.5%水溶液)在二氯甲烷中氧化,以得到中间体3。将反应用5%Na
在一些实施例中,步骤2进一步包括通过重结晶来纯化中间体3的步骤。例如,在一个实施例中,向乙腈溶液中加入水,得到呈白色结晶固体的中间体3。在一些实施例中,在存在溶剂和反溶剂的情况下发生重结晶。在一些实施例中,所述重结晶包括以下步骤:
i)将粗品中间体3与溶剂和反溶剂的混合物组合;
ii)搅拌粗品中间体3、溶剂和反溶剂的混合物;以及
iii)过滤混合物,得到纯化的中间体3。
在一些实施例中,i)中的溶剂是极性非质子有机溶剂,并且i)中的反溶剂是水性溶剂。在一些实施例中,溶剂包括乙腈。在一些实施例中,反溶剂是水。在一些实施例中,溶剂与反溶剂的比例为约1:1(v/v)。在一些实施例中,溶剂与反溶剂的比例为约1.04:1(v/v)。在一些实施例中,步骤ii)在15℃和20℃之间的温度下进行。在一些实施例中,步骤ii)在约18℃的温度下进行。在一些实施例中,步骤ii)在约20℃的温度下进行。在一些实施例中,步骤ii)的搅拌进行至少12小时、至少14小时、至少16小时或至少18小时。在一些实施例中,步骤ii)的搅拌进行约18小时。
步骤3是在5–10℃下使中间体3与中间体5在二甲基乙酰胺中与三乙酰氧基硼氢化钠(STAB)和三乙胺发生还原胺化,以得到化合物A。在一些实施例中,中间体3与中间体5的摩尔比为约1.1:1。在一些实施例中,中间体3与中间体5的摩尔比为约1.05:1。在一些实施例中,中间体3与中间体5的摩尔比介于约1:1和约1.1:1之间。将乙醇和水的混合物加入粗反应混合物中,并使化合物A沉淀为黄色固体。将粗品化合物A溶解在二氯甲烷:甲醇(9:1)的混合物中。将富含产物的溶液过滤并与乙醇进行蒸馏交换。从乙醇溶液结晶,得到呈浅黄色结晶固体的化合物A,将其在35–45℃下在真空中干燥。
第三代工艺
用于化合物A的第三代制造工艺在下面的方案5和实例中描述。
方案5.化合物A的第三代制造工艺
在第一步中,将中间体10和中间体7在DMAc中与DIPEA、氰基羟基亚氨基乙酸乙酯和1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDCI)在约40℃下偶联,然后用IPAc和水萃取,然后将有机层用IPAc冲洗并干燥,得到中间体2。
在一些实施例中,第一步进一步包括通过在有机溶剂中重结晶来纯化中间体2的步骤。在一些实施例中,有机溶剂是乙酸异丙酯。在一些实施例中,重结晶是通过减少有机溶剂的体积进行的。在一些实施例中,有机溶剂体积的减少是通过真空蒸馏进行的。
在<5℃下将中间体2与约0.003当量的TEMPO和约1当量的次氯酸钠(3.12%水溶液)用碳酸氢钠、溴化钠在二氯甲烷和水中氧化,得到中间体3。将粗品中间体3用二氯甲烷萃取,并与乙腈进行蒸馏交换。向乙腈溶液中加入水,得到呈白色结晶固体的中间体3。在5–10℃下使中间体3与中间体5在二甲基乙酰胺中与三乙酰氧基硼氢化钠(STAB)发生还原胺化,得到化合物A。在一些实施例中,中间体3与中间体5的摩尔比为约1.1:1。将乙醇和水的混合物加入粗反应混合物中,并使粗品化合物A沉淀。将粗品化合物A溶解在二氯甲烷:甲醇(9:1)的混合物中。将富含产物的溶液过滤并与乙醇进行蒸馏交换。从乙醇溶液结晶,得到呈浅黄色结晶固体的化合物A,将其在25℃下在真空中干燥。
在一些实施例中,在存在醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在仲醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在异丙醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在2-丁醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在2-戊醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在3-甲基2丁醇的情况下发生中间体2的氧化以得到中间体3。
在一个实施例中,第二代合成提供了一种化合物A的超纯形式,其纯度大于约95%。在某些实施例中,化合物A的超纯形式具有大于约96%、97%、98%、99%、99.5或99.9%的纯度。
在一个实施例中,第三代合成提供了一种化合物A的超纯形式,其纯度大于约95%。在某些实施例中,化合物A的超纯形式具有大于约96%、97%、98%、99%、99.5或99.9%的纯度。
第四代工艺
用于化合物A的第四代制造工艺在下面的方案6和实例中描述。
方案6.化合物A的第四代制造工艺
在第一步中,在约20℃下,通过2-吡啶醇1-氧化物(HOPO)和1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDCI)的催化,将中间体10与过量的中间体7在DMAc中与DIPEA进行偶联,以得到中间体2。在一些实施例中,中间体10与中间体7的摩尔比为约1.00:1.05。
在一些实施例中,第一步进一步包括通过在有机溶剂中重结晶来纯化中间体2的步骤。在一些实施例中,有机溶剂是乙酸异丙酯。在一些实施例中,重结晶是通过冷却有机溶剂进行的。在一些实施例中,有机溶剂被冷却至介于约15℃和约25℃之间的温度。在一些实施例中,有机溶剂被冷却至约20℃的温度。
在0℃下将中间体2与约0.01当量的TEMPO和约1当量的次氯酸钠用碳酸氢钠、溴化钠在二氯甲烷和水中氧化,得到粗品中间体3。将粗品中间体3用二氯甲烷萃取,并与四氢呋喃进行蒸馏交换。向四氢呋喃溶液中加入正庚烷,得到呈白色结晶固体的中间体3。
在一些实施例中,在存在醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在仲醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在异丙醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在2-丁醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在2-戊醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在3-甲基2丁醇的情况下发生中间体2的氧化以得到中间体3。
在0℃下使中间体3与中间体5在二甲基乙酰胺中与三乙酰氧基硼氢化钠(STAB)和N-甲基吗啉发生还原胺化,得到化合物A。在一些实施例中,中间体3与中间体5的摩尔比为约1.1:1。在一些实施例中,中间体5与N-甲基吗啉的比率介于约1.5:1和约2:1(w/w)之间。在一些实施例中,中间体5与N-甲基吗啉的比率为约1.7:1(w/w)。将乙醇和水的混合物加入粗反应混合物中,并使化合物A沉淀。将粗品化合物A溶解在二氯甲烷:甲醇(17:1w/w)的混合物中。将富含产物的溶液过滤并与乙醇进行蒸馏交换。从乙醇溶液结晶,得到呈浅黄色结晶固体的化合物A,将其在65℃下在真空中干燥。
在一个实施例中,第四代合成提供了一种化合物A的超纯形式,其纯度大于约95%。在某些实施例中,化合物A的超纯形式具有大于约96%、97%、98%、99%、99.5或99.9%的纯度。
第五代工艺
用于化合物A的第五代制造工艺遵循与上述第四代工艺相同的一般方案。
在第一步中,在约20℃下,通过2-吡啶醇1-氧化物(HOPO)和EDCI的催化,将中间体10与过量的中间体7在DMAc中与DIPEA进行偶联,以得到中间体2。在一些实施例中,中间体10与中间体7的摩尔比为约1.00:1.02。在一些实施例中,基于所使用的中间体7的纯度和效力调整中间体7的精确量。在一些实施例中,基于所使用的中间体10的纯度和效力调整中间体10的精确量。
在一些实施例中,第一步进一步包括通过在有机溶剂中重结晶来纯化中间体2的步骤。在一些实施例中,有机溶剂包括四氢呋喃和正庚烷。在一些实施例中,用于中间体2重结晶的有机溶剂用纯中间体2的晶体引晶。在一些实施例中,重结晶是通过冷却有机溶剂进行的。在一些实施例中,有机溶剂被冷却至介于约15℃和约25℃之间的温度。在一些实施例中,有机溶剂被冷却至约20℃的温度。
在20℃下将中间体2与约0.01当量的TEMPO和约1.15当量的次氯酸钠用碳酸氢钠、氯化钠和溴化钠在二氯甲烷和水中氧化,得到中间体3。向溶液中加入正庚烷和四氢呋喃,得到呈白色结晶固体的中间体3。
在一些实施例中,次氯酸钠被迅速加入到反应混合物中。在一些实施例中,次氯酸钠在少于60分钟、少于45分钟、少于30分钟或少于20分钟的过程内加入。在一些实施例中,次氯酸钠在介于约15和约45分钟之间的过程内加入。在一些实施例中,次氯酸钠在约30分钟的过程内加入。在一些实施例中,在存在醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在仲醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在异丙醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在2-丁醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在2-戊醇的情况下发生中间体2的氧化以得到中间体3。在一些实施例中,在存在3-甲基2丁醇的情况下发生中间体2的氧化以得到中间体3。
在0℃下使中间体3与中间体5在二甲基乙酰胺中与三乙酰氧基硼氢化钠(STAB)和N-甲基吗啉发生还原胺化,得到化合物A。在一些实施例中,中间体3与中间体5的摩尔比为约1.1:1。在一些实施例中,中间体5与N-甲基吗啉的比率介于约1.5:1和2:1(w/w)之间。在一些实施例中,中间体5与N-甲基吗啉的比率为约1.7:1(w/w)。将乙醇和水的混合物加入粗反应混合物中,并使化合物A沉淀。将粗品化合物A溶解在二氯甲烷:甲醇(17:1w/w)的混合物中。将富含产物的溶液过滤并与乙醇进行蒸馏交换。从乙醇溶液结晶,得到呈浅黄色结晶固体的化合物A,将其在65℃下在真空中干燥。
在从DCM到EtOH的溶剂交换中,自结晶(自引晶)发生在约1:1比率的DCM/EtOH含量下,这发生在14体积的EtOH被分配后不久(常压蒸馏结束;溶剂交换1)。为了对母液和洗涤液进行更均匀和一致的过滤,建议通过引晶控制结晶。实验表明,在回流条件下,产物溶液在67% DCM含量下/约67% DCM含量下过饱和。在一些实施例中,引晶方案包括以下步骤:
·蒸馏至过饱和点(添加7体积的EtOH)
·针对DCM含量除去样品,以确保DCM≤67%
(过饱和)
·将溶液冷却至回流(~42℃)至35℃以下
·在35℃下注入0.5wt%的晶种(基于中间体3输入)
·将浆料加热恢复到回流,并继续加热剩余的溶剂
交换
在一个实施例中,第五代合成提供了一种化合物A的超纯形式,其纯度大于约95%。在一个实施例中,化合物A的超纯形式具有大于约96%、97%、98%、99%、99.5或99.9%的纯度。
化合物A的纯化
在一个实施例中,化合物A的纯化包括以下步骤:
(1)将化合物A溶解在约二氯甲烷和甲醇的混合物中;
(2)过滤包括化合物A的溶液;
(3)将包括化合物A的溶液的溶剂与乙醇进行蒸馏交换;
(4)使化合物A从乙醇溶液中结晶;以及
(5)干燥纯化的化合物A的结晶固体形式。
在一个实施例中,(1)中二氯甲烷与甲醇的比率为约9:1(w/w)。在一个实施例中,(1)中二氯甲烷与甲醇的比率为约10:1(w/w)。
在一个实施例中,化合物A的纯化包括将化合物A溶解在介于约95:5(w/w)和约80:20(w/w)之间的二氯甲烷和甲醇的混合物的溶剂中。
在一个实施例中,化合物A的纯化包括将化合物A溶解在约80:20(w/w)的二氯甲烷和甲醇的混合物中。在一个实施例中,化合物A的纯化包括将化合物A溶解在约90:10(w/w)的二氯甲烷和甲醇的混合物中。在一个实施例中,化合物A的纯化包括将化合物A溶解在约95:5(w/w)的二氯甲烷和甲醇的混合物中。在一个实施例中,化合物A的纯化包括将化合物A溶解在约10:1(v/v)的二氯甲烷和甲醇的混合物中。
在一个实施例中,步骤(3)中的乙醇的体积相对于还原胺化步骤中提供的中间体3的量介于约5体积和约9体积之间。在一个实施例中,步骤(3)中的乙醇的体积相对于还原胺化步骤中提供的中间体3的量介于约6体积和约8体积之间。在一个实施例中,步骤(3)中的乙醇的体积相对于还原胺化步骤中提供的中间体3的量为约7体积。
在一些实施例中,将步骤(A3)中的乙醇的量针对粗品化合物A中的乙醇含量进行校正。
在一个实施例中,纯化的化合物A的结晶固体形式的干燥是在真空中进行的。在一些实施例中,所述干燥在约15℃至约30℃、约20℃至约30℃、约30℃至约40℃或约35℃至约45℃下发生。在一些实施例中,所述干燥在大于约50℃、大于约60℃、大于约70℃或大于约80℃下发生。在一些实施例中,所述干燥在约60℃和约70℃之间发生。在一些实施例中,所述干燥在约65℃下发生。在一些实施例中,所述干燥在约75℃和约85℃之间发生。
在一些实施例中,所述干燥在约80℃下发生。
化合物A的纯化
在以下实施例中,化合物A的纯度百分比,以及一种或多种杂质的组成百分比,以w/w为基础反映纯度。
在一些实施例中,化合物A的纯度百分比,以及一种或多种杂质的组成百分比,表示由HPLC确定的纯度(面积%)。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约1%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即中间体2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于1%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即中间体3。
在一个实施例中,化合物A的超纯形式具有大于95%的纯度,并且进一步包括少于约1%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即中间体5。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约1%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.05%的杂质,即杂质1。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约1%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有大于约99.85%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。在一个实施例中,化合物A的超纯形式具有约99.85%的纯度,并且进一步包括少于约0.15%的杂质,即杂质2。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约1%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有大于约99.85%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。在一个实施例中,化合物A的超纯形式具有约99.85%的纯度,并且进一步包括少于约0.15%的杂质,即杂质3。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约1%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约1%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约1%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约1%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约1%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括少于约0.1%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有约99.5%的纯度,并且进一步包括少于约0.5%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有约99.8%的纯度,并且进一步包括少于约0.2%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有大于约99.85%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。在一个实施例中,化合物A的超纯形式具有约99.85%的纯度,并且进一步包括少于约0.15%的杂质,即杂质4。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括总共少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约95%的纯度,并且进一步包括各自少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括总共少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约96%的纯度,并且进一步包括各自少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括总共少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约97%的纯度,并且进一步包括各自少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括总共少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约98%的纯度,并且进一步包括各自少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括总共少于约1%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约99%的纯度,并且进一步包括各自少于约1%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括总共少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有大于约99.5%的纯度,并且进一步包括各自少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括总共少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,化合物A的超纯形式具有约99.9%的纯度,并且进一步包括各自少于约1%、0.9%、0.8%、0.7%、0.6%或0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
在一个实施例中,本文所述的化合物A的超纯形式是结晶的。
在一个实施例中,本文所述的化合物A的超纯形式是无定形的。
化合物A的结晶形式
在一方面,本申请涉及化合物A的结晶形式,其中化合物A是乙醇酸盐(即,乙醇溶剂化物)。对应于该结晶形式的XRPD图被称为晶型4,并在图3C中提供。
化合物A乙醇酸盐的结晶形式,被称为晶型4并通过图3C中的XRPD图来表征,具有粉末x射线衍射图,所述衍射图包括选自由以下组成的组的至少一个峰:7.9°±0.2°2θ、9.7°±0.2°2θ、11.0°±0.2°2θ、11.3°±0.2°2θ、13.6°±0.2°2θ、16.1°±0.2°2θ、17.2°±0.2°2θ、17.9°±0.2°2θ和20.1°±0.2°2θ,其中所述粉末x射线衍射图是使用Cu Kα辐射在
在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括11.0°±0.2°2θ、16.1°±0.2°2θ和17.9°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图进一步包括11.3°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图进一步包括17.2°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图进一步包括7.9°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图进一步包括20.1°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图进一步包括13.6°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的这种结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图进一步包括9.7°±0.2°2θ处的峰。
在一个实施例中,化合物A乙醇酸盐的结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括11.0°±0.2°2θ、11.3°±0.2°2θ、16.1°±0.2°2θ和17.9°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括11.0°±0.2°2θ、11.3°±0.2°2θ、16.1°±0.2°2θ、17.2°±0.2°2θ和17.9°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括7.9°±0.2°2θ、11.0°±0.2°2θ、11.3°±0.2°2θ、16.1°±0.2°2θ、17.2°±0.2°2θ和17.9°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括7.9°±0.2°2θ、11.0°±0.2°2θ、11.3°±0.2°2θ、16.1°±0.2°2θ、17.2°±0.2°2θ、17.9°±0.2°2θ和20.1°±0.2°2θ处的峰。在一个实施例中,化合物A乙醇酸盐的结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括7.9°±0.2°2θ、11.0°±0.2°2θ、11.3°±0.2°2θ、13.6°±0.2°2θ、16.1°±0.2°2θ、17.2°±0.2°2θ、17.9°±0.2°2θ和20.1°±0.2°2θ处的峰。
在一个实施例中,化合物A乙醇酸盐的结晶形式,即晶型4,具有粉末x射线衍射图,所述衍射图包括7.9°±0.2°2θ、9.7°±0.2°2θ、11.0°±0.2°2θ、11.3°±0.2°2θ、13.6°±0.2°2θ、16.1°±0.2°2θ、17.2°±0.2°2θ、17.9°±0.2°2θ和20.1°±0.2°2θ处的峰。
在一方面,本申请涉及通过图3A中的XRPD图表征的化合物A的结晶形式,其在本文中也被称为晶型2。
化合物A的结晶形式,被称为晶型2并通过图3A中的XRPD图来表征,具有粉末x射线衍射图,所述衍射图包括选自由以下组成的组的至少一个峰:3.2°±0.2°2θ、7.6°±0.2°2θ、11.5°±0.2°2θ、17.6°±0.2°2θ、18.5°±0.2°2θ和21.4°±0.2°2θ,其中所述粉末x射线衍射图是使用Cu Kα辐射在
在一个实施例中,化合物A的结晶形式,被称为晶型2并通过图3A中的XRPD图来表征,充当用于制备化合物A的无定形和/或超纯无定形形式的方便的储存形式,并进一步用于制备本公开的药物组合物,包含例如片剂。
化合物A的无定形形式和包括化合物A的无定形形式的喷雾干燥中间体的制造工艺
本申请进一步提供了一种化合物A的无定形形式,或其盐或溶剂化物。
在一个实施例中,化合物A的无定形形式是超纯的。
在一个实施例中,化合物A的无定形形式的特征在于,在25℃和0%相对湿度下玻璃化转变温度Tg为约146℃。
在一个实施例中,化合物A的无定形形式的特征在于,在40℃和75%相对湿度下玻璃化转变温度Tg为约103℃。
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一个实施例中,化合物A的无定形形式的特征在于,D
在一些实施例中,化合物A的无定形形式的粒径通过激光衍射确定。
在一个实施例中,化合物A的无定形形式具有大于约95%、96%、97%、98%、99%、99.5或99.9%的纯度。
在一个实施例中,化合物A的无定形形式的特征在于,所述无定形形式在2-8℃下稳定至少1个月;在25℃和60%相对湿度下稳定1个月;并在40℃和75%相对湿度下稳定1个月。在一个实施例中,化合物A的无定形形式的特征在于,所述无定形形式在2-8℃下稳定至少6个月;在25℃和60%相对湿度下稳定6个月;并在40℃和75%相对湿度下稳定6个月。在一个实施例中,化合物A的无定形形式的特征在于,所述无定形形式在2-8℃下稳定至少12个月;在25℃和60%相对湿度下稳定12个月;并在40℃和75%相对湿度下稳定12个月。在一个实施例中,化合物A的无定形形式的特征在于,所述无定形形式在2-8℃下稳定至少24个月;在25℃和60%相对湿度下稳定24个月;并在40℃和75%相对湿度下稳定24个月。在一个实施例中,通过将化合物A储存在放置在含有干燥剂罐并盖有聚丙烯衬里封盖的热感应密封高密度聚乙烯(HDPE)瓶中的线束低密度聚乙烯袋中来评估化合物A的稳定性。
本申请进一步涉及用于制造化合物A的无定形形式或其盐或溶剂化物的方法。在一个实施例中,根据本文描述的方法制备的化合物A的无定形形式是超纯的。
在一个实施例中,化合物A的无定形形式是通过以下方式来制造的:取一定量的化合物A,包含化合物A的任何结晶形式、化合物A的超纯形式和本文所述的化合物A的结晶超纯形式,并溶解在适当的溶剂中直至获得澄清的溶液。将化合物A的溶液引入喷雾干燥机中,并将喷雾干燥机输出的潮湿固体通过托盘干燥以产生化合物A的无定形固体形式,即“喷雾干燥中间体”。在用于制备包括化合物A的药物组合物(例如,片剂)之前,检查喷雾干燥中间体是否有残留溶剂。
在一个实施例中,化合物A的无定形形式的制造工艺可以根据图14中的流程图完成。
在一个实施例中,如上所述制备的化合物A的无定形形式可用于制备包括化合物A的药物组合物(例如,片剂)。
在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,将化合物A溶解在甲醇、乙醇、异丙醇、1-丁醇、2-丁醇、丙酮、叔丁基甲醚、乙醚、乙酸乙酯、氯仿、二氯甲烷、2,2-二氯乙烷或其任意混合物中。
在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,将化合物A溶解在二氯甲烷和甲醇的混合物中。在一个实施例中,二氯甲烷和甲醇的混合物为约99/1(w/w)、约95/5(w/w)、约90/10(w/w)、约85/15(w/w)、约80/20(w/w)、约70/30(w/w)、约60/40(w/w)、约50/50(w/w)、约40/60(w/w)、约30/70(w/w)、约20/80(w/w)、约10/90(w/w)或约1/99(w/w)。在优选的实施例中,二氯甲烷和甲醇的混合物为约70/30(w/w)至约95/5(w/w),优选地,约90/10(w/w),并且最优选地,约93/7(w/w)。
在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约1mg/mL至约100mg/mL。
在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约1mg/mL至约50mg/mL。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约1mg/mL至约25mg/mL。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约1mg/mL至约10mg/mL。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约1mg/mL至约5mg/mL。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约2mg/mL至约5mg/mL。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约2mg/mL至约4mg/mL。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约2mg/mL至约3mg/mL。
在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,待引入喷雾干燥机的溶剂中化合物A的浓度为约5mg/mL、约10mg/mL、约15mg/mL、约20mg/mL、约25mg/mL、约30mg/mL、约35mg/mL、约40mg/mL、约45mg/mL、约50mg/mL、约55mg/mL、约60mg/mL、约65mg/mL、约70mg/mL、约75mg/mL、约80mg/mL、约85mg/mL、约90mg/mL、约95mg/mL或约100mg/mL。
在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,被引入喷雾干燥机的溶剂中化合物A的量为约1%(w/w)、约2%(w/w)、约3%(w/w)、约4%(w/w)、约5%(w/w)、约6%(w/w)、约7%(w/w)、约8%(w/w)、约9%(w/w)、约10%(w/w)、约11%(w/w)、约12%(w/w)、约13%(w/w)、约14%(w/w)或约15%(w/w)。在一个实施例中,对于本文所述的化合物A的无定形形式的制备工艺,被引入喷雾干燥机的溶剂中化合物A的量介于约1和约10%(w/w)之间、介于约3和约8%(w/w)之间、介于约5和约7%(w/w)之间、介于约5.5和约6.8%(w/w)之间,或优选地,介于约5.8和约6.2%(w/w)之间。
在一个实施例中,用于制造化合物A的无定形形式的工艺包括以下步骤:
(1)将结晶和/或超纯化合物A溶解在二氯甲烷:甲醇溶液中,得到化合物A的溶液;
(2)将步骤(1)中的所述化合物A的溶液引入喷雾干燥机中;
(3)从喷雾干燥机喷洒化合物A的溶液,以产生化合物A的无定形形式;以及
(4)干燥所述化合物A的无定形形式以除去残留溶剂。
在一个实施例中,用于制造化合物A的无定形形式的工艺的步骤(1)包括将化合物A溶解在约95:5(w/w)至约80:20(w/w)的二氯甲烷和甲醇溶液中。
在一个实施例中,用于制造化合物A的无定形形式的工艺的步骤(1)包括将化合物A溶解在二氯甲烷和甲醇的80:20(w/w)混合物中。在一个实施例中,用于制造化合物A的无定形形式的工艺的步骤(1)包括将化合物A溶解在二氯甲烷和甲醇的90:10(w/w)混合物中。在一个实施例中,用于制造化合物A的无定形形式的工艺的步骤(1)包括将化合物A溶解在二氯甲烷和甲醇的93:7(w/w)混合物中。在一个实施例中,用于制造化合物A的无定形形式的工艺的步骤(1)包括将化合物A溶解在二氯甲烷和甲醇的95:5(w/w)混合物中。
在一个实施例中,将溶液引入喷雾干燥机之前,步骤(1)中的溶液的温度为约20℃至约40℃。在一个实施例中,将溶液引入喷雾干燥机之前,步骤(1)中的溶液的温度为约25℃至约35℃。在一个实施例中,将溶液引入喷雾干燥机之前,步骤(1)中的溶液的温度为约27.5℃至约32.5℃。在一个实施例中,将溶液引入喷雾干燥机之前,步骤(1)中的溶液的温度为约30℃。
用于制造化合物A的无定形形式的工艺中使用的喷雾干燥机可以设定在适当的温度、气体流速、进料额定压力下,由本领域技术人员根据本公开确定。
在一个实施例中,用于制造化合物A的无定形形式的工艺中使用的喷雾干燥机具有SK80-16喷嘴并且在以下条件下采用:
在一个实施例中,用于制造化合物A的无定形形式的工艺中使用的喷雾干燥机具有SK80-16喷嘴并且在以下条件下采用:
在一个实施例中,用于制造化合物A的无定形形式的工艺中使用的喷雾干燥机具有Schlick 121型喷嘴并且在以下条件下采用:
在一个实施例中,用于制造化合物A的无定形形式的工艺中使用的喷雾干燥机具有Schlick 121型喷嘴并且在以下条件下采用:
在一个非限制性实施例中,化合物A的无定形形式在步骤(4)中通过托盘干燥进行干燥。在一个实施例中,化合物A的无定形形式在步骤(4)中通过过滤器干燥进行干燥。在一个实施例中,化合物A的无定形形式在步骤(4)中通过滚筒干燥进行干燥。在一个实施例中,化合物A的无定形形式在步骤(4)中通过搅拌锥形干燥进行干燥。在一个实施例中,化合物A的无定形形式在步骤(4)中通过流化床干燥进行干燥。
在一个非限制性实施例中,化合物A的无定形形式在步骤(4)中进行托盘干燥,以除去喷雾干燥过程中的任何残留溶剂。
在一个实施例中,托盘的深度为约2.5cm。
在一个实施例中,将含有无定形化合物A的托盘在步骤(4)中干燥总共1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、30小时、36小时或48小时,无论是在降低的压力下还是在环境压力下。在一个实施例中,将含有无定形化合物A的托盘干燥约1小时至约24小时。在一个实施例中,将含有无定形化合物A的托盘干燥约1小时至约10小时。在一个实施例中,将含有无定形化合物A的托盘干燥约5小时至约10小时。在一个实施例中,将含有无定形化合物A的托盘干燥约5小时至约7小时。
在一个实施例中,在步骤(4)中的托盘干燥程序期间,温度从约20℃升至约30℃、升至约40℃、升至约50℃、升至约60℃、升至约70℃或更高。
在一个实施例中,在步骤(4)中的托盘干燥程序期间,相对湿度从约15%相对湿度(RH)上升至约20% Rh、约25% Rh、约30% Rh、约35% Rh、约40% Rh、约45% Rh、约50%RH或更高。
在一个实施例中,步骤(4)中的托盘干燥程序不涉及温度或相对湿度的上升,即,温度和相对湿度保持恒定。
在一个实施例中,步骤(4)中的托盘干燥程序涉及在约2.5cm的床深中将步骤(3)中的产物在约40℃至约60℃下加热约6小时至约18小时(在约5% RH至约35% RH下,在降低的压力或环境压力下),其中温度和相对湿度均保持恒定。
在一个非限制性实施例中,对化合物A的无定形形式进行过滤干燥,以除去喷雾干燥过程中的任何残留溶剂。
在一个实施例中,将化合物A的无定形形式在真空下过滤干燥总共1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、30小时、36小时或48小时。在一个实施例中,将化合物A的无定形形式在真空下过滤干燥总共约1小时至约50小时。在一个实施例中,将化合物A的无定形形式在真空下过滤干燥总共约12小时至约50小时。在一个实施例中,将化合物A的无定形形式在真空下过滤干燥总共约12小时至约36小时。在一个实施例中,将化合物A的无定形形式在真空下过滤干燥总共约20小时至约30小时。
在一个实施例中,过滤器干燥程序期间的压力低于环境压力。在一个实施例中,过滤器干燥程序期间的压力为约0.1巴、约0.2巴、约0.3巴、约0.4巴、约0.5巴、约0.6巴、约0.7巴、约0.8巴或约0.9巴。在一个实施例中,过滤器干燥程序期间的压力比环境压力低约0.9巴。
在一个实施例中,过滤器干燥程序期间的温度从约20℃升至约30℃、升至约40℃、升至约50℃、升至约60℃、升至约70℃或更高。
片剂的制造工艺包括喷雾干燥中间体(即,化合物A的超纯和稳定的无定形形式)
在一方面,本申请提供了包括化合物A的片剂及其制造工艺。
在某些实施例中,本公开的片剂包括化合物A的无定形形式,即,本文公开的喷雾干燥形式。在一个实施例中,本公开的片剂包括化合物A的无定形形式,其也是超纯的。在一个实施例中,片剂含有约2.5%至约50%(w/w)的化合物A。
本公开的片剂可以进一步包括一种或多种药学上可接受的赋形剂,包含例如载体、填充剂、表面活性剂、稀释剂、甜味剂、崩解剂、粘合剂、润滑剂、助流剂、着色剂、香料、稳定剂、涂料或其任意混合物。
填充剂包含但不限于甘露醇、山梨醇、木糖醇、微晶纤维素、乳糖、硅化微晶纤维素、羟丙基甲基纤维素、羟丙基纤维素、支链淀粉和快速溶解型碳水化合物(如Pharmaburst
助流剂包含但不限于二氧化硅、胶体二氧化硅、硅酸钙、硅酸镁、三硅酸镁、滑石、淀粉、它们的混合物等。
润滑剂包含但不限于硬脂酸钙、单硬脂酸甘油酯、山嵛酸甘油酯、棕榈硬脂酸甘油酯、六方氮化硼、氢化植物油、轻矿物油、硬脂酸镁、矿物油、聚乙二醇、泊洛沙姆、苯甲酸钠、十二烷基硫酸钠、富马酸硬脂基钠、硬脂酸、滑石、硬脂酸锌、它们的混合物等。
崩解剂包含但不限于淀粉乙醇酸钠、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲基纤维素钠、交聚维酮、壳聚糖、琼脂、海藻酸、海藻酸钙、甲基纤维素、微晶纤维素、粉状纤维素、低级烷基取代的羟丙基纤维素、羟丙基淀粉、低取代的羟丙基纤维素、聚克立林钾、淀粉、预胶化淀粉、海藻酸钠、硅酸镁铝、聚克立林钾、聚维酮、淀粉乙醇酸钠、它们的混合物等。
在一个实施例中,片剂含有约5%至约95%w/w的一种或多种填充剂,如例如,约75%至约95%w/w、约65%至约85%w/w、约55%至约75%w/w、约45%至约65%w/w、约35%至约55%w/w、约25%至约45%w/w、约15%至约35%w/w或约5%至约25%w/w的一种或多种填充剂。
在一个实施例中,片剂含有约80%w/w的一种或多种填充剂。
在一个实施例中,片剂含有约1%至约20%w/w的崩解剂,如例如,约1%至约15%w/w、约1%至约10%w/w、约2%至约9%w/w、约3%至约8%w/w、约4%至约7%w/w或约5%至约7%w/w的崩解剂。
在一个实施例中,片剂含有约0.20%至约2.5%w/w的润滑剂,如例如,约0.2%至约2.0%w/w、约0.2%至约1.8%w/w、约0.2%至约1.5%w/w或约0.25%至约1.5%w/w的润滑剂。
在一些实施例中,片剂含有0%至约1%w/w的助流剂,如例如,约0.25%至约0.75%w/w或约0.25%至约0.50%w/w的助流剂。
在一方面,该申请涉及一种用于制造包括化合物A的片剂的工艺。
在一个实施例中,用于制造包括化合物A的片剂的工艺包括干法造粒。干法造粒是一种众所周知的制药工艺。通常,将API与适当的赋形剂(包含润滑剂)组合,然后压实以形成团块。然后通常对该团块进行粉碎或研磨,然后过筛以获得所需尺寸的颗粒。然后加入粒外赋形剂并混合,然后将颗粒状产物压缩成片剂,填充到胶囊中或以其它方式以常规方式形成为单一剂型。在一些实施例中,包括化合物A的高剂量片剂是通过该工艺生产的。在其它实施例中,将包括高剂量化合物A的颗粒状产物填充到胶囊中或以其它方式形成为单一剂型。
在一个实施例中,用于制造包括化合物A的片剂的工艺包括湿法造粒。湿法造粒涉及通过将造粒液添加到API的粉末床上来形成颗粒,该粉末床可能受到叶轮、一个或多个螺杆和/或气流的影响。颗粒形成后,通过干燥除去造粒液。
在一个实施例中,用于制造包括化合物A的片剂的工艺包括直接压缩。从本质上讲,直接压缩绕过颗粒的形成,并且涉及将API与一种或多种药学上可接受的载体、稀释剂和/或其它赋形剂共混,然后进行压缩。
压实成团块是使用常规设备完成的。通常,共混的API和赋形剂通过辊压实机或
包括化合物A的干法造粒组合物被定义为干法造粒工艺的产物。干法造粒组合物包含干法造粒的直接产物,即干颗粒本身,以及由这种颗粒制成的产品,包含片剂、胶囊、栓剂和其它药物剂型。
在一方面,本申请涉及一种片剂,所述片剂包括一种或多种药学上可接受的赋形剂和化合物A,包含本文所述的化合物A的超纯形式。
在一个实施例中,所述片剂包括约5至约1000mg的化合物A。在一个实施例中,所述片剂包括约5至约500mg的化合物A。在一个实施例中,所述片剂包括约5至约250mg的化合物A。在一个实施例中,所述片剂包括约25至约250mg的化合物A。在一个实施例中,所述片剂包括约25至约200mg的化合物A。在一个实施例中,所述片剂包括约25至约150mg的化合物A。在一个实施例中,所述片剂包括约5至约50mg的化合物A。在一个实施例中,所述片剂包括约30至约40mg的化合物A。在一个实施例中,所述片剂包括约65至约70mg的化合物A。在一个实施例中,所述片剂包括约100至约110mg的化合物A。在一个实施例中,所述片剂包括约135至约145mg的化合物A。
在一个实施例中,所述片剂包括约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、405、410、415、420、425、430、435、440、445、450、455、460、465、470、475、480、485、490、495或500mg的化合物A。
在一个实施例中,所述片剂包括约5mg的化合物A。
在一个实施例中,所述片剂包括约35mg的化合物A。
在一个实施例中,所述片剂包括约70mg的化合物A。
在一个实施例中,所述片剂包括约105mg的化合物A。
在一个实施例中,所述片剂包括约140mg的化合物A。
在一个实施例中,所述片剂包括约175mg的化合物A。
在一个实施例中,所述片剂包括约200mg的化合物A。
在一个实施例中,所述片剂包括约210mg的化合物A。
在一个实施例中,所述片剂包括约245mg的化合物A。
在一个实施例中,所述片剂包括约280mg的化合物A。
在一个实施例中,所述片剂包括约315mg的化合物A。
在一个实施例中,所述片剂包括约350mg的化合物A。
在一个实施例中,本公开的片剂包括约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、15.5、16.0、16.5、17.0、17.5、18.0、18.5、19.0、19.5、20.0、20.5、21.0、21.5、22.0、22.5、23.0、23.5、24.0、24.5、25.0、25.5、26.0、26.5、27.0、27.5、28.0、28.5、29.0、29.5、30.0、30.5、31.0、31.5、32.0、32.5、33.0、33.5、34.0、34.5、35.0、35.5、36.0、36.5、37.0、37.5、38.0、38.5、39.0、39.5、40.0、40.5、41.0、41.5、42.0、42.5、43.0、43.5、44.0、44.5、45.0、45.5、46.0、46.5、47.0、47.5、48.0、48.5、49.0、49.5或50.0%w/w的化合物A。
在一个实施例中,本公开的片剂包括约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、15.5、16.0、16.5、17.0、17.5、18.0、18.5、19.0、19.5、20.0、20.5、21.0、21.5、22.0、22.5、23.0、23.5、24.0、24.5、25.0、25.5、26.0、26.5、27.0、27.5、28.0、28.5、29.0、29.5、30.0、30.5、31.0、31.5、32.0、32.5、33.0、33.5、34.0、34.5、35.0、35.5、36.0、36.5、37.0、37.5、38.0、38.5、39.0、39.5、40.0、40.5、41.0、41.5、42.0、42.5、43.0、43.5、44.0、44.5、45.0、45.5、46.0、46.5、47.0、47.5、48.0、48.5、49.0、49.5或50.0%w/w的化合物A的超纯形式。
在一个实施例中,本公开的片剂包括约1%至约5%w/w的化合物A、约2.5%至约7.5%w/w的化合物A、约10%至约15%w/w的化合物A、约12.5%至约17.5%w/w的化合物A、约15%至约20%w/w的化合物A、约17.5%至约22.5%w/w的化合物A、约20%至约25%w/w的化合物A、约22.5%至约27.5%w/w的化合物A、约25%至约30%w/w的化合物A、约27.5%至约32.5%w/w的化合物A或约30%至约35%w/w的化合物A。
在一个实施例中,本公开的片剂包括约1%至约5%w/w的化合物A、约2.5%至约7.5%w/w的化合物A的超纯形式、约10%至约15%w/w的化合物A的超纯形式、约12.5%至约17.5%w/w的化合物A的超纯形式、约15%至约20%w/w的化合物A的超纯形式、约17.5%至约22.5%w/w的化合物A的超纯形式、约20%至约25%w/w的化合物A的超纯形式、约22.5%至约27.5%w/w的化合物A的超纯形式、约25%至约30%w/w的化合物A的超纯形式、约27.5%至约32.5%w/w的化合物A的超纯形式或约30%至约35%w/w的化合物A的超纯形式。
在一个实施例中,本公开的片剂包括:
约2.5%至约7.5%w/w的化合物A;
约42%至约47%w/w的微晶纤维素;
约42%至约47%w/w的乳糖一水合物;
约1%至约5%w/w的交联羧甲基纤维素钠;
约0.1%至约1.0%w/w的二氧化硅;以及
约0.1%至约1.0%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约5%w/w的化合物A;
约45.5%w/w的微晶纤维素;
约45.5%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约10%w/w的化合物A;
约57.3%w/w的微晶纤维素;
约28.7%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约20%w/w的化合物A;
约50.7%w/w的微晶纤维素;
约25.3%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约40%w/w的化合物A;
约37.3%w/w的微晶纤维素;
约18.7%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约2.5%至约7.5%w/w的化合物A的超纯形式;
约42%至约47%w/w的微晶纤维素;
约42%至约47%w/w的乳糖一水合物;
约1%至约5%w/w的交联羧甲基纤维素钠;
约0.1%至约1.0%w/w的二氧化硅;以及
约0.1%至约1.0%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约5%w/w的化合物A的超纯形式;
约45.5%w/w的微晶纤维素;
约45.5%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约10%w/w的化合物A的超纯形式;
约57.3%w/w的微晶纤维素;
约28.7%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约20%w/w的化合物A的超纯形式;
约50.7%w/w的微晶纤维素;
约25.3%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一个实施例中,本公开的片剂包括:
约40%w/w的化合物A的超纯形式;
约37.3%w/w的微晶纤维素;
约18.7%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
在一些实施例中,本公开的片剂包括粒内部分和粒外部分。在一些实施例中,所述粒内部分包括:
约10至约40%w/w的化合物A;
约35至约60%w/w的微晶纤维素;
约15至约30%w/w的乳糖一水合物;
约1至约10%w/w的交联羧甲基纤维素钠;
0至约1%w/w的二氧化硅;以及
0至约0.5%w/w的硬脂酸镁。
在一些实施例中,所述粒内部分包括:
约10至约40%w/w的化合物A的超纯形式;
约35至约60%w/w的微晶纤维素;
约15至约30%w/w的乳糖一水合物;
约1至约10%w/w的交联羧甲基纤维素钠;
0至约1%w/w的二氧化硅;以及
0至约0.5%w/w的硬脂酸镁。
在一些实施例中,所述粒外部分包括:
约1至约5%w/w的交联羧甲基纤维素钠;
0至约1%w/w的硬脂酸镁;以及
0至约2%w/w的二氧化硅。
在一个实施例中,本公开的片剂包括粒内部分和粒外部分,其中所述粒内部分包括:
约10至约40%w/w的化合物A;
约35至约60%w/w的微晶纤维素;
约15至约30%w/w的乳糖一水合物;
约1至约10%w/w的交联羧甲基纤维素钠;
0至约1%w/w的二氧化硅;以及
0至约0.5%w/w的硬脂酸镁;
并且其中所述粒外部分包括:
约1至约5%w/w的交联羧甲基纤维素钠;
0至约1%w/w的硬脂酸镁;以及
0至约2%w/w的二氧化硅。
在一个实施例中,本公开的片剂包括粒内部分和粒外部分,其中所述粒内部分包括:
约10至约40%w/w的化合物A的超纯形式;
约35至约60%w/w的微晶纤维素;
约15至约30%w/w的乳糖一水合物;
约1至约10%w/w的交联羧甲基纤维素钠;
0至约1%w/w的二氧化硅;以及
0至约0.5%w/w的硬脂酸镁;
并且其中所述粒外部分包括:
约1至约5%w/w的交联羧甲基纤维素钠;
0至约1%w/w的硬脂酸镁;以及
0至约2%w/w的二氧化硅。
在一个实施例中,本公开的片剂包括粒内部分和粒外部分,其中所述粒内部分包括:
约20%w/w的化合物A;
约48.7%w/w的微晶纤维素;
约24.3%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.25%w/w的硬脂酸镁;
并且其中所述粒外部分包括:
约2%w/w的交联羧甲基纤维素钠;
约0.5%w/w的硬脂酸镁;以及
约0.25%w/w的二氧化硅。
在一个实施例中,本公开的片剂包括粒内部分和粒外部分,其中所述粒内部分包括:
约20%w/w的化合物A的超纯形式;
约48.7%w/w的微晶纤维素;
约24.3%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.25%w/w的硬脂酸镁;
并且其中所述粒外部分包括:
约2%w/w的交联羧甲基纤维素钠;
约0.5%w/w的硬脂酸镁;以及
约0.25%w/w的二氧化硅。
在一些实施例中,所述粒外部分中的所述二氧化硅包括气相二氧化硅。气相二氧化硅(也被称为气相白炭黑)可以通过火焰水解由氯化硅(SiCl
在一个实施例中,根据实例中的程序制备本公开的片剂。
在一个实施例中,干法造粒方法用于生产化合物A片剂,如下所示:将喷雾干燥中间体,即化合物A的无定形形式,与至少一种药学上可接受的赋形剂共混以产生粉末。在一个实施例中,将化合物A与一种或多种填充剂、一种或多种崩解剂以及一种或多种助流剂共混。在一个实施例中,将化合物A与两种填充剂、一种崩解剂和一种助流剂共混。在一个实施例中,至少一种填充剂是微晶纤维素。在一个实施例中,至少一种填充剂是乳糖一水合物。在一个实施例中,崩解剂是交联羧甲基纤维素钠。在一个实施例中,助流剂是二氧化硅。在一个实施例中,将化合物A在合适的搅拌机中与微晶纤维素、乳糖一水合物、交联羧甲基纤维素钠和二氧化硅共混。
将所得粉末脱块并加入药学上可接受的赋形剂并共混。在一个实施例中,药学上可接受的赋形剂是润滑剂。在一个实施例中,润滑剂是硬脂酸镁。
使用合适的辊压实机对共混物进行造粒,并使其通过筛网以对颗粒进行适当的尺寸调整。
在一个实施例中,根据该工艺制备的颗粒的直径为约400μm至约600μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约450μm至约550μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约575μm至约625μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约590μm至约610μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约595μm至约605μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约598μm至约602μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约450μm、直径为约460μm、直径为约470μm、直径为约480μm、直径为约490μm、直径为约500μm、直径为约510μm、直径为约520μm、直径为约530μm、直径为约540μm或直径为约550μm。
在一个实施例中,根据该工艺制备的颗粒的直径为约500μm。
加入至少一种药学上可接受的赋形剂并将散装粉末在合适的搅拌机中共混。在一个实施例中,药学上可接受的赋形剂是润滑剂。在一个实施例中,润滑剂是粒外硬脂酸镁。
将共混物压缩成片剂并将所得片剂包装在散装容器中。在一些实施例中,使用旋转压力机将共混物压缩成片剂。
在一个实施例中,根据图15中的流程图所示的制造工艺制备本公开的片剂。
在细胞中泛素化/降解靶蛋白的方法
本公开进一步提供了一种在细胞中泛素化/降解靶蛋白的方法。所述方法包括向有需要的受试者或患者施用化合物A的任何形式,或包括任何这些形式的药物组合物(例如,片剂、胶囊、肠胃外溶液)。化合物A包括E3泛素连接酶(小脑蛋白)结合部分和通过接头部分连接的雄激素受体(AR)靶向部分,使得当靶蛋白靠近泛素连接酶放置时,AR的泛素化将发生,从而触发蛋白酶体降解以控制或降低AR的蛋白质水平,并抑制AR的作用。
治疗方法
在一个实施例中,本公开涉及一种治疗需要治疗的受试者的通过AR调节的前列腺癌的方法,其中AR蛋白的泛素化和降解导致在所述受试者中产生治疗效果,所述方法包括向所述受试者施用治疗有效量的化合物A或本文公开的化合物A的任何形式,或任何这些形式的组合物(例如,片剂、胶囊、肠胃外溶液)。疾病状态或病状可能与AR蛋白的表达或过表达有因果关系。
在一方面,本申请涉及一种治疗癌症的方法。
本文描述的治疗癌症的方法优选地导致肿瘤生长的减缓或停止,或者更优选地,导致肿瘤大小的减小。所述癌症是转移性癌症,并且该治疗方法可以包含抑制转移性癌细胞侵入。
在一个实施例中,所述癌症是前列腺癌。
在一个实施例中,所述癌症是转移性前列腺癌。
在一个实施例中,所述癌症是去势抵抗性前列腺癌。
在一个实施例中,所述癌症是转移性去势抵抗性前列腺癌。
在一个方面,治疗癌症导致肿瘤大小的减小。肿瘤大小的减小也可以被称为“肿瘤消退”。优选地,在一次或多次治疗之后,肿瘤大小相对于其治疗前的大小减小约5%或更多,例如,约5至约40%;更优选地,肿瘤大小减小约10%或更多,例如,约10%至约50%;更优选地,减小约20%或更多,例如,约20%至约60%;更优选地,减小约30%或更多,例如,约30%至约70%;更优选地,减小约40%或更多,例如,约40%至约80%;甚至更优选地,减小约50%或更多,例如,约50%至约90%;并且最优选地,减小大于约75%或更多,例如,约75%至约95%。肿瘤大小可以通过任何可重现的测量手段来测量。在一个优选的方面中,肿瘤大小可以被测量为肿瘤的直径。
另一方面,治疗癌症导致肿瘤体积的减小。优选地,在治疗后,肿瘤体积相对于其治疗前的体积减小约5%或更多,例如,约5%至约40%;更优选地,肿瘤体积减小约10%或更大,例如,约10%至约50%;更优选地,减小约20%或更多,例如,约20%至约60%;更优选地,减小约30%或更多,例如,约30%至约70%;更优选地,减小约40%或更多,例如,约40%至约80%;甚至更优选地,减小约50%或更多,例如,约50%至约90%;并且最优选地,减小大于约75%或更多,例如,约75%至约95%。肿瘤体积可以通过任何可重现的测量手段来测量。
另一方面,治疗癌症导致肿瘤数量的减少。优选地,在治疗后,肿瘤数量相对于治疗前的数量减少约5%或更多,例如,约5%至40%;更优选地,肿瘤数量减少约10%或更多,例如,约10%至约50%;更优选地,减少约20%或更多,例如,约20%至约60%;更优选地,减少约30%或更多,例如,约30%至约70%;更优选地,减少约40%或更多,例如,约40%至约80%;甚至更优选地,减少约50%或更多,例如,约50%至约90%;并且最优选地,减少大于约75%,例如,约75%至约95%。肿瘤数量可以通过任何可重现的测量手段来测量。在一个优选的方面中,可以通过对裸眼可见的或在指定的放大率下可见的肿瘤进行计数来测量肿瘤数量。在一个优选的方面中,指定的放大率为约2x、3x、4x、5x、10x或50x。
在另一方面,治疗癌症导致远离原发性肿瘤部位的其它组织或器官中的转移性病变的数量减少。优选地,在治疗后,转移性病变的数量相对于治疗前的数量减少约5%或更多,例如,约5%至约40%;更优选地,转移性病变的数量减少约10%或更多,例如,约10%至约50%;更优选地,减少约20%或更多,例如,约20至约60%;更优选地,减少约30%或更多,例如,约30%至约70%;更优选地,减少约40%或更多,例如,约40%至约80%;甚至更优选地,减少约50%或更多,例如,50%至约90%;并且最优选地,减少大于约75%,例如,约75%至约95%。转移性病变的数量可以通过任何可重现的测量手段来测量。在一个优选的方面中,可以通过对裸眼可见的或在指定的放大率下可见的转移性病变进行计数来测量转移性病变的数量。在一个优选的方面中,指定的放大率为约2x、3x、4x、5x、10x或50x。
另一方面,与仅接受载体的群体相比,治疗癌症导致经治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过约30天;更优选地,超过约60天;更优选地,超过约90天;并且最优选地,超过约120天。群体的平均存活时间的增加可以通过任何可重现的手段来测量。在一个优选的方面中,可以例如通过计算群体在用本公开的活性药剂或化合物开始或完成治疗后的平均存活长度来测量群体的平均存活时间的增加。在另一个优选的方面中,可以例如通过计算群体在用本公开的活性药剂或化合物完成第一轮治疗后的平均存活长度来测量群体的平均存活时间的增加。
另一方面,与未经治疗的受试者的群体相比,治疗癌症导致经治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过约30天;更优选地,超过约60天;更优选地,超过约90天;并且最优选地,超过约120天。群体的平均存活时间的增加可以通过任何可重现的手段来测量。在一个优选的方面中,可以通过计算群体在用本公开的活性药剂或化合物开始治疗后的平均存活长度来测量群体的平均存活时间的增加。在另一个优选的方面中,可以通过计算群体在用本公开的化合物完成第一轮治疗后的平均存活长度来测量群体的平均存活时间的增加。
另一方面,治疗癌症导致肿瘤生长速率的降低。优选地,在治疗后,肿瘤生长速率相对于治疗前的生长速率降低至少约5%,例如,约5%至约40%;更优选地,肿瘤生长速率降低至少约10%,例如,约10%至约50%;更优选地,降低至少约20%,例如,约20%至约60%;更优选地,降低至少约30%,例如,约30%至约70%;更优选地,降低至少约40%,例如,约40%至约80%;更优选地,降低至少约50%,例如,约50%至约90%;甚至更优选地,降低至少约60%,例如,约60%至约95%;并且最优选地,降低至少约75%,例如,约75%至约99%。肿瘤生长速率可以通过任何可重现的测量手段来测量。在一个优选的方面中,根据每单位时间的肿瘤直径的变化来测量肿瘤生长速率。
另一方面,治疗癌症导致肿瘤再生长的减少。优选地,治疗后,肿瘤再生长少于约5%;更优选地,肿瘤再生长少于约10%;更优选地,少于约20%;更优选地,少于约30%;更优选地,少于约40%;更优选地,少于约50%;甚至更优选地,少于约60%;并且最优选地,少于约75%。肿瘤再生长可以通过任何可重现的测量手段来测量。在一个优选的方面中,通过测量在治疗后的先前肿瘤缩小之后肿瘤的直径的增加来测量肿瘤再生长。在另一个优选的方面中,肿瘤再生长的减少由治疗停止后肿瘤再发生的失败来指示。
用于本文所述的任何方法和用途的本公开化合物的剂量根据化学药剂、受体受试者的年龄、体重和临床状况,以及施用疗法的临床医生或执业者的经验和判断,以及影响所选剂量的其它因素而改变。
治疗有效量的本公开化合物可以在一天内施用一次或多次,持续至多约30天或更多天,随后1天或更多天不施用本公开的化合物。该类型的治疗时间表,即,连续数日施用本公开的化合物随后连续数日不施用所述化合物,可以被称为一个治疗周期。治疗周期可以根据需要重复多次以达到预期效果。
在一些实施例中,所述方法包括向受试者施用治疗有效量的本文公开的化合物A的任何形式,或任何这些形式与至少一种其它生物活性剂组合的组合物。在一些实施例中,所述至少一种其它生物活性剂是抗癌剂。在一些实施例中,所述抗癌剂选自CDK抑制剂和PARP抑制剂。在一些实施例中,所述抗癌剂是CDK抑制剂。在一些实施例中,所述抗癌剂是CDK 4/6抑制剂。在一些实施例中,所述抗癌剂是PARP抑制剂。在一些实施例中,所述抗癌剂选自SHR6390、曲拉西利、lerociclib、AT7519M、迪纳西利、瑞博西利、阿贝西利、哌柏西利、奥拉帕尼、鲁卡帕尼、他拉唑帕尼、尼拉帕尼、维利帕尼、帕米帕尼、CEP 9722、E7016、3-氨基苯甲酰胺、美呋帕尼和AZD2281。在一些实施例中,所述抗癌剂选自SHR6390、曲拉西利、lerociclib、AT7519M、迪纳西利、瑞博西利、阿贝西利和哌柏西利。在一些实施例中,所述抗癌剂选自奥拉帕尼、鲁卡帕尼、他拉唑帕尼、尼拉帕尼、维利帕尼、帕米帕尼、CEP 9722、E7016、3-氨基苯甲酰胺、美呋帕尼和AZD2281。在一些实施例中,所述抗癌剂选自奥拉帕尼、鲁卡帕尼、他拉唑帕尼和尼拉帕尼。在一些实施例中,所述抗癌剂是奥拉帕尼。
实例
通过以下实例进一步说明本公开,所述实例不应被解释为将本公开的范围或精神限制为本文所述的特定程序。应当理解,提供实例以说明某些实施例,并且不意图由此限制本公开的范围。应当进一步理解,在不脱离本公开的精神和/或所附权利要求书的范围的情况下,可以诉诸本领域的技术人员鉴于本公开可以想到的各种其它实施例、修改及其等同物。
实例1.化合物A的一般性质
化合物A的化学和物理特性列于表1中。制备该批次用于28天的良好实验室规范(GLP)毒理学研究,所述研究使用与制备用于临床成品药的活性药物成分(API)相同的合成方案和加工。
表1.化合物A的一般性质
1
实例2:化合物A的第一代合成。
步骤1:(N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]氨基甲酸叔丁酯)(中间体1)。向50.0-mL圆底烧瓶中放入N-[(1r,4r)-4-羟基环己基]氨基甲酸叔丁酯(500.0mg,2.32mmol,1.00当量)、N,N-二甲基甲酰胺(10.0mL)、氢化钠(82.8mg,3.45mmol,1.50当量)、2-氯-4-氟苯腈(432.6mg,2.78mmol,1.20当量)。将所得溶液在水/冰浴中在0℃下搅拌2小时。然后通过添加20.0mL的水将反应淬灭。将所得溶液用乙酸乙酯(40.0mL)萃取,并将有机层合并。将所得混合物用氯化钠(40.0mL)洗涤。将混合物经无水硫酸钠干燥。将残留物施加到具有乙酸乙酯/石油醚(1/2)的硅胶柱上。将收集的级分合并,并在真空下浓缩。这产生470.0mg(58%)呈黄色油状物的中间体1(N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]氨基甲酸叔丁酯)。LC-MS(ES
步骤2:(4-(((1r,4r)-4-氨基环己基)氧基)-2-氯苯腈)(中间体7)。向50.0-mL圆底烧瓶中放入中间体1(N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]氨基甲酸叔丁酯)(470.0mg,1.34mmol,1.00当量)、甲醇(5.0mL)、氯化氢。将所得溶液在室温下搅拌2小时。将所得混合物在真空下浓缩。这产生340.0mg(88%)呈黄色固体的中间体7(2-氯-4-[[(1r,4r)-4-氨基环己基]氧基]苯甲腈)盐酸盐。LC-MS(ES
步骤3:(6-[4-(羟甲基)哌啶-1-基]-N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]哒嗪-3-甲酰胺)(中间体2)。向100-mL圆底烧瓶中放入6-[4-(羟甲基)哌啶-1-基]哒嗪-3-羧酸(1.0g,4.21mmol,1.00当量)、中间体7(2-氯-4-[(1r,4r)-4-氨基环己基]氧基苯甲腈盐酸盐)(1.2g,4.18mmol,1.00当量)、N,N-二甲基甲酰胺(30mL)、N,N,N',N'-四甲基-O-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.4g,6.31mmol,1.50当量)、N,N-二异丙基乙胺(1.6g,12.38mmol,3.00当量)。将所得溶液在室温下搅拌1小时。然后通过添加水(50mL)将反应淬灭,并用乙酸乙酯(50mL x 3)萃取。将合并的有机层用盐水(50mL)洗涤,经硫酸无水钠干燥,并在真空下浓缩。将残留物施加到具有二氯甲烷/甲醇(v:v=12:1)的硅胶柱上。这产生1.1g(56%)呈黄色油状物的中间体2(6-[4-(羟甲基)哌啶-1-基]-N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]哒嗪-3-甲酰胺)。LC-MS(ES
步骤4:(6-(4-甲酰基哌啶-1-基)-N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]哒嗪-3-甲酰胺)(中间体3)。向100-mL圆底烧瓶中放入中间体2(700.0mg,1.49mmol,1.00当量)、二氯甲烷(20mL)、(1,1,1-三乙酰氧基)-1,1-二氢-1,2-苯并碘氧基-3(1H)-酮(947.2mg,2.23mmol,1.50当量)。将所得溶液在室温下搅拌3小时。将所得混合物在真空下浓缩。将残留物施加到具有乙酸乙酯/石油醚(v:v=1:3)的硅胶柱上。这产生390.0mg(56%)呈黄色固体的中间体3。LC-MS(ES
步骤5:(6-[4-([4-[2-(2,6-d二氧代哌啶-3-基)-6-氟-1,3-二氧代-2,3-二氢-1H-异吲哚-5-基]哌嗪-1-基]甲基)哌啶-1-基]-N-[(1r,4r)-4-(3-氯-4-氰基苯氧基)环己基]哒嗪-3-甲酰胺)(化合物A)。向100-mL圆底烧瓶中放入中间体3(180.0mg,0.38mmol,1.00当量)、二氯甲烷(10mL)、中间体5(2-(2,6-二氧代哌啶-3-基)-5-氟-6-(哌嗪-1-基)-2,3-二氢-1H-异吲哚-1,3-二酮盐酸盐)(152.7mg,0.38mmol,1.00当量)、三乙酰氧基硼氢化钠(244.6mg,3.00当量)。将所得溶液在室温下搅拌3小时。然后将反应物用水(30mL)淬灭,用乙酸乙酯(30mL x 3)萃取,用盐水(30mL)洗涤并在减压下浓缩。将固体滤出。HPLC分析显示,按面积计,粗品的纯度为81.5%,其中16.9%的面积被鉴定为未反应的中间体5。见图16A。将粗产物通过制备型HPLC在以下条件下纯化:色谱柱,XBridge Prep C18 OBD色谱柱,19*150mm 5um;流动相,水(10mmol/L碳酸氢铵)和乙腈(48.0%乙腈,在8分钟内升至73.0%);检测器,UV 254nm。这产生146.1mg(47%)呈黄色固体的化合物A。HPLC-UV分析显示,按面积计,纯化产物的纯度为98%,含有三种杂质,分别定量为0.54%、0.74%和0.73%。见图16B
实例3:化合物A的第二代合成
步骤1:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-(羟甲基)哌啶-1-基)哒嗪-3-甲酰胺。向配备有温度控制器、两个笔图记录器和氮气排放的清洁、干燥、100-L夹套的玻璃反应器中注入二甲基乙酰胺(24L,5体积)、中间体4(4800.5g,1wt)、哌啶-4-基甲醇(1699.9g,0.35wt)和二异丙基乙胺(4759g,0.99wt)。在2小时7分钟内将批次的温度调节至90℃,然后将批次在90℃下再保持15小时。通过HPLC监测反应。在48分钟内将批次的温度调节至50℃,然后加入乙酸异丙酯(48L,10体积)。将批次分成两等份(每份≈42L)进行检查。
第1部分检查。将第1部分注入清洁、干燥、100-L夹套的玻璃反应器中,并加热至50℃。注入纯化水(36L,7.5体积),并将批次在50℃下搅拌5分钟。允许这些层分离,并将下层水层丢弃至废弃物。注入乙酸异丙酯(12L,2.5体积)和纯化水(24L,5体积),并将批次温度调节至50℃。将批次在50℃下搅拌5分钟,然后使各层分离,并将下层水层丢弃至废弃物。IPC:
第2部分检查。将第2部分注入清洁、干燥、100-L夹套的玻璃反应器中,并加热至50℃。注入纯化水(36L,7.5体积),并将批次在50℃下搅拌5分钟。允许这些层分离,并将下层水层丢弃至废弃物。注入乙酸异丙酯(12L,2.5体积)和纯化水(24L,5体积),并将批次温度调节至50℃。将批次在50℃下搅拌6分钟,然后使各层分离,并将下层水层丢弃至废弃物。IPC:
将合并的乙酸异丙酯提取物返回到100-L反应器中。注入中间体2晶种(48.82g,0.01wt),并在2小时内将批次温度调节至15℃。将批次在真空(夹套温度35℃)下蒸馏至剩余26L(5.4体积)。加入乙酸异丙酯(46L,9.6体积),并在1小时内将批次温度调节至50℃。将批次在50℃下搅拌36分钟,然后在28分钟内冷却至20℃。将批次在真空(夹套温度35℃)下蒸馏至剩余28L(5.8体积),然后在18分钟内将温度调节至10℃,并在此温度下搅拌1小时18分钟。将沉淀的固体通过真空过滤在24英寸聚乙烯过滤漏斗上分离。将反应器用乙酸异丙酯(24L,5体积)冲洗,并将冲洗液用于洗涤滤饼。将湿饼进一步用乙酸异丙酯(24L,5体积)洗涤。在氮气下对过滤器调节46分钟后,将湿饼转移到八个玻璃干燥托盘(湿重6545.8g)中,并在45℃的真空烘箱中干燥~22小时,直到达到恒定的重量。将分离的中间体2(4597.8g,79.7%)包装到两个3密耳LDPE袋中并储存在纤维板桶内。HPLC分析:99.4%。
步骤2:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-甲酰基哌啶-1-基)哒嗪-3-甲酰胺。向配备有温度控制器、两个笔图记录器和氮气排放的清洁、干燥、100-L夹套的玻璃反应器中注入二氯甲烷(36L,7.9体积)、中间体2(4577.1g,1wt)、碳酸氢钠(1222.0g)、溴化钠(1097.5g,0.24wt)和纯化水(25L,5.5体积)。将双相混合物在1小时11分钟内冷却至0℃,然后在32分钟内加入TEMPO(15.2g,0.0033wt)于二氯甲烷(9L,2.0体积)中的溶液,同时将内部温度保持在0±5℃。在45分钟内加入次氯酸钠溶液(14353.4g,3.12wt),同时将内部温度保持在0±5℃。将浅黄色批次在0±5℃下再搅拌46分钟。通过HPLC监测反应。加入另外一部分次氯酸钠溶液(223.0g,0.05wt),并在0±5℃下再搅拌2小时。加入二氯甲烷(9L,2.0体积),并将批次再搅拌5分钟。使这些层分离,并将上层水层丢弃至废弃物。将有机相用亚硫酸钠溶液(1222.2g,0.27wt)在纯化水(19L,4.2体积)中洗涤(5分钟)。使这些层分离,并将上层水层丢弃至废弃物。将有机相用纯化水(9L,2.0体积)洗涤(10分钟)。使这些层分离,并将上层水层丢弃至废弃物。将富含产物的有机相与乙腈(19L,4.2体积)一起注入100L反应器中,并真空蒸馏(夹套温度45℃)至最终体积为26L。在真空蒸馏过程中,向反应器中加入额外的乙腈(37L,8.1体积)。加入乙腈(54L,11.8体积),并将批次真空蒸馏(夹套温度45℃)至最终体积为26L。通过
步骤3:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-((4-(2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代异吲哚啉-5-基)哌嗪-1-基)甲基)哌啶-1-基)哒嗪-3-甲酰胺(化合物A)。向配备有温度控制器、两个单笔图记录器和氮气排放的清洁、干燥、50-L夹套的玻璃反应器中注入二甲基乙酰胺(4.3L,2.5体积)和三乙酰氧基硼氢化钠(2020.4g,1.17wt)。将所得悬浮液在22分钟内冷却至5±5℃。
向配备有温度控制器、两个笔图记录器和氮气排放的清洁、干燥、22-L夹套的玻璃反应器中注入二甲基乙酰胺(8.5L,4.9体积)、中间体5(1719.8g,1wt)和中间体3(2134.0g,1.24wt)。在39分钟内将内部温度调节至0±5℃,然后在38分钟内加入三乙胺(1200mL,0.7体积),同时保持内部温度<5℃。
将反应器的内容物在1小时25分钟内转移到单独的反应器中,同时将内部温度保持在5±5℃。转移完成后,用二甲基乙酰胺(1.1L,0.64体积)冲洗第一个反应器,并将冲洗液转移到第二个反应器中。将批次在5±5℃下再搅拌61分钟。通过HPLC监测反应。
向配备有温度控制器、两个笔图记录器和氮气排放的清洁、干燥、100-L夹套的玻璃反应器中注入乙醇(21L,12.4体积)和纯化水(21L,12.4体积)。在51分钟内将内部温度调节至10±5℃。将含有反应混合物的反应器的内容物在9分钟内转移到玻璃反应器中,同时保持内部温度<20℃。转移完成后,用二甲基乙酰胺(1.1L,0.64体积)冲洗前反应器,然后将冲洗液转移到玻璃反应器中。在3小时内将批次的温度调节至50℃,并在此温度下再保持33分钟。在81分钟内将批次冷却至20℃,在此温度下保持69分钟,然后通过真空过滤在24英寸聚乙烯过滤漏斗上分离沉淀的固体。将反应器用1:1乙醇/纯化水(2×11L,2×6.4体积)冲洗,并将冲洗液用于洗涤滤饼。将湿饼进一步用乙醇(2×11L,2×6.4体积)洗涤。在氮气下对过滤器调节≈13小时后,将湿饼(粗品化合物A)转移到七个玻璃干燥托盘(湿重11353g)中,并在25℃的真空烘箱中干燥≈115小时,直到达到恒定的重量(3382.4g)。HPLC纯度:99.60面积%(见图17A)。
向配备有温度控制器、两个笔图记录器和氮气排放的清洁、干燥、100-L夹套的玻璃反应器中注入二氯甲烷(54.7L,16.2体积)、甲醇(6L,1.8体积)和粗品化合物A(3375.5g,1wt)。搅拌批次直至观察到完全溶解(27分钟)。将批次通过0.4微米的在线过滤器澄清,然后在真空(夹套温度65℃)下蒸馏,同时加入预过滤乙醇(27L,8体积),加入的速率使总体积保持在≈67.5L。将在预过滤乙醇(200mL,C019788)中浆化的化合物A籽晶(8.4g,0.0025wt)加入到批次中。在真空(夹套温度65℃)下继续蒸馏,同时加入预过滤乙醇(54L,16体积),加入的速率使总体积保持在≈67.5L。通过
实例4:控制化合物A的制造工艺中的关键步骤和中间体
在此开发阶段,过程中控制包括对反应混合物的温度监测和高效液相色谱(HPLC)分析以确定反应的程度。通过预期的HPLC终点监测方案4中描述的转化的限制性试剂的消耗。
表2中提供了化合物A合成的关键过程中控制和靶标限值。
表2.关键过程中控制点和验收限值
化合物A的工艺开发包含10至100克实验室规模上的合成路线和相关工艺的开发,并转移至公斤实验室,用于以1.5千克的规模制备28天的毒理学用品。使用与28天毒理学用品相同的合成路线和工艺,以3千克规模制备用于制备临床用品的化合物A。
实例5:中间体4的第二代合成
步骤1:((1r,4r)-4-羟基环己基)氨基甲酸叔丁酯。在0-10℃下向K
步骤2:((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)氨基甲酸叔丁酯。在-10℃下将NaH(60%,于矿物油中,1110g,27.8mol)加入到中间体6((1r,4r)-4-羟基环己基)氨基甲酸叔丁酯(5kg,23mol)于DMF(65L)中的溶液中。将混合物在-10℃下搅拌1小时。分批加入2-氯-4-氟苯腈(3.6kg,23mol)。将所得混合物在-10℃下搅拌1小时。TLC(己烷/乙酸乙酯=5/1,2-氯-4-氟苯腈:R
步骤3:4-(((1r,4r)-4-氨基环己基)氧基)-2-氯苯腈盐酸盐。在0-20℃下将乙酰氯(13.6kg,173mol)逐滴加入到甲醇(35L)中。加入完成后,将混合物在室温下搅拌1小时。向混合物中加入中间体1(15.2Kg),并将所得混合物在室温下搅拌2小时。TLC(己烷/乙酸乙酯=5/1,SM:R
步骤4:6-氯-N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)哒嗪-3-甲酰胺。向20-L夹套反应器中注入6-氯哒嗪-3-羧酸(0.490kg,3.09mol,1.00当量)、中间体7(0.888kg,3.09mol,1.00当量)和乙酸乙酯(4.4L,9体积)。在47分钟内加入三乙胺(1.565kg,15.5mol,5.0当量),并用乙酸乙酯(0.5L,1体积)冲洗添加泵管路。将批次温度调节至15–25℃,并在70分钟内将T3P(3.93kg 50%溶液,6.2mol,2.00当量)加到反应中。用乙酸乙酯(0.5L,1体积)冲洗计量泵。将批次在19–20℃下陈化30分钟。通过HPLC监测反应。通过在45分钟内加入1N水性HCl(≈5L,1.6当量)淬灭反应。将浆料搅拌过夜,然后将批次在带有滤纸的布氏漏斗(Buchner funnel)中过滤。用水(2×2.4L,2×5体积)和乙酸乙酯(2L,4体积)冲洗水壶和滤饼。将湿饼在室温下在乙酸乙酯(2.5L,5体积)中重新浆化30分钟。将批次过滤并用乙酸乙酯(1.5L,3体积)冲洗。然而,湿饼的过程中HPLC分析显示N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-羟基哒嗪-3-甲酰胺(羟基杂质)的水平没有变化。将湿饼(1055g)在40–50℃下在托盘干燥机中干燥,得到0.96kg中间体4(79%产率)。通过KF滴定,批次的水含量为0.17wt%。1H NMR光谱与指定结构一致,HPLC纯度为97.3面积%,羟基杂质为2.4面积%。
将不纯的中间体4(906g)注入具有DMAc(2.72L,3体积)的10-L反应器中,并将批次升温至50.6℃。加入IPAc(2.72L,3体积),并将批次在50℃下保持1小时。在1.5小时内将温度调节至20℃,然后过滤批次。用IPAc(3×1.8L,3×2体积)冲洗反应器和滤饼。将湿饼(1.3kg)在30-35℃下在托盘干燥机中干燥,得到0.772kg 6-氯-N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)哒嗪-3-甲酰胺(中间体4)(85%产率)。1H NMR光谱与指定结构一致(见图20),HPLC纯度为98.6面积%,羟基杂质为1.3面积%。
实例6:中间体5的第二代合成
步骤1:2-(2,6-二氧代哌啶-3-基)-5,6-二氟异吲哚啉-1,3-二酮。将4,5-二氟邻苯二甲酸(9.81kg,1.0当量)、3-氨基哌啶-2,6-二酮(10.38kg,1.3当量)、CH
步骤2:4-(2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代异吲哚啉-5-基)哌嗪-1-羧酸叔丁酯。向100-L夹套反应器中注入中间体8(4.50kg,15.30mol,1.00当量)、碳酸氢钠(1.542kg,18.35mol,1.20当量)、叔丁氧羰基哌嗪(3.134kg,16.82mol,1.10当量)和NMP(22.5L,5体积)。以125rpm搅拌批次。在4小时内将批次温度调节至90℃。将批次在90℃下搅拌16.5小时。通过HPLC监测反应。将批次冷却约2小时至24℃。将冷却的反应混合物从反应器中取出至大瓶中,然后用甲醇、丙酮和水清洁反应器。向反应器中注入水(43.2L,9.6体积)和乙腈(1.8L,0.4体积)。将批次温度调节至20℃。在2小时内将大瓶中的产物混合物加到淬火溶液中,同时将保持温度在15-25℃。将沉淀的产物浆料转移到Nutsche过滤器中。将反应器和滤饼用水(2×22.5L,2×5体积)冲洗,并将滤饼在氮气下调节过夜。将湿饼(18.6kg)在40-45℃下在托盘干燥机中干燥11天,得到7.05kg 4-(2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代异吲哚啉-5-基)哌嗪-1-羧酸叔丁酯(中间体9)(100%产率)。通过KF滴定,批次的水含量为0.6wt%,并且
步骤3:2-(2,6-二氧代哌啶-3-基)-5-氟-6-(哌嗪-1-基)异吲哚啉-1,3-二酮盐酸盐。将30加仑的Pfaudler反应器配备氢氧化钠(2M)洗涤器。向反应器中注入3M盐酸溶液/甲醇(70L,10体积)。以75rpm搅拌批次。在30分钟内将批次温度调节至31.7℃。将中间体9(7.00kg,15.20mol)和二氯甲烷(28L,4体积)注入40-L大瓶中。搅拌浆料以溶解中间体9。在6.5小时内将中间体9的溶液注入30加仑反应器中,同时将温度保持在30-40℃。将批次在35℃下陈化21小时。通过HPLC监测反应。将批次在约30分钟内冷却至17.4℃。将浆料在Nutsche过滤器中过滤。用甲醇(15.75L)和二氯甲烷(5.25L)的混合物冲洗反应器和滤饼。将湿饼(7.1kg)在40–50℃下在托盘干燥机中干燥,得到5.14kg产物(85%产率)。通过KF滴定,批次的水含量为3.4wt%,并且
然后将批次重新纯化。向100-L夹套反应器中注入先前产物(4.95kg,12.5mol)和二甲基乙酰胺(15.0L,3体积)。将批次温度调节至55℃。将一部分水(8.4L,1.7体积)注入批次,并将温度重新调节55–65℃。将混合物搅拌44分钟,得到澄清溶液。在1小时内向批次中注入2-丙醇(40L,8体积),同时保持温度高于45℃。将批次在55℃下用中间体5晶种(5g)引晶。将批次在45–55℃下保持20分钟,并在1小时内冷却至25℃。将批次在20–25℃下陈化17.5小时。将浆料在Nutsche过滤器中过滤。用2-丙醇(25L,5体积)冲洗反应器和滤饼。将滤饼再次用2-丙醇(25L,5体积)洗涤。将湿饼(5.8kg)在40–50℃下在托盘干燥机中干燥,得到3.95kg产物(79%回收率)。通过KF滴定,批次的水含量为2.1wt%,并且
第三代合成
实例7:化合物A的第三代合成
步骤1:6-(4-(羟甲基)哌啶-1-基)哒嗪-3-羧酸(中间体10)。以下方案7中示出了中间体10的合成途径。
方案7.中间体10的合成途径
步骤2:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-(羟甲基)哌啶-1-基)哒嗪-3-甲酰胺。向配备有机械搅拌器、温度计和氮气排放的30-L夹套反应器中加入6-(4-(羟甲基)哌啶-1-基)哒嗪-3-羧酸(中间体10)(500g,2.11mol,1当量)、4-(((1r,4r)-4-氨基环己基)氧基)-2-氯苯腈盐酸盐(中间体7)(654g,2.28mol,1.08当量)和DMAc(2.5L,5体积)。向混合物中加入DIPEA(1.092Kg,8.43mol,4当量)和氰基羟基亚氨基乙酸乙酯(314g,2.21mol,1.05当量)。一次性向浆料中加入1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDCI)(525g,2.74mol,1.3当量)。将反应混合物的温度升高至~40℃。将反应混合物在~40℃的内部温度下保持~3小时。通过IPC监测反应。
将反应混合物用IPAc(5L,10体积)和H
步骤3:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-甲酰基哌啶-1-基)哒嗪-3-甲酰胺。向配备有机械搅拌器、温度计和氮气排放的30-L夹套反应器中加入中间体2(700g,1.49mol,1当量),然后加入DCM(5.6L,8体积)。在室温下向澄清溶液中加入NaHCO
停止搅动,并将各层分离。将有机相排干并收集在干净的大瓶中。使用DCM(1.4L,2体积)对水相进行反萃取并收集有机物。弃去水相。将有机相转移到反应器中并用Na
步骤4:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-((4-(2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代异吲哚啉-5-基)哌嗪-1-基)甲基)哌啶-1-基)哒嗪-3-甲酰胺。向配备有温度控制器、温度计、机械搅拌器和氮气排放的清洁、干燥、10-L夹套的玻璃反应器中注入二甲基乙酰胺(1.24L,2.75体积)和三乙酰氧基硼氢化钠(528g,2.42当量)。将所得悬浮液冷却至5±5℃。
向配备有温度控制器、温度计、机械搅拌器和氮气排放的清洁、干燥、30-L夹套的玻璃反应器中注入二甲基乙酰胺(2.2L,4.9体积)、中间体5(450g,90.7wt%)和中间体3(563g,94wt%,1.1当量)。将内部温度调节至0±5°,然后在40分钟内加入三甲胺(315mL),同时保持内部温度<5℃。将含有中间体5和中间体3的反应器的内容物在40分钟内转移到含有三乙酰氧基硼氢化钠的反应器中,同时将内部温度保持在5±5℃。转移完成后,用二甲基乙酰胺(DMAC)(225mL,0.5体积)冲洗反应器,然后将冲洗液转移到另一个反应器中。将批次在5±5℃下再搅拌1小时。通过IPC监测反应。
向配备有温度控制器、温度计和氮气排放的清洁、干燥、30-L夹套的玻璃反应器中注入乙醇(5.5L,12.1体积)和纯化水(5.6L,12.4体积)。将内部温度调节至15±5℃。将含有工艺混合物的反应器的内容物在1小时内转移到新反应器中,同时保持内部温度<20℃。转移完成后,用DMAC(200mL,0.5体积)冲洗前一个反应器,并将冲洗液转移到后一个反应器中。将批次的温度调节至50℃,并在此温度下再保持1小时。将批次在81分钟内冷却至20℃,在此温度下保持1,然后通过真空过滤分离沉淀的固体。将反应器用1:1乙醇/纯化水(2×2.9L,2×6.4体积)冲洗,并将冲洗液用于洗涤滤饼。将湿饼进一步用乙醇(2×2.9L,2×6.4体积)洗涤。在过滤器上调节1小时后,将湿饼(粗品化合物A)转移到三个玻璃干燥盘中,在50℃的真空烘箱中干燥3天。没有达到恒定重量。
向配备有温度控制器、温度计、机械搅拌器、冷凝器、真空控制器和氮气排放的清洁、干燥、30-L夹套的玻璃反应器中注入二氯甲烷(15L,16.2体积)、甲醇(1.66L,1.8体积)和粗品化合物A(925g,1wt)。搅拌批次直至观察到完全溶解。将批次通过0.4微米的在线过滤器澄清,然后在真空(夹套温度65℃)下蒸馏,同时加入
乙醇(5.6L,8体积),加入的速率使总体积保持在≈18.5L。将在乙醇(120mL)中浆化的化合物A籽晶(1.85g,0.0025wt)加入到批次中。在真空(夹套温度65℃)下继续蒸馏,同时加入乙醇(10L,10体积),加入的速率使总体积保持在≈18L。通过IPC监测蒸馏。将批次在20±5℃下搅拌18小时,然后通过真空过滤分离沉淀的固体。将湿饼进一步用纯化水(2×2L,2×2体积)和乙醇(2×2L,2×2体积)洗涤。将湿饼在25℃下在真空中干燥≈24小时,直到达到恒定的重量。分离的N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-((4-(2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代异吲哚啉-5-基)哌嗪-1-基)甲基)哌啶-1-基)哒嗪-3-甲酰胺(化合物A)(850g,100%)HPLC分析:99.22面积%(图18)。
实例8.阐明化合物A的结构和其它物理特性
方案8.化合物A的带编号的碳原子。
化合物A分子在碳36处存在单个立体中心。化合物A的起始材料来自非手性前体,因此该分子是外消旋的。
中心碳10和7是介观,并且根据定义不具有手性。酰胺和醚分别在碳10和7上的1,4-反式关系由
原料药已通过应用各种光谱技术(
NMR光谱法
在NMR溶剂氘代二甲亚砜(DMSO-d
1
表3.
NMR=核磁共振
a
b
c
d
质谱法
化合物A的高分辨率质谱(MS)分析是在傅里叶变换模式下使用正离子电喷雾[高分辨率电喷雾电离质谱法(HR-ESI)]在Thermo Orbitrap MS上进行流动注射分析而进行的。
化合物A的高分辨率质谱图呈现在图6中,并且812.308母离子的MS/MS碎裂产生的主峰呈现在图7中。
对观察到的MS/MS离子(MS
红外光谱法
化合物A的红外光谱是在配备DuraSamplIR金刚石ATR探头的Bomem MB-102FTIR光谱仪上获得的。图9中示出了所述光谱,以及观察到的峰列表。为化合物A的结构提供进一步支持的关键特征是2225cm
实例9:确定化合物A的粒径分布的研究摘要
表4中示出了将用于制备用于临床用途的成品药的化合物A批次12070-C-01-72-01的粒径统计。
表4.化合物A的粒径分布
实例10:化合物A的第二代制造工艺中的杂质
化合物A原料药批次含有低水平的杂质。表5中提供了每种已知杂质的结构和来源。按照协调国际会议(ICH)Q3C:“杂质:残留溶剂(Impurities:Guidelines for ResidualSolvents.)”,合成的最后步骤中使用的溶剂残留水平在限制范围内。残留元素金属符合美国药典(USP)<232/233>中针对成品药的限制,并遵循食品药品监督管理局(FDA)和ICH元素杂质指南(ICHQ3D)中描述的原则。
表5.化合物A原料药中与工艺相关的杂质
实例11.化合物A制造工艺的分析程序
下面呈现了化合物A的化合物特异性分析方法的摘要。
用于身份、测定和杂质的HPLC
这是一种反相高效液相色谱(HPLC)方法,旨在确定化合物A的测定和杂质谱,用于释放和稳定性测试。该方法符合其预期用途。进行强制降解研究,并用于将该方法定性为稳定性指示。HPLC参数列于下表6中。
表6.HPLC参数
梯度:
GC方法
这是一种气相色谱(GC)方法,用于测定化合物A原料药中的残留溶剂。色谱参数列于表7中。
表7.方法编号的GC参数
FID=火焰离子化检测器;GC=气相色谱;Temp.=温度
用于确定化合物A原料药中的测定、杂质和残留溶剂的分析程序已被认证。方法中提供了资格标准。高效液相色谱(HPLC)方法的认证旨在确保HPLC方法适合其测定和杂质确定的预期用途。该方法在特异性、检测限(LOD)、定量限(LOQ)、线性、精密度和溶液稳定性方面进行了认证。为每个研究参数建立了验收标准。强制降解研究确定,方法TM05187具有稳定性指示性,并且适用于在稳定性研究期间监测化合物A的测定和杂质确定。气相色谱(GC)方法的认证旨在确保该方法适合其用于残留溶剂确定的预期用途。该方法在特异性、灵敏度、线性和重复性方面进行了认证。
实例12.化合物A的稳定性研究
关于化合物A的探索性稳定性研究正在进行中。化合物A的稳定性将在5℃、25℃/60% RH和40℃/75% RH下进行研究,采样点为1个月、2个月、3个月和6个月。将使用稳定性指示方法TEST-05187(高效液相色谱法(HPLC))分析样品。
将被监测的原料药化合物A的关键质量属性是外观、纯度、测定(wt%)、杂质、水含量和x射线粉末衍射(XRPD)。用于稳定性研究的容器和封闭系统由放置在高密度聚乙烯(HDPE)容器内的双塑料(PE)袋组成。来自本研究的数据如表8、9和10所示。
表8.化合物A在5℃+/-3℃下储存的稳定性数据
1
HPLC=高效液相色谱法;ND=<0.02%;QL=0.05%;XRPD=x射线粉末衍射
表9.化合物A在25℃±2℃/60% RH±5%下储存的稳定性数据
/>
1
HPLC=高效液相色谱法;ND=<0.02%;QL=0.05%;XRPD=x射线粉末衍射
表10.化合物A在40℃±2℃/75% RH±5%下储存的稳定性数据
/>
1
HPLC=高效液相色谱法;ND=<0.02%;QL=0.05%;XRPD=x射线粉末衍射
摘要:2个月后,在所有温度站均未观察到杂质增加或固体性质变化。自制造之日起5个月后,没有观察到杂质增加或固体性质的变化。已经观察到水含量略有增加。
实例13.化合物A片剂的描述和组成
化合物A片剂旨在用于口服施用。含有5mg和35mg原料药的片剂分别由普通造粒制成,压力机重量分别为100mg和700mg。片剂组成列于表11中。
表11.化合物A 5片剂(5mg和35mg)的组成
NF/USP:美国国家处方集/美国药典;Ph.Eur.:欧洲药典;JP:日本药典
实例14.喷雾干燥分散中间体的制备。
在小规模下制造多种组合物并进行体外评估(例如,溶解度、稳定性等)和体内评估(例如,生物利用度、暴露水平等)。与纯喷雾干燥化合物A相比,掺入聚合物和/或表面活性剂的分散体没有观察到任何优势。为了保持简单性并使载药量最大化,采用了纯API喷雾干燥。
已经制造出一个工程化批次和两个临床批次的喷雾干燥中间体。下面显示的信息取自第一个临床批次的GMP制造批次记录(MBR)。由于这源自MBR,因此参考了特定的设备。没有理由期望同等的制造设备不会同样有效。
用于制备喷雾干燥中间体的工艺:
1.从结晶固体化合物A开始,在90%/10%(w/w)二氯甲烷/甲醇中制备化合物A的2.5%(w/w)溶液;
2.使用以下条件使用SK80-16喷嘴在PSD-1喷雾干燥机中对溶液进行喷雾干燥:
3.收集旋风分离器中的固体并转移到托盘干燥机中,以使用定义的温度/湿度斜升将残留的二氯甲烷和甲醇除去至低于ICH指导水平。
喷雾干燥分散体的更新制备
将上述工艺进一步细化。更新后的过程如下:
1.从结晶固体化合物A开始,在93%/7%(w/w)二氯甲烷/甲醇中制备化合物A的6%(w/w)溶液;
2.使用以下条件使用Schlick 121型喷嘴在PSD-1喷雾干燥机中对溶液进行喷雾干燥:
3.收集旋风分离器中的固体并转移到过滤干燥机中,以在40和60℃之间在真空下将残留的二氯甲烷和甲醇除去至低于ICH指导水平。
纯喷雾干燥化合物A的造粒共混物和片剂
下面的表12示出了取自GMP MBR的第一临床批次的5mg和35mg片剂的组成。批次中使用的实际数量与指示的小数点目标水平相匹配。按百分比计算,前体工程化批次和第二临床批次的组成相同,尽管所用材料的绝对数量不同。同样,由于这源自MBR,因此以下信息参考了特定的设备。没有理由期望同等的制造设备不会同样有效。
表12.纯喷雾干燥化合物A的第一临床批次片剂的组成。
用于制备纯喷雾干燥化合物A的片剂的工艺:
1.向料仓搅拌机中注入物品1-5
2.在12RPM下,旋转搅拌机180次
3.通过使共混物通过带有032R筛网的U10 Comil进入料仓搅拌机,将共混物脱块
4.在12RPM下,旋转搅拌机180次
5.通过20目筛网筛选物品6,并添加到搅拌机
6.在12RPM下。旋转搅拌机48次
7.通过带有滚花辊和1.25mm方丝造粒机筛网的Gerteis辊压实机进行颗粒共混
8.在料仓搅拌机中收集颗粒状材料,并注入通过20目筛网的物品7
9.在12RPM下旋转搅拌机48次以产生最终共混物
10.将最终共混物分到一个容器中,用于5mg片剂,并分到另一个容器用于35mg片剂
11.使用5工位Korsch XL100和0.3403”×0.6807”椭圆形刀具,以合适的压缩力(~14kN)压制35mg片剂
12.使用10工位Korsch XL100和0.25”SRC工具,以合适的压缩力(~4kN)压制5mg片剂
未测量用于制备临床用品的造粒的粒径。然而,如通过筛分分析确定的,使用相同百分比的组成和等效设备测量工程化批次的尺寸分布,如图10所示。
实例15.化合物A成品药。
化合物A的5mg和35mg片剂由喷雾干燥无定形化合物A的普通造粒制成,加入了以下药典赋形剂:
●微晶纤维素
●乳糖一水合物
●交联羧甲基纤维素钠
●二氧化硅
●硬脂酸镁
将片剂包装在热感应密封高密度聚乙烯瓶中并运送到临床药房,所述瓶子盖有衬里的聚丙烯封盖。包含一个二氧化硅干燥剂罐,以保持低湿度环境。
原料药注意事项
化合物A被指定为BCS IV(低溶解度,低渗透性)。MDCK细胞中的低体外渗透性以及结晶固体在pH 6.5模拟肠液(SIF)中的低溶解度(1.2μg/mL)支持了这一指定。这导致在施用形成胶体的抗沉淀溶液时,在面对低肝清除率时观察到适度的口服生物利用度。该化合物在SIF中的无定形溶解度为30μg/mL。进行了膜通量实验,其中将固定量的化合物以不同浓度的SIF胆盐引入供体室,并在受体侧监测药物的外观。化合物渗透速率强烈依赖于供体溶液中存在的胶束物质的浓度(表13),这表明吸收不仅受到低水溶性的限制,还受到溶解后的药物跨肠壁附近的未搅拌水层扩散的限制。如果吸收完全受溶解度的限制,则通量不会随这些物质的浓度而变化。因此,形成胶体的赋形剂不仅可以通过抑制沉淀来提高生物利用度,而且还可以通过在吸收发生时提供快速补充内腔表面的游离药物的载体来提高生物利用度。
表13.作为SIF浓度函数的通量测量结果
SIF=模拟肠液
基于机理的对上述吸收局限性的理解建议使用无定形分散体作为利用非结晶固体的较高溶解度特性的手段。化合物A具有与这种增溶策略兼容的热特性。纯结晶材料的熔点为290℃,与保持结晶状态的高倾向一致,玻璃化转变温度(Tg)为146℃。因此,虽然化合物A的晶体相当稳定,但从无定形形式转变为结晶状态仍存在显著障碍。事实上,部分结晶样品的温度倾斜上升最终会导致重结晶事件,但直到达到200-220℃的温度。因此,即使在纯状态下,也需要非常大量的能量来诱导无定形化合物A的迁移率和潜在结晶。如下所述,即使在存在水的情况下也能保持这种强大的抗结晶性。
进行90分钟的非下沉溶解实验,其中将化合物A悬浮液以1mg/mL的终浓度引入pH2HCl中,然后定期采样并准备通过离心进行分析。在实验30分钟后改变为pH 6.5SIF。图11中清楚地证明了无定形固体相对于结晶形式的溶解度改善。在实验的胃阶段达到更高的浓度,并在肠阶段用喷雾干燥的无定形化合物A维持所述更高的浓度。
早期调配物开发
由于化合物A的溶解度有限,早期的大鼠PK研究是在多种媒剂中用化合物A的溶液进行的。使用含有增溶剂和沉淀抑制剂的溶液的大鼠剂量线性暴露递增表明,如果在上消化道(GI)中维持足够浓度的可吸收药物,则化合物可以被递送到体循环中。
用喷雾干燥分散体进行大鼠研究
向雄性大鼠口服施用10mL/kg化合物A作为喷雾干燥分散体(SDD),所述化合物在含有0.5%甲氧醇A4M的水悬浮液中。加入聚乙烯吡咯烷酮/醋酸乙烯酯共聚物(PVPVA)中10%、25%和50%的载药量,以及羟丙基甲基纤维素(HPMC)或L级醋酸羟丙基甲基纤维素琥珀酸酯(HPMCAS-L)的25%的负载。这允许在共同载药量下比较最主要聚合物以及其它聚合物的载药量。
来自表14中描述的药代动力学研究的数据表明,与其它聚合物相比,使用PVPVA导致更好的暴露,但仅在10%的载药量下,这进而与类似剂量的溶液相比有利。该数据导致选择10:90化合物A:PVPVA分散体作为大鼠良好实验室规范(GLP)毒理学研究中所采用的调配物。
虽然负载10%药物的SDD使得大鼠能够进行28天的GLP毒理学研究,但因为临床前物种允许的高剂量体积,这样的值太低而无法用于人固体剂型。纯喷雾干燥无定形化合物A的性能在所有施用的无定形固体中实现了第二高的暴露,并将最大限度地提高临床固体剂型的强度。
表14.在大鼠药代动力学研究中测试的调配物
DMSO=二甲亚砜;HPMC=羟丙基甲基纤维素;HPMCAS-L=L级醋酸羟丙基甲基纤维素琥珀酸酯;PEG400=聚乙二醇400;PVPVA=聚乙烯吡咯烷酮/醋酸乙烯酯共聚物
用喷雾干燥分散体进行狗研究
来自表15中描述的药代动力学研究的数据示出了将化合物A作为药物的四种不同聚合物分散体的0.5% Methoce悬浮液(10mg/kg活性)施用于禁食的、经五肽胃泌素预处理的公狗的调配物。与溶液相比,狗中的悬浮液产生较低的暴露。因此,溶液调配物被用于28天的GLP毒理学研究。然而,关于临床固体剂型的开发,在曲线下面积(AUC)值的可变性范围内,没有迹象表明低载药量SDD的暴露得到改善。当这些数据与大鼠的实验结果相结合时,表明100%喷雾干燥无定形化合物A在实现暴露方面与化合物A/聚合物组合一样有效。因此,选择这种形式的药物掺入固体口服剂型中。
表15.在狗药代动力学研究中测试的调配物
DMSO=二甲亚砜;HPMC=羟丙基甲基纤维素;HPMCAS-L=L级醋酸羟丙基甲基纤维素琥珀酸酯;PEG400=聚乙二醇400;PVPVA=聚乙烯吡咯烷酮/醋酸乙烯酯共聚物
进行了与为获得表13中几种无定形悬浮液的数据而进行的实验类似的通量实验,结果如表16所示。无论聚合物包合物或载药量如何,通量都保持不变,因此证明了不含聚合物的纯喷雾干燥无定形化合物A在溶液中获取游离、可吸收药物的能力。
表16.喷雾干燥无定形和结晶化合物A的通量测量结果
PVPVA=聚乙烯吡咯烷酮/醋酸乙烯酯共聚物
纯化合物A的无定形形式具有高Tg甚至更高的重结晶温度。在高湿度的塑化条件下,玻璃化转变温度确实会降低。然而,该值仍远高于Tg与临床表现将遇到的任何温度之间通常应用的40-50℃差异。如表17所示,纯喷雾干燥无定形化合物A在高湿度条件下比聚合物分散体更稳定。
表17.含喷雾干燥无定形化合物A的固体的玻璃化转变温度作为温度和相对湿度的函数。
API=活性药物成分;PVPVA=聚乙烯吡咯烷酮/醋酸乙烯酯共聚物;RH=相对湿度
总之,体外和体内数据支持在临床调配物中使用纯喷雾干燥无定形化合物A API。
实例16.溶剂筛选
进行筛选以确定在喷雾干燥之前用于纯化化合物A和用于溶解结晶化合物A的最佳溶剂。筛选的结果在表18中示出。
表18.溶剂筛选初步数据。
实例17.喷雾干燥无定形化合物A中间体的制造工艺开发
采用在小规模(实验室)和~0.5kg(演示)规模下生产的无定形化合物A来优化回收的加工条件,并研究化学稳定性、非下沉溶解性能、粒径、热特性和残留溶剂水平。将结晶化合物A溶解在90:10二氯甲烷:甲醇(DCM:MeOH)中以得到2.5wt%的浓度,然后引入喷雾干燥机以产生无定形状态。使用两阶段托盘干燥程序除去残留溶剂。
通过激光衍射测量干燥粉末的粒径,如表19所示。正如预期的那样,使用较小规模的干燥机获得的粒径略小于使用较大干燥机进行喷雾干燥得到的粒径。使用后一种设备可重复获得10μm的D
表19.喷雾干燥中间体的激光衍射粒径。
D
D
D
合适的喷雾溶液和溶剂湿喷雾干燥中间体(SDI)在一周的时间内的化学稳定性已得到确认,如表20所示。
表20.溶剂湿喷雾干燥无定形化合物A和DCM/MeOH喷雾溶液在25℃下的化学稳定性。
DCM=二氯甲烷;MeOH=甲醇
最后,从性能角度来看,来自不同制造规模的几种无定形化合物A样品的非下沉溶解(如图12所示)再次证实了在初始调配物设计阶段观察到的pH改变的非下沉溶解度曲线。
实例18:化合物A片剂开发。
使用常规填充剂、助流剂、崩解剂和润滑剂制成几种不同组成的35mg强度化合物A片剂(表21)作为实验室规模的原型,以在制造后和应力储存条件(在50℃/75% RH开放下2周)后立即评估化学稳定性(表22)和溶解度(图13)。
表21. 35mg化合物A片剂原型的组成。
表22.原型片剂在50℃/75% RH开放下2周后的化学稳定性
基于所有组合物可接受的化学稳定性以及用调配物A3观察到的改进的溶解度曲线,选择A3进行临床开发。
实例19:喷雾干燥无定形化合物A中间产物的化合物A制造工艺开发:表征和过程评估
如上所述,化合物A在无定形状态下的维持是实现体内性能不可或缺的一部分。因此,努力确保对化合物A中间产物的产生和随后的使用有透彻的了解。
表23中提供了对喷雾干燥无定形化合物A中间产物的批次分析。该数据表明,通过喷雾干燥将化合物A从结晶形式转化为无定形形式不会对效力或杂质分布产生重大影响。这也证实了喷雾干燥中间体的无定形性质。
表23.喷雾干燥无定形化合物A中间产物演示批次(SDI)的批次分析结果与输入API的对比
/>
DCM=二氯甲烷;FIO=仅供参考;MeOH=甲醇;LOD=检测限;LOQ=定量限;PXRD=粉末x射线衍射;RRT=相对保留时间;SEM=扫描电子显微镜
低杂质水平的差异被认为是由方法可变性引起的。
实例20:化合物A(“喷雾干燥中间体”)的无定形形式的稳定性
在三种稳定性条件下评估了无定形化合物A的稳定性:2-8℃;25℃/60%RH;和40℃/75% RH,持续12个月。
在稳定性测试期间,将无定形化合物A储存在放置在含有干燥剂罐并盖有聚丙烯衬里封盖的热感应密封高密度聚乙烯(HDPE)瓶中的线束低密度聚乙烯袋中。
在2-8℃下储存6个月后,化合物A的无定形形式的纯度为>95%(95.7%),其中水是主要杂质(0.9%)。
在25℃/60% RH下存储12个月后,化合物A的无定形形式的纯度为>97%(97.7%),其中水是主要杂质(1.62%)。
在40℃/75% RH下存储12个月后,化合物A的无定形形式的纯度为98%,其中水是主要杂质(2.16%,如通过卡尔费休滴定法测量的)。
值得注意的是,在所有三种储存条件下,在这些研究期间的任何时候都没有无定形形式的化合物A重结晶的证据。
实例21.化合物A片剂的批次制造
化合物A片剂,5和35mg,由单一的、共同的共混物制备而成。在共混之前,将化合物A原料药(DS)溶解,然后进行喷雾干燥,以形成无定形成品药中间体(无定形化合物A)。表24和表25分别提供了演示批次每种强度(5mg和35mg片剂)的配方。
表24.化合物A片剂演示批次配方,5mg
a
b
表25.化合物A片剂演示批次配方,35mg
a
b
化合物A片剂的容器封闭系统
将化合物A片剂,5mg和35mg,包装在尺寸分别为100cc和500cc的热感应密封高密度聚乙烯瓶中,所述瓶子含有干燥剂,并用儿童安全盖封闭。主要的容器封闭组件符合美国(US)和欧盟(EU)有关与食品接触的材料的相关指南。
实例22.化合物A片剂的批次配方。
化合物A片剂,5和35mg,由单一的、共同的共混物制备而成。在共混之前,将化合物A DS溶解,然后进行喷雾干燥,以形成无定形成品药中间体(无定形化合物A)。表26和表27中提供了每种强度的代表性配方。
表26.临床化合物A片剂的批次配方,5mg
JP=日本处方集;NF=美国国家处方集;Ph.Eur.=欧洲药典;USP=美国药典
*共同共混物的总重量,所述共同共混物被适当划分以制成两个批次的片剂。
表27.临床化合物A片剂的批次配方,35mg
JP=日本处方集;NF=美国国家处方集;Ph.Eur.欧洲药典;USP=美国药典
*共同共混物的总重量,所述共同共混物被适当划分以制成两个批次的片剂。
实例23.化合物A片剂的制造和工艺描述。
化合物A中间产物:将化合物A溶解在国家处方集(NF)级的二氯甲烷(DCM)和甲醇(MeOH)的90/10(w/w)混合物中,并搅拌,直至得到25mg/mL澄清黄色溶液。将该溶液引入喷雾干燥机中。对潮湿的固体输出进行托盘干燥,以产生无定形固体(无定形化合物A)。作为过程中测试,检查该固体的残留DCM和MeOH。化合物A中间产物的制造工艺流程图如图14所示。
成片:采用普通的干法造粒法生产化合物A片剂。将无定形化合物A在合适的搅拌机中与微晶纤维素、乳糖一水合物、交联羧甲基纤维素钠和二氧化硅共混。将所得粉末脱块并加入硬脂酸镁并共混。使用合适的辊压实机对共混物进行造粒,并使其通过筛网。加入粒外硬脂酸镁,并将散装粉末在合适的搅拌机中共混。使用旋转压力机将共混物压缩成片剂,并将所得片剂包装在散装容器中。化合物A片剂的制造工艺的流程图如图15所示。
控制化合物A片剂的制造工艺中的关键步骤和中间体。
表28和表29中分别提供了在化合物A中间产物和化合物A片剂的制造工艺的关键步骤中执行的控制的摘要。
化合物A中间产物中的残留溶剂水平是质量属性,应对其进行仔细监测以确保安全性。验收标准是国际协调理事会(ICH)残留溶剂Q3C(R6)协调指南中规定的标准。监测片剂性质,以确保一致的尺寸和性能。随着药物开发的进展,可以增加或改进另外的控制。
表28.用于制造化合物A中间产物的过程中控制。
表29.用于制造化合物A片剂的过程中控制,5mg和35mg。
赋形剂的控制(化合物A,片剂)
说明:用于制造5mg和35mg片剂的赋形剂符合多药典要求:微晶纤维素(美国国家处方集(NF)、欧洲药典(Ph.Eur.)、日本药典(JP));乳糖一水合物(NF/USP,Ph.Eur.,JP);交联羧甲基纤维素钠(NF,Ph.Eur.,JP);二氧化硅(NF/USP,Ph.Eur.,JP);和硬脂酸镁(NF,Ph.Eur.,JP)。在制造过程中没有使用非药典赋形剂或成品药中不存在非药典赋形剂。
成品药的控制(化合物A,片剂)
化合物A片剂(5mg和35mg)的规格分别在表30和表31中概述。
表30.化合物A片剂的规格,5mg
DP=成品药;HPLC=高效液相色谱法;NMT=不超过;USP=美国药典;Q=溶解活性成分的量占标记含量的百分比
*通过将成品药的色谱杂质峰面积与原料药分析证书中报告的对应峰面积进行比较并取差异而获得的值。
表31.化合物A片剂的成品药规格,35mg
DP=成品药;HPLC=高效液相色谱法;NMT=不超过;USP=美国药典;Q=溶解活性成分的量占标记含量的百分比
*通过将成品药的色谱杂质峰面积与原料药分析证书中报告的对应峰面积进行比较并取差异而获得的值。
化合物A片剂的分析程序:已经开发了用于身份、测定、相关物质、含量均匀度和溶解度的分析方法,以确保化合物A片剂(5mg和35mg)的质量。以下部分介绍了方法摘要。
表32.化合物A片剂的分析程序
HPLC=高效液相色谱法
外观(方法TEST-009)
使用灯箱进行均匀照明,检查材料的颜色,并分别参考标准色轮和图形进行形状确认。
通过高效液相色谱法(HPLC)确认的化合物A的身份、测定、相关物质和含量均匀度(TEST-513)
称取样品,溶解在80:20(v/v)甲醇:水中的0.1%三氟乙酸(TFA)中,通过过滤器,并注射到HPLC上,条件如表33所示。
表33.TEST-513的色谱条件
身份被报告为样品的HPLC保留时间与最接近工作标准注射中主峰的保留时间之间的百分比差异。效力通过比较峰面积与工作标准品的峰面积来确定,并报告为标示量的百分比。报告峰面积≥0.05%但非化合物A的所有杂质。通过将成品药的色谱杂质峰面积与原料药分析证书中报告的对应峰面积进行比较并取差异,得到成品药制造或降解特有的杂质。分析10片样品以进行含量均匀度评估,结果根据美国药典(USP)<905>报告。
溶解度(方法TEST-514)
将片剂引入具有1升容器的USP II设备中,该容器含有900mL(35mg片剂)或500mL(5mg片剂)的50mM Na
表34.TEST-514的色谱条件
TFA=三氟乙酸;SLS=十二烷基硫酸钠
测试每种片剂的六次重复,并将结果报告为标示量的溶解剂量百分比。
批次分析(化合物A、片剂)
使用与表37和表38中分别表征的5mg和35mg片剂演示批次相同的配方和工艺生产用于拟议的1期临床试验的临床批次。
化合物A片剂的批次分析,5mg和35mg
表35、表36和表37提供了化合物A 5mg和35mg片剂的演示批次的描述。
表35.化合物A片剂批次的描述,5和35mg
表36.化合物A 5mg片剂的批次分析结果
/>
HPLC=高效液相色谱法;NR=未报告;RT=保留时间;RRT=相对保留时间;USP=美国药典;Q=溶解活性成分的量占标记含量的百分比
表37.化合物A 35mg片剂的批次分析结果
HPLC=高效液相色谱法;NR=未报告;RT=保留时间;RRT=相对保留时间;USP=美国药典;Q=溶解活性成分的量占标记含量的百分比
杂质的表征(化合物A,片剂)
没有鉴定出超出活性药物成分(API)中已经存在的杂质/降解物之外的成品药制造和降解产生的额外杂质/降解物。
实例24:化合物A片剂的稳定性
用于化合物A(5mg和35mg)的方案描述于表38中。在稳定性测试期间,将片剂储存在含有干燥剂罐并盖有聚丙烯衬里封盖的热感应密封高密度聚乙烯(HDPE)瓶中。
表38.化合物A片剂演示批次的稳定性方案(5mg和35mg)
*任选的时间点;KF=卡尔费休滴定法
稳定性结果摘要
已使用相同的配方、工艺和设备制备了1期临床试验成品药。
在40℃/75%相对湿度(RH)下放置1个月后,化合物A片剂(5mg和35mg)的关键质量属性没有变化,不同之处在于,在某些样品中观察到相对保留时间(RRT)=1.02的色谱峰。该峰的存在和大小与储存条件无关,并且在两种片剂强度中都可以看到。因此,这可能是由于分析变化造成的。同样,在25℃/60% RH下放置1个月的实时数据显示杂质分布没有变化。
6个月后,所有40℃/75% RH样品仍符合规格。这意味着样品的保质期至少为2年。
24个月后,所有样品在25℃/60% RH下仍符合规格。
表39-44提供了支持在2-8℃、25℃/60% RH和40℃/75% RH下临床使用5mg化合物A片剂,在2-8℃、25℃/60% RH和40℃/75% RH下临床使用35mg化合物A片剂的稳定性数据。
表39. 2-8℃下化合物A片剂的稳定性结果,5mg
/>
HDPE=高密度聚乙烯;NR=未报告;LOQ=定量限;RRT=相对保留时间;ND=未检测到;Q=溶解活性成分的量占标记含量的百分比;T=时间;KF=卡尔费休滴定法。
表40. 25℃/60% RH下化合物A片剂的稳定性结果,5mg
/>
HDPE=高密度聚乙烯;NR=未报告;LOQ=定量限;RRT=相对保留时间;ND=未检测到;Q=溶解活性成分的量占标记含量的百分比;T=时间;KF=卡尔费休滴定法。
表41. 40℃/75% RH下化合物A片剂的稳定性结果,5mg
HDPE=高密度聚乙烯;NR=未报告;LOQ=定量限;RRT=相对保留时间;ND=未检测到;Q=溶解活性成分的量占标记含量的百分比;T=时间;KF=卡尔费休滴定法。
表42. 2-8℃下化合物A片剂的稳定性结果,35mg
HDPE=高密度聚乙烯;NR=未报告;LOQ=定量限;RRT=相对保留时间;ND=未检测到;Q=溶解活性成分的量占标记含量的百分比;T=时间;KF=卡尔费休滴定法。
表43. 25℃/60% RH下化合物A片剂的稳定性结果,35mg
/>
HDPE=高密度聚乙烯;NR=未报告;LOQ=定量限;RRT=相对保留时间;ND=未检测到;Q=溶解活性成分的量占标记含量的百分比;T=时间;KF=卡尔费休滴定法。
表44. 40℃/75% RH下化合物A片剂的稳定性结果,35mg
/>
HDPE=高密度聚乙烯;NR=未报告;LOQ=定量限;RRT=相对保留时间;ND=未检测到;Q=溶解活性成分的量占标记含量的百分比;T=时间;KF=卡尔费休滴定法。
第四代合成
实例25:化合物A的第四代合成
步骤1:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-(羟甲基)哌啶-1-基)哒嗪-3-甲酰胺(中间体2)
在氮气下,向260L搪玻璃碳钢夹套反应器中注入中间体10(7.00kg)、中间体7(8.89kg)、2-吡啶醇1-氧化物(HOPO)(491.4g)和二甲基乙酰胺(26.32g)。将反应混合物以110rpm(允许范围:70至150rpm)搅拌,并在39分钟内冷却至约10℃(允许温度范围:5℃至15℃)。向反应器中注入N,N-二异丙基乙胺(DIPEA)(4193.0g),搅拌反应混合物并在47分钟内将温度重新调节回约10℃(允许温度范围:5℃至15℃),并将混合物再保持32分钟。停止搅拌,向反应器中注入1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDAC)(5936.0g),并将反应器吹扫6分钟。将反应混合物以110rpm搅拌,加入二甲基乙酰胺(6580.0g),并在1小时8分钟内将温度调节至约20℃(允许温度范围:10℃至30℃)。保持搅拌,将反应器在约20℃下保持16小时。在16小时结束时,过程中控制(IPC)显示中间体10的0.3%面积(验收标准:≤1.0%面积),这表明完成。
向反应器中注入自来水(35.0kg),产生浓稠的浆液。将反应器以约140rpm(允许范围:100至180rpm)搅拌,并在1小时15分钟内加热至约60℃(允许温度范围:55℃至65℃之间)。向反应器中额外注入自来水(35.0kg)和乙酸异丙酯(73.08kg)。将反应器温度调节至约78℃(允许温度范围:73℃至83℃)并保持40分钟,在此期间浆料溶解,并形成两层。使反应器的内容物在约78℃下沉降3小时。用氮气吹扫反应器并除去底部水层。
向800L搪玻璃碳钢夹套反应器中注入乙酸异丙酯(11.90kg),随后从260L反应器中注入有机层。注入氯化钠溶液(77.0kg,9.1%w/w),然后注入乙酸异丙酯(60.90kg)。形成双相溶液,并在搅拌下在47分钟内下将混合物加热至约78℃(允许温度范围:73℃至83℃)。将混合物在约78℃下搅拌4小时5分钟。将热混合物通过硅藻土545过滤到260L反应器中。用乙酸异丙酯(23.80g)冲洗800L反应器,将所述乙酸异丙酯过滤并加入260L反应器中。将260L反应器在3小时6分钟内加热至约78℃(73℃至83℃之间),并使内容物沉降4小时1分钟。用氮气吹扫反应器并除去底部水层。
将反应器以约110rpm(介于90和110rpm)搅拌。向反应器中注入氯化钠溶液(76.3kg,9.1%w/w),并形成双相溶液。将反应器在1小时54分钟内加热至约78℃(允许温度范围:73℃至83℃),并将温度保持31分钟。停止搅拌,使内容物沉淀3小时11分钟。用氮气吹扫反应器并除去底部水层。
将反应器的内容物在75℃(允许温度范围:70℃至80℃)下在真空蒸馏下浓缩至约42L。加入乙酸异丙酯(6.09kg),并在搅拌下将反应器加热至约80℃(允许温度范围:70℃至85℃)。将反应器在约80℃下保持1小时2分钟,然后在6小时28分钟内冷却至约20℃(允许温度范围:15℃至25℃)。将反应器在约20℃下保持4小时31分钟。将所得浆料迅速转移到带有8μm聚丙烯滤布的电搅拌哈氏合金过滤干燥机中。将浆液在真空下过滤,并用母液冲洗反应器。将反应器的内容物加入过滤干燥机并在真空下过滤。将固体滤饼用乙酸异丙酯洗涤两次(9.17kg×2),并在真空下过滤。将所得滤饼在真空下干燥,夹套温度为60℃(允许温度范围:55℃至65℃),直到总挥发物(通过快速水分测定仪)不超过1.0%w/w(6小时1分钟)。随后冷却干燥机,收集滤饼,得到中间体2(10.90kg,79%)。发布结果如表45所示:
表45:中间体2的发布结果:
步骤2:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-甲酰基哌啶-1-基)哒嗪-3-甲酰胺(中间体3)
在氮气下向800L搪玻璃碳钢夹套反应器中加入中间体2(10.80kg)、溴化钠(4.75kg)、碳酸氢钠(3.89kg)。将反应器用氮气吹扫(×3),随后加入去离子水(129.6kg)和二氯甲烷(186.73kg)。然后将反应器以50rpm(允许范围:30至70rpm)搅拌1小时39分钟。
停止搅拌,并在40分钟内加入(2,2,6,6-四甲基哌啶-1-基)氧基(TEMPO)(35.64g)。将反应器用氮气吹扫(×3),并随后向反应中注入二氯甲烷(7.18kg)。然后将反应器以50rpm(允许范围:30至70rpm)搅拌。向反应器中进一步注入异丙醇(2.81kg)和二氯甲烷(7.18kg)。将搅拌增加至110rpm(允许范围:105至115rpm),并在33分钟内使混合物调节至20℃(允许温度范围:15℃至25℃)。一旦调整,确保所有固体溶解,将反应混合物在此温度和搅拌速度下保持2小时5分钟。
然后将反应混合物在2小时1分钟内冷却至–2℃(允许温度范围:–3℃至0℃),然后在40分钟内加入次氯酸钠溶液(34.85kg),确保温度保持在–3℃和0℃之间(允许温度范围:–3℃至3℃),其中搅拌保持在约110rpm(允许范围:105至115rpm)。由于反应的放热性质,添加速率和批次温度至关重要。然后通过次氯酸钠转移中使用的转移管线加入去离子水(5.40kg),确保温度保持在–3℃和0℃之间。然后将混合物随后在–2℃(允许温度范围:-3℃和3℃)下保持1小时2分钟。1小时后,过程中控制(IPC)显示中间体2的0.3%面积(验收标准:≤1.0%面积),这表明反应完成。
将反应混合物升温至20℃(允许温度范围:15℃和25℃),并在90rpm(允许范围:80至100rpm)下保持搅拌,并向反应混合物中注入乙酸(4.104kg),并将混合物保持2小时37分钟,在此基础上形成双相溶液。向带有3-5μm聚丙烯滤布的电搅拌哈氏合金过滤干燥机中注入硅藻土545,随后过滤通过二氯甲烷(24.6kg)。将一部分反应混合物过滤到260L反应器中,其余混合物随后转移到100L反应器中,并用二氯甲烷(28.73kg)冲洗800L反应器,将所述二氯甲烷过滤并加入到100L反应器中。将800L反应器用二氯甲烷冲洗并过滤。将混合物从260L和100L反应器转移回800L反应器,随后用二氯甲烷冲洗(5.40kg×2)。
停止搅拌,使混合物沉淀成两相,持续3小时25分钟。将分离的有机相转移到260L反应器中。将有机层转移回800L,随后用二氯甲烷冲洗260L容器,并将内容物转移到800L反应器中。加入去离子水(108.0kg)并允许反应器搅拌,将温度升高至20℃并将内容物在此搅拌和温度下保持49分钟。停止搅拌,使混合物沉降2小时14分钟,并形成两层。将有机层转移到260L反应器中,并适当丢弃水层。
然后将混合物通过蒸馏浓缩,在正常气氛下在40℃(允许温度范围:35℃至45℃)下,通过根据需要补充四氢呋喃以使温度增加至60℃(允许温度范围:55℃至65℃)来将体积保持在约38-49L之间,并且最终体积约为46L。然后将反应器的内容物在真空蒸馏下浓缩,根据需要在60℃(允许温度范围:55℃至65℃)下补充四氢呋喃,直到剩余≤1.0%v/v的二氯甲烷。
通过加入正庚烷(29.38kg)(65℃)进行重结晶,并保持1小时10分钟,同时保持约65℃的温度,直到获得浓稠的浆料。随后将浆料在4小时34分钟内(4小时前温度不应低于20℃)缓慢冷却至20℃(允许温度范围:15℃至25℃),并在20℃下再保持6小时53分钟。将所得浆料迅速转移到带有8μm聚丙烯滤布的电搅拌哈氏合金过滤干燥机中,并在真空下过滤浆料。将滤饼用四氢呋喃(4.86kg)和正庚烷(3.67kg)溶液(×3)洗涤两次,并在真空下过滤。将所得滤饼在真空下干燥,夹套温度为50℃(允许温度范围:45℃和55℃),持续8小时2分钟,然后将夹套温度增加至75℃(允许温度范围:70℃和80℃),持续7小时42分钟,直到总挥发物(通过快速水分测定仪)不超过1.0%w/w。随后冷却干燥机,收集滤饼,得到中间体3(10.20kg,95%)。发布结果如表46所示。
表46:中间体3的发布结果:
/>
步骤3:N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-((4-(2-(2,6-二氧代哌啶-3-基)-6-氟-1,3-二氧代异吲哚啉-5-基)哌嗪-1-基)甲基)哌啶-1-基)哒嗪-3-甲酰胺(化合物A)
在氮气下向260L搪玻璃碳钢夹套反应器中加入中间体3(8.48kg)、中间体5(7.62kg)和二甲基乙酰胺(38.45kg)。将反应混合物以110rpm(允许范围:80至130rpm)搅拌,并在1小时26分钟内冷却至约0℃(允许范围:-5℃至5℃)。向此加入N-甲基吗啉(4.50kg)和二甲基乙酰胺(0.751kg),并在0℃和110rpm下搅拌反应3小时和7分钟。
在100L反应器中,在氮气下,制备三乙酰氧基硼氢化钠(STAB)(5.66kg)于二甲基乙酰胺(21.60kg)中的溶液,并使溶液在110rpm(允许范围:90至120rpm)、20℃(允许温度范围:15℃和25℃)下搅拌6小时24分钟。将STAB/二甲基乙酰胺溶液在2小时内缓慢加入到260L反应器中包含的反应混合物中,将温度保持在0℃(允许温度范围:-5℃至5℃)并以110rpm(允许范围:80至130rpm)搅拌。加入完成后,用二甲基乙酰胺(5.00kg)洗涤反应器,随后冷却至0℃,并将其内容物在20分钟内添加到260L反应器中的反应混合物中,确保温度和搅拌分别保持在0℃和110rpm下。将反应混合物保持在0℃(允许温度范围:–5℃至5℃)、110rpm下,持续6小时和43分钟。在6小时43分钟结束时,过程中对照(IPC)显示中间体3的0.7%面积(验收标准:≤2.0%面积),这表明反应完成。
通过在氮气下向反应器容器中注入无水乙醇(40.78kg)和去离子水(51.71kg)进行重结晶,并使其在50℃(允许温度范围:45℃至55℃)下加热1小时14分钟,然后在此温度下进一步保持1小时24分钟。然后将混合物冷却至20℃(允许温度范围:15至25),并在此温度下保持4小时3分钟。将混合物转移到带有3-5μm聚丙烯滤布的电搅拌哈氏合金过滤干燥机中。将混合物在真空下过滤,并用母液冲洗反应器,随后重新过滤。
通过混合无水乙醇(11.51kg)和去离子水(14.60kg)制备无水乙醇:水(去离子)洗涤液。使用洗涤液冲洗反应器,并使用该溶液洗涤滤饼。重复乙醇:水洗涤。搅拌滤饼(×3)形成浆料,随后使其沉降。将滤饼进一步用无水乙醇(23.02kg×4)洗涤,搅拌滤饼并充分使固体脱液。
将固体滤饼溶解在二氯甲烷(155.12kg)和甲醇(9.26kg)的溶液中,并将所得溶液随后通过0.2μm聚四氟乙烯胶囊过滤器转移到800L反应器中。将过滤干燥机用二氯甲烷/甲醇冲洗两次,并将漂洗液通过0.2μm聚四氟乙烯胶囊过滤器过滤到800L反应器中。然后将混合物在正常气氛下在45℃(允许温度范围:35℃至50℃)下进行常压蒸馏,通过根据需要补充无水乙醇至最终体积为约292L来保持体积,并获得浆料。然后将温度升高至55℃,通过根据需要补充无水乙醇至最终体积为约292L来保持体积。然后将反应器的内容物进行真空蒸馏,根据需要在55℃(允许温度范围:45℃至65℃)下补充无水乙醇,直至最终体积为约300L。重复真空蒸馏步骤,直到剩余≤1.0%v/v的二氯甲烷。
然后在30分钟内将混合物的温度调节至55℃(允许温度范围:50℃和60℃),并将搅拌保持在约100rpm(允许范围:90至110rpm),然后在55℃下保持34分钟。然后将混合物在3小时59分钟内(3小时前温度不应低于20℃)缓慢冷却至20℃(允许温度范围:15℃和25℃),然后在20℃下再保持4小时16分钟。将所得浆料迅速转移到带有3-5μm聚丙烯滤布的电搅拌哈氏合金过滤干燥机中,并在真空下过滤浆料。
将滤饼用无水乙醇(23.02kg,×3)洗涤,并要求满足IPC标准。随后将湿饼在真空下干燥,夹套温度为65℃(允许温度范围:60℃至70℃),持续29小时59分钟,直到总挥发物(通过快速水分测定仪)不超过1.0%w/w。随后冷却干燥机,收集滤饼,得到化合物A(13.08kg,89%)。发布结果如表47所示。
表47:化合物A的发布结果:
/>
第五代合成
实例26:化合物A的第五代合成
第五代序列遵循与第四代序列相同的一般方案。第五代序列的步骤如下所示。每个步骤的材料数量相对于假设的1kg起始材料被归一化。根据以下公式调整起始材料的数量:
步骤1:
反应在N
效力计算用于确定中间体10和中间体7的输入(每Kg)
中间体7的效力=(100%-干燥损失%)x纯度=a wt.%
中间体7的校正目标计算=中间体7:1.00kg x[1.0/(中间体7(%w/w)/100)]
中间体10的效力=(100%-(干燥损失%+灼烧残渣%))x纯度=b wt.%
中间体10的校正目标计算=1.00kg x[0.843/(中间体10的效力(%w/w)/100)]
1.向反应器A中加入中间体7(1.000Kg±1.0%,如上所述校正效力)、中间体10(0.843Kg±1.0%)、HOPO(0.0580Kg±1.0%,如上所述校正效力)。
2.通过喷球向反应器A中加入DMAc(2.82Kg;或3.0L±5.0%)。
3.用N
4.冷却至10±5℃。
5.在10±5℃下向反应器A中加入DIPEA(0.495Kg,或0.669L±1.0%)。
注意:微放热,控制加入以保持温度范围。
6.用DMAc冲洗线(0.09Kg或0.10L±5.0%)。
7.调节至10±5℃。
8.在10±5℃下搅拌NLT 0.5小时。
9.向反应器A中加入EDAC(0.701Kg±1.0%)。
10.如有必要,通过喷球使用额外的DMAc(0.66Kg或0.70L±5.0%)追逐
11.调节至20±10℃。
12.在20±5℃下搅拌。
13.NLT 20小时后,针对IPC-1采样。
注意:IPC≤1.0AP残余中间体7;
14.向反应器B中加入NaCl(1.00Kg±5.0%)。
15.向反应器B中加入自来水(6.6Kg,或6.6L±5.0%)。
16.在25±5℃下搅拌直至形成溶液。
17.将反应器B的内容物转移到反应器A中
18.向反应器A中加入四氢呋喃(5.34Kg或6.0L±5.0%)。
19.将内部温度调节至50±5℃。
20.在50±5℃下搅拌NLT 0.5小时。
21.将混合物从反应器A通过硅藻土床转移到反应器B。
22.用四氢呋喃(1.34Kg或1.5L±5%)洗涤反应器A和硅藻土床,然后转移到反应器B。
23.将反应器B的内容物调整至50±5℃
24.停止搅拌并保持NLT 1小时。
25.分离出底部水层。
26.向反应器A中加入氯化钠(1.25Kg±5.0%)。
27.向反应器A中加入自来水(6.60Kg或6.6L/Kg±5.0%)。
28.将反应器A在25℃下搅拌NLT 0.5小时,直到形成溶液。
29.将反应器A的内容物转移到反应器B中。
30.将反应器B的内容物调整至50±5℃
31.停止搅拌并保持NLT 1小时。
32.从反应器B中分离出底部水层。
33.向反应器A中加入氯化钠(1.50Kg±5.0%)。
34.向反应器A中加入自来水(6.60Kg或6.6L/Kg±5.0%)。
35.将反应器A在25℃下搅拌NLT 0.5小时,直到形成溶液
36.将反应器A的内容物转移到反应器B中。
37.将反应器B的内容物调整至50±5℃
38.停止搅拌并保持NLT 1小时。
39.从反应器B中分离出底部水层。
40.向反应器B中加入四氢呋喃(7.57Kg或8.5L±5.0%)。
41.将反应器B的内容物加热至65±5℃
42.在65±5℃下在大气压下蒸馏反应器B的内容物,并略微真空排放(洗涤器),直到体积为3.30L/Kg(±0.5L)。
43.向反应器B中加入四氢呋喃(7.57Kg或8.5L±5.0%)。
44.将反应器B的内容物加热至65±5℃
45.在65±5℃下在大气压下蒸馏反应器B的内容物,并略微真空排放(洗涤器),直到体积为3.30L/Kg(±0.5L)。
46.用水和四氢呋喃清洁反应器A。
47.向反应器A中加入四氢呋喃(4.45Kg或5.0L±5.0%)。
48.将反应器A的内容物加热至65±5℃。
49.通过喷球将反应器A的内容物转移到反应器B中
50.通过在线过滤器将反应器B的内容物转移到反应器A中。
51.通过喷球用四氢呋喃(1.34Kg或1.5L±5.0%)冲洗反应器B的内容物,并通过在线过滤器转移到反应器A中。
52.将反应器A的内容物调整至65±5℃。
53.用水和THF清洁反应器B。
54.在65±5℃下在大气压下蒸馏反应器B的内容物,并略微真空排放(洗涤器),直到体积为6.0L/Kg(±0.5L)。
55.向反应器B中注入THF(1.34Kg,1.5L±5.0%)。
56.将反应器B的内容物加热至65±5℃。
57.通过喷球将反应器B的内容物转移到反应器A中。
58.针对水含量采样(KF库仑法)。
59.如果结果为50.50wt.%,则继续执行步骤62,如果不是,则继续执行步骤60。
60.通过喷球向反应器A中注入THF(4.45Kg或5.0L±5.0%)。
61.继续执行步骤54。
62.验证溶液是否存在,增加搅拌以帮助溶解反应器壁上高于溶液的任何固体。
63.在65±5℃下向反应器A中注入正庚烷(0.68Kg,或1.0L±5%)。
64.注入中间体2晶种或中间体2(0.002Kg)于正庚烷(0.034Kg或0.05L)中的浆料。
65.在65±5℃下搅拌1小时(±30分钟)。
66.在65±5℃下在3小时(±30分钟)内向反应器A中注入正庚烷(2.72Kg,或4.0L±5%)。
67.在65±5℃下搅拌1小时(±30分钟)。
68.在3小时(±60分钟)内冷却至20±5℃。
69.在20±5℃下搅拌6小时(±60分钟)。
70.在20±5℃下在真空下过滤浆液,并使滤饼脱液。
71.验证来自反应器A的固体是否已转移到过滤干燥机。
72.用水和四氢呋喃清洁反应器B。
73.向反应器B中加入四氢呋喃(1.34Kg或1.5L/Kg)。
74.向反应器B中加入正庚烷(0.68Kg或1.0L/Kg)。
75.将反应器B的内容物在20±5℃下搅拌5分钟。
76.通过喷球将反应器B的内容物转移到反应器A中。
77.将反应器A的内容物转移到过滤干燥机中,然后将滤饼重新浆化NLT 5分钟。
78.在真空和氮气下对滤饼进行脱液。
79.在真空下在580℃(过滤干燥机夹套温度)下干燥湿饼,直到LOD通过(NLT 6小时)。
LOD规格=≤1.0%/120℃
80.中间体2的预期产率=1.44Kg(88mol%产率)。
步骤2:
反应在N
1.向反应器A中加入中间体2(1.00Kg±1.0%)、NaBr(0.219Kg±1.0%)和NaHCO
2.向反应器A中加入TEMPO(3.325g±1.0%)。
3.向反应器A中加入DCM(19.0L±5.0%)。
4.用DCM(0.50L±5.0%)追逐TEMPO添加,并将溶液添加到反应器A中。
5.在20℃下搅拌0.5小时。
6.向反应器A中加入H
7.向反应器A中加入IPA(0.127Kg±1.0%)。
8.用DCM(0.50L±5.0%)追逐IPA添加,并将溶液添加到反应器A中。
9.在20℃下搅拌NLT 2.0小时。
10.将混合物冷却至-12至-10℃,优选地,冷却至-11℃。
注意:批次温度的最大冷却控制对于此步骤至关重要;
11.通过喷球在NLT 15分钟但NMT 45分钟(优选地,<0.5小时)内向反应器A中加入水性NaClO(1.15当量±1.0%),同时将内部温度控制在-12至-3℃之间,优选地,-12至-8℃。
注意:水性NaClO的质量(Kg)=(1.15x 74.44)/(469.97x水性NaClO的浓度(wt%))
注意:漂白剂溶液预冷至0±5℃。
12.用额外的去离子H
13.在-12至-3℃下搅拌NLT 1.0小时。
14.对有机层进行采样以用于IPC-1分析。
15.如果IPC-1失败,则通过喷球在NLT 15分钟但NMT 45分钟内(优选地,<0.5小时)内对水性NaClO(预冷至0±5℃)进行踢注,同时将内部温度控制在-12至-3℃之间,优选地,-12至-8℃。
16.用额外的去离子H
17.在-12至-3℃下搅拌NLT 1.0小时
18.针对IPC-1采样。
19.如果IPC-1通过,则调整至20±5℃。
21.将反应器A中的底部DCM层与反应器B分开。
近似有机DCM相的体积(20L/Kg)并且溶液为无色至棕色溶胶。
水相的近似体积为(10L/Kg),并且溶液为无色至浅棕色。
22.从反应器A中取出水相并送去废弃物。
23.用水、THF清洁反应器A。
24.向反应器B中注入H
25.在20±5℃下将反应器B搅拌NLT 0.5小时。
26.通过硅藻土袋将混合物过滤到反应器A中。
27.用DCM(2.0L/Kg)将反应器B追洗至反应器A。
28.用H
29.停止搅拌反应器A,持续NLT 2.0小时。
30.将底部有机层分离到反应器B中。
注意:对DCM层进行采样以进行UPLC分析;
31.在正常气氛和批次温度=40±5℃下将反应器B中的有机溶液蒸馏至体积=5.0L/Kg(+/-0.5体积)
32.通过喷球向反应器B中注入THF(1.0L/Kg±5.0%)。
33.将批次温度调节至38±2℃。
34.在0.5小时内加入5.0L/Kg正庚烷,保持38±2℃的批次温度。
35.在正庚烷(0.10L/Kg)中加入中间体3晶种(5.0g/Kg)。
36.在38±2℃下搅拌NLT 4.0小时。
37.在1.0小时内加入额外5.0L/Kg正庚烷。
38.在38±2℃下搅拌NLT 2.0小时。
39.在NLT 4小时内冷却至20±5℃。
40.在20±5℃下搅拌另外NLT 6小时。
41.在20℃和氮气下在真空下过滤浆料。
42.如果固体残留在反应器中,则通过喷球将母液再循环回反应器,并再次过滤混合物。
43.通过喷球用1.5L/Kg正庚烷洗涤反应器B。
44.用浆液洗涤滤饼,并在真空下除去液体,直到大部分液体被除去。
45.在真空下除去液体,并拉动,直到大部分酒被除去。
46.将滤饼在NMT 50℃±5℃下在真空和氮气下干燥NLT 8小时。
47.在真空和氮气流下继续在75±5℃下干燥滤饼,直到LOD≤1.0%/120℃。
48.预期的中间体3的量=0.95Kg(95mol%)。
步骤3:
效力计算用于确定中间体3和中间体5的输入(每Kg)
中间体3的效力计算=(100%-干燥损失%)x纯度=a wt.%
中间体3的校正目标计算:
中间体5:1.00Kg x(1.0/(中间体3的效力(%w/w)/100))
中间体5的效力计算=(100%-(水含量%+残留溶剂%))x纯度=b wt.%
注意:从中间体5CofA获得的水含量、残留溶剂和纯度数据
中间体5的校正目标计算:
中间体5:1.00Kg x(0.848/(总效力/100))
1.向反应器A中注入NaBH(OAc)
2.向反应器A中注入DMAc-1(2.75体积±5%)。
3.一旦溶解,将反应器A在20±5℃下保持NLT 1.0小时
4.向反应器B中注入中间体5([0.848/(b wt.%/100)]Kg±1.0%)、中间体3(1.000/(a wt.%/100)Kg±1.0%)和DMAc-2(4.90体积±5%)。
5.将反应器B冷却至0±5℃。
6.在NLT 0.5小时内向反应器B中注入N-甲基吗啉(0.540Kg±1.0%),同时将批次温度保持在0±5℃。
7.将反应器B在0±5℃下搅拌NLT 2.0小时但NMT 4.0小时。
8.在NLT 1.0小时内将反应器A中的内容物转移到反应器B中,同时将内部温度保持在0±5℃。
9.将反应器A用DMAc-4(0.64体积±5%)冲洗,并在NLT 15分钟内转移到反应器B。
10.将反应器B在0±5℃下搅拌NLT 6.0小时。
11.针对IPC-1采样。
IPC-1标准:中间体3≤2.0%;
12.如果IPC-1失败,则继续在0±5℃下搅拌6小时。
13.再次针对IPC-1采样。
14.如果IPC-1再次失败,则查看技术建议。
15.在NLT 0.5小时内向反应器B中注入EtOH(6.2体积±5%),同时将温度保持在0±5℃。
16.在NLT 0.5小时内向反应器B中注入H
17.在NMT 2.0小时内将反应器B中的内容物调节至50±5℃。
18.将反应器B中的内容物在50±5℃下保持NLT 1.0小时但NMT 2.0小时。
19.在3.0小时±0.5小时内将反应器B中的内容物冷却至20±5℃。
20.将反应器B中的内容物在20±5℃下保持NLT 4.0±0.5小时。
21.将反应器B中的浆液在N
22.将反应器B在20±5℃下通过喷球用EtOH(1.75体积±5%)和H
23.在N
24.在20±5℃下用EtOH/H
25.脱液洗涤后,继续将湿饼脱液NLT 2小时,直到没有主要溶剂从过滤干燥机中除去。
26.在过滤器C中用EtOH(4x 3.5体积±5%)对湿饼进行四次浆液洗涤。
27.在四次浆液洗涤中的每一次后,将过滤器C中的湿饼脱液NLT 1小时。
28.对过滤器C中的湿饼进行IPC-2采样(LOD(2g,120℃)),并执行计算:
化合物A粗饼(97mol%化合物A)中EtOH的校正:
中间体3(Kg)的输入x 1.684=计算出的化合物A粗产物(Kg)
湿化合物A粗产物中的EtOH(Kg)=LOD%x计算出的化合物A粗产物(Kg)/(1-LOD%)
(湿化合物A粗产物中的EtOH(Kg)/0.789)/(中间体3(Kg)的输入)=待校正的
待校正的
*装料基于初始中间体3的输入*
29.将DCM(中间体3的28.0体积±5%)注入反应器A中。
30.将MeOH(中间体3的2.8体积±5%)注入反应器A中并搅拌NLT0.5小时。
31.将一半的DCM/MeOH(10:1,15.4体积±20%)从反应器A转移到过滤器C。
32.将过滤器C在20±5℃下搅拌NLT 0.5小时,以溶解大部分湿的粗品固体。
33.通过在线胶囊过滤器将过滤器C中的溶液抛光过滤到反应器B。
34.将部分剩余的DCM/MeOH(10:1,14.4体积±5%)从反应器A转移到过滤器C。
35.将过滤器C在20±5℃下搅拌NLT 0.5小时,以溶解所有剩余的粗品固体。
36.通过在线胶囊过滤器将过滤器C中的溶液抛光过滤到反应器B。
37.将过滤器C用剩余的DCM/MeOH(10:1;1.0体积±5%)冲洗,并通过在线胶囊过滤器过滤到反应器B。
38.在反应器B中蒸馏溶液,同时在大气条件下保持恒定体积(vmax~32体积),在35-45℃之间的内部温度下连续添加EtOH(7.0体积±5%
39.针对IPC-3采样,并对DCM含量进行GC分析。
IPC-3标准:DCM≤67体积%(相对于DCM+MeOH+EtOH峰的总体积);
Rep报告EtOH体积%和MeOH体积%。
40.如果DCM含量通过,则直接转到步骤43。如果失败,则转到步骤41
41.如果IPC-3失败,则继续用额外的EtOH(1.0体积±5%)蒸馏并重新采样以进行GC分析
IPC-3标准:DCM≤67%(相对于DCM+MeOH+EtOH峰的总体积);
Rep报告EtOH体积%和MeOH体积%。
42.如果IPC-3再次失败,则重复步骤41。
43.将反应器B冷却至35±2℃,并在EtOH(0.075体积±5%)中注入化合物A晶种(0.50wt%±5%)。
44.将反应器B在35±2℃下搅拌NLT 0.5小时
45.将反应器B加热恢复到回流条件(41±2℃),并在大气条件下继续恒定体积蒸馏(vmax-32体积),连续添加EtOH(7.0体积±5%),同时将批次温度保持在40-50℃之间。
46.在反应器B中继续在大气条件下以恒定体积(vmax-32体积)蒸馏,直到内部温度达到至少50℃。
47.在反应器B中,在真空下进行剩余的蒸馏,保持恒定的体积(vmax-32体积),添加EtOH(28.0体积±5%),并将内部温度保持在55±10℃。
48.通过GC对反应器B进行IPC-4采样。
IPC-4标准:DCM/EtOH≤1.0%。
49.如果IPC-4失败,则用额外的EtOH(4.0体积±5%)重复真空蒸馏,然后继续步骤50。
50.通过GC对反应器B进行IPC-4采样。
IPC-4标准:DCM/EtOH≤1.0%。
51.如果IPC-4通过,则将批次温度调节至55±5℃。
52.将反应器B中的浆液在55±5℃下搅拌NLT 0.5小时。
53.将反应器B中的浆液在NLT 3.0小时内冷却至20±5℃。
54.将反应器B中的浆液在20±5℃下搅拌NLT 4.0小时。
55.将反应器B中的浆料过滤到过滤器C(滤布=8μm)。
56.用EtOH(3.5体积±5%)冲洗反应器B。
注意:EtOH应经过抛光过滤。
57.将反应器B中的漂洗液过滤,并作为浆液洗涤液转移到过滤器C。
58.在过滤器C中用EtOH(2x 3.5体积±5%)对湿饼进行两次浆液洗涤。
注意:EtOH应经过抛光过滤。
59.将滤饼在过滤器C中脱液NLT 1小时
60.对过滤器C进行IPC-5采样,用于湿饼的杂质分布。
61.如果IPC-5失败,则返回步骤28(对湿饼进行LOD采样,执行EtOH计算并开始蒸馏)。
62.如果IPC-5通过,则在真空下在80±5℃下通过搅拌干燥滤饼。
注意:针对PDXR、DSC和KF(FIO),对湿饼进行采样。
63.对过滤器C中的内容物进行IPC-6、LOD(2g,120℃)采样
IPC-6标准:NLT 8小时后LOD(2g,120℃)≤1.0%。
64.如果IPC-6失败,则继续干燥,直到满足LOD标准。
65.如果IPC-6通过,则进行IPC-7采样(GC分析)。
66.IPC-7标准:GC残留溶剂
67.如果IPC-7失败,则继续干燥,直到满足GC标准。
68.一旦IPC-7通过,则从过滤器C排出材料。
上述第五代工艺以1.7kg规模进行(相对于中间体3),以得到化合物A(2.420kg)。通过UPLC计算纯度为99.9%(见图26和表48)。
表48:纯化化合物A色谱图的峰结果
实例27:高强度化合物A片剂的开发
由于对用于1期剂量递增试验的更高强度片剂的需求,开发了更高强度的片剂。
较高强度的片剂调配物分两个阶段完成。第一阶段使用小型化实验室技术筛选片剂调配物中的100%无定形喷雾干燥API(SDI)的负载,并且第二阶段优化所选的调配物组合物。
在筛选阶段期间,调配物组合物涵盖等于10%至40%的一系列SDI负载,并且片剂强度等于70mg、140mg和280mg(对于700mg压片重量),如表49中所概述的
表49:高强度SDI负载的调配物组合物-10%、20%和40%(700mg压片重量)
片剂采用小型化实验室技术制成,以模拟干法造粒和压缩。将预造粒共混物在F压力机上压块。使用研钵/研杵减小块的尺寸,并使其通过20目筛以进行适当的尺寸调整。将颗粒与硬脂酸镁混合并在F压力机上压缩。
在选择片剂的拉伸强度以达到足够坚硬的片剂(崩解时间小于5分钟)之后,使用USP下沉溶解试验评估每种片剂组合物(C1、C2和C3)的体外性能。作为基准,将10-40% SDI负载的片剂与原始5% SDI负载的片剂(片剂参考A3,上文)进行比较。
溶解方法TEST-1973:为了保持等效的下沉条件,以便能够在调配物之间进行有效的比较,溶解介质由0.01N HCl和0.1wt%吐温80组成。使用USP兼容容器,根据每种片剂强度调整培养基体积,以保持恒定的下沉状态(约4x)。溶解参数为USP II桨叶、37.0±0.5℃介质温度、75RPM和等于10、15、20、30、45和60分钟的采样时间。溶解结果如图27所示。将每种组合物的数据相对于90分钟时间点进行归一化,以补偿效力的变化并允许更有效的比较。所有组合物的溶解程度在60分钟时相等。20%负载的片剂为预期用途提供了足够的片剂强度。
由于目标是使SDI负载量最大化,因此系统地修改了20%的调配物组合物,以提高溶解速率。有关负载20% SDI的组合物的列表,请参阅表50。这些调配物是使用上述小型化实验室技术制备的10%、20%和40%组合物。修改的基本原理是分解/溶解机制的更快速的去聚集阶段。这些变化总结如下:
●D1–较小的微晶纤维素增强与微米尺寸的SDI颗粒的结合,并因此增强崩解性
●D2–添加粒外崩解剂,以减少初级SDI颗粒暴露于溶解介质的时间
●D3–添加较小尺寸的助流剂,以帮助与SDI颗粒更紧密地结合,并因此有利于调配物中SDI颗粒的物理分离
●D4–与D2类似,增加了崩解剂的总水平,有利于更快的崩解时间
表50:负载20% SDI的高强度片剂组合物的调配物组合物(700mg压片重量)
总体而言,除D1的流动性外,调配物类似地进行处理,并且它们均表现出小于1分钟的0.01N HCl崩解时间;因此,进一步评估的主要选择标准是溶解度特性。使用0.01N HCl培养基法(TEST-1973)针对D1、D2、D3、D4和35mg(5%)的溶解度曲线如图28所示。
对D2调配物进行规模扩大和工艺评估,以鉴定用于计划的临床生产的加工条件。批次大小为约3kg,并且由以下主要步骤组成:
●使用化合物A的100%喷雾干燥中间体进行预造粒共混
●辊压实(Gerteis小型压实机)
●最终共混(添加粒外崩解剂和润滑剂)
●压缩(Korsch XM12)
使用实验室技术(卡尔指数、剪切细胞流动函数/内聚系数和FloDex测量结果)确定预造粒共混物和最终共混物的流动性质,确定辊压实参数并进行压缩评估(可压缩性、表稳定性和压实性)。
在配备有2个刀具工位以适应批次大小的Korsch XM-12上压缩最终共混物期间,造粒表现出流量不足。材料在进料斗中鼠洞和桥接,使进料框架匮乏,从而导致重量控制不佳。
由于流动挑战,确定D2调配物和工艺不适合并且因此不可转移用于临床制造。因此,在实验室中评估了另一轮调配物,以改善流动性特性。
用于D2调配物的修改策略取决于对所使用的助流剂系统的评估并优化其功能。两种新的调配物F7和F11如表51所示。
表51:负载20% SDI的片剂的D2、F7和F11调配物组合物(525mg压片重量)
使用上述针对调配物C1-C3的小型化技术,以实验室规模(每个共混物50g)在105mg压片重量下制造F7和F11组合物。选择较低的压片重量来表示进一步剂量增加可能需要的压片重量范围的中点。两种调配物都实施了初始SDI/助流剂共混-研磨-共混工艺,作为预造粒共混物制造的一部分,以尝试粘附至SDI颗粒并降低其内聚力。调配物F7增加了整体助流剂水平(粒内和粒外),并且调配物F11添加了助流剂粒外并且也增加了粒外润滑剂,以评估增加的粒外助流剂和润滑剂是否对共混物流动具有协同作用。
将F7和F11的流动性与D2进行比较。表52示出了F7和F11组合物的最终共混物的流动性(FloDex、FFc和内聚系数)的适度改善,但是卡尔指数仍处于不可接受的值。
扫描电子显微镜分析显示Cab-O-Sil对SDI颗粒的粘附性极小,并且Cab-O-Sil对SDI颗粒的表面覆盖极小,甚至没有。
表52:化合物A调配物D2、F7和F11预造粒和最终共混物流动性质
/>
对F7和F11的片剂压缩评估显示出与D2相似的结果,并确认改变助流剂系统没有显著的不良影响。这些调配物在相对较低的压缩应力范围(75至100MPa)下形成可接受的片剂,并且两种调配物的崩解时间都小于1分钟。
F7和F11的溶解度特性与D2相似,这表明新的助流剂体系对溶解度性质没有不利影响。
总之,与D2相比,F7和F11的流动性的适度改善不足以提名它们中的任何一个作为临床调配物候选,因此,进行了进一步的调配物优化。
由于助流剂与SDI预混合的附加步骤没有产生理想的结果,因此放弃了这种方法。然而,助流剂几乎没有粘附到SDI的意外结果构成了评估化学改性形成的胶体二氧化硅以增加其疏水性并降低其表面自由能的基础。
对Cab-O-Sil M5P和Aerosil R972进行了直接比较。如上所述,Aerosil R972是经过化学改性的胶体二氧化硅,其在表面上产生三甲基硅基。它符合USP/NF胶体二氧化硅专论。在此比较中,这些助流剂中的每一种都从规模扩大批次中添加到D2共混物中,以直接研究它们与D2相比对流动性的影响。调配物组合物列于表53中。
表53:化合物A-G1*和G2*调配物组合物
流动指标列于表55中。与D2和G1*相比,G2*表现出最佳的流动性。
表54:化合物A调配物D2、G1*和G2*最终共混物流动性质
A
B
C
D
比较G1和G2的压缩性(固体对比压缩应力)、片剂性(片剂拉伸强度对比压缩应力)和压实性(片剂拉伸强度对比片剂固体分数)即CTC曲线。调配物G1具有与调配物D2相似的CTC性质,这表明Cab-O-Sil对最终共混物材料性质的影响很小。与调配物G1和D2相比,调配物G2的压缩性有所改善,但片剂性和压实性性质均有所降低。这一发现的重要性最终在更大规模和旋转压力机上得到了评估。两种G调配物的压缩应力状态均在观察到的最佳模具磨损性能和片剂孔隙率(100至300MPa)的典型范围内。
G1和G2的实验室规模片剂的溶解度比较显示了相当的溶解度曲线,如图29所示。
鉴于G2表现出最佳的流动性、可接受的压缩/片剂性质以及与D2相似的溶解度曲线,因此选择它进行进一步评估以进行预演示的加工性评估。
使用等于100克的实验室规模批次大小在Gerteis小型处理器上进行加工性预演示评估,以针对演示批次确定目标Gerteis设置。Gerteis设置了一个进料漏斗系统,所述系统被设计成进料因量太小而无法使用螺旋进料和夯实系统的材料。收集带,然后通过振荡造粒机手动进料,以调整其尺寸。
主要目的是评估带固体分数对颗粒尺寸的影响。
G2调配物组合物列于表55中。该组合物与G2*的组合物略有不同,但预计不会显著影响颗粒或片剂的性质。压片重量调整为525mg(对比G2*的530mg),并且Aerosil R972的数量正好是组合物的1%。
表55:G2调配物组合物(负载20% SDI的片剂-525mg压片重量)
/>
调整带拉伸强度对颗粒尺寸分布的影响以及最终共混对颗粒尺寸分布的影响如图30A和30B所示。颗粒尺寸随着带拉伸强度的增加而减小。
还评估了带拉伸强度(造粒机筛网常数=1.00mm)对流动性质的影响,如表57所示。与实验室规模的试验相比,流动指标更好,卡尔指数=21-23;FloDex=16,FFc=7.1–8.5表示自由流动的造粒。
表56:预演示G2组合物最终共混物流动特性
使用G2预演示批次在F-压力机上制造的片剂的CTC扫描与使用实验室规模设备制造的片剂的观察结果一致。该造粒具有高度压缩性和压实性,并且可在100MPa的压缩应力范围内生产出具有可接受拉伸强度的片剂。如前所述,值得注意的是陡峭的拉伸强度与固体分数的关系。较高的固体分数意味着较低的片剂孔隙率。片剂孔隙率是影响溶解度的已知因素,因此,还评估了片剂拉伸强度对溶解速率和溶解程度的影响。
将在2.0和2.5MPa下压缩的G2预演示片剂的溶解度曲线与在2.5MPa下压缩的D2片剂的溶解度曲线进行比较,如图31所示。溶解度曲线相似,这显示溶解度曲线作为片剂孔隙率的函数没有明显差异。
总之,基于改进的流动行为、可接受的片剂性质和可接受的片剂溶解度,选择使用在预演示实验室大小批次期间确定的Gerteis设置的G2片剂组合物来制造演示批次。
通过口服给药对应的片剂并比较由此获得的血浆水平来评估5%(A3)和20%(G2)载药量的片剂的生物制药性能。将24只狗分成两组。每组禁食过夜,然后在片剂施用前30分钟喂食常规食物,然后喂食30mL水。否则,从给药前1小时到给药后1小时停止用水。在片剂给药前50分钟,所有受试者都用6μg/mL肌内注射五肽胃泌素溶液进行预处理。在给药后0小时、0.5小时、1小时、2小时、3小时、4小时、6小时、8小时、10小时、12小时、16小时、20小时、24小时、36小时、48小时、72小时、96小时、120小时、144小时和168小时采集血液样品。向一组施用含有5%化合物A负载的35mg片剂中的2片,并向另一组施用含有20%化合物A的70mg片剂中的1片。
如表57所示,当口服施用35mg(5%)片剂中的两片或70mg(20%)片剂中的一片时,在经过五肽胃泌素预处理的喂养状态狗中观察到类似暴露。
表57.向狗给药两片35mg(5%载药量)片剂或一片70mg(20%载药量)片剂递送的口服暴露的比较
实例28:1期后期的片剂演示批次配方
应用一种常见的造粒/包围策略来制造用于20% SDI载药量的调配物组合物的演示批次。压片重量介于35mg和140mg片剂强度之间(即175mg至700mg压片重量)的片剂的制造按以下方式实施。将一部分演示普通造粒最终共混物等分,以使用单工位压缩机压缩35mg、70mg和140mg片剂。将其余的普通造粒用于在代表临床制造片剂机的旋转压片机上以105mg强度(525mg压片重量)压缩成一批。将35mg、70mg、105mg和140mg演示批次用于下面实例29中描述的稳定性研究。
调配物组合物、造粒批次数量和片剂数量列于表58中。
表58:使用20% SDI负载的化合物A片剂(35mg、70mg、105mg和140mg强度)的演示批次配方。
在共混之前,将化合物A原料药溶解,然后喷雾干燥以形成如上所述的无定形成品药中间体。
制造普通造粒带,以实现实际带固体分数=0.60,其相当于估计的拉伸强度为0.8MPa。
最终共混物颗粒尺寸分布是可重现的,与预演示批次相比有利,如图32所示。
最终共混物流动指标也是可重现的,与预演示批次相比有利,如表59所示。
表59:G2组合物的预演示和演示最终共混物批次之间的流动指标比较,所述组合物被造粒成0.8MPa的带拉伸强度。
将最终共混物分为4份。三份各100克用于在单工位机器上制造35mg、70mg和140mg片剂,其余部分(约2kg)用于在旋转片剂机上制造105mg批次。
将35mg、70mg和140mg片剂强度压缩至2.0MPa拉伸强度圆形片剂。140mg的片剂崩解时间为2.3至~3.0分钟,70mg的片剂崩解时间为1.5至2.0分钟,并且35mg片剂的崩解时间为~1至1.3分钟。
105mg演示批次表现出良好的流动性,出色的重量和硬度控制以及出色的剂量单位均匀性证明了这一点。压片重量很容易保持在单个片剂的过程中限制±5%。剂量单位的均匀性UPS<905>AV=3.5,平均值=97.2%标示量。
35mg、105mg和140mg的溶解度比较如图33所示。溶解度针对稳定性研究中使用的片剂强度进行,所述片剂强度包括最高、最低和中等强度。溶解度曲线相当,这表明片剂强度对溶解速率和程度没有影响。
总之,基于可接受的加工性和最终产品性能,G2组合物被提名用于制造临床片剂,其强度可在35mg至140mg之间
实例29:调配物G2片剂的稳定性
对强度为35mg、105mg和140mg化合物A的调配物G2片剂进行稳定性研究(表61)。
方案(片剂包装)
包装用品:
●白色500cc HDPE制药圆瓶,带HIS盖
●1g吸附干燥剂罐
片剂包装方案:
1.将(22个)片剂添加到500cc HDPE瓶中。
2.将(1个)1g吸附干燥剂罐加入HDPE瓶中。
3.将HIS盖在HDPE瓶上,并使用Enercon超级密封Jr.盖封口机以60%的密封力密封瓶子,持续一秒钟。
4.取下瓶盖,确保铝箔密封正确粘附在瓶子上。将瓶盖拧回瓶子上,然后将瓶子放入适当的稳定室中。
表60:片剂稳定性条件、时间点和测试
通过UPLC分析片剂的外观、测定和相关物质,通过USPII分析溶解度,并通过体积法KF分析水含量。根据下面的表征,所有片剂剂量的外观、测定、溶解度性能和水含量均符合预期。与用于制造的SDI相比,纯度略有提高,并且应在随后的稳定性拉动中密切监测纯度。
对片剂的外观进行了目视评估。所有的片剂都是黄色的、表面光滑的片剂。
片剂测定值对于每个剂量是一致的,并且符合90%-110%LC的当前规格(表62)。
表61:化合物A稳定性片剂的制表复合物测定数据
方案(泡罩包装)
片剂由Fisher进行泡罩包装
●每条5个片剂(1X 5),1片/腔
●ALU/ALU–泡罩(冷成型箔)
在下面的每个时间点,针对每个稳定性条件在每个时间点拉出5条(总共25片)进行分析。
表62:泡罩稳定性条件、时间点和测试
稳定性研究结果如下表63-66所示。
表63:140mg剂量复方片剂瓶稳定性结果的摘要
*增加似乎与RRT 0.43处的峰值增加有关
表64:105mg剂量复方片剂瓶稳定性结果的摘要
*增加似乎与RRT 0.43处的峰值增加有关
表65:105mg剂量复方片剂泡罩稳定性结果的摘要
表66:35mg剂量复方片剂瓶稳定性结果的摘要
*增加似乎与RRT 0.43处的峰值增加有关
实施例:
本公开的方面参照以下带编号的实施例作进一步说明:
1.一种化合物A的结晶形式
其具有包括7.6°±0.2°2θ、11.5°±0.2°2θ和17.6°±0.2°2θ处的峰的粉末x射线衍射图,其中所述粉末x射线衍射图是使用Cu Kα辐射在
2.根据实施例1所述的化合物A的结晶形式,其进一步包括18.5°±0.2°2θ处的峰。
3.根据实施例1或2所述的化合物A的结晶形式,其进一步包括21.4°±0.2°2θ处的峰。
4.根据实施例1至3中任一项所述的化合物A的结晶形式,其进一步包括3.1°±0.2°2θ处的峰。
5.一种化合物A的结晶形式,其具有如图3A所示的粉末x射线衍射图。
6.一种化合物A的结晶形式,其具有包括11.0°±0.2°2θ、16.1°±0.2°2θ和17.9°±0.2°2θ处的峰的粉末x射线衍射图,其中所述粉末x射线衍射图是使用Cu Kα辐射在
7.根据实施例6所述的化合物A的结晶形式,其进一步包括11.3°±0.2°2θ处的峰。
8.根据实施例6或7所述的化合物A的结晶形式,其进一步包括17.2°±0.2°2θ处的峰。
9.根据实施例6至8中任一项所述的化合物A的结晶形式,其进一步包括7.9°±0.2°2θ处的峰。
10.一种化合物A的结晶形式,其具有如图3C所示的粉末x射线衍射图。
11.一种用于制造化合物A的工艺,其中所述工艺包括使N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-甲酰基哌啶-1-基)哒嗪-3-甲酰胺(中间体3)与2-(2,6-二氧代哌啶-3-基)-5-氟-6-(哌嗪-1-基)异吲哚啉-1,3-二酮盐酸盐(中间体5)和还原剂发生还原胺化,以提供化合物A:
12.根据实施例11所述的工艺,其中所述还原胺化在极性溶剂中进行。
13.根据实施例12所述的工艺,其中用于所述还原胺化的所述极性溶剂是二甲基乙酰胺(DMA)。
14.根据实施例11至13中任一项所述的工艺,其中用于所述还原胺化的所述还原剂是三乙酰氧基硼氢化钠。
15.根据实施例11至14中任一项所述的工艺,其中所述还原胺化在约-15至约30℃、约-10至约25℃、约-5至约20℃、约0至约15℃或约5至约10℃的温度范围内进行。
16.根据实施例11至15中任一项所述的工艺,其中一旦所述还原胺化反应完成,将乙醇和水的混合物加入到粗反应混合物中以沉淀化合物A。
17.根据实施例16所述的工艺,其中所述乙醇与水的混合物具有约1:1(v/v)的乙醇:水比率。
18.根据实施例11至17中任一项所述的工艺,其中所述还原胺化是在存在碱的情况下进行的
19.根据实施例18所述的工艺,其中用于所述还原胺化的所述碱是三乙胺或N-甲基吗啉。
20.根据实施例19所述的工艺,其中中间体5与碱的比率为约1:0.7(w/v)。
21.根据实施例19所述的工艺,其中所述中间体5与碱的比率为约1.7:1(w/w)。
22.根据实施例19所述的工艺,其中所述中间体5与碱的比率为约1.9:1(w/w)。
23.根据实施例11至22中任一项所述的工艺,其中中间体3与中间体5的摩尔比为约1.1:1。
24.根据实施例11至22中任一项所述的工艺,其中中间体3与中间体5的所述摩尔比为约1.05:1。
25.根据实施例11至22中任一项所述的工艺,其中中间体3与中间体5的所述摩尔比介于约1:1和约1.1:1之间。
26.根据实施例11至22中任一项所述的工艺,其中中间体3与中间体5的所述摩尔比为约1.0:1.0。
27.根据实施例11至26中任一项所述的工艺,其进一步包括用于纯化化合物A的步骤。
28.根据实施例27所述的工艺,其中化合物A的所述纯化包括:
(A1)将化合物A溶解在约二氯甲烷和甲醇的混合物中;
(A2)过滤包括化合物A的溶液;
(A3)将包括所述化合物A的溶液的溶剂与乙醇进行蒸馏交换;
(A4)使化合物A从所述乙醇溶液中结晶;以及
(A5)干燥所述纯化的化合物A的结晶固体形式。
29.根据实施例28所述的工艺,其中(A1)中二氯甲烷与甲醇的所述比率为约9:1(w/w)。
30.根据实施例28所述的工艺,其中(A1)中二氯甲烷与甲醇的所述比率为约10:1(w/w)。
31.根据实施例28所述的工艺,其中步骤(A3)中的乙醇的体积相对于所述还原胺化步骤中提供的中间体3的量为约7体积。
32.根据实施例31所述的工艺,其中将步骤(A3)中的乙醇的量针对粗品化合物A中的乙醇含量进行校正。
33.根据实施例28至32中任一项所述的工艺,其中步骤(A5)中对所述纯化的化合物A的结晶形式的所述干燥是在真空中进行的。
34.根据实施例33所述的工艺,其中所述真空干燥在约15至约30℃、约20至约30℃、约30至约40℃或约35至约45℃下发生。
35.根据实施例33所述的工艺,其中所述真空干燥在大于约50℃、大于约60℃、大于约70℃或大于约80℃下发生。
36.根据实施例33所述的工艺,其中所述真空干燥在约60℃和约70℃之间发生。
37.根据实施例33所述的工艺,其中所述真空干燥在约65℃下发生。
38.根据实施例33所述的工艺,其中所述真空干燥在约75℃和约85℃之间发生。
39.根据实施例33所述的工艺,其中所述真空干燥在约80℃下发生。
40.根据实施例11至39中任一项所述的工艺,其进一步包括使N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-(羟甲基)哌啶-1-基)哒嗪-3-甲酰胺(中间体2)氧化,以形成N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-甲酰基哌啶-1-基)哒嗪-3-甲酰胺(中间体3):
41.根据实施例40所述的工艺,其中所述氧化是使用约0.01当量的(2,2,6,6-四甲基哌啶-1-基)氧基(TEMPO)和约1当量的次氯酸钠进行的。
42.根据实施例40所述的工艺,其中所述氧化是使用约0.01当量的TEMPO和约1.15当量的次氯酸钠进行的。
43.根据实施例41或42中任一项所述的工艺,其中所述氧化是在包括二氯甲烷的溶剂中进行的。
44.根据实施例41至43中任一项所述的工艺,其中所述氧化在存在仲醇的情况下发生。
45.根据实施例44所述的工艺,其中所述仲醇是异丙醇。
46.根据实施例43至45中任一项所述的工艺,其中用于所述氧化的所述溶剂进一步包括水性氯化钠。
47.根据实施例40至46中任一项所述的工艺,其中所述氧化在低于约25℃、低于约20℃、低于约15℃、低于约10℃、低于约5℃、低于约0℃、低于约-5℃或低于约-11℃的温度下进行。
48.根据实施例40至46中任一项所述的工艺,其中所述氧化在约-11℃的温度下进行。
49.根据实施例41至46中任一项所述的工艺,其中所述次氯酸钠在少于60分钟、少于45分钟、少于30分钟或少于20分钟的过程内加入。
50.根据实施例41至46中任一项所述的工艺,其中所述次氯酸钠在介于约15和约45分钟之间的过程内加入。
51.根据实施例41至46中任一项所述的工艺,其中所述次氯酸钠在约30分钟的过程内加入。
52.根据实施例41至51中任一项所述的工艺,其进一步包括将包括二氯甲烷的所述溶剂交换为第二溶剂的步骤。
53.根据实施例52所述的工艺,其中所述第二溶剂包括乙腈。
54.根据实施例52所述的工艺,其中所述第二溶剂包括四氢呋喃。
55.根据实施例52所述的工艺,其中所述溶剂交换是通过蒸馏完成的。
56.根据实施例40至55中任一项所述的工艺,其进一步包括通过重结晶纯化中间体3的步骤。
57.根据实施例56所述的工艺,其中通过重结晶对中间体3的所述纯化在存在溶剂和反溶剂的情况下发生。
58.根据实施例56所述的工艺,其中所述重结晶包括以下步骤:
Bi)将粗品中间体3与溶剂和反溶剂的混合物组合;
Bii)搅拌所述粗品中间体3、溶剂和反溶剂的混合物;以及
Biii)过滤所述粗品中间体3、溶剂和反溶剂的混合物,以获得中间体3。
59.根据实施例58所述的工艺,其中所述重结晶溶剂是极性非质子有机溶剂,并且所述反溶剂是水性溶剂。
60.根据实施例59所述的工艺,其中用于中间体3的所述重结晶溶剂包括乙腈。
61.根据实施例59所述的工艺,其中用于中间体3的所述重结晶溶剂包括二氯甲烷。
62.根据实施例59所述的工艺,其中用于中间体3的所述重结晶溶剂包括四氢呋喃。
63.根据实施例59所述的工艺,其中用于中间体3的所述重结晶溶剂包括二氯甲烷和四氢呋喃。
64.根据实施例59至63中任一项所述的工艺,其中所述重结晶反溶剂是水。
65.根据实施例59至63中任一项所述的工艺,其中所述重结晶反溶剂包括正庚烷。
66.根据实施例59至65中任一项所述的工艺,其中重结晶溶剂与反溶剂的所述比率为约1:1(v/v)。
67.根据实施例59至65中任一项所述的工艺,其中重结晶溶剂与反溶剂的所述比率为约1.04:1(v/v)。
68.根据实施例59至65中任一项所述的工艺,其中重结晶溶剂与反溶剂的所述比率为约0.6:1(v/v)。
69.根据实施例59至68中任一项所述的工艺,其中步骤Bii)在15℃和25℃之间的温度下进行。
70.根据实施例69所述的工艺,其中步骤Bii)在约18℃的温度下进行。
71.根据实施例69所述的工艺,其中步骤Bii)在约20℃的温度下进行。
72.根据实施例59至71中任一项所述的工艺,其中步骤Bii)的所述搅拌进行至少5小时、至少12小时、至少14小时、至少16小时或至少18小时。
73.根据实施例72所述的工艺,其中步骤Bii)的所述搅拌进行至少16小时。
74.根据实施例72所述的工艺,其中步骤Bii)的所述搅拌进行约18小时。
75.根据实施例11至74中任一项所述的工艺,其进一步包括使6-氯-N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)哒嗪-3-甲酰胺(中间体4)和哌啶-4-基甲醇在存在碱的情况下发生亲核芳香族取代反应,以提供N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-(羟甲基)哌啶-1-基)哒嗪-3-甲酰胺(中间体2):
76.根据实施例75所述的工艺,其中所述亲核芳香族取代反应在极性溶剂中进行。
77.根据实施例76所述的工艺,其中用于所述亲核芳香族取代的所述极性溶剂是二甲基乙酰胺(DMA)。
78.根据实施例75至77中任一项所述的工艺,其中用于所述亲核芳香族取代的所述碱是N,N-二异丙基乙胺。
79.根据实施例75至78中任一项所述的工艺,其中所述亲核芳香族取代反应在约60℃至约130℃、约75℃至约115℃或约90℃至约100℃的温度下进行。
80.根据实施例75至79中任一项所述的工艺,其进一步包括通过在有机溶剂中重结晶来纯化中间体2的步骤。
81.根据实施例75至80中任一项所述的工艺,其中中间体2的所述重结晶进一步包括以下步骤:
Ci)将有机溶剂中的粗品中间体2与促进结晶的药剂组合;
Cii)减少有机溶剂的体积;
Ciii)添加额外量的有机溶剂;
Civ)在高于30℃的温度下搅拌来自第iii)部分的混合物;
Cv)将来自第iii)部分的混合物冷却至低于25℃的温度;
Cvi)减少有机溶剂的体积;
Cvii)在低于25℃的温度下搅拌来自第vi)部分的混合物;以及
Cvii)过滤所述混合物,以获得中间体2。
82.根据实施例81所述的工艺,其中步骤Cii)中的所述有机溶剂是乙酸异丙酯。
83.根据实施例81或82所述的工艺,其中Ci)中促进结晶的所述药剂是中间体2的籽晶。
84.根据实施例81至83中任一项所述的工艺,其中步骤Ciii)中有机溶剂体积的所述减少是通过真空蒸馏进行的。
85.根据实施例81至84中任一项所述的工艺,其中步骤Cvi)中有机溶剂体积的所述减少是通过真空蒸馏进行的。
86.根据实施例81至85中任一项所述的工艺,其中步骤Civ)的所述温度为约50℃。
87.根据实施例81至86中任一项所述的工艺,其中步骤Cv)的所述温度为约20℃。
88.根据实施例81至87中任一项所述的工艺,其中步骤Cvii)的所述温度为约10℃。
89.根据实施例11至88中任一项所述的工艺,其进一步包括使4-(((1r,4r)-4-氨基环己基)氧基)-2-氯苯腈盐酸盐(中间体7)和6-(4-(羟甲基)哌啶-1-基)哒嗪-3-羧酸(中间体10)在偶联剂的促进下发生酰胺偶联,以提供N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)-6-(4-(羟甲基)哌啶-1-基)哒嗪-3-甲酰胺(中间体2):
90.根据实施例89所述的工艺,其中所述酰胺偶联在极性溶剂中进行。
91.根据实施例90所述的工艺,其中用于所述酰胺偶联的所述极性溶剂是二甲基乙酰胺(DMA)。
92.根据实施例89至91中任一项所述的工艺,其中用于所述酰胺偶联的所述偶联剂是碳二亚胺。
93.根据实施例92所述的工艺,其中所述碳二亚胺是1-乙基-3-(3-二甲氨基丙基)碳二亚胺。
94.根据实施例89至93中任一项所述的工艺,其中所述酰胺偶联在约5℃至约15℃、约10℃至约20℃、约20℃至约40℃、约30℃至约50℃或约35℃至约45℃的温度下进行。
95.根据实施例89至94中任一项所述的工艺,其中中间体7与中间体10的摩尔比的所述比率为约1.05:1。
96.根据实施例89至94中任一项所述的工艺,其中中间体7与中间体10的摩尔比的所述比率为约1.02:1。
97.根据实施例89至96中任一项所述的工艺,其进一步包括通过在有机溶剂中重结晶来纯化中间体2的步骤。
98.根据实施例97所述的工艺,其中用于中间体2重结晶的所述有机溶剂是乙酸异丙酯。
99.根据实施例97所述的工艺,其中用于中间体2重结晶的所述有机溶剂包括四氢呋喃和正庚烷。
100.根据实施例97至99中任一项所述的工艺,其中用于中间体2重结晶的所述有机溶剂用纯中间体2的晶体引晶。
101.根据实施例97至100中任一项所述的工艺,其中中间体2的所述重结晶是通过减少用于中间体2重结晶的所述有机溶剂的体积来进行的。
102.根据实施例101所述的工艺,其中减少用于中间体2重结晶的所述有机溶剂的体积是通过真空蒸馏进行的。
103.根据实施例97至102中任一项所述的工艺,其中中间体2的所述重结晶是通过冷却用于中间体2重结晶的所述有机溶剂来进行的。
104.根据实施例103所述的工艺,其中用于中间体2重结晶的所述有机溶剂被冷却至约15℃和约25℃之间的温度。
105.根据实施例103所述的工艺,其中用于中间体2重结晶的所述有机溶剂被冷却至约20℃的温度。
106.根据实施例11至105中任一项所述的工艺,其中所述化合物A的纯化形式具有结晶形式,所述结晶形式具有包括7.6°±0.2°2θ、11.5°±0.2°2θ和17.6°±0.2°2θ处的峰的粉末x射线衍射图,其中所述粉末x射线衍射图是使用Cu Kα辐射在
107.一种化合物,其是:
6-氯-N-((1r,4r)-4-(3-氯-4-氰基苯氧基)环己基)哒嗪-3-甲酰胺,
108.一种化合物A的超纯形式,其具有大于约98%的纯度。
109.一种化合物A的超纯形式,其具有大于约98%的纯度,并且包括少于约1%的杂质中间体2:
110.根据实施例109所述的化合物A的超纯形式,其包括少于约0.5%的杂质中间体2。
111.根据实施例109所述的化合物A的超纯形式,其包括少于约0.2%的杂质中间体2。
112.一种化合物A的超纯形式,其具有大于约98%的纯度,并且包括少于约1%的杂质中间体3:
113.根据实施例112所述的化合物A的超纯形式,其包括少于约0.5%的杂质中间体3。
114.根据实施例112所述的化合物A的超纯形式,其包括少于约0.1%的杂质中间体3。
115.一种化合物A的超纯形式,其具有大于约98%的纯度,并且包括少于约1%的杂质中间体5:
116.根据实施例115所述的化合物A的超纯形式,其包括少于约0.5%的杂质中间体5。
117.根据实施例115所述的化合物A的超纯形式,其包括少于约0.1%的杂质中间体5。
118.根据实施例115所述的化合物A的超纯形式,其包括少于约0.05%的杂质中间体5。
119.一种化合物A的超纯形式,其具有大于约98%的纯度,并且包括少于约1%的杂质1:
120.根据实施例119所述的化合物A的超纯形式,其包括少于约0.5%的杂质1。
121.根据实施例119所述的化合物A的超纯形式,其包括少于约0.1%的杂质1。
122.根据实施例119所述的化合物A的超纯形式,其包括少于约0.05%的杂质1。
123.一种化合物A的超纯形式,其具有大于约95%的纯度,并且包括少于约1%的杂质2:
124.根据实施例123所述的化合物A的超纯形式,其包括少于约0.5%的杂质2。
125.根据实施例123所述的化合物A的超纯形式,其包括少于约0.2%的杂质2。
126.根据实施例123所述的化合物A的超纯形式,其包括少于约0.15%的杂质2。
127.一种化合物A的超纯形式,其具有大于约95%的纯度,并且包括少于约1%的杂质3:
128.根据实施例127所述的化合物A的超纯形式,其包括少于约0.5%的杂质3。
129.根据实施例128所述的化合物A的超纯形式,其包括少于约0.2%的杂质3。
130.根据实施例129所述的化合物A的超纯形式,其包括少于约0.15%的杂质3。
131.一种化合物A的超纯形式,其具有大于约95%的纯度,并且包括少于约1%的杂质4:
132.根据权利要求131所述的化合物A的超纯形式,其包括少于约0.5%的杂质4。
133.根据实施例131所述的化合物A的超纯形式,其包括少于约0.2%的杂质4。
134.根据实施例131所述的化合物A的超纯形式,其包括少于约0.15%的杂质4。
135A.根据实施例108至134中任一项所述的化合物A的超纯形式,其中化合物A的所述纯度由HPLC确定。
135B.根据实施例109至135A中任一项所述的化合物A的超纯形式,其中所述中间体或杂质的所述量由HPLC确定。
136.根据实施例108至135A中任一项所述的化合物A的超纯形式,其中化合物A的所述纯度大于约99%、约99.5%或约99.9%。
137.根据实施例108至135中任一项所述的化合物A的超纯形式,其中化合物A的所述纯度大于约99.5%。
138.一种化合物A的超纯形式,其具有大于约98%的纯度,并且包括少于约1%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
139.根据实施例138所述的化合物A的超纯形式,其中化合物A的所述纯度大于约99%。
140.根据实施例108至135中任一项所述的化合物A的超纯形式,其包括少于约0.9%、约0.8%、约0.7%、约0.6%或约0.5%的以下杂质中的至少两种:中间体2、中间体3、中间体5、杂质1、杂质2、杂质3和杂质4。
141.根据实施例108至135中任一项所述的化合物A的超纯形式,其中所述化合物A具有约99.9%的纯度。
142.根据实施例108至141中任一项所述的化合物A的超纯形式,其中化合物A为无定形形式。
143.根据实施例108至141中任一项所述的化合物A的超纯形式,其特征在于,在25℃和0%相对湿度下玻璃化转变温度Tg为146℃。
144.根据实施例108至141中任一项所述的化合物A的超纯形式,其特征进一步在于,在40℃和75%相对湿度下玻璃化转变温度Tg为103℃。
145.根据实施例108至144中任一项所述的化合物A的超纯形式,其特征进一步在于,D
146.根据实施例108至145中任一项所述的化合物A的超纯形式,其特征进一步在于,D
147.根据实施例108至146中任一项所述的化合物A的超纯形式,其特征在于,D
148.根据实施例145至147中任一项所述的化合物A的超纯形式,其中粒径通过激光衍射测量。
149.根据实施例108至148中任一项所述的化合物A的超纯形式,其特征在于,所述无定形形式在2-8℃下稳定至少1个月;在25℃和60%相对湿度下稳定至少1个月;并在40℃和75%相对湿度下稳定至少1个月。
150.一种用于制造根据实施例108至149中任一项所述的化合物A的无定形形式的工艺,其中所述工艺包括以下步骤:
(D1)将结晶化合物A溶解在溶剂中,得到化合物A的溶液;
(D2)将来自步骤(1)的所述化合物A溶液引入喷雾干燥机中;
(D3)从所述喷雾干燥机喷洒所述化合物A溶液,以形成所述化合物A的无定形形式;
以及
(D4)从所述化合物A的无定形形式中除去残留溶剂。
151.根据实施例150所述的工艺,其中步骤(D1)的所述溶剂是二氯甲烷和甲醇的混合物。
152.根据实施例151所述的工艺,其中步骤(D1)的所述溶剂是约95:5(w/w)至约80:20(w/w)的二氯甲烷:甲醇的混合物。
153.根据实施例150至152中任一项所述的工艺,其中步骤(D1)的所述溶剂是约90:10(w/w)的二氯甲烷:甲醇的混合物。
154.根据实施例150至152中任一项所述的工艺,其中步骤(D1)的所述溶剂是约95:5(w/w)的二氯甲烷:甲醇的混合物。
155.根据实施例150至152中任一项所述的工艺,其中步骤(D1)的所述溶剂是约93:7(w/w)的二氯甲烷:甲醇的混合物。
156.根据实施例150至152中任一项所述的工艺,其中步骤(D4)中残留溶剂的去除是通过托盘干燥完成的。
157.根据实施例150至156中任一项所述的工艺,其中步骤(D4)中残留溶剂的去除是通过过滤器干燥完成的。
158.根据实施例150至156中任一项所述的工艺,其中步骤(D4)中残留溶剂的所述去除是通过滚筒干燥完成的。
159.根据实施例150至156中任一项所述的工艺,其中步骤(D4)中残留溶剂的所述去除是通过搅拌锥形干燥完成的。
160.根据实施例150至156中任一项所述的工艺,其中步骤(D4)中残留溶剂的所述去除是通过流化床干燥完成的。
161.一种口服剂型,其包括一种或多种药学上可接受的赋形剂和根据实施例108至160中任一项所述的化合物A,其中所述口服剂型选自由片剂、小袋或胶囊组成的组。
162.根据实施例161所述的口服剂型,其中所述化合物A是根据实施例108至149中任一项所述的化合物A的超纯形式。
163.根据实施例161或162所述的口服剂型,其中所述口服剂型是片剂。
164.根据实施例161或162所述的口服剂型,其中所述口服剂型是小袋。
165.根据实施例161或162所述的口服剂型,其中所述口服剂型是胶囊。
166.根据实施例163所述的片剂,其中所述片剂中所述化合物A的量介于约5mg和1000mg之间。
167.根据实施例166所述的片剂,其中所述片剂中所述化合物A的量为约35mg至约280mg。
168.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约35mg。
169.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约70mg。
170.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约105mg。
171.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约140mg。
172.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约175mg。
173.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约210mg。
174.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约245mg。
175.根据实施例167所述的片剂,其中所述片剂中所述化合物A的量为约280mg。
176.根据实施例163或166至175中任一项所述的片剂,其中所述药学上可接受的赋形剂选自由填充剂、崩解剂、助流剂和润滑剂组成的组。
177.根据实施例176所述的片剂,其中所述填充剂是微晶纤维素、硅化微晶纤维素、乳糖一水合物、甘露醇、山梨醇、木糖醇、羟丙基甲基纤维素、羟丙基纤维素、支链淀粉、如Pharmaburst
178.根据实施例176所述的片剂,其中所述崩解剂是淀粉乙醇酸钠、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲基纤维素钠、交聚维酮、壳聚糖、琼脂、海藻酸、海藻酸钙、甲基纤维素、微晶纤维素、粉状纤维素、低级烷基取代的羟丙基纤维素、羟丙基淀粉、低取代的羟丙基纤维素、聚克立林钾、淀粉、预胶化淀粉、海藻酸钠、硅酸镁铝、聚克立林钾、聚维酮或其任意混合物。
179.根据实施例176所述的片剂,其中所述助流剂是二氧化硅、胶体二氧化硅、硅酸钙、硅酸镁、三硅酸镁、滑石、淀粉或其任意混合物。
180.根据实施例176所述的片剂,其中所述润滑剂是硬脂酸镁、硬脂酸钙、单硬脂酸甘油酯、山嵛酸甘油酯、棕榈硬脂酸甘油酯、六方氮化硼、氢化植物油、轻矿物油、矿物油、聚乙二醇、泊洛沙姆、苯甲酸钠、十二烷基硫酸钠、富马酸硬脂基钠、硬脂酸、滑石、硬脂酸锌或其任意混合物。
181.根据实施例163或166至175中任一项所述的片剂,其包括:
约1至约50%w/w的化合物A;
约35至约60%w/w的微晶纤维素;
约15至约50%w/w的乳糖一水合物;
约1至约5%w/w的交联羧甲基纤维素钠;
0至约1%w/w的二氧化硅;以及
0至约1%w/w的硬脂酸镁。
182.根据实施例163或166至175中任一项所述的片剂,其包括:
约5%w/w的化合物A;
约45.5%w/w的微晶纤维素;
约45.5%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.5%w/w的硬脂酸镁。
183.根据实施例163或166至175中任一项所述的片剂,其包括粒内部分和粒外部分,其中所述粒内部分包括
约10至约40%w/w的化合物A;
约35至约60%w/w的微晶纤维素;
约15至约30%w/w的乳糖一水合物;
约1至约10%w/w的交联羧甲基纤维素钠;
0至约1%w/w的二氧化硅;以及
0至约0.5%w/w的硬脂酸镁;
并且其中所述粒外部分包括
约1至约5%w/w的交联羧甲基纤维素钠;
0至约1%w/w的硬脂酸镁;以及
0至约2%w/w的二氧化硅。
184.根据实施例163或166至175中任一项所述的片剂,其包括粒内部分和粒外部分,其中所述粒内部分包括:
约20%w/w的化合物A;
约48.7%w/w的微晶纤维素;
约24.3%w/w的乳糖一水合物;
约3%w/w的交联羧甲基纤维素钠;
约0.5%w/w的二氧化硅;以及
约0.25%w/w的硬脂酸镁;
并且其中所述粒外部分包括:
约2%w/w的交联羧甲基纤维素钠;
约0.5%w/w的硬脂酸镁;以及
约0.25%w/w的二氧化硅。
185.根据实施例183或184所述的片剂,其中所述粒外部分中的所述二氧化硅包括气相二氧化硅。
186.根据实施例183至185中任一项所述的片剂,其中所述粒外部分中的所述二氧化硅包括用二甲基二氯硅烷处理后的气相二氧化硅。
187.根据实施例183至186中任一项所述的片剂,其中所述粒外部分中的所述二氧化硅包括用二氧化硅表面的三甲基硅基进行化学改性的气相二氧化硅。
188.根据实施例163或166至187中任一项所述的片剂,其中所述化合物A是化合物A的超纯形式。
189.根据实施例163或166至187中任一项所述的片剂,其中所述化合物A是按照根据实施例150至160中任一项所述的工艺制备的。
190.一种制造根据实施例163或166至187中任一项所述的片剂的方法,所述方法包括以下步骤:
(E1)将一种形式的化合物A与至少一种药学上可接受的赋形剂共混以产生粉末;
(E2)将来自步骤(E1)的所述粉末脱块,加入至少一种药学上可接受的赋形剂,并共混以产生第一共混物;
(E3)将来自步骤(E2)的所述共混物造粒,并使所得粉末通过筛网以产生多个颗粒;
(E4)向来自步骤(E3)的多个颗粒中加入至少一种药学上可接受的赋形剂,并共混以产生第二共混物;以及
(E5)将来自步骤(E4)的所述第二共混物压缩成一个或多个片剂。
191.根据实施例190所述的方法,其中步骤(E1)中化合物A的所述形式是化合物A的无定形形式。
192.根据实施例190或191所述的方法,其中,在步骤(E1)中,将化合物A与至少一种填充剂、至少一种崩解剂和至少一种助流剂共混。
193.根据实施例192所述的方法,其中,在步骤(E1)中,将化合物A与两种填充剂、一种崩解剂和一种助流剂共混。
194.根据实施例192所述的方法,其中,在步骤(E1)中,将化合物A与两种填充剂、一种崩解剂、一种助流剂和一种润滑剂共混。
195.根据实施例193或194所述的方法,其中至少一种填充剂是微晶纤维素。
196.根据实施例193至195所述的方法,其中至少一种填充剂是乳糖一水合物。
197.根据实施例190至196中任一项所述的方法,其中至少一种崩解剂是交联羧甲基纤维素钠。
198.根据实施例190至197中任一项所述的方法,其中至少一种助流剂是二氧化硅。
199.根据实施例190至198中任一项所述的方法,其中至少一种润滑剂是硬脂酸镁。
200.根据实施例190至199中任一项所述的方法,其中步骤(E2)的至少一种药学上可接受的赋形剂是润滑剂。
201.根据实施例200所述的方法,其中至少一种润滑剂是硬脂酸镁。
202.根据实施例190至201中任一项所述的方法,其中步骤(E4)的所述至少一种药学上可接受的赋形剂包括至少一种润滑剂。
203.根据实施例202所述的方法,其中所述至少一种润滑剂是粒外硬脂酸镁。
204.根据实施例190至203中任一项所述的方法,其中在步骤(E4)中将至少一种助流剂、至少一种崩解剂和至少一种润滑剂加入到所述多个颗粒中。
205.根据实施例204所述的方法,其中在步骤(E4)中加入的至少一种助流剂是二氧化硅。
206.根据实施例204或205中任一项所述的方法,其中在步骤(E4)中加入的至少一种崩解剂是交联羧甲基纤维素钠。
207.根据实施例204至206中任一项所述的方法,其中在步骤(4)中加入的至少一种润滑剂是硬脂酸镁。
208.根据实施例190至207中任一项所述的方法,其中来自步骤(E4)的所述共混物在步骤(E5)中使用旋转压力机进行压缩。
209.一种治疗受试者的癌症的方法,所述方法包括向需要所述治疗的受试者施用根据实施例161至189中任一项所述的一种或口服剂型。
210.根据实施例209所述的方法,其中所述癌症是前列腺癌。
211.根据实施例210所述的方法,其中所述前列腺癌是转移性去势抵抗性前列腺癌。
212.根据实施例209至211中任一项所述的方法,其中将所述一个或多个片剂每天一次、每天两次、每天三次或每天四次施用于所述受试者。
213.根据实施例209至212中任一项所述的方法,其中将所述一个或多个片剂一次性全部施用于所述受试者或细分为两个、三个、四个或多个子部分进行施用。
214.根据实施例209至213中任一项所述的方法,其中所述受试者处于进食状态。
215.根据实施例209至213中任一项所述的方法,其中所述受试者处于禁食状态。
216.根据实施例209至215中任一项所述的方法,其中所述受试者还正在服用或正在被施用抗酸药物。
217.根据实施例209至216中任一项所述的方法,其进一步包括施用额外的抗癌剂。
218.根据实施例217所述的方法,其中所述额外的抗癌剂是PARP抑制剂。
- 双官能团苯甲酰基甲酸羟基酮酯类化合物及含该类化合物的光引发剂
- 新型双官能团苯甲酰基甲酸羟基酮酯类化合物及含该类化合物的光引发剂
