Argonaute介导的一锅法microRNA检测体系及检测方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及microRNA检测的技术领域,具体涉及一种Argonaute介导的一锅法microRNA检测体系及检测方法;更具体地,涉及可编程Argonaute核酸特异性剪切酶介导的一锅法microRNA检测/分子诊断体系及方法。
背景技术
MicroRNA(miRNA)是一类短链非编码RNA,miRNA通过靶向mRNA,进而抑制转录后的基因表达,在调控基因表达方面起着重要作用(Cell,2004,116(2):281-297)。miRNA丰度水平的升高或降低与疾病的发生密切相关,被作为疾病诊断、监测的重要标志物之一。例如过去几十年的研究表明,miRNA的异常水平与肿瘤的发生、发展、转移等密切相关,被认为是肿瘤诊断和预后的重要标志物(Nature reviews cancer,2006,6(4):259-269.)。由于肿瘤本身的复杂性,肿瘤标志物的敏感性和特异性较差,目前肿瘤的早期精准诊断一直是困扰着人类的一个难题。而miRNA在许多体液中稳定存在,包括血清、唾液、尿液等,其可以耐受RNA酶的降解,在一定pH和温度下保持稳定,为肿瘤的诊断开辟了新思路。检测循环血液中的miRNA表达水平有希望成为恶性肿瘤早期诊断最佳选择。
核酸检测技术包括逆转录-聚合酶链反应(reverse transcription-polymerasechain reaction,RT-PCR)、等温扩增和高通量测序,均已经发展成熟,并广泛应用于分子医学诊断,但在灵敏度、特异性和操作便利性方面存在不足。此外由于miRNA片段短、种类多、序列相似性高,而复杂生物样本的干扰物众多,靶标含量极其微少,导致传统方法运用于miRNA检测时存在很大的局限性。例如PCR检测miRNA需要复杂的设计、逆转录和PCR过程,灵敏度和特异性有限。高通量测序存在耗时长、费用高、步骤繁琐等问题。目前,针对miRNA尚缺乏令人满意的检测方法。
CRISPR-Cas系统是细菌为了防御病毒侵入而形成的一种机制,可编程核酸内切酶(Cas酶)可特异性识别其靶标和精准高效剪切核酸链酸,近几年来迅速成为基因组编辑、转录调控和核酸检测等一系列领域的高效工具,被认为是提高基因检测特异性和灵敏度的有力工具。CRISPR技术结合PCR、重组酶聚合酶扩增(recombinase polymeraseamplification,RPA)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)、滚环扩增(rolling circle amplification,RCA)等扩增方法,通过目标物的扩增子激活Cas酶的反式剪切活性,剪切探针放大信号,可实现各种目标的检测,包括病原体、基因突变等(ACS synthetic biology,2020,9(6):1226-1233.Biosensors andBioelectronics,2020,165:112430.)。CRISPR的主要不足有以下三点:1、Cas酶的前间隔序列邻近基序(protospacer adjacent motif,PAM)/PFS(protospacer flanking sequence)序列依赖性限制了其在任意目标序列的应用;2、Cas酶通过识别剪切目标物同时在非特异性反式切割游离的单链荧光探针,释放荧光以达到检测目的,对多重目标进行同时检测是需要依赖多重Cas酶,导致多重检测体系的复杂性高、较难实现、成本高;3、Cas酶依赖于RNA为向导(guide),RNA合成成本较高,且稳定性较差。目前,可利用Cas酶介导的反式切割对目标miRNA进行检测,但是通常需要两步法来实现,尚无法在一锅法检测体系,即在单个反应中一步完成核酸扩增和释放剪切信号,且无法对多重目标进行同步快速、有效检测。因此,本领域迫切需要开发针对目标miRNA的灵敏度高、特异性好、通量高的一锅法检测方法。
Argonaute蛋白(Ago蛋白/Ago核酸酶)是一类庞大的蛋白质家族,包括原核生物Ago(pAgo)和真核生物Ago(eAgo)(Genome biology,2008,9(2):1-8.Nature ReviewsGenetics,2013,14(7):447-459.)。eAgo使用小RNA向导来寻找其mRNA靶标,从而调节基因表达并抑制真核生物中的移动遗传元件。pAgo存在于许多细菌和古细菌物种中,与真核蛋白不同,pAgo使用小型DNA向导来切割DNA,这一过程被称为DNA干扰。这种独特的由DNA/RNA分子所引导的核酸内切酶活性引起越来越多的兴趣,Ago核酸酶(或称为Argonaute酶核酸,简称Ago酶或Argonaute酶)通过向导DNA与靶标碱基互补配对的方式,具备单碱基分辨率水平的精准识别能力和高效剪切能力,在基因编辑和基因检测方面展现出巨大的应用前景(Emerging Argonaute-based nucleic acid biosensors,Trends in Biotechnology,2022.)。来自超嗜热古生菌Pyrococcus furiosus的Ago(PfAgo)可以在95℃下执行由短链5′-磷酸化单链DNA(Single-stranded DNA,ssDNA)作为向导DNA(guide DNA,gDNA)指导的精确DNA切割(Nucleic acids research,2015,43(10):5120-5129.)。来自嗜热栖热菌Thermus thermophilus(TtAgo)和詹氏甲烷球菌Methanocaldococcus jannaschii(MjAgo)的嗜热Ago显示出与PfAgo相似的核酸内切酶活性,存在最佳剪切温度不同(Journal ofAdvanced Research,2020,24:317-324.)。此外,双链DNA(Double-stranded DNA,dsDNA)底物可以在无引导条件下,经过长时间高温下孵育后被Ago切割,这表明通过dsDNA不稳定性随机产生的ssDNA可能是用作新指导物并指导进一步的DNA切割。作为可编程核酸内切酶,TtAgo已被成功用于低丰度单碱基变异(single nucleotide variants,SNV)基因富集,提高SNV检测灵敏度(Nucleic acids research,2020,48(4):e19-e19.)。PfAgo和PCR反应耦联的核酸检测方法可以实现检测0.01%丰度的基因突变且效率提高5500倍以上(Nucleicacids research,2021,49(13):e75-e75.)。产气荚膜梭菌Clostridium perfringensArgonaute(CpAgo)是来自于人体肠道微生物产气荚膜梭菌Clostridium perfringens表达的蛋白,研究发现CpAgo在4-60℃温度范围内有剪切活性,在gDNA的介导下能剪切单链核酸目标物,长时间作用能剪切质粒(Cell Discovery,2019,5(1):1-4.)。格氏嗜盐碱杆菌Natronobacterium gregoryi Argonaute(NgAgo),丁酸梭菌Clostridium butyricumArgonaute(CbAgo)和Limnothrix rosea Argonaute(LrAgo),它们在生理温度下可在体外进行DNA介导的DNA切割。通常情况下,Ago只有需要一段5’磷酸化的单链DNA(一般15-20个碱基)作为gDNA,靶向识别与gDNA互补配对的特定核酸序列,并且在gDNA第10-11位的碱基位置剪切互补的DNA或者RNA核酸序列。与Cas核酸酶相比,Ago酶无PAM序列依赖性,实际检测应用中更具有普适性。另外gDNA设计容易,价格便宜且稳定。因此Argonaute酶在核酸检测方面展现出极大的优势和应用前景。
截至目前,大多数核酸检测方法涉及的步骤较为繁琐和耗时,例如RT-PCR检测miRNA需要逆转录和PCR两步完成,耗时且开盖容易导致气溶胶污染。CRISPR-Cas检测方法通常需要2-3步来完:先逆转录再预扩增,最后Cas酶检测;或者先预扩增后转录,最后Cas酶检测。采用两步或多步的反应体系也容易造成定量不准确,高度集成化的一锅法检测一方面可以大大减少操作步骤,简化操作流程,提高检测便捷性,有利于推向实际应用,另一方面缩短整体检测时间,避免开盖引起的气溶胶污染,有利于提高检测方法的准确性等性能优势。目前缺乏扩增和检测一体化的检测方法,尤其是尚未报道基于可编程Argonaute核酸特异性剪切酶介导的一锅法新型分子诊断及miRNA检测应用。
发明内容
发明要解决的问题
如前所述,miRNA片段短、含量少、家族成员之间碱基差异性小,导致miRNA的精准检测在实际临床中存在一定的难度和挑战,目前仍然是个技术难题。传统的PCR检测miRNA主要有两种方法:加尾法和茎环法,引物设计较为复杂且需要逆转录步骤,较难准确定量。其他等温扩增方法,如滚环扩增(RCA)和指数扩增反应(Exponential AmplificationReaction,EXPAR)技术存在非特异性扩增问题,容易出现假阳性,且灵敏度有限,较难实现在临床检测中应用。与CRIPSR结合的miRNA检测技术涉及步骤多,体系复杂,不利于实际应用;此外CRISPR技术中所运用的Cas酶具有PAM序列依赖性,普适性较差,且Cas酶非特异性剪切探针的信号放大方式导致难以在一个反应体系中实现多重检测。研究表明肿瘤的发生与多种miRNA的失调密切相关,而目前的方法基本依赖于多步法检测单一miRNA目标物,检测效率低,难以满足临床需求。因此急需开发可多重检测miRNA的方法,在方法上提高检测效率,简化检测操作流程,缩短检测时间;在临床诊断应用上,帮助获得更全面的检测信息,来提高诊断和预后的准确性和可靠性。当前缺乏一种通用的miRNA检测方法能够实现简单、快速、低成本、多重和一锅法检测。
因此,本发明的提出一种Argonaute介导的一锅法microRNA检测体系及检测方法,其基于可编程的Argonaute(Ago)特异性核酸剪切酶介导的新型分子诊断一锅法检测miRNA,利用EXPAR产生的扩增子为向导DNA(gDNA),介导Ago靶向识别并高效剪切(多周转(multi-turnover))单链荧光探针,实现在一个反应管中一步法、单碱基特异性的、高灵敏、多重miRNA的高效快速检测。该方法具备了多个检测优势,克服了当前技术所存在的问题和不足,在实际中具有广泛的应用前景。
用于解决问题的方案
本发明首次开发了一种基于Ago核酸内切酶的新型一锅法miRNA检测体系及方法,实现了单个反应体系集成扩增和检测步骤,对miRNA进行检测,同时具备了高特异性、高灵敏度、快速和多重检测的显著优点。本发明体系以一锅法为基础,整体为指数扩增反应体系(或称为EXPAR扩增体系)与microRNA检测体系(或称为Ago检测体系)的混合反应体系。
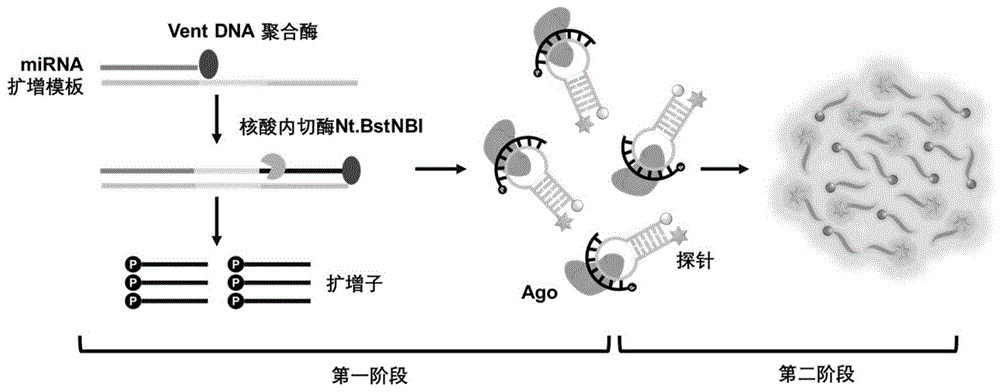
本发明提供的一锅法microRNA检测体系及方法中,首先根据miRNA序列设计EXPAR的扩增模板(template)、以及检测探针(probe)。将待测核酸样本加至EXPAR扩增体系与Ago检测体系的混合反应体系中,即一锅法检测体系中,反应条件为先50-60℃反应10-30min,再30-50℃反应10-30min。待测核酸样本中的目标物miRNA结合扩增模板,在Vent(exo-)DNA聚合酶的作用下延伸,切口酶Nt.BstNBI识别剪切位点,剪切聚合酶产生的扩增子,扩增产生的大量扩增子作为特异性gDNA触发和介导Ago特异性识别和剪切检测探针,产生荧光信号从而实现miRNA的检测。
多重检测miRNA时,将待测核酸样本加至含多个miRNA扩增模板和对应多个探针的一锅法混合体系中,在一个反应体系中同时扩增产生各自对应的扩增子,相应地,扩增子触发Ago剪切对应靶标特异性的且不同荧光标记的探针,最终通过不同的荧光信号通道检测多重miRNA。
本发明第一方面提供了一种microRNA检测方法,其包括:将待测核酸样本、指数扩增反应体系和microRNA检测体系混合,形成混合反应体系,进行反应,获得反应物中的荧光信号,实现microRNA的检测;其中,所述microRNA检测体系包括向导DNA、Argonaute核酸酶和检测探针,且所述指数扩增反应体系扩增目标物microRNA所获得的扩增产物作为所述向导DNA。
在一些实施方案中,所述Argonaute核酸酶选自来自产气荚膜梭菌(Clostridiumperfringens)的CpAgo核酸酶、来自巴特勒肠杆菌(Intestinibacter bartlettii)的IbAgo核酸酶、来自格氏嗜盐碱杆菌(Natronobacterium gregoryi)的NgAgo核酸酶中的一种或多种。
在一些优选的实施方案中,所述Argonaute核酸酶为来自产气荚膜梭菌(Clostridium perfringens)的CpAgo核酸酶。
在一些具体的实施方案中,在所述混合反应体系中,所述Argonaute核酸酶的含量为0.01-200nM。
在一些实施方案中,所述的指数扩增反应体系包括扩增模板、DNA聚合酶、切口酶、dNTP、RNase抑制剂和酶缓冲液。
在一些具体的实施方案中,所述的DNA聚合酶为Vent(exo-)DNA聚合酶或Bst DNA聚合酶。
在一些具体的实施方案中,所述的切口酶为限制性核酸内切酶或切口核酸内切酶。
在一些优选的实施方案中,所述的切口酶为限制性核酸内切酶。
在一些更具体的实施方案中,所述限制性核酸内切酶为Nt.BstNBI。
在一些实施方案中,所述的酶缓冲液包括
在一些实施方案中,所述的检测探针带有荧光基团和淬灭基团,且所述的检测探针包括与采用指数扩增反应体系扩增目标物microRNA所获得的扩增产物互补的区域。
在一些优选的实施方案中,在所述的检测探针中,所述的荧光基团和淬灭基团各自独立地位于所述的检测探针的5’端和3’端。
在一些实施方案中,所述的待测核酸样本包括来自生物样本的核酸。
在一些任选的实施方案中,所述的生物样本选自:血液、细胞、血清、唾液、体液、血浆、尿液、前列腺液、支气管灌洗液、脑脊液、胃液、胆汁、淋巴液、腹腔液、粪便或其组合。
在一些实施方案中,形成混合反应体系,进行反应的反应条件为:在50-60℃条件下,反应10-30min,之后在30-50℃条件下反应10-30min。
在一些实施方案中,在进行所述的microRNA检测方法之前还包括生物样本的预处理的步骤,其包括提取生物样本中的总microRNA。
本发明的第二方面提供了一种一锅法microRNA检测体系,其包含待测核酸样本、指数扩增反应体系和microRNA检测体系;其中,所述microRNA检测体系包括向导DNA、Argonaute核酸酶和检测探针,且所述指数扩增反应体系扩增目标物microRNA所获得的扩增产物作为所述向导DNA;所述Argonaute核酸酶选自来自产气荚膜梭菌(Clostridiumperfringens)的CpAgo核酸酶、来自巴特勒肠杆菌(Intestinibacter bartlettii)的IbAgo核酸酶、来自格氏嗜盐碱杆菌(Natronobacterium gregoryi)的NgAgo核酸酶中的一种或多种。
在一些实施方案中,所述的指数扩增反应体系包括扩增模板、DNA聚合酶、切口酶、dNTP、RNase抑制剂和酶缓冲液。
发明的效果
目前基于核酸扩增检测miRNA的方法需要逆转录、扩增、检测等步骤涉及开盖,容易导致气溶胶污染,步骤繁琐,耗时长。本发明提供的体系及方法首次建立了EXPAR扩增与Ago特异性剪切一体化的一锅法检测,结合EXPAR快速扩增和Ago特异性剪切放大检测信号的优势,实现在单个反应体系中(一个反应管)一边扩增一边剪切,不仅避免了气溶胶污染,而且充分展现了操作的便捷性和方法的高效性。该方法在检测性能方面具备以下优势:
(一)特异性高、准确性高,实现单碱基分辨率的高特异性检测;
(二)宽的检测浓度范围,高灵敏检测miRNA,最低检测限为1zM(10
(三)该方法可以一锅法同时检测多个目标物,多重检测的能力在实际应用中应用强大,不仅提高检测效率,同时为临床诊断提供全面的检测信息,提高诊断准确性;
(四)在miRNA分型分析提供了高效的工具,在医学研究、生命科学领域、临床应用等基础研究领域中具有重大意义;
(五)该方法简单、快速,不依赖于大型昂贵特殊的设备和特殊的原料,在实际应用中的可行性好,具有显著的应用前景。
附图说明
图1为本发明实施例中提供的一锅法microRNA检测体系及检测方法的原理示意图,其基于Ago一锅法检测miRNA。一锅法混合反应体系中包含miRNA扩增模板、Vent(exo-)DNA聚合酶(图中示为Vent DNA聚合酶)、切口酶(核酸内切酶Nt.BstNBI)、检测探针(图中示为探针)、Argonaute核酸酶(图中示为Ago);以及图中未示出的dNTP、Mn
图2为本发明实施例中提供的一锅法microRNA检测体系及检测方法中基于Ago一锅法进行miRNA多重检测原理示意图。
图3,其包括A和B,其中图3中的A为一锅法microRNA检测体系检测miRNA-141的相对荧光强度结果,浓度范围为0-1nM;图3中的B为对应的标准曲线。探针通道为ROX;浓度取log值作为横坐标,图中表示为Lg目标物浓度。
图4,其包括A和B,其中图4中的A为一锅法microRNA检测体系检测miRNA-21的相对荧光强度结果,浓度范围为0-1nM;图4中的B为对应的标准曲线。探针通道为FAM;浓度取log值作为横坐标,图中表示为Lg目标物浓度。
图5,其包括A和B,其中图5中的A为一锅法microRNA检测体系检测miRNA-92a的相对荧光强度结果,浓度范围为0-1nM;图5中的B为对应的标准曲线。探针通道为HEX;浓度取log值作为横坐标,图中表示为Lg目标物浓度。
图6,其包括A和B,其中图6中的A为一锅法microRNA检测体系法检测miRNA-31的相对荧光强度结果,浓度范围为0-1nM;图6中的B为对应的标准曲线。探针通道为CY3;浓度取log值作为横坐标,图中表示为Lg目标物浓度。
图7为本发明实施例中提供的一锅法microRNA检测体系及检测方法进行Ago一锅法检测miRNA-141特异性考察。其中图7中的A为实时荧光监测曲线图。图7中的B为相对荧光强度值柱状图。探针通道为ROX;浓度取log值作为横坐标,图中表示为Lg目标物浓度。
图8为考察本发明实施例中提供一锅法microRNA检测体系及检测方法进行一锅法多重miRNA检测。以miRNA-141、miRNA-21、miRNA-92a和miRNA-31为例,在一个反应体系中包含四种靶标的扩增模板和四种靶标对应的探针,同时检测其中一个、两个、三个或四个目标物。检测miRNA-141、miRNA-21、miRNA-92a和miRNA-31对应的检测探针所标记的荧光分子分别为:ROX、FAM、HEX和CY3。
具体实施方式
以下结合附图,通过实施例进一步说明本发明,但不作为对本发明的限制。以下提供了本发明实施方案中所使用的具体材料及其来源。但是,应当理解的是,这些仅仅是示例性的,并不意图限制本发明,与如下试剂和仪器的类型、型号、品质、性质或功能相同或相似的材料均可以用于实施本发明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
定义
如本说明书中所用的,除非另外明确地指出,否则术语“一个”、“一种”意指至少一个/一种。在本说明书中,除非另外明确地指出,否则单数的使用包括复数。
应理解,在本说明书中论述的温度、浓度、时间等之前存在隐含的“大约”,以便轻微的和非实质性偏差在本文中的教导的范围之内。并且,“包含”、“包括”、“有”、“具有”、“含有”、“拥有”、“带有”和“容有”的使用并非旨在是限制性的。应当理解,前面的一般性描述和详细描述都只是示例和说明性的,不是限制本发明。
如本文中所用,术语“或其组合”是指该术语之前所列项的所有排列和组合。例如,“A、B、C或其组合”旨在包括A、B、C、AB、AC、BC或ABC的至少一个,并且如果顺序在特定上下文中是重要的话,还包括BA、CA、CB、ACB、CBA、BCA、BAC或CAB。继续以该实例为例,明确地包括的是包含一个或多个条目或项的重复的组合,例如BB、AAA、AAB、BBC、AAABCCCC、CBBAAA、CABABB等。除非根据上下文是很明显地另有所指,否则本领域普通技术人员将理解通常在任何组合中对条目或项的数目没有限制。
术语“和/或”当用于连接两个或多个可选项时,应理解为意指可选项中的任一项或可选项中的任意两项或多项。
如本文使用的,术语“核酸”意指核苷酸单体的单链聚合物和双链聚合物,包括通过核苷酸间磷酸二酯键键合或核苷酸间类似物连接的2’-脱氧核糖核苷酸(DNA)和核糖核苷酸(RNA),以及缔合的抗衡离子,例如H
根据本领域习惯用语,核酸的长度可表示为碱基、碱基对(缩写“bp”)、核苷酸/核苷酸残基(缩写为“nt”)或千碱基(“kb”)。在上下文允许的情况下,术语“碱基”、“核苷酸”、“核苷酸残基”可以描述单链或双链的多核苷酸。当该术语应用于双链分子时,其用于指整个长度,并且应理解为相当于术语“碱基对”。
术语“碱基”,是指嘌呤和嘧啶的衍生物,是核酸、核苷、核苷酸的成分。碱基共有5种:胞嘧啶(缩写作C)、鸟嘌呤(G)、腺嘌呤(A)、胸腺嘧啶(T,DNA专有)和尿嘧啶(U,RNA专有)。
术语“microRNA”、“miRNA”和“miR”是同义的,并且指的是调控基因表达的约18-28个核苷酸长度的非编码单链RNA分子的集合。在广泛范围的生物体中发现了miRNA,并且已表明miRNA在发育、体内平衡和疾病病因学中发挥作用。
如本文所用的,术语“探针”通常是指标记有标记物(例如,荧光标记物、荧光基团)的核苷酸或多核苷酸,标记物可用于在杂交反应中通过与相应的靶序列杂交来检测或鉴定其相应的靶核苷酸或多核苷酸。
术语“标记”,是指任何可用于提供可检测(优选地为可定量的)信号的原子或分子,可与核酸或蛋白质通过共价键或非共价相互作用(例如,通过离子或氢键、或通过固定化、吸附等)连接。标记通常通过荧光、化学发光、放射性、比色法、质谱、X射线衍射或吸收、磁力、酶活性等提供所检测的信号。标记的实施例包括荧光团、发色团、放射性原子(特别是32p和125I)、电子致密试剂、酶和具有特定结合物的配体。
如本文使用的,术语“dNTP”指的是脱氧核苷三磷酸。NTP指的是核糖核苷三磷酸。嘌呤碱基(Pu)包括腺嘌呤(A)、鸟嘌呤(G)及其衍生物和类似物。嘧啶碱基(Py)包括胞嘧啶(C)、胸腺嘧啶(T)、尿嘧啶(U)及其衍生物和类似物。
如在本文中可互换使用的,术语“互补”、“互补序列”、“互补的”和“互补性”通常是指与给定序列完全互补且可杂交的序列。与给定核酸杂交的序列称为给定分子的“互补序列”或“反向互补序列”,前提是其在给定区域上的碱基序列能够与其结合伴侣的碱基序列互补地结合,使得例如形成A-T、A-U、G-C和G-U碱基对。
如本文中所用,术语“扩增”、“核酸扩增”或“扩增的”是指多个拷贝的核酸模板的产生,或多个与核酸模板互补的核酸序列拷贝的产生。术语(包括术语“聚合”)还可指延伸核酸模板(例如,通过聚合)。扩增反应可以是聚合酶介导的延伸反应例如,聚合酶链式反应(PCR)。然而,任何已知的扩增反应可适合于本文中描述的用途。
如本文中所用,术语“扩增子”和“扩增产物”通常是指扩增反应的产物。扩增子可以是双链或单链的,并且可包括通过使双链扩增产物变性获得的分开的组成链。在某些实施方案中,一个扩增循环的扩增子可在随后的扩增循环中用作模板。
术语“指数扩增反应”或“EXPAR”是一种在恒温条件下,对短链核酸序列以高效率呈指数级扩增的技术方法,该方法利用线性扩增生成寡核苷酸产物作为新的引物结合到含有两段重复序列的模板上,切口酶进行酶切后,又生成同样序列的寡核苷酸产物,造成了链式反应,则寡核苷酸产物成指数级增长。
如本文所用的,术语“聚合酶”通常是指能够催化聚合反应的酶(例如,天然的或合成的)。聚合酶的实例可包括核酸聚合酶(例如,DNA聚合酶或RNA聚合酶)、转录酶和连接酶(liage)。聚合酶可以是聚合反应酶(polymerization enzyme)。术语“DNA聚合酶”通常是指能够催化DNA的聚合反应的酶。
如本文所用的,术语“切口酶”通常是指切割双链核酸分子(即,对双链分子“切口”)的一条链的分子(例如,酶)。切口酶可以是仅切割单条DNA链的核酸酶,这是由于其天然功能或因为它已经被工程化(例如,通过突变和/或删除一个或多个核苷酸进行修饰)以仅切割单条DNA链。切口酶可以是产生切口的酶(例如,限制性核酸内切酶、切口核酸内切酶等)。切口酶可结合至双链核酸分子的切口位点,以在双链核酸分子的一条链中产生切口(或缺口)。切口可以在切口位点内产生。备选地,可以在切口位点附近产生切口。
如前所述,当前miRNA检测方法的灵敏度、特异性、高效性、普适性等各方面性能存在不足,难以真正应用于临床检测,为了克服这些问题和实现miRNA的精准检测,提出基于可编程Argonaute(Ago)特异性核酸剪切酶介导的新型分子诊断一锅法检测miRNA,利用EXPAR产生的扩增子为向导DNA(gDNA),介导Ago靶向识别并高效剪切(多周转(multi-turnover))单链荧光探针,通过一步法即在一个反应管中边扩增边剪切产生信号,极大简化了实验步骤,避免了气溶胶污染,提高了检测效率,加快了检测速度,为实际应用提供了强有力的新方法。此外Ago酶具有单碱基分辨率的特异性和剪切高效性,能够实现高特异性、高灵敏的miRNA检测。CRISPR需要借助多重具备不同单链核酸偏好性的cas核酸内切酶来实现多重检测,检测目标物越多反应体系越复杂,影响检测效率且容易产生强的背景信号,而目前Cas酶不仅种类有限且有序列依赖性,难以实现多重miRNA检测。相比之下,Ago核酸内切酶介导的检测体系,仅需要单个Ago酶就能实现多重检测,对任意目标物都适用,可任意编程,普适性广。
具体地,本发明提供了一种高特异性、高灵敏度、一锅法多重检测miRNA的方法。本发明实现EXPAR预扩增和Ago剪切放大信号一体化检测。检测样本可以为不同来源的生物样本,例如组织、血清进行核酸提取,获得低丰度核酸样本后,将核酸提取样本加至一锅法检测体系中,EXPAR产生的扩增子作为gDNA,触发和介导Ago剪切检测探针,从而产生检测信号。检测信号可以通过实时监测和终端检测方式,包括实时荧光PCR仪、各种荧光测定仪、侧向流免疫层析试纸条、肉眼观察法等。本发明具有简单、快速、低成本等优势,30min左右得到检测结果,灵敏度达到zM,能够很好地用于临床miRNA的检测。本发明可广泛应用于疾病诊断、临床研究、生命科学研究,例如肿瘤液体活检或者癌症早筛。
本发明的核心在于将EXPAR扩增与Ago剪切结合到一锅法中,利用EXPAR扩增miRNA所产生的大量扩增子介导Ago剪切靶标特异性探针,实现了一锅法多重miRNA。原理如图1,细节如下:每一种miRNA结合一条特异设计且互补配对的扩增模板,在Vent DNA聚合酶的作用下,进行链的延伸,产生与模板互补的核酸链,切口酶Nt.BstNBI识别特异性位点并剪切扩增链,剪切下来的核酸链进一步结合扩增模板进行扩增剪切,如此循环反复,产生大量5’磷酸化的单链DNA(16碱基左右,扩增子)。生成的核酸特异扩增子进一步作为gDNA介导Ago识别并特异性剪切检测探针,产生荧光信号。多重检测如图2,EXPAR体系加入待检测样本,对应的多重靶标的扩增模板和探针,产生的扩增子介导Ago通过碱基互补配对特异性结合相应的探针,通过检测不同荧光信号实现一锅法多重检测。
以下对本发明的技术方案进行详细说明。
在本发明的一些方面,提供了一种microRNA检测方法,其包括:将待测核酸样本、指数扩增反应体系和microRNA检测体系混合,形成混合反应体系,进行反应,获得反应物中的荧光信号,实现microRNA的检测。
在本发明的另一些方面,提供了一种一锅法microRNA检测体系,其包含上述的microRNA检测方法中的待测核酸样本、指数扩增反应体系和microRNA检测体系。
microRNA检测体系
在本发明中,microRNA检测体系包括Argonaute核酸酶和检测探针。在一些具体的实施方案中,microRNA检测体系还包括向导DNA,所述向导DNA为混合反应体系中指数扩增反应体系扩增目标物microRNA所获得的扩增产物。由于本发明提供的一锅法microRNA检测体系及microRNA检测方法创造性的采用了“一锅法”的方案,即无需二次添加试剂,反应前将全部试剂加入,因此,本发明提供的一锅法microRNA检测体系及microRNA检测方法的反应过程中,由指数扩增反应体系扩增目标物microRNA所获得的扩增产物可以直接作为向导DNA供microRNA检测体系使用进行microRNA检测的反应。
在一些具体的实施方案中,所述Argonaute核酸酶选自来自产气荚膜梭菌(Clostridium perfringens)的CpAgo核酸酶、来自巴特勒肠杆菌(Intestinibacterbartlettii)的IbAgo核酸酶、来自格氏嗜盐碱杆菌(Natronobacterium gregoryi)的NgAgo核酸酶的一种或多种。在一些优选的实施方案中,所述Argonaute核酸酶为来自产气荚膜梭菌(Clostridium perfringens)的CpAgo核酸酶。
上述Argonaute核酸酶、尤其是CpAgo核酸酶的使用,使得在混合反应体系中的microRNA检测体系与指数扩增反应体系的反应温度及反应/酶缓冲液相互兼容,达到一次混合反应原料,即可实现扩增、检测两种反应(即,一锅法),简化操作流程。并且,在一锅法的反应体系中,指数扩增反应体系扩增目标物microRNA所获得的扩增产物直接作为Argonaute核酸酶的向导DNA,也避免了进行指数扩增反应后,再将产物加入microRNA检测体系中容易产生气溶胶污染的问题。由于反应/酶缓冲液的兼容,使得无需将指数扩增反应产物二次添加至microRNA检测体系中,从而使全部反应产物均可用于检测反应,从而具有更高的灵敏度,并且上述核酸酶在上述混合反应体系下具有较高的活性。
在一些更具体的实施方案中,在混合反应体系中,Argonaute核酸酶的含量为0.01-200nM;更优选地,Argonaute核酸酶的浓度为10-190nM、20-180nM、30-170nM、40-160nM、50-150nM、60-140nM、70-130nM、80-120nM、90-110nM或90-100nM;最优选地,Argonaute核酸酶的浓度为100nM。
在一些实施方案中,所述的检测探针带有荧光基团和淬灭基团,且所述的检测探针包括与采用指数扩增反应体系扩增目标物microRNA所获得的扩增产物互补的区域。
在一些更具体的实施方案中,在所述的检测探针中,所述的荧光基团和淬灭基团各自独立地位于所述的检测探针的5’端和3’端。
在一些更具体的实施方案中,所述的检测探针为发夹型结构或者直链结构。在一些优选的实施方案中,所述的检测探针为发夹型结构,所述的检测探针5’端的茎部具有荧光基团,所述的检测探针3’端的茎部具有淬灭基团,所述的检测探针环部为与采用指数扩增反应体系扩增目标物miRNA所获得的扩增产物互补的区域。
在一些更具体的实施方案中,所述荧光基团选自FAM、HEX、CY5、CY3、VIC、JOE、TET、5-TAMRA、ROX、Texas Red-X或其组合;所述淬灭基团选自BHQ1、BHQ2、TAMRA、DABCYL、DDQ或其组合。
在一些更具体的实施方案中,在混合反应体系中,每种检测探针的含量为0.05~0.5μM,优选地,0.05~0.4μM、0.05~0.3μM、0.05~0.2μM、0.05~0.1μM、0.07~0.1μM、0.09~0.1μM。
在一些具体的实施方案中,所述microRNA检测体系还包括二价金属离子。
在一些更具体的实施方案中,所述的二价金属离子选自Mn
在microRNA检测体系中不需要额外添加针对Argonaute核酸酶的反应缓冲液。由于本发明所选择Argonaute核酸酶以及所构建的混合反应体系,Argonaute核酸酶与DNA聚合酶、切口酶反应/酶缓冲液相互适配,节省实验原料的同时,保留或提高了各种酶的活性,且相互间不存在影响。
在一些具体的实施方案中,所述的目标物miRNA为一种miRNA或者至少两种miRNA。当所述的目标物miRNA为至少两种miRNA时,相应地,所述的扩增模板为针对至少两种miRNA分别设计的扩增模板;所述的检测探针为针对至少两种miRNA分别设计的检测探针,且不同的检测探针具有不同的荧光基团。
指数扩增反应体系
指数扩增反应体系为microRNA检测体系中的Argonaute核酸酶提供向导DNA。在一些实施方案中,所述的指数扩增反应体系包括扩增模板、DNA聚合酶、切口酶、dNTP、RNase抑制剂和酶缓冲液。
在一些更具体的实施方案中,所述的扩增模板为根据目标物miRNA的序列设计的扩增模板。扩增模板包括3’端序列、5’端序列,以及3’端序列和5’端序列之间的切口酶识别序列,3’端序列和5’端序列的长度相同,均为15-20个核苷酸。在一些优选的实施方案中,所述的扩增模板的3’端还具有一个腺嘌呤碱基。
在本发明的一些实施方案中,所述3’端序列和5’端序列相同,均与目标物miRNA互补配对。由于miRNA长度通常为18-28个核苷酸,而本发明中3’端序列和5’端序列的长度为15-20个核苷酸,因此,在本发明的一些实施方案中,可以基于miRNA中的一段长度为15-20个核苷酸的连续序列进行扩增模板设计。在另一些实施方案中,可以基于miRNA的全长序列进行扩增模板设计。
在本发明的一些实施方案中,所述3’端序列的3’端的第一个碱基与目标物miRNA存在一个碱基错配,以使指数扩增反应体系的扩增子5’端的第一个碱基为胸腺嘧啶。
在一些更具体的实施方案中,在混合反应体系中,每种扩增模板的含量为0.05~0.5μM,优选地,0.05~0.4μM、0.05~0.3μM、0.05~0.2μM、0.05~0.1μM、0.07~0.1μM、0.09~0.1μM;示例性的,0.1μM。
在一些具体的实施方案中,所述的DNA聚合酶为Vent(exo-)DNA聚合酶或Bst DNA聚合酶。在一些更具体的实施方案中,在混合反应体系中,DNA聚合酶的含量为0.01~0.1UμL
在一些具体的实施方案中,所述的切口酶为(限制性)核酸内切酶或切口核酸内切酶;优选的,所述的切口酶为限制性核酸内切酶,更优选的,所述限制性核酸内切酶为Nt.BstNBI。在一些更具体的实施方案中,在混合反应体系中,切口酶的含量为0.1~1UμL
在一些优选的实施方案中,所述的DNA聚合酶为Vent(exo-)DNA聚合酶,所述的核酸内切酶为Nt.BstNBI;在这些优选的实施方案中,酶缓冲液可以是
在一些具体的实施方案中,在混合反应体系中,dNTP的含量为100~500μM,优选地,100~400μM、100~300μM、200~300μM;示例性的,200μM、250μM、300μM。在一些具体的实施方案中,在混合反应体系中,RNase抑制剂的含量为0.1~1.5UμL
反应条件
在本发明的一锅法microRNA检测体系及microRNA检测方法中,形成混合反应体系,进行反应的反应条件为:在50-60℃条件下,反应10-30min,之后在30-50℃条件下反应10-30min。
在一些优选的实施方案中,形成混合反应体系,进行反应的反应条件为:在50~57℃条件下,反应15~25min,之后在30~45℃条件下,反应10~20min;进一步优选地,在53~57℃条件下,反应15~25min,之后在35~45℃条件下,反应10~20min。
在一些更优选的实施方案中,形成混合反应体系,进行反应的反应条件为:在55℃条件下,反应20min,之后在37℃条件下,反应10min。
待测核酸样本
在本发明的一锅法microRNA检测体系及microRNA检测方法中,所述的待测核酸样本包括来自生物样本的核酸,所述的生物样本选自:血液、细胞、血清、唾液、体液、血浆、尿液、前列腺液、支气管灌洗液、脑脊液、胃液、胆汁、淋巴液、腹腔液、粪便等或其组合。
其他步骤
在一些具体的实施方案中,在进行本发明的microRNA检测方法之前还包括生物样本的预处理的步骤,其包括提取生物样本中的总microRNA。例如,可以使用市售的试剂盒提取生物样本中的总microRNA。
适用的microRNA检测
在一些具体的实施方案中,一锅法microRNA检测体系及microRNA检测方法可以用于单miRNA检测、多重miRNA检测或miRNA分型分析。
在一些更具体的实施方案中,当一锅法microRNA检测体系及microRNA检测方法用于多重miRNA检测或miRNA分型分析时,不同检测探针所具有的荧光基团不同。
例如,在进行多重miRNA检测时,将待测核酸样本混合至含多种用于目标物miRNA扩增的扩增模板的混合反应体系中,同时扩增多种目标物miRNA。同时,在混合反应体系中,扩增产物触发Argonaute核酸酶剪切,此时混合反应体系中混合有多种目标物miRNA特异性的、且具有不同荧光基团的检测探针,通过不同的荧光信号检测多重miRNA。再如,在进行miRNA分型分析时,在含有多种扩增模板的混合反应体系中针对包含核酸的待测核酸样本进行预扩增,扩增产物与相应地检测探针100%互补配对结合后,触发和启动混合反应体系中Argonaute核酸酶剪切检测探针,最后通过产生的荧光信号可进行miRNA分型分析。
实施例
实施例一、扩增模板和检测探针设计
1、EXPAR扩增模板设计参照文献(Angewandte Chemie International Edition,2010,49(32):5498-5501.),简要原则如下:
1)模板3’端第一个碱基为固定的A碱基且磷酸化修饰;
2)模板两端重复序列与目标物miRNA互补配对,长度为15-20个核苷酸;
3)模板中间ACTCAGACAA(SEQ ID NO:1)为固定序列,连接两端的重复序列,该序列为EXPAR反应中的切口内切酶(nicking endonuclease)Nt.BstNBI核酸剪切酶的识别序列;
4)产生的扩增子与模板重复序列互补配对。
通用模板序列为(以模板两端的重复序列均为17个核苷酸为例):3’-P-ANNNNNNNNNNNNNNNNNACTCAGACAANNNNNNNNNNNNNNNNN-5’(其中,P代表磷酸化)。
2、检测探针设计遵循原则:检测探针可为发夹型或者直链型的单链DNA序列,优选的使用发夹型探针。探针茎部5’端修饰信号分子,例如FAM、HEX、ROX、Cy5等信号基团,探针茎部3’端修饰淬灭基团,如BHQ1、BHQ2等。探针环部序列被设计为与目标物扩增子特异性互补配对,当探针环部与目标物扩增子100%互补配对时,启动Ago剪切探针,释放产生荧光信号。
本发明选择了四种miRNA作为目标物进行检测,分别是miRNA-21、miRNA-92a,、miRNA-31和miRNA-141,设计的对应EXPAR扩增模板以及对应的检测探针(如表1所示)。
表1:miRNA序列、EXPAR扩增模板、以及miRNA检测探针。
其中,表1中所示序列中的P代表磷酸化。
实施例二、microRNA检测方法中基于Ago的一锅法检测体系
本实施例主要建立microRNA检测方法中基于Ago的一锅法miRNA检测体系,即指数扩增反应体系与microRNA检测体系的混合反应体系。体系总体积可以是10或者20μL,具体包含切口酶Nt.BstNBI、Vent(exo-)DNA聚合酶、扩增模板、dNTP、RNase抑制剂,1×
体系中各成分的浓度为:每种检测探针(0.1μM)、每种扩增模板(0.1μM)、dNTP(250μM)、切口酶Nt.BstNBI(0.4UμL
反应条件分为两个阶段,第一阶段预扩增反应,温度范围在50-60℃,优选的为55℃。预扩增反应时间10-30min,优选的为20min。第二阶段剪切产生信号反应温度范围在30-50℃,优选的为37℃,反应时间10-30min,优选的为10min。单个miRNA检测只需加单个相对应的扩增模板和探针,多个miRNA检测加相对应的多个扩增模板和多个靶标特异性探针。反应于PCR仪中进行,采集实时荧光信号。
所用试剂和核酸序列来源如下表2所示。
表2:实施例中所使用试剂信息
实施例3、microRNA检测方法中基于Ago的一锅法体系检测miRNA灵敏度
本实施例探究了microRNA检测方法中基于Ago的一锅法体系检测miRNA灵敏度。分别以miRNA-141、miRNA-21、miRNA-92a、miRNA-31为例,配制一系列浓度的miRNA(0、10zM、100zM、1aM、10aM、100aM、1fM、10fM、100fM、1pM、10pM、100pM、1nM、10nM)作为待测核酸样本。一锅法体系总体积选择10μL,包含前述配置的1μL的待测核酸样本,切口酶Nt.BstNBI(0.4UμL
反应条件分为两个阶段,第一阶段预扩增反应温度为55℃,预扩增反应时间为20min。第二阶段剪切产生信号反应温度为37℃,反应时间10min。反应于PCR仪中进行,对应探针的荧光通道采集实时荧光信号。终点荧光信号与起始信号差值作为相对强度值,用于定量分析。针对miRNA-141的检测结果如图3中的A所示,拟合线性关系如图3中的B所示,其检测灵敏度达到1zM。同理,针对miRNA-21、miRNA-92a、miRNA-31的检测结果分别如图4中的A、图5中的A、图6中的A所示,拟合线性关系分别如图4中的B、图5中的B、图6中的B所示,其检测灵敏度均达到1zM。说明该方法具有高的灵敏度和普适性。
实施例4、microRNA检测方法中基于Ago的一锅法体系检测特异性考察
本实施例探究了microRNA检测方法中基于Ago的一锅法体系检测的特异性。以miRNA-141为检测目标物,其他miRNA作为干扰物对照,包括miRNA-21、miRNA-92a、miRNA-31、miRNA-125b、miRNA-30a,miRNA-375、miRNA-100、let 7a、let 7b、let 7c、let 7i和水(空白对照)。所有miRNA浓度均为1pM.
一锅法体系总体积选择10μL,包含切口酶Nt.BstNBI(0.4UμL
反应分为两个阶段进行,第一阶段预扩增反应温度为55℃,预扩增反应时间为20min。第二阶段剪切产生信号反应温度为37℃,反应时间30min。反应于PCR仪中进行,采集实时荧光信号。反应进行到30min时的荧光信号与起始信号差值作为相对强度值,用于考察特异性分析。针对miRNA-141的特异性实时荧光结果如图7中的A所示,当体系中存在目标物miRNA-141时,荧光信号在第二阶段开始显著增强,并且快速达到最大值进入平台期。而体系中加入其他miRNA时,在第二阶段产生极其微弱的荧光信号。进一步得到相对荧光强度值,如图7中的B所示,目标物miRNA-141引起强烈的信号增强,而其他miRNA的信号变化可忽略不计,说明本发明提供的microRNA检测方法中Ago核酸酶的检测体系具有极高的特异性,在实际检测应用中将发挥重大作用,可用于miRNA精准检测。
实施例5、microRNA检测方法中基于Ago的一锅法体系检测多重miRNA
本实施例探究了microRNA检测方法中Ago体系检测多重miRNA的能力。以miRNA-141、miRNA-21、miRNA-92a、miRNA-31四种靶标为例,所有miRNA(作为待测核酸样本)浓度均为1pM。一锅法体系总体积选择10μL,包含切口酶Nt.BstNBI(0.4UμL
反应分为两个阶段进行,第一阶段预扩增反应温度为55℃.预扩增反应时间为20min。第二阶段剪切产生信号反应温度为37℃,反应时间10min。反应于PCR仪中进行,采集实时荧光信号。PCR仪读取反应前后的荧光强度值用于定性定量检测。其中FAM信号代表miRNA-21,HEX信号代表miRNA-92a,CY3信号代表miRNA-31,ROX信号代表miRNA-141。Ago一锅法多重检测miRNA的结果如图8所示,该体系可通过不同荧光通道,可检测四种靶标中的某一种miRNA,同时检测其中两种、三种或者四种靶标,无明显干扰,且整个反应时间只需30min,反应操作简便,在临床诊断、预后以及病人耐药性等监测方面具备极大的应用前景。
综上实施例所验证,本发明的方法的优势和特点如下:
1)Ago无序列依赖性,可编程靶向任意核酸,普适性强;
2)Ago具备单碱基特异性识别能力,检测特异性极强,避免假阳性信号,尤其针对相似度高的miRNA非常有优势;
3)Ago是一种多周转(multi-turnover)核酸剪切酶,剪切效率高,反应快,极大地缩短了反应时间;
4)该方法集EXPAR扩增与Ago剪切为一体化,简化整个反应流程为一锅一步法检测,避免了气溶胶污染,简单便捷,有利于实际应用推广;
5)该方法进一步实现了一锅法高效快速精准检测多重miRNA,不仅在临床诊断方面有重大价值,也为miRNA表达谱分析提供了有力工具,能够服务于miRNA相关的各类研究。
- 二氧化锰纳米片介导的比率荧光生物传感器用于细胞内microRNA的检测与成像
- 一种水稻黄单胞菌的环介导等温扩增检测引物组、检测方法和检测试剂盒
- 基于指数扩增反应和Argonaute核酸酶的microRNA检测体系及方法
- 一种基于连接环介导等温扩增法快速检测肿瘤相关microRNA的方法
