芹菜素6位羟化酶蛋白及其编码基因与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,特别地涉及芹菜素6位羟化酶蛋白及其编码基因与应用。
背景技术
野黄芩素(Scutellarein)化学名为5,6,7-三羟基-2-(4-羟基苯基)色烯-4-酮(5,6,7-trihydroxy-2-(4-hydroxyphenyl)chromen-4-one)。分子式为C15H10O6,溶于DMSO等。野黄芩素是从黄芩中分离得到的一种化合物,是黄芩属植物的主要有效成分之一,来源广泛。同时,野黄芩素也是许多植物体内合成主要黄酮药效成分的重要中间产物,通过修饰可获得稀有的天然化合物,如能诱导人白血病细胞死亡的栀子黄素B、具有神经保护作用、抗肿瘤、细胞毒和免疫调节作用的鼠尾草素、人羧基酯酶1(hCE1)的选择性抑制剂并且临床用于结核辅助治疗的石吊兰素等。药理实验研究表明,野黄芩素具有保肝、抗肿瘤、抗菌和抗病毒、抗氧化活性和对神经退行性疾病的有效活性的作用,其对人白血病细胞有细胞毒活性、对17β-HSD和人唾液α-淀粉酶有抑制活性,同时它是tromboxane A2受体的拮抗剂,作为参与血栓性疾病的新药的配方之一。最新药理研究表明,野黄芩素可以抑制SARS冠状病毒解旋酶,并且已被用于中医治疗COVID-19等炎症性疾病。基于野黄芩素的良好生物活性和临床需求,探索野黄芩素的高效率合成方式并扩大应用范围是一项重要的研究工作。
通过结构修饰合成野黄芩素,国内外已有许多研究报道。目前野黄芩素的结构修饰主要可行途径为化学合成方法和生物合成方法。Cui等以2-乙酰基-3,4,5-三甲氧基苯酚为原料,首次提出三步反应合成野黄芩素。随后,Righi等优化野黄芩素化学合成路线,以柚皮素为原料,反应得到野黄芩素(总产率62%)及其甲基化衍生物。刘志辉等通过微生物发酵法转化野黄芩苷,从28种菌株中筛选出对野黄芩苷转化能力较强的黑曲霉,再从发酵液中分离得到了野黄芩素。居文政等研究了野黄芩苷在盐酸、β-葡糖醛酸苷酶和肠内菌群中的转化,发现其均能转化为苷元形式。应用化学方法进行结构修饰存在选择性不强,副产物多,后期分离困难,设备投资大,技术要求高,大量使用有机溶剂,存在环境污染的隐患。利用水解转换法和微生物转换法来获得野黄芩素的报道同样存在选择性不强,技术要求高等问题。
发明内容
虽然现在已有野黄芩素生物或化学合成的报道,但这些方法存在环境非友好型、目标产物多样性、制备条件高等问题。本发明主要是基于吊石苣苔三代全长转录组,获得芹菜素6位羟基转移酶序列,并通过真核表达重组蛋白,确认LpCYP82D-8可以催化野黄芩素的产生。
本发明的技术方案如下:
本发明提供了一种蛋白,是如下a)或b)的蛋白质:
a)由序列表中序列2所示的氨基酸序列组成的蛋白质;
b)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有芹菜素6位羟化酶活性的由a)衍生的蛋白质。
所述芹菜素6位羟化酶活性是催化芹菜素A环6位的羟基化生成野黄芩素。
所述蛋白的编码基因也属于本发明的保护范围。
所述编码基因为如下1)或2)或3)所示:
1)其核苷酸序列是序列表中序列1所示DNA分子;
2)在严格条件下与1)限定的DNA分子杂交的DNA分子;
3)与1)或2)限定的DNA分子具有90%以上的同源性的DNA分子。
将该基因命名为LpCYP82D-8,将其编码的蛋白命名为LpCYP82D-8。具体信息如下:LpCYP82D-8基因序列如序列表中序列1所示,其含有1578个核苷酸,其编码序列表中序列2所示的蛋白,序列2由525个氨基酸组成。
含有所述编码基因的表达盒、重组表达载体、转基因细胞系或重组微生物也属于本发明的保护范围。
所述蛋白在作为芹菜素6位羟化酶中的应用也属于本发明的保护范围。
所述芹菜素6位羟化酶是催化芹菜素A环6位的羟基化生成野黄芩素的酶。
所述蛋白、所述编码基因在催化芹菜素转化生成野黄芩素中应用也属于本发明的保护范围。
本发明基于吊石苣苔(Lysionotus pauciflorus)三代和二代转录组数据,用反向遗传学的方法找到并鉴定野黄芩素合成的特异羟基化修饰酶LpCYP82D-8,为生物合成野黄芩素提供了芹菜素6位羟化酶蛋白及其编码序列和实验基础。
附图说明
为了说明而非限制的目的,现在将根据本发明的优选实施例、特别是参考附图来描述本发明,其中:
图1为吊石苣苔各组织中LpCYP82D-8表达水平。
图2为pESC-His-LpCYPs载体转化WAT11的验证结果。
图3为LpCYP82D-8对芹菜素催化活性鉴定UPLC图。
图4为LpCYP82D-8对芹菜素催化产物MS鉴定图。
图5为芹菜素(左)和野黄芩素(右)分子结构式
图6为LpCYP82D-8和SbCYP82D1.1芹菜素转化率图。
具体实施方式
实施例1、芹菜素6位羟化酶蛋白及其编码基因与应用
一、
吊石苣苔(Lysionotus pauciflorus)(记载过吊石苣苔(Lysionotuspauciflorus)的非专利文献是:黄梅,李美君,黄红,等.贵州省野生苦苣苔科物种多样性与地理分布[J].广西植物,2022,42(2):210-219.DOI:10.11931/guihaia.gxzw202008055.)样品植株采自中国贵州省安龙县仙鹤坪镇,根、茎、叶、花4个组织样品快速存于-80℃用于多组学等实验。基于吊石苣苔三代全长转录组,结合CYP450保守结构域和Nelson分类原则,获得175个278aa-570aa A类型的LpCYP450s序列,通过二代+三代转录组和广靶代谢组联合分析,着重关注LpCYP82D-8。
合成连接在酵母表达载体pESC-His载体(由Gao提供,记载过酵母表达载体pESC-His载体的非专利文献是:Gao R,Lou Q,Hao L,Qi G,Tian Y,Pu X,He C,Wang Y,Xu W,XuZ,Song J.Comparative genomics reveal the convergent evolution of CYP82D andCYP706X members related to flavone biosynthesis in Lamiaceae andAsteraceae.Plant J.2022Mar;109(5):1305-1318.doi:10.1111/tpj.15634.Epub2021Dec 27.PMID:34907610.)上的LpCYP82D-8基因,连接位点为BamHI-F和SalI-R。连接体系直接转化TransT1感受态(购自北京全式金生物技术有限公司,产品目录号为CB101-01),挑选阳性克隆测序(菌落PCR体系总体积为20μL:13μL Mix Buffer,1μL模板,1μL引物和5μL水,程序如表1,菌落PCR所用引物序列如表2),与transcript序列比对,核苷酸序列与原数据100%相似度。以报道的SbCYP82D1.1(F6H)(Gao R,Lou Q,Hao L,Qi G,Tian Y,Pu X,HeC,Wang Y,Xu W,Xu Z,Song J.Comparative genomics reveal the convergentevolution of CYP82Dand CYP706X members related to flavone biosynthesis inLamiaceae and Asteraceae.Plant J.2022Mar;109(5):1305-1318.doi:10.1111/tpj.15634.Epub 2021Dec 27.PMID:34907610.)作为阳性对照,核苷酸序列与阳性对照序列相似度50.91%。
表1菌落PCR反应程序
表2菌落PCR所用引物序列
利用qRT-PCR检测LpCYP82D-8在组织中真实表达水平,设计150bp左右的LpCYP82D-8特异条带的引物,如表3,以Lp-Actin为看家基因,qPCR程序如表4。在贵州省安龙县仙鹤坪收集吊石苣苔(Lysionotus pauciflorus)的根、茎、叶和花,提取RNA,将浓度调整一致后反转录为cDNA,用于qPCR模板。最终获得LpCYP82D-8在吊石苣苔四个组织中的表达水平,如图1。LpCYP82D-8在花中表达量显著高于根、茎、叶,转录组表达量趋势与qPCR表达量趋势一致。
表3 qRT-PCR所用引物序列
表4 qRT-PCR反应程序
二、获得基因序列以及其编码的蛋白序列
获得的LpCYP82D-8基因含有1578个核苷酸,如序列表中序列1所示;其编码525个氨基酸的蛋白,如序列表中序列2所示,将其编码的蛋白命名为LpCYP82D-8。
三、基因功能验证
我们借助真核系统对基因功能进行验证,前文已构建pESC-His-LpCYPs载体,测序确认序列正确后,将载体成功转入真核表达菌株WAT11(由Gao提供,记载过真核表达菌株WAT11的非专利文献是:Gao R,Lou Q,Hao L,Qi G,Tian Y,Pu X,He C,Wang Y,Xu W,Xu Z,Song J.Comparative genomics reveal the convergent evolution of CYP82D andCYP706X members related to flavone biosynthesis in Lamiaceae andAsteraceae.Plant J.2022Mar;109(5):1305-1318.doi:10.1111/tpj.15634.Epub2021Dec 27.PMID:34907610.)进行酵母体内验证。具体转化方法如下:
1)酵母感受态制备
取数个YPAD培养基上生长状态良好的酵母菌落于5mL YPAD液体培养基中,30℃振荡过夜培养。取1mL酵母菌液加入50mL YPAD培养基中,继续培养直到其OD
3000g离心5分钟收集酵母细胞,加入无菌蒸馏水20mL清洗,室温3000g再次离心5分钟,弃上清。加入1mL无菌的浓度为0.1mol/L LiCl溶液重悬细胞,转入1.5mL离心管,12000rpm,离心15秒,去上清。用0.5-1mL 0.1mol/LLiCl重悬细胞,30℃,200rpm振荡摇菌30分钟后,每个转化样品取5μL鲑鱼精DNA(1μg/μL),94℃热变性5分钟,然后迅速放于冰上冷却2分钟。
2)LiCl法酵母转化
分装酵母感受态细胞100μL/管,加入5μL(约1μg)质粒和5μL热变性的鲑鱼精DNA,混匀。然后加入600μL的PEG和LiCl混合溶液(终浓度为40%PEG和0.1mol/L的LiCl),涡旋混匀。30℃水浴热激30分钟(每隔5分钟轻弹混匀)后,42℃水浴15分钟。12000rpm转速离心15秒,去上清。加入1mL无菌蒸馏水,涡旋混匀,12000rpm,离心15秒,去上清。加入1mL无菌蒸馏水悬浮细胞,均匀涂于酵母营养缺陷(-His)平板上。
平板静置于30℃培养2-3天,挑选单克隆进行PCR验证(如图2)。挑选3个LpCYP82D-8-pESC-His单克隆,在1500bp处均有阳性条带。
重组蛋白的诱导、酶活分析和产物鉴定如下:
1)重组蛋白的诱导
分别挑取LpCYP82D-8-pESC-His与pESC-His单克隆菌落于2mL SD-His液体培养基中30℃中振荡(200rpm)培养2-3天。
取0.1mL培养的菌液加入20mL新鲜的SD-His培养液(含2%葡萄糖)中,30℃摇床(200rpm)培养2-3天后,将菌液转移到50mL无菌离心管中,1000g离心10min,收集菌沉淀,去上清。用20mL无菌去离子水重悬菌沉淀,1000g离心5min,收集菌沉淀,去上清,重复2-3次。
加入50mL SG-His液体培养基(含2%半乳糖)重悬菌体至600nm的OD值为1.0,置于新三角瓶中,取1mL菌液到15mL无菌离心管中,加入终浓度为100μM的芹菜素(如表5),30℃摇床(200rpm)诱导和反应16h。
2)酶活性的测定
取500μL反应菌液进行酶活检测。用三倍体积乙酸乙酯终止反应,13,000rpm离心5min,取上清,45℃低压浓缩1h,加入200μL甲醇复溶。取2μL上样。
表5重组蛋白酵母体内酶活反应体系
3)酶活产物分析与鉴定
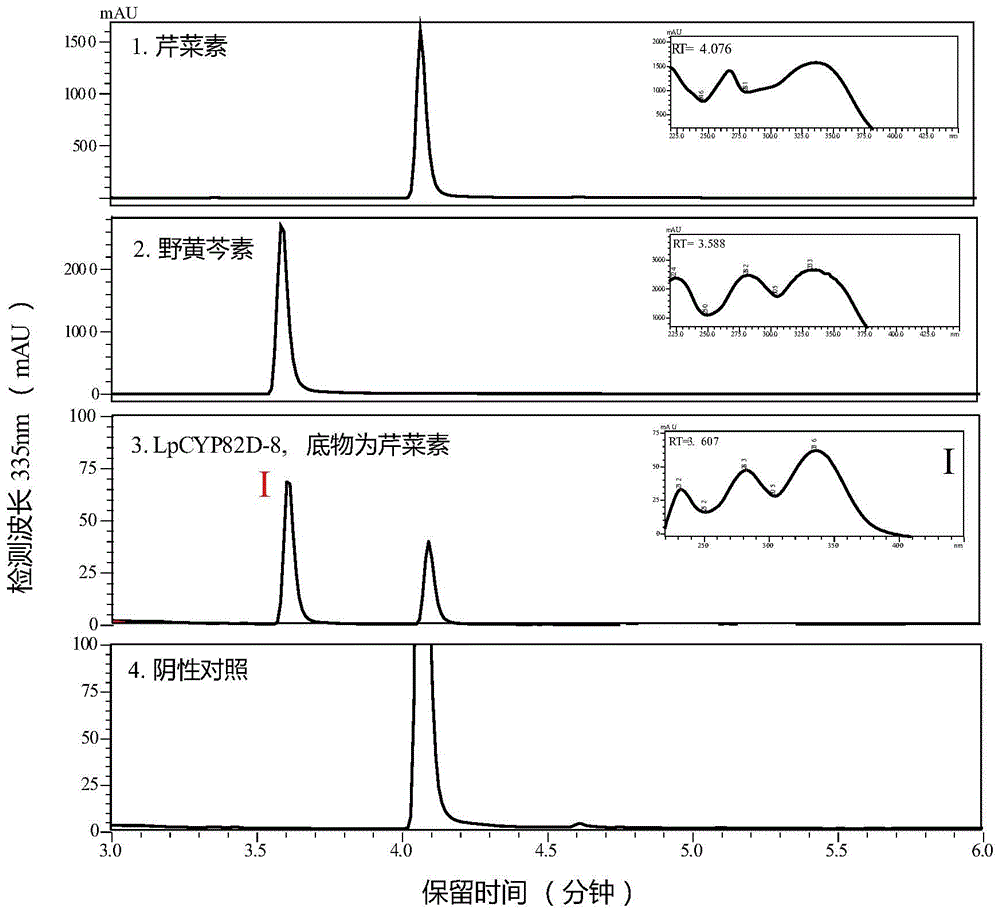
利用真核表达系统,成功表达了LpCYP82D-8的重组蛋白,进一步酶活分析来鉴定了它们的功能。酶活反应的受体为芹菜素。分析酶活产物UPLC图谱(图3),发现LpCYP82D-8对芹菜素具有活性。
UPLC条件:
UPLC型号:Nexera UHPLC LC-20A system(SHIMADZU,Japan)。
流动相:A相:0.1%甲酸水溶液;B相:乙腈。
洗脱梯度:0-7min,5%-100%B;7-9min,100%B;9-10.5min,100%-5%B;10.5-11.5min,5%B。
DAD检测波长:335nm。
利用UPLC鉴定酶活产物,发现LpCYP82D-8对于受体为芹菜素的酶活反应产物峰只有一个,其保留时间和紫外光谱图与标准品野黄芩素基本一致,初步判断产物为野黄芩素(图3)。利用质谱鉴定酶活产物,发现产物峰I的MS信息与标准品野黄芩素一致,主要离子碎片均为285和117(图4)。综上所述,体外酶活证据显示LpCYP82D-8编码催化6位羟基化芹菜素生成野黄芩素的羟基转移酶。图5为芹菜素(左,底物)和野黄芩素(右,产物)分子结构式,野黄芩素为6-羟基芹菜素。
质谱条件:
质谱前的样品准备同UPLC前的样品准备。
利用UPLC MS/MS对样品进行分离,柱子为InfinityLab Poroshell 120EC-C18column(2.1*50mm 1.9-micron;Agilent),流动相与UPLC相同,洗脱梯度为0min,5%B;7min,95%B,最后95%B平衡(7-8min),流速为0.30mL/min,检测波长同上。
UPLC MS/MS质谱条件,电喷雾离子化,全离子扫描,负离子模式negative-ion(EI)质谱分析。负离子模式条件如下:gas temperature:300℃,gas flow:6L/min,nebulizer:30psi,sheath gas temperature:300℃,sheath gas flow:11L/min,capillary voltage:2500V,nozzle voltage:2000V,collision energy:30V。野黄芩素在负离子模式下的特征离子为285.0和117.0。
4)LpCYP82D-8的催化活性
为进一步了解LpCYP82D-8重组蛋白的催化特性,我们以报道的SbCYP82D1.1作为阳性对照,检测SbCYP82D1.1和LpCYP82D-8对于芹菜素的催化活性。酶活反应体系同2)。以底物转化率(%)作为催化活性比较参数,计算公式=产物峰面积/(产物峰面积+底物峰面积)*100%。实验发现,LpCYP82D-8重组蛋白对于芹菜素转化生成野黄芩素的效率接近60%,约为SbCYP82D1.1转化率的2倍,表明重组蛋白LpCYP82D-8对于芹菜素的催化效率更高(如图6)。
上述具体实施方式,并不构成对本发明保护范围的限制。本领域技术人员应该明白的是,取决于设计要求和其他因素,可以发生各种各样的修改、组合、子组合和替代。任何在本发明的精神和原则之内所作的修改、等同替换和改进等,均应包含在本发明保护范围之内。
- 草鱼铁调素基因及其编码的重组蛋白和应用
- 秋葵类胡萝卜素生物合成和抗逆性相关蛋白AePDS及其编码基因与应用
- 芹菜素8位羟化酶蛋白及其编码基因与应用
- 鞘氨醇单胞菌的β–胡萝卜素羟化酶及其编码基因与其在生产虾青素中的应用
