一株降血糖功能发酵乳杆菌及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于食品微生物技术领域,具体涉及一株具有降血糖功能发酵乳杆菌及其应用。
背景技术
高血糖症是通常大家所说“三高”中的一高。空腹血糖值高于6.1mmol/L,餐后两小时血糖值高于7.8mmol/L,称为高血糖。
正常情况下,人体能够通过激素调节和神经调节这两大调节系统确保血糖的来源与去路保持平衡,使血糖维持在一定水平。但是在遗传因素(如糖尿病家族史)与环境因素(如不合理的膳食、肥胖等)的共同作用下,两大调节功能发生紊乱,就会出现血糖水平的升高。目前认为高血糖的发生主要与以下几种机制有关:1.胰腺β细胞不能分泌足够的胰岛素,α细胞分泌胰高血糖素过多;2.外周组织包括肝脏、肌肉和脂肪组织存在胰岛素抵抗;3.肠道吸收、肠道菌群和肠道影响血糖控制激素,导致其异常;4.肾脏过度地回吸收糖;5.神经系统对糖代谢的调节异常。高血糖患者往往伴随眼底病变、心血管疾病、脂肪肝等多种并发症,并出现多尿、多饮、多食、体重减少的临床症状。
乳酸菌是一类能利用碳水化合物产生乳酸的非病原性、革兰氏阳性细菌的通称,被公认是安全的食品微生物。益生菌可以作为替代补充剂发挥健康益处,包括对人体的降血糖作用。人体氧化应激反应与炎症是降低胰岛素敏感性的重要原因,益生菌通过降低人体氧化应激与炎症反应间接使胰岛素敏感性增强,使其能够在人体内发挥降低血糖的作用。因此,乳酸菌降血糖作用及其功能性产品的开发已逐渐成为研究热点。
发酵食品在许多国家构成了人类饮食的主要部分,乳酸菌发酵不仅可以延长食品保存期,还能改变食品的品质特性,赋予发酵食品新的生理功能。豆制品含有多种营养物质及功能成分,既能够补充营养,又能够预防及协助治疗某些疾病,比如豆制品中的膳食纤维和植物化学物质都有助于降低血糖。但利用发酵乳杆菌提高豆制品的降血糖活性鲜有报道,本发明则利用发酵乳杆菌进一步提高了大豆乳、花生豆乳和鹰嘴豆乳的降血糖功效。
发明内容
本发明提供了一株人源发酵乳杆菌及其在提高动物抗氧化能力和/或改善II型糖尿病高血糖及其他并发症中的应用。
本发明提供的一株发酵乳杆菌GD01(Lactobacillus fermentum GD01),其保藏名称:发酵乳杆菌Lactobacillus fermentum;保藏单位:中国普通微生物菌种保藏管理中心,保藏地址:北京市朝阳区北辰西路1号院3号,保藏编号:CGMCC NO:25513,保藏时间:2022年8月10日。
上述发酵乳杆菌GD01的16S rDNA序列如SEQ ID NO:1所示。
本发明是从健康人肠道中筛选出一株发酵乳杆菌GD01(Lactobacillusfermentum GD01),通过细菌形态学、生理学和生长特征,结合16S rDNA测序等对该菌进行了鉴定。
本发明的另一个目的是提供所述人源发酵乳杆菌GD01在提高动物抗氧化能力和/或改善II型糖尿病高血糖及并发症如消瘦和脂肪肝中的应用。
本发明的再一个目的是提供所述人源发酵乳杆菌GD01在制备功能性产品中的应用,该菌株具有耐胃肠液等益生特性及良好的安全性能。
所述功能性产品具体包括发酵鹰嘴豆豆乳、发酵大豆豆乳、发酵花生豆乳。
本发明的有益效果为:
本发明的发酵乳杆菌GD01对模拟胃液和模拟肠液具有良好的耐受性;在α-葡萄糖苷酶抑制实验中表现出显著优于阳性对照菌鼠李糖乳杆菌ATCC 53103的酶抑制能力;在抗氧化能力方面,本发明的发酵乳杆菌GD01的菌悬液及发酵液均显示出较强的还原能力、DPPH清除能力、羟自由基清除能力以及抗脂质过氧化能力。此外,本发明的发酵乳杆菌GD01可应用于发酵大豆豆乳、花生豆乳和鹰嘴豆乳,并提高3种豆乳的降血糖能力。再者,本发明的发酵乳杆菌GD01具有降低II型糖尿病小鼠血糖和改善其消瘦与脂肪肝等并发症状的功效。
附图说明
图1为发酵乳杆菌(Lactobacillus fermentum)GD01菌落形态图。
图2为发酵乳杆菌(Lactobacillus fermentum)GD01镜检结果图。
图3为发酵乳杆菌(Lactobacillus fermentum)GD01的生长曲线。
图4为发酵乳杆菌(Lactobacillus fermentum)GD01离心前的发酵培养液的24hpH变化图。
图5为三种发酵豆乳24h pH值变化。
图6为发酵乳杆菌GD01干预期间小鼠血糖变化。
图7为发酵乳杆菌GD01干预8周后小鼠血糖值。
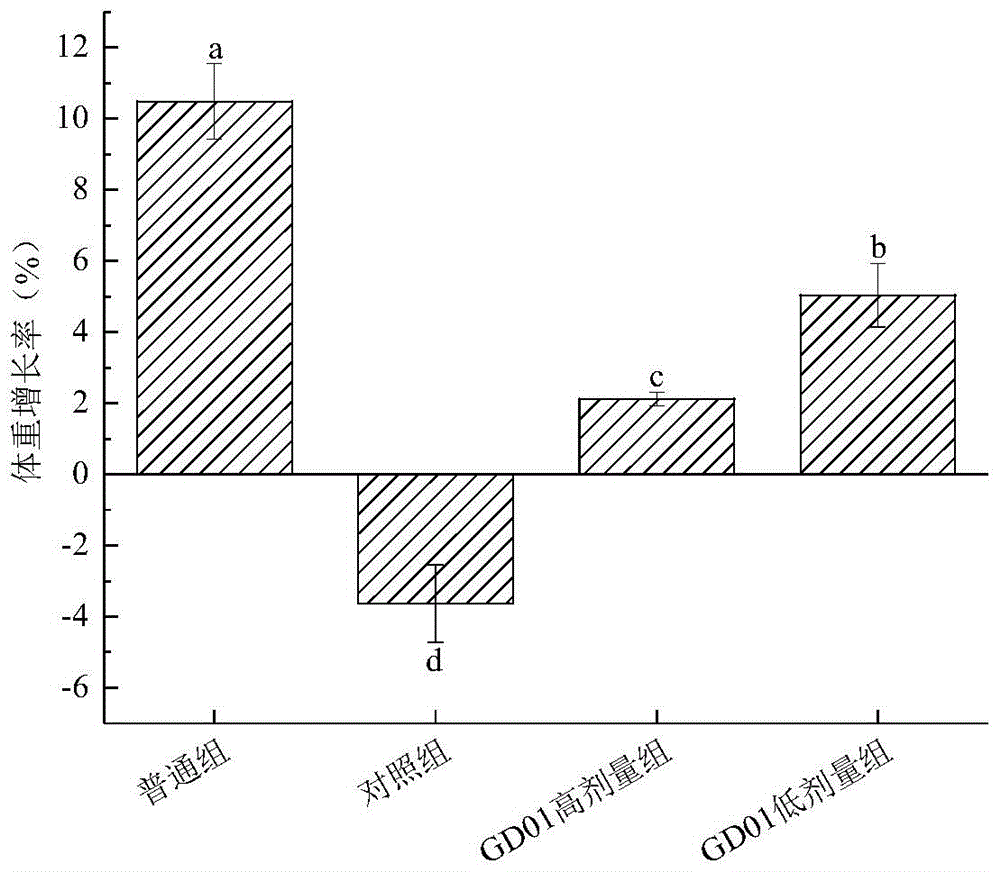
图8为发酵乳杆菌GD01干预8周后小鼠体重增长率。
图9为发酵乳杆菌GD01干预8周后小鼠肝脏组织切片。A为普通组;B为对照组;C为GD01高剂量组;D为GD01低剂量组。
保藏信息
发酵乳杆菌GD01:
保藏时间:2022年8月10日;
保藏单位名称:中国普通微生物菌种保藏管理中心
保藏编号:CGMCC NO:25513;
保藏单位地址:北京市朝阳区北辰西路1号院3号;
分类命名:发酵乳杆菌Lactobacillus fermentum。
具体实施方式
下面通过具体实施方式对本发明进行更加详细的说明,以便于对本发明技术方案的理解,但并不用于对本发明保护范围的限制。
实施例1发酵乳杆菌GD01的分离、筛选及鉴定
1.乳酸菌的筛选
1.1样品来源
本发明实施例使用的菌株均从健康人粪便样品中分离获得。共采集20多份样品用于后续的分离纯化鉴定。
1.2乳酸菌菌株的分离纯化
用无菌试管低温保存样品,立即送至实验室进行分离。取1g样品加入100mLMRS液体培养基中,于37℃恒温摇床富集培养24h;在超净台中吸取富集液1mL,PBS稀释,在10
筛选一株满足生长良好且遗传稳定性良好的菌株,命名为GD01。
MRS液体培养基:酵母膏5g/L,蛋白胨10g/L,牛肉膏10g/L,乙酸钠5g/L,葡萄糖20g/L,柠檬酸二铵2g/L,K
MRS琼脂培养基:在MRS液体培养基中加入15g/L琼脂,搅拌均匀,灭菌(121℃,1×10
2.发酵乳杆菌GD01的鉴定
2.1菌落特征
发酵乳杆菌GD01在MRS琼脂培养基培养48h后,直径在0.3~1.0mm之间,菌落圆形,中部隆起、边缘整齐、光滑湿润、呈乳白色,如图1所示。
2.2显微镜下形态
发酵乳杆菌GD01菌落涂片:革兰氏染色呈阳性,圆端直杆菌,单个、成对或短链状,无鞭毛,不产芽孢,如图2所示。
2.3 16S rDNA鉴定
通过16S rDNA基因测序,对筛选出的菌株进行鉴定。采用DNA提取试剂盒(天根生物技术有限公司)提取目标基因组DNA。利用27F和1492R两个通用引物进行16S rDNA的PCR实验,PCR扩增产物进行琼脂糖凝胶检测拍照,扩增片段长度约1.5kb。将PCR产物送至深圳华大基因科技服务有限公司进行测序,并与NCBI BLAST序列数据库进行对比,从物种水平鉴定菌株,结果显示该序列(如SEQ ID NO:1所示)与发酵乳杆菌的16SrDNA序列同源性超过99%。
待鉴定菌株的16S rDNA的序列(5'~3')如下:
ggcggggcggcttgctatacatgcagtcgaacgcgttggcccaattgattgatggtgcttgcacctgattgattttggtcgccaacgagtggcggacgggtgagtaacacgtaggtaacc tgcccagaagcgggggacaacatttggaaacagatgctaataccgcataacaacgttgttcgcatgaacaacgcttaaaagatggcttctcgctatcacttctggatggacctgcggtgcattagcttgttggtggggtaacggcctaccaaggcgatgatgcatagccgagttgagaga ctgatcggccacaatgggactgagacacggcccatactcctacgggaggcagcagtagggaatcttccacaatgggcgcaagcctgatggagcaacaccgcgtgagtgaagaagggtttcggctcgtaaagctctgttgttaaagaagaacacgtatgagagtaactgttcatacgttgacggtatttaaccagaaagtcacggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttatccggatttattgggcgtaaagagagtgcaggcggttttctaagtctgatgtgaaagccttcggcttaaccggagaagtgcatcggaaactggataacttgagtgcagaagagggtagtggaactccatgtgtagcggtggaatgcgtagatatatggaagaacaccagtggcgaaggcggctacctggtctgcaactgacgctgagactcgaaagcatgggtagcgaacaggattagataccctggtagtccatgccgtaaacgatgagtgctaggtgttggagggtttccgcccttcagtgccggagctaacgcattaagcactccgcctggggagtacgaccgcaaggttgaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagctacgcgaagaaccttaccaggtcttgacatcttgcgccaaccctagagatagggcgtttccttcgggaacgcaatgacaggtggtgcatggtcgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgttactagttgccagcattaagttgggcactttagtgagactgccggtgacaaaccggaggaaggtggggacgacgtcagatcatcatgccccttatgacctgggctacacacgtgctacaatggacggtacaacgagtcgcgaactcgcgagggcaagcaaatctcttaaaaccgttttcagttcggactgcaggctgcaactcgcctgcacgaagtcggaatcgctagtaatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccatgagagtttgtaacacccagaagtcggtggggtaaccttctaggagccagccgctaacggtgacttggtgg。
结合菌株GD01的序列比对结果和生理生化结果,确定筛选的乳酸菌GD01为发酵乳杆菌(Lactobacillus fermentum)。
将对数生长期的发酵乳杆菌GD01,以2%的接种量接入到MRS液体培养基中,37℃培养2小时,开始进入对数生长期,培养14小时到达稳定期,活菌数可达到10
3.发酵乳杆菌GD01菌悬液及发酵上清液的制备
将甘油管中保存的菌株在MRS琼脂平板上划线,挑取单菌落于MRS液体培养基中扩大培养18h。2%接种量转接于MRS液体培养基中,37℃培养18h,传2~3代后,离心(4000r/min,4℃,10min)。取上清过0.22μm滤膜除杂,所得即为发酵乳杆菌GD01发酵上清液;取沉淀,用质量分数为0.85%无菌生理盐水清洗3次后进行重悬,统一调整菌悬液浓度为1×10
发酵乳杆菌(Lactobacillus fermentum)GD01离心前的发酵培养液的24h pH变化如图4所示。
实施例2发酵乳杆菌GD01耐模拟胃肠液能力的测定
模拟胃液:将0.1mol/L磷酸钾缓冲液pH调至2.5,灭菌后加入胃蛋白酶10g使其充分溶解,使用前37℃进行预热。
模拟肠液:将0.1mol/L磷酸钾缓冲液pH调至8.0后灭菌,加入胰蛋白酶(10g/L),猪胆盐(3g/L),混合使其充分溶解,得到模拟肠液。使用前37℃进行预热。
将发酵乳杆菌GD01活化2~3代后,分别吸取1mL菌悬液接种到9mL模拟胃液和模拟肠液中,37℃分别孵育3h、4h后用平板计数法测定菌株的活菌数。按如下公式计算耐受率:
表1发酵乳杆菌GD01对模拟胃液和肠液耐受能力
如表1所示,发酵乳杆菌GD01在pH 2.5模拟胃液中及含胆盐的pH 8.0模拟肠液中,均表现出良好的耐受能力,且在模拟胃液中耐受率显著高于阳性对照鼠李糖乳杆菌ATCC53103。因此,发酵乳杆菌GD01具有良好的耐胃肠道逆环境性能。
实施例3发酵乳杆菌GD01抗氧化能力的测定
1.DPPH清除能力的测定
取1mL发酵乳杆菌GD01的菌悬液、发酵上清液分别与1mL 0.2mmol/LDPPH-无水乙醇溶液充分震荡混匀,于室温下避光反应30min,离心(6000rpm,10min),于517nm波长处测定上清液吸光度。以鼠李糖乳杆菌ATCC 53103作为阳性对照菌。用等体积生理盐水代替样品作为阴性对照组,并以等体积的生理盐水和无水乙醇混合液作为空白调零。按照以下公式计算DPPH自由基的清除率:
DPPH自由基清除率(%)=(1-A
表2发酵乳杆菌GD01的DPPH清除率
由表2可知,发酵乳杆菌GD01的菌悬液和发酵上清液都能有效清除DPPH自由基,其中菌悬液对DPPH的清除效果显著优于阳性对照菌株。发酵代谢产物的抗氧化活性是乳酸菌抗氧化作用非常重要的一个方面,发酵乳杆菌GD01的发酵上清液的DPPH自由基清除率与对照菌株无显著差异。
2.还原能力的测定
将0.5mL发酵乳杆菌GD01的菌悬液或发酵上清液与0.5mL1%铁氰化钾及0.5mLPBS(pH 6.6)混合,震荡充分混匀,于50℃水浴20min。冰浴急速冷却,加入0.5mL 10%三氯乙酸,3000rpm离心10min,取1mL上清加入1mL 0.1%FeCl
还原力(%)=(A
表3发酵乳杆菌GD01的还原能力
赤血盐(铁氰化钾)还原为黄血盐后与Fe
3.羟自由基清除率的测定
将1mL 2.5mmol/L 1,10-邻菲罗啉、1mL PBS(pH 7.4)和1mL发酵乳杆菌GD01的菌悬液或发酵上清液充分混匀后,加入1mL 2.5mmol/LFeSO
羟自由基清除率(%)=(A
表4发酵乳杆菌GD01的羟自由基清除率
乳酸菌对羟自由基的抑制可以有效降低或缓解DNA降解及生物细胞膜的损伤等,因此羟自由基清除率是评价抗氧化能力的一个重要指标。由表4可知,发酵乳杆菌GD01对羟自由基有较高的清除能力,其发酵上清液对羟自由基的清除率显著高于阳性对照菌株。
4.抗脂质过氧化能力的测定
0.5mL PBS(pH 7.4)中加入1mL亚油酸乳化液、0.2mL0.01%硫酸亚铁和0.01%抗坏血酸,再加入0.5mL发酵乳杆菌GD01的菌悬液或者发酵上清液,混匀后置于37℃水浴中反应12h。取2mL反应液加入0.2mL 0.4%三氯乙酸、2mL 0.8%硫代巴比妥酸和0.2mL0.4%二丁基羟基甲苯(BHT),震荡充分混匀后,在100℃下反应30min,冷却后再加入2mL三氯甲烷进行抽提,离心(4000rpm,10min),收集上清。532nm波长下测定样品OD值,以PBS作为空白对照。以鼠李糖乳杆菌ATCC 53103作为阳性对照菌。按照下式计算乳酸菌抗脂质过氧化的能力:
抗脂质过氧化率=(1-A
表5发酵乳杆菌GD01的抗脂质过氧化能力测定
由表5可知,发酵乳杆菌GD01菌悬液及发酵上清液的抗脂质过氧化能力与阳性对照菌株一样,无显著性差异。
5.α-葡萄糖苷酶抑制率测定
在试管中加入300μL PBS(0.1M pH 6.8)、150μL 20mM对硝基苯基-β-D-吡喃半乳糖苷(PNPG)溶液及50μL待测乳酸菌的菌悬液或发酵上清液,混合均匀后于37℃水浴10min。加入100μLα-葡萄糖苷酶溶液(0.2U/mL)继续反应20min。加入2mL 0.2mol/LNa
α-葡萄糖苷酶抑制率(%)=(1-(A-B)/(C-D))×100。
其中:A为含有α-葡萄糖苷酶溶液及待测样品的测定吸光值;
B为不含α-葡萄糖苷酶溶液但含待测样品的测定吸光值;
C为含有α-葡萄糖苷酶溶液但不含待测样品的测定吸光值;
D为不含α-葡萄糖苷酶溶液及待测样品的测定吸光值。
表6α-葡萄糖苷酶抑制率测定
由表6可知,发酵乳杆菌GD01的菌悬液和发酵上清液都能有效抑制α-葡萄糖苷酶的活性,可抑制葡萄糖的生成以减少人体对糖的吸收。尤其,发酵乳杆菌GD01菌悬液对α-葡萄糖苷酶的抑制率是阳性对照菌株(鼠李糖乳杆菌ATCC 53103)的2倍之多。
实施例4发酵乳杆菌GD01制备三种降血糖功能发酵豆乳
本实施例分别以鹰嘴豆、大豆、花生三种不同豆类豆乳为原料,接入活化后的发酵乳杆菌GD01,制备三种发酵豆乳,并对制备的三种发酵豆乳的pH值及降血糖活性进行了测定,具体方法如下:
S1:分别取40g豆,在常温下浸泡过夜,用蒸馏水洗净,在料理机中加入豆子重量12倍的蒸馏水,100℃条件下搅打20min,制得物料A;
S2:高温高压灭菌(121℃,20min),制得物料B;
S3:将物料B冷却至37℃,制得物料C;
S4:将发酵乳杆菌活菌调整到1.0×10
S5:测定三种发酵豆乳的pH值。
pH值的测定:
从0h开始,每隔4h使用雷磁PHS-3C酸度计(上海蚁霖科学仪器有限公司,中国)测定发酵豆乳的pH值。结果如图5所示。
由图5可知,经发酵乳杆菌GD01发酵,三种豆乳的pH值逐渐下降,20h后趋于稳定,表明本发明发酵乳杆菌GD01能在三种豆乳中有效增值,正常代谢。
S6:测定未发酵豆乳及三种发酵豆乳的α-葡萄糖苷酶及α-淀粉酶抑制率。α-葡萄糖苷酶抑制率测定同实施例3中第5条。
α-淀粉酶抑制率测定:
分别将发酵前后的三种豆乳冷冻干燥,得到相应的冻干粉。在试管中加入50mg冻干粉、500μL的可溶性淀粉溶液(1.5%)、250μL PBS溶液(0.1mol/L,pH 6.8),孵育(37℃,5min)。然后加入250μLα-淀粉酶(5U/mL),再次孵育(37℃,5min)。加入1mL DNS后沸水浴5min,迅速冷却至室温,取1mL稀释10倍,静置30min,离心(10 000r/min,10min),在540nm波长处测OD值。用PBS代替α-淀粉酶,其余试剂添加量及顺序不变,具体的实验分组如下:
表7α-淀粉酶抑制率
抑制率=[1-(A
表8三种豆乳发酵前后对α-葡萄糖苷酶及α-淀粉酶的抑制率(%)
由表8结果可知,将发酵乳杆菌GD01应用于发酵三种豆乳,3种发酵豆乳的α-葡萄糖苷酶及α-淀粉酶抑制率相比未发酵豆乳均有显著提高,这表明经本发明菌株发酵的植物基豆乳具有较好的降血糖活性。
实施例5发酵乳杆菌GD01改善II型糖尿病小鼠的高血糖的症状
本实施例用以说明本发明的发酵乳杆菌GD01具有显著的改善II型糖尿病小鼠高血糖及其并发症的功效。
实验动物房常年保持22±2℃的温度和55%±5%的湿度,并严格遵循12h白天和12h黑夜的循环标准。48只雄性8周龄的SPF级C57BL/6J小鼠,用基础饲料适应性喂养一周后随机分为4组(如表9所示)。第一周,除普通组喂食基础饲料外,其它各组均喂食高糖高脂饲料。一周后,所有小鼠禁食不禁水12h,除普通组外,其余各组小鼠均按照100mg/kg体重注射新鲜配制的链脲佐菌素STZ(50mmol/L)。将一定量STZ溶于50mmol/L柠檬酸-柠檬酸钠缓冲液中(pH 4.5),现配现用,冰浴保存,正常组注射0.85%的生理盐水。造模1周后,造模成功的糖尿病小鼠其空腹血糖高于11.6mmol/L(同组间血糖值无显著差异)。干预组的小鼠灌胃对应的菌株(悬浮于无菌生理盐水中的菌悬液),灌胃量为200μL/只,GD01高剂量组菌体含量为1×10
表9小鼠分组
高糖高脂饮食及注射STZ一周后小鼠状态观察:普通组小鼠精力充沛,毛色光亮,无掉毛,饮食与饮水正常。其余注射STZ造模组小鼠均不同程度表现精神不振,毛色发黄脱落,饮水与排尿量明显增多。然而随着乳酸菌的喂食,小鼠的以上不良状态得以缓解和改善。
由图6和图7可知,经本发明所述的发酵乳杆菌GD01灌胃5周后,高、低剂量组小鼠血糖值相比对照组有显著降低。此外,如图8所示,对照组有明显的糖尿病并发症-体重减少,而高、低剂量干预组小鼠体重与普通组一样有增长的趋势,其中GD01低剂量组小鼠的体重增量为5.03±0.89%,高剂量组小鼠体重增长率为2.12±0.18%。
干预期结束后对小鼠肝脏切片进行病理分析(图9),发现对照组糖尿病小鼠出现重度脂肪变形肝脏,肝细胞索间界线不甚清晰;肝细胞高度肿胀,胞浆界线已不明显,窦状隙几乎消失,多数细胞的胞浆内有很大的空泡(小的脂滴溶解后的很多空泡融合在一起所形成)出现。而高、低剂量干预组小鼠肝脏未观察到严重的肝脏脂肪变性情况,与普通组比较相似。
以上结果表明,本发明的发酵乳杆菌GD01能显著降低II型糖尿病小鼠的空腹血糖值,对II型糖尿病消瘦和脂肪肝的并发症有改善效果,具有巨大的开发价值。
本发明所有实验至少重复3次,数据用平均值±标准差
总的来说,发酵乳杆菌GD01具有较好的胃肠道耐受能力、DPPH清除能力、还原能力、羟自由基清除能力、抗脂质过氧化能力以及α-葡萄糖苷酶抑制能力,且经其发酵的豆乳降血糖活性显著提高;对II型糖尿病小鼠进行干预,可显著降低小鼠空腹血糖,缓解其消瘦和脂肪肝症状,显示出其在改善II型糖尿病方面的优良性能,可用于降血糖产品的开发。
以上所述之实施例,只是本发明的较佳实施例而已,并非限制本发明的实施范围,故凡依本发明专利范围所述的构造、特征及原理所做的等效变化或修饰,均应包括于本发明申请专利范围内。
- 一株戊糖乳杆菌发酵液及其抑制辣椒疫霉菌的应用
- 一株具有调节血糖和胆固醇水平等益生功能的嗜酸乳杆菌La-SJLH001及其应用
- 一株植物乳杆菌及其在制备降血糖血脂的功能性食品中的应用
- 一株植物乳杆菌及其在制备降血糖血脂的功能性食品中的应用
