一种冷适性α-琼胶酶及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种冷适性α-琼胶酶及其应用,属于基因工程与生物技术领域。
背景技术
琼脂是一种从大型红藻(包括石花菜、江蓠和紫檀)的细胞壁中获得的亲水性多糖,凝胶强度和亲水性较高,能够吸水膨胀,还具有特别的稳定效应,被广泛地用作增稠剂、乳化剂、胶凝剂、稳定剂、赋形剂、水分保持剂等添加剂。琼脂还可以进一步制成琼脂糖,琼脂糖是由3-O-β-D-半乳糖(D-Gal)和4-O-3,6-脱水-α-L-半乳糖(L-AHG)的交替单糖残基组成的线性链,因其具有电渗小、凝胶强度高等特性,可用作电泳的介质材料等生物学应用。此外,琼脂糖可水解生产琼脂寡糖,琼脂寡糖一般含有2~20个通过糖苷键连接的糖单元,分为以D-半乳糖为还原端的琼胶寡糖和以3,6-脱水-α-L-半乳糖为还原端的新琼寡糖,均具有一定的功能活性,例如抗炎、抗氧化、抑制黑素瘤细胞、作为益生元来调节肠道菌群和用于改善雄激素源性脱发等。
目前工业上降解琼脂主要有两种方式:酸水解和酶解,酸水解法效率高、产量大,但会产生大量副产物,存在琼胶寡糖分离提纯困难、具有安全隐患等问题;而琼胶酶酶解方法具有催化效率高、底物特异性强、反应条件温和等优点,是降解琼脂多糖的首选方式。但大多数利用酶法降解琼脂多糖的研究还处于实验室研究阶段,主要问题是产琼脂酶的菌株大多数来自于海洋,菌株产酶性状不稳定、产酶量低,使生产琼胶酶的成本高,价格昂贵,难以实现商业化应用。因此,寻找水解活力高,性状稳定的琼胶酶基因,并实现异源表达成为生产琼胶酶的最经济高效的办法。
琼胶酶,可根据水解琼脂糖模式的不同分为α-琼胶酶(EC3.2.1.158)和β-琼胶酶(EC3.2.1.81),α-琼胶酶能裂解琼脂糖的α-1,3键产生琼胶寡糖;β-琼胶酶可以水解β-1,4键生成新琼胶寡糖,该寡糖产物因具有特殊的功能活性在功能性食品、医药工业和化妆品行业而具有较高的经济价值。此外,琼胶酶在生物技术也存在应用潜力,如海藻原生质体制备和鉴定红藻中的琼脂、DNA凝胶回收等。
目前,市场上的DNA凝胶回收方法通常为首先将含目的DNA的凝胶切割出来后,添加适量化学融胶液并在在50℃以上的高温下孵育来融化胶。胶融化后,使用酚氯仿抽提,酒精沉淀或离子交换柱等方式进行清洗与洗脱。而融胶步骤中使用的融胶液通常含有硼酸、EDTA等化学成分,有毒有害,存在一定刺激性。同时需要在50℃以上的高温下加热,虽然高温可以提高反应速率,但这一过程耗费能源、增添了二氧化碳排量。因此,选择冷适性琼胶酶充当DNA凝胶回收过程中的生物融胶剂,具有安全环保、节能减排的优势,有广阔的市场应用空间。
发明内容
本发明提供了一种无需高温加热,环保无害的可用于DNA回收的冷适性α-琼胶酶,可作为环境友好的生物制剂,代替化学试剂用于DNA凝胶回收。
本发明提供了一种编码冷适性α-琼胶酶的基因,其核苷酸序列如SEQ ID NO.1所示。
本发明还提供了携带所述基因的重组载体。
本发明还提供了表达所述冷适性α-琼胶酶,或含有所述重组载体的重组微生物细胞。
在一种实施方式中,所述重组微生物细胞是重组毕赤酵母。
在一种实施方式中,所述重组毕赤酵母以Pichia GS115为宿主,以pPIC9k质粒为载体,表达所述冷适性α-琼胶酶。
本发明还提供了所述重组毕赤酵母的构建方法,将α-琼胶酶的基因克隆到pPIC9k质粒中,线性化质粒后将所述质粒通过电转化导入毕赤酵母的基因组中。
本发明还提供了应用所述重组毕赤酵母生产α-琼胶酶的方法。
在一种实施方式中,所述方法包括:
(1)将所述重组毕赤酵母菌在培养基中培养,用甲醇诱导表达产酶;
(2)收集细胞培养液中的α-琼胶酶。
在一种实施方式中,所述方法具体为:将所述重组毕赤酵母菌接种于YPD液体培养基,过夜培养得到种子液,然后将种子液接种于BMGY培养基中培养,培养至OD
在一种实施方中,所述YPD培养基包括10g/L酵母提取物、20g/L胰蛋白胨、20g/L葡萄糖。
在一种实施方式中,所述BMGY培养基包括10g/L酵母提取物、20g/L胰蛋白胨、100mL/L磷酸钾缓冲液母液、13.4g/L YNB、2mL/L生物素母液、10mL/L甘油。
在一种实施方式中,所述BMMY培养基包括10g/L酵母提取物、20g/L胰蛋白胨、20g/L葡萄糖、100mL/L磷酸钾缓冲液母液、13.4g/L YNB、2mL/L生物素母液、5mL/L甲醇。
在一种实施方式中,所述磷酸钾缓冲液母液由0.45g K
本发明还提供了氨基酸序列如SEQ ID NO.2所示的α-琼胶酶在回收DNA方面的应用。
在一种实施方式中,所述应用是在≤30℃,或≤25℃的环境下回收DNA。
在一种实施方式中,所述应用包括:
(a)将α-琼胶酶用于水解含DNA的琼脂糖凝胶;
(b)回收步骤(a)的酶解产物中的DNA。
在一种实施方式中,所述步骤(a)是在≤30℃,尤其是≤25℃的环境下进行酶解。
在一种实施方式中,所述步骤(b)包括使用使用离子交换柱进行洗脱与纯化。
在一种实施方式中,所述琼脂糖凝胶中琼脂糖的浓度为0.5~1.0%。
在一种实施方式中,所述α-琼胶酶的添加量为20~100U/g琼脂糖凝胶。
在一种实施方式中,步骤(a)酶解反应4~6h。
本发明还提供所述α-琼胶酶在制备用于DNA回收的试剂盒中的应用。
有益效果:
(1)本发明成功的采用食品安全菌株毕赤酵母菌对α-琼胶酶进行异源表达,应用该菌株生产α-琼胶酶安全、高效,且外源蛋白含量低,有利于分离纯化,生产获得的的α-琼胶酶的催化活力可高达20.1U/mg,可应用于食品、药品的生产中。
(2)本发明提供的α-琼胶酶具有较高的比酶活与良好的冷适性,在10℃仍能保持61.8%的相对酶活。
(3)本发明提供的利用α-琼胶酶进行DNA凝胶回收的方法:将该α-琼胶酶于室温下与含DNA片段的凝胶反应即可实现完全水解,所得液体纯化后得到回收率较高,达到78.0%。此方法无需添加含硼酸、EDTA的化学试剂融胶液,也无需高温加热,更加环保无害,节约能源,从而具有广阔的工业应用价值。
附图说明
图1:pPIC9k-AGA线性化验证;其中,M:蛋白质Marker;泳道1:未线性化的pPIC9k-AGA;泳道2:线性化后的pPIC9k-AGA。
图2:GS115-pPIC9k-AGA重组菌株菌落PCR验证;M:蛋白质Marker;泳道1:重组菌株GS115-pPIC9k-AGA。
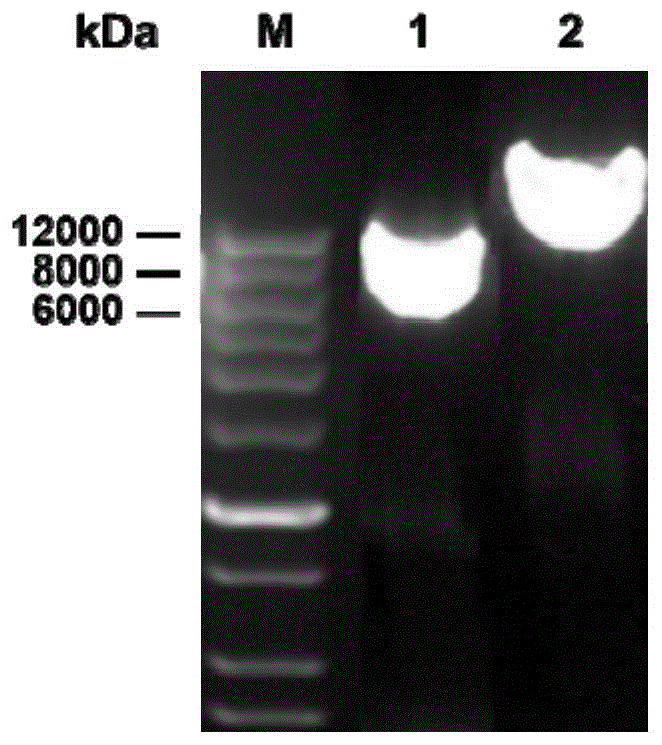
图3:α-琼胶酶的SDS-PAGE分析;其中,M:蛋白质Marker;泳道1:粗酶液;泳道2:纯酶液。
图4:不同温度条件下的α-琼胶酶的相对酶活数据。
图5:α-琼胶酶回收DNA片段验证图谱;其中,M:蛋白质Marker;泳道1:未经回收的原始DNA;泳道2:使用融胶液融胶后回收的DNA;泳道3:使用α-琼胶酶水解胶后回收的DNA;泳道4:使用水后回收的DNA。
具体实施方式
下述实施例中所涉及的检测方法如下:
α-琼胶酶酶活测定方法如下:以Tris-HCl缓冲液(20mM,pH 8.0)配制1g/L的琼脂糖底物,在0.9mL底物中加入0.1mL适当稀释的酶液,不同温度下震荡反应30min,加入1mL3,5-二硝基水杨酸(DNS)溶液终止酶促反应,沸水浴5min后冰浴冷却,540nm下测定吸光值,与半乳糖标准曲线比较。
酶活定义:每分钟生成1μmol还原糖(以半乳糖计)所需的酶量定义为1个酶活单位(U)。
凝胶DNA回收率检测方法:将经α-琼胶酶水解凝胶后得到的液体使用离子交换柱进行结合与纯化,所得产物使用酶标仪测定浓度计算DNA含量。回收率计算方式如下:
回收率=(切胶回收所得DNA含量/原始DNA量)×100%
实施例1:重组毕赤酵母分泌表达系统的构建
(1)化学合成核苷酸序列如SEQ ID NO.1所示的α-琼胶酶;
(2)利用限制性内切酶SnaB I和Not I双酶切载体质粒pPIC9K,双酶切反应条件为37℃酶切1h。
表1酶切反应体系
(3)使用同源重组方法将步骤(1)获得的α-琼胶酶基因和步骤(2)获得的pPIC9K质粒载体连接,同源重组条件为37℃孵育30min;之后转化大肠杆菌E.coli JM109,涂布具有10μg/mL氨苄霉素的LB固体培养基,挑取转化子进行测序、双酶切验证,获取重组质粒pPIC9K-AGA。
表2同源重组反应体系
其中,LB固体培养基配方如下:10g/L胰蛋白胨、5g/L酵母提取物、10g/L氯化钠,15g/L琼脂粉。
(4)将重组表达载体pPIC9K-AGA质粒用限制性内切酶Sac I进行单酶切以实现质粒线性化,单酶切反应条件为37℃酶切1h;使用DNA凝胶电泳鉴定是否线性化完全(如图1)。
表3酶切反应体系
(5)取步骤(4)制备的10μL经线性化处理的重组质粒与80μL酵母感受态细胞轻弹混匀;尽数吸出转移到0.2cm型预冷的转化杯中电穿孔转化;电击条件:电压1500V,电阻200Ω,电容25μF,脉冲时间4.5-5.0ms,一次电击;电击后,马上在电击转化杯中加入1mL 4℃预冷的1M的山梨醇溶液,混匀后吸入1.5mL无菌EP管中,置于30℃摇床静置培养1h。
(6)取500μL菌液涂布在MD平板上,30℃培养至菌落出现。
(7)将MD固体培养基上出现的单菌落悬浮于1-2mL无菌水中,按浓度梯度点接种于添加了0.25、1.0、2.0、4.0mg/mL G418(Geneticin)的YPD平板,以筛选多拷贝数的GS115-pPIC9k-AGA毕赤酵母重组菌,在30℃条件下培养2-5d,观察菌落的生长情况,挑取在高浓度生长且低浓度也生长的菌落。
其中,MD(营养组氨酸缺陷型)(g/L):20g/L葡萄糖,13.4g/L YNB,2mL/L生物素母液,15g/L琼脂粉,1mol/L山梨醇。
(8)菌落PCR验证是否为GS115-pPIC9k-AGA毕赤酵母重组菌。以质粒与基因连接处设计引物(AGA-Z:5’-AATTACCTACGTAAAGTTCTGGTTCTGGAAGCAGAATCATTTG-3’;AGA-F:5’-TTAATTCGCGGCCGCTCAGTGGTGGTGGTGGTGGTG-3’)进行PCR扩增目的基因,再进行核酸电泳验证,菌落PCR结果为4500bp左右,结果正确,见图2,验证正确的菌株命名为GS115-pPIC9k-AGA。
其中所涉及的PCR扩增程序为:95℃预变性3min,95℃变性15s,60℃退火15s,72℃延伸4min,循环扩增30次,72℃终延伸5min。
实施例2:α-琼胶酶的表达
将实施例1制备得到的菌株GS115-pPIC9k-AGA的单菌落接种于BMGY培养基,在30℃、转速300r/min条件下培养24-30h至OD600约为2。温度4℃转速3000rpm条件下离心收集菌体,弃去上清,将菌体重悬于BMMY培养基中继续培养。每24h加0.5%甲醇进行诱导表达,在培养72~96h后得到发酵液;分别取50mL的发酵液在4℃、10000rpm下离心10min,取上清液,即为胞外粗酶液,经测定,培养72h的粗酶液酶活为18.7U/mL。
实施例3:α-琼胶酶的纯化
采用镍柱对步骤(1)制备得到的重组α-琼胶酶进行纯化,平衡液(A液,pH 8.0)为500mM NaCl+50mM Tris-HCl+20mM咪唑,洗脱液(B液,pH 9.0)为500mM NaCl+50mM Tris-HCl+500mM咪唑。粗酶液调节pH至8.0,经0.45μm水系膜过滤后待纯化。在2mL/min流速下,用5~6个柱体积的缓冲液A平衡离子柱;上样,流速为2mL/min;之后先用6~8个柱体积的缓冲液A平衡离子柱,再采用20%的缓冲液B进行梯度洗脱,流速为2mL/min。根据洗脱峰收集对应洗脱液,置于透析袋中,在4℃条件下采用20mM、pH 8.0的Tris-HCl进行过夜透析,随后通过SDS-PAGE蛋白电泳(如图3所示)进行鉴定。α-琼胶酶的理论分子量为154.5kDa,与SDS-PAGE估算分子量相符。对纯化后的比酶活进行检测,结果显示,比酶活为20.1U/mg。
实施例4:α-琼胶酶的最适温度验证
检测实施例3制备得到的α-琼胶酶最适温度,具体步骤如下:分别在不同温度下(10-70℃)测定的酶活,以在35℃测定的酶活为100%,结果如表4所示。α-AGA酶的最适反应温度为35℃,在低温10℃下仍能保持61.8%的最高活力,证明该酶具有良好的冷适性。
表4α-琼胶酶的最适温度
实施例5:冷适性α-琼胶酶在DNA凝胶回收中的应用
由于SEQ ID NO.2所示的α-琼胶酶在低温下有较强的活力,应用该酶在常温下水解凝胶回收DNA。具体步骤如下:
(1)将1200ng的线性DNA加样至琼脂糖浓度为1%的琼脂糖凝胶加样孔中,恒压电泳至DNA样品泳动至距离凝胶前沿<三分之一距离处,结束电泳,在凝胶成像仪上观察电泳条带及位置,切下含DNA片段的琼脂凝胶块并称重后捣碎。
(2)向步骤(1)得到的200mg琼脂糖凝胶中添加实施例3制备得到的纯酶液,加酶量总计为50U,在常温(25℃)的摇床中反应6h;
(3)待胶融化后,使用DNA纯化柱完成洗脱纯化,使用酶标仪测定提取的DNA的浓度与含量。
对照组参照以上相同步骤,区别在于:
实验对照组步骤(2)具体为:向步骤(1)得到的凝胶中添加与胶等体积的碧云天公司生产的融胶液,在60℃下加热10min。
空白对照组步骤(2)用等量的水替换酶液。
以未切胶回收前的DNA含量为100%,计算结果如表5所示。
表5α-琼胶酶凝胶回收DNA得率表
使用α-琼胶酶室温下处理凝胶6h可以使琼脂完全融化,水解得到的液体纯化后能达到78.0%的DNA提取率,与市场上的化学融胶液具有大致相同的效果,表明使用该α-AGA酶可以在无需高温与化学试剂的情况下,环保无害、节约能源地用于水解琼脂、DNA凝胶回收。
对比例1:
具体实施方式同实施例1~3,区别在于,将SEQ ID NO.2所示的琼胶酶替换为具有不同氨基酸序列的琼胶酶(表6所示),按照实施例4或5的方法验证,结果显示,表6所示的琼胶酶在低温下(10-25℃)酶活较低,低于其最高活力的10%,无法充分水解琼脂糖凝胶,DNA回收率分别为6.6%与8.5%。
表6不同琼胶酶的应用效果
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 一种特异性产生新琼四糖的β-琼胶酶及其应用
- 一种降解产物均一的β-琼胶酶及其应用
- 一种具有pH广泛稳定性的适冷褐藻胶裂解酶AlgL2及其应用
- 一种适冷性海带淀粉酶及其应用
