抗菌多肽化合物及其药物组合物和应用
文献发布时间:2023-06-19 19:32:07
技术领域
本发明属于生物化学技术领域,具体而言,本发明涉及一类抗菌多肽化合物及包含其的药物组合物,及其在抗菌中的应用。
背景技术
耐药问题是治疗微生物感染的一大难题,据世界卫生组织估计,到2050年,因多重耐药菌感染造成的死亡人数每年将超过一千万人,并对世界经济造成数百万亿的损失,因此开发新的抗感染技术和药物成为药物研究的重大热点问题。抗菌肽因其分子量小,溶解性好,免疫原性低等优点成为其中最有希望的措施之一。最早的抗菌肽是从北美天蚕的血淋巴细胞中分离的具有抑菌活性的多肽物质,后来研究发现其广泛存在于细菌、真菌、昆虫、植物以及哺乳动物中。相较于传统的抗菌药,抗菌肽的不针对特定靶点而是通过对细胞膜的扰动影响膜的完整性发挥作用,因此,细菌产生耐药需要的时间更久。
为获得合适的治疗试剂,目前抗菌肽成药研究主要集中于天然抗菌肽的发现和改造。但是有限的发现手段和传统多肽改造的高消耗性极大限制了相应研究的发展。
发明内容
本发明的目的在于提供一种抗菌多肽化合物及其药物组合物和应用,该抗菌多肽化合物具有高抗菌活性。
为达上述目的,本发明提供一种抗菌多肽化合物的氨基酸序列选自以下之一:
化合物1(SEQ ID NO:1):RQGWIWYGFFWKK-NH
化合物2(SEQ ID NO:2):RIGWCAWLLKNKA-NH
化合物3(SEQ ID NO:3):WFIIWHWRKIPPK-NH
本发明还提供一种药物组合物,该药物组合物包括抗菌多肽化合物。
优选地,所述药物组合物还包括至少一种药学上可接受的药用载体和/或辅料。
优选地,所述药物组合物为用于皮肤表面的滴剂、喷剂、油膏、药贴、以及用于注射的无菌溶液中的至少一种剂型。
本发明又提供一种抗菌多肽化合物在制备用于抗菌药物中的应用。
本发明的抗菌多肽化合物具有高抗菌活性,本发明的抗菌多肽化合物的高抗菌活性在抗菌活性(MIC)、溶血活性、细胞毒性、抗菌机制(膜电势实验,PI摄取实验,大肠杆菌外膜、内膜渗透性实验,扫描电镜)和血清稳定性等方面也得到验证。由此可以证明,本发明的抗菌多肽化合物能够能够用于抗菌。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
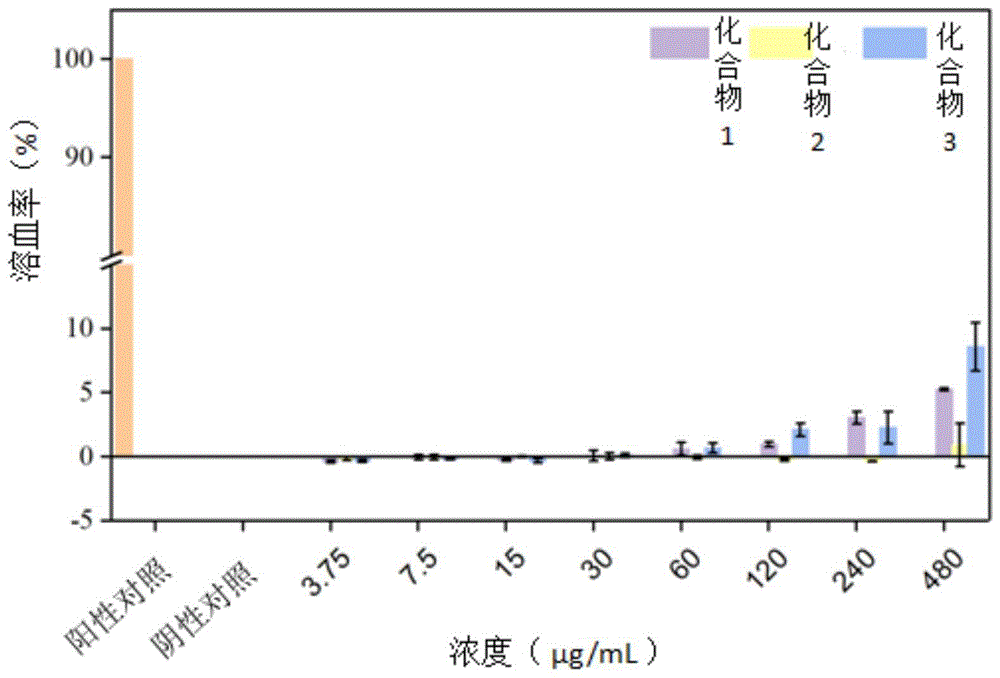
图1为化合物1、化合物2、化合物3的溶血率结果,其中Triton X-100用作阳性对照,其溶血率定为100%;PBS用作阴性对照,其溶血率为0。
图2为化合物1(左)、化合物2(中)、化合物3(右)对测试细胞株HL-7702、HEK-293T增殖的影响结果。
图3为不同剂量的化合物1、化合物2、化合物3对金黄色葡萄球菌(左)和表皮葡萄球菌(右)的膜电势的影响结果。其中,PBS用作阴性对照,Triton X-100用作阳性对照。
图4为4×MIC浓度的化合物1、化合物2、化合物3对金黄色葡萄球菌(左)和大肠杆菌(右)的PI摄取实验结果。其中,PBS作为阴性对照,16μg/mL的多粘菌素B(Ploymyxin B)作为金黄色葡萄球菌的阳性对照,2μg/mL的多粘菌素B作为大肠杆菌的阳性对照。
图5为不同剂量的化合物1、化合物2、化合物3大肠杆菌外膜通透性的影响结果。其中PBS作为阴性对照,多粘菌素B作为阳性对照。
图6为不同剂量的化合物1、化合物2、化合物3大肠杆菌内膜通透性的影响结果。其中0.5%NaCl作为阴性对照,多粘菌素B和Triton X-100作为阳性对照。
图7为4×MIC浓度的化合物1、化合物2、化合物3处理后的金黄色葡萄球菌(左)和大肠杆菌(右)在扫描电镜下的形态结果。其中,PBS处理的细菌作为阴性对照,2μg/mL的短杆菌肽处理后的金黄色葡萄球菌和2μg/mL多粘菌素B处理后的大肠杆菌作为阳性对照。
图8为化合物1(上左)、化合物2(上右)、化合物3(下)在血清中的降解情况结果。其中,以62.5μg/mL的化合物1、化合物2、化合物3和空白血清确定保留时间。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
材料与方法:
氨基酸购自成都郑源公司,缩合剂购自苏州昊帆公司。如果没有特别说明,其他所有试剂均为分析纯,溶剂购自上海泰坦公司。离心机购自卢湘仪。5.0cm反相C18制备柱(46mm x 250mm)用来纯化多肽。高效液相色谱仪为赛默飞公司产品。质谱分析采用Waters质谱仪进行测定。
实施例一、化合物的合成与纯化:
化合物1、化合物2、化合物3的合成采用经典的多肽固相合成方法,具体步骤如下:
1.溶胀树脂:称取一定量的树脂加入多肽合成仪中,再加入适量重蒸的DCM搅拌30min,使树脂完全溶胀,抽干后,用重蒸的DMF将树脂洗涤4次,每次3min,抽干;2.茚检:取少量树脂置于试管中,加入茚检试剂(茚三酮:吡啶:苯酚=1:2:1),于沸水中加热3min,若树脂颜色无变化,可进行下一步操作;3.脱保护:在合成仪中加入脱保护试剂(哌啶:DMF=1:4),搅拌,重复3次,每次5min,使Fmoc保护基完全脱除,用重蒸的DMF洗涤树脂4次,每次3min。再次茚检,若树脂为蓝紫色,则证明脱保护成功;4.缩合反应:称取3倍过量的Fmoc保护的氨基酸和缩合剂HOBT、HBTU,用重蒸的DMF溶解,加入6倍过量的启动剂DIEA,搅拌混匀后加入合成仪中,在惰性气体保护下搅拌1h,抽干,用重蒸的DMF洗涤树脂4次,每次3min,抽干,茚检,若树脂颜色无变化,则证明缩合反应成功。重复脱除Fmoc保护基和缩合反应的步骤,直至整条肽链全部合成。5.多肽的切割:最后一个氨基酸缩合完成后,脱去Fmoc保护基,用重蒸的DMF洗涤树脂4次,每次3min,再用DCM和无水甲醇交替洗涤树脂各3次,每次3min,将树脂放入真空干燥箱中。待树脂完全干燥后,加入切割试剂(TFA:Tis:H
表1抗菌多肽化合物的序列及分子量
实施例二、化合物最小抑菌浓度的测定:
化合物的抗菌活性测定所用的标准菌株:金黄色葡萄球菌(S.aureus ATCC25923)、表皮葡萄球菌(S.epidermidis ATCC 12228)、枯草芽孢杆菌(B.sutilis ATCC23857)、大肠杆菌(E.coli ATCC 25922)、鲍曼不动杆菌(A.baumanii ATCC 19606)、肺炎克雷伯菌(K.pneumoniae ATCC 700603)均来自于美国菌种保藏中心。化合物对细菌的最小抑菌浓度(MIC)值根据临床和实验室标准协会(CLSI)微量稀释法进行了少量修改。简而言之,挑取单个细菌菌落于4mL MH肉汤培养基中,37℃,120rpm摇床上孵育18h,用MH肉汤培养基将菌液稀释至10
表2抗菌多肽化合物对标准细菌菌株的最小抑菌浓度
实施例三、化合物1、化合物2、化合物3溶血活性实验:
化合物1、化合物2、化合物3的溶血活性是通过测定其对SD大鼠血红细胞的溶血浓度来测定的。将收集好的血红细胞用PBS稀释至8%(V/V)待用。采用二倍梯度稀释法将化合物从960μg/mL稀释至7.5μg/mL(终浓度为480μg/mL-3.75μg/mL),96孔板中加入100μL不同浓度的化合物溶液,再加入100μL 8%(V/V)红细胞,37℃孵育1h后取上清100μL于新的96孔板中,用多功能酶标仪(FlexStation III)于490nm处测定吸光值。使用PBS(pH7.4)作为阴性对照,2%TritonX-100(终浓度1%)作为阳性对照,本实验一式三份,重复三次。
研究发现化合物1、化合物2、化合物3能够表现出溶血活性,实验结果如图1所示。
实施例四、化合物1、化合物2、化合物3的细胞毒性实验:
化合物1、化合物2、化合物3的细胞毒性是通过MTT方法测定对人正常肝细胞HL-7702和人胚肾细胞HEK-293T的增殖影响而测定的。本实施例所用的细胞株均由兰州大学基础医学院实验中心提供。两种细胞均用含有10%胎牛血清的RPMI 1640培养基培养在37℃,5%CO
实施例五、膜电势测定:
化合物1、化合物2、化合物3对细胞膜的作用通过细胞膜荧光探针DiSC3(5)测定。简而言之,取对数期的菌液,10000rpm离心10分钟,得到的细菌沉淀用PBS溶液洗涤3次,用PBS(10mM,pH7.4)将细菌重悬至OD
研究发现化合物1、化合物2、化合物3均对金黄色葡萄球菌、表皮葡萄球菌产生明显膜电势变化,实验结果如图3所示。
实施例六、PI摄取实验:
化合物1、化合物2、化合物3对细菌的细胞膜的破坏作用是通过使用细胞核染色试剂PI对金黄色葡萄球菌(ATCC 25923)、大肠杆菌(ATCC 25922)染色而测定的,简而言之,将生长至对数期的细菌离心得到的细菌沉淀用PBS稀释至10
实施例七、大肠杆菌外膜(OM)渗透性实验:
化合物1、化合物2、化合物3对细菌细胞外膜的破坏作用是通过使用疏水性荧光探针NPN(1-N-phenylnaphthylamine)测定化合物对大肠杆菌(ATCC 25922)外膜渗透性的影响而测定的。收集对数期的大肠杆菌,用PBS(10mM,pH7.4)重悬至OD600=0.5±0.02。将化合物溶液配制成8×MIC、16×MIC、32×MIC(终浓度为2×MIC、4×MIC、8×MIC),在96孔微量滴定黑板(Costar3925)中加入50μL化合物溶液和50μL的NPN(400μM),混匀后加入100μL菌悬液。以作为PBS作为阴性对照,多粘菌素B作为阳性对照。激发波长350nm,发射波长420nm的条件下用多功能酶标仪一分钟测定一次,连续测定14分钟。研究发现化合物1、化合物2、化合物3均能破坏大肠杆菌外膜完整性,实验结果如图5所示。
实施例八、大肠杆菌内膜(IM)渗透性实验:
化合物1、化合物2、化合物3对细菌内膜渗透性的影响是通过使用ONPG(邻硝基苯-β-D-半乳糖苷)测定大肠杆菌ML-35(ATCC 43837)胞内β-半乳糖甘酶的释放量来测定的。本实施例选取外膜缺陷的大肠肝菌ML-35,收集生长至对数期的细菌,用PBS洗涤两次后,用0.5%NaCl重悬至OD
实施例九、扫描电镜:
通过扫描电镜观察化合物1、化合物2、化合物3处理后的细菌膜状态。简而言之,将等体积的10
实施例十、血清稳定性实验:
化合物1、化合物2、化合物3的血清稳定性实验是通过高效液相色谱法测得化合物经血清处理后的浓度。简而言之,将浓度为125μg/mL的化合物与等体积的50%的大鼠血清在37℃共孵育一定时间,加入15%乙腈,冰浴15分钟,12000g高速离心10分钟后取得上清。使用高效液相色谱法分析上清液。根据空白血清,化合物对照品以及经血清处理不同时间的化合物绘制谱图,实验结果如图8所示。
以上仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
- 抗菌化合物及其制备方法、药物组合物和用途
- 取代脲化合物、其药学上可接受的盐或其溶剂合物、其应用、药物及药物组合物
- 一种抗结核化合物及其在制备抗结核药物中的应用以及一种抗结核药物组合物
- 一种索拉菲尼与青蒿素类化合物的组合药物及其在制备抗癌药物中的应用
- 4’-硫代核苷的新型化合物及其制备方法、药物组合物和应用
- 一种萘并呋喃邻醌化合物及其制备方法和应用、抗肿瘤药物组合物、抗菌药物组合物
- 一种多肽类抗肿瘤活性化合物、药物组合物及在制备抗肿瘤药物中的应用
