一种治疗恶性肿瘤且具备特异性与灵敏度的合成基因网络系统
文献发布时间:2023-06-19 19:33:46
技术领域
本发明属基因治疗技术领域,尤其涉及一种治疗恶性肿瘤的合成基因网络系统,通过该系统可以提高治疗癌症的特异性和灵敏性。
背景技术
恶性肿瘤已成为威胁人类健康的公共卫生问题,现有的治疗方法无法有效清除肿瘤细胞,导致患者预后极差。手术、化疗和放疗是传统的肿瘤治疗方法。然而手术存在特异性不足、损伤较大,且存在肿瘤细胞残留风险。传统的放疗和化疗特异性较差,对正常组织与细胞存在损伤,存在难以控制的副作用。
基因治疗为恶性肿瘤患者带来了新的希望。现有的大部分靶向治疗药物通过抑制一个肿瘤相关蛋白的表达实现肿瘤杀伤。例如,肺癌常用靶向药物EGFR拮抗剂,通过抑制EGFR功能实现癌细胞的杀伤。但是,在正常细胞内EGFR同样调节着生理活动,抑制EGFR活性后将对正常细胞、正常组织的生理活动导致影响,进而产生副作用。需要探索新型特异的肿瘤基因治疗方法。近年来,基于合成基因网络的新型肿瘤治疗方法进入了人们的视野。合成基因网络可以在细胞内感知目标生物标志物的信号,并通过内置的处理方式做出相关的响应。利用外源人工搭建的合成基因网络编辑靶细胞后,靶细胞可以感知目标生物标志物,通过胞内自身的合成系统,产生相关输出进行响应。联合两个癌症特异性转录因子构建的、具有布尔逻辑AND门运算功能的合成基因网络细胞系统可以实现肿瘤细胞的靶向杀伤。例如,联合膀胱癌特异性转录因子hUPII与癌症特异性转录因子hTERT构建的AND门基因网络系统,可以实现膀胱癌细胞与正常细胞的分选。将系统输出设置为诱导凋亡蛋白BAX后,同时导入膀胱癌细胞和正常细胞后,可实现特异性膀胱癌细胞的杀伤。但是现有用于肿瘤治疗的基因网络系统仅对系统的特异性给予充分的关注,缺乏对灵敏度的关注。由于肿瘤特异性转录因子的转录活性不足,因此AND门系统的输出水平无法得到有效的保障,在治疗场景无法有效杀伤肿瘤细胞,这将导致肿瘤细胞残留,疾病复发等严重的后果。因此,尚缺乏一种结构紧凑、兼顾特异性与灵敏度的用于肿瘤靶向治疗的合成基因网络系统的设计与构建方法。
发明内容
针对现有技术存在的问题,本发明提供了一种提高基因治疗灵敏度的合成基因网络系统,目的在于解决现有技术中的一部分问题或至少缓解现有技术中的一部分问题。
本发明的目的在于克服现有技术的缺点,提供一种治疗恶性肿瘤的同时具备特异性与灵敏度的合成基因网络系统。
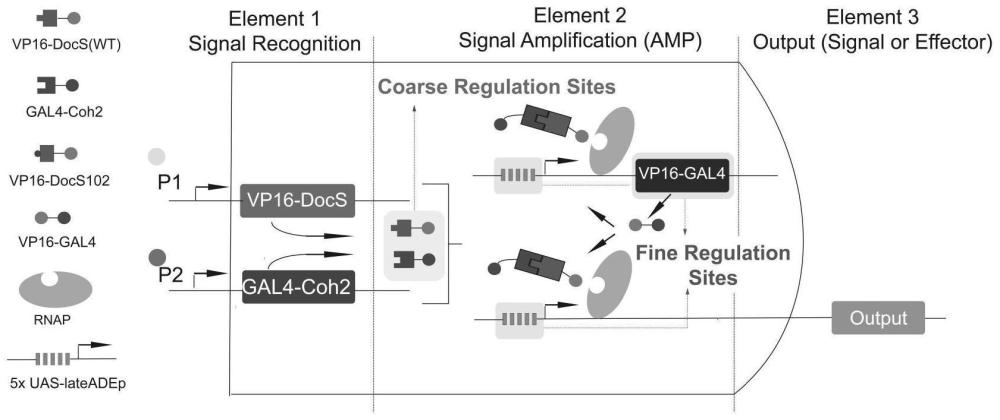
该系统包括三部分,信号识别模块:由两条并行的通路构成,分别识别两个不同的肿瘤相关转录因子,转录因子一和转录因子二,当把该系统导入细胞内,当细胞内存在转录因子一时,激活信号识别模块中的一条通路的启动子并产生VP16-DocS蛋白;当细胞中存在转录因子二时,激活信号识别模块中的另一条通路产生Gal4-Coh2蛋白。由于Coh2蛋白和DocS蛋白具有极好地亲和力,可将VP16-DocS和Gal4-Coh2结合为一体形成转录复合物VP16-DocS-Coh2-Gal4。信号识别模块中两条并行通路中的两个启动子组合可调,目的是实现多种癌症兼顾特异性与灵敏度的识别与杀伤。
以卵巢癌为例,如图2所示,当细胞内同时存在卵巢癌特异性转录因子E2F1和癌症特异性转录因子c-Myc时,二者分别激活对应的合成启动子S(E2F1)p和S(c-Myc)p。上述两启动子激活后分别产生VP16-DocS蛋白和Gal4-Coh2,进而完成下文所述的过程。将合成启动子组合调整为S(USF1)p/S(MAFK)p后,可进行乳腺癌细胞的特异性识别,从而实现系统的多病种应用。当缺少转录因子一或转录因子二任何一方时,均不能形成有效的转录复合物以激活下游的信号放大模块与信号输出模块。
信号输出模块:由5个重复的UAS序列(5x UAS)联合腺病毒最小启动子lateADEp耦合下游的效应输出分子组成。由于Gal4可特异性结合UAS位点、VP16可增强转录,因此上游形成的转录复合物VP16-DocS-Coh2-Gal4可结合本通路,激活效应分子的表达。效应分子可设置为诱导凋亡蛋白BAX及相关shRNA、抑制细胞增殖蛋白p21等。
信号放大模块:由5个重复的UAS序列(5x UAS)联合腺病毒最小启动子lateADEp并耦合转录复合物Gal4-VP16形成。信号输入模块形成的转录复合物VP16-DocS-Coh2-Gal4可结合本通路并激活下游Gal4-VP16(GV16)的表达。而GV16又可激活信号输出模块和再激活信号放大模块本身,形成自循环、正反馈的信号放大,提升系统灵敏度。
综上所述,本发明的优点及积极效果为:1系统可兼顾细胞识别的特异性与输出的灵敏性。系统联合卵巢癌特异性转录因子E2F1和肿瘤特异性转录因子c-Myc构建了AND门基因网络系统,利用AND门细胞识别特异性高的优势,加入正反馈循环信号放大模块,当且仅当细胞内同时出现E2F1和c-Myc实现细胞识别特异性与回路输出灵敏性的兼顾,有效提高了系统肿瘤治疗的效率;
2回路采用信号输入、信号放大、信号输出三模块设计,结构紧凑,仅需3.5kbp编码长度,与其它构建方法相比,结构更为紧凑;
3灵活通用。系统的输出可自由调整,实现多种类型的效应输出。输入启动子组合可调,可实现多种癌症兼顾特异性与灵敏度的识别与杀伤。
附图说明
图1A E2F1和c-Myc在卵巢癌组织中高表达,而在癌旁组织低表达
图1B E2F1和c-Myc在卵巢癌细胞SK-OV3、人胚肾细胞HEK-293T和人卵巢成纤维细胞HOF内的表达水平
图2兼顾特异性与灵敏度的用于靶向治疗卵巢癌的合成基因网络系统
图3兼顾特异性与灵敏度的诱导卵巢癌细胞凋亡的合成基因网络系统,输出BAX蛋白
图4兼顾特异性与灵敏度的抑制卵巢癌细胞增殖的合成基因网络系统,输出p21蛋白
图5用于乳腺癌细胞特异性胞内显影的合成基因网络系统,输出EBFP蛋白
图6加入信号放大元件后形成的回路SADI circuit与传统设计的DI circuit输出目的蛋白量的比较
图7加入信号放大元件后形成的回路SADI circuit与传统设计的DI circuit信号放大效果展示
图8SADI circuit荧光信号放大效果展示
图9系统特异性诱导卵巢癌细胞凋亡能力证明
图10更换输入后的SADI circuit对乳腺癌细胞特异性杀伤的展示
图11兼顾特异性与灵敏度的用于靶向治疗恶性肿瘤的通用性合成基因网络系统
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明,各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
根据本申请包含的信息,对于本领域技术人员来说可以轻而易举地对本发明的精确描述进行各种改变,而不会偏离所附权利要求的精神和范围。应该理解,本发明的范围不局限于所限定的过程、性质或组分,因为这些实施方案以及其他的描述仅仅是为了示意性说明本发明的特定方面。实际上,本领域或相关领域的技术人员明显能够对本发明实施方式作出的各种改变都涵盖在所附权利要求的范围内。
实施例1
下面结合附图及实施例对本发明做进一步的阐述。
一种治疗卵巢癌同时具备特异性与灵敏度的合成基因网络系统,该基因网络系统包括信号识别模块、信号输出模块、信号放大模块。
信号识别模块:由两条并行的通路构成,分别识别两个不同的肿瘤相关转录因子,两个转录因子分别为TF1和TF2。当系统导入细胞后,当细胞中存在TF1时,可激活信号识别模块中的一个通路表达,产生VP16-DocS蛋白;类似地,当细胞中存在TF2时,激活信号识别模块中另一个通路表达,产生Gal4-Coh2蛋白。由于Coh2蛋白和DocS蛋白具有极好地亲和力,可将VP16-DocS和Gal4-Coh2结合为一体形成转录复合物VP16-DocS-Coh2-Gal4。当缺少任何一方的输入时,均不能形成有效的转录复合物以激活下游的信号放大模块与信号输出模块。信号识别模块构成了TF1和TF2两转录因子的布尔逻辑AND门运算,保障了细胞识别的特异性。以卵巢癌为例,经GEO数据库数据生物信息学分析发现,E2F1和c-Myc在卵巢癌组织中高表达,而在癌旁组织低表达(附图1A)。进一步地,PCR分析结果提示卵巢癌细胞SK-OV3中转录因子E2F1和c-Myc表达水平较高,而人胚肾细胞HEK-293T和卵巢成纤维细胞HOF内的表达水平较低(附图1B)。因而选择转录因子E2F1和c-Myc作为信号识别模块的输入。如图2所示,当细胞内同时存在卵巢癌特异性转录因子E2F1和癌症特异性转录因子c-Myc时,二者分别激活对应的合成启动子S(E2F1)p和S(c-Myc)p。上述两启动子激活后分别产生VP16-DocS蛋白和Gal4-Coh2。
信号输出模块:由5个重复的UAS序列耦合下游的效应输出分子组成。由于Gal4可特异性结合UAS位点、VP16可增强转录,因此上游形成的转录复合物VP16-DocS-Coh2-Gal4可结合本通路,激活效应分子的表达,效应分子可设置为增强型蓝色荧光蛋白EBFP,以实现肿瘤细胞特异性显影;也可将输出设置为诱导凋亡蛋白BAX、诱导凋亡效应的Bcl-2shRNA,二者可发挥协同作用,增强诱导肿瘤细胞凋亡的效果,如附图3所示;效应分子还可以抑制细胞增殖蛋白p21,如附图4所示。
信号放大模块:由5个重复的UAS序列(5x UAS)耦合转录复合物Gal4-VP16形成。信号输入模块形成的转录复合物VP16-DocS-Coh2-Gal4可结合本通路并激活下游Gal4-VP16(GV16)的表达。而GV16又可激活信号输出模块和再激活信号放大模块本身,形成自循环、正反馈的信号放大,提升系统灵敏度。
通过治疗卵巢癌的具备特异性与灵敏度的合成基因网络系统可实现卵巢癌细胞与正常细胞的特异性筛选。
向卵巢癌细胞SK-OV3、人胚肾细胞HEK-293T和卵巢成纤维细胞内转入如图2所示的合成基因网络系统。当图2所示的合成基因网络系统中的信号输出模块输出的是EBFP即增强型蓝色荧光蛋白时,得到图6、图7、图8所示的实验结果。
如图6所示,加入信号放大元件后形成的回路(SADI circuit)在卵巢癌细胞SK-OV3内能够有效输出荧光蛋白,而在正常细胞HEK-293T和卵巢成纤维细胞HOF内无法有效输出荧光蛋白。SK-OV3组的荧光强度分别是HEK-293T组和HOF组的16.1倍和7.5倍。联合两个转录因子的合成基因网络系统可保证输出特异性。
治疗卵巢癌的具备特异性与灵敏度的合成基因网络系统较之前技术相比能有效地放大输出信号水平。
与传统设计的DI circuit相比,本发明设计的新型合成基因网络系统SADIcircuit可有效放大信号,提升体系的灵敏度。如图7、8所示,在系统转入后72h,可放大信号约9.8倍。
更改合成基因网络系统输出为诱导凋亡蛋白BAX后,可实现卵巢癌细胞特异性杀伤。
如图9所示,将合成基因网络系统输出更改为BAX,转入SK-OV3、HEK-293T和HOF。利用CCK-8方法评估转入后细胞活力,提示系统可特异性杀伤卵巢癌细胞。以HOF的OD值作为参照进行了标化。
实施例2
另外,为了证明系统的灵活可调性,经过文献调研(Cell.2017Nov16;171(5):1138-1150.e15.)后,我们将信号输入模块的输入调整为乳腺癌特异性转录因子组合USF1/MAFK,进行了实验(附图5)。如附图10所示,把治疗卵巢癌的合成基因网络系统中的信号识别模块调整为识别两个转录因子MAFK/USF1,即将合成启动子组合调整为S(USF1)p/S(MAFK)p后,可进行乳腺癌细胞的特异性识别。将输出效应产物设置为诱导凋亡蛋白hBAX,CCK-8实验数据提示系统可实现乳腺癌细胞的特异性选择与杀伤。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 用于恶性肿瘤基因治疗的增殖和肿瘤细胞特异性基因操纵系统
- 用于恶性肿瘤基因治疗的增殖和肿瘤细胞特异性基因操纵系统
