一种多肽及其应用
文献发布时间:2024-01-17 01:16:56
技术领域
本发明属于生物医药技术领域,尤其涉及一种多肽及其应用。
背景技术
银屑病是一种常见的慢性炎症性皮肤病,影响世界人口的0.1-3%。该病顽固性强,反复发作,难以治愈。银屑病发病的免疫学机制备受关注。银屑病是一种慢性炎症性疾病,银屑病病变是通过角质形成细胞和免疫细胞的相互作用形成的。人角质细胞增生异常是银屑病的重要特征。角质形成细胞的过度增生和异常分化是形成表皮肥大和角化不全的典型组织病理学基础。
发明内容
本发明的目的在于克服上述现有技术的不足之处而提供一种多肽及其应用。
为实现上述目的,在本发明的第一方面,本发明提供了一种银屑病诊断和/或预后评估的标记物,其特征在于,所述标记物为多肽N11,所述多肽N11的序列为:PKRGDECRECG。
发明人前期研究发现,Notch信号通路在哺乳动物细胞系统中主要在细胞分化、增殖和凋亡中起重要作用,并与炎症有关,该通路在许多炎症性疾病中都很活跃,包括银屑病、类风湿性关节炎和系统性红斑狼疮;Notch通过三步蛋白酶切水解,把有激活转录调节活性的Notch蛋白片段NICD或ICN)释放出来,再与转录因子CSL结合,调节下游Hes1、Hes5、Hey1等基因表达,促进表皮增生,因此在银屑病病变患者中的Hes1、Hes5、Hey1表达明显上调;Notch蛋白是细胞表面的跨膜蛋白,广泛存在于外周免疫系统的不同细胞中;特别是,该蛋白在外周血CD4
本发明提供的多肽N11可以通过采用现有技术常用的方法,如公知的化学合成法、遗传工程学的合成法等进行合成制备。
在本发明的第二方面,本发明提供了一种检测多肽N11的表达水平的试剂在制备诊断和/或预后评估银屑病的产品中的应用。
作为本发明所述应用的优选实施方式,所述产品包括试剂盒、芯片、核酸膜条。
在本发明的第三方面,本发明提供了一种诊断和/或预后评估银屑病的试剂盒,所述试剂盒包括检测多肽N11表达水平的试剂。
在本发明的第四方面,本发明提供了一种组合物在制备预防和/或治疗银屑病药物中的应用,所述组合物包括有效量的多肽N11表达促进剂。
在本发明的第五方面,本发明提供了一种预防和/或治疗银屑病的药物,所述药物包括多肽N11。
作为本发明所述药物的优选实施方式,所述药物的给药剂量为按每kg给药对象施加多肽N11的剂量为0.01μg~100μg计。
优选地,所述药物的给药剂量为按每kg给药对象施加多肽N11的剂量为20μg计。
作为本发明所述药物的优选实施方式,所述药物的剂型为喷雾剂、口服剂、搽剂。
优选地,当所述药物的剂型为喷雾剂时,将喷雾剂与生理盐水混合后使用。
作为本发明所述药物的优选实施方式,所述药物还包括药学上可接受的辅料。
在本发明的第六方面,本发明提供了一种预防和/或治疗银屑病的药物组合物,所述药物组合物包括多肽N11,和临床上常用的治疗银屑病的药物。
作为本发明所述药物组合物的优选实施方式,所述临床上常用的治疗银屑病的药物包括口服剂和外用剂。
示例性的,所述口服剂可为复合维生素B、维生素C、芦丁片、氯雷他定、西替利嗪、氯苯那敏;所述外用剂可为糖皮质激素类、维生素D3类、角质促成药、钙调磷酸酶抑制剂类。
与现有技术相比,本发明的有益效果为:
本发明发现多肽N11在银屑病患者中低表达,多肽N11可作为银屑病诊断和/或预后评估的标记物,进而作为相关试剂盒和检测方法的检测靶点,可应用于制备用于银屑病的诊断、风险评估或预后评估的试剂盒或检测试剂中;并且本发明发现多肽N11可应用于预防和/或治疗银屑病的药物的制备上,以其为药物时能够通过Notch信号通路抑制银屑病病发,用药后可明显抑制小鼠背部表皮CD3
附图说明
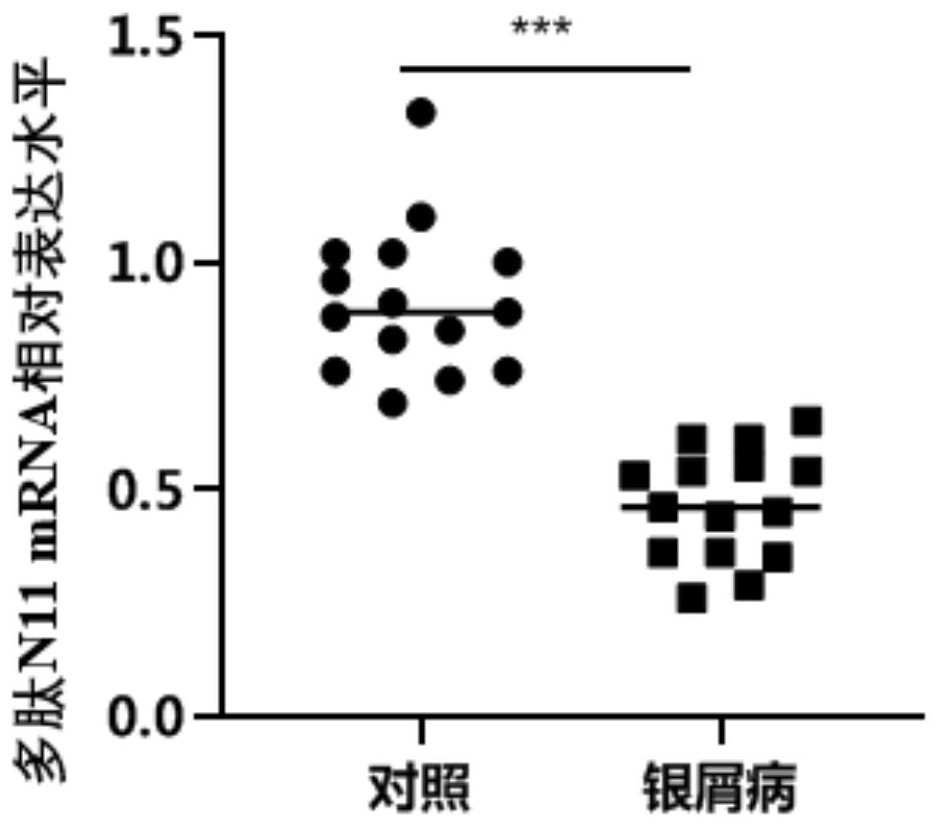
图1为实施例1中多肽N11在正常志愿者和银屑病患者皮损处的表达结果图;
图2为实施例2体外研究多肽N11与Notch信号通路的关系结果图:
A为HaCaT细胞中多肽N11表达结果图;
B为Notch信号通路下游基因Hes1、Hes5和Hey1的mRNA表达结果图;
C为HaCaT细胞增殖结果图;
D为HaCaT细胞增殖结果图;
图3为实施例3给药浓度和给药方式结果图:
A为喷雾给药方式的PASI评分结果图;
B为灌胃给药方式的PASI评分结果图;
C为喷雾给药和灌胃给药方式对比结果图;
图4为实施例4治疗结果图:
A为多肽治疗银屑病模型小鼠K6、K16、K17表达结果图;
B为多肽治疗银屑病模型小鼠CD3
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
本发明所采用的试剂、方法和设备,如无特殊说明,均为本领域常规试剂、方法和设备。
实施例1
本发明实施例探究多肽N11在银屑病患者和正常志愿者皮肤组织中的表达,具体为:从临床样本中筛选合格的银屑病患者及正常对照样本,所有银屑病患者均根据临床症状进行诊断,且术前至少4周未接受任何全身治疗;健康对照个体没有银屑病或其他自身免疫性疾病的阳性家族史。收取银屑病患者的皮损处和健康对照的皮肤组织进行RNA提取,检测多肽N11的mRNA的表达;检测过程具体包括以下步骤:
(1)RNA提取
将新鲜皮肤组织用0.4%的消化酶进行真表皮分离,对表皮进行剪碎后加入Trizol进行总RNA提取;
(2)反转录
定量后,使用iScript™ cDNA试剂盒在37°C下逆转录到cDNA的第一链中,在15°C下储存85分钟,在5°C下逆转录4秒;
(3)实时荧光定量
使用iTaq™ SYBR-Green定量后进行反转录成cDNA,20℃保存,β-肌动蛋白被用作内部对照,用于RT PCR检测;热循环条件如下:初始预变性在95°C下1分钟,变性15秒,在57°C下退火20秒,在72°C下延伸30秒;总共进行了50个循环。根据PCR产物的Cq值和相对标准曲线,测定每个标本中所含多肽N11 RNA模板的量,并与β-肌动蛋白的量进行比较。采用RNA模板量与β-肌动蛋白量的具体值作为最终统计值,结果使用2
(4)统计学处理
用软件GraphPad Prism 8.3.0处理并分析数据,用One-way ANOVA进行方差分析,采用Tukey’s Multiple-Comparison Test分析不同组之间的差异,数据以平均数±标准差(x ± SD)表示,*表示P<0.05、**表示P<0.01、***表示P<0.001具有显著性差异。
上述实验得到的结果如图1所示,从图1中可以看出,通过RT-PCP的方法评估了在正常对照组织与银屑病皮损组织的多肽N11 mRNA水平表达,发现相比正常皮组织,多肽N11mRNA在银屑病皮损处的表达呈极显著降低,表明多肽N11在银屑病表皮中的表达较低。
实施例2
本发明实施例进行体外研究多肽N11与Notch信号通路的关系,具体包括以下步骤:
(1)铺板
复苏冻存的人永生化角质形成细胞(HaCaT细胞),接种于培养瓶养至对数生长期,用胰酶消化计数后,取出所需细胞量,用完全培养基(RPMI-1640培养基含10%胎牛血清和1%链霉素-青霉素)将细胞数调整至6×10
(2)抑制剂处理
1. 用N11 siRNA(N11 inhibitor)(50nM)转染6孔板细胞,当细胞汇合度约50%时,加入10uL N11 siRNA(5μM)和siRNA NC(5μM),加入转染试剂A液70μL,吹打混匀,加入转染试剂B液20μL,混合均匀,室温放置5min,加培养液900μL,吹打混匀。将N11 siRNA和siRNANC转染复合液分别加入抑制剂组,各做3个孔,无药物刺激的3个空白孔为对照(Ctr),将细胞培养板置于二氧化碳培养箱中孵育42h;
2. 用含有不同浓度的Notch信号通路的抑制剂DAPT(2、10和15 μM)和N11 siRNA(N11 inhibitor)(10、25和50 μM)处理细胞,各浓度做3个孔,无药物刺激的3个空白孔为对照(Ctr),3个盐水处理和3个无细胞本底孔,将细胞培养板置于二氧化碳培养箱中孵育42h;
(3)细胞相对存活率
于孵育后的0h、24h、48h和72h取出上述96孔细胞培养板,用含有10%CCK-8染料的无血清培养基替换完整的培养基,并将细胞再培养1小时,取出上述细胞培养板,放入酶标仪中,在波长450nm处测定吸光度,记录测定结果;细胞存活率 =[(加药细胞OD-本底OD)/(盐水细胞OD-本底OD)]-1,盐水处理组中活细胞的存活定义为100%,结果表示为相对于对照值的比值;
(4)RT-PCR检测
将上述6孔细胞培养板中细胞取出,后加入Trizol进行总RNA提取。同实施例1的步骤(2)、步骤(3):测定每个标本中所含多肽N11、Hes1、Hes5和Hey1 RNA模板的量,并与β-肌动蛋白的量进行比较。采用RNA模板量与β-肌动蛋白量的具体值作为最终统计值,结果使用2
(5)统计学处理
同实施例1中的统计学处理。
上述实验得到的结果如图2的A-图2的D所示,从图2的A-图2的D中可以看出,多肽N11抑制剂显著抑制了HaCaT细胞中多肽N11的表达(图2的A);抑制48小时后,细胞中Notch信号通路下游基因(Hes1、Hes5和Hey1)的mRNA显示表达上调(图2的B),同时细胞增殖显著(图2的C);当Notch信号通路与多肽N11同时被抑制时,HaCaT细胞的增殖受到抑制(图2的D)。体外研究表明在多肽N11被抑制后,Notch信号通路下游基因(Hes1、Hes5和Hey1)的mRNA表达上调,表明多肽N11抑制后Notch信号通路被激活,从而促进HaCaT细胞的增殖。
实施例3
本发明实施例进行给药浓度和给药方式的探究,具体包括以下步骤:
(1)实验分组及处理
采用雌性8-12周龄SPF级C57BL/6小鼠进行实验;造模小鼠用剃刀刮除背部皮肤被毛,形成约3x2cm的裸露皮肤区域;同时将上述小鼠分为4组,分别为:
喷雾治疗组:采用0μg/kg(0.9%生理盐水)、0.01μg/kg、0.1μg/kg,1μg/kg、20μg/kg、100mg/kg的用药浓度,每个剂量组有4只造模小鼠,给予造模小鼠背部皮肤进行多肽N11喷雾处理,2小时后,再于背部裸露皮肤区域涂抹浓度为0.5%的咪喹莫特乳膏(30mg/d),持续喷雾、涂抹7天;
灌胃治疗组:采用0μg/kg(0.9%生理盐水)、0.01μg/kg、0.1μg/kg,1μg/kg、20μg/kg、100mg/kg的用药浓度,每个剂量组有4只造模小鼠,给予造模小鼠进行多肽N11灌胃处理,2小时后,再于背部裸露皮肤区域涂抹浓度为0.5%的咪喹莫特乳膏(30mg/d),持续灌胃、涂抹7天;
模型组(IMQ):于4只造模小鼠背部裸露皮肤区域涂抹浓度为0.5%的咪喹莫特乳膏(30mg/d),持续涂抹7天;
空白组(Ctr):于4只正常小鼠背部皮肤区域涂抹浓度为0.5%的咪喹莫特乳膏(30mg/d),持续涂抹7天。
(2)观察与评分
造模后第1/3/5/6天对小鼠观察并根据银屑病面积和严重程度指数(psoriasisarea and severity index,PASI)对小鼠皮损处的厚度、红斑状况、银屑状况进行评分。PASI评分标准为:0~4分,分别对应破损程度无、轻度、中等、严重和极严重;总分为厚度、红斑、鳞屑3项评分之和(0~12分),分别统计每只小鼠的评分,得分越高,病症越严重。
(3)统计学处理
将得到的数据进行分析整理,得图3的A-图3的C;从图3的A和图3的B可见,采用喷雾方式治疗的模型小鼠,多肽N11的浓度为20μg/kg-100μg/kg处理后明显抑制了小鼠的银屑病病发;采用灌胃方式治疗的模型小鼠,多肽N11的浓度为0.1μg/kg-20μg/kg处理后明显抑制了小鼠的银屑病病发;两种方式均可明显减轻银屑病炎症,且皮肤光滑,恢复良好。通过对喷雾组和灌胃组比较可知(图3的C),与20μg/kg浓度的喷雾治疗组相比,20μg/kg浓度的灌胃治疗组于造模后7天的恢复最好,无皮屑、无红肿,炎症明显减轻。
实施例4
本发明实施例进行动物治疗分析,具体包括以下步骤:
(1)实验分组及处理
采用雌性8-12周龄SPF级C57BL/6小鼠进行实验;造模小鼠用剃刀刮除背部皮肤被毛,形成约3x2cm的裸露皮肤区域;具体分为三组:
空白组(对照组、Ctr):采用0.9%生理盐水给4只正常小鼠进行灌胃处理,持续处理7天;
模型组(处理组、IMQ):采用0.9%生理盐水给4只模型小鼠进行灌胃处理,2小时后,再于背部裸露皮肤区域涂抹浓度为0.5%的咪喹莫特乳膏(30mg/d),持续处理、涂抹7天;
多肽N11治疗组(多肽治疗组、N11+IMQ):采用20μg/kg的用药浓度给与4只模型小鼠进行多肽N11灌胃处理,2小时后,再于背部裸露皮肤区域涂抹浓度为0.5%的咪喹莫特乳膏(30mg/d),持续灌胃、涂抹7天。
(2)Western blot检测
将三组小鼠背部皮肤组织中角蛋白Keratin6,Keratin16,Keratin17蛋白表达量从液氮中取出冻存的小鼠皮肤标本,用眼科剪将组织剪成细小的碎片并用组织匀浆器匀浆,采用RIPA裂解液于冰上提取皮肤组织蛋白,蛋白浓度均在50~2000µg/mL范围内。取50µg总蛋白变性后,根据SDS-PAGE凝胶试剂盒恒压电泳,将电泳产物转移至聚偏二氟乙烯膜,于含5%脱脂奶粉的TBST缓冲液中封闭2h,TBST溶液洗膜3次后滴加一抗,分别为兔抗鼠单克隆抗体Keratin6,Keratin16,Keratin17和GAPDH,稀释比例均为1:10000,4℃过夜;TBST缓冲液洗膜4次,每次10 min,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶1000),室温孵育1h;TBST洗膜4次,每次10min。按增强型ECL化学发光试剂盒说明书显色,在自动电泳凝胶成像分析系统下自动成像。实验重复3次。应用Image J软件分析目的蛋白条带的灰度值,以GAPDH为内参,目的蛋白的相对表达量=目的蛋白灰度值/ GAPDH灰度值。
(3)流式细胞术检测
提取三组小鼠背部皮肤组织,制备成单细胞,加30 μL小鼠血清混匀,于4°C静置30mim,每管加0.01 μL PE-CD3和0.02μL APC-CD4混匀,于4°C静置30 mim,每管加1mL PBS,离心6000 rpm,2 min,流式细胞仪上机检测。用Flowjo 7.6软件进行小鼠背部皮肤T淋巴细胞亚群的分析。
(4)统计学处理
将结果进行分析整理,从结果中可以看出,从第5天开始,接受多肽N11处理的小鼠的背部表皮厚度均显著变薄,通过Western Blotting检测后发现(图4的A),小鼠耳朵的厚度和银屑病增殖相关的角蛋白Keratin6(K6),Keratin16(K16),Keratin17(K17)在多肽N11处理后表达明显降低,说明多肽N11可以抑制角蛋白增殖,从而抑制银屑病表型,证实了多肽N11在银屑病发病机制中的保护作用;同时从图4的B中可以看出,多肽N11处理后可明显抑制小鼠背部表皮CD3
最后应当说明的是,以上实施例以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 一种多肽组件复合物、多肽组件双层片及制备工艺和应用
- 一种多肽、多肽组合物在治疗结肠癌中的应用
- 一种用于氨基酸环内酸酐开环聚合制备多肽的催化剂及利用该催化剂制备多肽的方法
- 一种用于多肽类药物合成的多肽缩合剂及其制备方法
- 一种多肽和多肽的应用及包含多肽的组合物
- 一种双效应防龋多肽、多肽衍生物、多肽可药用盐及应用
