一种α-L-阿拉伯呋喃糖苷酶及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及基因工程技术领域,具体涉及一种α-L-阿拉伯呋喃糖苷酶及其应用。
背景技术
由于动物摄食的复杂性,使动物胃肠道内存在的微生物具备降解食物中的纤维素、半纤维素、果胶和蛋白质等物质的功能。因此,动物胃肠道蕴含有丰富的微生物酶类基因资源。然而,通过传统的纯培养微生物来筛选新型酶技术大大限制了筛选的广泛性、有效性和安全性。宏基因组学技术避开微生物分离培养的问题,极大地扩展了微生物资源的利用空间,为寻找和发现新型酶提供了新的研究策略。
α-L-阿拉伯呋喃糖苷酶(α-L-arabinofuranosidase,EC3.2.1.55)具有多种用途,能催化木聚糖末端和非还原端α-(1,2)、α-(1,3)或α-(1,5)-阿拉伯呋喃糖基键的裂解,从木聚糖主链中去除侧链残基,协同其他半纤维素酶系完成木聚糖的完全水解。然而,现有的α-L-阿拉伯呋喃糖苷酶比活性较低,且对特殊环境的耐受性较差,尤其对高盐和高乙醇等环境的耐受性较差,大大限制了α-L-阿拉伯呋喃糖苷酶的应用。
发明内容
本发明的目的是提供一种具有高乙醇耐受性和高盐耐受性的α-L-阿拉伯呋喃糖苷酶,其氨基酸序列如SEQ ID NO.4所示,该酶在乙醇环境中具有较高酶活,在饲料加工、食品加工等领域具有潜在的应用价值和应用潜力。
为了达到上述目的,本发明提供了一种α-L-阿拉伯呋喃糖苷酶,该酶的氨基酸序列如SEQ ID NO.4所示,该酶对乙醇具有高耐受性,在30%的乙醇下耐受1h后还具有68%的活性。
本发明还提供了上述α-L-阿拉伯呋喃糖苷酶的编码基因,其核苷酸序列如SEQ IDNO.3所示。
本发明还提供了一种包含上述α-L-阿拉伯呋喃糖苷酶编码基因的重组表达载体,该载体采用pEASY-E2。
本发明还提供了一种包含上述α-L-阿拉伯呋喃糖苷酶编码基因的重组菌,该重组菌采用大肠杆菌BL21(DE3)。
本发明还提供了一种上述α-L-阿拉伯呋喃糖苷酶的制备方法,包含如下步骤:
(1)对西黑冠长臂猿粪便微生物提取宏基因组DNA;
(2)采用核苷酸序列如SEQ ID NO.1和SEQ ID NO.2所示的引物,以步骤(1)的基因组DNA为模板进行PCR扩增;
(3)将步骤(2)所得的扩增产物与质粒pEASY-E2进行连接得到重组表达载体,并将该重组表达载体转入大肠杆菌BL21(DE3)中,得重组菌;
(4)对步骤(3)所得的重组菌进行培养,经IPTG诱导,收集菌体并超声破碎,收集上清并用Nickel-NTAAgarose纯化,即得α-L-阿拉伯呋喃糖苷酶。
本发明提供的α-L-阿拉伯呋喃糖苷酶可被应用于饲料加工领域中。
本发明提供的α-L-阿拉伯呋喃糖苷酶可被应用于食品加工领域中,尤其可用于葡萄酒的风味改善。
本发明的α-L-阿拉伯呋喃糖苷酶及其应用,具有以下优点:
本发明所述的α-L-阿拉伯呋喃糖苷酶的最适pH为6.0;在pH6.0-9.0范围内处理1h后,剩余酶活90%以上;最适温度为55℃,在30℃、37℃、45℃、50℃、55℃条件下耐受1h后,剩余酶活在65%以上。在55℃下具有最好热稳定性;在pH6.0,温度55℃条件下,该酶的K
附图说明
图1为本发明中在大肠杆菌中表达的重组α-L-阿拉伯呋喃糖苷酶的SDS-PAGE结果。
图2为本发明中提供的α-L-阿拉伯呋喃糖苷酶的最适温度测定结果。
图3为本发明中提供的α-L-阿拉伯呋喃糖苷酶的温度稳定性测定结果。
图4是本发明中提供的α-L-阿拉伯呋喃糖苷酶的最适pH测定结果。
图5是本发明中提供的α-L-阿拉伯呋喃糖苷酶的pH稳定性测定结果
图6是本发明中提供的α-L-阿拉伯呋喃糖苷酶受NaCl的影响测定结果。
图7是本发明中提供的α-L-阿拉伯呋喃糖苷酶对NaCl的耐受测定结果。
图8是本发明中提供的α-L-阿拉伯呋喃糖苷酶受木糖和阿拉伯糖影响的测定结果。
图9是本发明中提供的α-L-阿拉伯呋喃糖苷酶对木糖和阿拉伯糖耐受的测定结果。
图10是本发明中提供的α-L-阿拉伯呋喃糖苷酶受乙醇影响的测定结果。
图11是本发明中提供的α-L-阿拉伯呋喃糖苷酶对乙醇耐受的测定结果。
图12是本发明中提供的α-L-阿拉伯呋喃糖苷酶和商业木聚糖酶协同降解木聚糖的效果测定结果。
图13是本发明中提供的α-L-阿拉伯呋喃糖苷酶和商业木聚糖酶协同降解木聚糖的薄层层析分析情况。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明用到的部分试验材料和试剂如下:
1、菌株及载体:载体pEASY-E2、BL21(DE3)购自北京擎科新业生物技术有限公司。
2、基因工程操作酶类、试剂盒及其他生化试剂:限制性内切酶、DNA聚合酶、连接酶购自TaKaRa公司,质粒提取试剂盒、胶回收纯化试剂盒为美国Omega公司;其他试剂均为分析纯。
3、LB培养基:Peptone 10g,Yeast extract 5g,NaCl 10g,加蒸馏水至1000ML,pH自然(约为7)。固体培养基在以上基础上加2.0%(w/v)琼脂。
说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)J.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
实验例1α-L-阿拉伯呋喃糖苷酶基因AbfNC2b_38的获得
1.西黑冠长臂猿粪便微生物宏基因组α-L-阿拉伯呋喃糖苷酶基因的筛选
从西黑冠长臂猿粪便微生物宏基因组(基因组提取方法参照公开号为CN102586234B的专利中的方法)中根据基因预测、功能注释和分泌蛋白预测分析结果,筛选注释结果为α-L-阿拉伯呋喃糖苷酶的基因。从而得到α-L-阿拉伯呋喃糖苷酶基因AbfNC2b_38。
2.α-L-阿拉伯呋喃糖苷酶基因AbfNC2b_38的克隆
提取西黑冠长臂猿粪便微生物宏基因组DNA,采用引物AbfNC2b_38-F和AbfNC2b_38-R(具体序列如下所示)以提取的基因组DNA为模板进行PCR扩增。其中,PCR反应体系为10.0μL:宏基因组DNA0.5μL,PrimeSTAR Max 5μL,AbfNC2b_38-F 0.5μL,AbfNC2b_38-R0.5μL,ddH
上述扩增所用的引物序列如下所示(5’→3’):
AbfNC2b_38-F(SEQ ID NO.1):
TAAGAAGGAGATATACATATGGAATTGATGTATCGTTTGTATACTAAC;
AbfNC2b_38-R(SEQ ID NO.2):
GTGGTGGTGGTGGTGCTCGAGCTCCTCCGCACTCACGGCAAG。
基因AbfNC2b_38(SEQ ID NO.3)的核苷酸序列如下所示(5’→3’):
ATGTATCGTTTGTATACTAACCCCAAAGAAAAAATGGGACATATCAGCAAGGAGCTGCAGGGGCATTTTTCGGAGCATCTGGGAAGGTGCATTTATGAAGGCATTTATGTGGGAGAAAATTCCCCCATCCCCAATGAAAACGGCATGCGGAAGGATGTTGTAAAGGCGCTGCGGGAAATGGGCATTCCGGTGCTCCGGTGGCCGGGCGGCTGCTTTGCTGACGAATACCACTGGATGGACGGCGTGGGTCCCAAAAACGGAAGAAAGAAAATGATAAACACCCACTGGGGCGGCGTGGTCGAGGACAACAGCTTCGGAACGGACGAATATATGGAGCTTTGCAGACAGCTTGGCTGCAAGACTTATGTAAACGGCAACCTGGGCAGCGGCACTGTACGGGAAATGAGCGAATGGGTGGAATATATGACGCTGGACGGCGTTTCCCCCATGGCGGATGTCAGAAAGAAGAACGGACATGAGGAGCCTTACCGGGTGGATTATTTTGGTGTGGGCAATGAAAGCTGGGGCTGCGGCGGCAATATGAACCCGGAGTTCTACGGCAATCTGTATAGGCAGTACCAGACCTATGTGCGCAATTACCAGCCCGACCGCCCTATTCAGAAAATTGCCTGCGGACCGAACGCGGACGATTACAACTGGACGGAAGAAGTGCTAAAAACCACGCACAAGGGAAATCCGTTGGCGCATGGCTTTATGGATGGGCTTTCCCTGCATTACTATACAGTACCCCACGACTGGGAACACAAGGGCAGCGCCACGGACTTTGACGAAAAAGAATGGTATCTTACCTTAAAGAAAACCCTTTATATGGAAGAACTCTTAAAAAGACATTCGGCGATAATGGATAAATATGATCCGGAGAAAAAGATCGGGCTTATTGTGGATGAATGGGGCACCTGGTACGACTGCGAGCCGGGCACCAATCCCGGATTTTTATACCAGCAGAACACCATGCGGGATGCACTCGTGGCAGGCATTAACTTAAACCTTTTCAACAAGCACTGCGACAGGGTAAAAATGGCAAACATTGCGCAGCTTGTGAATGTGCTGCAGGCAGTAATCCTGACGGAAGGGGAAAAGATGCTTCTTACTCCGACCTATCATGTGTTCAAAATGTACCGCTGTCATCAGGATGCCGAGCTTCTGCACAGTAGTCTGGAAACGGAGCTTATCGGCGCGGAGGAAAAAAACAGGGTGCCGAACTTAAGCGAGTCCGTATCCCTGGGAACGGACGGAAAAATTCATATTACCCTGAATAATCTGTCCGTAAACGAGGATTATGAAATAGAGGCGGTATTTGCGGAAACGGCACTAAAGGCGGTGGAAGGAGAAATTCTTACGGGAAATTTTGCCGCGCACAATACCTTTGCAAATCCGAACACCGTGCATACGGAGAGCTTTACGGGAGCAGACATACTGGACAATAAAATAAAATTTACCGTTCCGGCATGCAGTGTGCTGCATCTTGCCGTGAGTGCGGAGGAGTAA。
实验例2α-L-阿拉伯呋喃糖苷酶ABFNC2B_38的制备
通过常规构建方法,将实验例1中得到的基因序列与质粒pEASY-E2连接,得到重组表达载体pEASY-E2-AbfNC2b_38,然后转化大肠杆菌BL21(DE3)获得重组大肠杆菌菌株BL21(DE3)/AbfNC2b_38。取含有重组表达载体pEASY-E2-AbfNC2b_38的重组菌BL21(DE3)/AbfNC2b_38,以0.1%的接种量接种于LB(含100μg/mL的Amp)培养液中,37℃180rpm/min下过夜培养。然后将培养的菌液以1%接种量接种到新鲜的LB(含100μg/mL的Amp)培养液中,37℃180rpm/min下培养2~3h(OD
α-L-阿拉伯呋喃糖苷酶的氨基酸序列如下所示(SEQ ID NO.4):
MYRLYTNPKEKMGHISKELQGHFSEHLGRCIYEGIYVGENSPIPNENGMRKDVVKALREMGIPVLRWPGGCFADEYHWMDGVGPKNGRKKMINTHWGGVVEDNSFGTDEYMELCRQLGCKTYVNGNLGSGTVREMSEWVEYMTLDGVSPMADVRKKNGHEEPYRVDYFGVGNESWGCGGNMNPEFYGNLYRQYQTYVRNYQPDRPIQKIACGPNADDYNWTEEVLKTTHKGNPLAHGFMDGLSLHYYTVPHDWEHKGSATDFDEKEWYLTLKKTLYMEELLKRHSAIMDKYDPEKKIGLIVDEWGTWYDCEPGTNPGFLYQQNTMRDALVAGINLNLFNKHCDRVKMANIAQLVNVLQAVILTEGEKMLLTPTYHVFKMYRCHQDAELLHSSLETELIGAEEKNRVPNLSESVSLGTDGKIHITLNNLSVNEDYEIEAVFAETALKAVEGEILTGNFAAHNTFANPNTVHTESFTGADILDNKIKFTVPACSVLHLAVSAEE。
对上述的纯化目的蛋白进行SDS-PAGE分析,结果如图1所示,其中,M为蛋白质Marker;泳道1为纯化的重组α-L-阿拉伯呋喃糖苷酶;泳道2为未纯化的重组α-L-阿拉伯呋喃糖苷酶;泳道3为仅含有pEASY-E2载体的大肠杆菌诱导后的初酶。由图1可知,重组的α-L-阿拉伯呋喃糖苷酶在大肠杆菌中得到了表达,经Nickel-NTAAgarose纯化后为单一条带。
实验例3α-L-阿拉伯呋喃糖苷酶ABFNC2B_38的性质测定
对实验例2中得到的α-L-阿拉伯呋喃糖苷酶的性质进行测定,酶活性测定方法参照彭程等(彭程,et al.,2021):将25μL 2mmol/L的对硝基苯基-α-L-阿拉伯呋喃糖苷(pNPA)与50μL 100mmol/L的pH 6.0的醋酸钠缓冲液混合,在55℃下预热5min,加入25μL稀释适当倍数的酶,反应15min,用100μL1mol/L的Na
1.α-L-阿拉伯呋喃糖苷酶的最适温度及温度稳定性测定
酶的最适温度测定:将实验例2纯化的α-L-阿拉伯呋喃糖苷酶ABFNC2B_38在pH5.0,于20-80℃下进行酶促反应,并测定相对酶活,其最适温度测定结果如图2所示。
酶的温度稳定性测定:将同样酶量的酶液置于设定的温度(30、37、45℃、50℃、55℃、60℃)中处理1h,每隔10分钟在pH 5.0及55℃下进行酶促反应,以未处理的酶液作为对照,并测定相对酶活,其温度稳定性测定结果如图3所示。
综合图2和图3可知,α-L-阿拉伯呋喃糖苷酶的最适温度为55℃,在30、37、45、50、55℃条件下相对酶活保持稳定。
2.α-L-阿拉伯呋喃糖苷酶的最适pH和pH稳定性的测定
酶的最适pH测定:在55℃、pH3-pH13的缓冲液中进行酶促反应,并测定相对酶活,结果如图4所示。
酶的pH稳定性测定:将纯化的酶液置于pH3.0-12.0的缓冲液中,在37℃下处理1h后进行酶促反应,以未处理的酶液作为对照,并测定相对酶活,结果如图5所示。
缓冲液为:0.2mol/L醋酸-醋酸钠缓冲液(pH3.0-7.0);0.2mol/L甘氨酸-氢氧化钠缓冲液(pH8.0-12.0)。以pNPA为底物,反应15min,测定纯化的α-L-阿拉伯呋喃糖苷酶的酶学性质。
综合图4和图5可知,α-L-阿拉伯呋喃糖苷酶的最适pH为6.0;经pH6.0-9.0的缓冲液处理1h后,相对酶活保持90%以上。
3.不同金属离子及化学试剂对α-L-阿拉伯呋喃糖苷酶活力影响测定
在酶促反应体系中加入金属离子和化学试剂,使其终浓度分为1mM和1%(V/V),研究其对酶活的影响。在55℃,pH 6.0条件下,测定酶活(同样条件下以未加金属离子及化学试剂的酶促反应作为对照),结果见下表1。
表1.金属离子和化学试剂对酶活性的影响
由表1可知,Li
4.α-L-阿拉伯呋喃糖苷酶的动力学参数测定
动力学参数在pH6.0、温度55℃和一级反应时间下以不同浓度的pNPA为底物(0.1-1.8mM)进行测定,根据Lineweaver-Burk法计算出Km和Vmax值。经测定,在pH6.0及温度55℃条件下该酶的K
5.α-L-阿拉伯呋喃糖苷酶受NaCl的影响及对NaCl耐受性测定
酶受NaCl影响测定:在55℃、pH 6.0、1%-15%NaCl反应条件下进行酶促反应,并测定相对酶活,结果如图6所示。
酶在NaCl中耐受的稳定性测定:将同样酶量的酶液置于1%-30%NaCl反应条件中处理1h,在pH 6.0及55℃下进行酶促反应,以未处理的酶液作为对照,并测定相对酶活,结果如图7所示。
综合图6和图7可知,当NaCl浓度从1%增加到15%时,该酶的剩余酶活均保持在70%以上;该酶在20%的NaCl中耐受1h后,其剩余酶活保持在80%左右,在30%的NaCl中耐受1h后,其剩余酶活保持在50%左右。
6.α-L-阿拉伯呋喃糖苷酶受木糖和阿拉伯糖的影响及对木糖和阿拉伯糖耐受性测定
酶受木糖和阿拉伯糖影响测定:在55℃,pH6.0,50-1000mM木糖和阿拉伯糖反应条件下进行酶促反应,并测定相对酶活,结果如图8所示,其中,L-arabinose为阿拉伯糖,xylose为木糖。
酶对木糖和阿拉伯糖耐受的稳定性测定:将同样酶量的酶液置于50-1000mM木糖和阿拉伯糖反应条件中处理1h,在pH6.0及55℃下进行酶促反应,以未处理的酶液作为对照,并测定相对酶活,结果如图9所示。
综合图8和图9可知,在木糖浓度为0.4mol/L时,该酶剩余酶活保持在60%以上,在阿拉伯糖浓度为0.05mol/L时,该酶剩余酶活低于50%;该酶活性随阿拉伯糖浓度的提高而降低,在50-200mM木糖条件下耐受1h后,该酶剩余酶活均保持在110%以上,在800mM木糖条件下耐受1h后,该酶剩余酶活保持在60%以上。
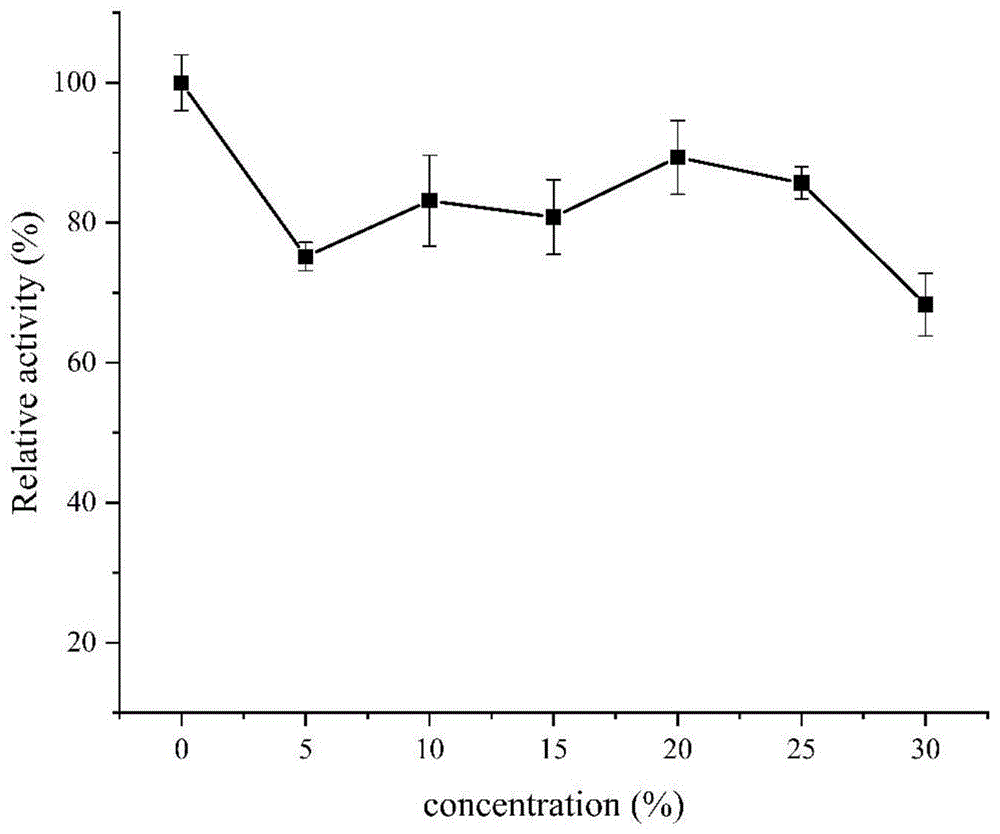
7.α-L-阿拉伯呋喃糖苷酶受乙醇的影响及对乙醇的耐受性测定
酶受乙醇影响测定:在55℃,pH 6.0,5%-30%乙醇反应条件下进行酶促反应,并测定相对酶活,结果如图10所示。
酶对乙醇耐受的稳定性测定:将同样酶量的酶液置于5%-30%乙醇反应条件中处理1h,在pH 6.0及55℃下进行酶促反应,以未处理的酶液作为对照,并测定相对酶活,结果如图11所示。
综合图10和图11可知,该酶活性随着乙醇浓度的提高而降低;在5%-30%乙醇条件下处理1h后,该酶剩余酶活均维持在65%以上。
8.α-L-阿拉伯呋喃糖苷酶对不同底物的降解测定
α-L-阿拉伯呋喃糖苷酶对不同底物降解的测定在55℃,pH6.0条件下,在酶活性测定体系中加入相同浓度的不同底物(对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)、对硝基苯基-β-D-木吡喃葡萄糖苷(pNPX)、对硝基苯基-α-D-甘露糖苷(pNPM)、4-硝基苯基-β-D-吡喃半乳糖苷(pNPG)和1%(V/V)的山毛榉木聚糖、桦木木聚糖、玉米芯木聚糖、甘蔗渣木聚糖),测定酶活(以对硝基苯基-α-L-阿拉伯呋喃糖苷(pNPA)为底物的酶活作为对照),结果表明α-L-阿拉伯呋喃糖苷酶均不分解以上底物。
9.α-L-阿拉伯呋喃糖苷酶协同商业木聚糖酶降解木聚糖的效果测定
在pH 5.0、50℃条件下进行木聚糖的降解:在1%的山毛榉木聚糖中加入0.5U/mL的α-L-阿拉伯呋喃糖苷酶和0.5U/mL的商业木聚糖酶的不同组合(只加入商业木聚糖酶于50℃反应4h;只加入α-L-阿拉伯呋喃糖苷酶于50℃反应4h;先加入α-L-阿拉伯呋喃糖苷酶于50℃反应4h后煮沸15min灭活酶,冷却后再加入商业木聚糖酶于50℃反应4h;同时加入α-L-阿拉伯呋喃糖苷酶和商业木聚糖酶于50℃反应4h;先加入商业木聚糖酶于50℃反应4h煮沸15min灭活酶,冷却后再加入α-L-阿拉伯呋喃糖苷酶煮沸灭活酶后),所有反应结束后均煮沸15min,以未加任何酶的木聚糖为空白对照,设置阳性对照(商业α-L-阿拉伯呋喃糖苷酶代替上述制备的α-L-阿拉伯呋喃糖苷酶)。用DNS法测定还原糖含量,结果如图12所示,其中,Abf为水解木聚糖时只加重组α-L-阿拉伯呋喃糖苷酶或商业α-L-阿拉伯呋喃糖苷酶;Xyl为水解木聚糖时只加商业木聚糖酶;Abf→Xyl为水解木聚糖时先加入重组α-L-阿拉伯呋喃糖苷酶水解木聚糖时或后加入商业木聚糖酶;Abf+Xyl为水解木聚糖时同时加入重组α-L-阿拉伯呋喃糖苷酶或商业α-L-阿拉伯呋喃糖苷酶和商业木聚糖酶;Xyl→Abf为水解木聚糖时先加入商业木聚糖酶后加入重组α-L-阿拉伯呋喃糖苷酶或商业α-L-阿拉伯呋喃糖苷酶。可知,本发明提供的α-L-阿拉伯呋喃糖苷酶与商业木聚糖协同作用可达到最高协同率1.20,还原糖的产生量为2.23mg/mL;商业α-L-阿拉伯呋喃糖苷酶与商业木聚糖酶协同作用的最高协同率为1.11,还原糖的产生量为2.05mg/mL。
注:协同作用或协同作用的程度被定义为“酶在一起使用时释放的产物的速率或产率与单独使用与混合物中使用相同量的酶时这些产物的速率或产率之和的比率”。
将反应液进行离心处理后,以三氯甲烷:冰醋酸:水为6:7:1(V:V:V)为展开剂,以丙酮50mL、二苯胺1g、苯胺1mL、正磷酸5mL混匀作为显色剂进行薄层层析(TLC)分析,其结果如图13所示,其中,Xylose为木糖标品;M为低聚木糖标准品;1为空白对照;2为反应体系只加入木聚糖酶的反应产物;3为反应体系只加入重组α-L-阿拉伯呋喃糖苷酶的反应产物;4为反应体系先加入重组α-L-阿拉伯呋喃糖苷酶再加入木聚糖酶的反应产物;5为反应体系同时加入重组α-L-阿拉伯呋喃糖苷酶和木聚糖酶的反应产物;6为反应体系先加入木聚糖酶再加入重组α-L-阿拉伯呋喃糖苷酶的反应产物;7为反应体系只加入商业α-L-阿拉伯呋喃糖苷酶的反应产物;8为反应体系先加入商业α-L-阿拉伯呋喃糖苷酶再加入木聚糖酶的反应产物;9为反应体系同时加入商业α-L-阿拉伯呋喃糖苷酶和木聚糖酶的反应产物;10为反应体系先加入木聚糖酶再加入商业α-L-阿拉伯呋喃糖苷酶的反应产物。由图13可知,除空白对照和α-L-阿拉伯呋喃糖苷酶单独反应组外,其余实验组均有低聚木糖产生。
本发明利用宏基因组技术从西黑冠长臂猿粪便微生物宏基因组筛选α-L-阿拉伯呋喃糖苷酶基因,并在大肠杆菌中异源表达了α-L-阿拉伯呋喃糖苷酶,通过对其酶学性质的研究,获得了具有更高活性、更稳定的新型α-L-阿拉伯呋喃糖苷酶。
本发明提供的α-L-阿拉伯呋喃糖苷酶具有高乙醇耐受性,在乙醇环境中具有较高酶活,可应用于葡萄酒风味改善等食品加工领域,还可用于饲料加工。本发明提供的高比活的α-L-阿拉伯呋喃糖苷酶容易实现高效催化,同时还具备高乙醇耐受性和高盐耐受。极具经济价值,在工业应用中具有强大的应用潜力,如在葡萄酒酿造过程中增加芳香化合物的释放从而改善葡萄酒风味或在酱油生产的高盐环境下与其他酶协同生产戊糖从而影响酱油着色。
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
- 一种真菌α-L-阿拉伯呋喃糖苷酶合成调控蛋白突变体及其应用
- 一种高温α-L-阿拉伯呋喃糖苷酶基因和一种高温乙酰木聚糖酯酶基因及其蛋白表达与应用
- 一种钙依赖型耐热α-L-阿拉伯呋喃糖苷酶的编码基因、制备技术和应用
