一种抗金黄色葡萄球菌肠毒素B的全人源SEB单克隆抗体及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及免疫领域,具体涉及一种抗金黄色葡萄球菌肠毒素B的全人源SEB单克隆抗体,还涉及抗体的应用。
背景技术
金黄色葡萄球菌(Staphylococcus aureus)是一种广泛流行,引起医院和社区感染的一种重要病原微生物,呈多重耐药和高度耐药传播蔓延。其感染以急性和化脓性为主,全身性感染能够导致急性肺炎、心内膜炎、脓毒性关节炎、骨髓炎、脓毒血症等多种严重感染和并发症。长期的抗生素滥用使得金葡菌耐药的问题日益加剧和突出,作为“超级细菌”的典型代表,耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcusaureus,MRSA)能够分泌多种毒素破坏正常的体液免疫和细胞免疫并重塑宿主的免疫环境,从而实现免疫逃逸并给人体造成严重的损伤。
金黄色葡萄球菌肠毒素B是金黄色葡萄球菌最常见和强力的超抗原之一,可与人类的主要组织相容性复合物(MHC)II类分子的α链和T细胞受体(TCR)的特定Vβ区域结合并形成三元复合物,导致单核细胞/巨噬细胞和T淋巴细胞的大量增殖和活化,并诱导高水平的促炎细胞因子和趋化因子。全身炎症因子可能会导致对患者潜在致命的中毒性休克综合征(Toxic shock syndrome,TSS)。此外,SEB与食物中毒密切相关,能够引发呕吐、腹痛和腹泻等症状。由于SEB容易使用基因工程技术大量生产,具有气溶胶稳定性,可作为致死和致残剂,是理想的生物毒素,被疾病预防控制中心(CDC)归类为B类选生物战剂。与此同时,我们仍缺乏对受影响人群进行大规模治疗的有效医疗对策,对SEB的担忧更加复杂。
当前,针对SEB还没有批准的疫苗或者特定的抗体疗法,前期研究发现了包括小分子治疗剂,疫苗和单克隆抗体等多种潜在的治疗方法。其中,能够立刻发挥作用的单克隆抗体是一种有效的免疫疗法,能够代表紧急干预相关的感染的最佳方法,也可能是无法正确接种疫苗的免疫缺陷患者的最佳选择,代表着缓解和治疗SEB引起的中毒性休克综合征和金黄色葡萄球菌感染的可能。对于金黄色葡萄球菌耐药引起的严峻形势和金黄色葡萄球菌肠毒素B的巨大威胁,所述针对金黄色葡萄球菌肠毒素B的抗体可以帮助降低金黄色葡萄球菌感染的严重性,治疗肠毒素B引起的生物毒性,还可以使用这些抗体检测金黄色葡萄球菌肠毒素分型。
发明内容
有鉴于此,本发明的目的之一在于提供一种抗金黄色葡萄球菌肠毒素B的全人源SEB单克隆抗体;本发明的目的之二在于提供编码所述全人源SEB单克隆抗体的核酸分子;本发明的目的之三在于提供含有所述核酸分子的重组表达载体;本发明的目的之四在于提供含有所述的核酸分子的重组表达载体的宿主细胞;本发明的目的之五在于提供所述全人源SEB单克隆抗体在制备特异性结合金黄色葡萄球菌肠毒素B的试剂中的应用;本发明的目的之六在于提供所述全人源SEB单克隆抗体在制备治疗或辅助治疗金黄色葡萄球菌感染的药物中的应用。
为达到上述目的,本发明提供如下技术方案:
1、一种抗金黄色葡萄球菌肠毒素B的全人源SEB单克隆抗体,其特征在于:所述全人源SEB单克隆抗体包括重链和轻链,所述重链的可变区CDR1,CDR2和CDR3的氨基酸序列分别如SEQ ID NO.5、SEQ ID NO.6和SEQ ID NO.7所示;所述轻链的可变区CDR1和CDR3的氨基酸序列分别如SEQ ID NO.9和SEQ ID NO.10所示,轻链的可变区CDR2氨基酸序列为Asp ThrLys。
本发明优选的,所述重链的氨基酸序列如SEQ ID NO.4所示;所述轻链的氨基酸序列如SEQ ID NO.8所示。
本发明优选的,所述抗体的恒定区包括人源IgM、IgA或IgG恒定区中的任意一种,所述抗体为单克隆抗体,为人源抗体,人抗体或单结构域抗体。此单克隆抗体的重链可以选自同种型IgM、IgA、或IgG,优选地IgG。
本发明的,本发明的单克隆抗体的轻链可以是κ型或λ型的,在一个优选的实例中轻链是λ型的。
本发明优选的,所述全人源SEB单克隆抗体特异结合金黄色葡萄球菌肠毒素B全长氨基酸或部分氨基酸序列,所述金黄色葡萄球菌肠毒素B的全长氨基酸如SEQ ID NO.1所示。
本发明优选的,所述全人源SEB单克隆抗体以不高于5×10
本发明中,单克隆抗体自感染金黄色葡萄球菌的血液淋巴细胞生成,并且如此生成具有高亲和力的天然精制的且选定的抗体以实现中和针对感染的有效保护。
2、编码所述全人源SEB单克隆抗体的核酸分子。
3、含有所述核酸分子的重组表达载体。
4、含有所述的核酸分子的重组表达载体的宿主细胞。所述宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇S2或Sf9的昆虫细胞;CHO、COS7、293细胞的动物细胞等。特别优选的是人生产细胞系。
5、所述全人源SEB单克隆抗体在制备特异性结合金黄色葡萄球菌肠毒素B的试剂中的应用。
6、所述全人源SEB单克隆抗体在制备治疗或辅助治疗金黄色葡萄球菌感染的药物中的应用。
本发明的有益效果在于:本发明通过分选单个浆细胞,将分离到的分泌抗SEB的全人源单克隆抗体,因此可以从分离的浆细胞分离到抗SEB的全人源单克隆抗体的基因序列,将分离到的基因序列构建表达载体,并通过在宿主细胞中表达来生产单克隆抗体,生成的单克隆抗体被分泌到上清液中,通过层析技术将其纯化。得到的看克隆抗体能够与金黄色葡萄球菌肠毒素B特异结合,可以作为检测金黄色葡萄球菌的抗体,得到的抗体还可治疗由MRSA感染引起的脓毒血症,在预防和治疗金黄色葡萄球菌感染方面有重要意义。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1是本发明中的单个浆细胞分选图。
图2是本发明中的SEB单克隆抗体Hm0487的SDS-PAGE检测结果。
图3是本发明中的SEB单克隆抗体Hm0487与SEB的结合活性检测。
图4是本发明利用生物膜干涉技术分析SEB与Hm0487相互作用结果。
图5是本发明中的SEB变性胶Western Blot结果图。
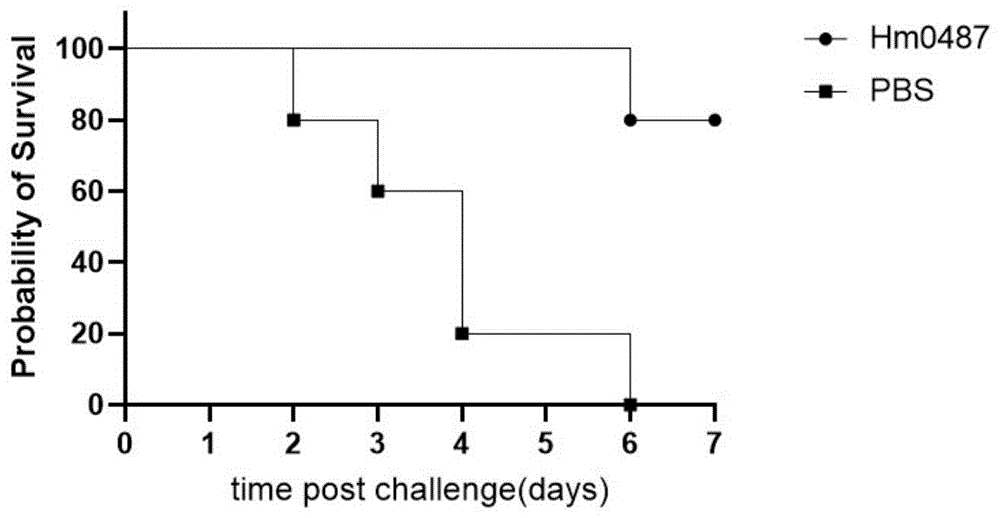
图6是本发明中的Hm0487抑制SEB致死动物模型评价结果图。
图7是本发明中的Hm0487对MRSA脓毒血症动物模型评价结果图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
实施例1、金黄色葡萄球菌肠毒素B(SEB)和突变型金黄色葡萄球菌肠毒素B(mSEB)的表达和纯化
将来自金黄色葡萄球菌菌株(ATCC登录号为BAA-1556)的基因组DNA通过PCR扩增SEB基因。然后使用QuickChange II XL定点诱变试剂盒通过野生型基因的定点诱变而产生L45R,Y89A,Y94A变体。DNA测序证明后,将其在大肠杆菌中表达,在含有氨苄西林的LB培养基内37℃培养过夜,离心收获细胞。利用Ni-NTA纯化获得SEB蛋白和mSEB(L45R,Y89A,Y94A)蛋白,SEB蛋白的氨基酸序列如SEQ ID NO.1所示。
实施例2、外周血单个核细胞(PBMC)的分离
招募健康的志愿者和严重感染金黄色葡萄球菌后痊愈的志愿者,采集静脉血样本于含有肝素的抗凝管中,利用密度离心法分离PBMC细胞,具体操作如下:取静脉血于22℃、400×g、离心15min;吸取上层透明血浆层,置于-80℃冻存;吸取上清后,与等量的RPMI1640(Gibco)充分混匀,沿倾斜的管壁缓慢加入到等量淋巴细胞分离液上层,2000rpm离心20min,吸取云雾层的单个核细胞于无菌离心管中,加入5倍以上体积的RPMI1640,1000rpm离心5min,洗涤细胞两次,适量RPMI1640重悬细胞以1×10
实施例3、流式细胞仪分选单个浆细胞
流式细胞术分选单个浆细胞:以SEB保护性抗原蛋白(HPLC纯度﹥95%)为抗原对血清进行ELISA检测确定样本的抗体滴度,选择抗体滴度高的样本,通过流式细胞仪分选单个浆细胞,通过CD3/CD14/CD16/CD235a-CD19+CD20+/-CD38hi CD27hi设门分选,将不同时间点的浆细胞群分离出来。通过血清学实验与B淋巴细胞表型的分析,可以保证我们能从>3%的浆细胞群中获得大量的单个浆细胞,并从中分离抗SEB的全人源单克隆抗体的基因序列,重链核苷酸序列如SEQ ID NO.11所示,轻链核苷酸序列如SEQ ID NO.12所示,分选到细胞数量较多状态良好(图1)。
实施例4、抗SEB抗体的克隆和全人源抗体的表达
使用SuperscriptV逆转录酶(Invitrogen,Carlsbad,CA)和随机引物合成cDNA的第一链。使用Ig引物组(重链的恒定区引物序列:5’-gcggccctgggctgcctggtcaag-3’(SEQID NO.2);轻链的恒定区引物序列:5’-aggagagtgtcacagagcaggacag-3’(SEQ ID NO.3))通过PCR扩增人Ig V
抗体基因序列测定与生物信息学分析:将凝胶电泳鉴定为阳性、且重链与轻链可匹配成对的抗体基因PCR产物用Qiagen PCR产物纯化试剂盒进行纯化,并分别从正向与反向进行序列测定,用IMGT在线服务器(http://imgt.cines.fr/)来分析抗体基因家族、突变率、亚型及CDR区,新的抗体基因录入抗体基因库中。
将凝胶电泳鉴定为阳性、且重链与轻链可匹配成对的抗体可变区基因的PCR产物利用TA克隆的方法连接到pcDNA3.3载体上,构建全人源抗SEB抗体的表达载体,然后将表达载体转化DH5α感受态细菌,在含有氨苄西林的平板上37℃培养过夜,挑取10个单菌落用特异性引物进行PCR,反应条件为:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸100s,28个循环;72℃延伸5min,取5μL PCR产物用1%琼脂糖凝胶电泳检测。
结果显示,在阳性转化子中鉴定出了含有抗体重链和轻链基因的转化子。
实施例5、全人源抗SEB抗体的表达和纯化
将实施例4中所得阳性转化子中的载体质粒转化DH5α进行大量扩增,快速提取重组质粒后,将Ig VH、VK/L与转染试剂PolyFect共转染HEK293细胞,转染后5-6小时补充HEK293基础培养基(OPM),并在37℃、5%CO
实施例6、表达抗体的结合活性检测
以重组表达的SEB蛋白(L45R,Y89A,Y94A)和SEB分别为抗原100μL/孔包被ELISA板,4℃过夜,用封闭液常温封闭2h。Hm0487抗体(1:1000倍稀释),阴性对照为无关抗体IgG10.5μg/mL,空白加入封闭液,每孔100μL,设置3个复孔,37℃孵育1h。
用PBST缓冲液洗板一次(3个循环),加入1:5000稀释的Anti-Human HRP-IgG(二抗)100μL/孔,37℃孵育45min。PBST缓冲液洗板一次(5个循环),避光,加TMB 100μL/孔,37℃避光显色5min,加入50μL的ELISA终止液终止反应,450nm处检测吸光度。计算阴性对照无关抗体IgG1的均值,算出阈值(均值的3倍),大于阈值为阳性抗体。
实验显示,全人源SEB单克隆抗体Hm0487能与SEB和mSEB(L45R,Y89A,Y94A)结合(图3),EC50分别为0.00913μg/mL和0.00702μg/mL(表1)。
表1、Hm0487和SEB与mSEB(L45R,Y89A,Y94A)的EC50
实施例7、生物膜干涉技术(BLI)测定抗体与抗原的亲和力
使用生物膜干涉技术来测量Hm0487与SEB的动力学参数,分离得到的Hm0487单克隆抗体200nM固化到AHC传感器上,SEB两倍连续稀释物(12.5nM至200nM)以按照样品板排列加样,按照“基线检测-加载检测-淬火-淬火-洗板-基线检测-结合检测-解离检测”的程序设定进行操作。计算结合速率常数(kon)、解离速率常数(kdis)、平衡解离常数(KD),结果如表2所示,Hm0487与SEB的KD为4.661×10
表2、Hm0487与SEB的结合亲和力数据
实施例8、Hm0487抗体表位类型的确定
蛋白样品制备:10μg SEB和mSEB(L45R,Y89A,Y94A)10μL在100℃金属浴中煮5min。安装电泳槽和电泳凝胶,加入电泳缓冲液,拔掉梳子后上样。设定电泳仪电压为100V跑电泳,至样品跑到分离胶后将电压调为200V,溴酚兰跑至距离下缘1cm即可终止电泳。电泳胶用水冲洗后,放入半干电转仪转膜,设置电压200V转膜90min;转膜后的PVDF薄膜置于含5%脱脂奶粉的TBST溶液中室温封闭1h。薄膜用TBST溶液洗3次,每次5min;加入1μg/mL的Hm0487溶液,4℃孵育过夜。洗膜3次后,用TBST将Anti-Human HRP-IgG(二抗)按照1:5000稀释,将薄膜放入上述溶液中,37℃孵育45min。
薄膜用TBST溶液洗3次,每次5min;将薄膜放入干净的平皿中,每块膜避光滴加约1mL的DAB显色液,条带明显时用水冲洗终止反应。图5显示,Hm0487能够和变性后的SEB和mSEB(L45R,Y89A,Y94A)结合,由此判断Hm0487抗体能够识别SEB的线性表位。
实施例9、肠毒素B动物模型评价实验
取20只小鼠分为2组,每组10只。将100μg Hm0487、10μg Hm0487、和PBS尾静脉注射各组小鼠,体积100μL。24h后,将20μg SEB和10mg D-氨基半乳糖盐酸盐尾静脉注射所有小鼠,体积100μL,观察小鼠7d并记录小鼠的生存情况(图6)。中和保护性评价实验表明,100μgHm0487抗体能够保护80%小鼠此结果表明Hm0487可以保护肠毒素B攻毒。总之,该实验结果说明金黄色葡萄球菌肠毒素B在致病菌中的作用,并且提供了抑制黄色金黄色葡萄球菌肠毒素B功能以限制金黄色葡萄球菌感染相关的疾病严重性甚至死亡的抗体的用途的证据。
实施例10、MRSA脓毒血症感染致死模型的建立及保护性评价
取10只小鼠,分为2组,每组5只。将600μg Hm0487和PBS尾静脉注射各组小鼠,体积100μL。24h后,将1.5×108CFU MRSA 252尾静脉注射所有小鼠,体积100μL,观察小鼠7d并记录小鼠的生存情况(图7)。MRSA脓毒血症保护性评价实验表明,600μg Hm0487抗体能够保护80%小鼠,此结果表明,Hm0487可以保护MRSA的脓毒血症。表明全人源抗SEB抗体Hm0487能够抑制疾病进展、增强清除并且还抑制入侵生物的全身扩散。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
- 一种抗金黄色葡萄球菌肠毒素B的单克隆抗体YG11-2及其应用
- 一种抗金黄色葡萄球菌肠毒素B的单克隆抗体YG11-1及其应用
