miRNA剂型的骨关节炎药物制剂及其制备方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于骨关节炎治疗技术领域,具体提供了一种miRNA剂型的骨关节炎药物制剂及其制备方法。
背景技术
骨关节炎(OA)是一种以慢性炎症、进行性关节软骨破坏和软骨下骨硬化为主要特征的慢性关节疾病。目前,早期和中期OA的治疗策略是缓解关节疼痛和关节内注射,晚期OA的治疗策略是关节置换手术。早中期骨关节炎最常用的方法为药物治疗,通过口服给药,药物经过全身循环很难到达病变区域,不但对病情治疗效果欠佳,还可能产生不必要的副作用。关节内注射给药,药物能够直达病变区域,但现有的药物主要是发挥消炎和镇痛作用,对软骨修复作用微乎其微。
近年来,通过将微小核糖核酸(microRNA,miRNA)应用于疾病治疗己引起广泛的关注。miRNA是一种小的内源性非编码RNA分子,大约由21-25个核苷酸组成。这些小的miRNA通常靶向一个或者多个miRNA,通过翻译水平的抑制或断裂靶标miRNAs而调节基因的表达,从而实现从基因水平上治疗疾病。比如,miRNA可以通过调节软骨细胞内与软骨基质合成相关基因的表达,进而使细胞外基质的合成增加并产生分解抑制,可以有效的加快软骨损伤的恢复。但miRNA在细胞外作用极其脆弱,且难以进入细胞内发挥生物学效应。因此,开发新型miRNA药物制剂用于骨关节炎治疗成为领域内的研究热点。
发明内容
本发明的目的在于针对现有骨关节炎药物存在的问题,提供一种miRNA剂型的骨关节炎药物制剂及其制备方法,所述miRNA剂型的骨关节炎药物可以直接关节注射给药,在消炎和镇痛的同时,实现软骨修复。
本发明的目的是通过以下技术方案实现的:一种miRNA剂型的骨关节炎药物制剂,所述制剂由miRNA和脂质纳米颗粒(LNP)组成。
miRNA为miR-200c-3p,序列为UAAUACUGCCGGGUAAUGAUGGA。
miRNA剂型的骨关节炎药物制剂中miRNA用量为100~2800μg/ml。
LNP是由二硬脂酰基磷脂酰胆碱(DSPC)、胆固醇(cholesterol)和1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000(DMG-PEG2000)或((4-羟基丁基)氮杂二基)双(己烷-6,1-二基)双(2-己基癸酸酯)(ALC-0315)、胆固醇和二硬脂酰基基磷脂乙醇胺-聚乙二醇组成的混合物。
miRNA剂型的骨关节炎药物为直径介于20-600纳米的颗粒组合物。
药物制剂作用靶点为ZEB2基因。miRNA剂型的骨关节炎药物用于预防或改善骨关节炎。
miRNA剂型的骨关节炎药物的施用方式包括皮下、肌肉、静脉和关节腔内注射。
本发明的另一方面:
miRNA剂型的骨关节炎药物制剂是采用微流控设备制备得到的。制备方法包括以下步骤:
(1)将脂质体原料溶解于无水乙醇,形成溶液A;
(2)将miRNA溶于柠檬酸缓冲液,形成溶液B;
(3)使用微流体纳米药物生产装置将所述溶液A、溶液B混合后,使用PBS缓冲液透析,过滤膜除菌后即得miRNA剂型的骨关节炎药物。
本发明相比现有技术的有益效果为:
1.miRNA类药物可以从基因水平上抑制炎症,使细胞外基质的合成增加并产生分解抑制,可以有效的加快软骨损伤的恢复。克服现有的药物主要是发挥消炎和镇痛作用,对软骨修复作用微乎其微的弊端。
2.通过脂质纳米粒包裹miRNA方法克服了miRNA在细胞外及其脆弱,且难以进入细胞内发挥生物学作用的弊端。
3.通过微流控技术生产miRNA剂型的骨关节炎药物,可以有效降低生产成本;且其制备的纳米粒理化性质(包括粒径、电势、包封率、稳定性)较为均一、生产和纯化过程易实现标准化操作,进一步节省了时间和经济成本。
4.miRNA剂型的骨关节炎药物可减少LPS刺激后小鼠ADTC5细胞TNF-α、IL-6、IL-1β、MCP-1蛋白的表达水平,增强细胞活力,同时拮抗细胞凋亡,降低MMP3、MMP13、ADAMTS-4的表达和提高Collagen II的表达。
附图说明:
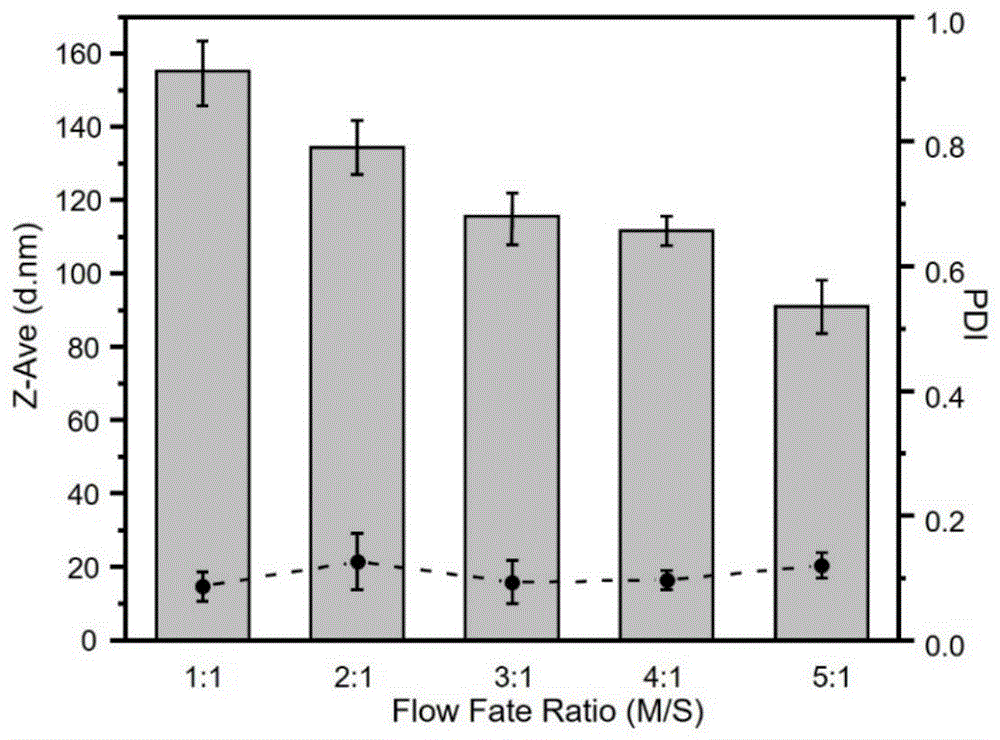
图1为微流控通道水相和乙醇相流速比对制备miRNA剂型的骨关节炎药物粒径(Z-AVE)与分散性(PDI)影响图。
图2为微流控通道水相和乙醇总流速对制备miRNA剂型的骨关节炎药物粒径(Z-AVE)与分散性(PDI)影响图。
图3为不同miR-200c-3p浓度对于miRNA剂型的骨关节炎药物中miR-200c-3p包封率的影响。
图4药物制剂的电镜图。
图5miRNA剂型的骨关节炎药物在生理环境下,随时间变化,粒径与分散性变化图。
图6LPS对ATDC5细胞活性及miR-200c-3p表达水平的影响图。其中,A.采用CCK-8检测LPS处理后细胞活性,B.LPS处理后miR-200c-3p的表达水平。其中与Control比较,***p<0.001。
图7RT-PCR检测LPS处理ATDC5细胞,Lipo-miR-200c-3p转染miR-200c-3p后,miR-200c-3p的表达水平,***p<0.001。
图8Lipo-miR-200c-3p传递miR-200c-3p后抑制LPS诱导ATDC5细胞的活力损伤图。
图9Lipo-miR-200c-3p传递miR-200c-3p对于ATDC5细胞炎症因子表达的影响图。
图10Lipo-miR-200c-3p传递miR-200c-3p对于ATDC5细胞凋亡的影响图。A:Tunel染色观察细胞凋亡的变化,B:凋亡相关蛋白(bcl2,bax,cleaved-caspase3,caspase3)表达变化。*p<0.05,***p<0.001。
图11Lipo-miR-200c-3p传递miR-200c-3p对于ATDC5细胞基质及相关蛋白酶的影响。蛋白质印迹检测MMP3,MMP13,ADAMTS-4和Collagen II的表达水平,*p<0.05,**p<0.01,***p<0.001。
图12在ATDC5细胞中转染miR-200c-3p后,检测ZEB2的表达水平,**p<0.01。
图13双荧光素酶报告基因实验结果提示miR-200c-3p和ZEB2结合,*p<0.05。
图14采用ELISA测定敲低ZEB2对细胞中促炎因子(TNF-α,IL-6,IL-1β和MCP-1)含量的影响图,**p<0.01。
图15采用western blot检测敲低ZEB2对MMP3,MMP13,ADAMTS-4和Collagen II的表达水平的影响,*p<0.05,**p<0.01,***p<0.001。
图16ALC-miR-200c-3p传递miR-200c-3p对于ATDC5细胞炎症因子表达的影响图。
图17为本发明使用的涡流混合器的示意图。
具体实施方式
为进一步说明本发明,具体实施方式如下。
实施例1纳米微粒Lipo-miR-200c-3p的制备及检测
(1)采用微流控芯片技术自制涡流混合器制备脂质体,用于封装包裹miR-200c-3p。
本发明自制涡流混合器具有s型的混合芯片,左边Y两端是进口,右边是出口,有利于制备尺寸在纳米级别,粒径均一的颗粒。
(2)将二棕榈酰磷脂酰胆碱(DPPC)、胆固醇和二硬脂酰基基磷脂乙醇胺-聚乙二醇(DSPE-PEG2000)按摩尔比为(90:5:5)溶解在5ml甲醇溶液中作为A溶液(甲醇相)。将10微克生工加工合成的miR-200c-3p(固体粉末)分散在5ml柠檬酸缓冲溶液中作为B溶液(水相)。然后将A溶液和B溶液按照不同流速比同时注入自制混合器中,从而形成荷载有miR-200c-3p脂质体纳米粒溶液(Lipo-miR-200c-3p)。配方中的初始脂质(二棕榈酰磷脂酰胆碱(DPPC))浓度为4mg/ml,水:有机流速比(FRR)为4:1,总流速(TFR)为25ml/min。
为了优化微流控芯片制备脂质体条件,对两通道的流速比、总流速进行了探究。如图1所示,随着流速比从1:1上升到5:1,所制备的脂质体粒径从143nm逐渐下降到95nm,综合考虑粒径和均一性(PDI),后续试验选择流速比为3:1。在固定流速比为3:1的条件下,继续对总流速进行探究,从图2可知,随着总流速不断上升,所制备的脂质体粒径不断减小,PDI逐渐变大。综合考虑粒径和均一性,总流速固定在15ml/min:5ml/min。
(3)依次改变miR-200c-3p溶液浓度从250μg/mL到500μg/mL、1000μg/mL、2000μg/mL、4000μg/mL,按照步骤(2)中脂质体配比和最优流速比和总流速,研究miR-200c-3p浓度与包封率的关系(图3),从图3中可以看出miR-200c-3p浓度越大,包封率越高,当miR-200c-3p浓度为250μg/mL时,包封率为40%,此时miRNA剂型的骨关节炎药物制剂中miRNA用量为100μg/mL。当miR-200c-3p浓度为4000μg/mL时,此时miRNA剂型的骨关节炎药物制剂中miRNA用量为2800g/mL。因此,通过调节miR-200c-3p溶液浓度,很容易制备出miRNA剂量在100-2800μg/mL的骨关节炎药物。
(3)所有新形成的脂质体(8ml)在1×PBS pH 7.4的磁性搅拌下通过透析缓冲液交换1小时,以确保所有脂质体都在1×PBS pH 7.4的溶液中。通过离心和透析去除任何非掺入的游离miR-200c-3p。
(4)透射电镜(TEM):Lipo-miR-200c-3p纳米微粒形貌采用JEOL JEM-2010TEM在100KV加速电压下观察(图4)。通过TEM成像可知,Lipo-miR-200c-3p粒径约100nm,
(5)动态光散射(DLS):Lipo-miR-200c-3p纳米微粒的粒径分布采用动态光散射(DLS)来测量,采用马尔文公司的Zetasizer Nano-ZS 90的粒径仪和电位仪测定纳米微粒的粒径、粒径分布指数(particle distribution index,PDI)及Zeta电位,。
(6)Lipo-miR-200c-3p纳米微粒粒径12周稳定性检测:将制备的Lipo-miR-200c-3p纳米微粒储存在4℃冰箱中,每隔一段时间,取一部分进行粒径检测以分析其稳定性(图5)。如图4所示,12周粒径维持在100~140nm之间,PDI维持在0.2至0.3之间,长时间保存后Lipo-miR-200c-3p的结构保持稳定。粒径分布均匀,能利于存放。
实施例2
脂质体纳米微粒Lipo-miR-200c-3p对ATDC5细胞炎症反应及凋亡等作用的研究
细胞炎症模型建立
将ATDC5细胞培养于含10%FBS DMEM培养基中。待细胞长至70%时使用350μg/mlLPS诱导细胞6h、12h和24h以构建骨关节炎软骨细胞模型(图5)。实验结果表明,使用350μg/ml LPS分别处理ATDC5细胞6h,12h,24h,随着时间的增加,细胞活力与miR-200c-3p的表达均逐渐降低,且与对照组Control相比,LPS处理12h和24h后细胞活力显著下降(图5)。因此选用350μg/ml LPS诱导ATDC5细胞24h这一条件来构建骨关节炎软骨细胞模型。
细胞转染
将ATDC5细胞接种于12孔板或者6孔板中,待细胞融合度为70%-80%时进行转染。
(1)取出培养板置于无菌操净台上,为细胞换取新鲜完全培养基。
(2)稀释Lipo-miR-200c-3p:利用一定的Opti-MEM转染培养基及适当体积Lipo-miR-200c-3p于EP管内,然后均分到培养板孔中,第二日换新鲜培养基继续培养用于后续实验。miR-200c-3p序列如下:
实验结果表明(图6),LPS处理ATDC5细胞后,miR-200c-3p含量相比对照组显著降低。再经Lipo-miR-200c-3p转染miR-200c-3p后,miR-200c-3p的表达较LPS、LPS+miR-NC组都显著增加,表明Lipo-miR-200c-3p能高效将miR-200c-3p递送进细胞并转染成功。
CCK8检测
采用DMEM完全培养基培养ATDC5细胞。第二代的软骨细胞生长至90%,且细胞生长状态良好,将处于对数生长期的细胞用吸引器吸去完全培养基,加入PBS清洗培养皿,含EDTA的0.25%胰酶消化3min,加入含血清的完全培养基3ml终止消化,后将ATDC5细胞离心,吹打重悬细胞后计数,取5×103个细胞接种于96孔板中,每组设置3复孔,分别培养6h、12h和24h,弃旧培养基,PBS洗涤后每孔加入CCK8溶液10μl,继续37℃孵育2h。将孔板放置于预热的酶标仪中,450nm测定各孔的吸光度(OD)。
CCK8实验结果表明,经LPS诱导处理后,ATDC5细胞活力下降明显。然而,LPS处理并转染miR-200c-3p后,细胞活力较LPS处理后有所增加。LPS处理后,再加入Lipo-miR-200c-3p转染miR-200c-3p后,ATDC5细胞活力较LPS+miR-NC组有所增加,表明经Lipo-miR-200c-3p传递miR-200c-3p可以有效的抑制LPS诱导的细胞活力损伤(图7)
RT-PCR
将ATDC5细胞按照5万/孔密度接种于12孔板,在实验处理后提取mRNA。
mRNA的提取与定量步骤:
(1)取出实验处理后的12孔板,去除完全培养基,PBS清洗2遍,每孔中加入500μlTRIZOL裂解液,室温静置5min。
(2)将mRNA裂解液吸于1.5ml的EP管中,加入100μl三氯甲烷剧烈震荡15s,室温静置10min。
(3)1.3×104rpm离心15min,取上清于新的1.5ml EP管中,加入700μl异丙醇,充分混匀,室温静置10min。
(4)静置后以相同转速继续离心10min,去上清,随后加入500μl 75%乙醇,6000rpm离心5min,重复3次。
(5)去除离心管中剩余乙醇,晾干后,加入20-40μl去离子水溶解mRNA,5min后酶标仪定量mRNA的浓度。用TRIZOL液裂解提取RNA后调整浓度至1μg/μl后开始进行逆转录、荧光定量PCR。反应体系如下:
以上体系混匀,50℃5min,85℃5s。即为cDNA。
逆转录后按下表反应体系进行Q-PCR操作:
按如下程序进行PCR扩增:
/>
按照程序共进行40个循环。RT-PCR仪观察判断引物是否可行,以U6作为内参照。7000HT PCR仪(美国AB公司)检测mRNA水平,2-△△CT法分析数据。
PCR引物序列如下:
结果显示(图8),LPS处理ATDC5细胞后,TNF-α,IL-6,IL-1β及MCP-1等促炎因子的表达明显增加。LPS处理并转染miR-200c-3p后,ATDC5细胞表达促炎因子含量较LPS组显著下降,表明过表达miR-200c-3p可在一定程度上缓解LPS诱导的细胞炎症反应。加入Lipo-miR-200c-3p并转染miR-200c-3p后,促炎因子含量较LPS+miR-200c-3p显著下降,表明经Lipo-miR-200c-3p传递miR-200c-3p可以更加有效的抑制LPS诱导的ATDC5细胞炎症反应
ELISA
ELISA法(标准双抗体夹心法)检测ATDC5细胞培养上清中(TNF)-α,IL-1β,IL-6和MCP-1的表达。在酶标仪上450nm和570nm(参比)读取OD值,根据标准曲线使用Gen5 DataAnalysis software计算浓度。
(1)样品采集与贮存
将ATDC5细胞按照10万每孔浓度接种于12孔板,采用LPS诱导骨关节炎软骨细胞模型后,24小时后转染miRNA,培养48小时后收集细胞培养上清液500μl,离心后去除沉淀,检测或者进行分装后放在-20℃条件下贮存。
(2)试剂准备
①1x洗液:按照一定配比稀释20x浓缩洗液至1x,常温保存。
②1x检测缓冲液:按一定配比稀释10x浓缩缓冲液至1x,立即使用。
③检测抗体:充分混匀检测抗体,根据需求,用1x检测缓冲液稀释浓缩的检测抗体。
④用1x检测缓冲液稀释辣根过氧化物酶标记的链霉亲和素。
⑤TNF-α,IL-1β,IL-6和MCP-1标准品的准备:根据使用要求使用一定体积蒸馏水重溶TNF-α,IL-1β,IL-6和MCP-1标准品,使重溶后的标准品浓度为20000pg/ml。
(3)制备细胞培养上清样本标准曲线:
分别取250μl稀释后的TNF-α,IL-1β,IL-6和MCP-1标准品,再加入相同体积的完全培养基,以最高浓度(10000pg/ml)作为标准曲线。在其他待稀释的EP管中均加入250μl培养基,取最高浓度标品,吹打后按照1:1系列稀释。
(4)检测步骤
①根据实验设计计算所需检测板条,将其从板条中拆卸下来。
②检测孔中加入250μl1×洗液,置检测板与摇床上转动(45转/分钟)2min,去除洗液,在吸水纸上将微孔板倒扣拍打数次以充分去除残留洗液。
③向复孔加入100μl稀释后的TNF-α,IL-1β,IL-6和MCP-1标准品。
④向样本孔中加入20μl细胞培养上清及80μl1x检测缓冲液。
⑤分别加入50μl稀释后的检测抗体。
⑥封板膜封板,置检测孔板于摇床,转速300rpm,避光孵育2h。
⑦重复步骤②。
⑧分别滴加100μl稀释后的辣根过氧化物酶标记的链霉亲和素。
⑨使用封板膜封板,置检测孔板于摇床,转速300rpm,室温避光孵育30-60min。
⑩重复步骤②。
取显色底物TMB100μl于各孔,培养箱中孵育30min。
加入100μl终止液于各检测孔,30min内,使用酶标仪测定450nm吸收波长下的OD值。
Tunel染色
将ATDC5细胞接种于载玻片上,细胞培养24小时后使用LPS刺激细胞,随后进行细胞转染,经适当处理时间后,PBS水洗后使用4%多聚甲醛固定30min,0.2%Triton X-100进行通透处理。滴加Equilibration Buffer 50μl,孵育30min。随后滴加含FITC-12-dUTPLabling Mix的TdT缓冲液,37℃避光孵育60min。PBS清洗载玻片2遍,之后将玻片浸入0.3%DAPI溶液中,室温避光孵育5min,去离子水清洗玻片3遍,滴加10μl抗荧光衰减试剂后,盖玻片封片,随后置于荧光显微镜下观察细胞凋亡变化,拍照后使用Image J软件分析结果。
ATDC5细胞经LPS诱导后,促凋亡因子bax和cleaved caspase3的表达上调,抗凋亡因子bcl-2表达下调。LPS处理并转染miR-200c-3p后,ATDC5细胞促凋亡因子bax和cleavedcaspase3的表达水平较LPS组显著降低,抗凋亡因子bcl-2的表达则有所增加,表明过表达miR-200c-3p可在一定程度上抑制LPS诱导的细胞凋亡。加入Lipo-miR-200c-3p并转染miR-200c-3p后,与LPS+miR-200c-3p组相比,促凋亡因子bax和cleaved caspase3表达水平降低,提示经Lipo-miR-200c-3p传递miR-200c-3p可更有效的抑制LPS诱导的ATDC5细胞凋亡(图9)
Western blot
(1)蛋白提取与处理
取于对数生长期的ATDC5细胞,按照2×106密度每孔接种于6孔板中,48小时后提取包浆蛋白。取处理后的6孔板,去除培养基,清洗细胞,置6孔板于冰上,每孔加入200μlRIPA蛋白裂解液裂解细胞,收集蛋白裂解液于1.5mlEP管中,离心后去除管底的沉淀,小心吸取蛋白溶液。
每管加入5x lodding Buffer 50μl,反复吹打胞浆蛋白液,将充分混匀的蛋白液置于超声破碎仪,低温超声4次,电压220V,每次2秒。经超声后的蛋白样品加热5min后,置于冰上降温后上样或-80℃冰箱备用。
(2)SDS-PAGE胶制备
SDS-PAGE胶配方如下,胶体凝固后置于清水中,放于4℃冰箱保存备用。
成分12%分离胶(10ml)15%分离胶(10ml)5%浓缩胶(3ml)
蒸馏水2.0ml 1ml 2.1ml
30%丙烯酰胺4.0ml 5.0ml 0.5ml
Tris-HCL 3.8ml(1.5M pH8.8)3.8ml(1.5M pH8.8)0.38(1.0M pH6.8)
10%SDS 0.1ml 0.1ml 0.03ml
10%过硫酸铵0.1ml 0.1ml 0.03ml
TEMED 0.004ml 0.004ml 0.003ml
(3)电泳分离
取出备用SDS-PAGE胶,将胶架装入电泳槽,加入1x电泳缓冲液500ml。取出胞浆蛋白置于冰上融化,上样20μl胞浆蛋白于SDS-PAGE胶上样孔中,同时上样2μl蛋白Marker,接通电源,设置电压100V,待蛋白样品跑至浓缩胶与分离胶接触面时,调整电压为120V,待溴酚蓝迁移到接近玻璃板底边时,切断电源,卸下玻璃板,开始转膜。
(4)转膜
打开玻璃板,取出胞浆蛋白分离后的SDS-PAGE胶,去除浓缩胶。根据Marker分离条带确定所测蛋白的位置,去掉其他凝胶,将相应SDS-PAGE胶片段裁剪。裁剪PVDF膜,与所切凝胶大小一致的,用75%乙醇浸泡以激活PVDF膜,随后置PVDF、凝胶、滤纸于转膜缓冲液中;组装转模槽,夹心法装配组装转膜结构。转膜顺序依次为:电源负极→海绵层→滤纸→SDS-PAGE胶片段→硝酸纤维素膜→滤纸→海绵层→电源正极。将转膜结构浸于转膜液中,去除滤纸、SDS-PAGE胶及PVDF膜三者之间的气泡。将转膜槽置于冰中,加入适量转膜缓冲液,连接电源(电流250mA),转膜结束关闭电源,取出杂交膜,回收转膜液。
(5)免疫杂交及显影
①将杂交膜置于10ml封闭液(5%脱脂牛奶)中,摇床上封闭1小时。
②按实验要求配置一抗稀释液1ml-3ml,一抗稀释倍数根据抗体说明书确定,将经脱脂牛奶封闭的杂交膜封于一次性塑料薄膜中,加入相应的一抗稀释液,去除塑料薄膜中的气泡,封闭塑料薄膜,将封闭后的杂交膜置于摇床晃动(转速25次/分钟),4℃孵育过夜。
③取出孵育后的杂交膜,置于10mlTBST缓冲液中,摇床清洗3次,转速45转/分钟。
④将二抗(1:5000)稀释于5%脱脂牛奶中,杂交膜置于含二抗的脱脂牛奶中,摇床上室温孵育1小时。
⑤取出二抗孵育后的杂交膜,重复步骤③。
⑥显影:在暗室中将杂交膜置塑料薄膜中,滴加200μl配置好的ECL超敏显影液(solution1和solution2按比例混和),将胶片置于塑料薄膜上,然后放入X-ray底片匣中。迅速地将曝光的胶片置于显影液中,显影液处理时依胶片条带亮度而定,随后将胶片置于定影液中迅速漂洗3分钟,水洗后室温晾干。
⑦电脑扫描胶片中蛋白条带,Image J软件定量,Graphpad Prism软件处理实验数据。
实验结果表明(图10):ATDC5细胞经LPS诱导后,细胞中的MMP3,MMP13和ADAMTS-4的表达显著增加,Collagen II的表达显著降低。LPS处理并转染miR-200c-3p后,ATDC5细胞MMP3,MMP13和ADAMTS-4的表达降低,Collagen II的表达升高。加入Lipo-miR-200c-3p并转染miR-200c-3p后,与LPS+miR-200c-3p组相比,MMP3,MMP13和ADAMTS-4的表达有所降低,Collagen II的表达升高。
靶点基因分析
在LPS诱导的ATDC5细胞的基础上转染miR-200c-3p(转染过程同上),检测ZEB2的表达情况,qRT-PCR结果显示:与对照组相比,在转染miR-200c-3p后,ZEB2的表达显著下调(图11),为了进一步验证miR-200c-3p和ZEB2基因的结合,我们做了双荧光素酶报告基因实验,证实miR-200c-3p和ZEB2是可以结合的(图12)随后,为了研究ZEB2对炎症因子和软骨基质合成和分解代谢的影响,我们设计了ZEB2的siRNA,在LPS诱导的ATDC5细胞中特异性的敲低ZEB2。通过ELISA法检测促炎因子(TNF-α,IL-6,IL-1β和MCP-1)的表达水平以及通过western blot方法检测软骨分解代谢相关蛋白(MMP3,MMP13,ADAMTS-4)和软骨合成代谢相关蛋白Collagen II的表达水平。我们的研究表明,促炎因子(TNF-α,IL-6,IL-1β和MCP-1)(图13)和软骨分解代谢相关蛋白(MMP3,MMP13,ADAMTS-4)的表达水平显著下降,而软骨合成代谢相关蛋白Collagen II的表达水平显著上升(图14)。上述结果表明miR-200c-3p通过与ZEB2基因结合,提高LPS诱导后ATDC5细胞的增殖能力、细胞周期以及软骨合成代谢,抑制了细胞凋亡、炎症浸润和软骨分解代谢。
实施例3
不同脂质材料制备纳米微粒递送miR-200c-3p对ATDC5细胞炎症反应及凋亡等作用的研究
(1)采用实施例1中的涡流混合器制备脂质体,脂质材料采用((4-羟基丁基)氮杂二基)双(己烷-6,1-二基)双(2-己基癸酸酯)(ALC-0315),封装包裹miR-200c-3p。
(2)将((4-羟基丁基)氮杂二基)双(己烷-6,1-二基)双(2-己基癸酸酯)(ALC-0315)、胆固醇和二硬脂酰基基磷脂乙醇胺-聚乙二醇(DSPE-PEG2000)按摩尔比为(80:10:10)溶解在5ml甲醇溶液中作为A溶液(甲醇相)。将500微克加工合成的miR-200c-3p溶液分散在5ml柠檬酸缓冲溶液(浓度为100微克/毫升)作为B溶液(水相)。然后将A溶液和B溶液按照不同流速比同时注入自制混合器中,从而形成荷载有miR-200c-3p脂质体纳米粒溶液(ALC-miR-200c-3p)。总流速与流速比采用实施例1中的优化条件。
(3)细胞炎症模型参考实施例2。
(4)RT-PCR过程参考实施例2,用新制备的脂质体包裹的miR-200c-3p进行转染实验,考察对LPS处理ATDC5细胞的炎症因子表达量的影响。结果显示(图16),LPS处理ATDC5细胞后,TNF-α,IL-6,IL-1β及MCP-1等促炎因子的表达明显增加。LPS处理并用新制备的脂质体转染miR-200c-3p后,ATDC5细胞表达促炎因子含量较LPS组显著下降,表明不同的阳离子脂质材料都可以很好的转染miR-200c-3p,有效的抑制LPS诱导的ATDC5细胞炎症反应。
- 一种6-取代平板霉素衍生物、制备方法、药物制剂及用途
- 芳香杂环乙烯基吡唑并嘧啶类化合物、药物制剂及制备方法与应用
- 一种mRNA剂型的骨关节炎药物制剂及其制备方法和应用
- 一种mRNA剂型的骨关节炎药物制剂及其制备方法和应用
