用于治疗眼部疾病的方法和组合物
文献发布时间:2024-04-18 19:52:40
交叉引用
本申请要求2021年3月18日提交的第63/162,960号美国临时申请、2021年7月7日提交的第63/219,336号美国临时申请和2021年11月24日提交的第63/283,117号美国临时申请的权益,其各自通过引用整体并入本文。
发明领域
本文的实施方案涉及眼部疾病的治疗和化合物向眼睛的递送。
发明内容
在一个方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛的眶周皮肤施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
在另一方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛的眼睑的外部皮肤施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
在另一个方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛的眼睑的外部皮肤施用治疗有效量的具有抗炎、抗氧化、抗微血管渗漏或抗新生血管形成特性的化合物或混合物。在可供选择的方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛的眼睑的外部皮肤施用治疗有效量的具有抗炎、抗氧化、抗微血管渗漏或抗新生血管形成特性的两种或更多种化合物或混合物的组合。
在另外的方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛的眶周皮肤施用治疗有效量的具有抗炎、抗氧化、抗微血管渗漏或抗新生血管形成特性的化合物或混合物。
在一些实施方案中,所述化合物或混合物包含具有抗氧化、抗炎、神经保护、镇痛和血管生成抑制特性的二十二碳六烯酸(DHA)。在一些实施方案中,所述化合物或混合物包含具有抗氧化、抗炎、神经保护、镇痛和血管生成抑制特性的ω-3脂肪酸。在一些实施方案中,所述化合物或混合物包含具有抗氧化、抗炎、神经保护、镇痛和血管生成抑制特性的ω-3脂肪酸乙酯。在一些实施方案中,所述化合物或混合物包含具有抗氧化、抗炎、神经保护、镇痛和血管生成抑制特性的ω-3甘油三酯。在一些实施方案中,所述化合物或混合物包含具有抗氧化、抗炎、神经保护、镇痛和血管生成抑制特性的ω-3磷脂,例如溶血磷脂酰胆碱(LPC)-ω-3(LPC-DHA或LPC-EPA)和di-DHA磷脂酰胆碱(PC)等。在一些实施方案中,所述化合物或混合物包含ω-3脂肪酸的代谢物,例如白三烯B
其中R可以选自:
其中R可以是Cl或Br、CF
其中R是甲基、异丁基,
在一些实施方案中,所述化合物或混合物包含选自以下的化合物:
3-[(3’–氟-4-氟联苯-3-羰基)氨基]苯氧乙酸异丙酯,其游离碱、阿卡他定、色甘酸、地塞米松、溴莫尼定、二氟泼尼酯、氟米龙、氯替泼诺、利美索龙、氮卓斯汀、依匹斯汀、二富马酸依美斯汀、奥洛他定、色甘酸眼用剂、洛度沙胺、奈多罗米、溴芬酸、双氯芬酸、氟比洛芬、酮咯酸、奈帕芬胺、氯雷他定、羟嗪、苯海拉明、氯苯那敏、盐酸氮卓斯汀溴苯那敏、赛庚啶、特非那定、氯马斯汀、左卡巴斯汀、曲普利啶、卡比沙明、二苯拉林、苯茚胺、阿扎他定、曲吡那敏、右氯苯那敏、右溴苯那敏、甲地嗪和异丁嗪多西拉敏、非尼拉敏、吡拉明、吡嘧司特、氯环嗪、松齐拉敏、顺铂、依托泊苷、干扰素、喜树碱及其衍生物、苯芥胆甾醇、紫杉醇及其衍生物、泰索帝及其衍生物、长春花碱、长春新碱、他莫昔芬、依托泊苷、哌泊舒凡、环磷酰胺、氟他胺、阿霉素、环磷酰胺、放线菌素、博来霉素、柔红霉素、多柔比星、表柔比星、丝裂霉素、甲氨蝶呤、氟尿嘧啶、卡铂、卡莫司汀(BCNU)、甲基-CCNU、氨苄青霉素、阿莫西林、环己西林、氨苄青霉素、头孢唑啉、头孢拉定、头孢克洛、头孢匹林、头孢唑肟、头孢哌酮、头孢替坦、头孢呋辛、头孢噻肟、头孢羟氨苄、头孢他啶、头孢氨苄、头孢噻吩、头孢羟唑、头孢西丁、头孢尼西、头孢雷特、头孢曲松、头孢羟氨苄、头孢拉定、头孢呋辛、环孢菌素、庆大霉素、妥布霉素、贝西沙星、环丙沙星、加替沙星、左氧氟沙星、莫西沙星、氧氟沙星、阿奇霉素、红霉素、杆菌肽、杆菌肽/多粘菌素、游霉素、新霉素/多粘菌素B/杆菌肽、新霉素/多粘菌素B/短杆菌肽、多粘菌素B/甲氧苄啶、青霉素G、青霉素V钾、哌拉西林、苯唑西林、巴氨西林、氯唑西林、替卡西林、阿洛西林、羧苄西林、甲氧西林、萘夫西林、红霉素、四环素、多西环素、米诺环素、氨曲南、氯霉素、盐酸环丙沙星、克林霉素、甲硝哒唑、庆大霉素、林可霉素、妥布霉素、万古霉素、硫酸多粘菌素B、甲磺酸粘菌素、粘菌素、阿奇霉素、奥格门汀、磺胺甲噁唑和甲氧苄啶,以及前述化合物的所有药学上可接受的酯或盐,类似物和同种型,和/或它们中的至少两种的混合物。
在一些实施方案中,所述化合物或混合物包含一种或多种具有下式的化合物:
其中,L是连接基团,每个连接基团独立地选自烷基、环烷基、杂烷基、杂环烷基或烷氧基,R
在一些实施方案中,所述化合物或混合物包含一种或多种具有下式的化合物:
其中,L是连接基团,每个连接基团独立地选自烷基、环烷基、杂烷基或烷氧基,R
在一些实施方案中,所述化合物或混合物选自以下化合物家族:基元受体3(CCR3)抑制剂、维生素A和维生素A的修饰形式(例如NCT03845582)、补体因子1q抑制剂、脱嘌呤/脱嘧啶核酸内切酶1/氧化还原效应因子-1(APE1/Ref-1)抑制剂、类固醇类、内皮细胞(EC)-特异性受体酪氨酸激酶Tie2激动剂(活化剂)、血管生成素-2拮抗剂、视黄醇结合蛋白4(RBP4)拮抗剂、补体成分3(C3)抑制剂、泛精氨酰-甘氨酰-天冬氨酸(RGD)整联蛋白拮抗剂、连接蛋白43半通道阻断剂、补体成分5抑制剂、泛RGD整联蛋白拮抗剂、Rho激酶抑制剂、Ref-1抑制剂、AP核酸内切酶1抑制剂、丝氨酸/苏氨酸-蛋白激酶(SRPK1)抑制剂、CC3(TIP30=30kDa的tat相互作用蛋白)抑制剂、补体C1Q抑制剂、补体因子(B和D)抑制剂、C3转化酶抑制剂、C5转化酶抑制剂、炎性体抑制剂、HtrA1抑制剂、基质调节剂(例如强力霉素)、MASP2(MBL相关的丝氨酸蛋白酶2)阻断剂、MASP3(MBL相关的丝氨酸蛋白酶3)阻断剂、抗病毒药(例如更昔洛韦)、VEGF受体(R1、R2、R3)抑制剂、PDGF受体抑制剂(包括伊马替尼、索拉非尼和舒尼替尼)、前列腺素类IP受体拮抗剂、酪氨酸激酶抑制剂,PAF(血小板活化因子)受体抑制剂,及其两种或更多种的组合。
在一些实施方案中,所述疾病或病症为眼后部的疾病或病症。在一些实施方案中,所述疾病或病症为眼前部的疾病或病症。在一些实施方案中,其中所述眼后部的疾病或病症包括视网膜疾病。在一些实施方案中,所述疾病或病症为眼前段疾病(ASED)。在一些实施方案中,所述疾病或病症为眼后段疾病(PSED)。在一些实施方案中,所述疾病或病症为干眼病和眼部不适、刺激、疼痛和应激、化学烧伤、眼前节发育不良、白内障、虹膜炎、翼状胬肉、角膜结膜炎、角膜炎、结膜炎、圆锥角膜、扩张性病症(包括球形角膜、透明角膜边缘变性)、假晶状体性和无晶状体性大泡性角膜病变、巩膜外层炎、角膜溃疡、角膜发育异常、角膜溃疡、Fuchs’内皮营养不良和其它角膜营养不良(包括格子状、颗粒状、斑块状和地图状点状指纹状)、眼部瘢痕性类天疱疮、Stevens Johnson综合征、急性和慢性葡萄膜炎(前部葡萄膜炎、中间葡萄膜炎)、对角膜、结膜和前段的创伤,包括虹膜创伤、穿透性眼创伤、睑缘炎、眼睑痉挛、睑板腺囊肿、上睑下垂、缺损、皮肤松弛症、睑外翻、睑内翻、倒睫、针眼、睑板腺炎、睑板腺功能障碍、泪腺阻塞、泪腺阻塞、脂溢性角膜炎、光化性角膜炎、细菌感染或病毒感染、屈光不正(近视、远视和散光)、葡萄膜炎(包括前部-、中间-、后部-和全-葡萄膜炎的急性和慢性葡萄膜炎)、年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性;多种视网膜病变、包括但不限于糖尿病性视网膜病变变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)、眼眶的淋巴管畸形(又名眼眶淋巴管瘤)或甲状腺眼病(格雷夫斯眼病),或其两种或更多种的组合。
在一些实施方案中,其中所述眼后部的疾病或病症包括视网膜疾病,所述视网膜疾病还包括来自视网膜或脉络膜血管系统的出血。在一些实施方案中,所述出血由高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。
在一些实施方案中,所述视网膜疾病或病症包括来自视网膜或脉络膜血管系统的血浆渗漏。在一些实施方案中,所述血浆渗漏由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。
在一些实施方案中,所述视网膜疾病或病症包括涉及视网膜或脉络膜血管系统的黄斑水肿形成。
在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性(湿性和干性)、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉分枝阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的和新生儿的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、中心性浆液性视网膜病变、视网膜母细胞瘤、糖尿病性黄斑水肿(DME)、视网膜静脉阻塞或眼内炎。
在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性。
在一些实施方案中,所述眼后部的疾病或病症为后部葡萄膜炎。
在一些实施方案中,所述方法还包括向患者施用另外的治疗剂。在一些实施方案中,另外的治疗剂是VEGF抗体、PDGF抗体、FGF抗体、SDF-1抗体、HIF-1抗体、PIGF抗体、TNF-α抗体、IGF-1抗体、VEGF受体拮抗剂、PDGF受体拮抗剂、FGF受体拮抗剂、SDF-1受体拮抗剂、HIF-1受体拮抗剂、PIGF受体拮抗剂、TNF-α受体拮抗剂、IGF-1受体拮抗剂、酪氨酸激酶抑制剂、甾体抗炎剂、非甾体抗炎剂、免疫抑制剂、抗胆碱能剂、沙利度胺、前列腺素受体拮抗剂、神经保护剂、神经再生剂、提供神经保护的RNA干扰分子、促进神经再生的RNA干扰分子、直接提供神经保护并降低眼内压的小分子、促进神经再生并降低眼内压的RNA干扰分子、提供神经保护并降低眼内压的RNA干扰、减少水肿、出血和血管生成的抗体、减少水肿、出血和血管生成的RNA干扰。
在一些实施方案中,向眶周皮肤施用药物将是优选的递送至巩膜的途径,用于防止由于促进巩膜的改变而导致的眼球长轴的增加。
在一些实施方案中,药物递送可涉及纳米颗粒。这些可以选自包括聚合物纳米颗粒、基于脂质的纳米颗粒、脂质体纳米颗粒、白蛋白结合的纳米颗粒、无机纳米颗粒、有机晶体纳米颗粒和基于病毒的纳米颗粒的组中。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺预防性地、作为紧急干预、或根据需要施用以实现所需的补救效果。
在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式施用。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。
在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、洗剂、乳膏或软膏。在一些实施方案中,所述组合物为软膏。在一些实施方案中,所述软膏包含矿脂、蜂蜡或可可脂。在一些实施方案中,所述软膏包含矿脂和中链甘油三酯。在一些实施方案中,所述中链甘油三酯包含C6、C8、C10和C12脂肪酸的混合物。在一些实施方案中,所述中链甘油三酯包含辛酸和癸酸的混合物。在一些实施方案中,所述软膏包含比例为约1:1(v/v)、约2:1(v/v)、约3:1(v/v)、约4:1(v/v)、约5:1(v/v)或约6:1(v/v)的矿脂和中链甘油三酯。在一些实施方案中,所述软膏包含比例为约4:1(v/v)的矿脂和中链甘油三酯。
在一些实施方案中,所述组合物的分子量为约50Da至约500Da。在一些实施方案中,所述组合物的分子量为约50Da至约100Da、约50Da至约150Da、约50Da至约200Da、约50Da至约250Da、约50Da至约300Da、约50Da至约350Da、约50Da至约400Da、约50Da至约450Da、约50Da至约500Da、约100Da至约150Da、约100Da至约200Da、约100Da至约250Da、约100Da至约300Da、约100Da至约350Da、约100Da至约400Da、约100Da至约450Da、约100Da至约500Da、约150Da至约200Da、约150Da至约250Da、约150Da至约300Da、约150Da至约350Da、约150Da至约400Da、约150Da至约450Da、约150Da至约500Da、约200Da至约250Da、约200Da至约300Da、约200Da至约350Da、约200Da至约400Da、约200Da至约450Da、约200Da至约500Da、约250Da至约300Da、约250Da至约350Da、约250Da至约400Da、约250Da至约450Da、约250Da至约500Da、约300Da至约350Da、约300Da至约400Da、约300Da至约450Da、约300Da至约500Da、约350Da至约400Da、约350Da至约450Da、约350Da至约500Da、约400Da至约450Da、约400Da至约500Da,或约450Da至约500Da。在一些实施方案中,所述组合物的分子量为约50Da、约100Da、约150Da、约200Da、约250Da、约300Da、约350Da、约400Da、约450Da,或约500Da。在一些实施方案中,所述组合物的分子量为至少约50Da、约100Da、约150Da、约200Da、约250Da、约300Da、约350Da、约400Da,或约450Da。在一些实施方案中,所述组合物的分子量为至多约100Da、约150Da、约200Da、约250Da、约300Da、约350Da、约400Da、约450Da,或约500Da。
在一些实施方案中,所述组合物包含抗体。在一些实施方案中,所述组合物具有约150kDa的分子量。在一些实施方案中,所述组合物具有约7kDa的分子量。在一些实施方案中,所述组合物包含双链siRNA。在一些实施方案中,所述组合物包含单链siRNA。在一些实施方案中,所述组合物包含短寡肽。
在一些实施方案中,所述短寡肽为约1个氨基酸至约6个氨基酸的序列。在一些实施方案中,所述短寡肽为约1个氨基酸至约2个氨基酸、约1个氨基酸至约3个氨基酸、约1个氨基酸至约4个氨基酸、约1个氨基酸至约5个氨基酸、约1个氨基酸至约6个氨基酸、约2个氨基酸至约3个氨基酸、约2个氨基酸至约4个氨基酸、约2个氨基酸至约5个氨基酸、约2个氨基酸至约6个氨基酸、约3个氨基酸至约4个氨基酸、约3个氨基酸至约5个氨基酸、约3个氨基酸至约6个氨基酸、约4个氨基酸至约5个氨基酸、约4个氨基酸至约6个氨基酸,或约5个氨基酸至约6个氨基酸的序列。在一些实施方案中,所述短寡肽为约1个氨基酸、约2个氨基酸、约3个氨基酸、约4个氨基酸、约5个氨基酸或约6个氨基酸的序列。在一些实施方案中,所述短寡肽为至少约1个氨基酸、约2个氨基酸、约3个氨基酸、约4个氨基酸或约5个氨基酸的序列。在一些实施方案中,所述短寡肽为至多约2个氨基酸、约3个氨基酸、约4个氨基酸、约5个氨基酸或约6个氨基酸的序列。
在一些实施方案中,所述组合物包含脂质体。在一些实施方案中,所述组合物包含纳米颗粒。在一些实施方案中,所述脂质体或纳米颗粒的平均直径为约0.1μm至约1μm。在一些实施方案中,所述脂质体或纳米颗粒的平均直径为约0.1μm至约0.2μm、约0.1μm至约0.3μm、约0.1μm至约0.4μm、约0.1μm至约0.5μm、约0.1μm至约0.6μm、约0.1μm至约0.7μm、约0.1μm至约0.8μm、约0.1μm至约0.9μm、约0.1μm至约1μm、约0.2μm至约0.3μm、约0.2μm至约0.4μm、约0.2μm至约0.5μm、约0.2μm至约0.6μm、约0.2μm至约0.7μm、约0.2μm至约0.8μm、约0.2μm至约0.9μm、约0.2μm至约1μm、约0.3μm至约0.4μm、约0.3μm至约0.5μm、约0.3μm至约0.6μm、约0.3μm至约0.7μm、约0.3μm至约0.8μm、约0.3μm至约0.9μm、约0.3μm至约1μm、约0.4μm至约0.5μm、约0.4μm至约0.6μm、约0.4μm至约0.7μm、约0.4μm至约0.8μm、约0.4μm至约0.9μm、约0.4μm至约1μm、约0.5μm至约0.6μm、约0.5μm至约0.7μm、约0.5μm至约0.8μm、约0.5μm至约0.9μm、约0.5μm至约1μm、约0.6μm至约0.7μm、约0.6μm至约0.8μm、约0.6μm至约0.9μm、约0.6μm至约1μm、约0.7μm至约0.8μm、约0.7μm至约0.9μm、约0.7μm至约1μm、约0.8μm至约0.9μm、约0.8μm至约1μm或约0.9μm至约1μm。在一些实施方案中,所述脂质体或纳米颗粒的平均直径为约0.1μm、约0.2μm、约0.3μm、约0.4μm、约0.5μm、约0.6μm、约0.7μm、约0.8μm、约0.9μm或约1μm。在一些实施方案中,所述脂质体或纳米颗粒的平均直径为至少约0.1μm、约0.2μm、约0.3μm、约0.4μm、约0.5μm、约0.6μm、约0.7μm、约0.8μm或约0.9μm。在一些实施方案中,所述脂质体或纳米颗粒的平均直径为至多约0.2μm、约0.3μm、约0.4μm、约0.5μm、约0.6μm、约0.7μm、约0.8μm、约0.9μm或约1μm。
在一些实施方案中,所述组合物包含亲脂性化合物。在一些实施方案中,所述组合物包含非极性化合物。在一些实施方案中,所述组合物包含双极性化合物。在一些实施方案中,所述组合物包含两性离子。
在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。
在一些实施方案中,通过滴管、泵、喷雾、点击笔或滚轮/储库装置将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于患者的至少一只眼睛的眶周皮肤。在一些实施方案中,通过刷子、棉签、指尖或刮铲将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于患者的至少一只眼睛的眶周皮肤,并且其中任选地在施用过程之前使用刻度滴管、注射器、点击笔或移液管。
在一些实施方案中,眼睛的眶周皮肤渗透可通过渗透增强剂、胶带剥离、微晶换肤术、溶剂、脉冲激光器和电离子透入疗法来辅助,用于递送在脂质体或纳米颗粒中的大分子,例如抗体、siRNA。在一些实施方案中,组合物容易地能够穿透皮肤屏障。
在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于患者的每只眼睛的眶周皮肤。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天一次施用。在一些实施方案中,所述方法包括将所述组合物施用于上眼睑上方的眶周皮肤、下眼睑下方的眶周皮肤或上眼睑上方和下眼睑下方两者的眶周皮肤。
在一个方面,本文提供了治疗患有眼后部的疾病或病症的患者的所述疾病或病症的方法,其包括将治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐施用于所述患者的眼睛的眼表面。
在一些实施方案中,所述眼后部的疾病或病症包括视网膜疾病。
在一些实施方案中,所述视网膜疾病包括来自视网膜或脉络膜血管系统的出血。在一些实施方案中,所述出血由高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。
在一些实施方案中,所述视网膜疾病或病症包括来自视网膜或脉络膜血管系统的血浆渗漏。在一些实施方案中,所述血浆渗漏由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。
在一些实施方案中,所述视网膜疾病或病症包括涉及视网膜或脉络膜血管系统的黄斑水肿形成。
在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性(湿性和干性)、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉分枝阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的和新生儿的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、中心性浆液性视网膜病变、视网膜母细胞瘤和眼内炎。
在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性。
在一些实施方案中,所述眼后部的疾病或病症为后部葡萄膜炎。
在一些实施方案中,所述疾病是神经系统变性眼病。
在一些实施方案中,所述方法还包括向患者施用另外的治疗剂。在一些实施方案中,另外的治疗剂是VEGF抗体、PDGF抗体、bFGF抗体、SDF-1抗体、HIF-1抗体、PIGF抗体、VEGF拮抗剂、酪氨酸激酶抑制剂、甾体抗炎剂、非甾体抗炎剂、免疫抑制剂、抗胆碱能剂、沙利度胺、前列腺素受体拮抗剂、ora神经保护剂、抗血管生成因子(例如PEDF)、神经再生剂、提供神经保护的RNA干扰、促进神经再生的RNA干扰、直接提供神经保护并降低眼内压的小分子、促进神经再生并降低眼内压的RNA干扰、提供神经保护并降低眼内压的RNA干扰、减少水肿、出血和血管生成的抗体、减少水肿、出血和血管生成的RNA干扰。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺预防性地、作为紧急干预、或根据需要施用以实现所需的补救效果。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式施用。在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、乳膏或软膏。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。
在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者的每只眼睛的眼表面。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天一次施用。
在一个方面,本文提供了治疗患有葡萄膜炎的患者的葡萄膜炎的方法,其包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
I在一个方面,本文提供了治疗患有翼状胬肉的患者的翼状胬肉的方法,其包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
在一个方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,其包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐,其中所述眼部疾病或病症为角膜结膜炎、圆锥角膜、巩膜外层炎、角膜溃疡、角膜发育异常、角膜营养不良或StevensJohnson综合征。
在一个方面,本文提供了治疗患有影响眼睑的眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐,其中所述影响眼睑的眼部疾病或病症是睑缘炎、眼睑痉挛、上睑下垂、缺损、皮肤松弛症、睑外翻、睑内翻、倒睫、针眼、睑板腺囊肿、睑板腺炎、泪腺阻塞、泪腺阻塞、脂溢性角膜炎、光化性角膜炎、细菌感染或病毒感染。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式局部施用于眼表面。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式眶周施用。
在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、乳膏或软膏。在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过滴管、泵、喷雾、点击笔或滚轮/储库装置局部施用。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过刷子、棉签、指尖或刮铲局部施用于至少一只眼睛的眶周皮肤,并且其中在施用过程之前可以使用刻度滴管、注射器、点击笔或移液管。
在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天一次施用。
在一个方面,本文提供了适于局部眶周施用的药物组合物,其包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。
在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、乳膏或软膏。在一些实施方案中,组合物被配制为油溶液。在一些实施方案中,组合物包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.6%、至少约99.7%、至少约99.8%、至少约99.9%、至少约99.95%、至少约99.96%、至少约99.97%、至少约99.98%或至少约99.99%(w/w)的量的油。在一些实施方案中,所述油衍生自天然来源。在一些实施方案中,油衍生自植物、植物种子或坚果或它们的任何组合。在一些实施方案中,所述油包含中链甘油三酯。在一些实施方案中,所述中链甘油三酯包含C6、C8、C10或C12脂肪酸的混合物。
在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。在一些实施方案中,所述药物组合物被配置为每次施用分配约10ng至约5mg的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。
在一些实施方案中,所述组合物还包含润肤剂、湿润剂、增稠剂、防腐剂、渗透增强剂或它们的任何组合。
在一个方面,本文提供了适于局部眼表面施用的药物组合物,其包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐和聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述PEG与蓖麻油的比率为约20:1至约50:1。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约1%(w/w)的量存在。
在一些实施方案中,所述组合物还包含眼表润滑剂。在一些实施方案中,所述眼表润滑剂为聚乙二醇、丙二醇、聚乙烯醇、蓖麻油或甘油。在一些实施方案中,所述眼表润滑剂以所述组合物的约0.05%至约2%(w/w)的量存在。在一些实施方案中,所述组合物还包含缓冲剂。在一些实施方案中,其中所述药物组合物具有约6.5至约8.5的pH。
在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。
在一个方面,本文提供了促进个体的眼部健康、预防或治疗眼部疾病的方法,其包括向所述个体的眼睛的眶周皮肤施用包含ω-3脂肪酸或其药学上可接受的酯或盐的局部药物组合物。在一些实施方案中,ω-3脂肪酸分离自鱼组织。在一些实施方案中,ω-3脂肪酸分离自磷虾、具有黑色大眼睛和淡红色半透明身体的小虾样甲壳纲动物。在一些实施方案中,ω-3脂肪酸分离自植物来源。在一些实施方案中,ω-3脂肪酸包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)或它们的任何组合。在一些实施方案中,ω-3脂肪酸包括DHA。在一些实施方案中,如果用作眼垫,则所述ω-3脂肪酸以约0.01mg/眼至约10000mg/眼、约0.01mg/眼至约3000mg/眼、约0.01mg/眼至约1000mg/眼、约0.01mg/眼至约500mg/眼、或约0.01mg/眼至约100mg/眼的量施用;如果不用作眼垫,则在眶周皮肤上每只眼每次施用约0.01mg至约200mg,或约0.01mg至约100mg、约0.01mg至约50mg、约0.01mg至约25mg、约0.01mg至约10mg、约0.01mg至约5mg、约0.01mg至约1mg,或约0.01mg至约0.5mg的量。
在一个方面,本文提供了促进个体的眼部健康、预防或治疗眼部疾病的方法,所述方法包括向所述个体的眼睛的眶周皮肤施用包含ω-3脂肪酸乙酯或其药学上可接受的酯或盐的局部药物组合物。在一些实施方案中,ω-3脂肪酸乙酯衍生自鱼组织。在一些实施方案中,ω-3脂肪酸乙酯衍生自植物来源。在一些实施方案中,ω-3脂肪酸包括α-亚油酸乙酯、二十碳五烯酸乙酯、二十二碳六烯酸乙酯或它们的任何组合。在一些实施方案中,如果用作眼垫,则所述ω-3脂肪酸乙酯以约0.01mg/眼至约5000mg/眼、约0.01mg/眼至约3000mg/眼、约0.01mg/眼至约1000mg/眼、约0.01mg/眼至约500mg/眼,或约0.01mg/眼至约100mg/眼的量施用;如果不用作眼垫,则在眶周皮肤上每只眼每次施用约0.01mg至约200mg,或约0.01mg至约100mg、约0.01mg至约50mg、约0.01mg至约25mg、约0.01mg至约10mg、约0.01mg至约5mg、约0.01mg至约1mg,或约0.01mg至约0.5mg的量。
在一些实施方案中,所述局部药物组合物被配制为乳膏、乳液、软膏或油溶液。在一些实施方案中,所述局部药物组合物还包含润肤剂、湿润剂、增稠剂、防腐剂、渗透增强剂、抗氧化剂、掩味剂或它们的任何组合。在一些实施方案中,所述组合物还包含防腐剂。
在一些实施方案中,将所述局部药物组合物用带有滚珠的瓶、点击笔刷、泵瓶或滴眼瓶、眼垫和棉签施用。
在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防与年龄相关的视力丧失。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防干眼症。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防年龄相关性黄斑变性。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防干性年龄相关性黄斑变性。
在一些实施方案中,将所述局部药物组合物每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者。在一些实施方案中,所述方法包括将所述组合物施用于上眼睑上方的眶周皮肤、下眼睑下方的眶周皮肤或上眼睑上方和下眼睑下方两者的眶周皮肤。
在一些实施方案中,向眶周皮肤施用组合物导致施用后30分钟个体的眼睛的视网膜中ω-3脂肪酸的组织浓度比基线高至少110微克/克。
在一个方面,本文提供了适于局部眶周施用的药物组合物,其包含ω-3脂肪酸或其药学上可接受的酯或盐和药学上可接受的赋形剂。
在一些实施方案中,所述ω-3脂肪酸分离自鱼组织。在一些实施方案中,所述ω-3脂肪酸分离自植物来源。在一些实施方案中,其中所述ω-3脂肪酸包含α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)或它们的任何组合。在一些实施方案中,所述ω-3脂肪酸包含DHA。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约0.01%至约100%(w/w)的量存在。
在一些实施方案中,所述组合物被配制为乳膏、乳液、软膏或油溶液。
在一些实施方案中,所述组合物还包含润肤剂、湿润剂、增稠剂、防腐剂、渗透增强剂、抗氧化剂、掩味剂或它们的任何组合。在一些实施方案中,所述组合物还包含防腐剂。在一些实施方案中,所述防腐剂是维生素E。
在一些实施方案中,所述组合物还包含脂肪酸媒介物。在一些实施方案中,脂肪酸媒介物以所述组合物的约0、0.1%至约99%的量存在。在一些实施方案中,所述脂肪酸媒介物为C14至C22脂肪酸。在一些实施方案中,所述脂肪酸媒介物包含亚油酸。
在一些实施方案中,所述组合物包含占所述组合物的约0、0.1%至约100%(w/w)的量的油。在一些实施方案中,所述油衍生自天然来源。在一些实施方案中,所述油衍生自植物、植物种子或坚果。
在一个方面,本文提供了治疗患有眼后部的疾病或病症的患者的所述疾病或病症的方法,所述方法包括将治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐施用于所述患者的眼睛的眶周皮肤。在一些实施方案中,所述眼后部的疾病或病症包括视网膜疾病。在一些实施方案中,所述视网膜疾病包括来自视网膜或脉络膜血管系统的出血。在一些实施方案中,所述出血由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。在一些实施方案中,所述视网膜疾病或病症包括来自视网膜或脉络膜血管系统的血浆渗漏。在一些实施方案中,所述血浆渗漏由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。在一些实施方案中,所述视网膜疾病或病症包括涉及视网膜或脉络膜血管系统的黄斑水肿形成。在一些实施方案中,所述眼后部的疾病或病症为年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性、多种视网膜病变、包括但不限于糖尿病性视网膜病变变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)或屈光不正(近视、远视和散光)。在一些实施方案中,所述方法还包括向患者施用另外的治疗剂。在一些实施方案中,所述另外的治疗剂为VEGF抗体、小分子VEGF拮抗剂、靶向VEGF受体的siRNA、TNFα抗体、小分子TNFα受体拮抗剂、靶向TNFα受体的siRNA、炎性细胞因子受体拮抗剂、针对炎性细胞因子的抗体、酪氨酸激酶抑制剂、丝氨酸/苏氨酸-蛋白激酶抑制剂、激酶抑制剂、甾体抗炎剂、非甾体抗炎剂、免疫抑制剂、抗胆碱能剂、沙利度胺、前列腺素受体拮抗剂、神经保护剂、神经营养剂、神经再生剂、降眼压药、抗生素、抗病毒剂、补体抑制剂、白介素受体抑制剂、白三烯受体抑制剂、肿瘤发生和发展的抑制剂、血管生成抑制剂,或具有抗氧化或抗微血管渗漏特性的药剂。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺预防性地、作为紧急干预、或根据需要施用以实现所需的补救效果。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式施用。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、洗剂、乳膏或软膏。在一些实施方案中,所述组合物为软膏。在一些实施方案中,所述软膏包含矿脂、蜂蜡或可可脂。在一些实施方案中,所述软膏包含矿脂和中链甘油三酯。在一些实施方案中,所述中链甘油三酯包含C6、C8、C10和C12脂肪酸的混合物。在一些实施方案中,所述中链甘油三酯包含辛酸和癸酸的混合物。在一些实施方案中,所述软膏包含比例为约1:1(v/v)、约2:1(v/v)、约3:1(v/v)、约4:1(v/v)、约5:1(v/v),或约6:1(v/v)的矿脂和中链甘油三酯。在一些实施方案中,所述软膏包含比例为约4:1(v/v)的矿脂和中链甘油三酯。在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。在一些实施方案中,通过滴管、泵、喷雾、点击笔或滚轮/储库装置将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于患者的至少一只眼睛的眶周皮肤。在一些实施方案中,通过刷子、棉签或刮铲将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于患者的至少一只眼睛的眶周皮肤,并且任选地在施用过程之前使用刻度滴管、注射器、点击笔或移液管。在一些实施方案中,通过胶带剥离、微晶换肤术、溶剂、脉冲激光器、电离子透入疗法或它们的组合辅助眶周皮肤渗透。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于患者的每只眼睛的眶周皮肤。在一些实施方案中,每天一次施用所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述方法包括将所述组合物施用于上眼睑上方的眶周皮肤、下眼睑下方的眶周皮肤或上眼睑上方和下眼睑下方两者的眶周皮肤。在一些实施方案中,所述另外的治疗剂为ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和所述ω-3脂肪酸或其药学上可接受的酯或盐作为单一组合物配制并施用。
在另一个方面,本文提供了治疗患有眼后部的疾病或病症的患者的所述疾病或病症的方法,所述方法包括将治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐施用于所述患者的眼睛的眼表面。在一些实施方案中,所述眼后部的疾病或病症包括视网膜疾病。在一些实施方案中,所述视网膜疾病包括来自视网膜或脉络膜血管系统的出血。在一些实施方案中,所述出血由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。在一些实施方案中,所述视网膜疾病或病症包括来自视网膜或脉络膜血管系统的血浆渗漏。在一些实施方案中,所述血浆渗漏由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。在一些实施方案中,所述视网膜疾病或病症包括视网膜或脉络膜血管系统中的黄斑水肿形成。在一些实施方案中,所述眼后部的疾病或病症为年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性;多种视网膜病变、包括但不限于糖尿病性视网膜病变变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)或屈光不正(近视、远视和散光)。在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性。在一些实施方案中,所述眼后部的疾病或病症为后部葡萄膜炎。在一些实施方案中,所述方法还包括向患者施用另外的治疗剂。在一些实施方案中,所述另外的治疗剂为小分子VEGF拮抗剂、靶向VEGF受体的siRNA、小分子TNFα受体拮抗剂、靶向TNFα受体的siRNA、炎性细胞因子受体拮抗剂、酪氨酸激酶抑制剂、丝氨酸/苏氨酸-蛋白激酶抑制剂、激酶抑制剂、甾体抗炎剂、非甾体抗炎剂、免疫抑制剂、抗胆碱能剂、沙利度胺、前列腺素受体拮抗剂、神经保护剂、神经再生剂、降眼压药、抗生素、抗病毒剂、补体抑制剂、白介素受体抑制剂、白三烯受体抑制剂、肿瘤发生和发展的抑制剂、血管生成抑制剂,或具有抗氧化或抗微血管渗漏特性的药剂。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式施用,其中所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、乳膏、软膏,所述组合物在脂质体中或在纳米颗粒中。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者的每只眼睛的眼表面。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天一次施用。在一些实施方案中,所述另外的治疗剂为ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,所述ω-3脂肪酸或其药学上可接受的酯或盐以组合物形式眶周施用。
在另外的方面,本文提供了治疗患有葡萄膜炎的患者的葡萄膜炎的方法,所述方法包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。在另外的方面,本文提供了治疗患有翼状胬肉的患者的翼状胬肉的方法,所述方法包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。在另外的方面,本文提供了治疗患有眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐,其中所述眼部疾病或病症为眼前节发育不良、白内障、虹膜炎、翼状胬肉、角膜结膜炎、角膜炎、结膜炎、圆锥角膜、扩张性病症(包括球形角膜、透明角膜边缘变性)、假晶状体性和无晶状体性大泡性角膜病变、巩膜外层炎、角膜溃疡、角膜发育异常、角膜溃疡、Fuchs’内皮营养不良和其它角膜营养不良(包括格子状、颗粒状、斑块状和地图状点状指纹状)、眼部瘢痕性类天疱疮、StevensJohnson综合征、急性和慢性葡萄膜炎(前部葡萄膜炎、中间葡萄膜炎)、对角膜、结膜和前段的创伤,包括虹膜创伤或穿透性眼创伤。在另外的方面,本文提供了治疗患有影响眼睑的眼部疾病或病症的患者的所述疾病或病症的方法,所述方法包括向所述患者的眼睛施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐,其中所述影响眼睑的眼部疾病或病症为睑缘炎、眼睑痉挛、睑板腺囊肿、上睑下垂、缺损、皮肤松弛症、睑外翻、睑内翻、倒睫、针眼、睑板腺炎、睑板腺功能障碍、泪腺阻塞、泪腺阻塞、脂溢性角膜炎、光化性角膜炎、细菌感染或病毒感染。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式局部施用于眼表面。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式眶周施用。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式局部施用于眼表面,并以组合物形式单独地眶周施用。在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、乳膏或软膏,所述组合物在脂质体中或在纳米颗粒中,具有或不具有siRNA或抗体的共并入。在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过滴管、泵、喷雾、点击笔或滚轮/储库装置局部施用。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过刷子、棉签或刮铲局部施用于至少一只眼睛的眶周皮肤,并且其中在施用过程之前可以使用刻度滴管、注射器、点击笔或移液管。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天一次施用。在一些实施方案中,所述方法还包括向患者的眼睛的眶周皮肤施用包含ω-3脂肪酸或其药学上可接受的酯或盐的局部药物组合物。
在另外的方面,本文提供了适于局部眶周施用的药物组合物,其包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、乳膏、软膏,所述组合物在脂质体中或在纳米颗粒中,具有或不具有siRNA或抗体的共并入。在一些实施方案中,所述组合物被配制为油溶液。在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.6%、至少约99.7%、至少约99.8%、至少约99.9%、至少约99.95%、至少约99.96%、至少约99.97%、至少约99.98%或至少约99.99%(w/w)的量的油。在一些实施方案中,所述油衍生自天然来源。在一些实施方案中,所述油衍生自植物、植物种子或坚果或它们的任何组合。在一些实施方案中,所述油包含中链甘油三酯。在一些实施方案中,所述中链甘油三酯包含C6、C8、C10或C12脂肪酸的混合物。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.00015%至约10%(w/w)的量存在。在一些实施方案中,所述药物组合物被配置为每次施用每只眼睛分配约0.5微克(μg)至约5毫克(mg)的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述药物组合物还包含润肤剂、湿润剂、增稠剂、防腐剂、渗透增强剂或它们的任何组合。在一些实施方案中,所述药物组合物还包含ω-3脂肪酸或其药学上可接受的酯或盐。
在另外的方面,本文提供了适于局部眼表面施用的药物组合物,其包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐和聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述PEG与蓖麻油的比率为约20:1至约50:1。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%,或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约1%(w/w)的量存在。在一些实施方案中,所述药物组合物还包含眼表润滑剂。在一些实施方案中,所述眼表润滑剂为聚乙二醇、丙二醇、聚乙烯醇、蓖麻油或甘油。在一些实施方案中,所述眼表润滑剂以所述组合物的约0.05%至约2%(w/w)的量存在。在一些实施方案中,所述药物组合物还包含缓冲剂。在一些实施方案中,所述药物组合物具有约6.5至约8.5的pH。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。
在另外的方面,本文提供了在个体中促进眼部健康或预防或治疗眼部疾病的方法,所述方法包括向所述个体的眼睛的眶周皮肤施用包含ω-3脂肪酸或其药学上可接受的酯或盐的局部药物组合物。在一些实施方案中,所述ω-3脂肪酸分离自鱼组织。在一些实施方案中,所述ω-3脂肪酸分离自植物来源。在一些实施方案中,所述ω-3脂肪酸包含α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)或它们的任何组合。在一些实施方案中,所述ω-3脂肪酸包含DHA。在一些实施方案中,所述ω-3脂肪酸包含EPA。在一些实施方案中,所述ω-3脂肪酸以约0.1mg至约3000mg、约0.1mg至约1000mg、约0.1mg至约500mg、约0.1mg至约200mg,或约0.1mg至约100mg的量施用。在一些实施方案中,所述局部药物组合物被配制为乳膏、乳液、软膏或油溶液。在一些实施方案中,所述局部药物组合物还包含润肤剂、湿润剂、增稠剂、防腐剂、渗透增强剂、抗氧化剂、掩味剂或它们的任何组合。在一些实施方案中,所述局部药物组合物还包含防腐剂。在一些实施方案中,所述局部药物组合物还包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。在一些实施方案中,将所述局部药物组合物用带有滚珠的瓶、点击笔刷、泵瓶或滴眼瓶和棉签施用。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防干眼病和眼部不适、刺激、疼痛和应激、化学烧伤、眼前节发育不良、白内障、虹膜炎、翼状胬肉、角膜结膜炎、角膜炎、结膜炎、圆锥角膜、扩张性病症(包括球形角膜、透明角膜边缘变性)、假晶状体性和无晶状体性大泡性角膜病变、巩膜外层炎、角膜溃疡、角膜发育异常、角膜溃疡、Fuchs’内皮营养不良和其它角膜营养不良(包括格子状、颗粒状、斑块状和地图状点状指纹状)、眼部瘢痕性类天疱疮、Stevens Johnson综合征、急性和慢性葡萄膜炎(前部葡萄膜炎、中间葡萄膜炎)、对角膜,结膜和前段的创伤、包括虹膜创伤、穿透性眼创伤、睑缘炎、眼睑痉挛、睑板腺囊肿、上睑下垂、缺损、皮肤松弛症、睑外翻、睑内翻、倒睫、针眼、睑板腺炎、睑板腺功能障碍、泪腺阻塞、泪腺阻塞、脂溢性角膜炎、光化性角膜炎、细菌感染或病毒感染,年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性;多种视网膜病变,包括但不限于糖尿病性视网膜病变变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)、屈光不正(近视、远视和散光)、眼眶的淋巴管畸形(又名眼眶淋巴管瘤)、甲状腺眼病(格雷夫斯眼病)或急性和慢性葡萄膜炎(包括中间葡萄膜炎、后部葡萄膜炎、全葡萄膜炎)。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防干眼症。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防湿性或干性年龄相关性黄斑变性。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防多种视网膜病变,包括但不限于糖尿病性视网膜病变变、早产儿视网膜病变。在一些实施方案中,将所述局部药物组合物每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者。在一些实施方案中,所述方法包括将所述组合物施用于上眼睑上方的眶周皮肤、下眼睑下方的眶周皮肤或上眼睑上方和下眼睑下方两者的眶周皮肤。在一些实施方案中,向眶周皮肤施用组合物导致施用后30分钟个体的眼睛的视网膜中ω-3脂肪酸的组织浓度比基线高至少110微克/克。
在另外的方面,本文提供了适于局部眶周施用的药物组合物,其包含ω-3脂肪酸或其药学上可接受的酯或盐和药学上可接受的赋形剂。在一些实施方案中,所述ω-3脂肪酸分离自鱼组织。在一些实施方案中,所述ω-3脂肪酸分离自植物来源。在一些实施方案中,所述ω-3脂肪酸包含α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)或它们的任何组合。在一些实施方案中,所述ω-3脂肪酸包含DHA。在一些实施方案中,所述ω-3脂肪酸包含EPA。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约0.01%至约100%(w/w)的量存在。在一些实施方案中,所述组合物被配制为乳膏、乳液、软膏或油溶液。在一些实施方案中,所述组合物还包含润肤剂、湿润剂、增稠剂、防腐剂、渗透增强剂、抗氧化剂、掩味剂或它们的任何组合。在一些实施方案中,所述制剂还包含防腐剂。在一些实施方案中,所述防腐剂为维生素E。在一些实施方案中,所述制剂还包含脂肪酸媒介物。在一些实施方案中,所述脂肪酸媒介物以所述组合物的约0.1%至约99%的量存在。在一些实施方案中,所述脂肪酸媒介物为C14至C22脂肪酸。在一些实施方案中,所述脂肪酸媒介物包含亚油酸。在一些实施方案中,所述制剂还包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述油衍生自天然来源。在一些实施方案中,所述油衍生自植物、植物种子或坚果。在一些实施方案中,所述制剂还包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
在另外的方面,本文提供了治疗患有眼后部的疾病或病症的患者的所述疾病或病症的方法,所述方法包括将治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐施用于所述患者的眼睛的眼睑的外部皮肤。在一些实施方案中,所述眼后部的疾病或病症包括视网膜疾病。在一些实施方案中,所述视网膜疾病包括来自视网膜或脉络膜血管系统的出血。在一些实施方案中,所述出血由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。在一些实施方案中,所述视网膜疾病或病症包括来自视网膜或脉络膜血管系统的血浆渗漏。在一些实施方案中,所述血浆渗漏由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。在一些实施方案中,所述视网膜疾病或病症包括涉及视网膜或脉络膜血管系统的黄斑水肿形成。在一些实施方案中,所述眼后部的疾病或病症为年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性;多种视网膜病变,包括但不限于糖尿病性视网膜病变变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)或屈光不正(近视、远视和散光)。在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性。在一些实施方案中,所述眼后部的疾病或病症为后部葡萄膜炎。在一些实施方案中,所述方法还包括向患者施用另外的治疗剂。在一些实施方案中,所述另外的治疗剂为VEGF抗体、小分子VEGF拮抗剂、靶向VEGF受体的siRNA、TNFα抗体、小分子TNFα受体拮抗剂、靶向TNFα受体的siRNA、炎性细胞因子受体拮抗剂、针对炎性细胞因子的抗体、酪氨酸激酶抑制剂、丝氨酸/苏氨酸-蛋白激酶抑制剂、激酶抑制剂、甾体抗炎剂、非甾体抗炎剂、免疫抑制剂、抗胆碱能剂、沙利度胺、前列腺素受体拮抗剂、神经保护剂、神经营养剂、神经再生剂、降眼压药、抗生素、抗病毒剂、补体抑制剂、白介素受体抑制剂、白三烯受体抑制剂、肿瘤发生和发展的抑制剂、血管生成抑制剂,或具有抗氧化或抗微血管渗漏特性的药剂。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺预防性地、作为紧急干预、或根据需要施用以实现所需的补救效果。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以组合物形式施用。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.0001%至约10%(w/w)的量存在。在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、洗剂、乳膏或软膏。在一些实施方案中,所述组合物为软膏。在一些实施方案中,所述软膏包含矿脂、蜂蜡或可可脂。在一些实施方案中,软膏包含矿脂和中链甘油三酯。在一些实施方案中,所述中链甘油三酯包含C6、C8、C10和C12脂肪酸的混合物。在一些实施方案中,所述中链甘油三酯包含辛酸和癸酸的混合物。在一些实施方案中,所述软膏包含比例为约1:1(v/v)、约2:1(v/v)、约3:1(v/v)、约4:1(v/v)、约5:1(v/v)或约6:1(v/v)的矿脂和中链甘油三酯。在一些实施方案中,所述软膏包含比例为约4:1(v/v)的矿脂和中链甘油三酯。在一些实施方案中,所述组合物为水溶液。在一些实施方案中,所述水溶液包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%或约0.1%至约20%(w/w)的量存在。在一些实施方案中,所述组合物包含眼表润滑剂。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过滴管、泵、喷雾、点击笔或滚轮/储库装置施用于所述患者的眼睛的眼睑的外部皮肤。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过刷子、棉签或刮铲施用于所述患者的眼睛的眼睑的外部皮肤,并且其中任选地在施用过程之前使用刻度滴管、注射器、点击笔或移液管。在一些实施方案中,眼睑皮肤渗透通过胶带剥离、微晶换肤术、溶剂、脉冲激光器、电离子透入疗法或它们的组合来辅助。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者的每只眼睛的眼睑皮肤。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺每天一次施用。在一些实施方案中,所述另外的治疗剂为ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和所述ω-3脂肪酸或其药学上可接受的酯或盐作为单一组合物配制并施用。
在另一个方面,本文提供了被配制用于局部施用于患者的眶周皮肤的活性成分,其用于制备治疗眼后部的疾病或病症的药物,其中所述制剂将治疗有效量的被配制用于局部施用于患者的眶周皮肤的所述活性成分递送至眼的后部。在一些实施方案中,活性成分具有小于或等于1000Da的分子量。在一些实施方案中,活性成分具有200-500Da的分子量。在一些实施方案中,每次使用将1毫升至10毫升的制剂局部施用于患者的单眼的眶周皮肤,其中使用眼垫局部施用活性成分。在一些实施方案中,每次使用将3微升至100微升的制剂直接局部施用于患者的单眼的眶周皮肤。在一些实施方案中,每次使用将0.01毫克至10克的活性成分局部施用于患者的单眼的眶周皮肤,其中使用眼垫局部施用活性成分。在一些实施方案中,每次使用将0.01毫克至100毫克的活性成分直接局部施用于患者的单眼的眶周皮肤。在一些实施方案中,所述制剂还包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述油衍生自天然来源。在一些实施方案中,所述油衍生自植物、植物种子或坚果。在一些实施方案中,所述油包含中链甘油三酯。在一些实施方案中,所述油包含大豆油。在一些实施方案中,所述活性成分为ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,所述ω-3脂肪酸或其药学上可接受的酯或盐包含α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)或它们的任何组合。在一些实施方案中,所述ω-3脂肪酸或其药学上可接受的酯或盐包含DHA。在一些实施方案中,所述ω-3脂肪酸或其药学上可接受的酯或盐包含EPA。在一些实施方案中,所述ω-3脂肪酸或其药学上可接受的酯或盐以所述组合物的约0.01%至约100%(w/w)的量存在。在一些实施方案中,施用6.7mg制剂导致施用后30分钟患者眼睛后部中ω-3脂肪酸30的组织浓度比基线高约110微克/克。在一些实施方案中,所述制剂还包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。在一些实施方案中,在眼睛的后部组织中可检测的活性成分的预期范围为约0.1μg至约1600μg/克后部组织。在一些实施方案中,将所述活性成分每天四次、每天三次、每天两次或每天一次施用于患者的每只眼睛的眶周皮肤。在一些实施方案中,所述活性成分为4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.00005%至约10%(w/w)的量存在。在一些实施方案中,所述制剂还包含ω-3脂肪酸或其药学上可接受的酯或盐。
通过引入作为参考
本说明书中提到的所有公开、专利和专利申请都通过引用并入到本文中,其程度如同每个单独的公开、专利或专利申请被具体地且单独地指出通过引用并入到本文中一样。
附图的简要说明
图1显示了眼睛的眶周区域的解剖学。
图2A显示了在用JV-DE1双边给药的兔子的右眼中JV-DE1的生物利用度,其中JV-DE1作为局部眼用制剂直接给药至眼表面。
图2B显示了在用JV-DE1双边给药的兔子的左眼中JV-DE1的生物利用度,其中JV-DE1作为局部眼用制剂直接给药至眼表面。
图3A显示在用JV-DE1右眼中给药的兔子的右眼中的JV-DE1的生物利用度,其中JV-DE1作为局部眼用制剂直接给药至眼表面。
图3B显示在用JV-DE1右眼中给药的兔子的左眼中的JV-DE1的生物利用度,其中JV-DE1作为局部眼用制剂直接给药至眼表面。
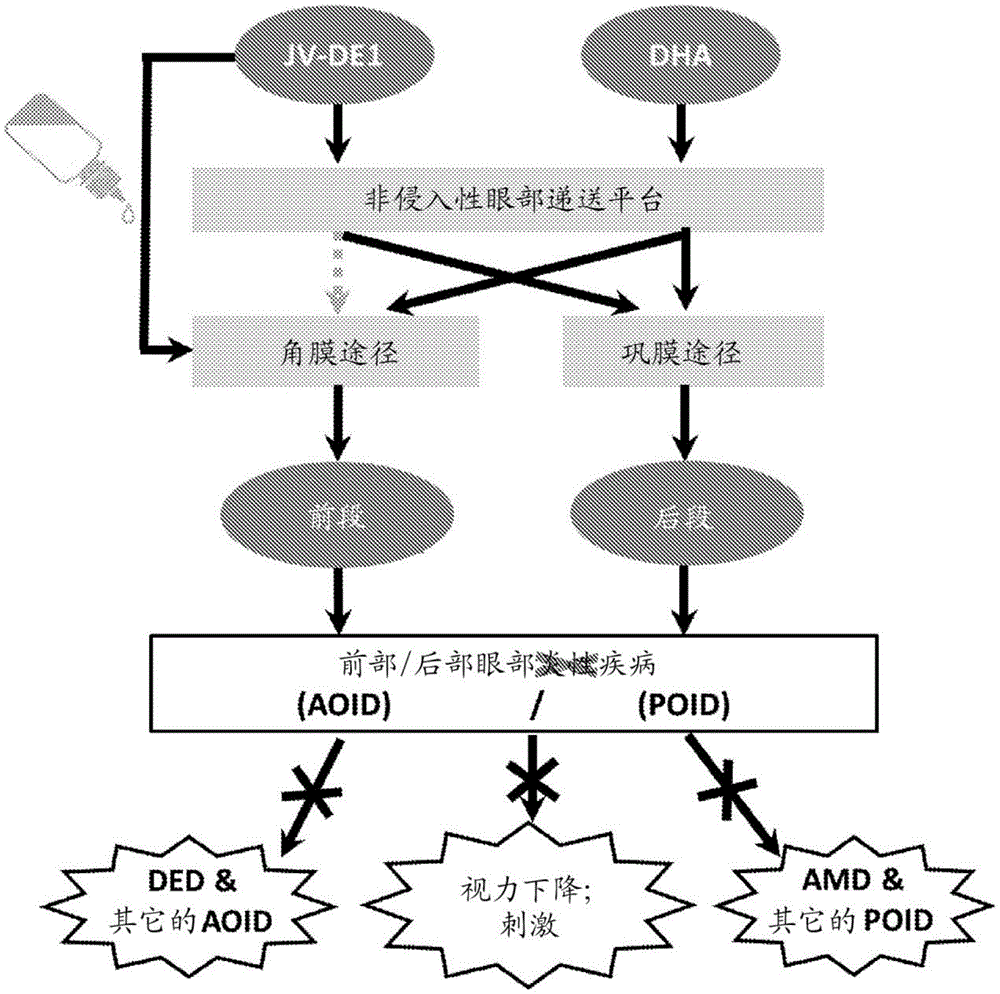
图4示例性说明了通过非侵入性眶周应用,化合物(例如本文公开的化合物)经由角膜途径递送至眼睛的前段,并且经由巩膜途径递送至眼睛的后段。
发明的详细说明
本文提供了化合物4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(也称为JV-DE1、JV-MD2)作为眼部疾病的治疗的用途。在一些实施方案中,眼部疾病是与眼睛的后段相关的疾病和病症。所配制的化合物通过滴眼剂施用于眼表面后但更有利地通过施用于眶周皮肤后实现在眼后段中的生物利用度。在一些实施方案中,所配制的化合物通过非侵入性眼部递送平台(NIODP)施用。非侵入性眼部递送平台(NIODP)是眶周皮肤透皮施用与适当的药物制剂的组合,以递送高于μg/g的眼部组织的眼部药物,特别是视网膜药物。
所公开的实施方案涉及治疗眼部疾病,包括眼前段的疾病,以及出乎意料地眼后段的疾病。这些疾病可以由眼睛的后段、眼睛的前段引起,或者作为全身疾病的结果,所述全身疾病例如糖尿病、类风湿性关节炎和系统性高血压作为非限制性实例。包括能够将治疗上足够量的化合物递送至眼后极的制剂,其通过滴眼剂施用于眼表面或施用于围绕眼球的眶周皮肤来实现。
本文还提供了用于经由眶周施用将脂肪酸(包括ω-3脂肪酸)递送至眼睛的方法和组合物。令人惊讶的是,在本文中已经发现ω-3脂肪酸,包括二十二碳六烯酸(DHA),可以经由眶周施用被有效地递送至眼睛并遍及眼睛,包括递送至眼睛的后部。这种施用途径为DHA和具有能使得通过滴眼剂进行施用是不合需要的油性特征的其它脂肪酸提供了几个优点。以这种方式施用ω-3脂肪酸可用于促进眼部健康、预防或治疗眼部疾病,包括年龄相关性黄斑变性(AMD)。
本文还公开了用于经由施用于眼睑的外表面将脂肪酸(包括ω-3脂肪酸)直接递送至眼睛的方法和组合物。
眼后部的疾病
视网膜疾病危及视力和由此引起的损害,并可最终导致全视力丧失。它们是常见的,并且主要的危险因素是“常见的嫌疑者”:年龄、肥胖和吸烟。视网膜和脉络膜血管系统的异常,特别是出血和血浆渗出,是由于系统性疾病的结果而发生的,系统性疾病包括糖尿病、高血压、脂肪性肝病、肥胖、头部创伤、贫血和白血病。
视网膜具有两种血液供应,即脉络膜血管系统和视网膜血管系统。脉络膜循环为视网膜色素上皮、光感受器和外网层提供基于血液的营养。视网膜循环为内核、丛状层、神经节和神经纤维层提供血源性营养。黄斑由视网膜中央动脉的上支和颞支供应。视网膜循环在解剖学上被定位为进入玻璃体内的出血来源。
源自视网膜本身的疾病包括但不限于年龄相关性黄斑变性、黄斑裂孔、黄斑皱褶、变性、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉分枝阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的和新生儿的视网膜病症、巨细胞病毒(cmv)视网膜感染、葡萄膜炎、感染性视网膜炎、中心性浆液性视网膜病变、视网膜母细胞瘤、眼内炎和地图样萎缩、视网膜色素变性等。视网膜新生血管形成也可能是由于儿童近视的结果而发生的(Bremond-Gignac D,2020,Med Sci,
来自脉络膜和/或视网膜血管系统的出血是严重的事情。目前没有用于治疗视网膜出血的“列出的”药物。在预防血管生成方面非常有效的抗VEGF抗体在治疗玻璃体出血方面具有很小的价值(El Annan,Carvounis PE,2014,Int Ophthalmol Clin
在糖尿病性视网膜病变变中已经报道了升高的前列环素水平(Davis TME,et al.(1981)Br Med J
血管生成在某些视网膜病变的发展中也是一个突出的特征。血管内皮生长因子(VEGF)在一些情况下产生脉络膜新生血管形成,抗VEGF抗体被广泛用作脉络膜新生血管形成的有效治疗。全身施用的受体选择性IP受体拮抗剂也显示有效预防脉络膜新生血管形成;这在美国专利号US 9295665和US 9321745中首次公开。这种新形成的血管允许组织血液灌注但倾向于出血并允许血浆渗出,这导致组织肿胀(水肿)和视网膜尺寸的最终变化,这对于最佳视觉是关键的。除VEGF外,血管生成因子,如bFGF(D’Amore P.,1994,InvestOphthalmol Vis Sci
视网膜疾病中视力丧失的另一个主要原因是黄斑水肿。黄斑对于中央视觉是必不可少的。由于黄斑的增厚和变形,流体外渗到黄斑区域导致视力受损。长久以来已知增加的血流量增加了流体渗出到组织中,特别是前列腺素类介导的血管舒张(Williams TJ,PeckMJ(1977)Nature
视网膜疾病是视力丧失的主要原因。它们的特征在于多种病理,包括出血、水肿、血管生成、炎症、纤维化和萎缩,其可以发生在单一事件或排列中。血管生成和所得后遗症可以被针对血管内皮生长因子(VEGF)的抗体消除。视网膜抗体治疗需要注射到位于眼球后房的玻璃体液中。玻璃体内注射基本上是不希望的。眼科医生继续花费大量的努力来降低抗体注射到眼睛中的频率。将滴眼剂自我施用于眼表面对于治疗眼睛疾病是典型的和优选的。然而,施加到眼表面的药物不能充分地达到眼睛的后段(Awwad S et al.,2017,Br JPharmacol
IP受体拮抗作用代表了用于治疗与视网膜和脉络膜血管系统相关的出血、血浆渗出、新生血管形成和黄斑水肿的可替换的和另外的作用机制,所述视网膜和脉络膜血管系统向位于眼后段的组织提供血源性营养。目前主流的治疗干预是玻璃体内注射能隔绝VEGF或其受体的蛋白质。将VEGF抗体注射到玻璃体内不是没有风险的。视网膜抗体治疗需要注射到眼后房中,这基本上是不希望的。每次注射的眼内炎、视网膜脱离和创伤性白内障的发生率分别被报道为0.16%、0.17%和0.07%((Michels S,2006,Br J Ophthalmol
独立于VEGF释放,IP拮抗剂将减少微血管系统的血液灌注,从而减少水肿形成和潜在的出血。4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(也被指定数字标识RO-1138452和JV-DE1)是独特的,因为它还具有PAF受体拮抗剂特性,这将抑制新生血管形成和纤维化。由于失明是许多患者不可避免的结果,因此向眼科医生目前使用的用于视网膜疾病的有效药物的小医疗设备中添加4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺将是无价的。
本文提供了治疗个体的眼后部疾病、视网膜疾病或病症的方法,所述方法包括向所述个体施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于眶周皮肤。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼睛。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面。
在一些实施方案中,眼后部疾病、视网膜疾病或病症为年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性;多种视网膜病变、包括但不限于糖尿病性视网膜病变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)或屈光不正(近视、远视和散光)。
在一些实施方案中,所述视网膜疾病或病症为年龄相关性黄斑变性(湿性和干性)。在一些实施方案中,所述视网膜疾病或病症为干性年龄相关性黄斑变性。在一些实施方案中,所述视网膜疾病或病症为湿性年龄相关性黄斑变性。
在一些实施方案中,所述视网膜疾病或病症不为视网膜新生血管形成。在一些实施方案中,所述视网膜疾病或病症不为新生血管形成。在一些实施方案中,所述视网膜疾病或病症不包括视网膜新生血管形成。
葡萄膜炎
本文还提供了治疗葡萄膜炎的方法,所述方法包括向患者的眼睛施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用并局部施用于眼表面。
葡萄膜炎是以被称为葡萄膜的眼睛部分的炎症为特征的疾病,葡萄膜由三个部分组成:虹膜、睫状体和脉络膜。有4种类型的葡萄膜炎。(1)前部葡萄膜炎,最常见且通常较不严重的类型,影响眼睛前部的虹膜;(2)中间葡萄膜炎影响睫状体和玻璃体;(3)后部葡萄膜炎影响眼睛后部的视网膜和脉络膜;(4)全葡萄膜炎影响葡萄膜的所有部分,从眼睛的前部到后部。全葡萄膜炎是最严重形式的葡萄膜炎,其也可影响晶状体、视网膜、视神经和玻璃体,引起视力降低或失明。可以施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺来治疗前部葡萄膜炎、中间葡萄膜炎、后部葡萄膜炎或全葡萄膜炎,或其组合。葡萄膜炎可具有感染性或非感染性原因。感染性原因包括细菌、真菌、寄生虫和病毒感染。非感染性原因包括免疫问题、变态反应、恶性肿瘤和未知的原因。作为大多数类型的葡萄膜炎(包括全葡萄膜炎)的治疗选择,皮质类固醇滴眼剂已经用于减轻炎症和疼痛,口服药物或注射剂已经用于治疗严重的病例。感染性葡萄膜炎可以使用或不使用皮质类固醇的情况下用对感染原特异的抗生素、抗寄生物剂或抗病毒剂治疗。对于不能通过短期使用皮质类固醇控制的慢性的、复发的、严重的葡萄膜炎,例如中间葡萄膜炎、后部葡萄膜炎和/或全葡萄膜炎,或在干扰日常活动的活跃性炎症的情况下,需要通过眼部注射递送的免疫调节药物(生物制剂)。因此,以非侵入性方式将治疗疾病的化合物递送至眼睛后部的方法提供了相对于现有治疗的实质性改善。
近视
近视的治疗还受益于对眶周皮肤施加的治疗干预,所述眶周皮肤直接覆在巩膜上。一个广泛存在的概念涉及由离焦图像产生的形觉剥夺会导致视网膜将信号传输到巩膜,并且由此通过改变巩膜来产生眼球长轴的延伸(Wang et al.,1997;Gallego et al.,2012)。眶周皮肤途径递送的药物可在巩膜和视网膜两者处产生治疗有效的药物水平。有趣的是,已报道抗青光眼剂溴莫尼定(Carr et al.,2019)和拉坦前列素(El-Nimri andWildsoet,2018)在其动物模型中抑制近视进展。
眼前部的疾病
本文还提供了治疗与眼睛前部相关的某些疾病和病症的方法。此类疾病的实例包括睑缘炎、眼睑痉挛、睑板腺囊肿、上睑下垂、缺损、皮肤松弛症、睑外翻、睑内翻、倒睫、针眼、睑板腺炎、睑板腺功能障碍、泪腺阻塞、泪腺阻塞、脂溢性角膜炎、光化性角膜炎、细菌感染或病毒感染、眼前节发育不良、白内障、虹膜炎、翼状胬肉、角膜结膜炎、角膜炎、结膜炎、圆锥角膜、扩张性病症(包括球形角膜、透明角膜边缘变性)、假晶状体性和无晶状体性大泡性角膜病变、巩膜外层炎、角膜溃疡、角膜发育异常、角膜溃疡、Fuchs’内皮营养不良和其它角膜营养不良(包括格子状、颗粒状、斑块状和地图状点状指纹状)、眼部瘢痕性类天疱疮、Stevens Johnson综合征、急性和慢性葡萄膜炎(前部葡萄膜炎、中间葡萄膜炎)、对角膜、结膜和前段的创伤,包括虹膜创伤、穿透性眼创伤。在一些实施方案中,所述疾病或病症包括眼前部炎性疾病。在一些实施方案中,所述疾病或病症是与炎症、出血、水肿或纤维化相关的眼前部病症。在一些实施方案中,这些疾病或病症可以用前列腺素类IP受体拮抗剂或抑制剂治疗,例如4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(又名JV-DE1)。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可以通过施用于眼表面(例如,以液滴制剂)来治疗眼前部的疾病。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可通过眶周皮肤施用来治疗眼前部的疾病。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可以通过施用于眼表面(例如,以液滴制剂)和施用于眶周皮肤两者来治疗眼前部的疾病。在一些实施方案中,这些疾病或病症可用ω-3脂肪酸或其药学上可接受的酯或盐治疗。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐眶周施用于患者以治疗患者的眼前段的疾病或病症。
炎症在某些眼前部的疾病的发展中起重要作用,包括干眼症、葡萄膜炎和翼状胬肉。已经提出VEGF是炎症和这些疾病之间交互作用的核心分子,这可以解释了这些疾病共存的高发生率(Liu C,Song Y,etal.2020)。
当用TNFα预先处理巨噬细胞以模拟炎症事件时,IP受体刺激有效力地且高度有效地促进VEGF从人类免疫细胞中释放。IP拮抗剂4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺在TNFα存在下消除由IP受体激动剂西卡前列素诱导的VEGF释放(US9321745)。因此,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺由于其抗炎作用可以在与炎症有关的眼前部的疾病中提供治疗作用。
血小板活化因子(PAF)是炎症的介导物并且可以引起对眼睛的损伤。各种PAF拮抗剂,例如4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(又名JV-DE1)已经显示出减少前部葡萄膜炎中的微血管系统渗漏(Lin N and Bazan H,etal.1991;Rubin RM,Samples JR,et al.1988),减少角膜移植物中的新生血管形成和减少嗜酸性粒细胞积聚(Cohen RA,Gebhardt BM,et al.1992)。因此,PAF拮抗剂可用于减轻眼前部的眼部炎症反应,例如血管通透性和趋化活性,以及眼后部的眼部炎症反应(Bazan H,Yao Y,et al.1994)。银杏提取物在诸如低氧/局部缺血、癫痫发作和周围神经损伤等条件下具有神经保护特性。银杏提取物的组分之一,银杏内酯B是有效的血小板活化因子(PAF)拮抗剂(Smith P,Maclennan K,et al,1996)。
翼状胬肉
本文提供了通过向患者施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺来治疗患者的翼状胬肉的方法。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用和局部施用于眼表面。在一些实施方案中,治疗睑裂斑或翼状胬肉包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和另一种抗炎剂。
在疾病的早期阶段,翼状胬肉通常无症状;然而,可能存在干眼症(例如灼热、瘙痒或流泪)的迹象,因为病变引起眼表面的不规则润湿。翼状胬肉上皮细胞的独特特征是其对正常结膜细胞、角膜缘细胞或角膜细胞中不存在的不同类型的基质金属蛋白酶的免疫组织化学染色呈阳性(Krachmer,J.H.et al.2005)。局部用的皮质类固醇滴眼剂的短期使用可用于减轻发红和炎症。在眼睛的干燥度是问题的情况下,使用人工泪液来保持眼睛良好地润滑。可能存在更严重的症状,例如发红(由于局部组织出血)、肿胀和疼痛。除了通过VEGF抑制的抗炎特性之外,已经显示IP受体拮抗剂涉及通过抑制血管扩张的出血抑制。
一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,该方法包括向眼表面局部施用包含抗炎剂的组合物。在一些实施方案中,通过滴眼剂实现向眼表面局部施用抗炎剂以治疗睑裂斑或翼状胬肉。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,所述方法包括将包含IP和/或PAF受体的拮抗剂的组合物局部施用于眼表面。在一些实施方案中,通过滴眼剂实现将包含IP和/或PAF受体的拮抗剂的组合物局部施用于眼表面以治疗睑裂斑或翼状胬肉。一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,所述方法包括将包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的组合物局部施用于眼表面。在一些实施方案中,使用滴眼剂实现将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面。
一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,该方法包括向眼睑施用包含抗炎剂的组合物。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,该方法包括向眼睑施用包含IP和/或PAF受体的拮抗剂的组合物。一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,其包括向眼睑施用包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的组合物。在一些实施方案中,治疗睑裂斑或翼状胬肉包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和另一种抗炎剂。
一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,所述方法包括眶周施用包含抗炎剂的组合物。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,其包括眶周施用包含IP和/或PAF受体的拮抗剂的组合物。一个实施方案提供治疗睑裂斑或翼状胬肉的方法,其包括眶周施用包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的组合物。一个实施方案提供了治疗睑裂斑或翼状胬肉的方法,包括眶周施用包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物。
其它眼前部疾病
本文还提供了用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗其它的眼前部疾病的方法。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面以治疗眼前部疾病。在一些实施方案中,使用滴眼剂实现将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面以治疗眼前部疾病。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于个体的眼睑。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过滴眼剂和眶周或眼睑施用的组合进行施用以治疗眼前部疾病。
本文还提供了用ω-3脂肪酸或其药学上可接受的酯或盐治疗眼前部疾病的方法。在一些实施方案中,ω-3脂肪酸或其药学上可接受的酯或盐眶周施用于患者以治疗患者眼前段的疾病或病症。
在一些实施方案中,眼前部疾病或病症为眼前节发育不良、白内障、虹膜炎、翼状胬肉、角膜结膜炎、角膜炎、结膜炎、圆锥角膜、扩张性病症(包括球形角膜、透明角膜边缘变性)、假晶状体性和无晶状体性大泡性角膜病变、巩膜外层炎、角膜溃疡、角膜发育异常、角膜溃疡、Fuchs’内皮营养不良和其它角膜营养不良(包括格子状、颗粒状、斑块状和地图状点状指纹状)、眼部瘢痕性类天疱疮、Stevens Johnson综合征、急性和慢性葡萄膜炎(前部葡萄膜炎、中间葡萄膜炎)、对角膜,结膜和前段的创伤,包括虹膜创伤、穿透性眼创伤。
在一些实施方案中,眼前部疾病或病症是干眼、干眼病、眼部不适、刺激、疼痛和应激或化学烧伤。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐眶周施用于患者以治疗干眼、干眼病、眼部不适、刺激、疼痛和应激或化学烧伤。
在一些实施方案中,眼睛的前部区域的疾病或病症是影响眼睑的病况。在一些实施方案中,眼睑病况为睑缘炎、眼睑痉挛、睑板腺囊肿、上睑下垂、缺损、皮肤松弛症、睑外翻、睑内翻、倒睫、针眼、睑板腺炎、睑板腺功能障碍、泪腺阻塞、泪腺阻塞、脂溢性角膜炎、光化性角膜炎、细菌感染或病毒感染。
在一些实施方案中,通过将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于眼睛的眶周皮肤来治疗眼睑病况。在一些实施方案中,通过将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于个体的眼睑来治疗眼睑病况。在一些实施方案中,通过将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于眼表面来治疗眼睑病况。在一些实施方案中,使用滴眼剂实现将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面以治疗眼睑病况。
在一些实施方案中,通过将ω-3脂肪酸或其药学上可接受的酯或盐施用于眼睛的眶周皮肤来治疗眼睑病况。在一些实施方案中,通过将ω-3脂肪酸或其药学上可接受的酯或盐施用于个体的眼睑来治疗眼睑病况。
影响眼睛的前段和后段的疾病
本文还提供了治疗与眼睛的前部和后部两者相关的某些疾病和病症的方法。这类疾病的实例包括眼眶的淋巴管畸形(即,眼眶淋巴管瘤)、甲状腺眼病(格雷夫斯眼病)、急性和慢性葡萄膜炎(包括中间葡萄膜炎、后部葡萄膜炎、全葡萄膜炎)。在一些实施方案中,这些疾病或病症可以用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可以通过向眼表面施用(例如,以液滴制剂)来治疗眼前部的疾病。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可通过眶周皮肤施用来治疗眼后部的疾病。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可以通过施用于眼表面(例如,以液滴制剂)和施用于眶周皮肤来治疗影响眼睛的前段和后段的疾病。在一些实施方案中,这些疾病或病症可用ω-3脂肪酸或其药学上可接受的酯或盐治疗。在一些实施方案中,通过眶周皮肤施用ω-3脂肪酸或其药学上可接受的酯或盐以治疗患者眼睛的前段和后段。在一些实施方案中,这些疾病或病症可以用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐的组合治疗。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐一起配制为单一组合物以施用于患者的眶周皮肤。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面(例如,以液滴制剂),并且通过替代方式,例如施用于患者的眶周皮肤,递送ω-3脂肪酸或其药学上可接受的酯或盐。
葡萄膜炎(包括全葡萄膜炎)
葡萄膜炎是由眼睛内的炎症反应引起的。葡萄膜炎治疗主要试图消除炎症或减轻疼痛。前部葡萄膜炎发生在眼睛的前部。它是葡萄膜炎最常见的形式。中间葡萄膜炎通常见于年轻成年人。炎症的中心经常出现在玻璃体内。后部葡萄膜炎是葡萄膜炎最不常见的形式。它主要发生在眼睛的后部,经常涉及视网膜和脉络膜。治疗取决于患者所显示的葡萄膜炎的类型。一些治疗,例如使用皮质类固醇滴眼剂和眼睛周围或眼睛内的注射剂,可以排他地靶向眼睛,而当在两只眼睛中,特别是在两只眼睛的后部中发生疾病时,可以使用其它治疗,例如通过口摄取免疫抑制剂。还可能发生涉及眼前段和眼后段的全葡萄膜炎。
本文还提供了通过向患者施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺来治疗患者的葡萄膜炎的方法。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面。在一些实施方案中,使用滴眼剂实现向眼表面局部施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过滴眼剂和眶周施用的组合进行施用。
本文还提供了通过向患者施用治疗有效量的ω-3脂肪酸或其药用的酯或盐来治疗患者的葡萄膜炎的方法。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐眶周施用。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐施用于患者的眼睑。在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐。
一个实施方案提供了治疗全葡萄膜炎或葡萄膜炎的方法,该方法包括将包含免疫抑制剂的组合物局部施用于眼表面。在一些实施方案中,通过滴眼剂实现将免疫抑制剂局部施用于眼表面以治疗全葡萄膜炎或葡萄膜炎。在一些实施方案中,所述免疫抑制剂为甲氨蝶呤、麦考酚酯、硫唑嘌呤或环孢菌素。
一个实施方案提供了治疗全葡萄膜炎或葡萄膜炎的方法,其包括眶周施用包含免疫抑制剂的组合物。在一些实施方案中,所述免疫抑制剂为甲氨蝶呤、麦考酚酯、硫唑嘌呤或环孢菌素。
一个实施方案提供了治疗全葡萄膜炎或葡萄膜炎的方法,该方法包括向眼睑施用包含免疫抑制剂的组合物。在一些实施方案中,所述免疫抑制剂为甲氨蝶呤、麦考酚酯、硫唑嘌呤或环孢菌素。在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和免疫抑制剂。在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和免疫抑制剂。在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和免疫抑制剂。
一个实施方案提供了治疗全葡萄膜炎或葡萄膜炎的方法,该方法包括将包含抗炎剂的组合物局部施用于眼表面。在一些实施方案中,通过滴眼剂实现向眼表面局部施用抗炎剂以治疗全葡萄膜炎或葡萄膜炎。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。
一个实施方案提供了治疗全葡萄膜炎或葡萄膜炎的方法,其包括眶周施用包含抗炎剂的组合物。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。
一个实施方案提供了治疗全葡萄膜炎或葡萄膜炎的方法,该方法包括向眼睑施用包含抗炎剂的组合物。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和抗炎剂。在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和抗炎剂。
在一些实施方案中,治疗全葡萄膜炎或葡萄膜炎包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和抗炎剂。
甲状腺眼病
甲状腺眼病也可称为格雷夫斯眼病、格雷夫斯眼病变或格雷夫斯眼眶病。甲状腺眼病通常在患有由格雷夫斯病引起的甲状腺功能亢进的人中发展。格雷夫斯病是由针对存在于甲状腺细胞中和眼后细胞表面上的受体的抗体引起的自身免疫性疾病。甲状腺眼病可导致眼睛的刺激感或砂砾感、结膜的发红或炎症、过度流泪或干眼、眼睑肿胀、对光敏感、眼睛的向前移位或隆起(眼球突出)和双重视觉。在更晚期的甲状腺眼病病例中,患者可能经历眼睛运动减少、眼睛不完全闭合伴角膜溃疡、视神经受压和很少受压、视力丧失。
甲状腺眼病治疗主要试图消除炎症或减轻疼痛。治疗可以包括向患者的眼睛施加冷敷、佩戴太阳眼镜、滴眼剂润滑、抬高患者的头部、棱镜眼镜、类固醇、眼睑手术、眼肌手术、眼眶减压手术、或对胰岛素样生长因子-1受体(IGF-1R)的抗体。
本文还提供了通过向患者施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺来治疗患者的甲状腺眼病的方法。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面。在一些实施方案中,使用滴眼剂实现向眼表面局部施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺通过滴眼剂和眶周施用的组合进行施用。
本文还提供了通过向患者施用治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐来治疗患者的甲状腺眼病的方法。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐眶周施用。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐施用于患者的眼睑。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐。
一个实施方案提供了治疗甲状腺眼病的方法,其包括将包含免疫抑制剂的组合物局部施用于眼表面。在一些实施方案中,通过滴眼剂实现向眼表面局部施用免疫抑制剂以治疗甲状腺眼病。在一些实施方案中,所述免疫抑制剂为甲氨蝶呤、麦考酚酯、硫唑嘌呤或环孢菌素。
一个实施方案提供了治疗甲状腺眼病的方法,其包括眶周施用包含免疫抑制剂的组合物。在一些实施方案中,所述免疫抑制剂为甲氨蝶呤、麦考酚酯、硫唑嘌呤或环孢菌素。
一个实施方案提供了治疗甲状腺眼病的方法,其包括向眼睑施用包含免疫抑制剂的组合物。在一些实施方案中,免疫抑制剂为甲氨蝶呤、麦考酚酯、硫唑嘌呤或环孢菌素。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和免疫抑制剂。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和免疫抑制剂。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和免疫抑制剂。
一个实施方案提供了治疗甲状腺眼病的方法,该方法包括将包含抗炎剂的组合物局部施用于眼表面。在一些实施方案中,通过滴眼剂实现向眼表面局部施用抗炎剂以治疗甲状腺眼病。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。
一个实施方案提供了治疗甲状腺眼病的方法,所述方法包括眶周施用包含抗炎剂的组合物。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。
一个实施方案提供了治疗甲状腺眼病的方法,所述方法包括向眼睑施用包含抗炎剂的组合物。在一些实施方案中,所述抗炎剂为非甾体抗炎剂。在另一个实施方案中,所述药剂是类固醇、COX抑制剂或能够阻断单一受体或多种受体的前列腺素类受体抑制剂。在另一个实施方案中,所述药剂是皮质激素类(corticoands),例如但不限于可的松、泼尼松龙、氟米龙、地塞米松、甲羟松、氯替泼诺、氟扎可特、氢化可的松、泼尼松、倍他米松、甲基泼尼松龙、曲安奈德、hexacatonide、醋酸帕拉米松、二氟拉松、氟轻松(fluocinonide)、肤轻松(fluocinolone)和曲安西龙。在另一个实施方案中,所述药剂是非甾体抗炎剂,例如阿司匹林、双氯芬酸、罗非考昔、布洛芬或吲哚美辛。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和抗炎剂。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和抗炎剂。在一些实施方案中,治疗甲状腺眼病包括施用治疗有效量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐和抗炎剂。
眼眶淋巴管瘤
淋巴管瘤也称为淋巴管畸形,是涉及淋巴管系统和血管系统的多囊性局部畸形,最常发生在头和颈中,并且通常在出生或两岁年龄内显现。眼眶淋巴管瘤特征性地涉及结膜下组织和眼周组织。浅眼眶结构或眼眶前结构的病变通常被早期诊断。在大量患者中,淋巴管畸形具有在PIK3CA基因中的激活突变。已知PIK3CA通过PI3K/mTOR通路发信号,在调节细胞生长中起作用。n-3多不饱和脂肪酸(PUFA),即二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),快速且有效地抑制mTOR复合物1(mTORC1)和mTORC2及其下游信号传导。并且随后在促进细胞凋亡的同时抑制细胞增殖和血管生成(Chen Z,et al.,2014,Oncogene,33,4548–4557)。除了上睑下垂(眼睑下垂)之外,症状包括肿胀、眶内出血、眼球突出、蜂窝织炎(皮肤受影响区域的发红、肿胀和疼痛)、结膜中的囊泡(Wiegand et al.,2013)。这些都是可由JV-DE1和ω-3多不饱和脂肪酸抑制的炎症的典型症状。
本文提供了治疗眼眶淋巴管瘤或任何炎性眼病的方法,所述方法包括向患者的眼睛施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,将所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面(例如,以液滴制剂)。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺眶周施用和局部施用于眼表面。
本文还提供了治疗眼眶淋巴管瘤或任何炎性眼病的方法,所述方法包括向患者的眼睛的眶周施用ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐与4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺组合以治疗眼眶淋巴管瘤或任何其它炎性眼病。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐一起配制为单一组合物施用于患者的眶周皮肤。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面(例如,以液滴制剂),并且通过替代方式,例如施用于患者的眶周皮肤,递送ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐递送至患者的眶周皮肤。
目前,治疗淋巴管畸形的主要治疗选择是主动观察,经皮引流,手术,硬化治疗,激光治疗,射频消融,或口服药物西罗莫司或西地那非的医药治疗。硬化疗法是总称,其特征在于将多种类型的药剂注射(通常在超声引导下)到病变的囊状空间中,导致瘢痕形成和减小囊肿和病变的尺寸。用于治疗眼眶淋巴管瘤的硬化疗法中的具体药剂包括OK-432(Picinibil)、十四烷基硫酸钠、强力霉素、乙醇、平阳霉素和博来霉素。
本文提供了通过向患者的眶周皮肤施用治疗有效量的十四烷基硫酸钠或其盐,游离酸或酯来治疗眼眶淋巴管瘤的方法。本文还提供了通过向患者的眶周皮肤施用治疗有效量的强力霉素或其盐、游离酸或酯来治疗眼眶淋巴管瘤的方法。本文还提供了通过向患者的眶周皮肤施用治疗有效量的平阳霉素或其盐、游离酸或酯来治疗眼眶淋巴管瘤的方法。本文还提供了通过向患者的眶周皮肤施用治疗有效量的博来霉素或其盐、游离酸或酯来治疗眼眶淋巴管瘤的方法。
尽管淋巴管瘤的原因是未知的,但在大量患者中存在PIK3CA基因中的激活突变。已知PIK3CA通过PI3K/mTOR通路的信号传导在调节细胞生长中起作用。最确定的mTOR抑制剂已经在针对各种肿瘤类型的临床试验中显示出肿瘤反应。西罗莫司(一种mTOR抑制剂)已被FDA批准通过口服施用治疗淋巴管畸形。另外,n-3多不饱和脂肪酸(PUFA),例如ω-3,可以在体外和体内消除mTORC1/2途径的活性,其具有预防癌症和抑制肿瘤的潜能(Chen etal.,2014)。本文提供了通过向患者的眶周皮肤施用治疗有效量的mTOR抑制剂治疗眼眶淋巴管瘤的方法。在一些实施方案中,mTOR抑制剂为西罗莫司、艾代拉里斯、库潘尼西、度维利塞、阿培利司、厄布利塞、林普利塞、布帕尼西或BGB-10188。在一些实施方案中,mTOR抑制剂和ω-3脂肪酸或其药学上可接受的酯或盐的组合被施用于患者的眶周皮肤。
本文还提供了通过向患者的眶周皮肤施用治疗有效量的磷酸二酯酶5(PDE-5)抑制剂治疗眼眶淋巴管瘤的方法。在一些实施方案中,PDE-5抑制剂为西地那非。在一些实施方案中,将PDE-5抑制剂和ω-3脂肪酸或其药学上可接受的酯或盐的组合施用于患者的眶周皮肤。
JV-DE1
本文通过将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(JV-DE1)作为滴眼剂施用于眼表面或通过施用于眶周皮肤实现了治疗某些眼部疾病的解决方案。出人意料地和令人惊讶地,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺施用于眶周皮肤为玻璃体液和视网膜提供了比通过滴眼剂获得的生物利用度大得多的生物利用度。
化合物4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(又名JV-DE1、RO-1138452、CAY 10441)在治疗视网膜疾病中具有特别的价值。它在单个分子中体现了两个重要的药理学性质;它既是前列腺素类IP受体拮抗剂又是血小板活化因子(PAF)拮抗剂(Bley et al.,2006)。在血管IP受体处,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺具有8.2的pA2(Jones RL et al.(2006)Br JPharmacol
与JV-DE1的组合
在治疗各种眼睛疾病或病症(包括眼睛后部的疾病或病症,例如视网膜疾病或后部葡萄膜炎)中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(又名JV-DE1、RO-1138452、CAY 10441)可以与一种或多种另外的治疗剂组合。化合物4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可以与一种或多种另外的治疗剂组合,并且该组合可以眶周施用、通过滴眼剂局部施用于眼表面,或局部施用于个体的眼睑。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用ω-3脂肪酸,包括二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用VEGF抗体或其功能片段。在一些实施方案中,施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺减少了另外需要被施用以产生预期治疗效果的VEGF抗体的量。在一些实施方案中,减少的VEGF抗体的量表现为VEGF抗体的较低剂量,或优选地,VEGF抗体的较少或较不频繁的注射(例如,较少注射到患者的眼睛中)。在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被施用小分子VEGF受体拮抗剂代替VEGF抗体或除了VEGF抗体之外被施用小分子VEGF受体拮抗剂。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用酪氨酸激酶抑制剂。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用甾体抗炎剂。在一些实施方案中,所述甾体抗炎剂选自可的松、泼尼松龙、甲基泼尼松龙、raimcinolone、氟米龙、甲羟松、地塞米松、氯替泼诺(lotprednol)、hexacatonide、倍他米松、帕拉米松、二氟拉松、氟轻松、肤轻松、氟替卡松和曲安西龙。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用非甾体抗炎剂。在一些实施方案中,非甾体抗炎剂选自酮咯酸、奈帕芬胺、氨芬酸、阿司匹林、吲哚美辛、氟比洛芬、布洛芬、罗非考昔和塞来考昔。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用免疫抑制剂。
在一些实施方案中,免疫抑制剂选自环孢菌素,立他司特(liftegrast),甲氨蝶呤、硫唑嘌呤、PI3K-AKT-mTOR信号传导途径的抑制剂(例如西罗莫司、艾代拉里斯、库潘尼西、度维利塞、阿培利司、厄布利塞、林普利塞、布帕尼西或BGB-10188),和干扰补体途径的活化和功能的药剂(例如POT-4、ARC1905)。
在一些实施方案中,向患者共同施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和环孢菌素。
在一些实施方案中,向患者共同施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和立他司特。
在一些实施方案中,向患者共同施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和甲氨蝶呤。
在一些实施方案中,向患者共同施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和硫唑嘌呤。在一些实施方案中,向患者共同施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、西罗莫司、艾代拉里斯、库潘尼西、度维利塞、阿培利司、厄布利塞、林普利塞、布帕尼西或BGB-10188。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用烟碱类抗胆碱能剂。在一些实施方案中,所述烟碱类抗胆碱能剂选自六甲铵、十甲铵和mecamyline。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用沙利度胺。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用前列腺素受体拮抗剂。在一些实施方案中,拮抗剂阻断多种前列腺素受体。在一些实施方案中,拮抗剂是AGN 211377和AGN 225660。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用神经保护剂。
在一些实施方案中,神经保护剂选自α
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用神经营养剂/神经再生剂(例如,睫状神经营养因子、神经生长因子、脑源性神经营养因子、神经胶质源性神经营养因子1、神经营养因子3)、热休克蛋白、JNK抑制剂、合成胆汁酸(例如UDCA、TUDCA)、孕酮、多巴胺能、神经营养因子、半胱天冬酶抑制剂、乙酰基-L-肉碱、乙酰胆碱酯酶抑制剂、胞磷胆碱(citicoline)、乙酰半胱氨酸、类视黄醇(例如芬维A胺)、emixustat、抗蛋白质聚集剂、磷酸二酯酶抑制剂、烟酰胺、大麻素、胞二磷胆碱(citicholine)、姜黄素、米诺环素、依达拉奉、红细胞生成素、雌激素、L-茶氨酸、褪黑激素、米诺环素、诺普平(Noopept)、吡咯并喹啉醌、司来吉兰、辛伐他汀、艾氯胺酮、哌醋甲酯、珀奈莫德(ponesimod)、醋酸格拉默、帕潘立酮、和干扰补体途径的活化和功能的长春西汀药剂、和长春西汀。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用RNA干扰分子。
在一些实施方案中,RNA干扰分子可以是siRNA、miRNA或shRNA。
在一些实施方案中,RNA干扰分子与编码蛋白质的基因序列互补。在一些实施方案中,RNA干扰分子具有与编码蛋白质的基因序列至少部分互补的序列。在一些实施方案中,RNA干扰分子的存在产生编码蛋白质的基因的沉默。在一些实施方案中,蛋白质是受体。在一些实施方案中,进一步向患者施用于少两种RNA干扰分子的组合。在一些实施方案中,在至少两种RNA干扰分子的组合下,编码至少两种蛋白质的基因沉默。在一些实施方案中,蛋白质是酶。在一些实施方案中,蛋白质选自VEGF、PDGF、bFGF、SDF-1、HIF-1、PIGF、GLUT-1、Claudin细胞粘附分子、HMBG-1、HuR、Ets1、GSK3β、RTP801、半胱天冬酶2-、3-、7-、PGC-1、ICAM1、t-PA、SNAI1、TBK1、ARMS2、TERT、ASK-1和Nrf-2。
在一些实施方案中,RNA干扰分子是单链RNA。在一些实施方案中,RNA干扰分子是双链RNA。在一些实施方案中,RNA干扰分子的链长为约10个核苷酸至约200个核苷酸。在一些实施方案中,RNA干扰分子的链长为约10个核苷酸至约20个核苷酸、约10个核苷酸至约30个核苷酸、约10个核苷酸至约40个核苷酸、约10个核苷酸至约50个核苷酸、约10个核苷酸至约60个核苷酸、约10个核苷酸至约70个核苷酸、约10个核苷酸至约80个核苷酸、约10个核苷酸至约90个核苷酸、约10个核苷酸至约100个核苷酸、约10个核苷酸至约200个核苷酸、约20个核苷酸至约30个核苷酸、约20个核苷酸至约40个核苷酸、约20个核苷酸至约50个核苷酸、约20个核苷酸至约60个核苷酸、约20个核苷酸至约70个核苷酸、约20个核苷酸至约80个核苷酸、约20个核苷酸至约90个核苷酸、约20个核苷酸至约100个核苷酸、约20个核苷酸至约200个核苷酸、约30个核苷酸至约40个核苷酸、约30个核苷酸至约50个核苷酸、约30个核苷酸至约60个核苷酸、约30个核苷酸至约70个核苷酸、约30个核苷酸至约80个核苷酸、约30个核苷酸至约90个核苷酸、约30个核苷酸至约100个核苷酸、约30个核苷酸至约200个核苷酸、约40个核苷酸至约50个核苷酸、约40个核苷酸至约60个核苷酸、约40个核苷酸至约70个核苷酸、约40个核苷酸至约80个核苷酸、约40个核苷酸至约90个核苷酸、约40个核苷酸至约100个核苷酸、约40个核苷酸至约200个核苷酸、约50个核苷酸至约60个核苷酸、约50个核苷酸至约70个核苷酸、约50个核苷酸至约80个核苷酸、约50个核苷酸至约90个核苷酸、约50个核苷酸至约100个核苷酸、约50个核苷酸至约200个核苷酸、约60个核苷酸至约70个核苷酸、约60个核苷酸至约80个核苷酸、约60个核苷酸至约90个核苷酸、约60个核苷酸至约100个核苷酸、约60个核苷酸至约200个核苷酸、约70个核苷酸至约80个核苷酸、约70个核苷酸至约90个核苷酸、约70个核苷酸至约100个核苷酸、约70个核苷酸至约200个核苷酸、约80个核苷酸至约90个核苷酸、约80个核苷酸至约100个核苷酸、约80个核苷酸至约200个核苷酸、约90个核苷酸至约100个核苷酸、约90个核苷酸至约200个核苷酸,或约100个核苷酸至约200个核苷酸。在一些实施方案中,所述RNA干扰分子的链长为约10个核苷酸、约20个核苷酸、约30个核苷酸、约40个核苷酸、约50个核苷酸、约60个核苷酸、约70个核苷酸、约80个核苷酸、约90个核苷酸、约100个核苷酸,或约200个核苷酸。在一些实施方案中,所述RNA干扰分子的链长为至少约10个核苷酸、约20个核苷酸、约30个核苷酸、约40个核苷酸、约50个核苷酸、约60个核苷酸、约70个核苷酸、约80个核苷酸、约90个核苷酸,或约100个核苷酸。在一些实施方案中,所述RNA干扰分子的链长为至多约20个核苷酸、约30个核苷酸、约40个核苷酸、约50个核苷酸、约60个核苷酸、约70个核苷酸、约80个核苷酸、约90个核苷酸、约100个核苷酸,或约200个核苷酸。
在一些实施方案中,RNA干扰分子可以阻止VEGF受体的表达或减弱VEGF及其各种同种型的生物合成。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用RNA干扰分子,所述RNA干扰分子选自减少或消除受体表达或减少如下的生物合成的组:PDGF、bFGF、SDF-1、HIF-1、PIGF、GLUT-1、Claudin细胞粘附分子,HMBG-1、HuR、Ets1、GSK3β、RTP801、半胱天冬酶2-、3-、7-、PGC-1、ICAM1、t-PA、SNAI1、TBK1、SRPK1、C1Q、HtrA1、ARMS2、TERT、ASK-1和Nrf-2。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用抗氧化剂。在一些实施方案中,抗氧化剂选自β-胡萝卜素、叶黄素、玉米黄质、核黄素、烟酸和多不饱和脂肪酸,例如二十二碳六烯酸(DHA)、二十碳五烯酸(EPA)、维生素B3、维生素B6、维生素B9、维生素B12、维生素C、维生素E、CoQ10、胃促生长素、α-硫辛酸、白藜芦醇、类黄酮、银杏叶提取物、ICAPS
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用治疗性抗体。在一些实施方案中,治疗性抗体是PDGF、FGF、PIGF、SDF-1或HIF-1抗体。在一些实施方案中,治疗性抗体是干扰补体途径的活化和功能的抗体。在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的施用减少了需要施用以产生预期治疗效果的治疗性抗体的量。在一些实施方案中,减少治疗性抗体的量表现为较低剂量的治疗性抗体,或者优选地,治疗性抗体的较少或较不频繁的注射(例如,较少注射到患者的眼睛中)。
在一些实施方案中,用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺治疗的患者被进一步施用酰化、脱酰化、甲基化或脱甲基化组蛋白的治疗性表观遗传调节剂。
在一些实施方案中,采用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的治疗与另外的干预(例如激光手术或类固醇植入物)配对。
在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和另外的治疗剂一起配制(例如,作为施用于患者的眶周皮肤的单一组合物)。在一些实施方案中,另外的治疗剂通过替代的手段,例如注射、植入或口服施用来递送。
ω-3脂肪酸
世界卫生组织建议成人每天接受200毫克至500毫克的ω-3脂肪酸,包括二十二碳六烯酸(DHA)和二十碳五烯酸(EPA),以获得一般的健康益处。有三种主要形式的ω-3脂肪酸:冷水鱼油中富含的DHA和EPA和通常衍生自植物来源的α-亚麻酸(ALA)。
视网膜含有高浓度的DHA,这不仅在维持正常的视网膜完整性和视觉功能方面是重要的,而且在视网膜和脑中起抗炎、抗细胞凋亡、神经保护作用。除了其营养、神经保护和抗氧化性质外,DHA是通过涉及环氧合酶和脂氧合酶的途径用于消退素和相关化合物(例如,保护素)的重要前体,所述途径可消除视网膜和眼表面,特别是泪腺中的炎性反应,其中这些DHA衍生物涉及干眼病的发病机理(Cortina and Bazan,2011)。另外,ω-3脂肪酸,包括DHA,产生局部麻醉效果。已经显示DHA在大鼠中减弱感受伤害的张颌反射,并且可以是用于预防急性三叉神经伤害感受或三叉神经痛的治疗剂和补充的替代药物。DHA促进急性炎症的消退并潜在地抑制炎性和神经性疼痛。
口服施用大剂量的包括DHA在内的ω-3脂肪酸可有益于年龄相关性黄斑变性(AMD)、干眼病、视网膜色素变性和早产儿视网膜病变。然而,DHA是最难以口服摄入足够量的获得眼睛益处的物质之一,因为它包含在很少的食物来源中。另外,这些化合物的油性使得它们不宜作为滴眼剂直接放入眼睛中。因此,需要能够将治疗或预防相关量的ω-3脂肪酸递送至眼睛组织的递送方法。
为了克服这个问题,已经令人惊讶地发现,当施用于眼睛的眶周皮肤时,包括DHA的ω-3脂肪酸的施用在遍及眼睛的组织(包括眼睛的前部和后部两者)中提供了显著的生物分布。
在一个方面,本文提供了经由眶周皮肤施用将一种或多种ω-3脂肪酸递送至眼睛(包括前部和后部)的方法。ω-3脂肪酸可以衍生自任何合适的来源。在一些实施方案中,ω-3脂肪酸分离自鱼组织。鱼油中ω-3的浓度可以通过乙基化增加。在一些实施方案中,ω-3脂肪酸分离自植物来源。在一些实施方案中,ω-3脂肪酸的植物来源是藻类、海藻、紫菜、螺旋藻或小球藻。在一些实施方案中,ω-3脂肪酸的植物来源是亚麻籽油。
在一些实施方案中,ω-3脂肪酸是C16-C24ω-3脂肪酸,或C16-C24ω-3脂肪酸的组合。在一些实施方案中,ω-3脂肪酸是C18至C22ω-3脂肪酸,或C18至C22ω-3脂肪酸的组合。在一些实施方案中,ω-3脂肪酸是非常长链的单不饱和脂肪酸(VLCMUFA)或非常长链的多不饱和脂肪酸(VLCPUFA)。
在一些实施方案中,ω-3脂肪酸是十六碳三烯酸(HTA)、α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳三烯酸(ETE)、二十碳四烯酸(ETA)、二十碳五烯酸(EPA)、二十一碳五烯酸(HPA)、二十二碳五烯酸(DPA)、二十二碳六烯酸(DHA)、二十四碳五烯酸、二十四碳六烯酸、或其任何组合。在一些实施方案中,ω-3脂肪酸包括二十四碳烯酸、二十六碳烯酸、二十八碳烯酸或其任何组合。在一些实施方案中,ω-3脂肪酸包括ALA、EPA、DHA或其任何组合。在一些实施方案中,ω-3脂肪酸包含DHA。在一些实施方案中,ω-3脂肪酸包含EPA。在一些实施方案中,ω-3脂肪酸包含ALA。在一些实施方案中,ω-3脂肪酸包括DHA和EPA。
在一些实施方案中,ω-3脂肪酸为ω-3乙酯的形式。一旦在皮肤中,ω-3乙酯可以通过酯酶转化成ω-3游离酸,这可以容易地通过角质层的细胞间脂质和毛孔。在一些实施方案中,ω-3脂肪酸包括DHA酯。在一些实施方案中,ω-3脂肪酸包含EPA酯。在一些实施方案中,ω-3脂肪酸包含DHA乙酯。在一些实施方案中,ω-3脂肪酸包含EPA乙酯。在一些实施方案中,ω-3脂肪酸包括DHA和EPA两者的酯。在一些实施方案中,ω-3脂肪酸包括DHA和EPA两者的乙酯。在一些实施方案中,ω-3脂肪酸包括ω-3-羧酸(主要由EPA和DHA组成的游离脂肪酸)。在一些实施方案中,ω-3脂肪酸包含二十碳五烯酸乙酯(EPA的乙酯)。
在一些实施方案中,ω-3脂肪酸为ω-3甘油三酯的形式。天然鱼油含有ω-3脂肪酸EPA和DHA,主要是ω-3甘油三酯的形式。ω-3甘油三酯具有约900Da的分子量。一旦在皮肤中,ω-3甘油三酯可以通过脂肪酶转化成ω-3游离酸。ω-3甘油三酯也可以通过角质层的细胞间脂质并通过毛孔。
在一些实施方案中,ω-3脂肪酸的代谢物可以被施用于眼睛的眶周皮肤以在整个眼睛的组织(包括眼睛的前部和后部)中提供实质性的生物分布。在一些实施方案中,ω-3脂肪酸代谢物可以包含白三烯或其衍生物。在一些实施方案中,ω-3脂肪酸可包含脂氧素或其衍生物。在一些实施方案中,ω-3脂肪酸代谢物可以包含5-系列白三烯(LTB5、LTC5、LTD5、LTE5)。在一些实施方案中,ω-3脂肪酸代谢物可以包含前列腺素类,例如前列环素、血栓素或前列腺素或其衍生物。在一些实施方案中,ω-3脂肪酸代谢物可以包含3系列前列腺素类或前列腺素。在一些实施方案中,ω-3脂肪酸代谢物可以包含前列腺素A3。在一些实施方案中,ω-3脂肪酸代谢物可以包含前列腺素13。在一些实施方案中,ω-3脂肪酸代谢物可以包含前列腺素F2α。在一些实施方案中,ω-3脂肪酸代谢物可以包含血栓素A3。尽管EPA对于减轻身体中任何部位的慢性疼痛和炎症(例如:对于心血管健康或疾病)有很大帮助,但是DHA最适合脑。为了支持脑部健康,必需脂肪酸补充剂可以具有至少4:1的DHA与EPA的比率。在一些实施方案中,必需脂肪酸补充剂可以具有3:1的DHA与EPA的比率。在一些实施方案中,必需脂肪酸补充剂可以具有2:1的DHA与EPA的比率。在一些实施方案中,必需脂肪酸补充剂可以具有1:1的DHA与EPA的比率。在一些实施方案中,ω-3脂肪酸代谢物可以包含噬消素或其衍生物。在一些实施方案中,ω-3脂肪酸代谢物可以包含消退素或其衍生物。在一些实施方案中,ω-3脂肪酸代谢物可以包含保护素或其衍生物。
在一些实施方案中,本文提供了在个体中促进眼部健康、预防或治疗眼部疾病的方法,所述方法包括向所述个体的眼睛施用包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防与年龄相关的视力丧失。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防干眼症。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防年龄相关性黄斑变性。在一些实施方案中,促进眼部健康、预防或治疗眼部疾病包括治疗或预防干性年龄相关性黄斑变性。在一些实施方案中,促进眼部健康包括治疗急性炎症和神经性疼痛。在一些实施方案中,促进眼部健康包括预防急性三叉神经伤害感受或三叉神经痛。
在一些实施方案中,本文提供了治疗或预防个体的年龄相关的视力丧失的方法,所述方法包括向所述个体的眼睛施用包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于个体的眶周皮肤。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于患者的眼睑。
在一些实施方案中,本文提供了治疗或预防个体的干眼症的方法,所述方法包括向个体的眼睛施用包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物。在一些实施方案中,所述方法包括向个体的眼睛施用包含透明质酸、透明质酸盐或其药学上可接受的酯或盐的组合物。在一些实施方案中,所述方法包括向个体的眼睛施用包含ω-3脂肪酸和透明质酸、透明质酸盐或其药学上可接受的酯或盐的组合物。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于个体的眶周皮肤。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于患者的眼睑。
在一些实施方案中,本文提供了治疗或预防个体的年龄相关性黄斑变性的方法,所述方法包括向所述个体的眼睛施用包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于个体的眶周皮肤。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于患者的眼睑。
在一些实施方案中,本文提供了治疗或预防个体的干年龄相关性黄斑变性的方法,所述方法包括向所述个体的眼睛施用包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于个体的眶周皮肤。在一些实施方案中,将包含ω-3脂肪酸或其药学上可接受的酯或盐的组合物施用于患者的眼睑。
与ω-3脂肪酸组合
在治疗各种眼部疾病或病症中,包括眼睛后部的疾病或病症,例如视网膜疾病或后部葡萄膜炎,ω-3脂肪酸或其药学上可接受的酯或盐(DHA、EPA等)可以与一种或多种另外的治疗剂组合。ω-3脂肪酸或其药学上可接受的酯或盐可以与一种或多种另外的治疗剂组合,并且该组合可以眶周施用或局部施用于个体的眼睑。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用VEGF抗体或其功能片段。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用酪氨酸激酶抑制剂。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用甾体抗炎剂。在一些实施方案中,所述甾体抗炎剂选自可的松、泼尼松龙、甲基泼尼松龙、raimcinolone、氟米龙、甲羟松、地塞米松、氯替泼诺(lotprednol)、hexacatonide、倍他米松、帕拉米松、二氟拉松、氟轻松、肤轻松、氟替卡松和曲安西龙。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用非甾体抗炎剂。在一些实施方案中,非甾体抗炎剂选自酮咯酸、奈帕芬胺、氨芬酸、阿司匹林、吲哚美辛、氟比洛芬、布洛芬、罗非考昔和塞来考昔。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用免疫抑制剂。在一些实施方案中,免疫抑制剂选自环孢菌素,立他司特(liftegrast),甲氨蝶呤、硫唑嘌呤、PI3K-AKT-mTOR信号传导途径的抑制剂(例如西罗莫司、艾代拉里斯、库潘尼西、度维利塞、阿培利司、厄布利塞、林普利塞、布帕尼西或BGB-10188),和干扰补体途径的活化和功能的药剂(例如POT-4、ARC1905)。
在一些实施方案中,向患者共同施用ω-3脂肪酸或其药学上可接受的酯或盐和环孢菌素。
在一些实施方案中,向患者共同施用ω-3脂肪酸或其药学上可接受的酯或盐和立他司特。
在一些实施方案中,向患者共同施用ω-3脂肪酸或其药学上可接受的酯或盐和甲氨蝶呤。
在一些实施方案中,向患者共同施用ω-3脂肪酸或其药学上可接受的酯或盐和硫唑嘌呤。在一些实施方案中,向患者共同施用ω-3脂肪酸或其药学上可接受的酯或盐和PI3K-AKT-mTOR信号传导途径的抑制剂(例如西罗莫司、艾代拉里斯、库潘尼西、度维利塞、阿培利司、厄布利塞、林普利塞、布帕尼西或BGB-10188)。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用烟碱类抗胆碱能剂。在一些实施方案中,所述烟碱类抗胆碱能剂选自六甲铵、十甲铵和mecamyline。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用沙利度胺。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用前列腺素受体拮抗剂。在一些实施方案中,拮抗剂阻断多种前列腺素受体。在一些实施方案中,拮抗剂是AGN 211377和AGN 225660。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用神经保护剂。在一些实施方案中,神经保护剂选自α
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用神经营养剂/神经再生剂(例如,睫状神经营养因子、神经生长因子、脑源性神经营养因子、神经胶质源性神经营养因子1、神经营养因子3)、热休克蛋白、JNK抑制剂、合成胆汁酸(例如UDCA、TUDCA)、孕酮、多巴胺能、神经营养因子、半胱天冬酶抑制剂、乙酰基-L-肉碱、乙酰胆碱酯酶抑制剂、胞磷胆碱(citicoline)、乙酰半胱氨酸、类视黄醇(例如芬维A胺)、emixustat、抗蛋白质聚集剂、磷酸二酯酶抑制剂、烟酰胺、大麻素、胞二磷胆碱(citicholine)、姜黄素、米诺环素、依达拉奉、红细胞生成素、雌激素、L-茶氨酸、褪黑激素、米诺环素、诺普平(Noopept)、吡咯并喹啉醌、司来吉兰、辛伐他汀、艾氯胺酮、哌醋甲酯、珀奈莫德(ponesimod)、醋酸格拉默、帕潘立酮、和干扰补体途径的活化和功能的长春西汀药剂、和长春西汀。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用RNA干扰分子。在一些实施方案中,RNA干扰分子可以是siRNA、miRNA或shRNA。在一些实施方案中,RNA干扰分子与编码蛋白质的基因序列互补。在一些实施方案中,RNA干扰分子具有与编码蛋白质的基因序列至少部分互补的序列。在一些实施方案中,RNA干扰分子的存在产生编码蛋白质的基因的沉默。在一些实施方案中,蛋白质是受体。在一些实施方案中,进一步向患者施用于少两种RNA干扰分子的组合。在一些实施方案中,在至少两种RNA干扰分子的组合下,编码至少两种蛋白质的基因沉默。在一些实施方案中,蛋白质是酶。在一些实施方案中,蛋白质选自VEGF、PDGF、bFGF、SDF-1、HIF-1、PIGF、GLUT-1、Claudin细胞粘附分子、HMBG-1、HuR、Ets1、GSK3β、RTP801、半胱天冬酶2-、3-、7-、PGC-1、ICAM1、t-PA、SNAI1、TBK1、ARMS2、TERT、ASK-1和Nrf-2。
在一些实施方案中,RNA干扰分子是单链RNA。在一些实施方案中,RNA干扰分子是双链RNA。在一些实施方案中,RNA干扰分子的链长为约10个核苷酸至约200个核苷酸。在一些实施方案中,RNA干扰分子的链长为约10个核苷酸至约20个核苷酸、约10个核苷酸至约30个核苷酸、约10个核苷酸至约40个核苷酸、约10个核苷酸至约50个核苷酸、约10个核苷酸至约60个核苷酸、约10个核苷酸至约70个核苷酸、约10个核苷酸至约80个核苷酸、约10个核苷酸至约90个核苷酸、约10个核苷酸至约100个核苷酸、约10个核苷酸至约200个核苷酸、约20个核苷酸至约30个核苷酸、约20个核苷酸至约40个核苷酸、约20个核苷酸至约50个核苷酸、约20个核苷酸至约60个核苷酸、约20个核苷酸至约70个核苷酸、约20个核苷酸至约80个核苷酸、约20个核苷酸至约90个核苷酸、约20个核苷酸至约100个核苷酸、约20个核苷酸至约200个核苷酸、约30个核苷酸至约40个核苷酸、约30个核苷酸至约50个核苷酸、约30个核苷酸至约60个核苷酸、约30个核苷酸至约70个核苷酸、约30个核苷酸至约80个核苷酸、约30个核苷酸至约90个核苷酸、约30个核苷酸至约100个核苷酸、约30个核苷酸至约200个核苷酸、约40个核苷酸至约50个核苷酸、约40个核苷酸至约60个核苷酸、约40个核苷酸至约70个核苷酸、约40个核苷酸至约80个核苷酸、约40个核苷酸至约90个核苷酸、约40个核苷酸至约100个核苷酸、约40个核苷酸至约200个核苷酸、约50个核苷酸至约60个核苷酸、约50个核苷酸至约70个核苷酸、约50个核苷酸至约80个核苷酸、约50个核苷酸至约90个核苷酸、约50个核苷酸至约100个核苷酸、约50个核苷酸至约200个核苷酸、约60个核苷酸至约70个核苷酸、约60个核苷酸至约80个核苷酸、约60个核苷酸至约90个核苷酸、约60个核苷酸至约100个核苷酸、约60个核苷酸至约200个核苷酸、约70个核苷酸至约80个核苷酸、约70个核苷酸至约90个核苷酸、约70个核苷酸至约100个核苷酸、约70个核苷酸至约200个核苷酸、约80个核苷酸至约90个核苷酸、约80个核苷酸至约100个核苷酸、约80个核苷酸至约200个核苷酸、约90个核苷酸至约100个核苷酸、约90个核苷酸至约200个核苷酸,或约100个核苷酸至约200个核苷酸。在一些实施方案中,所述RNA干扰分子的链长为约10个核苷酸、约20个核苷酸、约30个核苷酸、约40个核苷酸、约50个核苷酸、约60个核苷酸、约70个核苷酸、约80个核苷酸、约90个核苷酸、约100个核苷酸,或约200个核苷酸。在一些实施方案中,所述RNA干扰分子的链长为至少约10个核苷酸、约20个核苷酸、约30个核苷酸、约40个核苷酸、约50个核苷酸、约60个核苷酸、约70个核苷酸、约80个核苷酸、约90个核苷酸,或约100个核苷酸。在一些实施方案中,所述RNA干扰分子的链长为至多约20个核苷酸、约30个核苷酸、约40个核苷酸、约50个核苷酸、约60个核苷酸、约70个核苷酸、约80个核苷酸、约90个核苷酸、约100个核苷酸,或约200个核苷酸。
在一些实施方案中,RNA干扰分子可以阻止VEGF受体的表达或减弱VEGF及其各种同种型的生物合成。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用RNA干扰分子,所述RNA干扰分子选自减少或消除受体表达或减少如下的生物合成的组:PDGF、bFGF、SDF-1、HIF-1、PIGF、GLUT-1、Claudin细胞粘附分子,HMBG-1、HuR、Ets1、GSK3β、RTP801、半胱天冬酶2-、3-、7-、PGC-1、ICAM1、t-PA、SNAI1、TBK1、SRPK1、C1Q、HtrA1、ARMS2、TERT、ASK-1和Nrf-2。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用抗氧化剂。在一些实施方案中,抗氧化剂选自β-胡萝卜素、叶黄素、玉米黄质、核黄素、烟酸和多不饱和脂肪酸,例如二十二碳六烯酸(DHA)、二十碳五烯酸(EPA)、维生素B3、维生素B6、维生素B9、维生素B12、维生素C、维生素E、CoQ10、胃促生长素、α-硫辛酸、白藜芦醇、类黄酮、银杏叶提取物、ICAPS
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用治疗性抗体。在一些实施方案中,治疗性抗体是PDGF、FGF、PIGF、SDF-1或HIF-1抗体。在一些实施方案中,治疗性抗体是干扰补体途径的活化和功能的抗体。在一些实施方案中,ω-3脂肪酸或其药学上可接受的酯或盐的施用减少了需要施用以产生预期治疗效果的治疗性抗体的量。在一些实施方案中,减少治疗性抗体的量表现为较低剂量的治疗性抗体,或者优选地,治疗性抗体的较少或较不频繁的注射(例如,较少注射到患者的眼睛中)。
在一些实施方案中,用ω-3脂肪酸或其药学上可接受的酯或盐治疗的患者被进一步施用酰化、脱酰化、甲基化或脱甲基化组蛋白的治疗性表观遗传调节剂。
在一些实施方案中,采用ω-3脂肪酸或其药学上可接受的酯或盐的治疗与另外的干预(例如激光手术或类固醇植入物)配对。
在一些实施方案中,将ω-3脂肪酸或其药学上可接受的酯或盐和另外的治疗剂一起配制(例如,作为施用于患者的眶周皮肤的单一组合物)。在一些实施方案中,另外的治疗剂通过替代的手段,例如注射、植入或口服施用来递送。
JV-DE1和ω-3脂肪酸的组合
在治疗各种眼部疾病或病症,包括眼睛前部或后部的疾病或病症时,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺可与ω-3脂肪酸或其药学上可接受的酯或盐组合。包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐的组合物可以与一种或多种另外的治疗剂组合。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸或其药学上可接受的酯或盐一起配制为单一组合物以施用于患者的眶周皮肤。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面(例如,以液滴制剂),并且通过替代的方式,例如施用于患者的眶周皮肤,递送ω-3脂肪酸或其药学上可接受的酯或盐。
其它活性成分和赋形剂
在一个方面,本文提供了适于局部眶周施用的药物组合物,其可以包含任何药学上可接受的赋形剂。在一些实施方案中,药学上可接受的赋形剂包括一种或多种酸、碱、电解质、缓冲剂、溶质、抗氧化剂、稳定剂,和如果需要的话,防腐剂。在一些实施方案中,药学上可接受的赋形剂包括半氟化烷烃。在一些实施方案中,药学上可接受的赋形剂包括全氟己基辛烷。在一些实施方案中,药学上可接受的赋形剂包括全氟丁基戊烷。在一些实施方案中,适于局部眶周施用的药物组合物包含ω-3脂肪酸或其药学上可接受的酯或盐和半氟化烷烃。在一些实施方案中,适于局部眶周施用的药物组合物包含ω-3脂肪酸或其药学上可接受的酯或盐和全氟己基辛烷。在一些实施方案中,适于局部眶周施用的药物组合物包含ω-3脂肪酸或其药学上可接受的酯或盐和全氟丁基戊烷。在一些实施方案中,适于局部眶周施用的药物组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和半氟化烷烃。在一些实施方案中,适于局部眶周施用的药物组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和全氟己基辛烷。在一些实施方案中,适于局部眶周施用的药物组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和全氟丁基戊烷。在一些实施方案中,适于局部眶周施用的药物组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、ω-3脂肪酸和半氟化烷烃。在一些实施方案中,适于局部眶周施用的药物组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、ω-3脂肪酸和全氟己基辛烷。在一些实施方案中,适于局部眶周施用的药物组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺、ω-3脂肪酸和全氟丁基戊烷。
眶周皮肤施用
在视网膜疾病的治疗中,已知作为滴眼剂局部施用的药物不能达到目标组织或仅在眼后段中药理学不足浓度下是生物可利用的。尽管在眼睛很小的啮齿类动物中进行的研究声称取得了成功,但是这些成功并没有转化到具有与人眼尺寸相似的眼睛的物种中(delAmo et al.,2017)。据报道,在人眼大小的眼睛上取得成功的案例,都是由于不充分的不当的实验设计造成的。药物本身必须被直接检测和定量,不能从涉及组织学的技术中估计。在滴眼剂施用后,药物经常被吸收到血流中并由此被递送到视网膜。必须监测和报告血浆或血液水平。此外,令人满意的视网膜生物配置只能通过适当的组织取样来实现。应确立药物在玻璃体液、神经视网膜和下层的后巩膜中的停留。在组织取样过程中应该没有交叉污染。必须测量药物的全身血液水平。除了上述考虑事项之外,最后的必要的是药物是单侧施用。含有药物制剂的滴眼剂必须施用于单眼而不施用于对侧眼睛作为对照。必须在所有测量的时间点上以数值形式报告来自药物治疗的和未治疗的对照眼睛和血浆/血液的全部结果表示。如果治疗的和未治疗的眼睛的眼后段组织中的药物水平在实验误差内,则视网膜生物利用度是来自体循环的吸收(血源性递送)的结果。
在要求保护在视网膜和玻璃体液中的药物生物利用度的那些情况下,存在次优的实验设计。以下提供了常见的实验缺陷的实例。(1)Acheampong AA et al.(2002)DrugMetab Disp
因此,需要化合物的改进的递送方法以治疗眼后部的疾病。令人惊讶地,已经发现,包括4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺和ω-3脂肪酸在内的多种化合物的眶周施用提供了化合物在整个眼睛中的实质性的生物分布。此外,向眶周皮肤的施用提供了视网膜递送途径,经由玻璃体液,不受视网膜色素上皮、Bruch’s膜和血液视网膜屏障的阻碍。图1示出了眼睛解剖结构的表示,包括覆盖眼球的眶周区域。
向眶周皮肤施用化合物将通过巩膜途径向巩膜和视网膜提供药物递送,以防止可能与近视有关的眼球伸长。眶周皮肤递送途径在代表最大的近视患者群体的儿童中可能是特别有利的,因为这将避免滴眼剂带来的不希望的伤害感受效应和不便。
除了口服施用之外,局部滴眼剂是目前仅有的两种用于眼部递送的非侵入性机制之一。在局部滴眼剂施用中,可能有两种途径将药物递送至眼后段:首先,“巩膜途径”,其中药物从眼表面扩散至结膜,通过巩膜水通道到达视网膜;其次,“角膜途径”,其中药物穿过角膜表面、房水、晶状体/虹膜/睫状体、玻璃体液,然后到达视网膜。尽管有多篇文献报道在小动物模型中以药物有效剂量将潜在的治疗剂局部递送至眼睛的后部,但是这些报道尚未成功地转化到具有与人眼球类似的相关眼部解剖、生理学和尺寸的眼球的较大物种。口服施用是另一种目前可用的非侵入性运输眼药和营养物的方式。尽管口服药物可能具有通过体循环到达视网膜的某种机会,但难以在目标组织处获得有效的药理学有效剂量。因此,高剂量、非侵入性视网膜药物递送仍然是尚未满足的巨大医疗需要和最理想的眼部药物递送方式。
能够通过眶周施用途径施用化合物提供了优于其它施用类型的几个优点。患者可自我施用。这与视网膜植入物、视网膜注射和光凝固程序明显不同。这些补救性干预必须全部由医疗机构中的医生执行。完全避免了侵入性玻璃体内注射的副作用(眼内炎、视网膜脱离和创伤性白内障)。
与滴眼剂相比,向眶周皮肤施用在许多方面也是有利的。这些优点包括避免了与滴眼剂相关的反射性眨眼和不适。由于皮肤比高度敏感的角膜更坚韧且更耐受外源性施用的物质,所以可以更频繁地施用更大量的药物,并且存在于无防腐剂的制剂中。另外,眼睛对刺激比周围皮肤敏感得多。因此,眶周递送能够实现高得多的剂量强度递送,因为滴眼剂中高浓度的活性成分经常引起眼睛刺激,而在皮肤上未观察到这种刺激。
具体地,本文报道的研究揭示了在施用“平均”量(~160微克)的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺之后,视网膜中存在极高浓度的小分子(表1)。考虑表1中报道的数据,揭示了对眶周皮肤的施用允许至少在一天的时间内很好地维持极高的药物浓度。质量平衡的估计与主要受限于受者眼睛的药物应用一致;这与滴眼剂明显不同,滴眼剂中只有少量的药物被递送到眼球的内部。总之,据推测对眶周皮肤的施用将允许分子到达嵌入在视网膜中的“难以到达的”神经元元件中的靶标。在眶周皮肤的下面,锯齿缘对分子和颗粒物质似乎没有明显的屏障。
眼表面的局部眼部施用
在一些实施方案中,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺经由局部眼部施用被施用于眼表面。对眼表面的施用与将治疗剂递送到视网膜和玻璃体液的其它施用形式相比具有几个明显的优点;这些优点包括自我给药者的能力、自我给药的便利性、化合物向眼表面的快速递送,以及在眼表面快速达到高浓度的能力。在一些实施方案中,向眼表面的施用还为眼睛后部的结构(例如视网膜)提供了足够的生物分布。在本文提供的一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眼表面,例如在滴眼剂制剂中。在一些实施方案中,将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的组合物配制成以水溶液、非水溶液、油溶液、油、凝胶、水凝胶、洗剂、软膏、分散体、乳液、乳膏或悬浮液的形式局部眼部施用于眼表面。
制剂
用于眶周皮肤给药的组合物
在一些实施方案中,本文提供了适于施用于个体眼睛的眶周皮肤区域的组合物。在一些实施方案中,这些组合物可以通过非侵入性眼部递送平台(NIODP)施用。
在一些实施方案中,所述组合物为水溶液、非水溶液、油溶液、油、凝胶、水凝胶、洗剂、软膏、分散体、乳液、乳膏和悬浮液的形式。在一些实施方案中,所述组合物为软膏、乳膏或洗剂的形式。在一些实施方案中,所述组合物为软膏的形式。在一些实施方案中,所述组合物为水溶液的形式。在一些实施方案中,所述组合物为非水溶液的形式。在一些实施方案中,所述组合物为油溶液的形式。在一些实施方案中,所述组合物为油的形式。在一些实施方案中,所述组合物为凝胶的形式。在一些实施方案中,所述组合物为水凝胶的形式。在一些实施方案中,所述组合物为洗剂的形式。在一些实施方案中,所述组合物为软膏的形式。在一些实施方案中,所述组合物为分散体的形式。在一些实施方案中,所述组合物为乳液的形式。在一些实施方案中,所述组合物为乳膏的形式。在一些实施方案中,所述组合物为悬浮液的形式。
在一些实施方案中,所述组合物包含半固体油质基础材料。在一些实施方案中,所述组合物包含石油基、矿物油、多元醇、甘油三酯或它们的任何组合。在一些实施方案中,所述组合物包含石油基。在一些实施方案中,所述组合物包含矿脂。在一些实施方案中,所述组合物包含矿脂、甘油三酯或它们的任何组合。在一些实施方案中,所述组合物包含矿脂和甘油三酯。在一些实施方案中,所述组合物包含矿脂、蜂蜡或可可脂。在一些实施方案中,所述组合物包含蜂蜡。在一些实施方案中,所述组合物包含可可脂。
在一些实施方案中,所述组合物包含油。在一些实施方案中,所述组合物包含油或油的混合物。在一些实施方案中,所述组合物包含在一种或多种油中混合的本文提供的化合物(例如,ω-3脂肪酸或4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺)。在一些实施方案中,所述组合物包含在一种或多种油中混合的一种或多种本文提供的化合物(例如,ω-3脂肪酸和4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺)。在一些实施方案中,所述组合物包含一种或多种从植物、植物种子或坚果进行或衍生的油。在一些实施方案中,植物、植物种子或坚果是椰子、棕榈仁、大豆、芝麻、橄榄、植物、向日葵或其它植物来源或其任何组合。
在一些实施方案中,所述组合物主要是油。在一些实施方案中,所述组合物包含占所述组合物的至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.6%、至少约99.7%、至少约99.8%、至少约99.9%、至少约99.95%、至少约99.96%、至少约99.97%、至少约99.98%或至少约99.99%(w/w)的量的油。在一些实施方案中,所述组合物基本上由油和活性成分(例如,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺)组成。
在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的油。
在一些实施方案中,所述组合物包含甘油三酯。在一些实施方案中,甘油三酯是中链或长链甘油三酯。在一些实施方案中,甘油三酯衍生自天然来源。在一些实施方案中,甘油三酯衍生自植物、植物种子或坚果。在一些实施方案中,植物、植物种子或坚果包含椰子的一部分、棕榈仁、大豆、芝麻种子或植物、橄榄、向日葵种子或植物、或其它植物或植物来源、或其任何组合。
在一些实施方案中,所述组合物主要是甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.6%、至少约99.7%、至少约99.8%、至少约99.9%、至少约99.95%、至少约99.96%、至少约99.97%、至少约99.98%或至少约99.99%(w/w)的量甘油三酯。在一些实施方案中,所述组合物基本上由甘油三酯和活性成分(例如,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺)组成。
在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的甘油三酯。
在一些实施方案中,甘油三酯是中链甘油三酯。在一些实施方案中,中链甘油三酯包含2或3种中等长度脂肪酸。在一些实施方案中,中链甘油三酯包含C6或更大的脂肪酸。在一些实施方案中,中链甘油三酯包含C6至C12脂肪酸。在一些实施方案中,中链甘油三酯包含C6至C12脂肪酸的混合物。在一些实施方案中,中链甘油三酯包含选自C6、C8、C10和C12脂肪酸或其混合物的脂肪酸。在一些实施方案中,中链甘油三酯包括己酸、辛酸、癸酸、月桂酸或其任何组合。在一些实施方案中,中链甘油三酯包含辛酸、癸酸或其组合。在一些实施方案中,中链甘油三酯包含辛酸和癸酸。在一些实施方案中,中链甘油三酯包含辛酸和癸酸,其比率为约4:1(w/w)、约4:3(w/w)、约3:1(w/w)、约3:2(w/w)、约1:1(w/w)、约2:3(w/w)、约1:3(w/w)、约3:4(w/w),或约1:4(w/w)。在一些实施方案中,所述比率为约1:1(w/w)至约4:1(w/w)。在一些实施方案中,所述比率为约3:2(w/w)。在一些实施方案中,与其它脂肪酸(w/w)相比,中链甘油三酯包含至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%或至少95%的C6至C12脂肪酸。
在一些实施方案中,所述组合物主要是中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.6%、至少约99.7%、至少约99.8%、至少约99.9%、至少约99.95%、至少约99.96%、至少约99.97%、至少约99.98%或至少约99.99%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物基本上由中链甘油三酯和活性成分(例如,4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺)组成。
在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的中链甘油三酯。
在一些实施方案中,中链甘油三酯衍生自天然来源。在一些实施方案中,中链甘油三酯衍生自椰子、棕榈或棕榈仁或其组合。在一些实施方案中,中链甘油三酯衍生自椰子或棕榈。在一些实施方案中,中链甘油三酯是从椰子或棕榈的胚乳中提取的油。在一些实施方案中,中链甘油三酯是国家食品(NF)级(NF)或美国药典(USP)级。
在一些实施方案中,所述组合物包含矿脂和中链甘油三酯的混合物。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约10:1(v/v)至约1:2(v/v)。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约6:1(v/v)至约1:1(v/v)。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约6:1(v/v)至约1:1(v/v)、约5:1(v/v)至约1:1(v/v)、约4:1(v/v)至约1:1(v/v)、约3:1(v/v)至约2:1(v/v)或约3:2(v/v)至约1:1(v/v)。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约1:1(v/v)、约2:1(v/v)、约3:1(v/v)、约4:1(v/v)、约5:1(v/v),或约6:1(v/v)。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约1:1(v/v)。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约2:1(v/v)。在一些实施方案中,所述矿脂与中链甘油三酯的比率为约4:1(v/v)。
在一些实施方案中,所述组合物还包含润肤剂。在一些实施方案中,润肤剂选自植物油、矿物油、精油、必需脂肪酸、脂肪酸、脂肪酸酯和脂肪酸醇。
在一些实施方案中,所述组合物还包含湿润剂。在一些实施方案中,湿润剂选自丙二醇、芦荟、乳酸、三乙酸甘油酯、氯化锂、聚葡萄糖、皂树皮、六偏磷酸钠、甘油、山梨糖醇、木糖醇、麦芽糖醇和蓖麻油。
在一些实施方案中,所述组合物还包含增稠剂。在一些实施方案中,增稠剂选自脂肪酸、脂肪酸酯和脂肪酸醇。
在一些实施方案中,所述组合物还包含防腐剂。在一些实施方案中,防腐剂选自硼酸钠/硼酸、聚六亚甲基双胍(phmb)、对羟基苯甲酸酯类(对羟基苯甲酸衍生物;)硝酸苯汞、苯扎氯铵、苄索氯铵、氯己定、氯丁醇、对羟基苯甲酸甲酯、苯乙醇、乙酸苯汞、硝酸苯汞、对羟基苯甲酸丙酯和硫柳汞。
在一些实施方案中,所述组合物不含防腐剂。在一些实施方案中,所述组合物不含苯扎氯铵。
在一些实施方案中,所述组合物还包含抗微生物剂。在一些实施方案中,抗微生物剂选自罗勒油、牛至油、百里香油、柑橘油和单萜、倍半萜和苯丙素类(phenylpropanoids)。
在一些实施方案中,所述组合物还包含渗透增强剂。在一些实施方案中,渗透增强剂选自乙醇、异丙醇、d-己醇、辛醇、十二烷醇、肉豆蔻醇、乙酸乙酯、油酰乙酸酯、肉豆蔻酸异丙酯、氮酮、碳酰二胺、甘油基单油酸酯、水杨酸辛酯、丙二醇、二丙二醇、1,2-丁二醇、油酸、N-甲基-2-吡咯烷酮。2-吡咯烷酮、2-吡咯烷酮-5-羧酸、二甲亚砜、癸基甲基亚砜、十二烷基硫酸钠、司盘80、吐温80、桉树脑、丁子香酚、D-柠檬烯、薄荷醇、薄荷烷、环糊精、透明质酸和维生素E。
在一些实施方案中,所述组合物还包含气味掩蔽剂。气味掩蔽剂特别适用于包含衍生于动物组织的组分(例如,来源于鱼的ω-3脂肪酸)的组合物,所述动物组织可携带残留的气味。在一些实施方案中,气味掩蔽剂是精油(例如,花、果实、木材、薄荷、草药或其它精油)。
用于眶周皮肤施用的JV-DE1组合物
在一些实施方案中,本文提供的适于眶周皮肤施用的组合物包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺作为活性成分。包含4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺的组合物可以是本文提供的任何组合物。在一些实施方案中,所述组合物包含中链甘油三酯。
在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.00005%至约10%(w/w)的量存在。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.00005%至约0.0005%、约0.00005%至约0.005%、约0.00005%至约0.05%、约0.00005%至约0.5%、约0.00005%至约1%、约0.00005%至约10%、约0.0005%至约0.005%、约0.0005%至约0.05%、约0.0005%至约0.5%、约0.0005%至约1%、约0.0005%至约10%、约0.005%至约0.05%、约0.005%至约0.5%、约0.005%至约1%、约0.005%至约10%、约0.05%至约0.5%、约0.05%至约1%、约0.05%至约10%、约0.5%至约1%、约0.5%至约10%,或约1%至约10%(w/w)的量存在。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.005%、约0.01%、约0.02%、约0.03%、约0.04%、约0.05%、约0.06%、约0.07%、约0.08%、约0.09%,或约0.1%(w/w)的量存在。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.005%至约0.3%(w/w)的量存在。在一些实施方案中,所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺以所述组合物的约0.005%至约0.01%、约0.005%至约0.03%、约0.005%至约0.06%、约0.005%至约0.1%、约0.005%至约0.3%、约0.01%至约0.03%、约0.01%至约0.06%、约0.01%至约0.1%、约0.01%至约0.3%、约0.03%至约0.06%、约0.03%至约0.1%、约0.03%至约0.3%、约0.06%至约0.1%、约0.06%至约0.3%,或约0.1%至约0.3%(w/w)的量存在。
在一些实施方案中,本文提供的组合物被配置为每次施用分配固定量的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述组合物被配置为每次施用分配约10ng至约5mg的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述组合物被配置为每次施用分配约1微克至约500微克的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述组合物被配置为每次施用分配约1微克至约5微克、约1微克至约10微克、约1微克至约25微克、约1微克至约50微克、约1微克至约75微克、约1微克至约100微克、约1微克至约200微克、约1微克至约300微克、约1微克至约400微克、约1微克至约500微克、约5微克至约10微克、约5微克至约25微克、约5微克至约50微克、约5微克至约75微克、约5微克至约100微克、约5至约200微克、约5至约300微克、约5至约400微克、约5至约500微克、约10微克至约25微克、约10微克至约50微克、约10微克至约75微克、约10微克至约100微克、约10至约200微克、约10至约300微克、约10至约400微克、约10至约500微克、约25微克至约50微克、约25微克至约75微克、约25微克至约100微克、约25至约200微克、约25至约300微克、约25至约400微克、约25至约500微克、约50微克至约75微克、约50微克至约100微克、约50至约200微克、约50至约300微克、约5至约400微克、约50至约500微克、约75微克至约100微克、约75至约200微克、约75至约300微克、约75至约400微克、约75至约500微克、约100至约200微克、约100至约300微克、约100至约400微克、约100至约500微克、约200至约500微克、约300至约500微克,或约400至约500微克的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。
用于外部眼睑或眶周皮肤施用的ω-3脂肪酸的组合物
在一些实施方案中,本文提供的适于局部眶周皮肤施用的组合物包含ω-3脂肪酸或其药学上可接受的酯或盐和药学上可接受的赋形剂。在一些实施方案中,这些组合物可以通过非侵入性眼部递送平台(NIODP)施用。
在一些实施方案中,本文提供的适于局部外部眼睑皮肤施用的组合物包含ω-3脂肪酸或其药学上可接受的酯或盐和药学上可接受的赋形剂。
在一些实施方案中,所述ω-3脂肪酸以所述组合物的约0.01%至约100%(w/w)的量存在于所述组合物中。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约0.01%至约50%(w/w)的量存在。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约1%至约50%(w/w)的量存在。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约1%至约5%、约1%至约10%、约1%至约20%、约1%至约30%、约1%至约40%、约1%至约50%、约5%至约10%、约5%至约20%、约5%至约30%、约5%至约40%、约5%至约50%、约5%至约75%、约5%至约100%、约10%至约20%、约10%至约30%、约10%至约40%、约10%至约50%、约10%至约75%、约10%至约100%,about20%至约30%、约20%至约40%、约20%至约50%、约20%至约75%、约20%至约100%、约30%至约40%、约30%至约50%、约30%至约75%、约30%至约100%、约40%至约50%、约40%至约75%、约40%至约100%、约50%至约75%、约50%至约100%,或约75%至约100%(w/w)的量存在。在一些实施方案中,所述ω-3脂肪酸以所述组合物的至多约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%(w/w)的量存在。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约10%至约15%、约10%至约20%、约10%至约25%、约10%至约30%、约15%至约20%、约15%至约25%、约15%至约30%、约20%至约25%、约20%至约30%,或约25%至约30%(w/w)的量存在。在一些实施方案中,所述ω-3脂肪酸以所述组合物的约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%(w/w)的量存在。在一些实施方案中,所述ω-3脂肪酸单独施用(例如,没有任何媒介物)。
在一些实施方案中,所述组合物被配置成递送约0.1mg至约3000mg、约0.1mg至约1000mg、约0.1mg至约500mg、约0.1mg至约300mg、约0.1mg至约200mg、约0.1mg至约100mg的量的所述ω-3脂肪酸。在一些实施方案中,所述组合物被配置成递送约0.1mg至约100mg的量的所述ω-3脂肪酸。在一些实施方案中,所述组合物被配置成递送约0.1mg至约1mg、约0.1mg至约10mg、约0.1mg至约20mg、约0.1mg至约50mg、约0.1mg至约100mg、约1mg至约10mg、约1mg至约20mg、约1mg至约50mg、约1mg至约100mg、约10mg至约20mg、约10mg至约50mg、约10mg至约100mg、约20mg至约50mg、约20mg至约100mg,或约50mg至约100mg的量的所述ω-3脂肪酸。在一些实施方案中,所述组合物被配置成递送约0.1mg、约1mg、约10mg、约20mg、约50mg,或约100mg的量的所述ω-3脂肪酸。在一些实施方案中,所述组合物被配置成递送至少约0.1mg、约1mg、约10mg、约20mg,或约50mg的量的所述ω-3脂肪酸。在一些实施方案中,所述组合物被配置成递送至多约1mg、约10mg、约20mg、约50mg,或约100mg的量的所述ω-3脂肪酸。
在一些实施方案中,所述组合物包含用于递送ω-3脂肪酸的媒介物。在一些实施方案中,媒介物包含油。在一些实施方案中,媒介物包含油或油的混合物。在一些实施方案中,媒介物包含溶解在一种或多种油中的ω-3脂肪酸。在一些实施方案中,所述油衍生自天然来源。在一些实施方案中,媒介物包含一种或多种衍生自植物、植物种子或坚果的油。在一些实施方案中,植物、植物种子或坚果是大豆、芝麻、橄榄、植物、向日葵或其它植物来源或其任何组合。
在一些实施方案中,所述媒介物为油。在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的油。在一些实施方案中,所述油占所述组合物的约50%至约99%(w/w)。在一些实施方案中,所述油占所述组合物的约50%至约60%、约50%至约70%、约50%至约80%、约50%至约90%、约50%至约99%、约60%至约70%、约60%至约80%、约60%至约90%、约60%至约99%、约70%至约80%、约70%至约90%、约70%至约99%、约80%至约90%、约80%至约99%,或约90%至约99%(w/w)。在一些实施方案中,所述油占所述组合物的约50%、约60%、约70%、约80%、约90%,或约99%(w/w)。
在一些实施方案中,媒介物包含甘油三酯。在一些实施方案中,甘油三酯是中链或长链甘油三酯。在一些实施方案中,甘油三酯衍生自天然来源。在一些实施方案中,甘油三酯衍生自植物、植物种子或坚果。在一些实施方案中,植物、植物种子或坚果包括椰子的一部分,棕榈仁,大豆,芝麻种子或植物,橄榄,向日葵种子或植物,或其它植物或植物来源,或其任何组合。
在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的甘油三酯。在一些实施方案中,所述甘油三酯占所述组合物的约50%至约99%(w/w)。在一些实施方案中,所述甘油三酯占所述组合物的约50%至约60%、约50%至约70%、约50%至约80%、约50%至约90%、约50%至约99%、约60%至约70%、约60%至约80%、约60%至约90%、约60%至约99%、约70%至约80%、约70%至约90%、约70%至约99%、约80%至约90%、约80%至约99%,或约90%至约99%(w/w)。在一些实施方案中,所述甘油三酯占所述组合物的约50%、约60%、约70%、约80%、约90%,或约99%(w/w)。
在一些实施方案中,甘油三酯是中链甘油三酯。在一些实施方案中,中链甘油三酯包含2或3种中等长度脂肪酸。在一些实施方案中,中链甘油三酯包含C6或更大的脂肪酸。在一些实施方案中,中链甘油三酯包含C6至C12脂肪酸。在一些实施方案中,中链甘油三酯包含C6至C12脂肪酸的混合物。在一些实施方案中,中链甘油三酯包含选自C6、C8、C10和C12脂肪酸或其混合物的脂肪酸。在一些实施方案中,中链甘油三酯包括己酸、辛酸、癸酸、月桂酸或其任何组合。在一些实施方案中,中链甘油三酯包含辛酸、癸酸或其组合。在一些实施方案中,中链甘油三酯包含辛酸和癸酸。在一些实施方案中,中链甘油三酯包含辛酸和癸酸,其比率为约4:1(w/w)、约4:3(w/w)、约3:1(w/w)、约3:2(w/w)、约1:1(w/w)、约2:3(w/w)、约1:3(w/w)、约3:4(w/w),或约1:4(w/w)。在一些实施方案中,所述比率为约1:1(w/w)至约4:1(w/w)。在一些实施方案中,所述比率为约3:2(w/w)。在一些实施方案中,与其它脂肪酸(w/w)相比,中链甘油三酯包含至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%或至少95%的C6至C12脂肪酸。
在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的中链甘油三酯。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的中链甘油三酯。在一些实施方案中,所述中链甘油三酯占所述组合物的约50%至约99%(w/w)。在一些实施方案中,所述中链甘油三酯占所述组合物的约50%至约60%、约50%至约70%、约50%至约80%、约50%至约90%、约50%至约99%、约60%至约70%、约60%至约80%、约60%至约90%、约60%至约99%、约70%至约80%、约70%至约90%、约70%至约99%、约80%至约90%、约80%至约99%,或约90%至约99%(w/w)。在一些实施方案中,所述中链甘油三酯占所述组合物的约50%、约60%、约70%、约80%、约90%,或约99%(w/w)。
在一些实施方案中,中链甘油三酯衍生自天然来源。在一些实施方案中,中链甘油三酯衍生自椰子、棕榈或棕榈仁或其组合。在一些实施方案中,中链甘油三酯衍生自椰子或棕榈。在一些实施方案中,中链甘油三酯是从椰子或棕榈的胚乳中提取的油。在一些实施方案中,中链甘油三酯是国家食品(NF)级(NF)或美国药典(USP)级。
在一些实施方案中,所述媒介物为脂肪酸媒介物。在一些实施方案中,所述脂肪酸媒介物为不饱和脂肪酸。在一些实施方案中,所述脂肪酸媒介物为C14至C22脂肪酸。在一些实施方案中,所述脂肪酸媒介物为C14至C22不饱和脂肪酸。在一些实施方案中,所述脂肪酸媒介物包含亚油酸。
在一些实施方案中,所述脂肪酸媒介物占所述组合物的约1%至约100%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的约50%至约99%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的约50%至约60%、约50%至约70%、约50%至约80%、约50%至约90%、约50%至约99%、约60%至约70%、约60%至约80%、约60%至约90%、约60%至约99%、约70%至约80%、约70%至约90%、约70%至约99%、约80%至约90%、约80%至约99%,或约90%至约99%(w/w)。在一些实施方案中,所述脂肪酸媒介物占所述组合物的约50%、约60%、约70%、约80%、约90%,或约99%(w/w)。
在一些实施方案中,经由非侵入性眼部递送平台向患者施用组合物导致生理相关量的ω-3脂肪酸递送至眼睛的至少一部分。
在一些实施方案中,眼睛的所述部分是上眼睑、角膜、视网膜或其任何组合。
在一些实施方案中,向患者施用组合物导致治疗或其它有益相关量的ω-3脂肪酸递送至眼睛的至少一部分。
在一些实施方案中,眼睛的所述部分是上眼睑、角膜、视网膜或其任何组合。
在一些实施方案中,向患者施用组合物导致施用后30分钟在上眼睑中的ω-3脂肪酸的水平高于基线水平至少10μg/g、至少50μg/g、至少100μg/g、至少150μg/g、至少200μg/g、至少250μg/g、至少300μg/g、至少350μg/g、至少400μg/g或至少500μg/g。
在一些实施方案中,向患者施用组合物导致施用后30分钟在角膜中的ω-3脂肪酸的水平高于基线水平至少10μg/g、至少15μg/g、至少20μg/g、至少25μg/g、至少30μg/g、至少35μg/g、至少40μg/g、至少50μg/g、至少60μg/g或至少70μg/g。
在一些实施方案中,向患者施用组合物导致施用后30分钟在视网膜中的ω-3脂肪酸的水平高于基线水平至少10μg/g、至少15μg/g、至少20μg/g、至少25μg/g、至少30μg/g、至少35μg/g、至少40μg/g、至少45μg/g、至少50μg/g、至少60μg/g、或至少70μg/g、至少80μg/g、至少90μg/g、至少100μg/g、至少110μg/g或至少120μg/g。
用于局部眼部施用JV-DE1的组合物
本文还提供了适于局部眼部施用的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(又名JV-DE1)的组合物。在一些实施方案中,局部眼部施用是对眼表面的施用。在一些实施方案中,所述组合物被配制为滴眼剂。在一些实施方案中,所述组合物被配制为水溶液、非水溶液、油溶液、油、凝胶、水凝胶、洗剂、软膏、分散体、乳液、乳膏,所述组合物在脂质体中或在纳米颗粒中,或为悬浮液。在一些实施方案中,所述组合物被配制为水溶液。在一些实施方案中,局部眼部施用是向患者的眶周皮肤施用。
在一些实施方案中,所述组合物包含聚氧乙烯蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油为聚(环氧烷)蓖麻油。在一些实施方案中,所述聚氧乙烯蓖麻油包含选自聚(乙二醇)(PEG)、聚(丙二醇)或其任何组合的聚(环氧烷)亚单元。
在一些实施方案中,所述聚氧乙烯蓖麻油为PEG化蓖麻油。在一些实施方案中,PEG化蓖麻油中PEG与蓖麻油的摩尔比为约20:1至约50:1。在一些实施方案中,所述PEG与蓖麻油的摩尔比为约25:1至约45:1或约30:1至约40:1。在一些实施方案中,所述PEG与蓖麻油的摩尔比为约35:1。在一些实施方案中,所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。
在一些实施方案中,所述聚氧乙烯蓖麻油以所述组合物的约0.1%至约20%、0.1%至约15%、0.1%至约10%或0.1%至约5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯蓖麻油以所述组合物的约0.1%至约5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯蓖麻油以所述组合物的约0.1%至约0.5%、约0.1%至约1%、约0.1%至约2%、约0.1%至约5%、约0.5%至约1%、约0.5%至约2%、约0.5%至约5%、约1%至约2%、约1%至约5%,或约2%至约5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯蓖麻油以所述组合物的约0.5%至约1.5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯蓖麻油以约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约1.1%、约1.2%、约1.3%、约1.4%,或约1.5%的量存在。在一些实施方案中,所述聚氧乙烯蓖麻油以所述组合物的约0.5%至约1.5%、约0.6%至约1.4%、约0.7%至约1.3%、约0.8%至约1.2%,或约0.9%至约1.1%(w/w)的量存在。
在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约20%、0.1%至约15%、0.1%至约10%或0.1%至约5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约0.5%、约0.1%至约1%、约0.1%至约2%、约0.1%至约5%、约0.5%至约1%、约0.5%至约2%、约0.5%至约5%、约1%至约2%、约1%至约5%,或约2%至约5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.5%至约1.5%(w/w)的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约1.1%、约1.2%、约1.3%、约1.4%,或约1.5%的量存在。在一些实施方案中,所述聚氧乙烯35蓖麻油以所述组合物的约0.5%至约1.5%、约0.6%至约1.4%、约0.7%至约1.3%、约0.8%至约1.2%,或约0.9%至约1.1%(w/w)的量存在。
在一些实施方案中,所述组合物还包含眼表润滑剂。在一些实施方案中,所述眼表润滑剂选自聚乙二醇、丙二醇、聚乙烯醇、蓖麻油或甘油。在一些实施方案中,所述眼表润滑剂为甘油。
在一些实施方案中,所述眼表润滑剂以所述组合物的约0.05%至约2%(w/w)的量存在。在一些实施方案中,所述眼表润滑剂以所述组合物的约0.05%至约0.5%(w/w)的量存在。在一些实施方案中,在一些实施方案中,所述眼表润滑剂以所述组合物的约0.05%、约0.1%、约0.15%、约0.2%、约0.25%、约0.3%、约0.4%,或约0.5%(w/w)的量存在。在一些实施方案中,所述眼表润滑剂以所述组合物的约0.05%至约0.1%、约0.05%至约0.15%、约0.05%至约0.2%、约0.05%至约0.25%、约0.05%至约0.3%、约0.05%至约0.4%、约0.05%至约0.5%、约0.1%至约0.15%、约0.1%至约0.2%、约0.1%至约0.25%、约0.1%至约0.3%、约0.1%至约0.4%、约0.1%至约0.5%、约0.15%至约0.2%、约0.15%至约0.25%、约0.15%至约0.3%、约0.15%至约0.4%、约0.15%至约0.5%、约0.2%至约0.25%、约0.2%至约0.3%、约0.2%至约0.4%、约0.2%至约0.5%、约0.25%至约0.3%、约0.25%至约0.4%、约0.25%至约0.5%、约0.3%至约0.4%、约0.3%至约0.5%,或约0.4%至约0.5%(w/w)的量存在。
在一些实施方案中,所述组合物还包含缓冲剂。在一些实施方案中,所述缓冲剂选自三乙醇胺(tris)、组氨酸、碳酸氢盐;N-(2-羟基乙基)哌嗪-N'-(2-乙磺酸)(HEPES);2-(N-吗啉代)乙磺酸(MES);2-(N-吗啉代)乙磺酸钠盐(MES);3-(N-吗啉代)丙磺酸(MOPS);和N-三[羟甲基]甲基-3-氨基丙磺酸(TAPS)。在一些实施方案中,所述缓冲液是tris。在一些实施方案中,组合物包含tris缓冲的盐水。
在一些实施方案中,所述组合物包含油。在一些实施方案中,所述组合物包含油或油的混合物。在一些实施方案中,所述组合物包含混合在一种或多种油中的4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述组合物包含一种或多种衍生自植物、植物种子或坚果的油。在一些实施方案中,植物、植物种子或坚果是大豆、芝麻、橄榄、植物、向日葵或其它植物来源或其任何组合。在一些实施方案中,所述油包含甘油三酯。在一些实施方案中,油包含中链甘油三酯。
在一些实施方案中,所述组合物主要是油。在一些实施方案中,所述组合物包含占所述组合物的至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、至少约99.6%、至少约99.7%、至少约99.8%、至少约99.9%、至少约99.95%、至少约99.96%、至少约99.97%、至少约99.98%或至少约99.99%(w/w)的量的油。在一些实施方案中,所述组合物基本上由油和4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺组成。
在一些实施方案中,所述组合物包含占所述组合物的约1%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的约1%至约20%、约1%至约40%、约1%至约60%、约1%至约80%、约1%至约100%、约20%至约40%、约20%至约60%、约20%至约80%、约20%至约100%、约40%至约60%、约40%至约80%、约40%至约100%、约60%至约80%、约60%至约100%,或约80%至约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的约1%、约20%、约40%、约60%、约80%,或约100%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至少约1%、约20%、约40%、约60%,或约80%(w/w)的量的油。在一些实施方案中,所述组合物包含占所述组合物的至多约20%、约40%、约60%、约80%,或约100%(w/w)的量的油。在一些实施方案中,所述组合物具有约6.5至约8.5的pH。在一些实施方案中,所述组合物具有约6.7至约8.3、约7.0至约8.0、约7.2至约7.8,或约7.3至约7.7的pH。在一些实施方案中,所述组合物具有约7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9或8.0的pH。
在一些实施方案中,所述组合物包含ω-3脂肪酸或其药学上可接受的酯或盐。在一些实施方案中,所述ω-3脂肪酸分离自鱼组织。在一些实施方案中,所述ω-3脂肪酸分离自植物来源。在一些实施方案中,所述ω-3脂肪酸包含α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)或它们的任何组合。
治疗方法
本文提供了用如本文提供的化合物治疗本文提供的所述疾病和病症的方法。在一些实施方案中,所述化合物是4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺。在一些实施方案中,所述化合物是ω-3脂肪酸。
在一些实施方案中,将化合物每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次或它们的任何组合(例如可变的给药方案)施用于所述患者的每只眼睛。在一些实施方案中,将化合物每周一次、每周两次、每周三次、每两周一次或每三周一次施用于所述患者的每只眼睛。在一些实施方案中,将所述化合物每天一次施用于所述患者的每只眼睛。
在一些实施方案中,将所述化合物每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次或它们的任何组合(例如可变的给药方案)施用于患者的单眼。在一些实施方案中,将化合物每周一次、每周两次、每周三次、每周一次、每两周一次或每三周一次施用于患者的单眼。在一些实施方案中,所述化合物每天一次施用于患者的单眼。
在一些实施方案中,将所述化合物任意施用于单眼或双眼。
在一些实施方案中,将化合物施用于眼睛的眼表面。在一些实施方案中,将化合物通过滴管、泵、喷雾、点击笔或管施用。
在一些实施方案中,使用装置将化合物施用于眶周皮肤。在一些实施方案中,该装置是滴管、泵、喷雾、点击笔或管式储库装置。在一些实施方案中,将所述化合物通过通过刷子、棉签或刮铲局部施用。
在一些实施方案中,使用眼垫将化合物施用于眶周皮肤。眼垫(也称为眼贴剂)是足够大以覆盖眼睛的眶周区域的小(并且可以是无菌的)垫,其特别设计用于吸附用于眶周或眼睑施用的制剂。在一些实施方案中,眼垫包含预选剂量的活性成分。个体可以将眼垫施用到眶周皮肤一段时间。时间可取决于所需活性成分的所需剂量。在一些实施方案中,可以将眼垫施用于患者的眶周皮肤1分钟、5分钟、10分钟、20分钟、30分钟、45分钟或1小时。
在一些实施方案中,装置以均匀的方式将预选剂量释放到患者的眶周皮肤上。在一些实施方案中,通过滚轮装置将化合物施用于眶周皮肤。在一些实施方案中,通过棉签将化合物施用于眶周皮肤。在一些实施方案中,通过刮铲将化合物施用于眶周皮肤。在一些实施方案中,可以在施用过程之前使用刻度滴管、注射器、点击笔或移液管。
使用不含防腐剂的制剂可能是有益的。在一些实施方案中,将化合物包装在一次性使用的容器中。在一些实施方案中,一次性使用的容器是吹灌封胶囊。在一些实施方案中,一次性使用的容器是软凝胶胶囊。在一些实施方案中,将化合物包装在多用途容器中。在一些实施方案中,多用途容器是真空泵或滴瓶。在一些实施方案中,包装被设计成使可能由ω-3脂肪酸氧化引起的鱼腥味最小化。
在一些实施方案中,将化合物施用于上眼睑上方的眶周皮肤、下眼睑下方的眶周皮肤或上眼睑上方和下眼睑下方两者的眶周皮肤。在一些实施方案中,将所述化合物在上眼睑上方施用。在一些实施方案中,将化合物在下眼睑下方施用。在一些实施方案中,将所述化合物既在上眼睑上方又在下眼睑下方施用。
在一些实施方案中,通过渗透增强剂、胶带剥离、微晶换肤术、溶剂、脉冲激光器和电离子透入疗法增加通过眶周皮肤的渗透,其已被发现可用于递送在脂质体中或在纳米颗粒中的大分子,例如抗体、siRNA(Fukuta et al.(2020)J Control Release 10:323-332.)。
在一些实施方案中,使用装置将化合物施用于眼睑皮肤。在一些实施方案中,该装置是滴管、泵、喷雾、点击笔或管式储库装置。在一些实施方案中,将化合物通过刷子、棉签或刮铲局部施用。
在一些实施方案中,装置以均匀的方式将预选剂量释放到患者的眼睑皮肤上。在一些实施方案中,通过滚轮装置将化合物施用于眼睑皮肤。在一些实施方案中,通过棉签将化合物施用于眼睑皮肤。在一些实施方案中,通过刮铲将化合物施用于眼睑皮肤。在一些实施方案中,可以在施用过程之前使用刻度滴管、注射器、点击笔或移液管。
在一些实施方案中,通过渗透增强剂、胶带剥离、微晶换肤术、溶剂、脉冲激光器和电离子透入疗法增加通过眼睑皮肤的渗透,其已被发现可用于递送在脂质体中或在纳米颗粒中的大分子,例如抗体、siRNA(Fukuta et al.(2020)J Control Release 10:323-332.)。
在一些实施方案中,将所述化合物预防性地、作为紧急干预、或根据需要施用以实现所需的补救效果。
特定定义
如本文和所附权利要求书中所使用的,单数形式“一个”、“一种”和“该/所述”包括复数指示物,除非上下文另外明确规定。因此,例如,提及“药剂”包括多种这样的药剂,并且提及“该细胞”包括提及一种或多种细胞(或提及多个细胞)及其本领域技术人员已知的等同物,等等。当本文针对物理性质(例如分子量)或化学性质(例如化学式)使用范围时,旨在包括范围的所有组合和子组合以及其中的具体实施方案。当涉及数字或数值范围时,术语“约”是指所提及的数字或数值范围是在实验变异性内(或在统计实验误差内)的近似值,因此该数字或数值范围可以在所述数字或数值范围的1%至15%变化。术语“包含”(以及相关术语如“含有”或“具有”或“包括”)不旨在排除在其它某些实施方案中,例如,本文所述的物质、组合物、方法或过程等的任何组成的实施方案,可以“由所述特征组成”或“基本上由所述特征组成”。
本文所用的“治疗”包括用于在个体的病况中获得有益或期望的结果(包括临床结果)的任何方法。有益的或期望的临床结果可包括但不限于减轻或改善一种或多种症状或病况,减少疾病的程度,稳定(即不恶化)疾病的状态,延迟或减缓疾病进展,改善,减少疾病的复发。治疗可以防止疾病的发生;减轻疾病的症状,完全或部分地消除疾病的潜在原因,缩短疾病的持续时间,或进行上述的组合。
本文所用的“治疗”也可包括预防性治疗。治疗方法包括向个体施用治疗有效量的活性剂。施用步骤可以由单次施用组成或可以包括一系列施用。治疗周期的长度取决于多种因素,例如病况的严重性、患者的年龄、活性剂的浓度、用于治疗的组合物的活性或它们的组合。还应理解,用于治疗或预防的药剂的有效剂量可在特定的治疗或预防方案的过程中增加或减少。剂量的变化可通过本领域已知的标准诊断测定法引起并变得明显。在一些情况下,可能需要长期给药。例如,将组合物以足以治疗患者的量和持续时间施用于个体。
术语“有效量”、“治疗有效量”或“药学上有效量”是指对视网膜疾病或其它眼科疾病有效的活性剂的量,包括从症状的可检测到的改善量到症状的实质性缓解/改善或疾病或病症的治愈等一系列效果。其结果可以是减少和/或减轻疾病的体征、症状或病因,或生物系统的任何其它预期改变。例如,用于治疗用途的“有效量”是包含本文所述的药剂的组合物提供临床上显著降低眼科疾病所需的量。例如,对于给定的方面(例如,发病时间),治疗有效量将显示出至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或100%的增加或降低。治疗效果也可表示为“-倍”的增加或降低。例如,治疗有效量可以具有至少1.2倍、1.5倍、2倍、5倍或更多倍的超过对照的效果。在任何个案中适当的“有效”量可以使用技术来确定,例如剂量递增研究。
术语“眶周”是指围绕眼窝的区域。
术语“眶前”是指眼眶或眼窝前面的区域。
术语“眼睑”是指眼睛上可移动的皮肤褶皱。
“OD”是指右眼。
“OS”是指左眼。
“OU”是指双眼。
“眶周施用”涉及对眶周皮肤的施用,并且具体地不包括对上眼睑、下眼睑和眼睑边缘的施用。
术语“洗剂”描述了乳液液体剂型。该剂型通常用于皮肤外用(US FDA DrugNomenclature Monograph,number C-DRG-00201)。
术语“乳膏”描述了乳液半固体剂型,其通常含有>20%的水和挥发物和/或<50%的烃、蜡或多元醇作为媒介物。乳膏比洗剂更粘稠。该剂型通常用于皮肤外用(US FDA DrugNomenclature Monograph,number C-DRG-002011)。
术语“软膏”描述了半固体剂型,其通常含有<20%的水和挥发物和/或>50%的烃、蜡或多元醇作为媒介物。该剂型通常用于外用于皮肤或粘膜(US FDA Drug NomenclatureMonograph,number C-DRG-00201)。
术语“溶液”描述了澄清的、均匀的液体剂型,其含有溶解在溶剂或互溶溶剂的混合物中的一种或多种化学物质(US FDA Drug Nomenclature Monograph,number C-DRG-00201)。
术语“悬浮液”是指含有足以沉降的大的固体颗粒的非均相混合物。
“乳液”是指但不限于水包油乳液、油包水乳液、指粒度为10
“制剂”和“组合物”旨在是等同的并且是指适于药用(即,产生治疗效果以及具有可接受的药代动力学和毒理学性质)的物质的组合物。
“润肤剂”是软化和光滑皮肤的试剂。
“湿润剂”是湿润皮肤的吸湿性试剂。
“渗透增强剂”是改善经皮药物递送的试剂。
“增稠剂”增加制剂的粘度以实现最佳的施用特性。
“眼表面”是角膜和巩膜及其相关的球结膜。
“眼科上可接受的组合物”是可以施用于眼睛的组合物。
“药学上可接受的”用作等同于生理学上可接受的。在某些实施方案中,药学上可接受的组合物或制剂将包括用于缓冲和在储存中保存的试剂,并且可以包括用于适当递送的缓冲剂和载体,这取决于施用途径。
术语“对象”、“患者”、“个体”不旨在是限制性的并且通常可以互换。即,被描述为“患者”的个体不必患有给定的疾病,而是可以仅仅是寻求医疗建议。本文所用的术语“个体”包括易于患有所示病症的动物界的所有成员。在一些方面,个体是哺乳动物,并且在一些方面,个体是人。
除非另有说明,本文所用的“局部”、“局部应用”、“局部施用”和“局部给药”在本文中可互换使用,包括对个体的眼表面或眶周皮肤的施用。局部应用或施用可导致活性剂直接递送到眼睛中。
术语“组合”是指一起使用的单独实体以实现改善的或最佳的治疗益处和安全性。在最简单的情况下,组合可以是同时施用的固定剂量的两种治疗剂的组合。在这种情况下,成分可以单独配制或在单一制剂中混合在一起。然而,为了实现令人满意的疾病控制,治疗剂的剂量和它们的相对施用时间可能需要一定程度的灵活性。例如,在两种疗法的组合中,在添加另一种(第二种)药物之前,可以首先施用两种疗法中的一种疗法以确定其基线补救水平。药物的组合可以包括通过不同的制剂、给药方法和不同的施用途径施用药物。作为示例性说明性实例,可以将4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺局部施用于眶周皮肤,并且玻璃体内注射VEGF抗体、静脉内施用的VEGF抗体或将VEGF抗体局部施用于眶周皮肤,有或没有4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺存在于相同制剂中。还考虑了递送途径和递送方法的进一步排列。
“局部制剂”和“局部药物组合物”在本文中可互换使用,并且包括适于局部施用于眼睛的制剂。当指定时,局部制剂可适于局部施用于眼表面、眼睛的眶周皮肤或两者。局部制剂可例如用于赋予其使用者治疗益处。
IP受体是属于G蛋白偶联受体超家族的细胞表面蛋白。IP受体的主要内源性配体是前列环素(PGI2)、前列腺素E
血小板活化因子(PAF)受体也是属于G蛋白偶联受体超家族的细胞表面蛋白(Ishii S et al.(2002)PGs&Other Lipid Med
siRNA代表被不同地描述为小干扰RNA、小抑制RNA和短干扰RNA的相同实体。
实施方案
实施方案1.治疗患有眼后部的疾病或病症的患者的所述疾病或病症的方法,所述方法包括将治疗有效量的ω-3脂肪酸或其药学上可接受的酯或盐施用于所述患者的眼睛的眼睑的外部皮肤,其中所述ω-3脂肪酸被配制用于递送至所述眼后部。
实施方案2.如实施方案1所述的方法,其中所述眼后部的疾病或病症包括视网膜疾病。
实施方案3.如实施方案2所述的方法,其中所述视网膜疾病包括来自视网膜或脉络膜血管系统的出血。
实施方案4.如实施方案3所述的方法,其中所述出血由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。
实施方案5.如实施方案2所述的方法,其中所述视网膜疾病或病症包括来自视网膜或脉络膜血管系统的血浆渗漏。
实施方案6.如实施方案5所述的方法,其中所述血浆渗漏由系统性高血压、糖尿病、脂肪性肝病、肥胖、摇晃婴儿综合征、头部创伤、贫血或白血病引起。
实施方案7.如实施方案2所述的方法,其中所述视网膜疾病或病症包括涉及视网膜或脉络膜血管系统的黄斑水肿形成。
实施方案8.如实施方案1所述的方法,其中所述眼后部的疾病或病症为年龄相关性黄斑变性(湿性和干性)、干性和湿性黄斑变性、格子样变性、黄斑裂孔、黄斑皱褶、格子样变性、视网膜裂孔、视网膜脱离、视网膜动脉阻塞、视网膜静脉阻塞、视网膜中央静脉阻塞、眼内肿瘤、儿科的、新生儿的或遗传性的视网膜病症、遗传性视网膜营养不良、地图样萎缩、视网膜色素变性(包括Leber先天性黑矇)、巨细胞病毒(cmv)视网膜感染、感染性视网膜炎、视网膜母细胞瘤、眼内炎、脉络膜视网膜炎、近视性黄斑变性和正常眼压性青光眼、青光眼中的视网膜变性;多种视网膜病变、包括但不限于糖尿病性视网膜病变、早产儿视网膜病变、镰状红细胞性视网膜病变、辐射性/日光性视网膜病变、中心性浆液性视网膜病变、高血压性视网膜病变、外周性视网膜病变和神经病;黄斑水肿、视网膜出血、糖尿病性黄斑水肿、糖尿病性黄斑缺血、地图样萎缩、眼底黄色斑点症(Stargardt病)、葡萄膜炎(包括中间葡萄膜炎、后部葡萄膜炎和全葡萄膜炎)或屈光不正(近视、远视和散光)。
实施方案9.如实施方案205-211中任一项所述的方法,其中所述视网膜疾病或病症为年龄相关性黄斑变性。
实施方案10.如实施方案1所述的方法,其中所述眼后部的疾病或病症为后部葡萄膜炎。
实施方案11.如实施方案1-10中任一项所述的方法,还包括向所述患者施用另外的治疗剂。
实施方案12.如实施方案11所述的方法,其中所述另外的治疗剂为VEGF抗体、小分子VEGF拮抗剂、靶向VEGF受体的siRNA、TNFα抗体、小分子TNFα受体拮抗剂、靶向TNFα受体的siRNA、炎性细胞因子受体拮抗剂、针对炎性细胞因子的抗体、酪氨酸激酶抑制剂、丝氨酸/苏氨酸-蛋白激酶抑制剂、激酶抑制剂、甾体抗炎剂、非甾体抗炎剂、免疫抑制剂、抗胆碱能剂、沙利度胺、前列腺素受体拮抗剂、神经保护剂、神经营养剂、神经再生剂、降眼压药、抗生素、抗病毒剂、补体抑制剂、白介素受体抑制剂、白三烯受体抑制剂、肿瘤发生和发展的抑制剂、血管生成抑制剂,或具有抗氧化或抗微血管渗漏特性的药剂。
实施方案13.如实施方案1-12中任一项所述的方法,其中将所述ω-3脂肪酸或其药学上可接受的酯或盐预防性地、作为紧急干预、或根据需要施用以实现所需的补救效果。
实施方案14.如实施方案1-13中任一项所述的方法,其中所述ω-3脂肪酸或其药学上可接受的酯或盐以组合物形式施用。
实施方案15.如实施方案1所述的方法,其中所述ω-3脂肪酸或其药学上可接受的酯或盐以所述组合物的约0.0001%至约10%(w/w)的量存在。
实施方案16.如实施方案14或15所述的方法,其中所述组合物为水溶液、非水溶液、油溶液、凝胶、悬浮液、乳液、洗剂、乳膏或软膏。
实施方案17.如实施方案14-16中任一项所述的方法,其中所述组合物为软膏。
实施方案18.如实施方案17所述的方法,其中所述软膏包含矿脂、蜂蜡或可可脂。
实施方案19.如实施方案17或18所述的方法,其中所述软膏包含矿脂和中链甘油三酯。
实施方案20.如实施方案19所述的方法,其中所述中链甘油三酯包含C6、C8、C10和C12脂肪酸的混合物。
实施方案21.如实施方案19或20所述的方法,其中所述中链甘油三酯包含辛酸和癸酸的混合物。
实施方案22.如实施方案17-21中任一项所述的方法,其中所述软膏包含比率为约1:1(v/v)、约2:1(v/v)、约3:1(v/v)、约4:1(v/v)、约5:1(v/v),或约6:1(v/v)的矿脂和中链甘油三酯。
实施方案23.如实施方案22所述的方法,其中所述软膏包含比例为约4:1(v/v)的矿脂和中链甘油三酯。
实施方案24.如实施方案14-16中任一项所述的方法,其中所述组合物为水溶液。
实施方案25.如实施方案24所述的方法,其中所述水溶液包含聚氧乙烯蓖麻油。
实施方案26.如实施方案25所述的方法,其中所述聚氧乙烯蓖麻油为聚乙二醇(PEG)-化蓖麻油。
实施方案27.如实施方案25或26所述的方法,其中所述聚氧乙烯蓖麻油为聚氧乙烯35蓖麻油。
实施方案28.如实施方案27所述的方法,其中所述聚氧乙烯35蓖麻油以所述组合物的约0.1%至约5%、约0.1%至约10%、约0.1%至约15%或约0.1%至约20%(w/w)的量存在。
实施方案29.如实施方案24-28中任一项所述的方法,其中所述组合物包含眼表润滑剂。
实施方案30.如实施方案1-29中任一项所述的方法,其中通过滴管、泵、喷雾、点击笔或滚轮/储库装置将所述ω-3脂肪酸或其药学上可接受的酯或盐施用于所述患者的眼睛的眼睑的外部皮肤。
实施方案31.如实施方案1-29中任一项所述的方法,其中通过刷子、棉签或刮铲,将所述ω-3脂肪酸或其药学上可接受的酯或盐施用于所述患者的眼睛的眼睑的外部皮肤,并且其中任选地在施用过程之前使用刻度滴管、注射器、点击笔或移液管。
实施方案32.如实施方案1-31中任一项所述的方法,其中通过胶带剥离、微晶换肤术、溶剂、脉冲激光器、电离子透入疗法或它们的组合辅助眼睑皮肤渗透。
实施方案33.如实施方案1-32中任一项所述的方法,其中所述ω-3脂肪酸或其药学上可接受的酯或盐每天四次、每天三次、每天两次、每天一次、每隔一天一次、每三天一次、每四天一次或每七天一次施用于所述患者的每只眼睛的眼睑皮肤。
实施方案34.如实施方案33所述的方法,其中每天一次施用所述ω-3脂肪酸或其药学上可接受的酯或盐。
实施方案35.如实施方案11所述的方法,其中所述另外的治疗剂为4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐。
实施方案36.如实施方案35所述的方法,其中所述ω-3脂肪酸或其药学上可接受的酯或盐和所述4,5-二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺或其药学上可接受的酯或盐作为单一组合物配制并施用。
实施例
实施例1:对双眼的表面进行JV-DE1局部眼部施用的兔子研究
对二氢-N-[4-[[4-(1-甲基乙氧基)苯基]甲基]苯基]-1H-咪唑-2-胺(指定为编码符号JV-DE1)进行视网膜生物利用度研究。该研究表明,配制在滴眼剂中并双侧施用于前眼表的化合物在视网膜中是生物可利用的。在新西兰兔中进行了JV-DE1的药代动力学和眼组织分布研究。简而言之,5只兔子(雄性)通过以0.12mg/眼的剂量对双眼进行眼部滴注而接受JV-DE1。在单次眼部施用于双眼后0、0.5、2、4、8和24h采集血样(1mL)。在每个时间点,在血液采集后对一只动物实施安乐死,然后从两只眼睛采集眼组织样品。采集房水、球结膜、前巩膜、后巩膜(在视神经出口区域)、视网膜、角膜、睫状体和虹膜并称重。然后将样品储存在超低温冷冻器中。随后通过LC-MS/MS方法测定样品中的药物浓度。结果显示在图2A(右眼)和图2B(左眼)中。
在眼部施用后新西兰兔中JV-DE1的血浆浓度低:在给药后0.5小时的C
实施例2:对单眼的表面进行JV-DE1局部眼部施用的兔子研究
为了证实在滴眼剂与前段眼表组织接触后,除了通过血液循环外,JV-DE1的药物递送基本上只限于眼再分布,进行了单眼药物应用研究。
在含有2.4%CrEL和0.2%甘油的pH7.6 TBS中配制JV-DE1。CrEL为聚氧乙烯35蓖麻油。聚氧乙烯35蓖麻油的其它名称包括聚乙二醇甘油蓖麻醇酸酯(macrogolglycerolricinoleate)、PEG-35蓖麻油和聚氧乙烯35氢化蓖麻油。简而言之,对于生物配置实验,通过以0.12mg/眼的剂量对单眼(OD)进行眼部滴注,对所述眼睛施用JV-DE1。在单次滴眼剂眼部施用后0、0.5、2、6和24小时采集血样(1mL)。在每一个上述时间点时,在血液采集后对一只动物进行安乐死,并且从两只眼睛中采集所选择的眼组织样品。采集房水、球结膜、前巩膜、后巩膜(在视神经出口区域)、视网膜、角膜、睫状体和虹膜并称重。然后将样品储存在超低温冷冻器中。随后通过LC-MS/MS方法测定样品中的JV-DE1浓度。图3A显示在不同时间点被施用JV-DE1的眼睛的不同部分中的JV-DE1浓度。图3B显示了在对对侧眼睛施用后的不同时间点,在未被施用JV-DE1的眼睛的不同部分中的JV-DE1浓度。
在单眼施用后新西兰兔中JV-DE1的血浆浓度低:给药后0.5小时时的C
实施例3:施用于单眼的眶周皮肤的JV-DE1的食蟹猴研究
针对JV-DE1进行了另外的实验,其涉及在局部施用于围绕着眼球前部的眶周皮肤之后确定其生物配置。
在中链甘油三酯(MCT)油中配制JV-DE1。将约0.16mg的量的JV-DE1制剂通过周向局部施用于围绕着眼球前部的眶周皮肤而施用于单眼(OD)。在单次施用于右眼的眶周皮肤(OD)后0、0.5、2、6和24小时采集血样(1mL)。在每一个上述预先指定的时间点,在血液采集后对一只动物实施安乐死,并从两只眼采集所选择的眼组织样品。采集以下代表性组织;上眼睑、角膜、视网膜和玻璃体液。随后通过LC-MS/MS方法测定样品中的JV-DE1浓度。结果概述于下表1中
表1-在单剂量右眼眶周皮肤施用之后的JV-DE1的生物分布
/>
在单剂量单眼眶周施用后食蟹猴中JV-DE1的血浆浓度低:给药后6小时时段内的C
在施用于眶周皮肤后,JV-DE1的眼部分布与常规的滴眼剂施用于眼表面时相关的眼部分布完全不同。在眶周施用后,向后段的化合物递送显著大于向角膜的化合物递送。相反,滴眼剂施用比眶周递送更多地将JV-DE1递送到角膜和其它前段组织(图2A、2B、3A)。然而,根据在人IP受体和PAF受体上获得的JV-DE1 pK
从眶周皮肤层递送至眼睑的化合物的生物分布以前不是实验研究的主题。从大量患者的经验中可以知道,由于在眼睑边缘上方没有发生色素沉着过度引起的皮肤变色,因此,在上眼睑边缘应用比马前列素不会影响眶周皮肤。在施用于眶周皮肤后,在上眼睑中实现高水平的JV-DE1(参见表1)。在该药代动力学和生物分布研究中,通过NIODP以165.30±4.65μg/眼(平均值±SEM)的剂量向猴的右眼(OD)施用JV-DE1。为了便于样品处理,仅采集上眼睑。24小时后,在上眼睑/眶周区域保留大量的药物。在视网膜中发现大于1000ng/g(即,>1μg/g)的类似量的药物,并且在给药后的所有测试时间点保持在这样高的水平。另一方面,在角膜和玻璃体液中药物水平最低。在给药后0.5、3、6和24小时的每个测试时间点,视网膜中保留的药物水平比角膜中的药物水平高200倍以上。在给药后6小时,在视网膜中JV-DE1处于其最大浓度,为23929.5ng/g(23.9μg/g),而血浆浓度保持小于0.3ng/ml,接近定量下限(LLOQ,0.1ng/ml)。
实施例4:眶周施用的二十二碳六烯酸的食蟹猴研究
通过施用于眶周皮肤将不限于JV-DE1的化合物递送至眼睛的后部组织,特别是视网膜。这得到了用表2中所示的显著不同的化合物二十二碳六烯酸(DHA)获得的结果的支持。将在亚油酸中的包含14.85mg/mLβ-胡萝卜素+198.02mg/ml DHA的油溶液通过周向局部施用于围绕着眼球前部的眶周皮肤而施用于单眼(OD)。在单次施用于右眼(OD)的眶周皮肤后0、0.5、2、6和24小时采集血样(1mL),在每一个上述预定时间点,在血液采集后对一只动物实施安乐死,并从两只眼采集所选择的眼组织样品。采集以下代表性组织;上眼睑、角膜、视网膜和玻璃体液。通过LC-MS/MS方法测定样品中的DHA浓度。结果总结于下表2中。在药代动力学和生物分布研究中,将DHA通过NIODP以6775.1±92.5μg/眼(平均值±SEM)的剂量施用于猴子的左眼。再次,为了便于样品处理,仅采集到上眼睑。在给药后0.5、3、6和24小时的所有测试时间点,大量的DHA(>10μg/g)保留在上眼睑/眶周区域、视网膜和角膜中。在给药后0.5小时,DHA在视网膜中迅速达到其最大值,为110.9μg/g。在玻璃体液中,DHA保持在定量限(BLQ)以下,定量下限(LLOQ)为0.5μg/ml(图3)。与BLQ基线相比,DHA的血浆浓度为1.2μg/ml至3.1μg/ml,相当于经由NIODP的3.65mM至9.4mM(MW328.5)。血浆C
表2-眶周皮肤施用后DHA的生物分布
二十二碳六烯酸(DHA)的血浆水平在整个24小时实验时间过程中基本上是稳定的;在给药后0.5、3、6和24小时分别为2.2、3.1、2.1和1.2μg/mL。发现DHA的这种血浆浓度在猴子中显著升高至其内源性水平(≤0.5μg/ml)的约2至6倍。这意味着NIODP递送也可以有益于实现更高的DHA的全身循环,从而促进人体的一般健康。用于AMD治疗和其它视网膜疾病的更多的DHA ω-3临床试验应使用NIODP途径进行。NIODP有潜能消除或显著降低向眼睛注射的需要,从而打破目前选择的用于视网膜药物递送的方法。与JV-DE1相比,DHA迅速渗入眼组织,并且在上眼睑的施用部位处迅速减少。
相反,如表3所示,制剂中的β-胡萝卜素组分在施用后不容易摄取和生物分布。因此,不是所有的化合物都容易被摄取和分布到眼睛的后部区域。
表3-在眶周皮肤施用后的β-胡萝卜素的生物分布
化合物施用于眶周皮肤令人惊奇地将治疗且有益的有效量提供于眼后段以及眼表面和眼睑。眶周施用在向视网膜提供化合物方面是特别有利的。尽管不受理论的限制,但所描述的施用途径表明在眶周施用后,绕过晶状体有利于渗透到玻璃体液和视网膜中,对于滴眼剂来说,晶状体为药物从眼前段进入到包括视网膜在内的眼后段提供了主要阻碍。
实施例5:非侵入性眶周眼部药物递送
将药物溶解并通过施用于眼睛的眶周皮肤而经由非侵入性和非刺激性制剂递送至眼的前段和眼的后段。亲脂性药物优选地被输送到眼睛的这些部分;一旦药物通过眶周皮肤的角质层,药物就可以经历经由结膜进入巩膜水通道的被动扩散。在巩膜水通道中在生理pH下可电离的药物优选地被输送到眼睛的后段,以克服因保护性解剖和生理屏障造成的限制进入视网膜的障碍。
实施例6:眼组织中的内源性DHA水平
表2中所示的眶周皮肤施用后DHA在眼组织中的生物分布不是由于DHA的内源性水平(DHA源自生物体内,并且不可归因于任何外部因素)。眼组织中DHA的内源性水平是可忽略的。表4显示存在于眼组织中的DHA的内源性水平,以μg/mL测量。在表4中的测量之前,患者没有被给予任何药物制剂。
表4-空白基质中的DHA的结果
BLQ:低于定量下限(LLOQ=0.5μg/mL)并在相关计算中给予0值。
实施例7:眼组织中的内源性β-胡萝卜素水平
表3中所示的眶周皮肤施用后β-胡萝卜素在眼组织中的生物分布不是由于β-胡萝卜素的内源性水平(β-胡萝卜素源自生物体内,并且不可归因于任何外部因素)。眼组织中β-胡萝卜素的内源性水平是可忽略的。表5显示存在于眼组织中的β-胡萝卜素的内源性水平,以μg/mL测量。在表5中的测量之前,患者没有被给予任何药物制剂。
表5-空白基质中的β-胡萝卜素的结果
/>
BLQ:低于定量下限(LLOQ=0.5μg/mL)并在相关计算中给予0值。
实施例8:非侵入性眼睑眼部药物递送
将药物溶解并通过施用于眼睛的眼睑皮肤而经由非侵入性和非刺激性制剂递送至眼的前段和眼的后段。亲脂性药物优选地被输送到眼睛的这些部分;一旦药物通过眼睑皮肤的角质层,药物就可以经历经由结膜进入巩膜水通道的被动扩散。例如,DHA和JV-DE1都是亲脂性的,这两种化合物都具有大于或等于1的预测亲脂性指标。DHA的预测亲脂性指标(LogP值)为约6.8。JV-DE1的预测亲脂性指标(LogP值)为约3.36。在巩膜水通道中在生理pH下可电离的药物优选地被输送到眼睛的后段,以克服因保护性解剖和生理屏障造成的限制进入视网膜的障碍。例如,DHA具有-1的生理电荷。类似地,JV-DE1具有+1的生理电荷。在生理pH下具有多于一个可电离中心的化合物更可能到达眼睛的后段。
实施例9:用于JV-DE1和DHA的药物递送的非侵入性眼部递送平台与滴眼剂的比
非侵入性眼部递送平台(NIODP)是眶周皮肤透皮施用与适当的药物制剂的组合,以高于μg/g的眼部组织递送眼部药物,特别是视网膜药物。证明了具有眼部抗炎和抗微血管渗漏特性的高剂量(>1μg/g)的JV-DE1可以以滴眼剂形式递送至眼睛的前房,并且经由NIODP递送至眼睛的后房,尤其是视网膜。作为滴眼剂施用的JV-DE1的生物分布剂量梯度为:角膜≥结膜≥前巩膜≈虹膜≥睫状体≥后巩膜≥房水≥视网膜。通过NIODP的生物分布为:眼睑≥视网膜>>角膜≥玻璃体液。ω-3抗氧化剂,二十二碳六烯酸(DHA)也通过NIODP施用。对于DHA,通过NIODP施用的剂量梯度为眼睑≈视网膜>角膜>>玻璃体液=0。尽管作为滴眼剂施用的JV-DE1在角膜中达到高浓度,但其在虹膜和睫状体处被截留,并且在前房水中的浓度保持非常低(几乎与视网膜中一样低),并且似乎失去了进一步扩散通过玻璃体液到达视网膜的动量。另一方面,JV-DE1通过巩膜途径从结膜通过后巩膜到达视网膜保持良好的浓度梯度。因此,JV-DE1滴眼剂的小于60ng/g的视网膜分布可能通过巩膜途径而不是通过角膜途径。
类似地,当通过NIODP递送时,由于玻璃体液中的药物非常低(JV-DE1)或BLQ(DHA),即使当角膜中的药物浓度高(DHA)时,JV-DE1和DHA也似乎通过巩膜途径到达视网膜。这种观察结果与先前的报道一致,即通过结膜/巩膜注射(在眶周皮肤下面),相比于通过角膜途径扩散到视网膜,非离子的非胶束(nomicelles)通过巩膜水通道更能够扩散到达视网膜。巩膜水通道是在水性介质中的胶原蛋白纤维、蛋白聚糖和糖蛋白的网络。根据药物的物理化学性质,例如分子量、半径、电荷和亲脂性,巩膜途径为某些药物绕过前段屏障(晶状体、虹膜和睫状体)并将药物输送到眼睛的后部提供了更容易的途径。
如图4所示,当通过滴眼剂途径施用时,大多数药物通过角膜途径转运,并且有时仅以可忽略不计的水平到达视网膜。然而,当通过NIODP途径施用时,一旦穿过眶周皮肤的角质层,药物可以被动地扩散通过巩膜水通道(“巩膜途径”)到达视网膜或采取角膜途径到达前段。NIODP可以通过角膜途径将化合物以高剂量递送至前段,并通过巩膜途径将化合物递送至后段,而滴眼剂主要通过角膜途径将药物(JV-DE1)递送至眼的前段。目标组织中的有效药物浓度决定了治疗目标疾病的成功性,所述目标疾病例如干眼病(DED)和其它眼前部炎性疾病(AOID)、年龄相关性黄斑变性(AMD、其它眼后部炎性疾病(POID)和神经系统变性眼病,以及预防与这些炎性疾病和神经系统变性疾病相关的导致视力下降和刺激的进展。
虽然本文已经示出和描述了本发明的优选实施方案,但是对于本领域的技术人员来说,显然这些实施方案仅仅是通过示例的方式来提供的。并不意味着本发明由说明书中提供的具体实施例来限制。虽然已经参考上述说明书描述了本发明,但是本文实施方案的描述和说明不意味着以限制的意义解释。在不脱离本发明的情况下,本领域的技术人员现在可以想到许多变化、改变和替换。此外,应当理解,本发明的所有方面不限于本文所述的取决于各种条件和变量的具体描述,配置或相对比例。应当理解,在实施本发明时可以采用本文所述的本发明实施方案的各种替代方案。因此,预期本发明还将涵盖任何此类替代、修改、变化或等同物。以下权利要求旨在限定本发明的范围,并且在这些权利要求及其等同物的范围内的方法和结构由此被覆盖。
- 一种锅炉管道超声波检测装置
- 一种气动循环式管道通径检测装置及管道通径的检测方法
- 一种非接触式电磁炉温度检测装置及电磁炉
- 一种工业管道的电磁超声检测装置
- 一种工业管道的电磁超声测厚内检测器
