一种手性吡啶-2,6-二醇的合成方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及有机合成领域,具体涉及一种利用铱催化2,6-二酰基吡啶的不对称加氢制备手性吡啶-2,6-二醇化合物的合成方法。
背景技术
不饱和双键的不对称氢化是将前手性化合物转化为手性化合物的最简单有效的方法。在铂族金属的均相催化氢化和手性配体的发展之前,双键的对映选择性氢化是通过将手性助剂引入底物或者通过在手性载体上进行非均相加氢来实现。然而,这些相对老旧的方法在对映体诱导和转换数(TONs)方面的效率都非常低下。上世纪60年代,Wilkinson和Schrock/Osborn的铑催化体系实现了过渡金属催化的均相加氢反应,在这些均相加氢反应中对映体选择性更为有效[(a)J.A.Osborn,G.Wilkinson and J.F.Young,Chem.Commun.,1965,17.(b)J.A.Osborn,F.H.Jardine,J.F.Young and G.Wilkinson,J.Chem.Soc.A,1966,1711–1732.(c)R.R.Schrock and J.A.Osborn,J.Am.Chem.Soc.,1976,98,2143–2147.(d)R.R.Schrock and J.A.Osborn,J.Am.Chem.Soc.,1976,98,4450–4455.]。随后,孟山都公司成功将Rh催化的不对称氢化应用在L-Dopa和Takasago的薄荷醇生产工艺中,自此不饱和双键的对映选择性氢化策略已成为合成手性分子的最有效工具之一[(e)W.S.Knowles,Angew.Chem.,Int.Ed.,2002,41,1998–2007.(f)R.Noyori,Angew.Chem.,Int.Ed.,2002,41,2008–2022.]。
手性吡啶-2,6-二醇作为一种重要的中间体,可以合成具有C
发明内容
本发明的目的是提供一种手性吡啶-2,6-二醇化合物的合成方法,该方法提供了一种高效加氢催化体系,反应体系中使用叔丁醇钾为碱添加剂,操作简单、原料易得、反应活性高,极大的降低了反应成本,具有很高的工业应用价值。
具体地,本发明提供了一种手性吡啶-2,6-二醇化合物的合成方法,2,6-二酰基吡啶和氢气为原料,反应介质中使用金属铱和芳基骨架PNN配体原位形成的络合物为催化剂,在碱添加剂作用下,发生加氢反应,并以高收率、高ee和de值生成手性吡啶-2,6-二醇。具体步骤如下:
在手套箱中,将金属铱和芳基骨架的PNN配体按摩尔比1:1.1-1:2.2于乙醇中剧烈搅拌0.5-1小时,随后将2,6-二酰基吡啶的乙醇溶液加入其中,再加入碱添加剂,最后将其置于反应釜中,用氢气置换3次,充氢气至3-5MPa,20-60℃下反应1-24小时,冷却到室温后缓慢释放氢气,除去溶剂,残余物柱层析分离得到吡啶-2,6-二醇。
R选自氢、C
反应介质选自甲苯、苯、甲醇、乙醇、异丙醇、二氯甲烷、二氯乙烷、四氯化碳、乙酸乙酯、乙醚、四氢呋喃、二甲基亚砜或N,N-二甲基甲酰胺中的至少一种。优选为乙醇。
碱添加剂选自KOH、NaOH、Na
所述的金属铱和芳基骨架的PNN配体原位形成的络合物为催化剂,PNN配体其结构通式如下:
式中:
Ar为苯基、2-取代、3-取代、4-取代、2,6-二取代、2,4,6-三取代的芳基等芳环上碳数为C
R
R
所述的手性苯基膦-1,2-二苯基乙二胺配体,上述环烷基及环烷基衍生基团优选为六元哌啶环L-1a。
所述底物和催化剂的摩尔比为100-50000:1
所述底物和碱添加剂的摩尔比为10-10000:1
所述的催化反应条件为:
温度:室温-100℃,优选为20℃;
压力:3MPa;
时间:0.1-24小时,优选为12小时。
本发明具有以下优点:
1、起始原料易得
2、反应条件温和、反应活性高、对映选择性高和产物收率高。
3、催化剂制备简单且高效,整个工艺适合工业化生产。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:
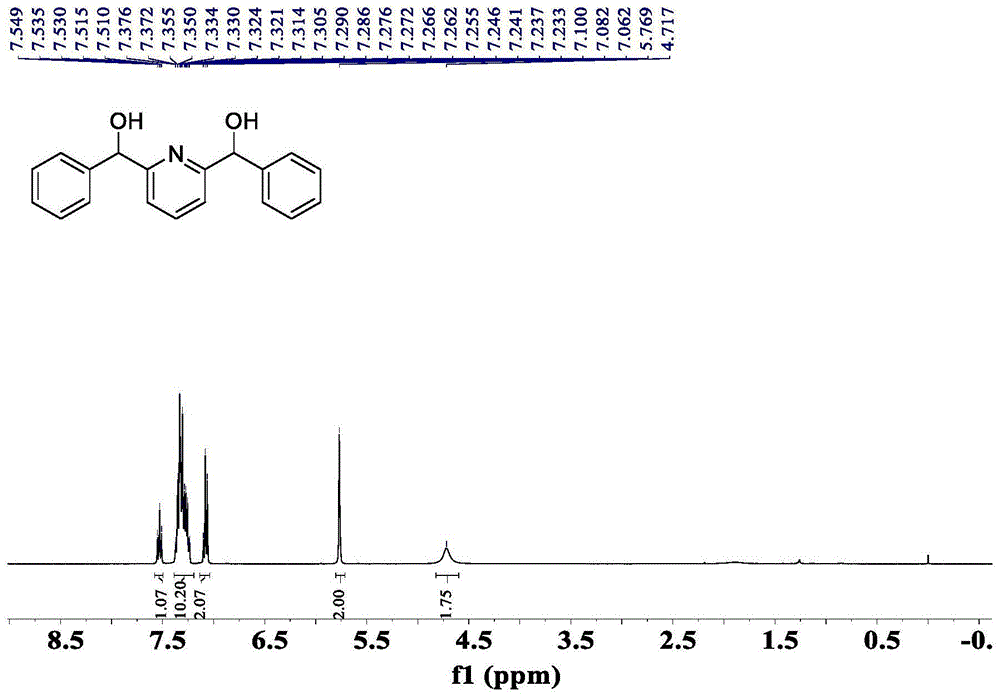
图1为实施例1制备的吡啶-2,6-二基双(苯基甲醇)II-A的核磁共振氢谱;
图2为实施例1制备的吡啶-2,6-二基双(苯基甲醇)II-A的核磁共振碳谱;
图3为实施例2制备的吡啶-2,6-二基双(对甲苯基甲醇)II-B的核磁共振氢谱;
图4为实施例2制备的吡啶-2,6-二基双(对甲苯基甲醇)II-B的核磁共振碳谱;
图5为实施例3制备的吡啶-2,6-二基双(间甲苯基甲醇)II-C的核磁共振氢谱;
图6为实施例3制备的吡啶-2,6-二基双(间甲苯基甲醇)II-C的核磁共振碳谱;
图7为实施例4制备的吡啶-2,6-二基二乙醇II-D的核磁共振氢谱;
图8为实施例4制备的吡啶-2,6-二基二乙醇II-D的核磁共振碳谱。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本发明所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本发明所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。本发明实施例的核磁共振是通过Bruker 400核磁共振仪测定。
实施例1
在手套箱中,将金属铱(0.002mmol)和配体L-1a(0.0022mmol)按摩尔比1:1.1于乙醇中剧烈搅拌1h,随后将2,6-二苯甲酰基吡啶I-A(0.2mmol)的乙醇溶液(0.1M)加入其中,并加入
实施例2
吡啶-2,6-二基双(对甲苯基甲醇)II-B的核磁共振氢谱和碳谱如图3、图4所示:
实施例3
吡啶-2,6-二基双(间甲苯基甲醇)II-C的核磁共振氢谱和碳谱如图5、图6所示:
实施例4
/>
吡啶-2,6-二基二乙醇II-D的核磁共振氢谱和碳谱如图7、图8所示:
获得的产物II-D可以作为原料用于合成手性膦配体,该手性膦配体可应用于酮类化合物的不对称转移氢化(Q.Jiang,D.V.Plew,S.Murtuza,X.Zhang.Tetrahedron Lett.,1996,37,797–800).
以上所述实施案例仅表达本发明的实施方式,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- (+)-2,6-二(4,5-蒎烯-2-吡啶基)吡啶手性单核锰配合物及其制备方法
- 一种不对称有机催化合成含有手性2,3-二氢呋喃骨架的多取代吡啶氮氧化合物的方法
- 一种吡啶气相光氯化制备2,6-二氯吡啶的方法及生产线
- 1,4-二氢-3,5-二乙酸月桂醇酯-2,6-二甲基吡啶的合成方法
- 1,4-二氢-3,5-二乙酸月桂醇酯-2,6-二甲基吡啶的合成方法
