一种批量纯化多肽毒素的方法及复合型双层层析柱
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于多肽纯化技术领域,具体涉及一种批量纯化多肽毒素的方法及复合型双层层析柱。
背景技术
多肽毒素,是有毒动物分泌的一类天然活性多肽,具有丰富的生理学功能,是当前药物开发作为筛选药物前体分子的研究热点。多肽毒素的获取手段主要包括天然提取,化学合成与基因表达,由于大部分多肽毒素具有天然的空间结构,富含多对二硫键,以及氨基酸序列较长,天然提取的方式工艺过于复杂,并且提取的含量极低,而化学合成对于此类多肽毒素的合成成本过高,同时难以正确形成多肽毒素的空间结构,因此现阶段的多肽毒素获取方式主要集中于基因表达,尤其是以原核表达的方式为主。现有文献报道的蜘蛛源、蝎子源和蜈蚣源等多肽毒素采用原核表达较多,选用的表达载体各式各样,大多数是针对单个的多肽毒素的纯化方法,在1L的表达体系中,一般产量约为0.3mg/L~5mg/L。多肽毒素的纯化大多数采用透析,膜过滤与色谱系统的方式,其中透析和膜过滤的方式耗时长,除盐和除杂不够彻底,更重要的是容易造成多肽沉淀,损失较大,而选用色谱系统的方式,虽然脱盐和除杂彻底,但对于设备和耗材要求高,成本大,更不能进行批量纯化。
在多肽毒素药物开发中,研究学者们为了能够高效深度挖掘动物毒素多肽,建立活性多肽分子库,提高多肽毒素药物筛选的进度,缩短药物研发周期,解决小分子药物开发出现的分子来源不足的瓶颈问题,正在做大量的研究工作。然而,在原核表达过程中如何快速纯化和富集高纯度的多肽毒素仍面临重大挑战,其中低成本与快速去除盐分子和杂蛋白,提高收率是主要难点。所以有必要提供一种克服现有技术存在的耗时长,纯度低,成本高的缺点,操作简便同时大大提高收率和产品纯度的批量纯化方法。
发明内容
本发明的目的在于,针对现有技术的上述不足,提供了一种批量纯化多肽毒素的方法及复合型双层层析柱。
为实现上述目的,本发明采用如下的技术方案:
本发明的第一目的是提供一种复合型双层层析柱,应用于批量纯化多肽毒素,所述复合型双层层析柱的柱体内自上而下铺设有凝胶过滤填料和反向高效液相色谱填料,所述复合型双层层析柱的柱体积为12mL-30 mL,所述凝胶过滤填料与所述反向高效液相色谱填料的质量比为1:(1-2);所述凝胶过滤填料为含葡聚糖和琼脂糖的复合基质;所述反向高效液相色谱填料选自C18和C8中任意一种。
进一步的,所述凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。
进一步的,所述反向高效液相色谱填料的粒径为30-50μm,孔径为60Å- 200Å,比表面积300-550m
进一步的,所述复合型双层层析柱的柱体内径15 mm ~ 25mm;柱体长度为75mm~110 mm。
本发明的第二目的是提供一种批量纯化多肽毒素的方法,采用上述的复合型双层层析柱,将原核表达多肽毒素的发酵菌液预处理后经过镍柱亲和层析、蛋白酶酶切、复合型双层层析柱纯化。
进一步的,所述镍柱亲和层析包括以下步骤:
(1)柱平衡:用20%~25%乙醇溶液洗涤镍柱,之后用咪唑溶液平衡镍柱;
(2)上样:将预处理后的菌液上清样品加载到平衡后的镍柱中,流速控制在1~2mL/min;
(3)除杂:用10mM~30mM咪唑溶液进行杂蛋白洗脱;
(4)洗脱:用300mM~400mM咪唑溶液进行目的蛋白洗脱并收集;
所述蛋白酶酶切包括以下步骤:
将经镍柱亲和层析洗脱下来的洗脱液收集,按照1:50的质量比进行
TEV酶切,所述TEV酶切的条件为16℃±0.5℃,酶切12h-14h,得酶切液;
所述复合型双层层析柱纯化包括以下步骤:
(1)柱平衡:用流动相A洗涤所述复合型双层层析柱,之后用流动相B对所述复合型双层层析柱进行平衡;
(2)上样:取酶切液上样,加载到所述复合型双层层析柱中,流速控制在1mL/min;
(3)洗涤脱盐:用3-4个柱体积的流动相B进行洗涤脱盐,收集洗脱液;
(4)除盐:再用1~2个柱体积的流动相C进行洗脱,去除所述复合型双层层析柱中残留的盐离子,弃置洗脱液;
(5)用从步骤(3)中得到的洗脱液替换步骤(2)中的酶切液,重复步骤(2)-(4)直至样品全部脱盐,其电导值应不大于200μs/cm。
进一步的,所述多肽毒素的分子量为3000-6000Da。
进一步的,所述发酵菌液为多肽毒素表达序列构建pet26b原核表达载体,转化E.coli BL21(DE3)大肠杆菌,经过诱导表达筛选获得的稳定表达菌株发酵获得的菌液;所述预处理为发酵菌液离心收集沉淀,洗涤后重悬,用高压破碎仪进行破碎,破碎后离心收集上清液。
进一步的,所述酶切液的上样量为所述复合型双层层析柱中的填料质量的2%~4%。
进一步的,所述流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为65%水:35%乙腈。
本发明所述的多肽毒素在构建时引入6XHis标签,TEV酶切位点,DsbC
标签蛋白,采用亲和标签去除大量杂蛋白,再通过咪唑洗脱获得多肽毒素融合蛋白。所述的多肽毒素融合蛋白通过TEV酶酶切,获得多肽毒素溶液,其中的酶切体系为1:50的质量比,包含EDTA,精氨酸,甘油,增加多肽和杂蛋白的溶解性,防止沉淀产生,降低多肽的损失和过柱难度。
与现有技术比较,本发明提供的技术方案带来的有益效果是:
(1)本发明提供了一种批量纯化多肽毒素的方法及复合型双层层析柱,
该复合型双层层析柱的柱体内自上而下铺设有凝胶过滤填料和反向高效液相色谱填料,复合型双层层析柱的柱体积为12mL-30 mL,凝胶过滤填料与反向高效液相色谱填料的质量比为1:(1-2);凝胶过滤填料为含葡聚糖和琼脂糖复合基质;反向高效液相色谱填料选自C18或C8;通过复合型双层柱一步纯化快速脱盐和去除杂蛋白,获得的多肽毒素,符合多肽药物筛选的纯度和产率,整个过程操作简单,耗时短,成本低,无需使用昂贵的设备。
(2)本发明提供了一种批量纯化多肽毒素的方法,包括将原核表达多肽毒素的发酵菌液预处理后经过镍柱亲和层析、蛋白酶酶切、复合型双层层析柱纯化,该方法可同时能够实现对不同1L的原核表达多肽毒素体系的批量纯化,成功率高达90%,收率不低于10%,提高多肽毒素药物筛选的进度。
(3)现有中高压分离纯化设备,虽可获得高纯度多肽,仅能进行单通道纯化,每次纯化至少需要0.5h,对于几十或上百个多肽表达样品,单台仪器一个工作日内基本无法完成纯化,通过增加设备台数,成本较大,而本发明提供的方法,通过使用复合型双层层析柱搭配固相萃取仪,成本低廉,每增加一套装置,就可增加24个多肽纯化通道,2-4h内可高效实现上百个不同序列多肽的批量纯化。
附图说明
图1为复合型双层层析柱富集的SEQ ID NO.1多肽毒素的质谱鉴定图;
图2为复合型双层层析柱富集的SEQ ID NO.4多肽毒素的质谱鉴定图;
图3为复合型双层层析柱富集的SEQ ID NO.6多肽毒素的质谱鉴定图;
图4为复合型双层层析柱富集的SEQ ID NO.10多肽毒素的质谱鉴定图;
图5为复合型双层层析柱富集的SEQ ID NO.1多肽毒素的高效液相色谱图;
图6为复合型双层层析柱富集的SEQ ID NO.4多肽毒素的高效液相色谱图;
图7为复合型双层层析柱富集的SEQ ID NO.6多肽毒素的高效液相色谱图;
图8为复合型双层层析柱富集的SEQ ID NO.10多肽毒素的高效液相色谱图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例和附图,对本发明的具体实施方式作进一步详细描述。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
本发明用到的复合型双层层析柱的尺寸信息为: 12mL SPE柱管的尺寸为:柱体内径15.6mm,柱体长度79.2mm;20mL SPE柱管的尺寸为:柱体内径19.4mm,柱体长度93.6mm;30mL SPE柱管的尺寸为:柱体内径23.5mm,柱体长度105.7mm。
本发明用到的反向高效液相色谱填料的粒径为30-50μm,孔径为60Å- 200Å,比表面积300-550m
本发明的多肽毒素来源如下:
对有毒动物的组织提取物进行基因组、转录组、多肽组和蛋白组的高通量测序,对高通量测序结果进行分析,筛选出可能具有活性的多肽片段。将初步分析得到的多肽序列片段进一步通过软件分析和打分,将可能有活性的多肽序列放入多肽数据库,并对多肽结构进行重构,形成多肽库的数据。
本发明的多肽毒素为30-60个氨基酸残基的多肽,包括如表1所示的多肽毒素序列:
表1.多肽毒素序列及结构特征
本发明中预处理后的菌液上清样品来源如下:
将多肽毒素表达序列拼接到自主构建的pet26b载体(参照专利CN202111270816.2中记载的构建方法),转化E.coli BL21(DE3)大肠杆菌,挑取单克隆接种于含有氨苄抗性的LB培养基中,37℃,220pm振荡培养6-8h,分装300μL送往擎科生物公司测序,利用测序正确的菌液进行后续的原核表达。将测序正确的菌液按1:100的比例接种于含有氨苄抗性的LB培养基中过夜培养,次日将菌液加入1L含有抗性的LB培养基中,37℃,220rpm摇床中培养,当其OD值达到0.6-0.8后,加入终浓度为1mM的IPTG,此刻将摇床设置为28℃,100pm进行诱导表达,诱导时间为12-16h。
次日将菌液离心收集,超纯水洗涤两次后离心去上清。用l×BindingBuffer重悬菌体,直至无明显菌体颗粒后,菌液倒入均质机中连续破碎3次,保证菌液中无明显沉淀即可,离心收集菌液上清,即得。
本发明中预处理后的菌液上清样品通过镍柱亲和层析,可获得约10mL 的洗脱液,然后采用紫外分光光度仪测定其蛋白浓度。以表1中如SEQ ID NO.1-10所示的多肽毒素为例,分别收集到的洗脱液中的蛋白浓度在6-10mg/mL之间,分别可获得的融合蛋白约60-100mg。
本发明中“40mg酶切液”,指的是取约含40mg融合蛋白的洗脱液,按照1:50的质量比加入TEV酶,同时酶切体系中包含0.5mM EDTA,1%精氨酸,2%甘油,16℃下,进行12-14hTEV酶切,得40mg酶切液。
本发明的SPE柱管的装备:选择12、20或者30mL 空柱管进行填料填充,填充顺序为先向空柱中填充反相填料,盖上筛板,进一步填充凝胶过滤填料,盖上筛板。
为了探究采用复合型双层柱批量纯化多肽毒素的特点,本发明进行了如下研究:
以表1中如SEQ ID NO.1-10所示的多肽毒素为例,进行重组表达后的富集纯化。SPE空柱中装入反相高效液相色谱填料,进一步装入凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min,纯化温度为20-24℃。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(4个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。收集的多肽毒素进行分析检测。查看其富集成功率,同时包括纯度分析检测,查看脱盐和除去接头蛋白效果。
(1)考察反相高效液相色谱填料对多肽毒素纯化的影响,设计的试验组和对比组包括:
试验组1:SPE柱管体积12mL,凝胶过滤填料1g,C18填料1g;
试验组2:SPE柱管体积12mL,凝胶过滤填料1g,C18填料2g;
试验组3:SPE柱管体积12mL,凝胶过滤填料1g,C8填料1g;
试验组4:SPE柱管体积12mL,凝胶过滤填料1g,C8填料2g;
试验组5:SPE柱管体积12mL,凝胶过滤填料1g,PEP填料1g;
试验组6:SPE柱管体积12mL,凝胶过滤填料1g,PEP填料2g;
试验组7:SPE柱管体积12mL,凝胶过滤填料2g,C18填料1g;
试验组8:SPE柱管体积12mL,凝胶过滤填料2g,C18填料2g;
试验组9:SPE柱管体积12mL,凝胶过滤填料2g,C8填料1g;
试验组10:SPE柱管体积12mL,凝胶过滤填料2g,C8填料2g;
试验组11:SPE柱管体积12mL,凝胶过滤填料2g,PEP填料1g;
试验组12:SPE柱管体积12mL,凝胶过滤填料2g,PEP填料2g;
对比组1:SPE柱管体积20mL,凝胶过滤填料1g,C18填料1g;
对比组2:SPE柱管体积20mL,凝胶过滤填料1g,C18填料2g;
对比组3:SPE柱管体积20mL,凝胶过滤填料1g,C8填料1g;
对比组4:SPE柱管体积20mL,凝胶过滤填料1g,C8填料2g;
对比组5:SPE柱管体积12mL,凝胶过滤填料1g,PEP填料1g;
对比组6:SPE柱管体积12mL,凝胶过滤填料1g,PEP填料2g;
对比组7:SPE柱管体积20mL,凝胶过滤填料2g,C18填料1g;
对比组8:SPE柱管体积20mL,凝胶过滤填料2g,C18填料2g;
对比组9:SPE柱管体积20mL,凝胶过滤填料2g,C8填料1g;
对比组10:SPE柱管体积20mL,凝胶过滤填料2g,C8填料2g;
对比组11:SPE柱管体积12mL,凝胶过滤填料2g,PEP填料1g;
对比组12:SPE柱管体积12mL,凝胶过滤填料2g,PEP填料2g。
结果如表2所示,选取12mL空柱中填充C18填料2g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm,富集多肽的成功率最高。
表2.
注:成功率指本发明方法对例举的10条多肽富集的纯度大于50%及收率高于5%的多肽数目成功率。
(2)考察不同型号的凝胶填料对纯化效果的影响
12mLSPE空柱中装入C18填料2g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 30,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,纯化温度为20-24℃。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(4个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。富集多肽的成功率为90%。
实施例1
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
1.样品预处理
将分别含有如SEQ ID NO.1-10所示的多肽毒素的大肠杆菌发酵液各1L放入离心机中,超纯水洗涤两次后离心去上清。用l×Binding Buffer重悬菌体,直至无明显菌体颗粒后,菌液倒入均质机中连续破碎3次,保证菌液中无明显沉淀即可,离心收集菌液上清,得预处理多肽毒素样品约100mL。
2.镍柱亲和层析
将步骤1得到的预处理多肽毒素经过镍柱亲和层析,具体步骤如下:
(1)平衡镍柱:从冰箱4℃取出His亲和层析树脂,摇匀后用移液枪吸取5mL装于层析柱内,待柱内的镍柱保存液自然流净后,使用5-10倍柱体积的低溶度咪唑溶液平衡镍柱,该步骤是为了去除镍柱中的乙醇,避免对后续蛋白结合造成影响。
(2)上样过柱:将获得的菌液上清均匀沿壁加入,并小心控制流速1~2mL/min,使其溶液可以8-10s一滴的流速均匀流出,保证蛋白溶液可以缓慢的与镍柱充分结合。
(3)洗脱:待蛋白溶液全部滴完以后,先用超纯水清洗镍柱,进一步用低浓度10mM和30mM咪唑缓冲试剂洗脱杂蛋白,再利用高浓度300mM的咪唑溶液Eluting Buffer洗脱融合蛋白,将洗脱液收集,可获得约10mL的洗脱液,并用NanoDrop微量紫外分光光度计测定浓度,SEQ ID NO.1-10多肽毒素各自对应的洗脱液的蛋白浓度分别为7.554mg/mL、7.129mg/mL、8.527mg/mL、5.579mg/mL、8.413mg/mL、8.924mg/mL、6.188mg/mL、11.686mg/mL、7.659mg/mL、9.230mg/mL,洗脱液中所含有的蛋白总量约在60mg ~100mg范围内。
3.蛋白酶酶切
取5~6mL洗脱液,约含40mg融合蛋白的洗脱液,按照1:50的质量比加入TEV酶,同时酶切体系中包含0.5mM EDTA,1%精氨酸,2%甘油,16℃下,进行12-14h TEV酶切,得酶切液。
4.复合型双层层析柱纯化
12mLSPE空柱中装入C18填料2g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。将收集的多肽毒素溶液冷冻干燥后即可得多肽毒素。
多肽毒素的纯度检测方法为:采用高效液相色谱法,色谱柱为UniSil@5-120 C18Ultra,4.6×250mm;检测波长215nm和280nm;流速为1mL/min;其中流动相A为含0.1%TFA的乙腈,流动相B为含0.1%TFA的超纯水,梯度洗脱0-30min内,流动相A与流动相B的体积比由10:90变化为40:60,柱温:30℃。
具体结果如表3所示:40mg酶切液的纯化得到的多肽毒素的产量在4.5mg-7.68mg范围内,仅SEQID NO.2的纯度低于50%,同时收率为4.65%,不符合要求,故收集到的多肽数目成功率为90%,获得的多肽毒素的纯度在63.0-88.9%之间,电导率均低于200μs/cm,收率在10.9-19.2%。
收率=冷冻干燥后多肽重量/40mg酶切液
表3.
如图1和图5所示,分别为SEQ ID NO.1多肽毒素的质谱鉴定图和色谱纯度图;
如图2和图6所示,分别为SEQ ID NO.4多肽毒素的质谱鉴定图和色谱纯度图;
如图3和图7所示,分别为SEQ ID NO.6多肽毒素的质谱鉴定图和色谱纯度图;
如图4和图8所示,分别为SEQ ID NO.10多肽毒素的质谱鉴定图和色谱纯度图。
SEQ ID NO.1序列为:
SVIENCSKPGKNVTCLCNEGFINLKTKCLNQWL,2对二硫键脱去4个H,以及TEV酶酶切会在N端残留G一个氨基酸,其理论分子量为3751.4 。由图1和图5可知,保留时间为21.460min的收集峰,经高分辨质谱鉴定,实际质荷比751.2255、938.7801与1251.3709换算后均符合理论分子量,采用高效液相色谱法测得纯度为66.4%。
SEQ ID NO.4序列为:
ECRYWMGGCSKTEDCCEHLSCSPKHKWCVWDWTFGK,3对二硫键脱去6个H,以及TEV酶酶切会在N端残留G一个氨基酸,其理论分子量为4379.0 ,由图2和图6可知,保留时间为21.117min的收集峰,经高分辨质谱鉴定,实际质荷比730.6915、876.8286与1095.7843换算后均符合理论分子量,采用高效液相色谱法测得纯度为75.3%。
SEQ ID NO.6序列为:
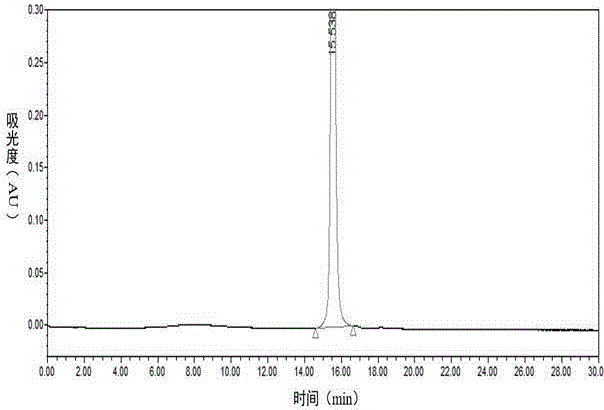
ECRYFLGKCAQTSDCCKHLACHNKHKWCVGQDLQEV,3对二硫键脱去6个H,以及TEV酶酶切会在N端残留G一个氨基酸,其理论分子量为4233.86,由图3和图7可知,保留时间为15.538min的收集峰,经高分辨质谱鉴定,实际质荷比583.2998、706.5370与847.6432换算后均符合理论分子量,采用高效液相色谱法测得纯度为84.3%。
SEQ ID NO.10序列为:
EAEADICSQPPVMGPCRAMLPSLYFNGLECEFFIYGGCQGNSNNFKTVEECKQTC,3对二硫键脱去6个H,以及TEV酶酶切会在N端残留G一个氨基酸,其理论分子量为6060.63,由图4和图8可知,保留时间为12.227min的收集峰,经高分辨质谱鉴定,实际质荷比1515.7286与2020.9683换算后均符合理论分子量,采用高效液相色谱法测得纯度为88.9%。
实施例2
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
12mLSPE空柱中装入C8填料2g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表4所示:40mg酶切液的纯化得到的多肽毒素的产量在4.68mg-6.84mg范围内,不符合要求的多肽序列为SEQ ID NO.9;符合要求的多肽序列为SEQ ID NO.1-SEQID NO.8、SEQ ID NO.10,故收集到的多肽数目成功率为90%,纯度在60.8-81.3%之间,电导率低于200μs/cm,收率在11.7-17.1%。
表4.
实施例3
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
30mLSPE空柱中装入C18填料4g,粒径为50μm,孔径为120Å,进一步装入2g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表5所示:40mg酶切液的纯化得到的多肽毒素的产量在3.31mg-6.92mg范围内,不符合要求的多肽序列为SEQ ID NO.2;符合要求的多肽序列为SEQ ID NO.1、SEQIDNO.3-SEQ ID NO.10,故收集到的多肽数目成功率为90%,纯度在62.3-90.1%之间,其中,SEQ ID NO.3、SEQ ID NO.5、SEQ ID NO.6、SEQ ID NO.7和SEQ ID NO.10的收率均超过10%,电导率低于200μs/cm,收率在6.4-15.7%。
表5.
对比例1
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
12mLSPE空柱中装入C18填料2g,粒径为50μm,孔径为60Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表6所示:不符合要求的多肽序列为SEQ ID NO.2、SEQ ID NO.3、SEQID NO.9;符合要求的多肽序列为SEQ ID NO.1、SEQ ID NO.4-8,故收集到的多肽数目成功率为70%,纯度在59.8-80.3%之间,电导率低于400μs/cm,收率在5.1-8.5%。
表6.
对比例2
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
12mLSPE空柱中装入C18填料2g,粒径为50μm,孔径为200Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表7所示:不符合要求的多肽序列为SEQ ID NO.2、SEQ ID NO.4、SEQID NO.7、SEQ ID NO.9;符合要求的多肽序列为SEQID NO.1、SEQ ID NO.3、SEQ IDNO.5-6、SEQ ID NO.8、SEQ IDNO.10,故收集到的多肽数目成功率为60%,纯度在55.7-75.3%之间,电导率低于200μs/cm,收率在5.3-8.2%。
表7.
对比例3
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
12mLSPE空柱中装入PEP填料2g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表8所示:不符合要求的多肽序列为SEQ ID NO.2、SEQ ID NO.4、SEQID NO.5、SEQ ID NO.8、SEQ ID NO.10;符合要求的多肽序列为SEQ ID NO.1、SEQ ID NO.3、SEQ ID NO.6-7、SEQ ID NO.9,故收集到的多肽数目成功率为50%,纯度在51.5-62.6%之间,电导率低于400μs/cm,收率在5.9-7.3%。
表8.
对比例4
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
20mLSPE空柱中装入C18填料2g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表9所示:不符合要求的多肽序列为SEQ ID NO.2、SEQ ID NO.5、SEQID NO.9;符合要求的多肽序列为SEQ ID NO.1、SEQ ID NO.3、SEQ ID NO.4、SEQ ID NO.6-7、SEQ ID NO.8、SEQ ID NO.10,固收集到的多肽数目成功率为70%,纯度在63.5-77.1%之间,电导率低于250μs/cm,收率在6.5-12.5%。
表9.
对比例5
本实施例为如SEQ ID NO.1-10所示的多肽毒素的批量纯化
与实施例1基本相同,不同之处为步骤4:
12mLSPE空柱中装入C18填料1g,粒径为50μm,孔径为120Å,进一步装入1g凝胶过滤填料为Sup-DextranTM 75,粒径为22-44μm。配制流动相A为5%水:95%乙腈,流动相B为95%水:5%乙腈,流动相C为:65%水:35%乙腈,流速控制为1mL/min。通过流动相A进行柱活化(1个柱体积),流动相B平衡柱(2个柱体积),40mg酶切液上样,流动相B洗涤脱盐(2个柱体积),流动相C洗脱收集多肽毒素(1个柱体积)。流动相过柱的流速通过固相萃取仪进行控制流速为1mL/min。
具体结果如表10所示:不符合要求的多肽序列为SEQ ID NO.1-SEQID NO.3、SEQID NO.5、SEQ IDNO.7-SEQ ID NO.9;符合要求的多肽序列为SEQ ID NO.4、SEQ IDNO.6、SEQID NO.10,故收集到的多肽数目成功率为30%,纯度在62.1-68.3%之间,电导率低于300μs/cm,收率在6.3-7.8%。
具体结果如表10所示:
表10.
在不冲突的情况下,本文中上述实施例及实施例中的特征可以相互结合。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种大批量纯化克级力学功能蛋白的层析柱的制备方法及再生方法
- 一种河豚毒素纯化用层析柱的填料装填装置
