重组人奥克纤溶酶在制备治疗脉络膜血管疾病药物中的用途
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及针对人类眼底疾病或者病症的并发症的制药用途。更具体的,本发明涉及使用截短型纤溶蛋白酶用于制备治疗或预防人类眼底疾病或者疾病的并发症的药物中的用途。
背景技术
息肉样脉络膜血管病变(Polypoidal Choroidal Vasculopathy,PCV)为脉络膜血管疾病,患者表现为眼底黄斑区橘红色脉络膜视网膜隆起,部分可见黄斑区视网膜下大范围出血,视网膜硬性渗出,吲哚青绿眼底血管造影(ICGA)表现出脉络膜息肉样血管病变和异常分支血管网(BVN)、末端血管瘤样扩张结节 (polyps)等,导致出血性和浆液性黄斑病变的反复发作和多发性视网膜色素上皮脱落(PED),严重影响患者视力。该疾病于20世纪90年代初首次被描述,主要发生在亚洲人中的视网膜疾病。
PCV易导致出血,有30.0%~63.6%的该病患者会发生视网膜下出血。息肉样病灶出现的位置也有差异,亚洲人患者中有92%息肉样病灶在黄斑区分布,而欧洲人患者中息肉样病灶均匀分布在视乳头周围和黄斑区。
目前国内外均无治疗PCV的药物获批上市,当前PCV的常规治疗方法为光动力疗法联合抗VEGF药物治疗PCV。但已有研究显示,PDT在相当一部分人群中会导致复发性出血并存在导致视力丧失的可能(HIRAMI et al.Hemorrhagic complications afterphotodynamic therapy for polypoidal choroidal vasculopathy.Retina:March2007Volume 27Issue 3p335-341doi:10.1097/01.iae.0000233647.78726.46)。经PDT治疗后并发视网膜下大量出血的风险使研究人员考虑了较少的创伤性医学干预措施,尤其是抗VEGF治疗,然而抗VEGF疗法的结果亦是好坏参半。尽管一项研究表明玻璃体内贝伐单抗注射引起暂时性渗出减少,但吲哚菁绿血管造影术(ICGA)在11只眼中的 10只眼中仍可检测到脉络膜血管异常(F Gomietal.Efficacy of intravitreal bevacizumab forpolypoidal choroidal vasculopathy.British Journal of Ophthalmology 2008;92:70–73.doi:10.1136/bjo.2007.122283)。尽管贝伐单抗可以稳定视力并减少渗出性视网膜脱离,但PDT对于治疗息肉样病变仍是必要的(T Y Y Lai etal.Intravitrealbevacizumab(Avastin)with or without photodynamic therapy for the treatment ofpolypoidal choroidal vasculopathy.British Journal of Ophthalmology2008;92:661–666.doi:10.1136/bjo.2007.135103)。鉴于上述疗法在有效性和安全性方面的问题以及PCV的高发病率所带来的极大的临床需求,亟需开发新的靶点或作用机制的药物。
人纤溶酶由791个氨基酸组成,分子量约为88kD,形成两条链,重链和轻链之间以二硫键连接。重组人奥克纤溶酶作为只保留酶活性片段的重组丝氨酸蛋白酶类的纤溶酶,其原研产品
本申请发明人在开发重组人奥克纤溶酶的过程中,创新地将其应用到PCV 的治疗中,惊喜地发现奥克纤溶酶在改善PCV患者相关指标中的显著效果,无论是在安全性方面或是有效性方面均展现出优势,为后期的适应症开发奠定基础。
发明内容
本发明的目的是提供保留酶活性结构域的经截短的纤溶酶的新用途,具体的是重组人奥克纤溶酶的新用途。
不受任何理论束缚,将保留酶活性片段的重组人奥克纤溶酶应用于PCV患者的治疗中能够显著改善PCV患者的相关症状,一方面可降低息肉样结构血管簇内渗透压,从而减少渗漏及出血,另一方面可溶解血管簇外的血凝块,促进黄斑下出血移除,从而达到治疗PCV的目的,尤其是出血型特发性PCV。因此,本发明提供保留酶活性结构域的经截短的纤溶酶在制备预防或治疗PCV的药物中的用途。
根据本发明,所述保留酶活性结构域的经截短的纤溶酶是指通过缺失一个或多个人纤溶酶原的79-791号氨基酸中的氨基酸产生的纤溶酶蛋白,其产生的蛋白具有丝氨酸蛋白酶的催化活性。优选为只保留纤溶酶原C端249个氨基酸的重组人奥克纤溶酶,其具有如SEQ ID NO:1所示的重链19个氨基酸(此肽链虽然短,但是来自于人纤溶酶的重链,故依然称为重链),和如SEQ ID NO:2所示的轻链230个氨基酸,重链和轻链之间通过两条二硫键相连,且轻链内还有4 条二硫键(如图4所示)。
根据本发明,“脉络膜血管疾病”是指各种原因导致的脉络膜缺血、脉络膜出血等病变的总称,是眼科常见的可致盲性疾病,以血管壁形态的改变、血管硬化、渗漏、水肿、出血、渗出和新生血管等病理改变为特征。
所述“息肉样脉络膜血管病变(PCV)”,是脉络膜循环的主要异常,其特征在于内部脉络膜血管网络最终形成息肉样扩张,呈现为眼底橘红色结节样病灶、ICGA检查显示异常分支血管网及末端息肉样血管扩张病灶(polyps),除 polyps外,渗出型PCV有明显的浆液性视网膜色素上皮脱离(PED)和/或视网膜脱离以及大量黄白色脂质渗出,出血型PCV主要是出血性色素上皮脱离或大量的视网膜下出血,且视力可突然丧失。
在生理结构上脉络膜是位于视网膜和巩膜之间一层具有弹性和富有血管的棕色薄膜,其内侧通过一层十分光滑的玻璃膜与视网膜的色素上皮层相联系,外侧通过一潜在性间隙与巩膜相接,脉络膜的主要作用是营养视网膜外层,其次能阻断透入巩膜进入眼内的光线,以保证成像清晰。脉络膜和视网膜是完全不同的眼底结构。
在临床诊断中,PCV与AMD的表现比较相似,但是二者的具体诊断和流调情况均由明显差异,尤其是息肉样结构的产生,如下表所示:
本发明的第二目的是提供预防或治疗PCV的方法,该方法包括将包含保留酶活性结构域的经截短的纤溶酶的药物施用于患者,使患者眼底患部与有效量的保留酶活性结构域的经截短的纤溶酶接触,并以缓解、消除或逆转症状的方式产生对PCV患者的治疗作用,其中所述保留酶活性结构域的经截短的纤溶酶优选为重组人奥克纤溶酶。
在一些实施方式中,本发明所述药物可以为液体制剂,且可施用于玻璃体、房水、巩膜,结膜,巩膜和结膜之间,视网膜脉络膜组织,黄斑或其他能够通过这些组织或眼周途径将药物施用于受试者眼睛内或附近的区域。在一些实施方式中,对于PCV的预防、治疗或延迟发作,不同的给药途径,其所需施用的有效量和维持时间可以不同。
在一些实施方式中,本发明所述药物可以为液体制剂,包括但不限于通过以下方式进行药物的递送:(1)通过使用常规注射器或皮下注射针头来施用所述药物;(2)使用专门设计的装置来注射所述药物;(3)通过注射器直接注射进入玻璃体或其他任何相关组织递送所述药物。
在一些实施方式中,本发明所述药物可以为液体制剂,所述液体制剂包括但不限于溶液、混悬液、乳液。所述液体制剂可任选地进一步包含稳定剂、赋形剂、助剂、抗氧化剂或其组合。在一些实施方式中,所述液体制剂中保留酶活性结构域的经截短的纤溶酶的质量体积浓度(w/v)在约0.01%-10%之间、在约 0.05%-10%之间、在约0.05%-8%之间、在约0.05%-6%之间、在约0.05%-4%之间、在约0.05%-2%之间、在约0.05%-1%之间,在约0.05%-0.5%之间,在约 0.05%-0.3%之间或在约0.05%-0.15%之间。在一些实施方式中,所述液体制剂中所述保留酶活性结构域的经截短的纤溶酶为重组人奥克纤溶酶,其质量体积浓度(w/v)在约0.01%-0.5%。在一些实施方式中,所述液体制剂中的重组人奥克纤溶酶质量体积浓度为0.01%、0.05%、0.0627%、0.1%、0.125%或0.15%中的任意一种。
在一些实施方式中,本发明所述液体制剂的局部实施总体积为约500μL、约 400μL、约300μL、约200μL、约150μL、约100μL、约90μL、约80μL,约70μL,约60μL,约50μL,约40μL,约30μL,约20μL,约10μL,约5μL,约3μL或约1μL。在一些实施方式中,本发明所述液体制剂直接施用于患者玻璃体内,其施用体积包括但不限于约150μL、约100μL、约90μL、约80μL,约70μL,约 60μL,约50μL,约40μL,约30μL,约20μL,约10μL,约5μL,约3μL或约 1μL。在一些实施方式中,所述液体制剂中所述保留酶活性结构域的经截短的纤溶酶的局部单次施用量为约500μg、约400μg、约300μg、约200μg、约100μg、约80μg、约60μg、约40μg、约20μg、约10μg或约5μg。在一些实施方式中,所述液体制剂中的所述保留酶活性结构域的经截短的纤溶酶为重组人奥克纤溶酶,其玻璃体单次施用量为约200μg、约100μg、约80μg、约60μg、约40μg、约20μg或约10μg或约5μg。
在一些实施方式中,单位剂型以其将被施用的浓度制备或在施用给受试者前被稀释。在一些实施方式中,在施用于受试者之前,将本发明所提供液体制剂在水性介质中稀释。在一些实施方式中,所述水性介质是等渗介质。在一些实施方式中,在给予受试者之前,将本发明所提供的液体制剂在非水介质中稀释。
有益的效果
1.组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA)作为一种纤溶酶原激活剂,已有相关研究探索了t-PA在治疗PCV中的可能性,本发明对比考察了不同浓度重组人奥克纤溶酶以及t-PA在体外的纤溶作用,终浓度在0.125~0.25mg/mL的重组人奥克纤溶酶对
2.本发明对比考察了食蟹猴PVD模型中不同浓度的重组人奥克纤溶酶与不同浓度的t-PA给药后玻璃体后脱离情况,其实验结果显示,无论是降解内界膜表面胶原纤维的的有效性还是安全性,重组人奥克纤溶酶均明显优于t-PA。
3.本发明对比考察了新西兰白兔RVO模型中不同浓度的重组人奥克纤溶酶与不同浓度的t-PA给药后视网膜静脉再通的水平,其实验结果显示,不同浓度的重组人奥克纤溶酶给药组的完全再通率分别为70%和90%,而不同浓度的 t-PA给药组的完全再通率分别30%和50%。
4.由于t-PA针对PCV适应症的应用仍停留在研究层面而并未获批,本发明在临床试验设计中对比考察使用重组人奥克纤溶酶与当前临床针对PCV的常规治疗(抗VEGF+PDT)的治疗效果,其结果显示,在相同治疗周期内,重组人奥克纤溶酶治疗组相较雷珠单抗与PDT联合治疗组在疗效方面具有一定优势,包括明显改善患者视力、减轻眼底黄斑部视网膜下出血和渗出。
附图说明
图1为不同浓度重组人奥克纤溶酶和t-PA针对
图2为食蟹猴眼部施用低中高剂量重组人奥克纤溶酶与t-PA诱导玻璃体后脱离OCT成像;
图3为食蟹猴眼部施用低中高剂量重组人奥克纤溶酶后视网膜内界面扫描电镜图。
图4为重组人奥克纤溶酶的氨基酸序列及其中二硫键的连接位点。
具体实施方式
以下通过对本发明较佳实施方式的描述,详细说明但不限制本发明。
材料/试剂与动物(如非特别说明,本发明所使用的材料均为市售购买)
实施例1重组人奥克纤溶酶的制备
重组人奥克纤溶酶的氨基酸序列如SEQ ID NO.1和SEQ ID NO.2所示,其结构中二硫键连接位点如图4中所示,并参照CN114480353A中所公开的方法制备所需重组人奥克纤溶酶,制备步骤简述如下:
1)发酵重组人奥克纤溶酶原的工艺
采用基因工程技术,将合成的编码基因克隆入表达载体pPICZ中构建形成重组表达载体,所述基因片段具有如SEQ ID NO:4所示的正义链和SEQ ID NO:5 所示的反义链;然后将重组表达载体转化到大肠杆菌DH5将中扩增培养,采用试剂盒提取重组表达载体;重组表达载体经过线性化,进一步纯化后,采用电击转化入感受态酵母宿主Pichia PastorisX33中,得到目的基因整合到酵母基因组中的重组工程菌;经筛选得到稳定、高表达的工程菌。
取工程菌,甘油种子解冻,接种到BMGY培养基摇瓶中振荡培养后扩增,得到OD
2)制备酶切后的SAK酶
在8mL葡激酶融合蛋白溶液(其中葡激酶融合蛋白的浓度为2mg/mL)中添加24uLEK酶(肠激酶)溶液(其中EK酶的活性为10IU/uL),混匀,在23±2℃的水浴中静置17±0.1小时,过滤,得到酶切后的SAK酶(葡激酶)溶液,编号为 EK-SAK-meiqie-30min-20190107。通过NI亲和层析、阳离子层析后收集含有酶切后的SAK酶的洗脱液,再以BestaroseDiamondMIX-A作为层析介质进行混合模式层析,以pH5.4±0.1的10mM CB缓冲液作为平衡缓冲液,收集含有目标成分的流穿液,使用0.22μm滤器过滤,得到酶切后纯化的SAK酶原液(编号为EK-SAK-FT-20190107),-20℃保存。酶切后纯化的SAK酶的氨基酸序列如SEQ ID NO:3所示。
3)制备重组人奥克纤溶酶
取步骤1)中发酵制备得到的30mL目的蛋白洗脱液中添加10mL 0.8M氨甲环酸,使样品中氨甲环酸的终浓度为0.2M,在所得稀释液中添加0.53mL步骤2) 中获得的酶切后的SAK酶,控制重组人奥克纤溶酶原与SAK酶的质量比为120: 1,混匀溶液,将溶液置于23±2℃的水浴中进行酶切反应,4±0.1小时后取出。在所得酶切后的溶液中以1:1的体积比添加含20mMPB,2M(NH
实施例2
1、实验目的:
体外验证实施例1中制备得到的重组人奥克纤溶酶的溶栓效果,为其后期的药效学评价及临床应用提供参考。
2、实验方法:
1)
取新鲜大鼠全血与3.8%枸橼酸钠9:1混合,在0.5mL上述全血中依次加入
2)重组人奥克纤溶酶体外溶栓活性检测
将上述血栓条切成每段2cm长,检测其总放射性后,加入到不同体积的大鼠血浆中,并分别加入对应体积溶媒对照组、t-PA组和供试样品1-4,其中供试样品1-4分别为奥克纤溶酶组0.25mg/mL、奥克纤溶酶组0.125mg/mL、奥克纤溶每组0.0625mg/mL、奥克纤溶酶组0.03125mg/mL),具体见表1。之后立即放置于37℃恒温培养箱中孵育,分别于15min、30min、1h、2h和4h时各取0.05mL 溶液测定其放射性,计算各组溶栓率。每组3个样本。
表1
各组溶栓率=(测试组放射性-溶媒组平均放射性)÷(测试组血栓总放射性 -溶媒组平均放射性)×100%
溶媒对照组溶栓率=溶媒组放射性÷溶媒组血栓总放射性×100%
3、实验结果
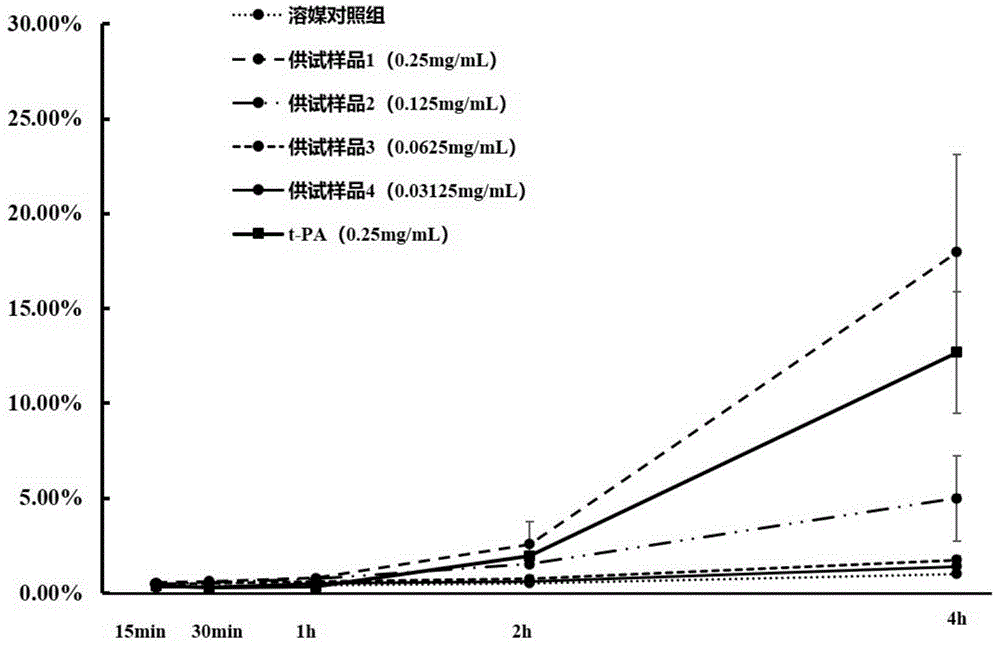
各组不同时间点溶栓率见图1。如图所示,溶媒对照组15min、30min、1h、 2h和4h的溶栓率分别为0.36±0.08%、0.35±0.04%、0.55±0.05%、0.66±0.15%和 1.39±0.04%,不同时间点的血栓自溶率较低,说明本实验条件下得到的同位素数据可靠。
终浓度0.03125mg/mL和0.0625mg/mL的供试品在不同时间点的溶栓率与溶媒对照组相似,溶栓率较低。终浓度为0.125mg/mL的供试品在4h的溶栓率分别为5.00±2.24%,其余时间点溶栓率均较低。终浓度0.25mg/mL的供试品2h、 4h的溶栓率分别为2.59±1.19%和17.98±5.16%,其余时间点溶栓率相对较低。而终浓度0.25mg/mL的t-PA在2h、4h的溶栓率分别为1.95±0.24%和12.68±3.21%,明显逊于相同给药条件下的奥克纤溶酶供试品组。
由此可知,在本实验条件下,终浓度在0.125~0.25mg/mL的奥克纤溶酶供试品对
实施例3重组人奥克纤溶酶诱导食蟹猴完全性玻璃体后脱离(PVD)实验
1、实验目的
利用食蟹猴作为实验动物考察不同给药剂量重组人奥克纤溶酶对玻璃体后脱离的发生率及后界膜及其纤维的影响,验证重组人奥克纤溶酶在眼底对界膜胶原纤维的降解作用。
2、实验方法
实验动物及分组:70只食蟹猴,随机分为7个组别,依次为眼用平衡盐缓冲液(BSSbuffer)、低中高剂量奥克纤溶酶给药组(62.5μg/眼、75μg/眼、125μg/ 眼)、低中高剂量t-PA给药组(62.5μg/眼、75μg/眼、125μg/眼),单次单眼(左眼)给药,给药体积为50μL/眼/次。
实验过程:按照上述实验分组通过玻璃体腔注射给予相应药物,在给药后 2天(3d),恢复期4周(29d)后进行光学相干断层扫描(OCT)。检测部位为视盘、视网膜血管弓及视网膜后极部。观测周期结束后,随机选择奥克纤溶酶各剂量给药组动物一只,安乐死后,取动物受试眼球样本,将其中半个眼球切成长条状全层组织作扫描电镜。
3、实验结果
参见表2,OCT检测结果显示,单眼给药后,溶媒对照组未见玻璃体后脱离,奥克纤溶酶给药组在低(62.5μg/眼)、中(75μg/眼)、高(125μg/眼)剂量下均能够促进玻璃体后脱离的发生,在给药后2天(3d),奥克纤溶酶低剂量组既有1只食蟹猴出现了完全的玻璃体后脱离,高剂量组则有9只食蟹猴为完全的玻璃体后脱离。相比之下,t-PA给药组无论是低、中、高剂量均未能诱导完全性玻璃体后脱离。进一步的,恢复期四周(29d)后,奥克纤溶酶给药组在低、中、高剂量下均展现出充分诱导玻璃体后脱离的效果,仅低剂量组有一只食蟹猴检测结果未达到完全性玻璃体后脱离的要求,且奥克纤溶酶给药组均未出现明显不良反应,相比之下,t-PA对于玻璃体后脱离的诱导效果逊于奥克纤溶酶,且存在导致眼底出血和黄斑裂孔的不良反应风险,在本次实验条件下,t-PA低、中、高剂量组均有实验动物出现眼底出血和/或黄斑裂孔的情况。图2展示了D29,各给药组代表动物OCT成像结果,其中奥克纤溶酶给药组展现出更为彻底的玻璃体后脱离。图3展示了D3,奥克纤溶酶75μg/眼、125μg/眼剂量给药组扫描电镜图,其结果显示奥克纤溶酶能够有效地降解或松解食蟹猴玻璃体后界膜胶原纤维,其视网膜内界膜表面几乎未见胶原纤维分布。
表2.食蟹猴玻璃体后脱离结果统计表
注:“+++”为未观测到玻璃体后脱离、“++”为不完全性玻璃体后脱离,视网膜内表面与玻璃体皮质仍有明显粘连、“+”为不完全性玻璃体后脱离,视网膜内表面与玻璃体皮质有少量粘连、“-”为完全性视网膜后脱离,呈现光滑的视网膜内界膜。
实施例4重组人奥克纤溶酶促进荷兰兔视网膜静脉栓塞(RVO)模型溶栓实验
1、实验目的
利用荷兰兔RVO模型,体内验证重组人奥克纤溶酶对于视网膜静脉栓塞中的溶栓作用。
2、实验方法
1)光化学法诱导荷兰兔视网膜静脉栓塞(RVO)造模
简要如下:将孟加拉红用生理盐水稀释至7.5g/L,经无菌过滤后,麻醉动物后,在术眼交替点滴1%阿托品和吡卡胺眼药水充分散瞳,固定动物头部,经耳缘静脉按10mg/kg剂量注射孟加拉红。1min后,待孟加拉红循环至静脉,使用550nm波长氙激光照射拟阻塞的静脉主干。血栓形成后1h、3h和1d、3d、 7d和2周、3周、4周进行眼底观察和荧光造影检查,判断造模是否成功。
2)重组人奥克纤溶酶对荷兰兔RVO模型的治疗作用
实验动物与分组:选择50只造模成功荷兰兔,随机分成5个组别,每组 10只,依次为眼用平衡盐缓冲液(BSS buffer)、奥克先纤溶酶给药组(15μg/ 眼、25μg/眼)、t-PA给药组(15μg/眼、25μg/眼),单次单眼给药,给药体积为50μL/眼/次。
实验过程:按照上述实验分组通过玻璃体腔注射给予相应药物,在给药后7天(8d),通过眼底照相及荧光素眼底血管造影观察实验动物视网膜静脉栓塞的治疗效果。
3、实验结果
参见表3,眼底照相以及血管造影结果显示,单眼给药后,溶媒对照组未见血管再通,且眼底观察有明显出血情况,其中4只动物出现了视网膜脱离,造影显示栓塞静脉部分无荧光灌注,周边血管有明显扭曲增粗,通透性增高,严重荧光渗漏。给药组在一定程度上能够改善血管栓塞和荧光渗漏情况,其中 15μg/眼和25μg/眼剂量奥克纤溶酶给药组的血管完全再通率分别为70%和90%,进而显著减少荧光渗漏水平,相比之下,15μg/眼和25μg/眼剂量t-PA给药组的血管完全再通率分别为30%和50%,弱于奥克纤溶酶给药组,其中15μg/眼和 25μg/眼剂量t-PA给药组均有实验动物存在不同程度的血管未通,并在造影观察中显示有血管扭曲,荧光渗漏的情况。
表3.荷兰兔视网膜静脉栓塞再通结果统计表
实施例5重组人奥克纤溶酶对于PCV患者的治疗作用
1、研究目的
开展的一项随机、双盲、平行两组、阳性对照临床试验:比对抗VEGF联合PDT的组合疗法与玻璃体腔注射重组人奥克纤溶酶治疗PCV的有效性。
2、研究设计
患者入选标准:1.签署知情同意书,并愿意按照试验所规定的时间进行随访受试者;2.年龄≥45周岁,性别不限;3..目标眼的BCVA≥24个字母且≤73个字母;4.经ICGA确诊的PCV患者注射吲哚菁绿造影剂后最初6分钟内,目标眼产生源自脉络膜循环的单个或多个局灶高荧光病灶,同时伴或不伴有与之相关联的分支血管网(BVN);5.无影响眼底检查的屈光介质混浊及瞳孔缩小。
研究设计:纳入20例符合入选标准的PCV患者(只选取一只眼作为目标眼),按1;1的比例随机分配到以下两个治疗组别:
组1:雷珠单抗+V
组2:重组人奥克纤溶酶治疗组采用玻璃体腔注射重组人奥克纤溶酶(制剂浓度0.45mg/0.3mL、注射100μL)。
终点指标:两组患者进行相应治疗后,分别在治疗后第14、28、56天进行随访,随访期间进行眼科检查(包括:BCVA、OCT和CFP,ICGA,FFA,lOP)以进行有效性及安全性的评估。主要终点指标为:1.评估第14、28、56天BCVA较基线的变化;2.第14、28、56天CRT较基线的变化;
3、研究结果
如表4所示,虽然所有治疗组的平均BCVA较基线的变化显示均有所改善,但与雷珠单抗联合PDT的组合治疗方案相比,施用奥克纤溶酶能够更显著地改善PCV患者视力水平,其中奥克纤溶酶组治疗14、28、56天的BCVA较基线平均提高5.3、7.2、9.3个字母,而雷珠单抗+PDT组合治疗14、28、56天的BCVA 较基线平均提高4.2、5.7、7.5;其中改善15个或更多个字母的患者人数雷珠单抗+PDT组合治疗组为2位,重组人奥克纤溶酶治疗组为4位;末次访视(治疗后第56天)时,奥克纤溶酶治疗组患者中心视网膜厚度(CRT)减少程度与雷珠单抗+V
以上结果初步证明重组人奥克纤溶酶可减少或消除PCV患者患眼中的息肉样病灶,可预期的有益效果包括异常分支血管网的减少,视力的稳定或改善。
表4重组人奥克纤溶酶对于PCV患者的疗效结果统计表
/>
序列信息:
SEQ ID NO:1:
APSFDCGKPQVEPKKCPGR
SEQ ID NO:2:
VVGGCVAHPHSWPWQVSLRTRFGMHFCGGTLISPEWVLTAAHCLEKSPRPSS YKVILGAH
QEVNLEPHVQEIEVSRLFLEPTRKDIALLKLSSPAVITDKVIPACLPSPNYVVAD RTECF
ITGWGETQGTFGAGLLKEAQLPVIENKVCNRYEFLNGRVQSTELCAGHLAGG TDSCQGDS
GGPLVCFEKDKYILQGVTSWGLGCARPNKPGVYVRVSRFVTWIEGVMRNN
SEQ ID NO:3:
SSSFDKGKYKKGDDASYFEPTGPYLMVNVTGVDSKGNELLSPHYVEFPIKPG TTLTKEKIEYYVEWALDATAYKEFRVVELDPSAKIEVTYYDKNKKKEETKSFPITEKGFVVPDLSEHIKNPGFNLITKVVIEKK
SEQ ID NO:4:
GCCCCATCTTTTGATTGTGGTAAACCACAAGTTGAACCTAAGAAGTGTCCAGGTAGAGTT GTTGGTGGTTGTGTTGCTCATCCTCATTCTTGGCCATGGCAAGTTTCTTTGAGAACTAGATTTGGTATGCATTTTTGTGGTGGTACTTTGATTTCTCCAGAATGGGTTTTGACTGCTGCT CATTGTTTGGAAAAGTCTCCTAGACCATCTTCTTACAAGGTTATTTTGGGTGCTCATCAA GAAGTTAACTTGGAACCACATGTTCAAGAAATTGAAGTTTCTAGGTTGTTTCTGGAACCAACTAGAAAAGATATTGCTTTGTTGAAGTTGTCATCTCCAGCTGTTATTACTGATAAGGTT ATTCCAGCTTGTTTGCCTTCTCCAAACTACGTTGTTGCTGATAGAACTGAATGTTTTATTACTGGTTGGGGTGAAACTCAAGGTACTTTTGGAGCTGGTTTGTTGAAGGAAGTCTAATTG CCTGTTATTGAAAACAAGGTTTGTAACAGATATGAATTTTTGAACGGTAGAGTTCAATCTACTGAATTGTGTGCTGGTCATTTGGCTGGTGGTACTGATTCTTGTCAAGGTGACTCTGGT GGTCCTTTGGTTTGTTTTGAAAAGGATAAGTACATTTTGCAAGGTGTTACTTCCTGGGGTTTGGGTTGTGCTAGACCTAACAAGCCTGGTGTTTACGTTAGAGTTTCCAGATTTGTTACTTGGATTGAAGGTGTTATGAGAAACAAC
SEQ ID NO:5
CGGGGTAGAAAACTAACACCATTTGGTGTTCAACTTGGATTCTTCACAGGTCCATCTCAA CAACCACCAACACAACGAGTAGGAGTAAGAACCGGTACCGTTCAAAGAAACTCTTGATCTAAACCATACGTAAAAACACCACCATGAAACTAAAGAGGTCTTACCCAAAACTGACGACGA GTAACAAACCTTTTCAGAGGATCTGGTAGAAGAATGTTCCAATAAAACCCACGAGTAGTTCTTCAATTGAACCTTGGTGTACAAGTTCTTTAACTTCAAAGATCCAACAAAGACCTTGGT TGATCTTTTCTATAACGAAACAACTTCAACAGTAGAGGTCGACAATAATGACTATTCCAATAAGGTCGAACAAACGGAAGAGGTTTGATGCAACAACGACTATCTTGACTTACAAAATAA TGACCAACCCCACTTTGAGTTCCATGAAAACCTCGACCAAACAACTTCCTTCGAGTTAAC GGACAATAACTTTTGTTCCAAACATTGTCTATACTTAAAAACTTGCCATCTCAAGTTAGATGACTTAACACACGACCAGTAAACCGACCACCATGACTAAGAACAGTTCCACTGAGACCA CCAGGAAACCAAACAAAACTTTTCCTATTCATGTAAAACGTTCCACAATGAAGGACCCCAAACCCAACACGATCTGGATTGTTCGGACCACAAATGCAATCTCAAAGGTCTAAACAATGAACCTAACTTCCACAATACTCTTTGTTG
- 嘧啶并-异喹啉-醌衍生的化合物、它们的盐、异构体、药学上可接受的互变异构体;药物组合物;制备方法;和它们在细菌性疾病和多重抗性的细菌性疾病的治疗中的用途
- 1,2,3-取代中氮茚衍生物在制备治疗病理学脉络膜血管生成相关疾病的药物中的用途
- 重组人血管内皮抑制素在制备治疗眼表新生血管性疾病药物中的应用
