纳米颗粒、其制备和应用、及包括其的眼疾药物及其制备
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物制药领域,特别涉及一种纳米颗粒、其制备方法和应用、以及包括其的用于治疗眼疾的药物及其制备方法。
背景技术
据Frost&Sullivan统计,我国四类主要的视网膜疾病患病人数从2015年的1710万增长至2019年的1850万,预计2030年将达到2200万人。由此可见,开发和改善治疗眼疾的药物迫在眉睫。
其中,糖尿病视网膜病变(Diabetic Retinopathy,DR)、年龄相关性黄斑病(Age-related Macular Degeneration,AMD)变等退行性疾病是目前老年人永久性、不可逆视力下降的主要原因,且发病率近年来持续增长。视网膜和脉络膜中血管畸形增生被认为是导致DR、AMD等疾病发生的主要原因。
滴眼液为一种操作简便,无需高端设备辅助的一种理想的治疗手段。对于眼前段疾病,滴眼液显示出良好的治疗效果。但是,现有的滴眼液存在渗透性差的问题,故对眼后段疾病治疗基本无效。其主要原因可能包括眼睛存在多种生理屏障包括角膜屏障、血-眼屏障(血-房水-屏障和血-视网膜屏障):角膜上皮会阻挡分子量大于500Da的药物透过;视网膜毛细管内皮细胞及其间的紧密连接更容易将亲水性化合物和大分子阻挡在外。因此,将药物通过滴眼液跨越眼部屏障,到达眼底发挥药效仍是需要解决的问题。
随着生物技术的不断发展,眼睛被认为是理想的基因治疗部位:严密的血眼屏障可提供一个相对的免疫豁免环境,阻断循环系统中的免疫细胞转移至眼部,抑制炎症发生;其次,眼睛局部基因治疗降低了全身给药的风险,基因药物因屏障阻碍主要富集在眼部提高了药物的利用率和疗效,为减少给药次数后可长期持续表达抗血管蛋白的药物治疗提供可能性。然而,用于基因治疗的核酸药物在活体中易被降解等特性阻碍了核酸药物在实际中的应用。而且,实现眼部核酸药物有效、且快速的递送治疗依旧是一项挑战。
发明内容
本发明的目的在于解决现有技术的至少一个技术问题。
本发明的实施例一方面涉及一种纳米颗粒,其包括:核糖核酸、以及硫醇,其中,所述核糖核酸包括双链核糖核酸、核糖核酸适配体。
一些实施例中,所述纳米颗粒在水溶液中显负电性。
一些实施例中,所述纳米颗粒在水溶液中的电位在-5mV至-30mV的范围。
一些实施例中,所述纳米颗粒为球形。
一些实施例中,所述纳米颗粒的粒径在50纳米至200纳米的范围。
一些实施例中,所述核糖核酸包括血管上皮生长因子小干扰核糖核酸、血管上皮生长因子核糖核酸适配体。
一些实施例中,所述核糖核酸的碱基序列包括:
正义链(5’-3’):CGAUGAAGCCCUGGAGUGC,反义链(3’-5’):GCACUCCAGGGCUUCAUCG;
正义链(5’-3’):Cy5-CGAUGAAGCCCUGGAGUGC,反义链(3’-5’):GCACUCCAGGGCUUCAUCG;
(5’-3’):CGGAAUCAGUGAAUGCUUAUACAUCCG;
(5’-3’):
(5’-3’):
正义链(5’-3’):GGAGUACCCUGAUGAGAUC,反义链(3’-5’):GAUCUCAUCAGGGUACUCC;
其中,序列里面字体加粗代表碱基修饰2‘F,字体斜体代表碱基修饰2’-Ome。
一些实施例中,所述硫醇的氮与所述核糖核酸的磷的摩尔比值在10-40的范围。
本发明的实施例另一方面涉及一种如本申请所述的纳米颗粒的制备方法,其包括:将核糖核酸与硫醇混合以获取所述纳米颗粒。
一些实施例中,将所述核糖核酸与所述硫醇在经焦碳酸二乙酯(DEPC)处理的无核酸酶水中混合。
一些实施例中,所述硫醇在水溶液中显正电性。
本发明的实施例又一方面涉及一种如本申请所述的纳米颗粒在制备用于治疗眼疾的药物中的应用。
本发明的实施例再一方面涉及一种用于治疗眼疾的药物,其包括如本申请所述的纳米颗粒。
一些实施例中,所述用于治疗眼疾的药物为滴眼液。
一些实施例中,所述用于治疗眼疾的药物适于眼表滴注。
一些实施例中,所述用于治疗眼疾的药物包括人工泪液。
一些实施例中,所述用于治疗眼疾的药物的pH在5.5~8.0的范围,渗透压在287~312mmol/L的范围。
一些实施例中,所述用于治疗眼疾的药物包括氯化钠、碳酸氢钠、氯化钾、氯化钙。
一些实施例中,所述用于治疗眼疾的药物适于治疗细胞增殖,血管增生、渗漏引发的眼底性疾病。
本发明的实施例又一方面涉及一种如本申请所述的用于治疗眼疾的药物的制备方法,其包括以下步骤:制备人工泪液;以及将所述硫醇和所述核糖核酸、以及/或者所述纳米颗粒与所述人工泪液混合以得到所述药物。
一些实施例中,将氯化钠、碳酸氢钠、氯化钾、氯化钙与经焦碳酸二乙酯(DEPC)处理的无核酸酶水混合以制备所述人工泪液。
一些实施例中,所述氯化钙为一水氯化钙粉末。
在技术条件允许的情况下,本申请中各实施例的技术方案可以进行任意组合。
下文将结合附图对本申请进行进一步的描述。图中可能使用相同、类似的简称指代不同实施例中相同、类似的物料,也可能省略不同实施例中相同、类似的物料、步骤、效果等的描述以及与现有技术相同、类似的物料、步骤、效果等的描述。
附图说明
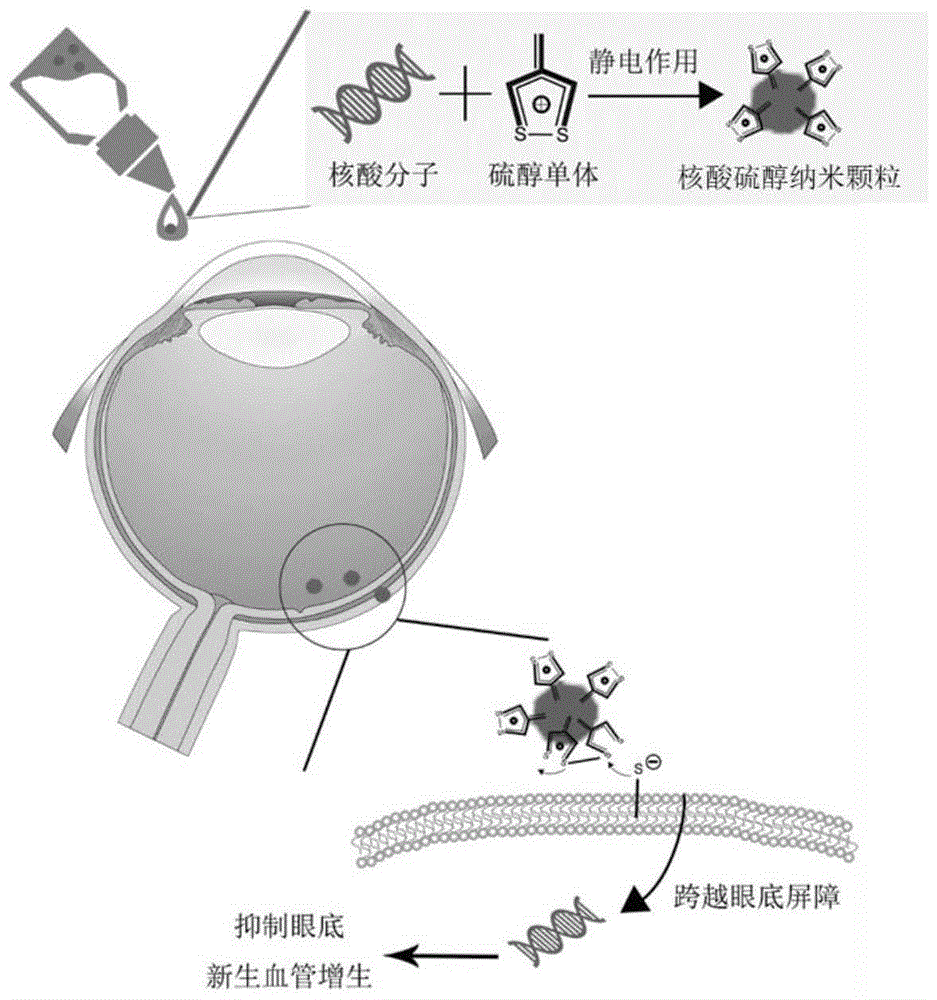
图1为本发明实施例涉及的纳米颗粒、药物的制备、应用示意图。
图2是实验示例1中硫醇的电位数据图。
图3A、3B和3C分别为实验示例2里鼠源VEGF siRNA-硫醇颗粒的电位、粒径的数据分析图和扫描电镜拍摄图。
图4A和4B分别是实验示例3中鼠源VEGF siRNA-硫醇纳米颗粒组装比例优化验证分离示意图与N/P=20、30、40的粒径分布图。
图5为实验示例4里单独的鼠源VEGF siRNA(单独VEGF siRNA)和鼠源VEGF siRNA-硫醇纳米颗粒(VEGF siRNA组装体)分别在50%胎牛血清中孵育0小时,2小时,8小时,24小时,36小时,50小时的时间节点的凝胶电泳成像图,以及对照样品的凝胶电泳成像图。
图6是实验示例6中siRNA组、siRNA-聚乙烯亚胺(PEI)纳米颗粒组、以及siRNA-硫醇纳米颗粒组C57BL6J小鼠的眼睛分别滴入鼠源VEGF siRNA-Cy5滴眼液、鼠源VEGF siRNA-Cy5与PEI组装的纳米颗粒滴眼液、以及鼠源VEGF siRNA-Cy5-硫醇纳米颗粒滴眼液后的激光扫描荧光共聚焦显微镜成像图像。
图7为实验示例7里治疗不同时间时各组小鼠眼底的光学相干断层扫描成像图。
图8A和8B分别为实验示例7中治疗后各组小鼠眼底新生血管面积的免疫荧光共聚焦荧光成像图和数据统计图。
图9是实验示例8里各组小鼠在不同时间的荧光素眼底血管造影术成像图。
图10A、10B和10C分别为实验示例9中VEGF aptamer-硫醇纳米颗粒的电位,粒径大小的数据分析图和扫描电镜拍摄图。
图11是实验示例9里的电泳成像图。
图12为实验示例10中不同组C57BL6J小鼠样品组织的激光扫描荧光共聚焦显微镜成像图像。
图13是实验示例11里治疗不同时间时各组小鼠眼底的光学相干断层扫描成像图。
图14A和14B分别为实验示例11中治疗后各组小鼠眼底新生血管面积的免疫荧光共聚焦荧光成像图和数据统计图。
图15是实验示例12里人源VEGF siRNA-硫醇纳米颗粒的电位数据图。
图16为实验示例13中人源VEGF siRNA-硫醇纳米颗粒抑制A549细胞增殖的抑制率统计图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应该理解,这些实施例仅用于说明本发明,而不用于限定本发明的保护范围。在实际应用中本领域技术人员根据本发明做出的改进和调整,仍属于本发明的保护范围。
本发明的实施例一方面涉及一种纳米颗粒,其包括:核糖核酸、以及硫醇,其中,所述核糖核酸包括双链核糖核酸、核糖核酸适配体。本发明实施例涉及的纳米颗粒在血清中具有较好的稳定性、可以延长包括其的核酸药物被血清降解的时间,可以从眼表有效、快速进入眼底,适于治疗眼疾,可以抑制血管增生、渗漏,可以抑制细胞增殖,可以用于制备滴眼液,可以用于操作简便、无需高端设备辅助的治疗。本发明实施例涉及的纳米颗粒能有效透过眼底屏障,进而干扰血管内皮生长因子(VEGF)的作用,减少新生血管增生,有效治疗眼底血管异常增生相关的疾病。本发明实施例涉及的纳米颗粒能够通过非侵入的滴眼方式将包括其的核酸药物递送进眼底以治疗异常血管增生疾病。
一些实施例中,所述纳米颗粒在水溶液中显负电性。如此,可以助于所述纳米颗粒具有较好的稳定性、不易被降解,有利于所述纳米颗粒在眼部组织内发生渗透。
一些实施例中,所述纳米颗粒在水溶液中的电位在-5mV至-30mV的范围。如此,可以有助于保持所述纳米颗粒在生理条件下的分散性,同时有利于所述纳米颗粒发生眼部组织渗透。
一些实施例中,所述纳米颗粒为球形。如此,可以有利于所述纳米颗粒可以从眼表有效、快速进入眼底,适于治疗眼疾。
一些实施例中,所述纳米颗粒的粒径在50纳米至200纳米的范围。如此,可以助于所述纳米颗粒可以用于制备滴眼液,有利于所述纳米颗粒在眼表组织间发生硫醇交换介导的组织渗透,可以操作简便、无需高端设备辅助地进行眼疾治疗。
所述核糖核酸可以是能够抑制VEGF的信使核糖核酸(mRNA)翻译、或者抑制VEGF功能的核糖核酸。编码VEGF的mRNA在美国国家生物技术信息中心(National Center forBiotechnology Information,NCBI)数据库的编号为XM_002733270.2。
所述双链核糖核酸可以包括双链小干扰核糖核酸。所述核糖核酸适配体可以包括有氟修饰和甲基化修饰的核糖核酸适配体。
一些实施例中,所述核糖核酸包括血管上皮生长因子小干扰核糖核酸、血管上皮生长因子核糖核酸适配体。如此,可以有利于所述纳米颗粒可以抑制血管增生、渗漏,抑制眼底血管异常增生。
眼内新生血管的形成是多种眼部疾病的共同病理特征,如糖尿病视网膜病变(Diabetic Retinopathy,DR)、年龄相关性黄斑病(Age-related Macular Degeneration,AMD)变等退行性眼底疾病。很多眼底疾病的发病机制均与血管内皮生长因子(VEGF)过量表达有关。生理情况分泌的VEGF对维持血管完整性起着重要作用,但是过度表达则会使血管异常增生。因此,本申请实施例所涉及的所述纳米颗粒包括血管上皮生长因子小干扰核糖核酸、血管上皮生长因子核糖核酸适配体可以有助于从源头上消除VEGF,可对新生血管进行“斩草除根”,从而恢复眼部功能。
所述双链核糖核酸可以包括血管上皮生长因子双链小干扰核糖核酸。所述核糖核酸适配体可以包括有氟修饰和甲基化修饰的血管上皮生长因子核糖核酸适配体。
所述核糖核酸的碱基序列示例可以包括,但不限于:
正义链(5’-3’):CGAUGAAGCCCUGGAGUGC,反义链(3’-5’):GCACUCCAGGGCUUCAUCG;
正义链(5’-3’):Cy5-CGAUGAAGCCCUGGAGUGC,反义链(3’-5’):GCACUCCAGGGCUUCAUCG;
(5’-3’):CGGAAUCAGUGAAUGCUUAUACAUCCG;
(5’-3’):
(5’-3’):
以及正义链(5’-3’):GGAGUACCCUGAUGAGAUC,反义链(3’-5’):GAUCUCAUCAGGGUACUCC。
其中,序列里面字体加粗代表碱基修饰2‘F,字体斜体代表碱基修饰2’-Ome。
一些实施例中,所述硫醇的氮与所述核糖核酸的磷的摩尔比值在10-40的范围。如此,可以有列于所述纳米颗粒具有较好的稳定性、不易被降解。
本发明的实施例另一方面涉及一种如本申请所述的纳米颗粒的制备方法,其包括:将核糖核酸与硫醇混合以获取所述纳米颗粒。本发明的实施例所涉及的纳米颗粒的制备方法无需大型仪器,造价成本低廉,工艺简便,利于大规模生产。
本发明的实施例所涉及的纳米颗粒的制备方法可能通过核酸碱基的磷酸基团与硫醇的胍基之间静电作用进行自组装。
核糖核酸与硫醇混合的时候可以借助震荡、超声、涡旋、微流体混合等。核糖核酸与硫醇混合完成后可以超滤、透析、离心等,以去除过量未组装的核酸或者硫醇。
一些实施例中,将所述核糖核酸与所述硫醇在经焦碳酸二乙酯(DEPC)处理的无核酸酶水中混合。如此,可以有利于所述纳米颗粒的制备方法用料种类较少、操作比较简单、成本相对较低,减少所述纳米颗粒所载核酸分子的降解,保持核酸分子结构功能完整性,保证药效。
所述硫醇可以具有结构通式:|A|-R-|M|,其中,A为
举例而言,所述硫醇的分子结构可以为:
其中,
M1为在一定条件下电离后带正电的基团,例如:伯胺基团
具体来说,所述硫醇的结构式示例可以包括,但不限于:
一些实施例中,所述硫醇在水溶液中显正电性。如此,可以有助于所述硫醇与所述核糖核酸顺利组合以得到所述纳米颗粒。
本发明的实施例又一方面涉及一种如本申请所述的纳米颗粒在制备用于治疗眼疾的药物中的应用。如此,可以有利于所制备的用于治疗眼疾的药物从眼表有效、快速进入眼底,抑制血管增生、渗漏,抑制细胞增殖,操作简便、无需高端设备辅助地进行眼疾治疗。
本发明的实施例再一方面涉及一种用于治疗眼疾的药物,其包括如本申请所述的纳米颗粒。本发明的实施例所涉及的所述用于治疗眼疾的药物可以从眼表有效、快速进入眼底,可以抑制血管增生、渗漏,可以抑制细胞增殖。
一些实施例中,所述用于治疗眼疾的药物为滴眼液。如此,可以有助于所述药物可以操作简便、无需高端设备辅助地进行眼疾治疗,可以非侵入式给药、大大减少患者痛苦以及眼内感染等副作用发生的风险。
一些实施例中,所述用于治疗眼疾的药物适于眼表滴注。如此,可以有利于所述药物可以操作简便、无需高端设备辅助地进行眼疾治疗,可以非侵入式给药、大大减少患者痛苦以及眼内感染等副作用发生的风险。
一些实施例中,所述用于治疗眼疾的药物包括人工泪液。如此,可以有助于所述药物在治疗眼疾的同时滋润眼睛。人工泪液可以为对眼睛无毒副作用、生物相容性高、安全、且不影响药物疗效的液体。
一些实施例中,所述用于治疗眼疾的药物的pH在5.5~8.0的范围,渗透压在287~312mmol/L的范围。如此,可以有助于所述药物对眼睛的副作用较小,有利于保持所述药物在溶液中的纳米结构完整性和功能性。
一些实施例中,所述用于治疗眼疾的药物包括氯化钠、碳酸氢钠、氯化钾、氯化钙。如此,可以有利于所述药物对眼睛的副作用较小,有利于保持所述药物在溶液中的纳米结构完整性和功能性。
一些实施例中,所述用于治疗眼疾的药物适于治疗细胞增殖,血管增生、渗漏引发的眼底性疾病。如此,可以有助于满足眼底性疾病治疗的需求。
本发明的实施例又一方面涉及一种如本申请所述的用于治疗眼疾的药物的制备方法,其包括以下步骤:制备人工泪液;以及将所述硫醇和所述核糖核酸、以及/或者所述纳米颗粒与所述人工泪液混合以得到所述药物。如此,可以有助于本申请所述的用于治疗眼疾的药物的制备方法流程比较简洁、用料种类比较精简、成本相对较低、适于大规模生产。
将所述硫醇和所述核糖核酸与所述人工泪液混合的时候,所述硫醇和所述核糖核酸可以在所述人工泪液中形成所述纳米颗粒。
将所述纳米颗粒与所述人工泪液混合的时候,可以待所述硫醇和所述核糖核酸形成所述纳米颗粒之后再与所述人工泪液混合。
若有所需要且条件许可,也可以将所述硫醇和所述核糖核酸、所述纳米颗粒与所述人工泪液混合,即所述药物中的所述纳米颗粒既包括所述硫醇和所述核糖核酸与所述人工泪液混合前形成的、也包括所述硫醇和所述核糖核酸与所述人工泪液混合后形成的。
一些实施例中,将氯化钠、碳酸氢钠、氯化钾、氯化钙与经焦碳酸二乙酯(DEPC)处理的无核酸酶水混合以制备所述人工泪液。如此,可以有利于本申请所述的用于治疗眼疾的药物的制备方法所用物料相对容易取得、成本较低,有利于保持所述药物在溶液中的纳米结构完整性和功能性。
一些实施例中,所述氯化钙为一水氯化钙粉末。如此,可以有助于本申请所述的用于治疗眼疾的药物的制备方法所用物料便于运输、保存。
图1为本发明实施例涉及的纳米颗粒、药物的制备、应用示意图。请参见图1,本申请实施例中,双链核糖核酸、核糖核酸适配体之类的核酸分子碱基的磷酸基团可能与硫醇的胍基之间通过静电作用进行自组装,获得的核酸硫醇纳米颗粒稳定性好,能将核酸分子有效透过眼部屏障到达眼底,例如脉络膜层,通过阻碍血管上皮生长因子(VEGF)对受体激活或者敲低VEGF表达量,实现抑制眼底新生血管增生,治疗新生血管增生有关的病变。
本申请中的实验示例主要用于帮助理解本发明的实施方式,无意构成对权利要求范围的限制。参考后述实验示例可见,本申请实施例中组装有多种不同序列的核糖核酸的纳米颗粒都能够通过非侵入滴眼形式、眼表滴注的给药方式渗透到达眼底,对血管增生、血管渗透、细胞增殖有着较明显的抑制,有着较强的普适性,具有良好的临床转化与应用前景。
实验示例
除非另外特别说明,本申请实验示例所用的物料及其来源如后所述。
核糖核酸(RNA)包括鼠源血管内皮生长因子小干扰核糖核酸(鼠源VEGF siRNA),进行了Cy5荧光标记的鼠源VEGF siRNA(鼠源VEGF siRNA-Cy5),VEGF核酸适配体(VEGFaptamer),进行了Cy5荧光标记的VEGF aptamer(VEGF aptamer-Cy5),以及人源VEGFsiRNA。各核糖核酸的碱基序列表分别列于下表1。
表1.
注:序列里面字体加粗代表碱基修饰2‘F,字体斜体代表碱基修饰2’-Ome。
核糖核酸均由上海生工生物有限公司合成,并通过高效液相色谱(HighPerformance Liquid Chromatography,HPLC)纯化。磷酸盐缓冲液(PBS),4%多聚甲醛,制备十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide GelElectrophoresis,SDS-PAGE)凝胶时使用的过硫酸铵、30%丙烯酰胺、TBE缓冲液,制作组织样品时使用的牛血清白蛋白、蔗糖、封片剂,以及测定细胞增殖使用的CCK8试剂盒均购自上海碧云天科技有限公司。对照实验使用的聚乙烯亚胺(PEI)、制备SDS-PAGE凝胶时使用的四甲基乙二胺(TEMED)、以及核酸凝胶电泳成像时使用的Gel Red核酸染料购自美国Sigma-Aldrich公司。Tris磷酸盐缓冲液(1x TBST)购自美国CST公司。氯化钠、碳酸氢钠、氯化钾和一水氯化钙粉末购自国药集团。测定眼底新生血管面积大小时使用的凝集素GS-IB4染料购自美国Thermo Fisher公司。光学相干断层扫描技术(Optical CoherenceTomography,OCT)凝胶购自美国樱花(SAKURA)公司。硫辛酸、1’1-羰基二咪唑、无水二氯甲烷、乙二胺、无水硫酸钠、1H-吡唑-1-甲脒盐酸盐、乙醚、甲醇均购自西格玛奥德里奇(上海)贸易有限公司。经焦碳酸二乙酯(diethypyrocarbonate,DEPC)处理的无核酸酶水(DEPC水)购自上海生工生物有限公司。人非小细胞肺癌细胞(A549)购自中国医学科学院基础医学研究所细胞资源中心。小鼠为购买自北京维通利华实验动物技术有限公司的6-8周C57BL6J品系。
实验示例1.硫醇制备与表征
称取2.352克硫辛酸和2.436克N,N'-羰基二咪唑(CDI),用70毫升二氯甲烷溶解于圆底烧瓶。随后,将圆底烧瓶置于0℃下的磁力搅拌器上,同时向圆底烧瓶内逐滴加入4毫升无水二氯甲烷和6毫升乙二胺,并搅拌以获取混合物。搅拌结束后,将混合物倒入分液漏斗后回收有机层液体,并用无水硫酸钠除去水份,再减压旋蒸获得油状物。将获得的油状物溶于等摩尔量的1H-吡唑-1-甲脒盐酸盐的二氯甲烷溶液中,减压蒸馏后将获得的沉淀溶于1毫升甲醇,再用10毫升乙醚洗涤沉淀,以获得浅黄色固体状的硫醇,其结构式如下:
测得硫醇在水溶液中的电位,为正电,示于图2。
实验示例2.鼠源VEGF siRNA-硫醇纳米颗粒制备与表征
将239.7mM的用如实验示例1所述方法制备的硫醇与20μM的鼠源VEGF siRNA或者鼠源VEGF siRNA-Cy5在90μL经焦碳酸二乙酯(diethypyrocarbonate,DEPC)处理的无核酸酶水(DEPC水)中混合,室温震荡40min后静置20min,之后20000rpm离心30min去掉多余硫醇,加入90μL DEPC水重悬,得到硫醇的氮与核糖核酸的磷的摩尔比值N/P=20的鼠源VEGFsiRNA-硫醇纳米颗粒溶液或者鼠源VEGF siRNA-Cy5-硫醇纳米颗粒溶液。测量鼠源VEGFsiRNA-硫醇纳米颗粒的电位、粒径的数据分析图和用扫描电镜拍摄鼠源VEGF siRNA-硫醇纳米颗粒得到的图像分别示于图3A、3B和3C。
参见图3A、3B和3C,鼠源VEGF siRNA和硫醇在DEPC水中成功组装为球形鼠源VEGFsiRNA-硫醇纳米颗粒,其在溶液中显负电性(图3A),粒径约为75nm(图3B和图3C)。
实验示例3.鼠源VEGF siRNA-硫醇纳米颗粒组装比例
采用硫醇的氮与核糖核酸的磷的摩尔比值N/P=5、10、15、20、30、40的硫醇和鼠源VEGF siRNA、参照实验示例2的方法分别合成鼠源VEGF siRNA-硫醇纳米颗粒。
利用16%SDS-PAGE凝胶在100V电泳50min以分离不同N/P比的鼠源VEGF siRNA-硫醇纳米颗粒,以验证鼠源VEGF siRNA和硫醇的组装效果。分离结果与单独的VEGF siRNA利用16%SDS-PAGE凝胶在100V电泳50min的图像如图4A所示。可见,当N/P>15时,组装效果比较充分。
分别测量N/P=20、30、40的球形鼠源VEGF siRNA-硫醇纳米颗粒的粒径,数据示于图4B。可见,纳米颗粒的粒径在50纳米至200纳米的范围,而且,当N/P增加时,纳米颗粒的粒径增大。除非另外特别说明,后续实验使用N/P=20的鼠源VEGF siRNA-硫醇纳米颗粒。
实验示例4.鼠源VEGF siRNA-硫醇纳米颗粒在胎牛血清中的稳定性
将单独的鼠源VEGF siRNA(单独VEGF siRNA)和鼠源VEGF siRNA-硫醇纳米颗粒(VEGF siRNA组装体)分别置于50%胎牛血清中,于37℃的温度进行孵育,分别在0小时,2小时,8小时,24小时,36小时,50小时的时间节点,取孵育的样品用16%SDS-PAGE凝胶在100V电泳50min进行条带分离,Gel Red染色30min成像,所得示于图5。
作为对照,0小时无血清孵育的鼠源VEGF siRNA样品(0小时无血清VEGF siRNA)、50小时无血清孵育的鼠源VEGF siRNA样品(50小时无血清VEGF siRNA)、50小时无血清孵育的鼠源VEGF siRNA-硫醇纳米颗粒(50小时组装无血清)分别用16%SDS-PAGE凝胶在100V电泳50min,Gel Red染色30min成像,所得一并示于图5。
请参见图5,随着孵育时间增长,比如第2个小时开始,单独VEGF siRNA明显被降解,而VEGF siRNA组装体在24小时内基本未受影响。
可见,鼠源VEGF siRNA-硫醇纳米颗粒相较于鼠源VEGF siRNA具有更好的稳定性,更加不易被血清中的核酸酶降解。
实验示例5.鼠源VEGF siRNA-硫醇纳米颗粒滴眼液的制备
将氯化钠、碳酸氢钠、氯化钾和一水氯化钙粉末加到DEPC水中充分混匀,以得到人工泪液。人工泪液的pH值为7.4-7.6,其中各组分的浓度分别为:氯化钠116.02mmol/L;碳酸氢钠25.95mmol/L;氯化钾18.51mmol/L;氯化钙0.65mmol/L。
再将7.8mmol/L的硫醇、14μmol/L的鼠源VEGF siRNA在人工泪液(制剂溶剂)中充分混合,以得到滴眼液。
实验示例6.鼠源VEGF siRNA-硫醇纳米颗粒跨越视网膜色素上皮细胞层和外核层
为了验证穿透性,本示例采用参照实验示例5的方式制备的鼠源VEGF siRNA-Cy5-硫醇纳米颗粒滴眼液、鼠源VEGF siRNA-Cy5滴眼液、以及鼠源VEGF siRNA-Cy5与聚乙烯亚胺(PEI)组装的纳米颗粒滴眼液。
将鼠源VEGF siRNA-Cy5滴眼液、鼠源VEGF siRNA-Cy5与聚乙烯亚胺(PEI)组装的纳米颗粒滴眼液和鼠源VEGF siRNA-Cy5-硫醇纳米颗粒滴眼液分别滴入siRNA组、siRNA-PEI纳米颗粒组、以及siRNA-硫醇纳米颗粒组C57BL6J小鼠的眼睛3小时后,处死小鼠并取眼球样品组织,将样品组织在冰上用4%多聚甲醛固定15min,再用30%蔗糖溶液脱水处理。然后,将样品组织包埋于OCT凝胶中用冷冻切片机制成厚度为10μm的切片并用封片剂封片,最后利用激光扫描荧光共聚焦显微镜分别成像siRNA组小鼠、siRNA-PEI纳米颗粒组小鼠和siRNA-硫醇纳米颗粒组小鼠的样品组织中的鼠源VEGF siRNA-Cy5的分布情况,所得图像示于图6。
从图6可以看出,siRNA组没有出现siRNA的Cy5荧光信号,在siRNA-PEI纳米颗粒组和siRNA-硫醇纳米颗粒组的小鼠眼底的视网膜色素上皮细胞层与外核层之间出现强弱不同的siRNA的Cy5荧光信号。
由此可知,单独的鼠源VEGF siRNA-Cy5基本没有跨越眼部屏障的能力,siRNA-PEI纳米颗粒穿透能力有限,而siRNA-硫醇纳米颗粒穿透性强,能有效、快速跨越眼底视网膜色素上皮细胞层、分布在眼球的外核层,有更好的跨越屏障的能力、效率。
实验示例7.鼠源VEGF siRNA-硫醇纳米颗粒用于治疗CNV小鼠模型
用美国Phoenix Research Labs公司的小动物视网膜成像系统构建小鼠CNV模型,2天后开始给药治疗:将单独的鼠源VEGF siRNA-Cy5滴眼液和制备好的鼠源VEGF siRNA-Cy5-硫醇纳米颗粒的滴眼液按照每天0.28nmol/眼的给药量,分3次分别滴入siRNA组和siRNA-硫醇纳米颗粒组6-8周C57BL6J小鼠(CNV小鼠)的眼表,在给药的第3天和第7天利用小动物视网膜成像系统的光学相干断层扫描(Optical Coherence Tomography,OCT)对各组小鼠眼底成像,得到图7,以观察恢复情况。
从图7可以看出,鼠源VEGF siRNA-硫醇纳米颗粒对CNV小鼠有较好的治疗作用,随着鼠源VEGF siRNA-硫醇纳米颗粒的不断治疗,对应组小鼠的眼底持续好转,治疗到第7天时小鼠的眼底基本恢复。但是,单独的鼠源VEGF siRNA无法起到治疗作用,而且其对应组的小鼠眼底细胞断层变得更为严重。
将第7天治疗后的CNV小鼠的眼球取出,在4℃固定24h。将固定完成后的眼球在体视显微镜下进行样品制备:利用角膜剪将角膜和虹膜去除,去除晶状体,再用显微无齿镊将视网膜剥离,留下脉络膜,并用含有5%牛血清白蛋白(BSA)的封闭液(1x TBST)在室温震荡2h,用凝集素GS-IB4(1:200)室温震荡孵育过夜。接着用PBS洗3次,每次10min,最后将样品置于载玻片上,用免疫荧光共聚焦显微镜荧光成像,观察564nm激发下的荧光,所得图像示于图8A,接着测定血管面积大小,采集多点进行面积统计,所得数据统计示于图8B。
如图8A、8B所示,相比于单独的鼠源VEGF siRNA,鼠源VEGF siRNA-硫醇纳米颗粒能够在相同治疗时间内有效抑制CNV小鼠眼底的新生血管增生现象,能减少血管增生,能降低新生血管的大小。
实验示例8.鼠源VEGF siRNA-硫醇纳米颗粒用于抑制小鼠眼底血管渗漏
用美国Phoenix Research Labs公司的小动物视网膜成像系统构建小鼠CNV模型,2天后开始给药治疗:分别将单独的鼠源VEGF siRNA-Cy5滴眼液和鼠源VEGF siRNA-Cy5-硫醇纳米颗粒滴眼液按照每天0.28nmol/眼的给药量,分3次分别滴入单独VEGF siRNA组和VEGF siRNA纳米颗粒组的6-8周C57BL6J小鼠(CNV小鼠)眼表,在治疗第3天和第7天麻醉小鼠并向其腹腔注射荧光素钠溶液,3分钟内利用小动物视网膜成像系统的荧光素眼底血管造影术(fluorescein fundus angiography,FFA)成像,图像示于图9,观察各组小鼠眼底血管渗漏情况。与此同时,1只只建模不治疗的CNV小鼠(CNV对照模型组)与上述治疗的CNV小鼠同步在第3天和第7天取得FFA图像,一并示于图9。
如图9所示,单独构建的CNV小鼠模型在7天内不会自愈。相比于单独的鼠源VEGFsiRNA,鼠源VEGF siRNA-硫醇纳米颗粒能够在相同治疗时间内降低荧光素钠在造模部位的荧光强度,说明鼠源VEGF siRNA-硫醇纳米颗粒有效抑制了CNV小鼠造模部位的血管渗漏,能减轻CNV小鼠的眼底血管渗漏程度。
实验示例9.VEGF核酸适配体(aptamer)-硫醇纳米颗粒或者VEGF aptamer-Cy5-硫醇纳米颗粒制备、表征、优化
将239.7mM的硫醇与20μM的VEGF aptamer、或者VEGF aptamer-Cy5在90μL的DEPC水中混合,室温震荡40min后静置20min,之后20000rpm离心30min去掉多余硫醇,加入90μLDEPC水重悬得到VEGF aptamer-硫醇纳米颗粒溶液、或者VEGF aptamer-Cy5-硫醇纳米颗粒溶液。
测量VEGF aptamer-硫醇纳米颗粒的电位、粒径得到的数据分析图和用扫描电镜拍摄VEGF aptamer-硫醇纳米颗粒的图像分别示于图10A、10B和10C。
参见图10A、10B和10C,VEGF aptamer和硫醇在DEPC水中成功组装为球形VEGFaptamer-硫醇纳米颗粒,其在溶液中显负电性(图10A),粒径约为65nm(图10B和图10C)。
将VEGF aptamer和硫醇按照N/P=5、10、15、20、30、40进行组装,利用16%SDS-PAGE凝胶在100V电泳50min分离,验证不同比例组装效果,所得图像示于图11。单独VEGFaptamer作为纳米颗粒有没有组装成功的对照,同样利用16%SDS-PAGE凝胶在100V电泳50min,所得图像示于图11。
从图11可见,当N/P≥10时,即可成功组装,纳米颗粒会滞留在孔道里而不会通过凝胶跑下来。若非另外特别说明,后续实验选择N/P=20的VEGF aptamer-硫醇纳米颗粒。
实验示例10.VEGF aptamer-硫醇纳米颗粒跨越视网膜色素上皮细胞层和外核层
为了验证穿透性,本示例使用进行了Cy5荧光标记的VEGF aptamer滴眼液和VEGFaptamer-Cy5-硫醇纳米颗粒滴眼液,分别滴入aptamer组与aptamer-硫醇纳米颗粒组的C57BL6J小鼠眼睛3小时后处死各小鼠并取其眼球样品组织,将样品组织在冰上用4%多聚甲醛固定15min,再用30%蔗糖溶液脱水处理。然后,将样品组织包埋于OTC凝胶中,用冷冻切片机制成厚度为10μm的切片,并用封片剂封片,最后利用激光扫描荧光共聚焦显微镜成像样品组织中VEGF aptamer-Cy5荧光的分布情况,所得图像示于图12。
从图12可以看出,aptamer组小鼠的样品组织没有出现VEGF aptamer的Cy5荧光信号,在aptamer-硫醇纳米颗粒组小鼠的样品组织的眼底的视网膜色素上皮细胞层与外核层之间出现aptamer的Cy5荧光信号。
由此可知,单独的VEGF aptamer-Cy5基本没有跨越眼部屏障的能力,aptamer-硫醇纳米颗粒穿透性强,能有效、快速跨越眼底视网膜色素上皮细胞层、分布在眼球的外核层,有较好的跨越屏障的能力、效率。
实验示例11.VEGF aptamer-硫醇纳米颗粒用于治疗CNV小鼠模型
用美国Phoenix Research Labs公司的小动物视网膜成像系统构建小鼠CNV模型,2天后开始给药治疗:将单独的VEGF aptamer-Cy5滴眼液和VEGF aptamer-Cy5-硫醇纳米颗粒滴眼液按照每天0.28nmol/眼的给药量,分3次分别滴入aptamer组与aptamer-硫醇纳米颗粒组的6-8周C57BL6J小鼠(CNV小鼠)眼表,在给药的第3天和第7天利用小动物视网膜成像系统的OCT对各组小鼠眼底成像,所得示于图13,以观察各组小鼠眼底的恢复情况。
从图13可以看出,VEGF aptamer-硫醇纳米颗粒对CNV小鼠有较好的治疗作用,能较好地治愈小鼠眼底激光打透的细胞层,治疗到第7天的时候眼底基本恢复。另一方面,单独的VEGF aptamer无明显治疗效果。
将第7天治疗后的CNV小鼠的眼球取出,在4℃固定24h。将固定完成后的眼球在体式显微镜下进行样品制备:利用角膜剪将角膜和虹膜去除,去除晶状体,再用显微无齿镊将视网膜剥离,留下脉络膜,并用含有5%BSA的封闭液(1x TBST)在室温震荡2h,用凝集素GS-IB4(1:200)室温震荡孵育过夜。接着用PBS洗3次,每次10min,最后将样品置于载玻片上免疫荧光共聚焦荧光成像,得到图14A,以观察564nm激发下的荧光,并测定血管面积大小,采集多点进行面积统计,数据分析示于图14B。
如图14A所示,相较于单独的VEGF aptamer,VEGF aptamer-硫醇纳米颗粒能够在相同治疗时间内降低新生血管生成的大小。
结合图14B可见,VEGF aptamer-硫醇纳米颗粒能降低CNV小鼠的眼底血管增生情况,能有效抑制小鼠眼底的新生血管增生现象。
实验示例12.人源VEGF siRNA-硫醇纳米颗粒制备
将239.7mM的硫醇与20μM的人源VEGF siRNA在90μL的DEPC水中混合,室温震荡40min后静置20min,之后20000rpm离心30min去掉多余硫醇,加入90μL DEPC水重悬得到人源VEGF siRNA-硫醇纳米颗粒溶液。
测量人源VEGF siRNA-硫醇纳米颗粒的电位、得到的数据分析图示于图15。结合参见图15,人源VEGF siRNA和硫醇在DEPC水中成功组装为球形人源VEGF siRNA-硫醇纳米颗粒,颗粒在溶液中显负电性。
实验示例13.人源VEGF siRNA-硫醇纳米颗粒抑制细胞增殖
为了验证人源VEGF siRNA-硫醇纳米颗粒能够抑制细胞VEGF的表达影响细胞增殖、生长,本示例选择表达VEGF的A549细胞作为模型,将人源VEGF siRNA-硫醇纳米颗粒与A549细胞共培养,并用CCK8试剂盒测定抑制率,验证了人源VEGF siRNA-硫醇纳米颗粒具有浓度依赖性的抑制A549细胞增殖的作用。
具体而言:将A549细胞按照4000个/孔接入96孔板培养24小时,去掉原培养基,并将人源VEGF siRNA-硫醇纳米颗粒溶液分梯度稀释至1μM、0.8μM、0.4μM后,加入96孔板中,培养48小时,最后加入CCK8试剂培养2小时,在450nm处测定光密度(optical density,OD)值并统计,所得抑制率数据统计如图16所示。
从图16可见,人源VEGF siRNA-硫醇纳米颗粒能有效抑制细胞生长,而且浓度越高,抑制率越高,0.8μM浓度的人源VEGF siRNA-硫醇纳米颗粒就能有效抑制细胞生长。
上文所描述以及附图所示的各种具体实施方式仅用于说明本发明,并非本发明的全部。在本发明的基本技术思想的范畴内,相关技术领域的普通技术人员针对本发明所进行的任何形式的变更均在本发明的保护范围之内。
序列表
<110>苏州维益生物科技有限公司
<120>纳米颗粒、其制备和应用、及包括其的眼疾药物及其制备
<130>MP22011066
<160>6
<170>SIPOSequenceListing 1.0
<210>1
<211>38
<212>RNA
<213>人工序列(Artificial Sequence)
<400>1
cgaugaagcc cuggagugcg cacuccaggg cuucaucg38
<210>2
<211>40
<212>RNA
<213>人工序列(Artificial Sequence)
<400>2
cycgaugaag cccuggagug cgcacuccag ggcuucaucg40
<210>3
<211>27
<212>RNA
<213>人工序列(Artificial Sequence)
<400>3
cggaaucagu gaaugcuuau acauccg27
<210>4
<211>27
<212>RNA
<213>人工序列(Artificial Sequence)
<400>4
cggaaucagu gaaugcuuau acauccg27
<210>5
<211>29
<212>RNA
<213>人工序列(Artificial Sequence)
<400>5
cycggaauca gugaaugcuu auacauccg29
<210>6
<211>38
<212>RNA
<213>人工序列(Artificial Sequence)
<400>6
ggaguacccu gaugagaucg aucucaucag gguacucc38
- 用于药物流产的胎盘靶向纳米颗粒及其制备方法和应用
- 含碲化合物、利用其制备碲金纳米颗粒的方法及碲金纳米颗粒在制备抗肿瘤药物中的应用
- 含碲化合物、利用其制备碲金纳米颗粒的方法及碲金纳米颗粒在制备抗肿瘤药物中的应用
