一种拉司米地坦中间体的制备方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于药物合成技术领域,具体涉及一种拉司米地坦中间体的制备方法。
背景技术
拉司米地坦(lasmiditan),化学名为2,4,6-三氟-N-[6-[(1-甲基-4-哌啶基)羰基]-2-吡啶基]苯甲酰胺,是Eli Lilly研发的一种口服处方药,临床上用其琥珀酸盐,用于成人伴或不伴先兆症状偏头痛的急性治疗,于2019年10月获得美国FDA批准(商品名
目前拉司米地坦的合成工艺已经在多篇专利如WO2011123654A1、US2019233393A1、CN03807363、US8697876B2、WO2011123654、CN110386918A等中公开。但其思路与原研专利WO03084949大体一致,合成方法为:N-甲基-4-哌啶甲酸盐酸盐与DMF/草酰氯反应或在THF中与氯化亚砜反应得到N-甲基-4-哌啶酰氯盐酸盐,然后滴加二甲胺的THF溶液和三乙胺,经后处理得到N,N'-二甲基-N-甲基哌啶-4-甲酰胺;然后与2,6-二溴吡啶和正丁基锂在-70℃左右反应或在THF中与格氏试剂(i-PrMgCl-LiCl的THF溶液)反应得到2-溴-6-(1-甲基哌啶-4-基酰基)-吡啶粗品,之后经柱层析或与HBr溶液成盐进行纯化;纯化后的2-溴-6-(1-甲基哌啶-4-基酰基)-吡啶在密封的高压釜中,乙二醇作溶剂高温加压与氨气反应20h后得到2-氨基-6-(1-甲基哌啶-4-基酰基)-吡啶粗品,与浓盐酸成盐进行纯化后经碱处理得2-氨基-6-(1-甲基哌啶-4-基酰基)-吡啶;之后氮气保护下,与2,4,6-三氟苯甲酰氯在无水THF或氯苯中反应得到拉司米地坦;最后,在丙酮中与琥珀酸成盐得到琥珀酸拉司米地坦。合成路线如下:
但该方法在制备2-溴-6-(1-甲基哌啶-4-基酰基)-吡啶时,需要用到对水敏感、易燃、反应条件苛刻的正丁基锂,不利于工业化放大生产。
专利CN1642939A(CN100352817C)和文献J.C.S.Perkin,T(24),3597-3600(1997)以2-氯吡啶为起始原料,和N-甲氧基-N-甲基-1-甲基哌啶-4-甲酰胺在正丁基锂和N,N-二甲基氨基乙醇的己烷条件下经超低温金属锂化后得6-氯-2-(1-甲基哌啶-4-)甲酰基吡啶,然后在Pd
此路线为早期药物发现研究时所采用的技术路线,但是该路线中2-氯吡啶至2-氯吡啶衍生物,收率极低(约10%),且后期采用贵重金属及昂贵的试剂(BINAP),很显然该路线不适合工业化放大生产。
此外,原研化合物专利US8748459中描述了一种方法(Goldberg芳酰胺化反应):由2,4,6-三氟苯甲酰胺与2-溴-6-(1-甲基哌啶-4-基酰基)-吡啶在叔丁醇钠存在下,经三(二亚苄基丙酮)二钯(Pd2dba3)、1,1'-联萘-2,2'-双二苯膦(BINAP)催化反应,直接得到目标产物,但收率仅37%。该工艺的条件苛刻(叔丁醇钠),需要用贵金属催化剂及价格昂贵的BINAP,且收率低。合成路线如下所示:
由上可知,2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)吡啶是制备拉司米地坦的重要中间体,因此2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)-吡啶可直接影响该药品的生产、市场供应和质量问题,而目前制备2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)-吡啶的方法存在诸多问题:如(1)采用Weinreb酰胺法合成2-氯-6-(1-甲基哌啶-4-基酰基)-吡啶时,需要应用正丁基锂和2-二甲基氨基乙醇的作用下经超低温金属锂化反应获得,不仅操作繁琐,并且安全性较低,同时收率较低(10%)的问题;(2)采用格式反应合成2-溴-6-(1-甲基哌啶-4-基酰基)-吡啶时,需要用到对水敏感、反应条件苛刻的正丁基锂,不利于工业化放大生产的问题等。
综上,鉴于目前制备拉司米地坦关键中间体2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)吡啶时在工艺安全、操作繁琐,收率不高等方面存在许多不足。因此,研究寻找一条反应条件温和,操作过程简便,产品收率高、纯度高的适合工业化生产2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)-吡啶的反应路线仍是目前需要解决的问题。
发明内容
针对现有拉司米地坦关键中间体2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)吡啶制备方法存在的不足,本发明提供了一种新的2-溴(或氯)-6-(1-甲基哌啶-4-基酰基)吡啶的制备方法。本方法简单、高效,应用本方法所制得的目标产品具有较高的纯度、收率。
本发明具体通过如下技术方案实现:
一种拉司米地坦中间体的制备方法,步骤如下:将SM-2加入反应瓶中,惰性气体保护下、控温t
其中R=CH
优选地,所述金属有机试剂选自异丙基氯化镁氯化锂、二异丙基镁氯化锂、仲丁基氯化镁氯化锂、二仲丁基镁氯化锂中的一种;或以镁和氯化锂联用,其中氯化锂和镁的摩尔比为1:1.1~1.6;进一步优选地,所述金属有机试剂选自二异丙基镁氯化锂、二仲丁基镁氯化锂中的一种。
优选地,所述有机溶剂A选自四氢呋喃、乙醚、1,4-二氧六环中的一种,优选四氢呋喃。
优选地,所述SM-1与SM-2的投料摩尔比为1:1.05~1.60,优选1:1.30。
优选地,所述SM-1与金属有机试剂(镁/氯化锂联用时以氯化锂计)的投料摩尔比为1:1.25~1.55,优选1:1.35。
优选地,所述控温反应温度t
优选地,所述控温反应温度t
优选地,所述控温反应时间T
优选地,所述控温反应时间T
所述惰性气体为氮气或氩气中的一种。
在一优选实施方案中,反应后需进行后处理操作,具体步骤为:反应完毕,降温至0℃,用饱和NH
优选地,所述有机溶剂B包括但不限于乙酸乙酯、二氯甲烷、甲基叔丁基醚。
所述干燥,为本领域常用干燥方法,如无水硫酸钠干燥。
本发明的有益效果:
本发明提供了一种拉司米地坦中间体的制备方法,以SM-1为起始物料,在金属有机试剂作用下与2,6-二卤吡啶反应制得目标化合物I。本发明技术方案反应条件温和,可有效降低杂质的生成,且原料便宜易得,操作简单,仅一步反应即可以高收率制得化合物I,产物无需纯化即具有较高的纯度,大大降低工业成本,适合工业化生产。
附图说明
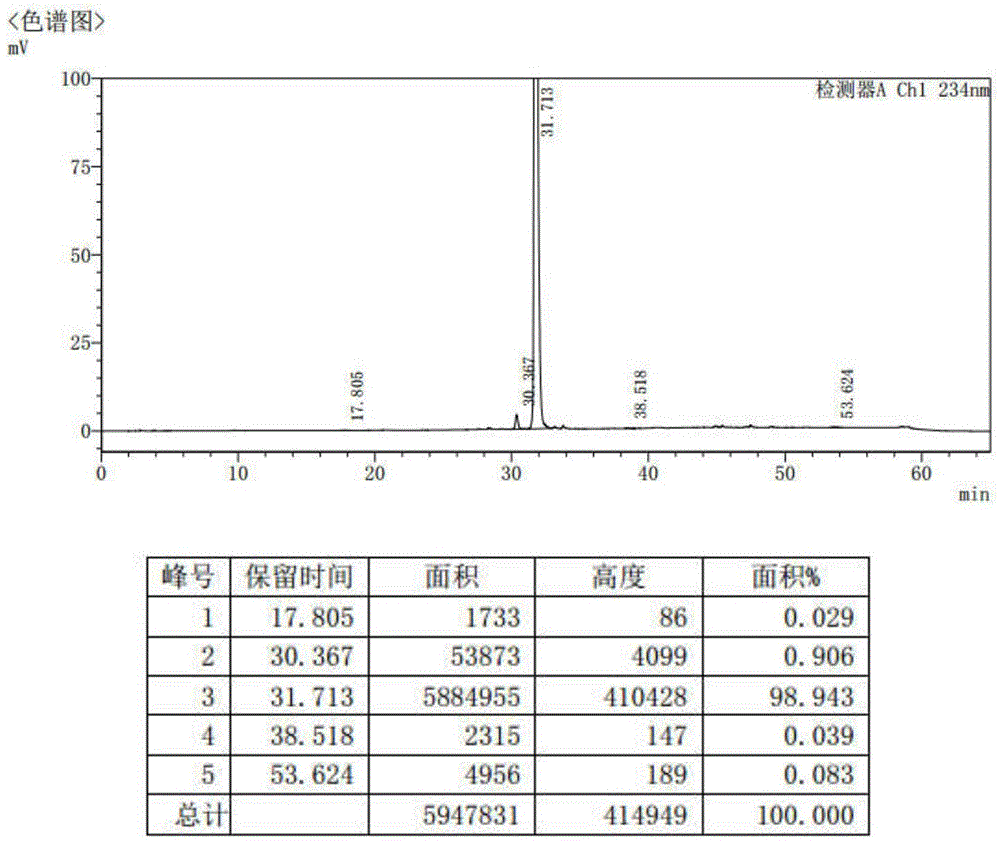
图1实施例1高效液相色谱图
具体实施方式
下面通过实施例来进一步说明本发明,应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属于本发明要求保护的范围。
以下各实施例中,使用的SM-1和SM-2原料以及金属有机试剂可自制或购买,未详细描述的各种过程和方法是本领域中公知的常规方法,所用试剂未标明来源和规格的均为市售分析纯或化学纯。
实施例1
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入二异丙基镁氯化锂(20.6g,0.135mol)的无水THF(120mL)溶液,保温反应9~10h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例2
将2,6-二溴吡啶(37.6g,0.16mol)加入到三口瓶中,氮气保护下、控温0~5℃加入二异丙基镁氯化锂(20.6g,0.135mol)的无水乙醚(120mL)溶液,保温反应8~9h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水乙醚(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例3
将2,6-二溴吡啶(24.6g,0.105mol)加入到三口瓶中,氮气保护下、控温0~5℃加入二异丙基镁氯化锂(20.6g,0.135mol)的无水乙醚(120mL)溶液,保温反应8~9h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水乙醚(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例4
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-10~-5℃加入二仲丁基镁氯化锂(28.0g,0.155mol)的无水1,4-二氧六环(120mL)溶液,保温反应10~11h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水1,4-二氧六环(40mL)溶液,升温至40~45℃,保温搅拌5~6h,降温至0℃,加入饱和NH
实施例5
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-10~-5℃加入二仲丁基镁氯化锂(22.6g,0.125mol)的无水1,4-二氧六环(120mL)溶液,保温反应10~11h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水1,4-二氧六环(40mL)溶液,升温至40~45℃,保温搅拌5~6h,降温至0℃,加入饱和NH
实施例6
将2,6-二溴吡啶(42.3g,0.18mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入异丙基氯化镁氯化锂(1.34mol/L THF溶液,100mL,0.135mol),保温反应9~10h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至20~25℃,保温搅拌7~8h,降温至0℃,加入饱和NH
实施例7
将2,6-二溴吡啶(23.5g,0.1mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入异丙基氯化镁氯化锂(1.34mol/L THF溶液,100mL,0.135mol),保温反应9~10h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至20~25℃,保温搅拌7~8h,降温至0℃,加入饱和NH
实施例8
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温5~10℃加入仲丁基氯化镁氯化锂(1.2mol/L THF溶液,133.3mL,0.16mol),保温反应7~8h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例9
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温5~10℃加入仲丁基氯化镁氯化锂(1.2mol/L THF溶液,100mL,0.12mol),保温反应7~8h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌7~8h,降温至0℃,加入饱和NH
实施例10
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-10~-5℃加入二仲丁基镁氯化锂(24.4g,0.135mol)的无水1,4-二氧六环(120mL)溶液,保温反应10~11h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水1,4-二氧六环(40mL)溶液,升温至40~45℃,保温搅拌5~6h,降温至0℃,加入饱和NH
实施例11
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入异丙基氯化镁氯化锂(1.34mol/L THF溶液,100mL,0.135mol),保温反应9~10h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至20~25℃,保温搅拌7~8h,降温至0℃,加入饱和NH
实施例12
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温5~10℃加入仲丁基氯化镁氯化锂(1.2mol/L THF溶液,112.5mL,0.135mol),保温反应7~8h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例13
将2,6-二氯吡啶(19.2g,0.13mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入二异丙基镁氯化锂(20.6g,0.135mol)的无水THF(120mL)溶液,保温反应9~10h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例14
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入二异丙基镁氯化锂(20.6g,0.135mol)的无水THF(120mL)溶液,保温反应9~10h,加入1-甲基-4-哌啶甲酸甲酯(15.7g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例15
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入镁(3.6g,0.149mol)、氯化锂(5.7g,0.135mol)和无水THF(120mL),保温反应9~10h,加入1-甲基-4-哌啶甲酸甲酯(15.7g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例16
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-5~0℃加入镁(5.3g,0.216mol)、氯化锂(5.7g,0.135mol)和无水THF(120mL),保温反应9~10h,加入1-甲基-4-哌啶甲酸甲酯(15.7g,0.1mol)的无水THF(40mL)溶液,升温至25~30℃,保温搅拌6~7h,降温至0℃,加入饱和NH
实施例17
将2,6-二溴吡啶(30.5g,0.13mol)加入到三口瓶中,氮气保护下、控温-10~-5℃加入二仲丁基镁氯化锂(24.4g,0.135mol)的无水1,4-二氧六环(120mL)溶液,保温反应10~11h,加入1-甲基-4-哌啶甲酸乙酯(17.1g,0.1mol)的无水1,4-二氧六环(40mL)溶液,升温至25~30℃,保温搅拌5~6h,降温至0℃,加入饱和NH
- 一种阿瑞匹坦中间体的制备方法
- 一种高手性纯度内酰胺中间体及布瓦西坦的制备方法
- 一种阿维巴坦中间体制备方法
- 一种他唑巴坦中间体的制备方法
- 一种拉司米地坦中间体的制备方法
- 一种拉司米地坦中间体化合物
