一株高产人源重组胶原蛋白的工程酵母菌株及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于蛋白质工程和基因工程技术领域,具体涉及一株高产人源重组胶原蛋白的工程酵母菌株及其应用。
背景技术
本发明背景技术中公开的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
胶原蛋白是哺乳动物体内含量最丰富的蛋白,占体内蛋白质含量的25%~35%,其广泛分布于人体各个组织器官,如皮肤、骨骼、角膜、血管等,尤其在皮肤等组织中,含有大量的胶原蛋白,胶原蛋白作为一种结缔组织的粘合物质,对维护细胞、组织、器官的正常生理功能具有重要作用。重组人源胶原蛋白以其低毒性、低抗原性、低免疫性、能引导细胞再生和生物相容性较好等优点,而广泛应用于生物医药、化妆品、食品等行业中。
在现有技术中,生产胶原蛋白最主要的方法是利用酸、碱法处理动物来源的组织,为提高胶原蛋白的生物安全性、纯度及活性,拓宽其在化妆品和医疗器械等领域的应用。基因工程技术被广泛应用。国内外一些研究机构及生物公司相继投入研究开发重组人源胶原蛋白,其中毕赤酵母表达系统被广泛应用,但在生产过程中,重组人源胶原蛋白的产量及纯化方法成为主要难点。
增加毕赤酵母中外源基因的拷贝数通常可以获得更高的蛋白表达水平,但基因的过表达往往会引起细胞在合成和分泌途径的负担,导致细胞内可用分子伴侣的不足,进而造成未正确折叠蛋白的不断聚集。蛋白质二硫键异构酶(PDI)可以发挥分子伴侣的特性帮助蛋白质正确折叠,也可以帮助蛋白质形成二硫键,从而缓解重组菌内部压力,提高蛋白表达量。
发明内容
针对现有技术的不足,本发明的目的在于提供一株高产人源重组胶原蛋白的工程酵母菌株及其应用。本发明得到一株共表达伴侣蛋白PDI
为了实现上述技术目的,本发明提供的技术方案如下:
本发明的第一个方面,提供一种编码蛋白质二硫键异构酶的核酸分子,所述核酸分子具有(a1)-(a4)中任一所述核苷酸序列:
(a1)如SEQ ID NO.1所示的核苷酸序列;
(a2)如(a1)所示的核苷酸序列经过一个或多个核苷酸的取代、缺失和/或添加形成的序列;
(a3)与(a1)或(a2)限定的核苷酸序列具有90%或90%以上的同一性,且编码所述蛋白质二硫键异构酶的核酸分子;
(a4)在严格条件下能够与如(a1)-(a3)中任一项所述核苷酸序列杂交并编码相同或相近功能蛋白质二硫键异构酶的核苷酸序列。
本发明的第二个方面,提供一种重组表达载体,所述重组表达载体包含第一方面所述的核酸分子。
本发明的第三个方面,提供一种宿主细胞,所述宿主细胞含有本发明第二方面所述的重组表达载体或染色体整合有本发明第一方面所述的核酸分子;
进一步的,所述宿主细胞还包含编码重组人源胶原蛋白的核酸分子或者含有包含重组人源胶原蛋白的第二重组表达载体或者能够表达重组人源胶原蛋白。
其中,所述重组人源胶原蛋白选自:
(b1)SEQ ID NO.3所示氨基酸序列组成的蛋白质;
(b2)将(b1)所示的氨基酸序列经过一个或多个氨基酸残基的取代、缺失和/或添加且具有相同功能的蛋白质;
(b3)与(b1)或(b2)所示的氨基酸序列组成具有同一性达到90%或90%以上并且具有与(b1)或(b2)所示的蛋白质具有相同功能的蛋白。
所述编码重组人源胶原蛋白的核酸分子具有(c1)-(c4)中任一所述核苷酸序列:
(c1)如SEQ ID NO.4所示的核苷酸序列;
(c2)如(c1)所示的核苷酸序列经过一个或多个核苷酸的取代、缺失和/或添加形成的序列;
(c3)与(c1)或(c2)限定的核苷酸序列具有90%或90%以上的同一性,且编码所述蛋白质二硫键异构酶的核酸分子;
(c4)在严格条件下能够与如(c1)-(c3)中任一项所述核苷酸序列杂交并编码相同或相近功能蛋白质二硫键异构酶的核苷酸序列。
具体的,本发明获得一株毕赤酵母GS115/col
本发明的第四个方面,提供一种生产重组人源胶原蛋白的高密度发酵方法,所述方法包括:发酵培养本发明第三个方面所述的宿主细胞,从而表达出所述重组人源胶原蛋白;和分离纯化所述重组人源胶原蛋白。
本发明的第五个方面,提供一种重组人源胶原蛋白的纯化方法,所述纯化方法包括:采用中空纤维及卷式膜过滤,并结合一步离子层析对所述重组人源胶原蛋白进行纯化。
上述一个或多个技术方案的有益技术效果:
上述技术方案中重组人源胶原蛋白胞外分泌表达载体与经毕赤酵母密码子偏好性优化的蛋白质二硫键异构酶PDI基因胞内表达载体构建到毕赤酵母的不同染色体上,得到共表达伴侣蛋白PDI
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1为本发明优化的蛋白质二硫键异构酶PDI基因与野生型基因的核苷酸序列比对图。
图2为本发明共表达菌株GS115/col
图3为本发明实施例5中共表达菌株GS115/col
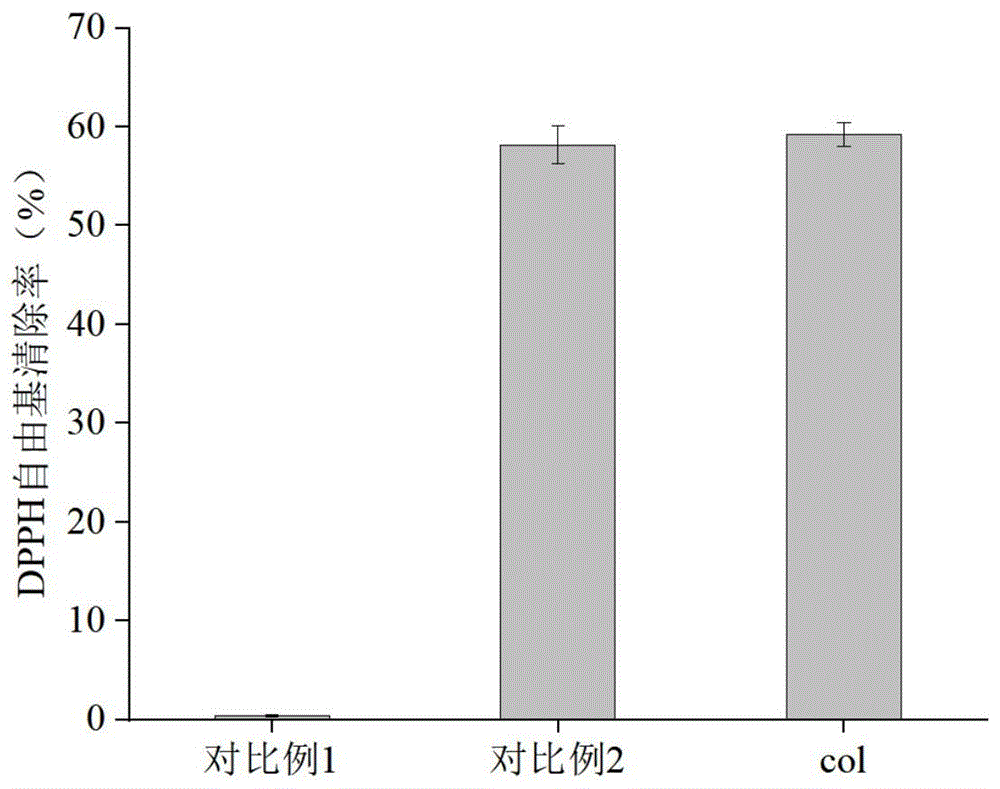
图4为本发明实施例7中样品DPPH自由基清除率的数据图。其中,对比例1代表空白对照组;对比例2代表以专利申请号202310882902.1中的重组胶原蛋白做的对比实验组;col代表使用本发明方法生产的重组人源胶原蛋白实验组。
图5为本发明实施例8中重组人源化Ⅲ型胶原蛋白的促细胞迁移活性结果图;其中,对比例1代表空白对照组;对比例2代表以专利申请号202310882902.1中的重组胶原蛋白做的对比实验组;样品col代表使用本发明方法生产的重组人源胶原蛋白实验组。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
现结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到。
本发明的一个典型具体实施方式中,提供一种编码蛋白质二硫键异构酶的核酸分子,所述核酸分子具有(a1)-(a4)中任一所述核苷酸序列:
(a1)如SEQ ID NO.1所示的核苷酸序列;
(a2)如(a1)所示的核苷酸序列经过一个或多个核苷酸的取代、缺失和/或添加形成的序列;
(a3)与(a1)或(a2)限定的核苷酸序列具有90%或90%以上的同一性,且编码所述蛋白质二硫键异构酶的核酸分子;
(a4)在严格条件下能够与如(a1)-(a3)中任一项所述核苷酸序列杂交并编码相同或相近功能蛋白质二硫键异构酶的核苷酸序列。
本发明的又一具体实施方式中,提供一种重组表达载体,所述重组表达载体包含第一方面所述的核酸分子。
根据本发明,所述重组表达载体通过上述核酸分子有效地连接到表达载体上获得,所述表达载体为病毒载体、质粒、噬菌体、黏粒或人工染色体中的任意一种或多种;病毒载体可包括腺病毒载体、逆转录病毒载体或腺伴随病毒载体,人工染色体包括细菌人工染色体、噬菌体P1衍生的载体、酵母人工染色体或哺乳动物人工染色体。本发明的又一具体实施方式中,所述表达载体为质粒,更具体的,所述表达载体为pPIC9K或pPICZA质粒。
本发明的又一具体实施方式中,提供一种宿主细胞,所述宿主细胞含有上述重组表达载体或染色体整合有上述核酸分子;
本发明的又一具体实施方式中,所述宿主细胞还包含编码重组人源胶原蛋白的核酸分子或者含有包含重组人源胶原蛋白的第二重组表达载体或者能够表达重组人源胶原蛋白。
所述宿主细胞可以为原核细胞或真核细胞。
本发明的又一具体实施方式中,所述宿主细胞是细菌细胞或真菌细胞;
其中所述细菌细胞为埃希氏菌属、农杆菌属、芽孢杆菌属、链霉菌属、假单胞菌属或葡萄球菌属内的任一种;
本发明的又一具体实施方式中,所述细菌细胞为大肠杆菌(如大肠杆菌BL21)、根癌农杆菌(如GV3101)、发根农杆菌、乳酸乳球菌、枯草芽孢杆菌、蜡状芽孢杆菌或荧光假单胞菌。
所述真菌细胞包括酵母菌。
进一步的,所述酵母菌为巴斯德毕赤酵母(如毕赤酵母GS115、KM71或SMD1168)。
其中,所述重组人源胶原蛋白选自:
(b1)SEQ ID NO.3所示氨基酸序列组成的蛋白质;
(b2)将(b1)所示的氨基酸序列经过一个或多个氨基酸残基的取代、缺失和/或添加且具有相同功能的蛋白质;
(b3)与(b1)或(b2)所示的氨基酸序列组成具有同一性达到90%或90%以上并且具有与(b1)或(b2)所示的蛋白质具有相同功能的蛋白。
所述编码重组人源胶原蛋白的核酸分子具有(c1)-(c4)中任一所述核苷酸序列:
(c1)如SEQ ID NO.4所示的核苷酸序列;
(c2)如(c1)所示的核苷酸序列经过一个或多个核苷酸的取代、缺失和/或添加形成的序列;
(c3)与(c1)或(c2)限定的核苷酸序列具有90%或90%以上的同一性,且编码所述蛋白质二硫键异构酶的核酸分子;
(c4)在严格条件下能够与如(c1)-(c3)中任一项所述核苷酸序列杂交并编码相同或相近功能蛋白质二硫键异构酶的核苷酸序列。
需要说明的是,术语“同一性”指与核苷酸/氨基酸序列的序列相似性。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
上述90%以上同一性,可以为91%、93%、95%、97%或99%以上的同一性。
具体的,本发明获得一株毕赤酵母GS115/col
本发明的又一具体实施方式中,提供一种生产重组人源胶原蛋白的高密度发酵方法,所述方法包括:发酵培养本发明第三个方面所述的宿主细胞,从而表达出所述重组人源胶原蛋白;和分离纯化所述重组人源胶原蛋白。
所述发酵培养过程中,所选用的培养基可以为BSM培养基,同时可以以甲醇作为碳源来进行发酵生产。
本发明的又一具体实施方式中,提供一种重组人源胶原蛋白的纯化方法,所述纯化方法包括:采用中空纤维及卷式膜过滤,并结合一步离子层析对所述重组人源胶原蛋白进行纯化。
即可获得上述纯化方法后,可得到纯度大于95%、收率大于70%的重组人源胶原蛋白。
其中,所述重组人源胶原蛋白选自:
(b1)SEQ ID NO.3所示氨基酸序列组成的蛋白质;
(b2)将(b1)所示的氨基酸序列经过一个或多个氨基酸残基的取代、缺失和/或添加且具有相同功能的蛋白质;
(b3)与(b1)或(b2)所示的氨基酸序列组成具有同一性达到90%或90%以上并且具有与(b1)或(b2)所示的蛋白质具有相同功能的蛋白。
需要说明的是,采用上述方法分离纯化获得的重组胶原蛋白,具有良好的抗氧化性和促细胞迁移活性,表明其具有良好的生物学活性,因此同样可广泛应用于食品、药品及化妆品等诸多领域。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中为注明具体条件的试验方法,通常按照常规条件进行。本发明实施例中构建的毕赤酵母GS115/col
实施例1伴侣蛋白PDI表达载体的构建
本发明是在专利申请号202310882902.1的基础上展开的,重组菌P.pastorisGS115/pPIC9K-col
基于NCBI数据库公开的蛋白质二硫键异构酶全长基因序列(Genbank:EU805807.1),根据毕赤酵母密码子偏好性对其进行了密码子优化,图1所示,优化后的基因序列如SEQ ID NO.1所示,与野生型基因序列同源性为76.32%。优化后的基因编码的氨基酸序列如SEQ ID NO.2所示,与野生型基因编码的氨基酸序列一致。密码子优化的蛋白质二硫键异构酶PDI序列委托南京金斯瑞生物科技有限公司全基因合成,并克隆到毕赤酵母胞内表达载体pPICZA上,转化至E.coil TOP10中,在确保阅读框不移码的前提下获得重组表达载体pPICZA-PDI
实施例2构建重组人源胶原蛋白基因高拷贝的重组毕赤酵母表达系统
如专利申请号202310882902.1所示,利用NCBI网站获取天然人III型胶原蛋白α1链蛋白氨基酸序列(序列号NP_000081),依据天然胶原蛋白为不溶性纤维蛋白且氨基酸序列高度重复的特点,拼接成为一段447个氨基酸的全新胶原蛋白序列,其氨基酸序列如SEQID NO.3所示,该序列与人Ⅲ型胶原蛋白序列100%同源;根据毕赤酵母密码子偏好性对人源化Ⅲ型胶原蛋白进行序列优化,优化后的人源化Ⅲ型胶原蛋白核苷酸序列如SEQ IDNO.4所示,包括EcoR I酶切位点、Not I酶切位点、起始密码子、终止密码子及6×His标签序列,克隆到毕赤酵母表达载体pPIC9K的EcoRI和NotI酶切位点之间,得到重组表达载体pPIC9K-col
实施例3伴侣蛋白PDI与重组人源胶原蛋白共表达的工程酵母菌株的构建
将伴侣蛋白PDI表达载体pPICZA-PDI
实施例4重组人源胶原蛋白工程酵母菌株摇瓶发酵
对本发明获得的共表达毕赤酵母菌株P.pastoris GS115/col
发酵步骤如下:挑取单克隆接种于40mL的YPD培养基(酵母提取物10g/L,蛋白胨20g/L,葡萄糖20g/L),30℃、200rpm培养24h。按10%的接种量转接于40mL的初始表达培养基BMGY(酵母提取物10g/L,蛋白胨20g/L,K
重组工程菌发酵上清液进行SDS-PAGE蛋白电泳分析,理论蛋白分子量为51kDa,结果如图2所示,共表达毕赤酵母菌株发酵上清液(泳道4)与组合菌株(泳道3)相比,蛋白含量更高。经BioAnaly生物分析软件得,共表达菌株的蛋白表达量相比组合菌株提高了1.5倍,相比无伴侣蛋白的高拷贝菌株提高了3.5倍。
实施例5共表达菌株5-L发酵罐高密度培养
将共表达毕赤酵母菌株P.pastoris GS115/col
SDS-PAGE检测结果如图3所示,随着诱导时间的延长,发酵上清液中重组人源胶原蛋白产量逐渐增加,经BioAnaly生物分析软件分析,判定标准蛋白及重组人源胶原蛋白的灰度值,计算得甲醇诱导72h时重组人源胶原蛋白产量为15.3g/L。
实施例6重组人源胶原蛋白的纯化制备
共表达毕赤酵母菌株P.pastoris GS115/col
①中空纤维膜:上述发酵上清液经500kDa中空纤维膜过滤,除菌及去除大分子杂质;
②卷式膜:用1kDa的卷式膜进行过滤,除去小分子杂质,收集浓缩液,并对料液进行缓冲液置换,置换成离子A液(20mM Tris,pH 7.4);
③离子交换层析:使用阳离子交换柱进行离子层析,去除带负电的杂质,用20%离子B液(20mM Tris、500mM NaCl,pH 7.4)洗脱,收集洗脱峰;
④卷式膜:用1kDa的卷式膜进行过滤,脱盐,得到纯化原液。
经过上述步骤纯化的蛋白纯度大于95%,收率大于70%。
实施例7重组人源胶原蛋白的抗氧化实验
取适量纯化的重组人源Ⅲ型胶原蛋白置于试管中,加入2.5mL溶于95%乙醇的DPPH自由基溶液(0.1mmoL/L),将混合物激烈振荡10s,然后置于室温下反应30min,反应结束后,于517nm下测量反应混合物吸光度,以蒸馏水代替样品液做空白对照(对比例1),以专利申请号202310882902.1中的重组胶原蛋白做对比实验(对比例2,即本发明实施例2中酵母工程菌株P.pastoris GS115/pPIC9K-col
结果如图4所示,本发明col与空白对照相比具有明显的DPPH自由基清除能力且其自由基清除率与专利申请号202310882902.1中的重组胶原蛋白自由基清除率相当,故本发明提供的提高重组人源胶原蛋白产量的方法不会影响重组胶原蛋白的抗氧化效果。
实施例8重组人源胶原蛋白的促细胞迁移活性实验
细胞迁移活性是有效表征胶原蛋白生物学活性的指标,迁移率越高,速度越快,说明胶原蛋白的生物学活性越佳。
试验前使用马克笔在6孔板底部画一条横线,做好标记。收集生长状态良好的HaCaT人永生化角质形成细胞并用细胞培养基制备细胞悬液,调整细胞浓度为1x10
表1重组胶原蛋白细胞迁移率数据统计表
结果如图5所示,24h拍摄的细胞迁移实际对比图及表1所示的计算出的细胞相对迁移率比较可知,样品col组的细胞迁移率明显高于对照组,并且样品col的细胞迁移率与专利申请号202310882902.1中的重组胶原蛋白细胞迁移率相当,故本发明提供的提高重组人源胶原蛋白产量的方法不会影响重组胶原蛋白的生物活性。
本发明未尽事宜为公知技术。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 重组全长Ⅲ型人源化胶原蛋白酵母工程菌株及构建方法
- 一株高产单萜香叶醇的重组酿酒酵母菌株及其应用
