新型生物标志物
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及出于预后疾病发展的目的并且具体地出于预测癌症患者对免疫疗法的反应和评价癌症患者的存活时间的目的的细胞群体的检测和分析的领域。
背景技术
癌症是全世界主要的死亡原因,并且据估计2017年有约960万人死于癌症。随着由于对其它死因治疗的发展所带来的预期寿命的提高,癌症病例数缓慢增长。因此,持续需要用于评价癌症的新方法以告知患者和护理人员两者患者个体疾病的状态和未来存活前景。
恶性肿瘤的TNM分类系统(Brierly等人,2017)提供了描述癌症和对癌症分期的国际统一标准,其隶属于国际抗癌联盟(UICC)发表。
已提议了以商品名
已表明CD163
WO2016/134416公开了提供患有弥漫性大B-细胞淋巴瘤的受试者对治疗方案起反应的预后的方法,该方法包括:基于受试者中CD137、CD4、CD8、CD56、TNFα(α)和LMO2中的任何一种或多种的水平与受试者中的PD-1、PD-L1、CD163、CD68、PD-L2、LAG3、TIM3和SCYA3(CCL3)中的任何一种或多种的水平之比,确定受试者的免疫得分,将免疫得分与参考得分相比较;其中与参考得分相比的免疫得分指示了受试者对治疗方案起反应的预后。WO2016/134416中公开的特异性免疫得分全部定义了比例,该比例在分子中包括了多种标志物水平,并且所有所指明的免疫得分引入了PD-1或PD-L1。
发明内容
本发明的目的是提供用于评价多种癌症形式的替代和改善的生物标志物,并且具体地提供用于预后诊断患有癌症的受试者的存活时间的方法。
因此,在第一方面,本发明涉及用于预测诊断患有癌症的受试者对免疫疗法的反应或者预后诊断患有癌症的受试者的存活时间的体外方法,包括:
-在受所述癌症影响的组织中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对以下中的至少一种呈阳性的细胞组成的第二细胞类别的第二密度D2:C1q;CD68和CD163的组合;以及CD68和C1q的组合,
-确定D1和D2之间的关系;和
-将所确定的关系与预测所述受试者对免疫疗法的反应或指示所述受试者的存活时间的至少一个预定参考值相比较。
在一个实施方式中,该方法包括
-从该受试者获得癌组织样品;
-在该组织样品中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对以下中的至少一种呈阳性的细胞组成的第二细胞类别的第二密度D2:C1q;CD68和CD163的组合;以及CD68和C1q的组合,
-确定D1和D2之间的关系;
-将所确定的关系与指示所述受试者的存活时间的至少一个预定参考值相比较;和
-基于该比较确定受试者对免疫疗法的反应的预测以及受试者的存活时间的预后。
在一个实施方式中,通过以下确定用于预测受试者对免疫疗法的反应的预定参考值:
-在来自诊断患有所述癌症并且对免疫疗法具有已知反应的受试者群组中每位受试者的癌组织样品中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对以下中的至少一种呈阳性的细胞组成的第二细胞类别的第二密度D2:C1q;CD68和CD163的组合;以及CD68和C1q的组合,
-确定D1和D2之间的关系;
-将所确定的关系与受试者的已知存活时间相比较以获得该关系与存活时间之间的关联;和
-确定参考值以预测诊断患有癌症的受试者对免疫疗法的反应。
在一个实施方式中,通过以下确定用于预后受试者的存活时间的预定参考值:
-在来自诊断患有所述癌症并且具有已知存活时间的受试者群组中每位受试者的癌组织样品中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对以下中的至少一种呈阳性的细胞组成的第二细胞类别的第二密度D2:C1q;CD68和CD163的组合;以及CD68和C1q的组合,
-确定D1和D2之间的关系;
-将所确定的关系与受试者的已知存活时间相比较以获得该关系与存活时间之间的关联;和
-确定参考值以指示诊断患有癌症的受试者的存活时间。
在一个方面,测量受癌症影响的组织样品中的相对细胞密度的方法包括以下步骤:测量组织样品中由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和组织样品中由对以下中的至少一种呈阳性的细胞组成的第二细胞类别的第二密度D2:C1q;CD68和CD163的组合;以及CD68和C1q的组合,以及计算D1和D2之间的关系。
在一些实施方式中,第二细胞类别由对CD68和CD163两者呈阳性的细胞组成。
在一些实施方式中,第二细胞类别由对C1qA、C1qB和C1qC中的至少一种以及任选地CD68呈阳性的细胞组成。
在一些实施方式中,D1和D2之间的关系的确定包括计算比率D1/(D1+D2)或D1/D2或者它们的倒数。
在一些实施方式中,癌症选自结直肠癌、膀胱癌、肺癌、黑色素瘤和胃食管腺癌。
在一些实施方式中,将计算的比例与确定受试者的存活时间的预后的至少一种临床风险因子组合。
在一些实施方式中,至少一种临床风险因子选自由以下组成的组:受试者的性别、微卫星不稳定性状态、肿瘤偏侧性、T期、N期、肿瘤分化。
在一些实施方式中,通过分析基因表达进行细胞密度的测量。
在一些实施方式中,通过以下进行细胞密度的测量:对分析的组织区域中对CD8呈阳性的细胞以及对以下中的至少一种呈阳性的细胞计数:C1q;CD68和CD163的组合;以及CD68和C1q的组合,以及任选地针对分析的组织区域的尺寸进行归一化。
在一些实施方式中,分析的组织区域包括肿瘤中心和侵袭边缘两者。
在一些实施方式中,通过用对待检测的CD8、CD68、CD163、C1q、C1qA、C1qB或C1qC特异的可检测抗体对组织染色来帮助细胞计数。
在一个方面,本发明涉及用于预测诊断患有癌症的受试者对免疫疗法的反应或者预后诊断患有癌症的受试者的存活时间的体外方法,包括:
a)在受该癌症影响的组织中,测量选自由CD8和编码它的RNA分子组成的组中的第一组分子的第一浓度C1和选自由以下组成的组中的第二组分子的第二浓度C2:C1q;CD68和CD163的组合;以及CD68和C1q的组合;以及编码它们的RNA分子;
b)确定C1和C2之间的关系;和
c)将所确定的关系与预测所述受试者对免疫疗法的反应或指示所述受试者的存活时间的至少一个预定参考值相比较。
在一些实施方式中,该方法包括
-从所述受试者获得癌组织样品;
-进行根据权利要求16的方法的步骤a)-c);和
-基于该比较确定受试者对免疫疗法的反应的预测以及受试者的存活时间的预后。
在一些实施方式中,其中该方法用于预测受试者对免疫疗法的反应,通过以下确定预定参考值:
-在受所述癌症影响的组织中,测量选自由CD8和编码它的RNA分子组成的组中的第一组分子的第一浓度C1和选自由以下组成的组中的第二组分子的第二浓度C2:C1q;CD68和CD163的组合;以及CD68和C1q的组合;以及编码它们的RNA分子;
-确定C1和C2之间的关系;和
-将所确定的关系与受试者的已知存活时间相比较以获得该关系与存活时间之间的关联;和
-确定参考值以预测诊断患有癌症的受试者对免疫疗法的反应。
在一个方面,该方法涉及测量受癌症影响的组织样品中相对分子浓度的方法,该方法包括以下步骤:测量组织样品中选自由CD8和编码它的RNA分子组成的组中的第一组分子的第一浓度C1和组织样品中选自由以下组成的组中的第二组分子的第二浓度C2:C1q;CD68和CD163的组合;以及CD68和C1q的组合;以及编码它们的RNA分子;以及计算C1和C2之间的关系。
在一些实施方式中,第二组分子由CD68和CD163或者编码它们的RNA分子组成。
在一些实施方式中,第二组分子由C1qA、C1qB和C1qC中的至少一种以及任选地CD68或者编码它们的RNA分子组成。
在一些实施方式中,C1和C2之间的关系的确定包括计算比率C1/(C1+C2)或C1/C2或它们的倒数。
在一些实施方式中,癌症选自结直肠癌、乳腺癌、胰十二指肠癌、膀胱癌、肺癌、黑色素瘤和胃食管腺癌。
在一些实施方式中,将所确定的关系与确定受试者的存活时间的预后的至少一种临床风险因子组合。
在一些实施方式中,至少一种临床风险因子选自由以下组成的组:受试者的性别、微卫星不稳定性状态、肿瘤偏侧性、T期、N期、肿瘤分化。
在一些实施方式中,通过整体RNA测序进行浓度的测量。
附图说明
图1:免疫细胞亚类的单变量关联的森林图,(作为转化为三个水平的分类值的细胞密度评估),其具有未经疗法治疗过的I-III期结肠癌患者中的OS。实心正方形表示风险比(HR)并且须(whisker)表示95%的置信区间(CI)。将Cox回归用于统计分析。星号表示统计学显著关联(p<0.05)。
图2:未经疗法治疗过的I-III期结肠癌患者(n=286)中的Kaplan-Meier存活曲线。通过分成三类的SIA划分的患者组的整体存活期(A)和无复发存活期(B),其中将SIA-低用作参考组。通过IS划分患者组的整体存活期(C)和无复发存活期(D)。
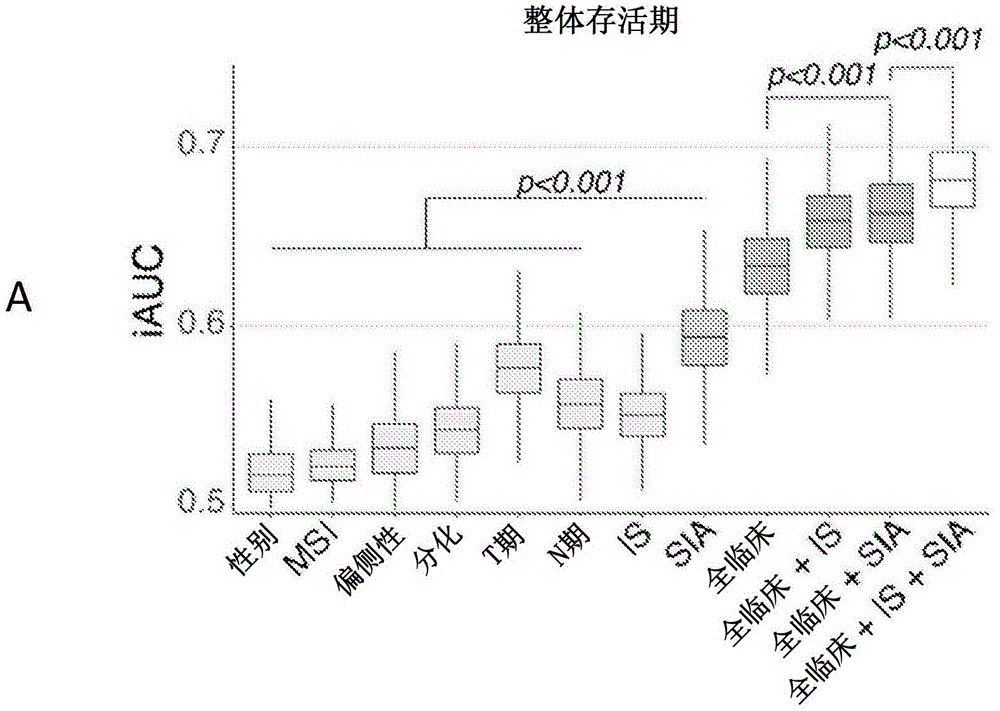
图3:使用积分时间依赖性AUC分析(iAUC),通过1000-倍自举重采样,SIA、IS和临床参数对于OS(A)和RFS(B)的预测准确度。
图4:对于通过分成三类的SIA划分的患有II期结肠癌(A)和转移性结直肠癌(B)的患者,OS的Kaplan-Meier曲线和处于风险的数目。
图5:在6种肿瘤类型(膀胱尿路上皮癌(BUC)、胃食管腺癌(GA)、肺癌(LC)、黑色素瘤、宫体子宫内膜癌(UCEC)和卵巢癌(OC))中,通过SIA划分的整体存活期。根据SIA水平,以百分位点划分BUC、GA和LC群组中的患者。在通过中值分开的两个组中,划分黑色素瘤患者。SIA在膀胱癌、胃食管连接部癌、肺癌和黑色素瘤是预后的。在UCEC(p值=0.996)和OC(p值=0.383)中,通过SIA划分并且通过log-秩分析的整体存活期未显示出统计学显著关联。
图6:在7种肿瘤类型(3个上组)中,通过分成两类的CD8A以及C1q补体亚基:C1QA、C1QB和C1QC中的每一种的整体RNA表达水平之间的比率划分的整体存活期,以及通过分成两类的CD8A和CD3E(IS-样量度)的平均整体RNA表达水平划分整体存活期。从KM plotter数据库实现的基因表达和存活数据。
图7:通过计算来自根据反应分组的患者的26种免疫检查点抑制剂治疗的黑色素瘤中CD8A和C1QA-C表达的计数之间的比率,从整体RNA数据产生的SIA值。
具体实施方式
定义
在本公开中术语“免疫激活特征”或“SIA”在一方面用于表示整个CD8+细胞群体的生物标志物以及在另一方面用于表示表达CD68和CD163两者的巨噬细胞亚型的生物标志物,该生物标志物包括基于癌组织的组织切片中细胞密度之间的关系的计算得分。
“OS”是整体存活期的缩写。
“RFS”是无复发存活期的缩写。
术语结肠癌用于表示结肠的癌症(在TNM分类中分类为解剖学位点C18),而直肠癌用于表示直肠的癌症(在TNM分类中分类为解剖学位点C20)。术语结直肠癌(或CRC)用于表示结肠或直肠的癌症。
术语“胃食管腺癌”表示食管或胃区的腺癌。
C1q或补体组分1q是通过三种亚基所形成的~400kDa的蛋白质复合物,每种亚基包含6条肽链,总计18条肽链。在这18条肽链中,6条为A-链(C1qA),6条为B-链(C1qB)并且6条为C-链(C1qC)。在本公开的背景中,术语“C1q”是指C1qA、C1qB和C1qC中的任一个,以及完整的蛋白质复合物及其亚基以及编码这些的DNA/RNA,如根据背景所提供的。在本公开的背景中,术语“C1qA”、“C1qB”和“C1qC”是指各个肽链以及编码这些的DNA/RNA,如根据背景所提供的。
发明的详细说明
本发明基于以下意外发现建立:肿瘤微环境中两种具体定义的细胞类别的测量以及它们相对密度的计算可以用于预测癌症患者对免疫疗法的反应和癌症患者的存活。细胞类别之间的这种比率可以区分免疫检查点抑制剂疗法的响应细胞(responder),并且还比现有技术评分方法更好地预测结肠癌中的存活,并且与所建立的临床参数相比,对存活预测具有最高相对贡献。该比率在具有高突变负荷的其它癌症如肺、膀胱、食管和黑色素瘤的那些癌症中是预后的。
根据本发明的预测且预后的生物标志物确认了CD8
现代原位分析技术如多标志物免疫组织化学和多光谱成像能够通过标志物的多重标记将免疫细胞亚分类为不同的表型和功能组。为了后天性(adaptive)和先天性免疫细胞可视化,本发明人开发了两个这种小组,每个小组由五种免疫标志物的抗体组成。在如本公开的实验部分中所描述的数字化组织切片的细胞分割后,这些标志物的共表达模式使得能够将免疫细胞亚分类(表1)。
表1:两个小组中的免疫标志物组合定义了免疫细胞的类和亚类。
通过单一标志物表达(CD4、CD8、CD45RO、CD68和CD163)定义了主要免疫细胞谱系。此外,根据标志物共表达,将细胞分成亚类。因此,我们识别了记忆CD4(CD4+CD45RO+)和CD8(CD8+CD45RO+)淋巴细胞、经典调节性T(CD4+FoxP3+)和CD8+Treg(CD8+)细胞。由于自然杀伤(NK)细胞的标志物不太特异,因此我们需要两种标志物(CD56和NKp46)的共表达将细胞分类为NK。类似地,将NK T(NKT)细胞定义为表达NK标志物和CD3两者的那些。最终,将单核细胞/巨噬细胞谱系再分成M1-样巨噬细胞(CD68+CD163-)、M2-样巨噬细胞(CD68+CD163+)和CD68-CD163+细胞。
评估了未用TNM I-III期疗法治疗过的结肠癌(n=286)中不同免疫细胞的密度的预后影响。仅两个免疫细胞类显示出细胞密度与整体存活期(OS)的关联,即CD8-阳性T淋巴细胞(正关联,p=0.042)和M2-样巨噬细胞(负关联,p=0.004)(图1)。有趣地,仅对于整个CD8
基于该意外发现,基于这两种免疫细胞类型的免疫激活特征(SIA)产生并且构成了本发明的一部分的基础。不受理论束缚,假设CD8
此外,确定了C1q组分的表达定义了恶性组织以及正常组织中的M2-样巨噬细胞。还发现CD8与C1q基因表达的高比率在膀胱癌、食道癌和直肠癌以及肺腺癌中对于整体存活期是预后性的,但是在卵巢癌和子宫内膜癌以及肺鳞状细胞癌中不是预后性的,这在很大程度上确认了来自以上定义的基于免疫组织化学的SIA得分的结果。
还发现免疫激活特征可以区分免疫检查点抑制剂疗法的响应细胞。
因此,在第一方面,本发明涉及用于预后诊断患有癌症的受试者的存活时间的体外方法,该方法包括
-在受所述癌症影响的组织中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对CD68和CD163两者呈阳性的细胞组成的第二细胞类别的第二密度D2,
-确定D1和D2之间的关系;和
-将所确定的关系与指示所述受试者的存活时间的至少一个预定参考值相比较。
在一个实施方式中,该方法包括
-从所述受试者获得癌组织样品;
-在所述组织样品中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对CD68和CD163两者呈阳性的细胞组成的第二细胞类别的第二密度D2,
-确定D1和D2之间的关系;
-将所确定的关系与指示所述受试者的存活时间的至少一个预定参考值相比较;和
-基于该比较确定受试者的存活时间的预后。
在一个方面,本发明涉及测量受癌症影响的组织样品中相对细胞密度的方法,该方法包括以下步骤:测量该组织样品中由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和该组织样品中由对CD68和CD163两者呈阳性的细胞组成的第二细胞类别的第二密度D2,以及计算D1和D2之间的关系。
在一个方面,本发明涉及通常如本文所描述的方法,其中不将第二细胞类别定义为对CD68和CD163两者呈阳性的细胞,而是定义为对选自由以下组成的组中的至少两种细胞标志物呈阳性的细胞:CD206、CD200R、CD36、CD204、巨噬细胞活化蛋白(MAF)和CD86,并且第二密度D2是这种细胞类别的密度。在一个实施方式中,将第二细胞类别定义为对至少CD206和CD200R;CD206和CD36;CD206和CD204;CD206和MAF;CD206和CD86;CD200R和CD36、CD200R和CD204;CD200R和MAF;CD200R和CD86;CD36和CD204;CD36和MAF、CD36和CD86;CD204和MAF;CD204和CD86;和/或MAF和CD86呈阳性的细胞。
如本领域中已知的,可以通过手术切除、活组织检查和类似方法获得受癌症影响的组织即癌组织的样品。
在一个实施方式中,通过以下确定预定参考值:
-在来自诊断患有所述癌症并且具有已知存活时间的受试者群组中每位受试者的癌组织样品中,测量由对CD8呈阳性的细胞组成的第一细胞类别的第一密度D1和由对CD68和CD163两者呈阳性的细胞组成的第二细胞类别的第二密度D2,
-确定D1和D2之间的关系;
-将所确定的关系与受试者的已知存活时间相比较以获得该关系与存活时间之间的关联;和
-确定参考值以指示诊断患有癌症的受试者的存活时间。
可以以许多方式计算D1和D2之间的关系,如细胞密度之间的简单比率(即D1/D2或D2/D1)或者以细胞密度中的一个与两个细胞类别的细胞密度之和的关系(例如,D1/(D1+D2)或D2/(D1+D2)或者它们的倒数)。
可以以多种方式确定参考值以将D1和D2之间的关系与预测的受试者的免疫疗法反应相关联。可以通过确定来自诊断患有相关癌症形式的患者参考群组的样品中D1和D2之间的关系来确定参考值,其中对于参考群组中每位患者,实际免疫疗法反应是已知的。这些样品可以获自组织样品的现有集合(例如,“生物库”),或者采集自特异性选择、诊断和/或分类的患者的新的样品集合,其中该样品被评价为对于建立相关参考群组有用。
还可以以多种方式确定参考值以将D1和D2之间的关系与受试者的预期存活时间相关联。可以通过确定来自诊断患有相关癌症形式的患者参考群组的样品中D1和D2之间的关系来确定参考值,其中对于参考群组中每位患者,实际存活时间是已知的。这些样品可以获自组织样品的现有集合(例如,“生物库”),或者采集自特异性选择、诊断和/或分类的患者的新的样品集合,其中该样品被评价为对于建立相关参考群组有用。
在一个实施方式中,通过以下确定参考值:获得参考群组中每个样品的D1和D2之间的关系,并将获得的关系转化为具有设定个数的水平/类别的分类变量,水平/类别如“高”和“低”(两个水平)或者“高”、“中”和“低”(三个水平),其中每个类别中的样品数目基本相等。
还可以通过以下获得参考值:为向参考群组提供样品的每位受试者分配预期存活时间水平(例如,在两个类别的情况下,“>X周”和“≤X周”),将每个所获得的D1和D2之间的关系分配给相关存活时间类别并计算类别之间的统计学相关的截止值。
为了相对于结肠癌中整体存活期(OS)和无复发存活期(RFS)验证根据本发明的生物标志物的预后值,对于结肠癌参考群组中的每个样品,将免疫激活特征(“SIA”)计算为D1/(D1+D2)。
然后,使用无偏方法,以33.3%和66.6%作为截止值,将SIA转化为三个水平的分类变量,即高、中和低。为了比较,我们生成了
有趣地,在对于pT期、pN期、患者年龄、性别和MSI状态调整的多变量Cox模型中,SIA和IS两者对于OS和RFS是显著独立的预测因子(表2)。
表2:在未经疗法治疗过的I-III期结肠癌中SIA和IS的单变量和多变量分析。MSI:微卫星不稳定性;MMR:错配修复;*Wald p值。
此外,比较了SIA与IS和熟知的临床风险因子的预测能力。积分时间依赖性AUC分析(iAUC)将T期识别为OS的最强临床预测因子(中值iAUC 0.58)并且将N期识别为RFS的最强临床预测因子(中值iAUC 0.58)(图3)。
然而,临床风险因子和IS两者均不如SIA(OS和RFS的中值iAUC 0.59)。将SIA添加至具有组合临床参数的模型中进一步改善了预测能力(OS和RFS的中值iAUC为0.66和0.67)。最终,当将临床参数IS和SIA整合到一个模型中时,OS和RFS的iAUC分别为0.68和0.69。SIA对OS预测的相对贡献高于T和N期的那些(表3)。
表3:使用χ
当在模型中包括IS时,SIA和IS的相对贡献超过50%并且明显超过已知的临床因子(表4)。
表4:使用χ
对于II期结肠癌患者(n=117)重复该分析,并且利用划分高和低风险疾病的SIA观察到类似结果(图4A)。另外,评价了患有转移性疾病的CRC患者(n=66)并根据SIA将这些患者划分成三个规模相同的百分位点。再次,在SIA-高组中看到了更长的OS(图4B)。
因此,SIA显示出优于最强已知临床预测因子(T和N期)的独立预后性能,在I-III期结肠癌患者中为多变量预测模型增加了显著值并且在II期结肠癌和在转移性结直肠癌患者中显示出预后能力。
进一步研究了SIA是否还可以在其它肿瘤类型中用作预后因子。由于SIA似乎反映了肿瘤微环境中抗肿瘤和促肿瘤细胞类型之间的平衡,因此它在具有明显免疫原性性质的肿瘤类型中的有用性将可能是最高的。因此,我们分析了获得自TCIA计划(Charoentong等人,2017)的数据,并且根据突变和新抗原数目对不同肿瘤类型归类(rank,排序)。然后,我们分析了以高突变和新抗原计数为特征的四个独立肿瘤群组,即黑色素瘤(n=94)(Stromberg等人,2009)、肺癌(n=251)(Micke等人,2016)、膀胱尿路上皮癌(n=224)(Hemdan等人,2014)和胃食管腺癌(n=121)(Jeremiasen等人,2020)。我们还包括了具有较低突变和新抗原密度的两个肿瘤群组,子宫内膜癌(n=295)(Huvila等人,2018)和卵巢癌(n=141)(Nodin等人,2010)。
根据SIA在第三列划分患者,除了其中41%的患者具有最高可能的SIA值的黑色素瘤外,并且因此作为替代将中值用作截止值。当在Cox回归模型中评估时,在具有高突变和新抗原计数的四种肿瘤类型(p值范围为0.001-0.037)中,高SIA与长存活期显著关联,而在子宫内膜癌和卵巢癌(p值分别为0.996和0.399)中未看到关联(图5和表5-8)。
在表3-6中显示了使用整体存活期作为终点,在单变量Cox比例风险模型中估计的相对风险。
表5:膀胱尿路上皮癌
表6:胃食管腺癌
表7:肺癌
表8:黑色素瘤
在子宫内膜癌和卵巢癌(p值分别为0.996和0.399)中未观察到关联。
此外,根据4个群组中的iAUC分析,对于OS的预测,SIA超过IS,这显示出从膀胱癌中0.55至黑色素瘤中0.61的范围内的中值iAUC(表9)。有趣地,SIA在结肠癌中的时间依赖性区分性质高于最近发表的验证的IS性能(iAUC 0.57(Pagès等人,2018))。
表9:使用积分时间依赖性AUC分析(iAUC)利用1000-倍自举重采样在4个癌症群组中SIA和IS对于OS的预测准确度。
因此,SIA是多种癌症肿瘤类型中的预后因子。
因此,在本发明的一个实施方式中,癌症是突变和/或新抗原的中位数大于100的癌症。突变和新抗原的中位数可以获得自癌症免疫组图谱(Cancer Immunome Atlas)(TCIA)计划(
分析了来自9个结直肠肿瘤的单细胞RNA测序数据(Lee等人,2020)。识别了通过CD68和CD163基因表达定义的三种亚类的6520个巨噬细胞,包括17%的M1-样巨噬细胞,79%的M2-样巨噬细胞和4%的CD68-CD163+细胞。这些巨噬细胞中差异表达的基因的分析表明M2-样亚组的细胞过表达C1QA、C1QB和C1QC,以及编码C1q,C1补体复合物的亚组分。这还在另外两个数据集中观察到,其中C1QA-C处于肺癌(n=13286个细胞)(Lambrechts等人,2018)和葡萄膜黑色素瘤(n=25413个细胞)(Durante等人,2020)中M2-样巨噬细胞中顶部上调基因中。在CRC和肺癌中,还观察到受限于M2-样巨噬细胞的编码载脂蛋白E的APOE的高表达。然而,葡萄膜黑色素瘤中的情况并非如此,其中APOE也在M1-样巨噬细胞中高表达。通过来自癌症组织的三种单细胞集合的完整数据集的分析(CRC中的54259个细胞、肺癌中的32439个细胞和葡萄膜黑色素瘤中的97550个细胞),观察到C1QA、C1QB和C1QC几乎仅在巨噬细胞中表达,而APOE还在其它细胞类型中表达,这与先前的发现一致。
进一步研究了巨噬细胞的转录谱是否在肿瘤、相邻组织和在非患病器官中存在差异。首先,比较了来自CRC和肺癌中的肿瘤和瘤周组织的巨噬细胞并且发现在来自两个位置的巨噬细胞中C1QA-C和APOE的表达水平相同。然后,研究了来自相同个体的15个不同非恶性器官的scRNAseq数据(He等人,2020),以确定C1QA-C和APOE生产细胞是否也存在于正常器官中。仅一小部分细胞表达C1QA-C(所有器官间的平均值为4%,其范围从淋巴结中的0.12至肝脏中的17-19%),然而更大的部分表达APOE(平均值17%,从血液中的0%至皮肤中的64%)。大部分表达C1QA-C的细胞是巨噬细胞(通过CD68和/或CD163阳性定义),其范围从淋巴结中45-56%的阳性细胞到肝脏中的91-93%。
当分析巨噬细胞亚类时,C1QA-C表达是M2-样巨噬细胞的特征,但是在M1-样细胞中极低,而巨噬细胞中的APOE表达较低且缺少与分化的关联。总体上,C1q组分的表达定义了恶性以及正常组织中的M2-样巨噬细胞。
由于在M2-样巨噬细胞中主要检测到癌症中的C1QA-C表达,因此在本发明的一个实施方式中,将在整体RNA水平上分析的补体C1q组分的合成用于定义根据本发明的第二细胞类别。从KM plotter数据库(Nagy等人,2021)提取整体RNA表达数据,将CD8A与C1QA、C1QB或C1QC的表达水平之间的比率分成两类,并对膀胱癌、食道癌、直肠癌、子宫内膜癌和卵巢癌、肺腺癌和肺鳞状细胞癌进行存活期分析。除肺鳞状细胞癌和卵巢癌外,在所有分析的肿瘤类型中,高比率与改善的存活期相关联(图6),这在很大程度上确认了来自基于免疫组织化学的SIA得分的结果(参见图5)。重要地,除子宫内膜癌外,从整体RNA数据集产生的Immunoscore-样量度具有较差的表现(图6)。因此,在整体肿瘤基因表达数据中CD8A与C1QA、C1QB或C1QC之间的比率在至少五种肿瘤类型中是预后的。
最后,研究了SIA是否可以区分免疫检查点抑制剂疗法的响应细胞。分析了来自用抗-PD-1疗法治疗的患者中黑色素瘤的整体RNA(Hugo等人,2016)。然后,计算CD8A与C1QA、C1QB或C1QC基因表达之间的比率。有趣地,与部分响应细胞(n=10)和非响应细胞(n=12)相比,响应细胞(n=4)具有更高的SIA值(图7A)。
为了能够更准确地进行特征估计,还分析了来自用抗-PD1和/或抗-CTLA4治疗的黑色素瘤患者(n=48)的单细胞测序数据(Sade Feldman等人,2018),并使用CD8A的单细胞基因表达水平定义CD8+细胞,和使用CD68以及CD163、C1QA、C1QB或C1QC中任一个的表达的组合定义M2-样巨噬细胞来计算SIA。利用分别来源于CD8A和CD68+CD163(p=0.001)、CD68+C1QA(p=0.026)、CD68+C1QB(p=0.017)或者CD68+C1QC(p=0.012)的SIA,观察到高SIA得分和对免疫检查点抑制剂疗法的反应之间的明确关联(图7B)。
为了验证SIA对预测治疗反应的准确度,进行了ROC分析,其产生了从0.70(对于来源于CD8A和CD68+C1QA的SIA)至0.79(对于来源于CD8A和CD68+CD163的SIA)的范围内的曲线下面积(AUC)。分析了来自肾细胞癌的单细胞RNA测序数据(Bi等人,2021),其中四位患者接受免疫检查点疗法并且具有客观反应记录。与具有肿瘤进展的一位患者相比,两位具有部分反应的患者具有更高的SIA,其来源于考虑通过M2-样巨噬细胞的补体共表达的细胞计数(图7C)。总体上,这些观察支持SIA可以预测黑色素瘤及其它肿瘤类型中对使用免疫检查点抑制剂的治疗的反应。
在一个实施方式中,癌症选自结肠癌、结直肠癌、膀胱癌、肺癌、黑色素瘤和胃食管腺癌。
在一个实施方式中,将所确定的关系与确定受试者的存活时间的预后的至少一种临床风险因子组合。
在一个实施方式中,至少一种临床风险因子选自由以下组成的组:受试者的性别、微卫星不稳定性状态、肿瘤偏侧性、T期、N期、肿瘤分化。
在根据上述方面的本发明的实施方式中,通过对所分析的组织区域中对CD8呈阳性的细胞以及对CD68和CD163两者呈阳性的细胞计数,以及任选地针对所分析的组织区域的尺寸进行归一化来进行细胞密度的测量。
在根据上述方面的本发明的实施方式中,所分析的组织区域包括肿瘤中心和侵袭边缘两者。
在根据上述方面的本发明的实施方式中,通过用对适用的细胞标志物(例如,CD8、CD68和CD163)特异的可检测抗体对组织免疫荧光染色来帮助细胞计数。通常可以通过以下来进行细胞计数:使能够特异性亲和结合至适用的细胞标志物的可检测化合物(通常被称为“亲和结合剂”)结合至感兴趣组织的组织切片中的细胞,检测所结合的可检测化合物的量,以及将所检测的量与组织切片的尺寸相关联或者将所检测的每个细胞标志物的量与所有细胞标志物或细胞标志物亚群的总量相关联。亲和结合剂包括抗体(单克隆和多克隆)和抗体片段,该抗体片段至少包括重和轻免疫球蛋白链两者保持在一起(通常通过二硫键)的可变区,以保留抗体结合位点。抗体片段的类型包括Fab、Fab'、F(ab')2、Fv、rIgG、单链可变片段(scFv)、scFv二聚体(双链抗体(diabody,双体抗体))、scFv融合蛋白(例如,scFv-Fc)、亲和体(affibody)等。还可以利用其它类型的亲和结合剂,如分子印记聚合物。可检测化合物在本领域中也是已知的,并且包括例如荧光部分、金属(例如,金纳米颗粒)和可以用于结合其它可检测化合物的部分,例如,链酶亲和素或生物素。
在一个方面,本发明涉及包含一组试剂的成套部件(kit of part),这些试剂适合于帮助对CD8呈阳性的细胞以及对CD68和CD163两者呈阳性的细胞、或者定义如本文所公开的感兴趣细胞类别的其它适用标志物的计数。这些试剂可以选自表12中所列的试剂和在检测表达感兴趣细胞标志物的细胞中具有等同功能的试剂。
包括以下实施例以进一步说明和帮助理解本发明。不应将它们视为对本发明范围的限制,本发明的范围是所附权利要求的范围。本文引用的所有参考文献以其全部内容作为参考明确并入。
实施例
材料和方法
研究群组和组织微阵列
结直肠癌(CRC)群组由在瑞典乌普萨拉省生活的预先募集的CRC患者组成,他们中的大部分包括在Uppsala-
所有患者接受根据2008年瑞典国家指南的阶段划分的标准护理。根据该指南,如果存在复发风险因子,则建议结肠肿瘤进行初次手术和辅助化疗。如果认为结肠肿瘤是无法根除的/边界可切除的,则在手术之前施用新辅助化疗以使肿瘤缩小。直肠癌接受根据局部或全身性复发风险划分的术前或新辅助放疗/放化疗。将原发性肿瘤和远处转移物的福尔马林固定石蜡包埋组织块用于构建TMA。在核心来源于肿瘤中心部分和来源于侵袭边缘的TMA上显示了每种情况。在来自瑞典乌普萨拉地区伦理委员会的伦理许可内进行研究。
表10
/>
/>
表10:结直肠癌群组中的基线临床病理学特征。在具有从两个多重小组(左列TIL小组和中间列NK/MF小组)中的每一个可获得的成功染色的亚组中以及在其中两个小组均可获得的亚组(右列SIA小组)中显示了患者数据。除非另外指明,否则将值显示为病例数(百分比)。由于凑整,百分比相加可能不为100%。(MSI-微卫星不稳定性;MMR-错配修复;RT-放疗;scRT-短期放疗;lcRT-长期放疗;CT-化疗;CRT-放化疗)
黑色素瘤群组涵盖了来自瑞典乌普萨拉地区从1980至2004年诊断患有原发性皮肤恶性黑色素瘤的94位患者的TMA核心(Stromberg等人,2009)。瑞典乌普萨拉省乌普萨拉大学的研究伦理委员会批准了本研究。
肺癌群组涵盖了来自从2006至2010年在瑞典乌普萨拉大学医院经历手术治疗的诊断患有非小细胞肺癌的251位患者的TMA核心(Micke等人,2016)。在来自乌普萨拉地区伦理委员会的许可下进行本研究。
胃食管癌群组包括来自从2006至2010年在隆德和马尔摩
尿路上皮癌群组涵盖了从1984至2005年在乌普萨拉大学医院经历手术的224位患者的原发性尿路上皮肿瘤收集的TMA核心(Hemdan等人,2014)。在来自乌普萨拉地区伦理委员会的许可下进行本研究。
宫体子宫内膜癌群组由来自2004-2007年间在芬兰土尔库(Turku)大学医院通过手术治疗的患者的295例子宫癌的TMA核心组成(Huvila等人,2018)。在来自赫尔辛基伦理审查委员会的许可下进行本研究。
作为来自来源于两个混合的先前基于群体的群组:马尔默膳食和癌症研究(
表11提供了黑色素瘤、肺癌、胃食管癌、尿路上皮癌、UCEC和卵巢癌群组中所包括的患者以及他们的肿瘤的临床病理学特征。
表11
/>
/>
/>
/>
表11:验证群组的基线临床病理学特征。在其中SIA数据可获得的组中显示患者数据。除非另外指明,否则将值显示为病例数(百分比)。由于凑整,百分比相加可能不为100%。
a
b
多重免疫荧光染色
对于多重免疫荧光染色,将4μm厚的TMA切片脱蜡,再水化并在蒸馏H
/>
*在微波炉中在100℃进行15min抗原修复。
使用扩增系统/>
#
表12:用于多重荧光IHC的抗体以及稀释和扩增试剂的列表。
使用相应方法和对这些细胞标志物特异的试剂,作为CD68+、CD163+群体的替代,研究了细胞标志物CD206、CD200R、CD36、CD204、巨噬细胞激活蛋白(MAF)和CD86对于将细胞群体分类为M2-样巨噬细胞群体的相关性。
成像、图像分析和阈值化(thresholding)
以多光谱模式在2像素/μm的分辨率下使用Vectra Polaris系统(Akoya)对染色的TMA成像。由病理学家手动检查并挑选每张图像以排除伪影、染色缺陷以及免疫细胞在坏死区和腺内结构中的积累。训练在inForm软件中执行的厂家提供的机器学习算法以将组织分成三个类别:肿瘤隔室、基质隔室或空白区。通过提供由病理学家手动注释的一组样品,对每个群组分开进行训练。如所描述的使用DAPI核染色进行细胞分割(Mezheyeuski等人,2018)。将距核边界3μm(6像素)的核周区域认为是细胞质区。将inForm软件的细胞分型功能用于手动定义对每种标志物的表达呈阳性的细胞的代表性亚组和对所有标志物呈阴性的细胞亚组。将标志物在所选细胞中的表达强度用于设置标志物阳性阈值。
通过GeneVia技术(Tampere,Finland),在R编程环境[R Core Team,2013]中确定标志物的强度阈值。通过对该标志物的阳性和阴性细胞强度的分布定义标志物特异性阈值。通过使用R package stats的密度函数,利用具有自动带宽检测的高斯核估计使强度值平滑来估计标志物特异性概率密度分布。将每个标志物的强度阈值设立为(1)如果阳性和阴性细胞的强度不重叠,阴性细胞的最高强度和阳性细胞的最低强度的平均值,或者(2)如果存在重叠,使基于概率密度分布的整体分类错误最小化的强度值。对每个所设立的阈值,即对于每个标志物,计算假阳性率、真阳性率、假阴性率、真阴性率和整体分类错误,并单独控制。对于每种肿瘤类型,分开并独立设立阈值,并将该阈值应用于完整群组的原始输出数据。因此,对于小组中的每个标志物,将每个细胞表征为阳性或阴性。该数据用于分类细胞和定义其免疫亚型(表1)。最后,针对所分析的组织区域大小将细胞计数归一化并在进一步分析中将该细胞计数作为细胞密度(单位/mm
免疫激活特征和
作为CD8+细胞密度与CD8+和M2-样细胞密度之和的比率或者SIA=(CD8密度)/(CD8密度+M2-样密度)计算免疫激活特征(SIA)。如所描述的生成了
突变和新抗原
19种实体癌间的突变和新抗原的数目的中值获得自癌症免疫组图谱(CancerImmunome Atlas)(TCIA)计划(
统计学
使用R(3.5.1版)和SPSS V20(SPSS Inc.,Chicago,IL)进行统计分析。在进行根治性手术的CRC I-III期患者中,将无复发存活期(RFS)计算为从手术到第一次记录到疾病进展(包括局部复发或远处转移或者由于任何原因死亡,以先发生为准)的时间。整体存活期(OS)是从手术至由于任何原因死亡的时间。为了估计单变量和多变量模型两者中的相对风险,使用Cox比例风险模型。通过1000-倍自举重采样并且通过计算每个自举采样的接收者操作特征曲线下的时间依赖性面积(iAUC)评估了模型的预测准确度。使用卡方比例(χ
参考文献
Bi et al.(2021).Tumor and immune reprogramming during immunotherapyin advanced renal cell carciRoma.Cancer Cell,39,649-661.
Brierly et al.(Ed.).(2017).TNM Classification of Malignant Tumours(8ed.).Wiley-Blackwell.Retrieved from ISBN:978-1-119-26357-9
Charoentong et al.(2017).Pan-cancer lmmunogenomic Analyses RevealGenotype-lmmunophenotype Relationships and Predictors of Response toCheckpoint Blockade.Cell Rep,18,248-262.
Durante et al.(2020).single-cell analysis reveals new evolutionarycomplexity in uveal melanoma.Nat.Commun.,11,496.
Galon et al.(2006,September 29).Type,density,and location of immunecells within human colorectal tumors predict clinical outcome.Science,29(313),1960-1964.
Gomez-Brouchet et al.(2017).CD163-positive tumor-associatedmacrophages and CD8-positive cytotoxic lymphocytes are powerful diagnosticmarkers for the therapeutic stratification of osteosarcoma patients:Animmunohistochemical analysis of the biopsies from the French OS2006 phase3.Oncoimmunology,6(9),e13311931-12.
He et al.(2020).Single-celltranscriptome profiling of an adult humancell atlas of 15major organs.6enome Biol,21,294.
Hemdan et al.(2014).The prognostic value and therapeutic target ro1eof stathmin-1in urinary bladder cancer.Br J Cancer,111,1180-1187.
Hugo et al.(2016).Genomic and Transcriptomic Features of Response toAnti-PD-1 Therapy in Metastatic MelaRoma.Cell,165,35-44.
Huvila et al.(2018).Combined ASRGL1 and p53 immunohistochemistry asan independent predictor of survival in eRdometrioid endometrialcarcinoma.Gynecol Oncol,149,173-180.
Jeremiasen et al.(2020).Tumor-Associated CD68(+),CD163(+),and MARCO(+)Macrophages as Prognostic Biomarkers in Patients With Treatment-NaiveGastroesophageal Adenocarcinoma.Front Oncol,10,534761.
Lambrechts et al.(2018).Phenotype molding of stromal cells in thelung tumor microenvironment.Not.Med.,24,1277-1289.
Lee et al.(2020).Lineage-dependent gene expression programs influencethe immune landscape of colorectal cancer.Nat.Genet.,52,594-603.
Mezheysuski et al.(2018).Multispectral imaging for quantitative andcompartment-spec.fic immune infiltrates reveals distinct immune profiles thatclassify lung cancer patients.The Journal of pathology,244,421-431.
Micke et al.(2016).The Impact of the Fourth Edition of the WHOClassification of Lung Tumours on Histological Classification of ResectedPulmonary NSCCs.J Thorac Oncol,11,862-872.
Nagy et al.(2021).Pancancer survival analysis of cancer hallmarkgenes.Sci.Rep.,11,6047.
Nodin et a1.(2010).lncreased androgen receptor expression in serouscarcinoma of the ovary is associated with an improved survival.J Ovarian Res,3(1),14.
Pagès et al.(2018,May 26).International validation of the consensuslmmunoscore for the classification of colon cancer:a prognostic and accuracystudy.Lancet,391(10135),2128-2139.
Sade Feldman et al.(2018).Defining T Cell States AssoCiated withResponse to Checkpoint lmmunotherapy in Melanoma.Cell,175(e1020),998-1013.
Stromberg et al.(2009).Selective expression of Syntaxin-7 protein inbenign melanocytes and malignant melanoma.J Proteome Res,8,1639-1646.
- 生物标志物检测方法、疾病判断方法、生物标志物检测装置和生物标志物检测程序
- 提取胰腺癌诊断生物标志物的方法、用于该方法的计算装置、胰腺癌诊断生物标志物以及包含该生物标志物的胰腺癌诊断装置
