一种含酯链PD-1/PD-L1小分子抑制剂及其制备方法和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于小分子化合物技术领域,涉及一种含酯链PD-1/PD-L1小分子抑制剂及其制备方法和应用。
背景技术
肿瘤免疫治疗是指以杀伤癌细胞为目的,激活人体的免疫系统,其独特的治疗手段在肿瘤治疗领域受到广泛关注。免疫疗法主要分为三类:嵌合抗原受体T细胞(CAR-T)疗法、免疫检查点抑制剂(ICIs)疗法和肿瘤疫苗法,其中以PD-1/PD-L1为代表的免疫检查点抑制剂应用最为广泛,是临床上最有效的治疗手段。所谓程序性细胞死亡蛋白-1(PD-1)是CD28免疫受体家族的成员之一,其主要功能是调节T细胞的激活,在免疫细胞中高度表达,如T细胞、B细胞、肿瘤相关巨噬细胞(TAMs)和自然杀伤细胞(NK)。肿瘤细胞表面表达的程序性细胞死亡配体-1(PD-L1)作为PD-1的配体,具有诱导调节性T细胞生存、发育等功能。它的过度表达可以向T细胞传递错误的调节信号,从而抑制T细胞介导的抗肿瘤免疫反应,促使肿瘤细胞逃逸。
因此,阻断PD-1/PD-L1的相互作用被认为是一种有前途的治疗策略,它不仅能迅速恢复人体的免疫系统,还能引发肿瘤特异性T细胞反应。迄今为止,美国食品和药物管理局(FDA)已经批准了六种人源化单克隆抗体(Mab),即三种PD-1抑制剂nivolumab、pembrolizumab和cemiplimab,以及三种PD-L1抑制剂atezolizumab、durvalumab和avelumab,它们已经在各种肿瘤中显示出明显的治疗效果。然而,它们同样明显的缺点,如半衰期长、渗透性差、价格高,大大限制了它们更广泛的应用。
因此设计PD-1/PD-L1小分子抑制剂是一项具有重大意义的工作。
发明内容
本发明的目的是针对现有技术的上述不足,提供一种含酯链PD-1/PD-L1小分子抑制剂。
本发明的另一目的是提供该含酯链PD-1/PD-L1小分子抑制剂的制备方法。
本发明的又一目的是提供该含酯链PD-1/PD-L1小分子抑制剂的应用。
本发明的目的可通过以下技术方案实现:
结构如式I所示的化合物、立体异构体或其药学上可接受的盐:
其中,R
R
R
以上所述取代或未取代的烷基和烷氧基中的取代基为下列基团中的一个或多个:卤素、C1-C5烷基、羟基、C1-C5烷氧基、C1-C5羧基、C1-C5酯基或C1-C5酰胺基:所述取代的羟基或取代的氨基中的取代基为下列基团中的一个或多个:C1-C5烷基、C1-C5烷氧基、C1-C5羧基、C1-C5酯基或C1-C5酰胺基
作为本发明的一种优选,通式(I)中
R
以上所述取代或未取代的烷基和烷氧基中的取代基为下列基团中的一个或多个:卤素、C1-C5烷基、羟基、C1-C5烷氧基、C1-C5羧基、C1-C5酯基或C1-C5酰胺基:所述取代的羟基或取代的氨基中的取代基为下列基团中的一个或多个:C1-C5烷基、C1-C5烷氧基、C1-C5羧基、C1-C5酯基或C1-C5酰胺基;
作为本发明的一种优选,通式(I)中
R
作为本发明的一种优选,所述的通式(I)所示的化合物选自以下任意一种:
本发明所述化合物的制备方法:
(1)当R
(2)当R
一种药物组合物,包括药物有效量的活性成分和药学上可接受的辅料;所述活性成分包括本发明所述的化合物、立体异构体或其药学上可接受的盐中的一种或多种。
本发明所述药物组合物中,所述辅料包括药学上可接受的载体、稀释剂和/或赋形剂。
根据治疗目的可将所述的药物组合物制成各种类型的给药单位剂型,如片剂、丸剂、粉剂、液体、悬浮液、乳液、颗粒剂、颗粒剂、胶囊和针剂(溶液或悬浮液)等,优选片剂、胶囊、液体、悬浮液和针剂(溶液或悬浮液)。
本发明化合物或含有其它的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、肌肉注射、皮下注射、直肠等,优选注射剂。
本发明所述化合物、立体异构体或其药学上可接受的盐或所述的药物组合物在制备PD-1/PD-L1抑制剂中的应用。
本发明所述化合物、立体异构体或其药学上可接受的盐或所述的药物组合物在制备PD-1/PD-L1高表达所致免疫调节相关疾病、肿瘤、感染性疾病中的应用。
作为本发明的一种优选,所述免疫调节相关疾病选自器官特异性自身免疫疾病或系统性自身免疫疾病;所述的肿瘤选自黑色素瘤,结肠癌,肺癌,乳腺癌、宫颈癌、神经胶质瘤或肝癌。
相对于现有的技术,我们的化合物具有如下特点和优势:
1、申请人利用一种新的连接链设计出可以靶向PD-L1的具有新骨架的小分子抑制剂,主要通过机体免疫激活进而抑制肿瘤细胞的增殖。通过体外体内实验验证,发现该小分子化合物能够有效激活机体内免疫微环境,从而抑制肿瘤的生长,
2、体内实验显示本发明的小分子抑制剂不仅具有较好的治疗效果,在小鼠正常器官中显示无增殖毒性。
3、本发明化合物的抗癌谱较广,适用多种癌症如黑色素瘤,神经胶质瘤,结肠癌等。
综上所述,本发明所公开的化合物在肿瘤免疫治疗领域具有很好的应用前景,并将为基于PD-1/PD-L1的药物开发提供新思路和新方法。
附图说明
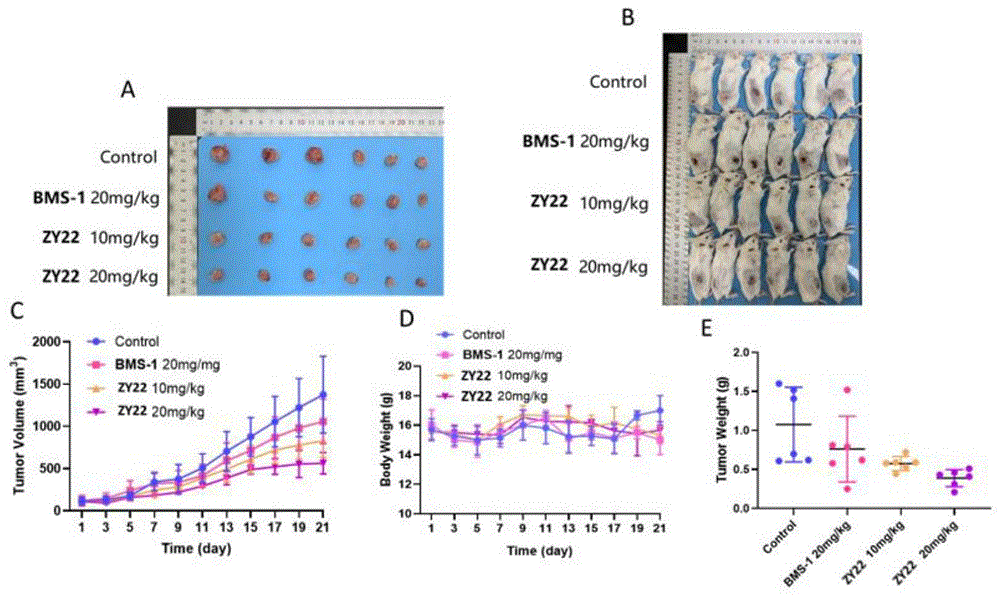
图1。体内抗肿瘤试验。(A)4T1肿瘤组织解剖图;(B)小鼠模型照片;(C)治疗期间肿瘤体积变化;(D)治疗期间小鼠体重变化情况;(E)治疗后第21天肿瘤重量。图2。4T1肿瘤病理切片。(A)CD8
具体实施方式
合成路线
方案1概述了ZY1-ZY9的合成:
将市售原料化合物1与化合物2Suzuki-Miyaura反应得到中间体3,中间体3和4,6-8由DMAP催化,以DCC为偶联剂进行Steglich酯化反应,制得化合物5,9-11,最后,在氰基硼氢化钠存在下,对化合物5进行还原胺化反应,得到目标化合物ZY1-ZY9:
其中,c步骤反应物1a、2a、3a分别对应产物ZY1、ZY2、ZY3。
其中,各目标化合物对应的各步反应物与产物:
方案2ZY22,ZY10-ZY13的合成:
中间体3与不同的醛12,13发生Steglich酯化反应生成化合物14,15,然后将得到的化合物14,15与化合物16结合,在Cs
其中,各目标化合物对应的各步反应物与产物:
1a和4a的结构式同上;
以下是上述制备方法的最优方案优选化合物具体实施方案
实施例1
(2-(甲氧基-4-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)-L-丝氨酸(ZY1)的制备:
称取苯硼酸(1.00g)、3-溴-2-甲基苯甲酸(0.80g),溶于30ml(dioxane/H
将得到的化合物3(1.20g)溶于30ml二氯甲烷中,加入4-羟基-2-甲氧基苯甲醛(0.90g)、DMAP(0.05g)、DCC(1.80g),反应混合物在室温下搅拌6h,TLC监测反应完全,粗产物经色谱柱纯化得到白色固体中间体5(0.90g)
取中间体5(0.10g)和L-丝氨酸(化合物1a,0.05g)在8ml DMF中的溶液中加入6滴乙酸。混合物在室温下搅拌2小时,然后加入氰基硼氢化钠(0.09g)。室温下继续搅拌12小时,TLC显示反应完成。反应液浓缩后得到残留物,残留物溶于二氯甲烷并用水洗涤。有机层经干燥和蒸发得到粗产物,粗产物经柱层析纯化得到白色固体,收率34%;
实施例2
4-(((1,3-二羟基-2-(羟甲基)丙-2-基)氨基)甲基)-3-甲氧基苯基-2-甲基-[1,1'-联苯]-3-甲酸酯(ZY2)的制备:
操作步骤同化合物ZY1。白色固体,收率45%;
实施例3
4-(((1,3-二羟基丙-2-基)氨基)甲基)-3-甲氧基苯基-2-甲基-[1,1'-联苯]-3-甲酸酯(ZY3)的制备:
操作步骤同化合物ZY1。白色固体,收率60%;
实施例4
((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)-D-丝氨酸(ZY4)的制备:
操作步骤同化合物ZY1。白色固体,收率45%;
实施例5
2-(((1,3-二羟基-2-(羟甲基)丙-2-基)氨基)甲基)苯基-2-甲基-[1,1'-联苯]-甲酸酯(ZY5)的制备:
操作步骤同化合物ZY1。白色固体,收率42%;
实施例6
(2-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)丝氨酸(ZY6)的制备:
操作步骤同化合物ZY1。白色固体,收率39%;
实施例7
2-溴-4-((((1,3-二羟基-2-(羟甲基)丙-2-基)氨基)甲基)苯基-2-甲基-[1,1'-联苯]-3-甲酸酯(ZY7)的制备:
操作步骤同化合物ZY1。白色固体,收率53%;
实施例8
2-(((1,3-二羟基-2-(羟甲基)丙-2-基)氨基)甲基)-3-甲基苯基-2-甲基-[1,1'-联苯]-3-甲酸酯(ZY8)的制备:
操作步骤同化合物ZY1。白色固体,收率29%;
实施例9
(2-甲基-4-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)-D-丝氨酸(ZY9)的制备:
操作步骤同化合物ZY1。白色固体,收率32%;
实施例10
((3-氰基苄基)氧基)-4-((((2-羟乙基)氨基)甲基)苯基-2-甲基-[1,1'-联苯]-3-甲酸酯(ZY10)的制备:
参考通式I中的化合物5合成化合物14,15,取化合物14(1.35g)溶于20ml DMF中,随后将化合物16(0.80g)与CS
将得到的中间体17(0.10g)与乙醇胺(0.04g)再次溶于4ml DMF中,反应体系中加入6滴乙酸,室温搅拌2h后加入NaBH
实施例11
(2R,4S)-1-(2-((3-氰基苄基)氧基)-4-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)-4-羟基吡咯烷-2-羧酸(ZY22)的制备:
操作步骤同化合物ZY10。白色固体,收率36%;
实施例12
(3-((3-氰基苄基)氧基)-4-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)丝氨酸(ZY11)的制备:
操作步骤同化合物ZY10。白色固体,收率38%;
实施例13
(2-((3-氰基苄基)氧基)-6-甲基-4-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)丝氨酸(ZY12)的制备:
操作步骤同化合物ZY10。白色固体,收率36%;
实施例14
(2-((3-氰基苄基)氧基)-6-甲基-4-((2-甲基-[1,1'-联苯]-3-甲酰)氧基)苄基)-D-丝氨酸(ZY13)的制备:
操作步骤同化合物ZY10。白色固体,收率31%;
实施效果
本发明部分化合物药理实验及结果如下:
化合物抑制PD-1/PD-L1相互作用的活性:
实验方法:PD-1/PD-L1结合检测试剂盒购自CISBIO(Cat#64PD1PEG)。化合物按浓度梯度依次稀释。在384孔板中,将2μL目标化合物稀释液与4μLTag1-PD-L1蛋白和4μLTag2-PD-1蛋白混合。混合物在室温(RT)下孵育15分钟。然后加入10μL抗Tag1-Eu Cryptate试剂和抗Tag2-XL665抗体的混合物,封板暗处RT孵育2h。在665nm和620nm波长下检测荧光信号。用Graphpad8.0.2软件计算IC
表1本发明优选化合物对抑制PD-1/PD-L1相互作用的抑制率;
a
从表1可知,本发明化合物对PD-1/PD-L1的抑制效果均由于阳性对照,尤其是化合物ZY7、ZY8、ZY9、ZY22,其中化合物ZY22对抑制PD-1/PD-L1相互作用效果最好,相对于阳性对照BMS-1,抑制活性提高了130倍,有作为优秀的抗肿瘤药物潜力。
化合物ZY22体内抗肿瘤实验:
BALB/c雌性小鼠(6周龄)购自江苏悟空生物科技有限公司。所有实验均按照江苏省动物实验保护协会批准的指南和方案进行,饲养环境为无菌食物和水,在标准实验室条件下(292±2℃,55±10%湿度,12-12h明暗循环)进行。将9.0×10
体内实验表明ZY22相比于BMS-1可以更好的抑制肿瘤生长,对组织进行免疫功能分析结果表明,ZY22是通过激活体内CD8
- 一种透明耐高温聚芳酯/聚碳酸酯合金酯交换反应抑制剂的制备方法及应用
- 一种含中链甘油三酯的火锅底料及其制备方法
- 一种含铈盐催化剂、其制备方法和催化制备丙酸丁酯的应用
- 一种含小分子肽的精华液护肤保湿面膜及其制备方法
- 含氟氯吡啶肟酯结构的化合物及其制备方法和应用及一种除草剂
- 小分子PD-1/PD-L1抑制剂、其与PD-L1抗体的药物组合物及其应用
- 一种新型PD-1/PD-L1小分子抑制剂及其应用
