一种生物酶法去消旋化制备(R)-β-氨基醇的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于酶工程技术领域,具体涉及一种生物酶法去消旋化制备(R)-β-氨基醇的方法。
背景技术
手性(R)-β-氨基醇是一类非常重要的手性化合物,可用作手性助剂、手性配体,或用于合成多种手性药物的手性中间体或砌块。例如,(R)-2-氨基-2-苯基乙醇可用于制备3-磷酸肌醇依赖性蛋白激酶-1(PDK1)抑制剂,而(R)-2-氨基-2-苯基丙醇是生产嗜睡新药-索利氨酯(Solriamfetol)的核心手性砌块。因此,手性(R)-β-氨基醇合成方法的开发具有重要意义。
生物催化技术是一种绿色、高效的现代制造技术,具有催化效率高、反应条件温和、特异性强、选择性高、催化剂无毒可降解、操作安全性高等优势,与绿色化学的原则完美契合。生物酶催化的去消旋化能够在不分离中间体的情况下将廉价、易得的外消旋体通过酶蛋白的催化作用转化为单一对映体,由于其固有的原子经济性和高效性,被视为手性(R)-β-氨基醇合成的理想工艺。但是,由于缺少合适的酶催化剂,目前尚没有利用生物酶催化外消旋β-氨基醇去消旋化制备手性(R)-β-氨基醇的报道。因此,开发基于生物酶法的手性(R)-β-氨基醇去消旋化制备方法,对于实现高值手性(R)-β-氨基醇的高效、绿色制备具有重要意义,应用潜力巨大。
发明内容
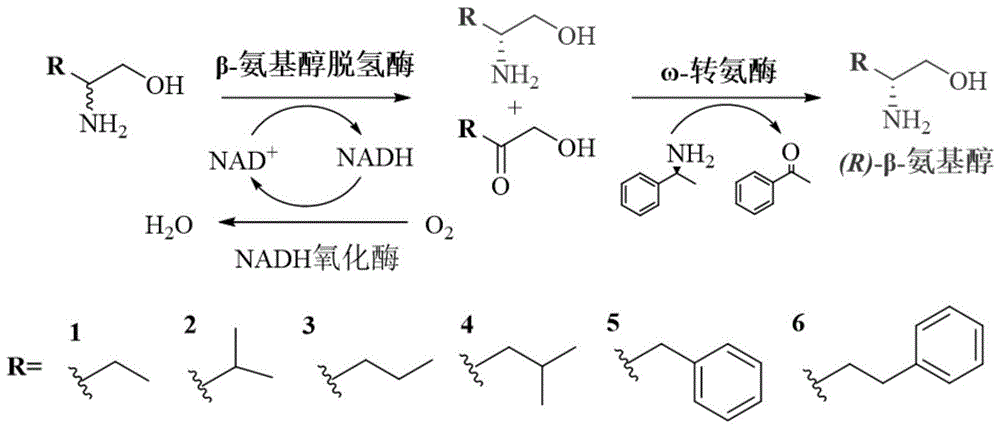
为了克服上述现有技术的不足,本发明提出了一种利用三酶耦联催化反应将外消旋β-氨基醇去消旋化生成手性纯(R)-β-氨基醇的方法,以由工程化β-氨基醇脱氢酶、NADH氧化酶与ω-转氨酶三个酶组成的生物酶催化系统作为催化剂,催化外消旋β-氨基醇去消旋化制备具有高光学纯度(ee值大于99%)的手性(R)-β-氨基醇,具有重要的应用价值。
为了实现上述目的,本发明所采用的技术方案是:
本发明提供了一种生物酶法去消旋化制备(R)-β-氨基醇的方法,具体为:以外消旋β-氨基醇为原料,利用由工程化β-氨基醇脱氢酶、NADH氧化酶与ω-转氨酶组成的三酶耦联催化系统催化其去消旋化而制备得到手性(R)-β-氨基醇。
作为本发明的一个优选实施方式,所述一种生物酶法去消旋化制备(R)-β-氨基醇的方法,包括以下步骤:
S1、配置外消旋β-氨基醇、有机氨基供体、磷酸吡哆醛(PLP)和NAD
S2、往预反应液中加入β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶,配制反应体系,经去消旋化反应后制得手性纯(R)-β-氨基醇。
本发明通过对一个热泉宏基因组来源的缬氨酸脱氢酶的活性中心进行了两轮分区分子改造,成功获得了一类能够高效催化(S)-β-氨基醇氧化脱氨的工程化β-氨基醇脱氢酶。在这些工程化β-氨基醇脱氢酶的基础上,采用一锅化的三酶催化体系,以外消旋β-氨基醇为原料,利用工程化β-氨基醇脱氢酶将(S)-β-氨基醇氧化脱氨生成对应α-羟基酮,使(R)-β-氨基醇不能反应而得以保留。该氧化脱氨过程消耗NAD
所述工程化β-氨基醇脱氢酶能以NAD
所述NADH氧化酶用以实现辅酶NAD
所述ω-转氨酶以有机胺作为氨基供体,将生成的α-羟基酮进一步还原胺化为(R)-β-氨基醇。优选地,所述ω-转氨酶为对(R)-β-氨基醇具有立体选择性的ω-转氨酶,来源于Bacillus Megaterium SC6394,其氨基酸序列如SEQ ID NO.7所示。
优选地,所述有机氨基供体包括但不限于苯乙胺。
优选地,所述外消旋β-氨基醇包括2-氨基丁醇、2-氨基-3-甲基丁醇、2-氨基戊醇、2-氨基-4-甲基戊醇、2-氨基-3-苯基丙醇和2-氨基-4-苯基丁醇。
优选地,所述手性(R)-β-氨基醇包括(R)-2-氨基丁醇、(R)-2-氨基-3-甲基丁醇、(R)-2-氨基戊醇、(R)-2-氨基-4-甲基戊醇、(R)-2-氨基-3-苯基丙醇和(R)-2-氨基-4-苯基丁醇。
优选地,去消旋化反应的温度为30-50℃,时间为24-96h。
优选地,去消旋化反应体系的pH为7-10。
优选地,反应体系中,外消旋β-氨基醇的浓度为5-25mM,磷酸吡哆醛的浓度为0.1-1.0mM,NAD
更优选地,反应体系为2mL,含有10mM外消旋底物β-氨基醇,0.5mM NAD
优选地,所述工程化β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a(+)为表达载体,大肠杆菌作为表达宿主,培养发酵制得。
更优选地,所述酶液为纯化获得的纯酶。当然,包含酶蛋白的重组工程菌静息细胞悬液或者破胞粗酶液也同样适用本发明。
与现有技术相比,本发明的有益效果是:
本发明公开了一种生物酶法去消旋化制备(R)-β-氨基醇的方法,通过将β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶三种酶进行耦联,并将其应用于外消旋β-氨基醇的去消旋化制备得到手性(R)-β-氨基醇,该法的底物转化率≥90%,合成(R)-β-氨基醇的ee值>99%。因此,本发明提供了一种制备高值光学纯(R)-β-氨基醇的新方法,该方法原料转化率高、分离精制过程简单、产品收率高、生产成本低,易于实际应用。
附图说明
图1为羧基结合区域组合突变库的筛选结果;
图2为侧链结合区域组合突变库的筛选结果;
图3为三酶耦联生物酶法去消旋化制备(R)-β-氨基醇的反应式;
图4为产物(R)-2-氨基丁醇的ee值分析液相图谱;
图5为产物(R)-2-氨基-3-甲基丁醇的ee值分析液相图谱;
图6为产物(R)-2-氨基戊醇的ee值分析液相图谱;
图7为产物(R)-2-氨基-4-甲基戊醇的手性ee值液相图谱;
图8为产物(R)-2-氨基-3-苯基丙醇的ee值分析液相图谱;
图9为产物(R)-2-氨基-4-苯基丁醇的ee值分析液相图谱;
图4-9中,A为标样的分析图谱,B为反应液的分析图谱。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
实施例中所使用的DNA聚合酶(2×Phanta Max Master Mix)、Dpn I酶、重组克隆试剂盒和质粒提取试剂盒均购自南京诺唯赞生物科技股份有限公司;基因、引物的合成与基因测序工作均由擎科梓熙生物技术(广州)有限公司完成,以上试剂的使用方法均参考商品说明书。
实施例中所涉及的表达载体为pET 28a(+),所用宿主为大肠杆菌BL21(DE3),均由发明人所在的中山大学海洋科学学院海洋天然产物实验室保藏。
实施例中所用的表达NADH氧化酶、ω-转氨酶的工程菌委托擎科梓熙生物技术(广州)有限公司构建,其氨基酸序列分别如WP_014622893.1(GenBank登录号)与SEQ ID NO.7所示。
ω-转氨酶的氨基酸序列(SEQ ID NO.7):
MSLTVQKINWEQVKEWDRKYLMRTFSTQNEYQPVPIESTEGDYLIMPDGTRLLDFFNQLYCVNLGQKNQKVNAAIKEALDRYGFVWDTYATDYKAKAAKIIIEDILGDEDWPGKVRFVSTGSEAVETALNIARLYTNRPLVVTREHDYHGWTGGAATVTRLRSYRSGLVGENSESFSAQIPGSSYNSAVLMAPSPNMFQDSDGNLLKDENGELLSVKYTRRMIENYGPEQVAAVITEVSQGAGSAMPPYEYIPQIRKMTKELGVLWINDEVLTGFGRTGKWFGYQHYGVQPDIITMGKGLSSSSLPAGAVLVSKEIAAFMDKHRWESVSTYAGHPVAMAAVCANLEVMMEENFVEQAKDSGEYIRSKLELLQEKHKSIGNFDGYGLLWIVDIVNAKTKTPYVKLDRNFTHGMNPNQIPTQIIMKKALEKGVLIGGVMPNTMRIGASLNVSRGDIDKAMDALDYALDYLESGEWQ。
实施例中所用的2-氨基-3-苯基丙醇购自上海麦克林生化科技股份有限公司,2-氨基戊醇购自梯希爱化成工业发展有限公司,S-2-氨基-3-甲基丁醇购自北京百灵威科技有限公司,S-2-氨基-4-甲基戊醇购自上海笛柏生物科技有限公司,其它β-氨基醇标样与PLP购自上海毕得医药科技股份有限公司。NAD
实施例中所使用的氨基酸三字母或单字母表达方式,均采用IUPAC规定的氨基酸代码(Eur.J.Biochem.,138:9-37,1984)。
菌体的培养与蛋白纯化标准程序:从甘油管中对菌株进行划线活化后,挑单菌落接种至含50μg/mL卡那霉素(Kan)的5mL LB液体培养基中,37℃、200rpm震荡培养6h。然后按2%的接种量转接至250mL同样含50μg/mL Kan的新鲜TB液体培养基中,37℃、200rpm震荡培养3h,加入IPTG至其终浓度为0.5mM,18℃下诱导培养16h。培养结束后,12000g、4℃对培养液离心10min,收集菌体,超声破胞,采用镍柱亲和层析纯化得到蛋白。
β-氨基醇氧化脱氨活力的标准检测体系为:0.005~0.7mg的纯酶,20mM(S)-β-氨基醇,0.5mM NAD
酶活单位(U)的定义:在标准的反应条件下,每分钟生成1μmol NADH所需要的酶量。
实施例中通过气相色谱法分析反应液中的β-氨基醇浓度,通过柱前衍生化高效液相色谱法分析β-氨基醇的ee值。其中,气相色谱条件:气相色谱柱为RESTEK
表1 β-氨基醇的气相检测程序
注:底物1a、2a、3a、4a、5a、6a的结构式分别如下所示:
表2 β-氨基醇液的相分析程序
注:流动相A:水(0.1%三氟乙酸);流动相B:甲醇(0.1%三氟乙酸)。1a-6a的结构同表1。
实施例1 缬氨酸脱氢酶(HsVDH)的羧基结合区域改造
(1)结构分析与突变库设计
利用AlfaFold2与AutoDock Vina工具对专利CN115927229A报道的缬氨酸脱氢酶(HsVDH,其氨基酸序列如SEQ ID NO.1所示)进行模型构建与分子对接分析,发现其活性口袋可分为三个区域,包括羧基结合区域、催化位点区域与侧链结合区域(图1)。为使HsVDH获得对β-氨基醇的催化活力,首先考虑对其活性中心的羧基结合位点进行组合突变。该羧基结合位点包含68位赖氨酸与261位天冬酰胺两个氨基酸残基,因此采用NNK密码子构建这两个氨基酸的饱和组合突变库。
HsVDH野生型氨基酸序列(SEQ ID NO.1):
MPVFDHPEFDHHQQIVFGSDAGSGLRAIIAIHDTTRGPALGGLRIYPYASETEALTDVLRLSRGMSYKSAMADLPLGGGKAVIIADPRTAKTPELLRAMGRLVDSLGGAYITAEDSGSSEADMQIIAEETRHVGGLRRASGESGDPSPFTAWGVFCALKSAVRHGLGRDDLEGLRVAIQGVGHVGAHLARHLADAGARLVLTDVDREALAHLAEELGAETTPPEAIFDAEVDLFAPCALGAVLDDDVVERLRARVVCGAANNQLATPAMAERLMARGILYTPDYVANAGGVIEIAWQRREDYRREAVMAHIEGIGATLDELFARAASEGRSPATIADTMARERFGRG。
(2)HsVDH重组菌的活化及质粒提取
将带有pET-28a(+)-HsVDH重组质粒的大肠杆菌BL21(DE3)工程菌使用LB培养基进行活化与培养。
LB培养基的具体配方为:蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,用去离子水溶解后定容,121℃灭菌20min,待用。固体培养基为LB培养基加入15%(质量比)的琼脂。
取出带有pET-28a(+)-HsVDH重组质粒的重组菌的甘油管,挑取菌落划线至含有LB固体培养基(50μg/mL卡那霉素)的平皿上,37℃静置培养12h。从平皿上挑取单菌落接入含50μg/mL卡那霉素的5mL LB液体培养基中,37℃、200rpm培养12h。在获得培养液后,参照质粒提取试剂盒的操作说明书进行质粒的提取。
(3)突变库的构建
合成特异性引物(表3),以步骤(2)中提取的pET-28a(+)-HsVDH质粒为模板,以K68-F与N261-R为引物对进行PCR获得线性化片段Ⅰ,以K68-R与N261-F为引物对进行PCR获得线性化载体片段Ⅱ。具体的PCR体系如表4所示,具体的PCR扩增条件为:1)95℃预变性2min;2)95℃变性15s;56℃退火15s;72℃延伸45s;30个循环;3)72℃后延伸5min;4)4℃保存。
最后参考单片段重组克隆试剂盒(ClonExpress IIOne Step Cloning Kit)按照说明书,对这两个片段分别进行后续的DpnⅠ消化、胶回收,再将两个片段进行重组随后转化至大肠杆菌BL21(DE3)感受态细胞,构建得到68位和261位氨基酸残基的组合饱和突变库。
表3 NNK突变库构建所用引物
表4 PCR扩增体系
(4)突变库的高通量筛选
在灭菌的96深孔板中加入200μL的LB培养基(50μg/mL的卡那霉素),使用灭菌枪头挑取单菌落至96深孔板。然后将深孔板置于37℃,200rpm条件下培养6h,称之为一级板。在另外的灭菌的96深孔板中加入400μL的LB培养基(50μg/mL的卡那霉素)作为二级板,在一级板中吸取50μL菌液至二级板,一级板加入20%的甘油放置于-80℃冰箱长期保藏。然后将二级板置于37℃下震荡培养3h,再加入终浓度为0.5mM的IPTG进行诱导,然后将二级板置于18℃,200rpm条件下培养16h。
将二级板置于4000rpm、4℃下离心20min后收集菌体,然后置于-80℃下冷冻24h以上。将二级板从-80℃取出,室温下放置0.5h解冻,之后往每孔加入300μL溶菌液(50mMpH7.5磷酸盐缓冲液,2mg/mL溶菌酶,10mg/L DNaseⅠ),震荡使细胞悬浮,并置于摇床在37℃,200rpm下孵育1.5h。孵育结束后,4000rpm,4℃离心20min,取上清进行酶活测定。
向新的96孔板(反应板)各孔中加入50μL测活混合液[(0.1M pH 8.5Tris-HCl缓冲液,5mM NAD
(5)对β-氨基醇催化活力的验证
对筛选获得的阳性突变体进行基因测序,分析其具体突变情况。随后,对获得的突变体进行发酵培养与蛋白纯化,并采用氧化脱氨活力标准检测体系对纯化获得的纯蛋白进行活力测试。成功筛选获得3个对(S)-2-氨基-1-丁醇具有氧化脱氨活力的突变体(N261M、N261F、N261L),其中N261M(氨基酸序列如SEQ ID NO.2所示)具有最高的比活力,达到了46.36U/g(图1)。
N261M的氨基酸序列(SEQ ID NO.2):
MPVFDHPEFDHHQQIVFGSDAGSGLRAIIAIHDTTRGPALGGLRIYPYASETEALTDVLRLSRGMSYKSAMADLPLGGGKAVIIADPRTAKTPELLRAMGRLVDSLGGAYITAEDSGSSEADMQIIAEETRHVGGLRRASGESGDPSPFTAWGVFCALKSAVRHGLGRDDLEGLRVAIQGVGHVGAHLARHLADAGARLVLTDVDREALAHLAEELGAETTPPEAIFDAEVDLFAPCALGAVLDDDVVERLRARVVCGAAMNQLATPAMAERLMARGILYTPDYVANAGGVIEIAWQRREDYRREAVMAHIEGIGATLDELFARAASEGRSPATIADTMARERFGRG。
N261M的基因序列(SEQ ID NO.8):
ATGCCGGTTTTTGATCATCCGGAATTTGATCATCATCAGCAGATCGTTTTTGGTTCCGATGCCGGTAGCGGTCTGCGTGCCATCATTGCCATCCATGATACCACCCGTGGTCCGGCCCTGGGTGGTCTGCGTATTTATCCGTATGCATCAGAAACCGAAGCCCTGACCGATGTTCTGCGTCTGAGCCGTGGTATGAGTTATAAAAGTGCAATGGCAGATCTGCCTCTGGGTGGTGGTAAAGCAGTTATTATTGCCGATCCGCGTACCGCAAAAACCCCGGAACTGCTGCGTGCCATGGGTCGTCTGGTTGATAGCCTGGGCGGTGCATATATTACCGCCGAAGATAGCGGTAGCAGCGAAGCAGATATGCAGATTATTGCAGAAGAAACCCGCCATGTGGGTGGCCTGCGTCGTGCAAGTGGCGAAAGCGGTGATCCGAGTCCGTTTACCGCATGGGGTGTGTTTTGTGCACTGAAAAGCGCAGTTCGTCATGGTCTGGGTCGTGATGATCTGGAAGGTCTGCGTGTTGCAATTCAGGGTGTGGGTCATGTTGGTGCGCATCTGGCACGTCATCTGGCGGATGCGGGTGCCCGTCTGGTTCTGACCGATGTGGATCGTGAAGCGCTGGCGCATCTGGCTGAAGAACTGGGTGCTGAAACGACACCGCCGGAAGCAATTTTTGATGCAGAAGTAGATCTGTTTGCACCGTGTGCACTGGGTGCAGTGCTGGATGATGATGTTGTTGAACGTCTGCGTGCACGTGTCGTGTGTGGTGCAGCGATGAACCAGCTGGCGACCCCGGCAATGGCAGAACGTCTGATGGCACGTGGTATTCTGTATACGCCTGATTATGTTGCGAATGCAGGTGGTGTTATTGAAATTGCGTGGCAGCGTCGTGAAGATTATCGTCGTGAAGCAGTTATGGCACATATTGAAGGCATTGGTGCGACCCTGGATGAACTGTTTGCCCGTGCAGCAAGCGAAGGTCGTAGCCCGGCCACAATTGCAGATACCATGGCACGTGAACGTTTTGGTCGTGGCTAA。
实施例2 HsVDH突变体(N261M)的侧链结合区域改造
(1)侧链结合区域精简组合突变库的设计
在实施例1的基础上,对N261M的侧链结合区域进行改造,以提高其对不同类型β-氨基醇底物的催化活力。以氨基酸脱氢酶家族的序列进化信息作为指导,选择向N261M的113位、114位、146位、291位和294位氨基酸残基随机引入丙氨酸(A)或甘氨酸(G),构建一个精简的五点组合突变库。
(2)精简组合突变库的构建
合成特异引物(表5),以实施例1中获得的含N261M突变体基因的pET-28a(+)重组质粒为模板,以113_114M-F与混合引物Ⅰ(146M-R_1:146M-R_2=1:2)为引物对进行PCR获得线性化片段Ⅰ,以AID1_F与混合引物Ⅱ(291_294M-R_1:291_294M-R_1=1:2)为引物对进行PCR获得线性化载体片段Ⅱ,再以AID2_R与AID2_F为引物对进行PCR获得线性化载体片段Ⅲ。PCR体系与条件参照实施例1的步骤(3)。
参考多片段重组克隆试剂盒(ClonExpress MultiS One Step Cloning Kit)的使用说明书,对这三个片段分别进行后续的DpnⅠ消化与胶回收,再将三个片段进行重组随后转化至大肠杆菌BL21(DE3)感受态细胞,构建113位、114位、146位、291位和294位氨基酸残基的精简组合突变库。
表5精简组合突变库构建所需引物
(3)精简组合突变库的筛选
针对2-氨基-3-甲基丁醇、2-氨基-4-甲基戊醇、2-氨基己醇、2-氨基庚醇、2-氨基-3-苯基丙醇、2-氨基-3-(对甲基苯基)丙醇和2-氨基-4-苯基丁醇这7个不同的β-氨基醇底物,参照实施例1中的步骤(4)和步骤(5)对构建好的精简组合突变库进行筛选。如图2所示,获得8个对不同底物催化活力均提高的突变体(即工程化β-氨基醇脱氢酶)。选择其中四个催化活力较高的突变体进行后续(R)-β-氨基醇去消旋化制备,这四个突变体的具体突变情况如下:
1)E114G/N261M突变体为将SEQ ID NO.1所示氨基酸序列的第114位谷氨酸,第261位天冬酰胺分别突变为甘氨酸和甲硫氨酸而形成的突变体,所述突变体的氨基酸序列如SEQ ID NO.3所示;E114G/N261M的氨基酸序列(SEQ ID NO.3):
MPVFDHPEFDHHQQIVFGSDAGSGLRAIIAIHDTTRGPALGGLRIYPYASETEALTDVLRLSRGMSYKSAMADLPLGGGKAVIIADPRTAKTPELLRAMGRLVDSLGGAYITAGDSGSSEADMQIIAEETRHVGGLRRASGESGDPSPFTAWGVFCALKSAVRHGLGRDDLEGLRVAIQGVGHVGAHLARHLADAGARLVLTDVDREALAHLAEELGAETTPPEAIFDAEVDLFAPCALGAVLDDDVVERLRARVVCGAAMNQLATPAMAERLMARGILYTPDYVANAGGVIEIAWQRREDYRREAVMAHIEGIGATLDELFARAASEGRSPATIADTMARERFGRG。
E114G/N261M的基因序列(SEQ ID NO.9):
ATGCCGGTTTTTGATCATCCGGAATTTGATCATCATCAGCAGATCGTTTTTGGTTCCGATGCCGGTAGCGGTCTGCGTGCCATCATTGCCATCCATGATACCACCCGTGGTCCGGCCCTGGGTGGTCTGCGTATTTATCCGTATGCATCAGAAACCGAAGCCCTGACCGATGTTCTGCGTCTGAGCCGTGGTATGAGTTATAAAAGTGCAATGGCAGATCTGCCTCTGGGTGGTGGTAAAGCAGTTATTATTGCCGATCCGCGTACCGCAAAAACCCCGGAACTGCTGCGTGCCATGGGTCGTCTGGTTGATAGCCTGGGCGGTGCATATATTACCGCCGGAGATAGCGGTAGCAGCGAAGCAGATATGCAGATTATTGCAGAAGAAACCCGCCATGTGGGTGGCCTGCGTCGTGCAAGTGGCGAAAGCGGTGATCCGAGTCCGTTTACCGCATGGGGTGTGTTTTGTGCACTGAAAAGCGCAGTTCGTCATGGTCTGGGTCGTGATGATCTGGAAGGTCTGCGTGTTGCAATTCAGGGTGTGGGTCATGTTGGTGCGCATCTGGCACGTCATCTGGCGGATGCGGGTGCCCGTCTGGTTCTGACCGATGTGGATCGTGAAGCGCTGGCGCATCTGGCTGAAGAACTGGGTGCTGAAACGACACCGCCGGAAGCAATTTTTGATGCAGAAGTAGATCTGTTTGCACCGTGTGCACTGGGTGCAGTGCTGGATGATGATGTTGTTGAACGTCTGCGTGCACGTGTCGTGTGTGGTGCAGCGATGAACCAGCTGGCGACCCCGGCAATGGCAGAACGTCTGATGGCACGTGGTATTCTGTATACGCCTGATTATGTTGCGAATGCAGGTGGTGTTATTGAAATTGCGTGGCAGCGTCGTGAAGATTATCGTCGTGAAGCAGTTATGGCACATATTGAAGGCATTGGTGCGACCCTGGATGAACTGTTTGCCCGTGCAGCAAGCGAAGGTCGTAGCCCGGCCACAATTGCAGATACCATGGCACGTGAACGTTTTGGTCGTGGCTAA。
2)A113G/E114A/N261M突变体为将SEQ ID NO.1所示氨基酸序列的第113位丙氨酸、第114位谷氨酸和第261位天冬酰胺分别突变为甘氨酸、丙氨酸和甲硫氨酸而形成的突变体,所述突变体的氨基酸序列如SEQ ID NO.4所示;A113G/E114A/N261M的氨基酸序列(SEQ ID NO.4):
MPVFDHPEFDHHQQIVFGSDAGSGLRAIIAIHDTTRGPALGGLRIYPYASETEALTDVLRLSRGMSYKSAMADLPLGGGKAVIIADPRTAKTPELLRAMGRLVDSLGGAYITGADSGSSEADMQIIAEETRHVGGLRRASGESGDPSPFTAWGVFCALKSAVRHGLGRDDLEGLRVAIQGVGHVGAHLARHLADAGARLVLTDVDREALAHLAEELGAETTPPEAIFDAEVDLFAPCALGAVLDDDVVERLRARVVCGAAMNQLATPAMAERLMARGILYTPDYVANAGGVIEIAWQRREDYRREAVMAHIEGIGATLDELFARAASEGRSPATIADTMARERFGRG。
A113G/E114A/N261M的基因序列(SEQ ID NO.10):
ATGCCGGTTTTTGATCATCCGGAATTTGATCATCATCAGCAGATCGTTTTTGGTTCCGATGCCGGTAGCGGTCTGCGTGCCATCATTGCCATCCATGATACCACCCGTGGTCCGGCCCTGGGTGGTCTGCGTATTTATCCGTATGCATCAGAAACCGAAGCCCTGACCGATGTTCTGCGTCTGAGCCGTGGTATGAGTTATAAAAGTGCAATGGCAGATCTGCCTCTGGGTGGTGGTAAAGCAGTTATTATTGCCGATCCGCGTACCGCAAAAACCCCGGAACTGCTGCGTGCCATGGGTCGTCTGGTTGATAGCCTGGGCGGTGCATATATTACCGGCGCAGATAGCGGTAGCAGCGAAGCAGATATGCAGATTATTGCAGAAGAAACCCGCCATGTGGGTGGCCTGCGTCGTGCAAGTGGCGAAAGCGGTGATCCGAGTCCGTTTACCGCATGGGGTGTGTTTTGTGCACTGAAAAGCGCAGTTCGTCATGGTCTGGGTCGTGATGATCTGGAAGGTCTGCGTGTTGCAATTCAGGGTGTGGGTCATGTTGGTGCGCATCTGGCACGTCATCTGGCGGATGCGGGTGCCCGTCTGGTTCTGACCGATGTGGATCGTGAAGCGCTGGCGCATCTGGCTGAAGAACTGGGTGCTGAAACGACACCGCCGGAAGCAATTTTTGATGCAGAAGTAGATCTGTTTGCACCGTGTGCACTGGGTGCAGTGCTGGATGATGATGTTGTTGAACGTCTGCGTGCACGTGTCGTGTGTGGTGCAGCGATGAACCAGCTGGCGACCCCGGCAATGGCAGAACGTCTGATGGCACGTGGTATTCTGTATACGCCTGATTATGTTGCGAATGCAGGTGGTGTTATTGAAATTGCGTGGCAGCGTCGTGAAGATTATCGTCGTGAAGCAGTTATGGCACATATTGAAGGCATTGGTGCGACCCTGGATGAACTGTTTGCCCGTGCAGCAAGCGAAGGTCGTAGCCCGGCCACAATTGCAGATACCATGGCACGTGAACGTTTTGGTCGTGGCTAA。
3)A113G/E114A/P146A/N261M突变体为将SEQ ID NO.1所示氨基酸序列的第113位丙氨酸、第114位谷氨酸、第146位脯氨酸和第261位天冬酰胺分别突变为甘氨酸、丙氨酸、丙氨酸和甲硫氨酸而形成的突变体,所述突变体的氨基酸序列如SEQ ID NO.5所示;A113G/E114A/P146A/N261M的氨基酸序列(SEQ ID NO.5):
MPVFDHPEFDHHQQIVFGSDAGSGLRAIIAIHDTTRGPALGGLRIYPYASETEALTDVLRLSRGMSYKSAMADLPLGGGKAVIIADPRTAKTPELLRAMGRLVDSLGGAYITGADSGSSEADMQIIAEETRHVGGLRRASGESGDASPFTAWGVFCALKSAVRHGLGRDDLEGLRVAIQGVGHVGAHLARHLADAGARLVLTDVDREALAHLAEELGAETTPPEAIFDAEVDLFAPCALGAVLDDDVVERLRARVVCGAAMNQLATPAMAERLMARGILYTPDYVANAGGVIEIAWQRREDYRREAVMAHIEGIGATLDELFARAASEGRSPATIADTMARERFGRG。
A113G/E114A/P146A/N261M的基因序列(SEQ ID NO.11):
ATGCCGGTTTTTGATCATCCGGAATTTGATCATCATCAGCAGATCGTTTTTGGTTCCGATGCCGGTAGCGGTCTGCGTGCCATCATTGCCATCCATGATACCACCCGTGGTCCGGCCCTGGGTGGTCTGCGTATTTATCCGTATGCATCAGAAACCGAAGCCCTGACCGATGTTCTGCGTCTGAGCCGTGGTATGAGTTATAAAAGTGCAATGGCAGATCTGCCTCTGGGTGGTGGTAAAGCAGTTATTATTGCCGATCCGCGTACCGCAAAAACCCCGGAACTGCTGCGTGCCATGGGTCGTCTGGTTGATAGCCTGGGCGGTGCATATATTACCGGCGCAGATAGCGGTAGCAGCGAAGCAGATATGCAGATTATTGCAGAAGAAACCCGCCATGTGGGTGGCCTGCGTCGTGCAAGTGGCGAAAGCGGTGATGCCAGTCCGTTTACCGCATGGGGTGTGTTTTGTGCACTGAAAAGCGCAGTTCGTCATGGTCTGGGTCGTGATGATCTGGAAGGTCTGCGTGTTGCAATTCAGGGTGTGGGTCATGTTGGTGCGCATCTGGCACGTCATCTGGCGGATGCGGGTGCCCGTCTGGTTCTGACCGATGTGGATCGTGAAGCGCTGGCGCATCTGGCTGAAGAACTGGGTGCTGAAACGACACCGCCGGAAGCAATTTTTGATGCAGAAGTAGATCTGTTTGCACCGTGTGCACTGGGTGCAGTGCTGGATGATGATGTTGTTGAACGTCTGCGTGCACGTGTCGTGTGTGGTGCAGCGATGAACCAGCTGGCGACCCCGGCAATGGCAGAACGTCTGATGGCACGTGGTATTCTGTATACGCCTGATTATGTTGCGAATGCAGGTGGTGTTATTGAAATTGCGTGGCAGCGTCGTGAAGATTATCGTCGTGAAGCAGTTATGGCACATATTGAAGGCATTGGTGCGACCCTGGATGAACTGTTTGCCCGTGCAGCAAGCGAAGGTCGTAGCCCGGCCACAATTGCAGATACCATGGCACGTGAACGTTTTGGTCGTGGCTAA。
4)A113G/E114A/P146A/N261M/I294G突变体为将SEQ ID NO.1所示氨基酸序列的第113位丙氨酸、第114位谷氨酸、第146位脯氨酸、第261位天冬酰胺和第294位异亮氨酸分别突变为甘氨酸、丙氨酸、丙氨酸、甲硫氨酸和甘氨酸而形成的突变体,所述突变体的氨基酸序列如SEQ ID NO.6所示;A113G/E114A/P146A/N261M/I294G的氨基酸序列(SEQ IDNO.6):
MPVFDHPEFDHHQQIVFGSDAGSGLRAIIAIHDTTRGPALGGLRIYPYASETEALTDVLRLSRGMSYKSAMADLPLGGGKAVIIADPRTAKTPELLRAMGRLVDSLGGAYITGADSGSSEADMQIIAEETRHVGGLRRASGESGDASPFTAWGVFCALKSAVRHGLGRDDLEGLRVAIQGVGHVGAHLARHLADAGARLVLTDVDREALAHLAEELGAETTPPEAIFDAEVDLFAPCALGAVLDDDVVERLRARVVCGAAMNQLATPAMAERLMARGILYTPDYVANAGGVIEGAWQRREDYRREAVMAHIEGIGATLDELFARAASEGRSPATIADTMARERFGRG。
A113G/E114A/P146A/N261M/I294G的基因序列(SEQ ID NO.12):
ATGCCGGTTTTTGATCATCCGGAATTTGATCATCATCAGCAGATCGTTTTTGGTTCCGATGCCGGTAGCGGTCTGCGTGCCATCATTGCCATCCATGATACCACCCGTGGTCCGGCCCTGGGTGGTCTGCGTATTTATCCGTATGCATCAGAAACCGAAGCCCTGACCGATGTTCTGCGTCTGAGCCGTGGTATGAGTTATAAAAGTGCAATGGCAGATCTGCCTCTGGGTGGTGGTAAAGCAGTTATTATTGCCGATCCGCGTACCGCAAAAACCCCGGAACTGCTGCGTGCCATGGGTCGTCTGGTTGATAGCCTGGGCGGTGCATATATTACCGGCGCAGATAGCGGTAGCAGCGAAGCAGATATGCAGATTATTGCAGAAGAAACCCGCCATGTGGGTGGCCTGCGTCGTGCAAGTGGCGAAAGCGGTGATGCCAGTCCGTTTACCGCATGGGGTGTGTTTTGTGCACTGAAAAGCGCAGTTCGTCATGGTCTGGGTCGTGATGATCTGGAAGGTCTGCGTGTTGCAATTCAGGGTGTGGGTCATGTTGGTGCGCATCTGGCACGTCATCTGGCGGATGCGGGTGCCCGTCTGGTTCTGACCGATGTGGATCGTGAAGCGCTGGCGCATCTGGCTGAAGAACTGGGTGCTGAAACGACACCGCCGGAAGCAATTTTTGATGCAGAAGTAGATCTGTTTGCACCGTGTGCACTGGGTGCAGTGCTGGATGATGATGTTGTTGAACGTCTGCGTGCACGTGTCGTGTGTGGTGCAGCGATGAACCAGCTGGCGACCCCGGCAATGGCAGAACGTCTGATGGCACGTGGTATTCTGTATACGCCTGATTATGTTGCGAATGCAGGTGGTGTTATTGAAGGCGCGTGGCAGCGTCGTGAAGATTATCGTCGTGAAGCAGTTATGGCACATATTGAAGGCATTGGTGCGACCCTGGATGAACTGTTTGCCCGTGCAGCAAGCGAAGGTCGTAGCCCGGCCACAATTGCAGATACCATGGCACGTGAACGTTTTGGTCGTGGCTAA。
实施例3 外消旋2-氨基丁醇去消旋化合成(R)-2-氨基丁醇
反应式如图3所示,具体合成方法包括以下步骤:
(1)蛋白的表达纯化:按工程菌培养与蛋白纯化标准程序对β-氨基醇脱氢酶(E114G/N261M,SEQ ID NO.3),NADH氧化酶(NOX)和ω-转氨酶进行表达纯化,获得纯蛋白。所述β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a为表达载体,大肠杆菌BL21(DE3)为表达宿主,经由发酵培养制得。
(2)反应体系的配置及去消旋化反应:反应体系为2mL,含有10mM外消旋底物2-氨基丁醇,0.5mM NAD
检测结果表明,外消旋2-氨基丁醇去消旋化合成(R)-2-氨基丁醇的ee值>99%,转化率>99%。
实施例4 外消旋2-氨基-3-甲基丁醇去消旋化合成(R)-2-氨基-3-甲基丁醇
(1)蛋白的表达纯化:按工程菌培养与蛋白纯化标准程序对β-氨基醇脱氢酶(E114G/N261M,SEQ ID NO.3),NADH氧化酶(NOX)和ω-转氨酶进行表达纯化,获得纯蛋白。同样的,所述β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a为表达载体,大肠杆菌BL21(DE3)为表达宿主,经由发酵培养制得。
(2)反应体系的配置及去消旋化反应:反应体系为2mL,含有10mM外消旋底物2-氨基-3-甲基丁醇,0.5mM NAD
检测结果表明,外消旋2-氨基-4-甲基丁醇去消旋化合成(R)-2-氨基-3-甲基丁醇的ee值>99%,转化率>99%。
实施例5 外消旋2-氨基-4-甲基戊醇的去消旋化合成(R)-2-氨基-4-甲基戊醇
(1)蛋白的表达纯化:按工程菌培养与蛋白纯化标准程序对β-氨基醇脱氢酶(A113G/E114A/N261M,SEQ ID NO.4),NADH氧化酶(NOX)和ω-转氨酶进行表达纯化,获得纯蛋白。同样的,所述β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a为表达载体,大肠杆菌BL21(DE3)为表达宿主,经由发酵培养制得。
(2)反应体系的配置及去消旋化反应:反应体系为2mL,含有10mM外消旋底物2-氨基-4-甲基戊醇,0.5mM NAD
检测结果表明,外消旋2-氨基-4-甲基戊醇的去消旋化合成(R)-2-氨基-4-甲基戊醇的ee值>99%,转化率>99%。
实施例6 外消旋2-氨基戊醇的去消旋化合成(R)-2-氨基戊醇
(1)蛋白的表达纯化:按工程菌培养与蛋白纯化标准程序对β-氨基醇脱氢酶(A113G/E114A/N261M,SEQ ID NO.4),NADH氧化酶(NOX)和ω-转氨酶进行表达纯化,获得纯蛋白。同样的,所述β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a为表达载体,大肠杆菌BL21(DE3)为表达宿主,经由发酵培养制得。
(2)反应体系的配置及去消旋化反应:反应体系为2mL,含有10mM外消旋底物2-氨基戊醇,0.5mM NAD
检测结果表明,外消旋2-氨基戊醇的去消旋化合成(R)-2-氨基戊醇的ee值>99%,转化率>99%。
实施例7 外消旋2-氨基-3-苯基丙醇的去消旋化合成(R)-2-氨基-3-苯基丙醇
(1)蛋白的表达纯化:按工程菌培养与蛋白纯化标准程序对β-氨基醇脱氢酶(A113G/E114A/P146A/N261M,SEQ ID NO.5),NADH氧化酶(NOX)和ω-转氨酶进行表达纯化,获得纯蛋白。同样的,所述β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a为表达载体,大肠杆菌BL21(DE3)为表达宿主,经由发酵培养制得。
(2)反应体系的配置及去消旋化反应:反应体系为2mL,含有10mM外消旋底物2-氨基-3-苯基丙醇,0.5mM NAD
检测结果表明,外消旋2-氨基-3-苯基丙醇的去消旋化合成(R)-2-氨基-3-苯基丙醇的ee值>99%,转化率为95.6%。
实施例8 外消旋2-氨基-4-苯基丁醇的去消旋化合成(R)-2-氨基-4-苯基丁醇
(1)蛋白的表达纯化:按工程菌培养与蛋白纯化标准程序对β-氨基醇脱氢酶(A113G/E114A/P146A/N261M/I294G,SEQ ID NO.6),NADH氧化酶(NOX)和ω-转氨酶进行表达纯化,获得纯蛋白。同样的,所述β-氨基醇脱氢酶、NADH氧化酶和ω-转氨酶是以pET28a为表达载体,大肠杆菌BL21(DE3)为表达宿主,经由发酵培养制得。
(2)反应体系的配置及去消旋化反应:反应体系为2mL,含有10mM外消旋底物2-氨基-4-苯基丁醇,0.5mM NAD
检测结果表明,外消旋2-氨基-4-苯基丁醇的去消旋化合成(R)-2-氨基-4-苯基丁醇的ee值>99%,转化率为90.0%。
综合实施例3-8可见,本发明以外消旋β-氨基醇为原料,利用工程化β-氨基醇脱氢酶将(S)-β-氨基醇氧化脱氨生成对应的α-羟基酮,再利用NADH氧化酶实现该过程的辅酶再生,使(R)-β-氨基醇不能反应而得以保留;随后生成的α-羟基酮进一步被ω-转氨酶还原胺化为(R)-β-氨基醇,进而实现了外消旋β-氨基醇的一锅法去消旋化,得到手性纯(R)-β-氨基醇,转化率≥90%,光学纯度可达99%以上。本发明提供的(R)-β-氨基醇制备方法具有立体选择性强、原子经济性高等显著特点,具有重要的应用价值。
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 一种纯水中一步法制备消旋体芳基邻二醇的方法
- 一种氨基聚醚多元醇及其制备方法、一种聚氨酯硬质泡沫及其制备方法
- 一种生物酶法去消旋化制备L-草铵膦的方法、草铵膦脱氢酶突变体及应用
- 一种ω-转氨酶的应用及生物酶法去消旋化制备L-草铵膦的方法
