一种体外诱导胚胎干细胞定向分化为心肌细胞的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本申请涉及细胞分化技术领域和心肌组织再生医学技术领域,尤其是涉及一种体外诱导胚胎干细胞定向分化为心肌细胞的方法,本申请还涉及一种含有KDM5抑制剂的诱导分化培养基,及利用该诱导分化培养基诱导胚胎干细胞体外定向分化心肌细胞的方法。
背景技术
胚胎干细胞(Embryonic stem cell,ESCs,简称ES细胞)具有可以分化为任何体细胞的潜能,导致人们对胚胎干细胞在再生医学、药物发现、体外疾病建模和发育生物学领域的应用寄予厚望。
心脏肌肉是身体中再生能力最差的组织之一。现有研究表明,成年哺乳动物的心脏不包含心脏干细胞,而且哺乳动物的心肌细胞(Cardiomyocyte,CMs)在出生后不久便丧失自我更新的潜力,再生能力受到限制。因此,由ES细胞衍生的心肌细胞为心脏疾病的心肌细胞损伤修复和药物筛选提供了材料。然而,目前常用的小分子抑制剂诱导心肌细胞的方法效率不稳定,不利于大规模的心肌细胞生产。
因此,提供一种方法简单,操作简单,并且能够大幅度提高人胚胎干细胞体外定向分化心肌细胞的诱导方法以解决现有技术的不足,甚为必要。
发明内容
本申请的目的在于克服上述现有技术的不足之处而提供一种体外诱导胚胎干细胞定向分化为心肌细胞的方法。本申请的方法显著提高了胚胎干细胞分化为心肌细胞的效率。
为实现上述目的,本申请采取的技术方案为:
第一方面,本申请提供了一种KDM5抑制剂在诱导胚胎干细胞体外定向分化心肌细胞中的应用。
在诱导胚胎干细胞体外定向分化心肌细胞过程中,本申请发明人经过大量研究及试验发现,添加KDM5抑制剂作为额外添加的诱导因子均能够明显提高TNNT2阳性细胞的比例,说明KDM5抑制剂可以提高胚胎干细胞分化为心肌细胞的效率。
作为本申请所述应用的优选实施方式,所述KDM5抑制剂包括CPI455。
利用CPI455介导的KDM5抑制,可以提高胚胎干细胞(ES细胞)在定向分化为心肌细胞诱导过程中的H3K4me3整体水平,进而显著提高了胚胎干细胞分化为心肌细胞的效率。
作为本申请所述应用的优选实施方式,所述KDM5抑制剂配制成诱导分化培养基,在诱导分化培养基中KDM5抑制剂的质量浓度为5-10μM,优选地,所述KDM5抑制剂的质量浓度为5μM。
在胚胎干细胞定向分化为心肌细胞的过程中,采用5μM CPI455和10μM CPI455作为额外添加的诱导因子均能够明显提高TNNT2阳性细胞的比例,但是5μMCPI455的效果更佳。
作为本申请所述应用的优选实施方式,所述KDM5抑制剂的使用时间为诱导定向分化时间的第0天至第15天,优选地,所述KDM5抑制剂的使用时间为诱导定向分化时间的第0天至第7天。
第二方面,本申请提供了一种诱导分化培养基,所述诱导分化培养基包括第一分化培养基、第二分化培养基和第三分化培养基;
所述第一分化培养基包括基础培养基、5-10μM CPI455和6μM WNT信号通路激活剂CHIR99021;
所述第二分化培养基包括基础培养基、5-10μM CPI455和2.5μM WNT信号通路抑制剂IWP2;
所述第三分化培养基包括基础培养基、200μg/mL抗坏血酸和10μg/mL胰岛素。
本申请通过设计的诱导分化培养基可以高效获得能够自主跳动的心肌细胞。
优选地,所述第三分化培养基还含有5-10μM CPI455。添加CPI455可以促进TNNT2阳性细胞的产量,说明CPI455显著提高了胚胎干细胞分化为心肌细胞的效率。
第三方面,本申请提供了上述诱导分化培养基在诱导胚胎干细胞体外定向分化心肌细胞中的应用。
第四方面,本申请提供了一种体外诱导胚胎干细胞定向分化为心肌细胞的方法,所述方法利用上述诱导分化培养基培养获得心肌细胞。
作为本申请所述方法的优选实施方式,所述方法包括以下步骤:
使用第一分化培养基将胚胎干细胞诱导分化至中胚层;使用第二分化培养基对所述中胚层进行下一步诱导分化为心肌中胚层;使用第三分化培养基对心肌中胚层进行下一步诱导分化,获得心肌细胞。
作为本申请所述方法的优选实施方式,所述方法包括以下具体步骤:
1)向生长状态良好、细胞密度达到90%以上的胚胎干细胞中加入第一分化培养基培养24小时,诱导细胞往中胚层分化;并于诱导培养的第2天至第3天,切换成含有CPI455的RPMI-1640维持培养基孵育48小时,以维持中胚层细胞的状态。
2)在诱导培养的第3天至第4天,将培养基更换为第二分化培养基,诱导细胞往心肌中胚层分化;并于诱导培养的第5天至第6天将培养基更换为含有CPI455的RPMI-1640维持培养基,孵育48小时以维持心肌中胚层细胞的状态。
3)诱导培养的第7天至第15天,使用第三分化培养基,进一步诱导分化为心肌细胞。
优选地,含有CPI455的RPMI-1640维持培养基中CPI455的浓度为5μM。
每种分化培养基使用结束之后,均要用含5μM CPI455的RPMI-1640维持培养基孵育细胞48小时,以维持细胞数量和特性,再更换下一种分化培养基。
作为本申请所述方法的优选实施方式,所述胚胎干细胞为人胚胎干细胞,优选为H1人胚胎干细胞。
在一些具体实施例中,所述步骤1)中,利用ES细胞的生长培养基(meTSR1培养基)将H1人胚胎干细胞接种至提前包被了Matrigel胶的6孔板中进行培养和扩增,然后将生长至对数生长期的H1人胚胎干细胞以1:6的比例进行传代。
所述方法包括以下具体步骤:
用Accutase细胞解离试剂消化处理处于对数生长期且细胞状态良好的H1人胚胎干细胞,于37℃培养箱中处理3分钟;然后用等体积的新鲜DMEM-F12培养基稀释Accutase,将干细胞克隆团吹散成单细胞,1000rpm离心3min;吸走上清,用含10μM的ROCK抑制剂Y27632的mTeSR1培养基重悬细胞,并将其接种于提前用Matrigel胶包被的6孔板中,再置于37℃、5% CO
在所有具体实施例中,利用H1人胚胎干细胞体外定向诱导分化心肌细胞的过程均在12孔板中进行,具体步骤包括以下:将使用Accutase消化获得的单细胞悬液,用含10μMROCK抑制剂Y27632的mTeSR1培养基接种于已提前用Matrigel胶包被的12孔板中,然后置于37℃、5% CO
本申请对采用胚胎干细胞体外定向分化心肌细胞方法获得的心肌细胞进行心肌诱导效率的检测,检测时间为体外定向诱导分化的第15天。
优选地,使用流式细胞术和免疫荧光技术对心肌诱导效率进行检测。
优选地,所述检测使用心肌细胞特异性标记物TNNT2进行流式检测和免疫荧光染色。
通过流式细胞术检测Day15的TNNT2阳性细胞比例。
由结果可知,额外添加5μM CPI455作为诱导因子能够明显提高H1人胚胎干细胞定向心肌细胞分化的效率。
另一方面,通过免疫荧光技术分别分析Day15时心肌细胞特异性标志物TNNT2的表达水平。由结果可知,与对照组相比,增加5μM CPI455作为诱导因子的H1细胞经15天定向心肌诱导后,TNNT2的表达明显增强。
与现有技术相比,本申请具有以下有益效果:
本申请提供的以CPI455为诱导因子调节诱导人胚胎干细胞往心肌细胞方向分化的方法能够为干细胞来源的心肌细胞的生产提供有效可行的新方法,且效果稳定,有利于大规模生产。本申请通过CPI455介导的KDM5抑制,提高人胚胎干细胞在定向心肌诱导过程中心肌特异性相关基因的H3K4me3整体水平,进而显著提高了胚胎干细胞分化为心肌细胞的效率,并且由本申请的方法得到心肌细胞纯度较高,应用前景较广,可为研究早期心脏发育、心脏疾病的再生修复以及药物筛选提供材料,有较广泛的应用前景。
附图说明
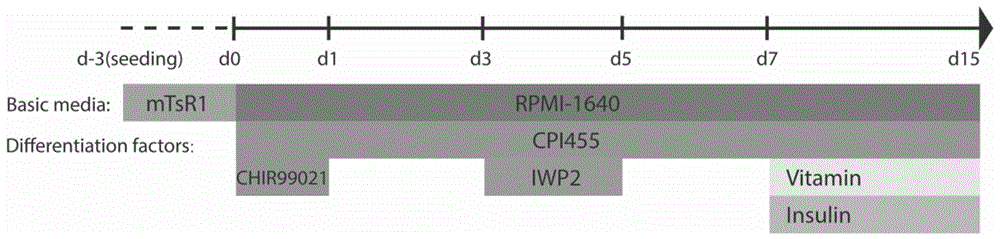
图1为实施例1中诱导分化培养基和使用时间窗口的流程示意图(以确定H1细胞定向心肌分化过程中CPI455的最佳使用浓度);
图2为实施例1在定向分化第15天时通过流式细胞术分析TNNT2阳性心肌细胞细胞的比例结果图;
图3为实施例2中诱导分化培养基和使用时间窗口的流程示意图(以确定CPI455的最佳使用时间);
图4为实施例2在定向分化第15天时通过流式细胞术分析TNNT2阳性心肌细胞细胞的比例结果图;
图5为实施例3中提供的一种优选的诱导分化培养基和使用时间窗口的流程示意图;
图6为实施例3提供的不同诱导天数的细胞形态(明场视野物镜5×);
图7为实施例3中利用CPI455作为主要诱导因子之一诱导ES细胞向心肌细胞分化的第15天时通过流式细胞术分析TNNT2阳性细胞的比例结果图;
图8为实施例3中添加CPI455作为诱导因子诱导ES细胞向心肌细胞分化的第15天时通过免疫荧光技术分别分析TNNT2阳性细胞的比例结果图;
图9为实施例3中添加CPI455作为诱导因子诱导ES细胞向心肌细胞分化的第15天时的代表性细胞视野录像图。
具体实施方式
为更好的说明本申请的目的、技术方案和优点,下面将结合附图和具体实施例对本申请作进一步说明。
在以下实施例和对比例中,除非特别指明,本申请中所用到的细胞,来自中国科学院广州生物医药与健康研究所,本申请中所用的试剂均为分析纯级试剂。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是,所述第一分化培养基、第二分化培养基和第三分化培养基并非是对培养基的个数、组成或种类的限定,而是对于不同培养阶段的区分,第一分化培养基为第一阶段采用的分化培养基,第二分化培养基为第二阶段采用的分化培养基,第三分化培养基为第三阶段采用的分化培养基。在没有对其组成进行具体限定的情况下,其可以理解为普通的分化培养基,所述出现的维持培养基同此理解。
实施例1、一种体外诱导胚胎干细胞定向分化为心肌细胞的方法
本实施例提供了诱导胚胎干细胞体外定向分化心肌细胞的方法,包括以下步骤:
(1)用Matrigel胶包被12孔培养板:将200μl Matrigel胶(CORNING品牌,货号354277)加入到30mL新鲜DMEM-F12培养基(Gibco品牌,货号C11330500BT)中,混匀,得到Matrigel胶稀释液。取0.5mL稀释液加入12孔板中,并将该培养皿放置于37℃、5% CO
(2)H1人胚胎干细胞的培养、传代和消化:使用mTeSR1培养基(STEMCELL品牌,货号85850)进行H1人胚胎干细胞培养。细胞传代过程中,使用细胞解离试剂Accutase消化处理处于对数生长期(细胞密度约为85-90%)的H1人胚胎干细胞,于37℃培养箱中孵育3分钟;然后用等体积的新鲜DMEM-F12培养基稀释Accutase,将干细胞克隆团吹散成单细胞,1000rpm离心3分钟;随后,弃上清液,保留细胞沉淀,并用含10μM ROCK抑制剂Y27632的mTeSR1培养基重悬细胞沉淀,将细胞悬液接种至提前用Matrigel胶包被的12孔培养板中,于37℃、5% CO
(3)H1人胚胎干细胞诱导分化前的准备(Day(-3)~Day(-1)):以每孔4×10
(4)H1人胚胎干细胞的诱导分化Day0:待细胞密度长至90%左右,定义为Day0,使用现配的第一分化培养基开始进行定向分化至中胚层,第一分化培养基为含有5μM(或10μM)CPI455以及6μM CHIR99021的RPMI-1640培养基。为了更准确的分析CPI455对H1人胚胎干细胞定向心肌分化的效果,设置相应对照组H1人胚胎干细胞同步进行诱导分化,对照组H1人胚胎干细胞在整个诱导分化过程中均仅不使用CPI455,其余条件保持不变。在Day0天,对照组使用含有6μMCHIR99021的RPMI-1640培养基。第一分化培养基的处理时间为20-24小时。
(5)诱导分化Day1:吸走第一分化培养基,更换为维持培养基并培养44-48小时。维持培养基的成分为含5μM(或10μM)CPI455的RPMI-1640培养基(以保持中胚层细胞的数量和特性)。同样地,对照组则更换为新鲜的RPMI-1640培养基培养44-48小时。每天更换新鲜培养基。
(6)诱导分化Day3:吸走维持培养基,更换为第二分化培养基对中胚层进行诱导分化为心肌中胚层,第二分化培养基为含有5μM(或10μM)CPI455和2.5μMIWP2的RPMI-1640基础培养基。同样地,对照组的培养基更换成不含CPI455的第二分化培养基,即只含2.5μMIWP2的RPMI-1640培养基。第二分化培养基的处理时间为44-48小时,每天更换新鲜培养基。
(7)诱导分化Day5:吸走第二分化培养基,更换为(5)中描述的维持培养基,并培养44-48小时。维持培养基的成分为含5μM(或10μM)CPI455的RPMI-1640培养基(保持心肌中胚层细胞的数量和特性)。同样地,对照组则更换为新鲜的RPMI-1640培养基培养44-48小时。每天更换新鲜培养基。
(8)诱导分化Day7:吸走维持培养基,更换为第三分化培养基并进行下一步诱导分化为心肌细胞,所述第三分化培养基为含有200μg/mL抗坏血酸和10μg/mL胰岛素以及5μM(或10μM)CPI455的RPMI-1640培养基。同样地,对照组则更换为仅不含CPI455的第三分化培养基。每天更换新鲜培养基,直至诱导分化Day15,可收集细胞并进行下一步的心肌细胞鉴定检测。
(9)H1人胚胎干细胞定向心肌分化的效率的检测:通过流式细胞术分析Day15的TNNT2阳性细胞比例,并与仅不含CPI455的诱导对照组作对比,结果参照附图2。
此结果表明:在H1人胚胎干细胞定向心肌分化过程中,5μM CPI455和10μMCPI455作为额外添加的诱导因子均能够明显提高TNNT2阳性细胞的比例,但是5μMCPI455的效果更佳。
本申请诱导胚胎干细胞体外定向分化心肌细胞的方法中使用的第一分化培养基、维持分化培养基、第二分化培养基和第三分化培养基及其使用时间窗口如图1所示。
实施例2、一种体外诱导胚胎干细胞定向分化为心肌细胞的方法
本实施例提供了诱导胚胎干细胞体外定向分化心肌细胞的方法,分别设置对照组(整个分化过程仅不使用CPI455)、Day0-3组(只在分化过程中第0-3天使用CPI455)、Day0-5组(只在分化过程中第0-5天使用CPI455)、Day0-7组(只在分化过程中第0-7天使用CPI455)和Day0-15组(在分化过程中全程使用CPI455),以确定H1人胚胎干细胞定向心肌分化过程中CPI455的最佳使用时长。
诱导胚胎干细胞体外定向分化心肌细胞的方法包括以下步骤:
(1)H1人胚胎干细胞诱导分化前的准备(Day(-3)~Day(-1)):以每孔4×10
(2)H1人胚胎干细胞的诱导分化Day0:待细胞密度长至90%左右,定义为Day0,使用现配的第一分化培养基开始进行定向分化至中胚层细胞,各实验组的第一分化培养基为含有5μM CPI455以及6μM CHIR99021的RPMI-1640培养基,相应对照组的第一分化培养基为含有6μM CHIR99021的RPMI-1640培养基。第一分化培养基的处理时间为20-24小时。
(3)诱导分化Day1:移除第一分化培养基,更换为维持培养基并培养44-48小时。实验组的维持培养基的成分为含5μM CPI455的RPMI-1640培养基(保持中胚层细胞的数量和特性),对照组的维持培养基则是新鲜的RPMI-1640培养基。每天更换新鲜培养基。
(4)诱导分化Day3:移除维持培养基,更换为第二分化培养基对中胚层进行诱导分化为心肌中胚层,并培养44-48小时,每天更换新鲜培养基。其中,Day0-5组、Day0-7组以及Day0-15组的第二分化培养基为含5μM CPI455和2.5μM IWP2的RPMI-1640基础培养基,对照组和Day0-3组的第二分化培养基为含只含2.5μMIWP2的RPMI-1640培养基。
(5)诱导分化Day5:移除第二分化培养基,更换为(3)中描述的维持培养基,并培养44-48小时。其中,在这一阶段中,Day0-7组和Day0-15组的维持培养基的成分为含5μMCPI455的RPMI-1640培养基(保持心肌中胚层细胞的数量和特性),对照组、Day0-3组和Day0-5组的维持培养基为新鲜的RPMI-1640培养基培养44-48小时。每天更换新鲜培养基。
(6)诱导分化Day7:吸走维持培养基,更换为相应的第三分化培养基并进行下一步诱导分化为心肌细胞。其中,Day0-15组的第三分化培养基为含有5μMCPI455、200μg/mL抗坏血酸和10μg/mL胰岛素的RPMI-1640培养基,对照组、Day0-3组、Day0-5组以及Day0-7组则更换为仅不含CPI455的第三分化培养基。每天更换新鲜培养基,直至诱导分化的Day15。
(7)H1人胚胎干细胞定向心肌分化的效率的检测:通过流式细胞术检测Day15时各组内的TNNT2阳性细胞比例,并与仅不含CPI455的诱导对照组作对比,结果参照附图4。
结果表明:在H1人胚胎干细胞定向心肌分化过程中的第0-7天额外使用5μMCPI455能够极显著提高TNNT2阳性心肌细胞的比例。此外,定向心肌分化的全程(第0-15天)使用5μM CPI455虽可促进TNNT2阳性心肌细胞的产量,但会造成相应的CPI455浪费。
本申请诱导胚胎干细胞体外定向分化心肌细胞的方法中使用的第一分化培养基、维持分化培养基、第二分化培养基和第三分化培养基及其使用时间窗口如图3所示。
实施例3、一种优选的诱导胚胎干细胞体外定向分化心肌细胞的方法
本实施例提供了诱导胚胎干细胞体外定向分化心肌细胞的方法(参考图5),包括以下步骤:
(1)提前包被用于培养H1人胚胎干细胞和定向诱导生产心肌细胞的12孔培养板:具体地,将200μl Matrigel胶(CORNING品牌,货号354277)加入到30mL新鲜DMEM-F12培养基(Gibco品牌,货号C11330500BT)中,混匀,得到Matrigel胶稀释液。取0.5mL稀释液加入12孔板中,并将该培养皿放置于37℃,5% CO
(2)H1人胚胎干细胞的传代和消化:用Accutase细胞解离试剂消化处理处于对数生长期(细胞密度约为85-90%)且细胞状态良好的H1人胚胎干细胞,于37℃培养箱中孵育3分钟;然后用等体积的新鲜DMEM-F12培养基稀释Accutase,将干细胞克隆团吹散成单细胞,1000rpm离心3分钟;弃上清液,保留细胞沉淀。用现配的含有10μM ROCK抑制剂Y27632的mTeSR1培养基重悬细胞沉淀。
(3)H1人胚胎干细胞诱导分化前的准备(Day(-3)~Day(-1)):以4×10
(4)H1人胚胎干细胞的诱导分化Day0天:待细胞密度长至90%左右,细胞状态良好,定义为Day0,使用现配的第一分化培养基开始进行定向分化至中胚层细胞,第一分化培养基为含有5μM CPI455和6μM CHIR99021的RPMI-1640培养基。为了更准确的分析CPI455对H1人胚胎干细胞定向心肌分化的效果,设置相应对照组H1人胚胎干细胞同步进行诱导分化,对照组H1人胚胎干细胞在整个诱导分化过程中不接触CPI455,使用不含CPI455的第一分化培养基,即只含有6μMCHIR99021的RPMI-1640培养基(将CPI455更换为相同体积的DMSO)。第一分化培养基的处理时间为24小时。
(5)诱导分化Day1:吸走旧的培养基,更换为维持培养基并培养44-48小时,以保持中胚层细胞的数量和特性。维持培养基的成分为含5μM CPI455的RPMI-1640培养基。同样地,对照组H1人胚胎干细胞则更换为新鲜的RPMI-1640培养基培养44-48小时。每天更换新鲜培养基。
(6)诱导分化Day3:吸走旧的培养基,更换为第二分化培养基并孵育44-48小时,对所述中胚层进行下一步诱导分化为心肌中胚层。所述第二分化培养基的成分为含有5μMCPI455和2.5μM IWP2的RPMI-1640培养基。同样地,对照组的第二分化培养基为只含2.5μMIWP2的RPMI-1640培养基。每天更换新鲜培养基。
(7)诱导分化Day5:吸走旧的培养基,更换为维持培养基并培养44-48小时,以保持所获得的心肌中胚层细胞的数量和特性。维持培养基的成分与上述(5)一致,为含5μMCPI455的RPMI-1640培养基,对照组的维持培养基为RPMI-1640培养基。每天更换新鲜的培养基。
(8)诱导分化Day7:吸走旧的培养基,更换为第三分化培养基并进行下一步诱导分化为心肌细胞,所述的第三分化培养基包括基础培养基RPMI-1640,还包括200μg/mL抗坏血酸和10μg/mL胰岛素。由于第三分化培养基不含CPI455,对照组H1人胚胎干细胞也更换为同款的第三分化培养基即可。第三分化培养基应每天更换以保持充足的营养成分,直至诱导分化Day15。收集细胞并进行心肌细胞的鉴定及检测。不同诱导分化时间节点的细胞形态可参照附图6。诱导分化第15天可观察到添加CPI455组的心肌细胞跳动频率明显比对照组强,结果参照图9。不同诱导天数的细胞形态(明场视野物镜5×)如图6所示。
(9)H1人胚胎干细胞定向心肌分化的效率的检测:通过流式细胞术检测Day15的TNNT2阳性细胞比例,结果参照图7。由结果可知,与对照组相比,额外添加5μMCPI455作为诱导因子能够明显提高H1人胚胎干细胞向心肌细胞分化的效率。
另一方面,通过免疫荧光技术分别分析Day15时心肌细胞特异性标志物TNNT2的表达水平,结果参照图8。由结果可知,与对照组相比,增加5μM CPI455作为诱导因子的H1人胚胎干细胞经15天定向心肌诱导后,TNNT2的表达明显增强。
最后所应当说明的是,以上实施例仅用以说明本申请的技术方案而非对本申请保护范围的限制,尽管参照较佳实施例对本申请作了详细说明,本领域的普通技术人员应当理解,可以对本申请的技术方案进行修改或者等同替换,而不脱离本申请技术方案的实质和范围。
- 诱导胚胎干细胞定向分化为心肌细胞的诱导剂及培养基
- 诱导胚胎干细胞定向分化为心肌细胞的诱导剂及培养基
