双特异性蛋白质及其制备方法
文献发布时间:2024-04-18 19:58:26
本申请是申请日为2017年7月19日,申请号为201780044935.1,发明名称为“双特异性蛋白质及其制备方法”的分案申请。
技术领域
本发明涉及具有高异源二聚化率的双特异性蛋白质以及制备双特异性蛋白质的方法。
背景技术
双特异性抗体(BsAb)是具有两个能够识别两种不同类型靶标抗原的抗体结合部位的抗体,是能够同时结合两种不同靶标抗原或其抗原结合片段的抗体的总称。该特征使得能够建立无法使用常规单克隆抗体的治疗策略。双特异性抗体很少天然存在,并且大部分是以人工构建以同时结合两种不同类型的生物靶标。双靶向能力可为这样的BsAb提供尚未由单特异性抗体(MsAbs)完成的新应用领域。当涉及到治疗目的时,在(1)将免疫细胞可靠地募集到靶细胞附近、(2)抑制或激活靶细胞中两个分开较远的信号传导通路以产生协同效应,以及(3)将治疗物质、药物、毒素等特异性和调节性递送至靶细胞的方面引起了相当大的关注。
已经开发了各种与BsAb相关的技术(45种不同的形式)。这些技术在结构基础上分为四类:第一、通过各种方法的重链异源双特异性,所述方法包括结构互补(也称为Knob-into-Hole或简单KiH)、静电转向效应和CH3结果域改组(称为SEEDbody
例如,Zymeworks的美国专利No.2013-892198A公开了在Fc结构域中具有突变的免疫球蛋白链的杂聚物结构,特别指出可以通过将涉及二硫键的半胱氨酸残基修饰为带电荷的氨基酸以发挥电相互作用来构建杂聚物结构的抗体。
构建双特异性抗体的常规技术存在如下问题。
首先,存在不合需要的重链组合。当分别源自靶向不同表位的两种抗体的重链(A和B)彼此随机组合时,形成相同来源的两种组合(AA和BB)和不同来源的一种组合(AB或BA)。来自相同来源的重链之间的组合在构建双特异性抗体中充当不合需要的杂质,降低双特异性抗体的纯度并且需要去除所述组合的过程。因此,它们可能具有不利的效果(诸如引起抗体的分离和纯化困难、引起不希望的免疫应答或信号转导以引起副作用等)。因此,持续存在仅形成异源的重链之间的组合以使得能够在同源的重链之间没有组合或组合水平相当受限的需要。
其次,虽然同源的轻链和重链彼此特异性结合,但发生的情况是,彼此结合的轻链和重链是异源的。双特异性抗体靶向两种不同的表位。每个表位可以被相同来源的轻链和重链组合的抗体识别。通过来自异源的轻链和重链的组合产生的抗体可识别除所希望的两个表位之外的新表位,充当杂质使得难以分离和纯化目的抗体,并引起副作用。因此,双特异性抗体的产生需要正确的轻链和重链对的组合,而轻链和重链的非特异性组合不会发生或以不显著的水平发生。
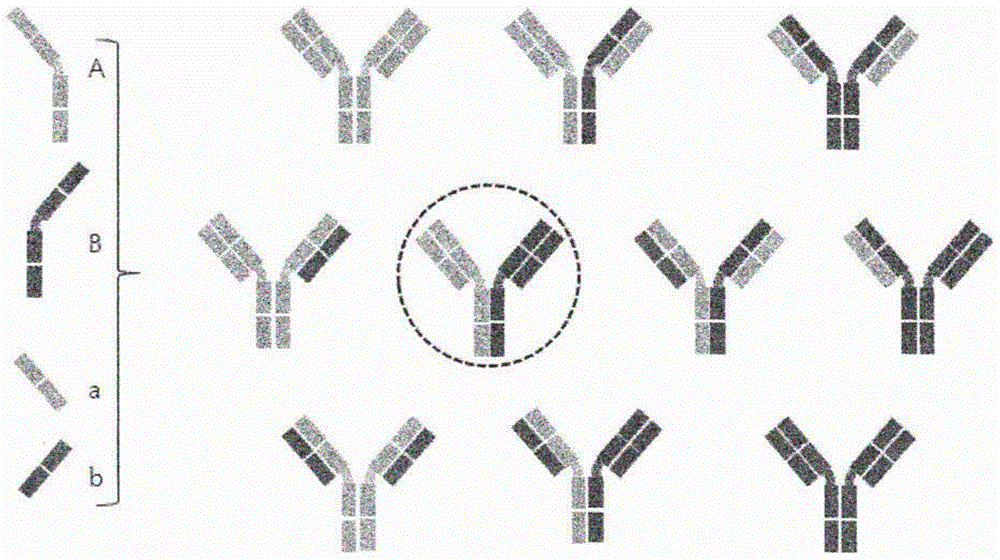
考虑到提供双特异性抗体的上述问题,构建双特异性抗体的要求总结如下。当用来自分别识别两种不同表位的两种不同抗体的轻链和重链构建双特异性抗体时,总共十种组合是可能的,如图1所示。其中,由虚线圆圈标记的组合满足以下要求:(1)源自不同抗体的重链彼此组合,和(2)源自相同抗体的轻链和重链彼此偶联。其他九种组合不应该形成或应该以最低水平形成。
WO2014142591是本发明人的在先专利申请,其介绍了“在疏水相互作用位点内引入电相互作用的蛋白质及其制备方法”。在该专利申请中公开了一种蛋白质或抗体,其具有在其疏水相互作用位点中引入的电相互作用,其中,电相互作用是通过带正电荷的物质和带负电荷的物质上的正电荷和负电荷而得到的,所述物质是从在疏水相互作用位点选择的一对疏水氨基酸改变的。沿着本发明,本发明人进行的深入和彻底的研究结果发现可以在非疏水相互作用位点中使用静电相互作用形成双特异性抗体,这在先前的专利申请中未被考虑并且即使通过偶联对之间的大小依赖性偶联和/或氨基酸改变(交换)也可以高产率构建。
[现有技术文献]
[专利文献]
(专利文献1)韩国专利号:10-2014-0019385A(2014年2月14日)
发明内容
技术问题
为了解决上述问题,本发明提供了一种高纯度的双特异性抗体及其制备方法。
一个实施方案提供了二聚体,其包含抗体的第一CH3结构域和第二CH3结构域,或包含CH3结构域的Fc区,其中
突变第一CH3结构域和第二结构域,使得选自第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对中的至少一个被下列突变的至少一个修饰:
(1)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸被带正电荷的氨基酸取代,且另一个氨基酸被带负电荷的氨基酸取代的突变;
(2)在CH3结构域之间的至少一个氨基酸对中的氨基酸相互交换的突变;和
(3)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸被大疏水性氨基酸取代,而另一个氨基酸被小疏水性氨基酸取代的突变。
第一CH3结构域和第二CH3结构域可以源自相同或不同类型的抗体(免疫球蛋白)。
另一个实施方案提供了编码经修饰的CH3结构域或包含该经修饰的CH3结构域的经修饰的Fc区的核酸分子、携带该核酸分子的重组载体,和细胞中含有该重组载体的重组细胞。
如本文所用,在表述“至少一个氨基酸对,一个氨基酸......和另一个氨基酸......”中,术语“一个氨基酸”和“另一个氨基酸”分别表示在一个或更多个氨基酸对的每一对中的两个氨基酸的一个氨基酸和另一个氨基酸(下文中将应用相同的定义)。
另一个实施方案提供了用于靶向两种不同类型靶的双特异性蛋白质,所述双特异性蛋白质包含第一CH3结构域或包含第一CH3结构域的第一Fc区和第二CH3结构域或包含第二CH3结构域的第二Fc区,其中,突变第一CH3结构域和第二CH3结构域,使得选自第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对中的至少一个被下列突变的至少一个修饰:
(1)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸被带正电荷的氨基酸取代,而另一个氨基酸被带负电荷的氨基酸取代的突变;
(2)在CH3结构域之间的至少一个氨基酸对中的氨基酸相互交换的突变;和
(3)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸被大疏水性氨基酸取代,而另一个氨基酸被小疏水性氨基酸取代的突变。
在步骤(1)中被带相反电荷的氨基酸取代的氨基酸对可以是疏水相互作用下的氨基酸和/或非疏水相互作用下的氨基酸。在一个实施方案中,构成氨基酸对的两个氨基酸中的至少一个可以不是疏水性氨基酸(即亲水性氨基酸)。通过步骤(1)的带相反电荷的氨基酸取代而引入的静电相互作用可有助于改善Fc区之间异源二聚体的形成。
如本文所用,术语“异源二聚体”是指融合体,其中的两种不同的蛋白质彼此偶联并且旨在包括其中的靶向各自不同靶标的两种蛋白质彼此偶联的任何双特异性蛋白质(例如,双特异性抗体)等。
步骤(2)中的氨基酸转换(交换)可以在形成Fc区或CH3域中的氨基酸-氨基酸键的任何氨基酸对中进行,并且,例如,在通过静电相互作用、疏水相互作用、基于氨基酸大小差异的相互作用以外的相互作用而结合的所有氨基酸对中选择的至少一个氨基酸对中进行。因此,在每个氨基酸对中(即,相互作用的氨基酸对中第一CH3结构域的氨基酸残基和第二CH3结构域的另一个氨基酸)彼此相互作用(例如,彼此结合)的两个氨基酸残基可相互交换以降低形成同源二聚体的可能性,因为在同源的CH3结构域之间氨基酸相互作用的相应位置存在相同的氨基酸使得它们之间的键合变得困难,从而有助于提高异源二聚化率(例如,当S364和K370的氨基酸对在第一结构域中经历S364K突变而在第二CH3结构域中经历K370S突变时,在同源CH3结构域之间没有相互作用,因为第364和370位两个氨基酸在第一CH3结构域中成为赖氨酸(K),在第二CH3结构域中成为丝氨酸(S),但只在异源CH3结构域之间发生相互作用以形成异源二聚体)。
用大小不同的氨基酸取代的步骤(3)改善了大氨基酸和小氨基酸之间的结构结合适宜性(即,将大氨基酸插入由小氨基酸建立的空余空间,从而提高了结合效率),结果提高了异源二聚化率。特别地,突变相互作用的氨基酸对,使得一个氨基酸被大疏水性氨基酸取代,而另一个氨基酸被小疏水性氨基酸取代,从而利用在大氨基酸之间或小氨基酸之间形成键的困难来最小化同源二聚化率(如果分别存在于两条相反的链中,大氨基酸则使两条链彼此远离以阻止二聚化,而如果存在于两条相反的链中,两个小氨基酸则由于它们之间的距离较长并且难以在期间相互作用而以低的可能性的相互作用)。相反,相比于预先突变氨基酸,一个CH3结构域或Fc中的大疏水性氨基酸与另一个CH3结构域或Fc中的小疏水性氨基酸在较近的距离内发生疏水相互作用,从而为异源二聚化提供了良好的条件。因此,在取代步骤中将要取代的大氨基酸和小氨基酸的大小不同的氨基酸均可以从疏水性氨基酸中选择。例如,大氨基酸可以是选自由色氨酸和苯丙氨酸组成的组中的至少一个,其都是疏水的。此外,所述小氨基酸可以是选自由丙氨酸、甘氨酸和缬氨酸组成的组中的至少一种,其全是疏水的。
包含突变Fc区或突变CH3结构域的双特异性蛋白质可选自靶向(例如,特异性识别和/或结合)两种不同类型靶标的任何类型的蛋白质。对于靶向,包含突变Fc区或突变CH3结构域的双特异性蛋白可包含两个能够分别靶向(特异性识别和/或结合)两种不同类型靶标的靶向结构域(例如,用于靶向第一靶标的第一靶向结构域和用于靶向第二靶标的第二靶向结构域)。靶向结构域可以分别以直接或间接(例如,通过接头)方式与突变Fc区或突变CH3结构域形成共价或非共价键(连接)。例如,包含突变Fc区或突变CH3结构域的双特异性蛋白质可以是选自下组中至少一个:双特异性抗体、双特异性抗体的抗原结合片段(例如,(scFv-Fc)2等)、双特异性抗体类似物(例如,纳米抗体、肽抗体、肽、aptide等),以及靶标特异性结合多肽和突变Fc区或突变CH3结构域的融合蛋白。
靶标特异性结合多肽可以是与生物靶标物质(存在于体内的任何化合物,包括蛋白质、核酸等)特异性结合的任何多肽,并且可以是选自例如下组中的至少一种多肽:抗体结合部(例如,重链和/或轻链的CDR或可变区)、单链Fv(scFv)、膜蛋白(例如,各种受体等)、膜蛋白胞外域和配体(例如,各种生长因子、细胞因子等)。在一个实施方案中,靶标特异性结合多肽和突变Fc区或突变CH3结构域的融合蛋白可以是选自下组中的至少一种:膜蛋白和突变Fc区或突变CH3结构域的融合蛋白、膜蛋白胞外域和突变Fc区或突变CH3结构域的融合蛋白、配体和突变Fc区或突变CH3结构域的融合蛋白,以及scFv和突变Fc区或突变CH3结构域的融合蛋白。
当包含突变Fc区或突变CH3结构域的双特异性蛋白质是抗体、抗体的抗原结合片段或抗体类似物时,靶向结构域可以是抗体结合部(例如,重链和/或轻链的CDR或可变区)。对于上述的靶标特异性结合多肽和突变Fc区或突变CH3结构域的融合蛋白,靶标特异性结合多肽可以选自下组中的至少一种:膜蛋白(例如各种受体)、膜蛋白胞外域、配体(例如,各种生长因子、细胞因子等)和抗体结合部(例如,重链和/或轻链的CDR或可变区)。
两种不同类型的靶标可以指两种不同类型的生物物质(例如,两种蛋白质)或一种生物物质(例如,一种蛋白质)内的不同区域。与包含非突变(野生型)Fc区或非突变CH3结构域的双特异性蛋白相比,包含突变Fc区或突变CH3结构域的双特异性蛋白的特征在于异源二聚化率的增加、同源二聚化的降低和/或稳定。
另一个实施方案提供双特异性抗体或其抗原结合片段,该双特异性抗体包含分别源自识别第一表位的抗体的重链和轻链的第一CH1结构域和第一C1(轻链恒定区)结构域和分别源自识别第二表位的抗体的重链和轻链的第二CH1结构域和第二CL结构域,其中,突变CH1结构域和CL结构域以含有至少一个下列突变:
组成选自第一CH1结构域和第一CL结构域之间分别形成氨基酸-氨基酸键的氨基酸对中的一个或更多对第一氨基酸对的两个氨基酸中的一个被带正电荷的氨基酸取代且另一个被带负电荷的氨基酸取代的突变;和
组成选自第二CH1结构域和第二CL结构域之间分别形成氨基酸-氨基酸键的氨基酸对中的一个或更多对第二氨基酸对的两个氨基酸中的一个被带正电荷的氨基酸取代且另一个被带负电荷的氨基酸取代的突变。
第一表位和第二表位可以存在于相应的不同蛋白质(抗体)中或存在于一种蛋白质(抗原)的不同(有区别的)区域中。
在根据一个实施方案的双特异性抗体或其抗原结合片段中,分别在第一CH1结构域和第二CH1结构域中取代的氨基酸具有相反的电荷,分别在第一CL结构域和第一CH1结构域中取代的氨基酸具有相反的电荷,以及分别在第二CL结构域和第二CH1结构域中取代的氨基酸具有相反的电荷。
例如,在双特异性抗体或其抗原结合片段中,
作为选自在第一CH1结构域和第一CL结构域之间分别形成氨基酸-氨基酸键的氨基酸对中的至少一对第一氨基酸对的一员,位于第一CH1结构域中的氨基酸,可以被带正电荷的氨基酸取代,而位于第一CL结构域中的另一员可以被与第一CH1结构域中被取代的氨基酸的电荷不同(即,负电荷)的氨基酸取代,和
作为选自在第二CH1结构域和第二CL结构域之间分别形成氨基酸-氨基酸键的氨基酸对中的至少一对第二氨基酸对的一员,位于第二CH1结构域中的氨基酸,可以被与第一CH1结构域中被取代的氨基酸的电荷不同(即,负电荷)的氨基酸取代,而位于第二CL结构域中的另一员可以被具有与第二CH1结构域中被取代的氨基酸的电荷不同(即,正电荷)的氨基酸取代。
在包含突变CH1 CL结构域的双特异性抗体或其抗原结合片段中,待取代的第一和第二氨基酸对可以相同或不同,在第一和第二氨基酸对中取代的带正电荷的氨基酸可以相同或不同,并且在第一和第二氨基酸对中取代的带负电荷的氨基酸可以相同或不同。包含突变CH1结构域和突变CL结构域的双特异性抗体的抗原结合片段可以是例如F(ab')2片段。包含突变CH1和突变CL结构域或其抗原结合片段的双特异性抗体靶向与包含非突变(野生型)CH1和CL结构域的双特异性抗体相同的表位,并且与包含非突变(野生型)CH1和CL结构域的双特异性抗体相比,表现出更高的重链(或重链可变区-CH1)-轻链二聚化速率和/或稳定性。
包含突变CH1和CL结构域的双特异性抗体可包含经修饰的CH3结构域,其包含源自识别第一表位的抗体的第一CH3结构域和源自识别第二表位的抗体的第二CH3结构域,或包含经修饰的CH3结构域的Fc区,其中,第一CH3结构域和第二CH3结构域具有下列突变的至少一个:
(1)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸被带正电荷的氨基酸取代,而另一个氨基酸被带负电荷的氨基酸取代的突变;
(2)在CH3结构域之间的至少一个氨基酸对中的氨基酸相互转换的突变;和
(3)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸被大疏水性氨基酸(例如,诸如色氨酸、苯丙氨酸的大疏水性氨基酸)取代,且另一个氨基酸被小疏水性氨基酸(例如,诸如丙氨酸、甘氨酸、缬氨酸等的小疏水性氨基酸)取代的突变。
与包含没有一个是突变的CH1结构域、CL结构域和Fc区或CH3结构域的双特异性蛋白质或抗体相比,包含突变CH1结构域、突变CL结构域和突变Fc区或经修饰的CH3结构域的双特异性蛋白质或双特异性抗体可表现出同源二聚化速率、靶向相同表位的重链(或重链可变区-CH1)和轻链之间的异源二聚化速率,和/或稳定性的改善。
与包含非突变(野生型)CH1和非突变CL结构域的双特异性抗体相比,包含突变CH1和突变CL结构域或其抗原结合片段的双特异性抗体靶向与包含非突变(野生型)CH1和非突变CL结构域的双特异性抗体相同的表位,并且表现出更高的重链(或重链可变区-CH1)-轻链二聚化速率和/或稳定性。
另一个实施方案提供了用于增强靶向不同靶标的双特异性蛋白质的异源二聚化的方法,所述双特异性蛋白质包含经修饰的CH3结构域或包含经修饰的CH3结构域的Fc区,所述方法包括以下突变引入步骤之一:
(1)用带正电荷的氨基酸取代选自在CH3结构域之间形成氨基酸-氨基酸键的至少一个氨基酸对中的两个氨基酸中的一个并用带负电荷的氨基酸取代另一个;
(2)将选自第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对的至少一个氨基酸对中的两个氨基酸相互转换;和
(3)用大疏水性氨基酸(例如,色氨酸、苯丙氨酸等)取代选自在第一CH3结构域和第二CH3结构域之间形成氨基酸键的氨基酸对的至少一个氨基酸对中的两个氨基酸中的一个并用小疏水性氨基酸(例如,丙氨酸、甘氨酸、缬氨酸等)取代另一个。
另一个实施方案提供了构建双特异性抗体或其抗原结合片段或用于增强靶向相同表位的重链(或重链可变区-CH1)和轻链之间的二聚化速率的方法,该方法包括以下CH1和CL域变异步骤:
用带正电荷的氨基酸取代选自在识别第一标为抗体的源自重链的第一CH3结构域和的第一CL结构域之间形成氨基酸-氨基酸键的氨基酸对中的至少一个氨基酸对的两个氨基酸残基中的一个,并用带负电荷的氨基酸取代另一个;和
用带正电荷的氨基酸取代选自在识别第二表位的抗体的源自重链的第二CH3结构域和第二CL结构域之间形成氨基酸-氨基酸键的氨基酸对中的至少一个氨基酸对的两个氨基酸残基中的一个,并用带负电荷的氨基酸取代另一个。
用于构建双特异性抗体或其抗原结合片段或用于增强重链(或重链可变区-CH1)与轻链之间的二聚化速率的方法,除了CH1和CL结构域突变步骤之外还可以包含至少下列CH3结构域突变步骤之一:
(1)用带正电荷的氨基酸取代选自在识别第一表位的抗体的源自重链的第一CH3结构域和识别第二表位的抗体的源自重链的第二CH3结构域之间形成氨基酸键的氨基酸-氨基酸对中的至少一个氨基酸对中的两个氨基酸中的一个并用带负电荷的氨基酸取代另一个;
(2)将选自第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对的至少一个氨基酸对中的两个氨基酸相互转换;和
(3)用大疏水性氨基酸(例如,色氨酸、苯丙氨酸等)取代选自在第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对的至少一个氨基酸对中的两个氨基酸中的一个,并用小疏水性氨基酸(例如,丙氨酸、甘氨酸、缬氨酸等)取代另一个。
另一个实施方案提供了用于构建双特异性抗体或其抗原结合片段并用于增强靶向不同靶标的双特异性抗体或其抗原结合片段的异源二聚化的方法,该方法包括以下突变引入步骤之一以引入至少一种突变到选自在第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对中至少一个氨基酸对中:
(1)用带正电荷的氨基酸取代选自在识别第一表位的抗体的源自重链的第一CH3结构域和识别第二表位的抗体的源自重链的第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对中的至少一个氨基酸对中的两个氨基酸中的一个并用带负电荷的氨基酸取代另一个;
(2)将选自第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对的至少一个氨基酸对中的两个氨基酸相互转换;和
(3)用大疏水性氨基酸(例如,色氨酸、苯丙氨酸等)取代在第一CH3结构域和第二CH3结构域之间形成氨基酸-氨基酸键的氨基酸对的至少一个氨基酸对中的两个氨基酸中的一个,并用小疏水性氨基酸(例如,丙氨酸、甘氨酸、缬氨酸等)取代另一个。
用于构建双特异性抗体或其抗原结合片段的方法可进一步包括以下CH1和CL结构域突变步骤:
用带正电荷的氨基酸取代选自在识别第一表位的抗体的源自重链的第一CH3结构域和第一CL结构域之间形成氨基酸键的氨基酸对中的至少一个氨基酸对中的两个氨基酸残基中的一个并用带负电荷的氨基酸取代另一个;和
用带正电荷的氨基酸取代选自在识别第二表位的抗体的源自重链的第二CH3结构域和第二CL结构域之间形成氨基酸键的氨基酸对中的至少一个氨基酸对中的两个氨基酸残基中的一个并用带负电荷的氨基酸取代另一个。
用于构建双特异性抗体或其抗原结合片段的方法可以增强源自识别不同表位的抗体的CH3结构域或Fc区之间的异源二聚化,以及源自识别相同表位的抗体的CH1结构域(重链)和CL结构域(轻链)之间的异源二聚化。
技术解决方案
下面,将给出本发明的详细描述。
本发明提供了包含Fc恒定区和/或Fab恒定区并靶向不同靶标的双特异性蛋白质及其构建方法,其中,氨基酸突变分别引入连接(融合)彼此不同的靶向结构域的Fc恒定区(CH3结构域),以增加与不同靶向结构域连接的Fc恒定区之间的偶联,从而增加与不同靶向结构域连接的Fc恒定区之间的异源二聚化速率,并降低与相同靶向结构域连接的Fc恒定区之间的同源二聚化速率;和/或
将氨基酸突变引入与彼此不同的靶向结构域连接的Fab恒定区,以增加与不同靶向结构域连接的Fab恒定区之间的偶联,从而在相同的靶向结构域之间和与其连接的Fab恒定区之间的二聚化速率。
由此可以以高产率生产具有不同靶向结构域的双特异性蛋白质。
本说明书中公开的抗体(重链和轻链)、CH1结构域、CL结构域、Fc区和CH3结构域中的氨基酸位置均按照EU编号系统[引自“Kabat et al.,Sequences of Proteins ofImmunological Interest,5th Ed.Public Health Service,National Institutes ofHealth,Bethesda,MD.(1991)”的EU-索引]编号给出,并且不同于序列表中序列位置的数字。
抗体可以是选自源自哺乳动物或鸟类的所有类型的免疫球蛋白中的至少一种。例如,在说明书中使用的抗体可以是选自下组中的至少一种:IgG(例如,IgG 1型(IgG1)、IgG2型(IgG2)、IgG 3型(IgG 3)和IgG4型(IgG4))、IgA(例如,IgA 1型(IgA1)和IgA 2型(IgA2))、IgD、IgE和IgM。抗体可以是源自哺乳动物(诸如包含人、猴等的灵长类动物和包含小鼠、大鼠等的啮齿动物)的免疫球蛋白,并且可以是例如人源免疫球蛋白。在一个实施方案中,抗体可以是选自以下至少一种:人IgG1(恒定区;蛋白质:GenBank登录号AAC82527.1、基因:GenBank登录号J00228.1)、人IgG2(恒定区;蛋白质:GenBank登录号AAB59393.1、基因:GenBank登录号J00230.1)、人IgG3(恒定区;蛋白质:GenBank登录号P01860、基因:GenBank登录号X03604.1)、人IgG4(恒定区;蛋白质:GenBank登录号AAB59394.1、基因:GenBank登录号K01316.1)、人IgA1(恒定区;蛋白质:GenBank登录号AAT74070.1、基因:GenBank登录号AY647978.1)、人IgA2(恒定区;蛋白质:GenBank登录号AAB59396.1、基因:GenBank登录号J00221.1)、人IgD(恒定区;蛋白质:GenBank登录号AAA52771.1、AAA52770.1)、人IgE(恒定区;蛋白质:GenBank登录号AAB59395.1、基因:GenBank登录号J00222.1)和人IgM(恒定区;蛋白质:GenBank登录号CAB37838.1、基因:GenBank登录号X57086.1)。在一个实施方案中,抗体可以是选自人源IgG1、IgG2、IgG3和IgG4组成的组中的至少一种,但不限于此。引入突变的第1CH3结构域和第2CH3结构域、第1CH1结构域和第1CL结构域、以及第2CH1结构域和第2CL结构域可以从相同或不同的免疫球蛋白类型中各自独立地选择。
如图33a中可见,描绘了人IgG1重链恒定区(SEQ ID NO:33)和人IgA1重链恒定区(SEQ ID NO:34)的序列比对结果以及图33b描绘了人免疫球蛋白轻链的κ恒定区(SEQ IDNO:35)和λ恒定区(SEQ ID NO:36)的序列比对结果,重链恒定区和轻链恒定区显示亚型之间的高度保守的氨基酸序列。
此外,免疫球蛋白序列在序列来源的物种和亚型中是高度保守的。例如,如图33c(CH1结构域序列比对)和图33d(CH3结构域序列比对)中人、小鼠和大鼠之间重链恒定区的序列比对结果所示,免疫球蛋白重链恒定区的氨基酸序列具有高的种间保守性。
因此,在本说明书中,参照人IgG1,以指定CH1结构域和CH3结构域中的氨基酸位置,并参照人κ恒定区,以指定CL结构域中的氨基酸位置。用作为参照的人IgG1和人κ恒定区指定的氨基酸位置使得能够通过典型的序列比对手段明确指定其他亚型的免疫球蛋白和除人以外的物种的免疫球蛋白中的相应氨基酸位置(例如,https://blast.ncbi.nlm.nih.gov/Blast.cgi)(见表1)。
另外,在说明书中提供的CH1结构域、CL结构域和CH3结构域中的氨基酸位置根据EU编号系统表示,并且关于其细节,可以参考“http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html(重链恒定区)”、“http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGLCnber.html(轻链λ区)”、和“http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGKCnber.html(轻链κ区)”。
使用人类IgG1作为参照,EU编号系统:
(1)连续地编号CH1结构域(SEQ ID NO:1),第一个氨基酸残基(Ala)给定第118位(即,SEQ ID NO:1的CH1结构域的108个氨基酸残基分别对应于IgG1中第118位至215位);和
(2)连续地编号CH3结构域(SEQ ID NO:15),第一个氨基酸残基(Lys)给定第340位(即,SEQ ID NO:15的CH3结构域的108个氨基酸残基分别对应于IgG1中第340位至第447位)(参见http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html)。
在本说明书中,用人IgG1作为参照,描述了CH1和CH3结构域中的氨基酸位置和与其对应的氨基酸类型。
进一步地,根据EU编号,
连续编号人κ恒定区(蛋白质:GenBank登录号AAA58989.1基因:GenBank登录号J00241.1)的CL结构域(SEQ ID NO:10),第一个氨基酸残基(Val)给定第110位(即,SEQ IDNO:10的CL结构域的105个氨基酸残基分别对应于第110位至第214位;参见http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGKCnber.html);和
连续编号人λ恒定区的CL结构域(SEQ ID NO:11(λ1)、SEQ ID NO:12(λ2)、SEQ IDNO:13(λ3)和SEQ ID NO:14(λ7)),第一个氨基酸残基(Lys)给定第110位(对于λ恒定区,第169、201和203位从建立的序列号中省略;即,SEQ ID NO:11或12的CL结构域的103个氨基酸残基编号从第110位到第168位、从第170位到第200位、从第203位到第215位;参见http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGLCnber.html)。在本说明书中,用人κ恒定区作为参照,描述了CL结构域中的氨基酸位置和与其对应的氨基酸类型。
Fab恒定区可包含一个重链恒定区(即CH1结构域)和一个轻链恒定区(即CL结构域),重链恒定区选自由IgG(IgG1、IgG2、IgG3和IgG4)的Fab片段、IgA(IgA1和IgA2)的Fab片段、IgD的Fab片段、IgE的Fab片段和IgM的Fab片段组成的组以及轻链恒定区选自由免疫球蛋白轻链的κ型和λ型(例如,λ1型、λ2型、λ3型和λ7型)组成的组。
举例来说,各自可作为Fab片段的重链恒定区(CH1结构域)的IgG1、IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM的CH1结构域可分别包含SEQ ID NO:1(对应于根据EU编号的第118至215位)、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8和SEQ ID NO:9的氨基酸序列。此外,κ型、λ1型、λ2型、λ3型和λ7型的CL结构域各自可用作轻链恒定区(CL结构域)并且可分别包含SEQ ID NO:10(对应于根据EU编号的位置第110至214位)、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13和SEQ IDNO:14的氨基酸序列。在一个实施方案中,Fab恒定区是IgG 1型的CH1结构域(SEQ ID NO:1)和κ型的轻链恒定区(CL结构域)(SEQ ID NO:10)。为了增强靶向相同主体的分子之间的二聚化,在CH1结构域中被带负电荷的氨基酸或带正电荷的氨基酸取代的氨基酸可以是选自下组中至少一个残基(例如,一个)、两个或更多个残基(例如,两个)、三个或更多个残基(例如,三个),或四个或更多个(例如,四个)残基:根据EU编号系统编号的IgG 1型(SEQ ID NO:1)中的第145位亮氨酸、第147位赖氨酸、第170位苯丙氨酸、第183位丝氨酸和第185位缬氨酸。在另一个实施方案中,在CH1结构域中被带负电荷的氨基酸或带正电荷的氨基酸取代的氨基酸可以是选自下组中至少一个残基:其他IgG亚型(IgG2、IgG3和IgG4)、IgA1、IgA2、IgD、IgE和IgM(分别为SEQ ID NO:2至9)中对应于SEQ ID NO:1的氨基酸序列的第145位亮氨酸、第147位赖氨酸、第170位苯丙氨酸、第183位丝氨酸和第185位缬氨酸处的氨基酸。
如本文所用,“对应于…位置处的氨基酸”可以通过SEQ ID NO:1的氨基酸序列与靶标氨基酸序列(即,SEQ ID NO:2至9)的典型序列比对而无困难的确定(下文中同样适用)。
具有正电荷的氨基酸(带正电荷的氨基酸)可以选自碱性氨基酸,并且可以是例如赖氨酸或精氨酸。当带正电荷的氨基酸被引入CH1结构域时,选自由SEQ ID NO:1的第145位亮氨酸、第147位赖氨酸、第170位苯丙氨酸、第171位脯氨酸、第183位丝氨酸和第185位缬氨酸,以及在SEQ ID NO:2至9的氨基酸序列上相对应的位置的氨基酸组成的组的至少一个残基,例如一个残基、两个或更多个残基(例如,两个)、三个或更多个残基(例如,三个),或四个或更多个残基(例如,四个)各自可以独立地被碱性氨基酸(例如赖氨酸或精氨酸)取代。
例如,为了将带正电荷的氨基酸引入其中,CH1结构域可在其中包含下列突变(在SEQ ID NO:1的氨基酸序列上;并且还应用于另在SEQ ID NO:2至9的氨基酸序列上相对应的位置的氨基酸残基)中的至少一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个(例如,四个):
用赖氨酸或精氨酸(例如赖氨酸)取代第145位亮氨酸;
用赖氨酸或精氨酸(例如赖氨酸)取代第183位丝氨酸;
用精氨酸取代147位赖氨酸;
用赖氨酸或精氨酸(例如赖氨酸)取代第170位苯丙氨酸;
用赖氨酸或精氨酸(例如赖氨酸)取代第171位脯氨酸;和
用赖氨酸或精氨酸(例如精氨酸)取代第185位缬氨酸。
带负电荷的氨基酸可以选自酸性氨基酸残基,并且可以是例如天冬氨酸或谷氨酸。因此,当带负电荷的氨基酸被引入CH1结构域时,选自由SEQ ID NO:1的第145位亮氨酸、第147位赖氨酸、第170位苯丙氨酸、第171位脯氨酸、第183位丝氨酸和第185位缬氨酸,以及在SEQ ID NO:2至9的氨基酸序列上相对应的位置的氨基酸组成的组的至少一个,例如一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个残基(例如,四个)各自可以独立地被酸性氨基酸(例如天冬氨酸或谷氨酸)取代。例如,为了将带正电荷的氨基酸引入其中,CH1结构域可在其中包含下列突变(在SEQ ID NO:1的氨基酸序列上;并且还应用于另在SEQ ID NO:2至9的氨基酸序列上相对应的位置的氨基酸残基)中的至少一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个(例如,四个):
用天冬氨酸或谷氨酸(例如谷氨酸)取代第145位亮氨酸;
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第147位赖氨酸;
用天冬氨酸或谷氨酸(例如谷氨酸)取代第183位丝氨酸;
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第185位缬氨酸;
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第170位苯丙氨酸;和
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第171位脯氨酸。
为了增强靶向相同主体的分子之间的二聚化,在轻链恒定区(CL结构域)中被带负电荷的氨基酸或带正电荷的氨基酸取代的氨基酸可以是选自下组中至少一个,例如一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个(例如,四个)残基:κ型(SEQ ID NO:10)中的第131位丝氨酸、133位缬氨酸、第135位亮氨酸、第162位丝氨酸和第180位苏氨酸。在另一个实施方案中,在CL结构域中被带负电荷的氨基酸或带正电荷的氨基酸取代的氨基酸可以是选自下组中至少一个残基:λ类型的CL结构域(λ1型、λ2型、λ3型和λ7型)(分别为SEQ ID NO:11至14)中对应于SEQ ID NO:10的氨基酸序列的第131位丝氨酸、133位缬氨酸、第135位亮氨酸、第162位丝氨酸和第180位苏氨酸的氨基酸。
具有正电荷的氨基酸(带正电荷的氨基酸)可以选自碱性氨基酸,并且可以是例如赖氨酸或精氨酸。因此,当带正电荷的氨基酸被引入CL结构域时,选自由SEQ ID NO:10的第131位丝氨酸、133位缬氨酸、第135位亮氨酸、第162位丝氨酸和第180位苏氨酸,以及在SEQID NO:11至14的氨基酸序列上相对应的位置的氨基酸组成的组的至少一个残基,例如一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个残基(例如,四个)各自可以独立地被碱性氨基酸(例如赖氨酸或精氨酸)取代。
举例来说,为了将带正电荷的氨基酸引入其中,CL结构域可包含下列突变(对于SEQ ID NO:10的氨基酸序列;并且还应用于在SEQ ID NO:11至14的氨基酸序列上相对应的位置的氨基酸)中的至少一个,例如一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个(例如,四个):
用赖氨酸或精氨酸(例如赖氨酸)取代第131位丝氨酸;
用赖氨酸或精氨酸(例如赖氨酸)取代第133位缬氨酸;
用赖氨酸或精氨酸(例如精氨酸)取代第135位亮氨酸;
用赖氨酸或精氨酸(例如赖氨酸)取代第162位丝氨酸;和
用赖氨酸或精氨酸(例如精氨酸)取代第180位苏氨酸。
为了进一步增强同源二聚化,突变CH1结构域和/或突变CL结构域可以同时包含两个或更多个突变。
例如,CH1结构域中第147位赖氨酸和第185位缬氨酸可以被带正电荷或负电荷的氨基酸取代。举例来说,第一CH1结构域和第二CH1结构域之一的第147位赖氨酸和第185位缬氨酸可被带正电荷的氨基酸(例如赖氨酸或精氨酸)取代,而另一CH1结构域中的第147位赖氨酸和第185位缬氨酸可以被带负电荷的氨基酸(谷氨酸或天冬氨酸)取代。另外,CL结构域的第135位亮氨酸和第180位苏氨酸可以被带正电荷或负电荷的氨基酸取代。举例来说,第一和第二CH1结构域之一的第135位亮氨酸和第180位苏氨酸可以被带正电荷的氨基酸(例如,赖氨酸或精氨酸)取代,而另一CL结构域中的第135位亮氨酸和第180位苏氨酸可以被带负电荷的氨基酸(谷氨酸或天冬氨酸)取代。
在另一个实施方案中,CH1结构域中第170位苯丙氨酸和171位脯氨酸可以被带正电荷或负电荷的氨基酸取代。举例来说,第一CH1结构域和第二CH1结构域之一的第170位苯丙氨酸和第171位脯氨酸可被带正电荷的氨基酸(例如赖氨酸或精氨酸)取代,而另一CH1结构域中第170位苯丙氨酸和第171位脯氨酸可以被带负电荷的氨基酸(谷氨酸或天冬氨酸)取代。另外,CL结构域的第135位亮氨酸和第162位丝氨酸可以被带正电荷或负电荷的氨基酸的取代。举例来说,第一CL结构域和第二CL结构域之一的第135位亮氨酸和第162位丝氨酸可以被带正电荷的氨基酸(例如,赖氨酸或精氨酸)取代,而另一CL结构域中第135位亮氨酸和第162位丝氨酸可以被带负电荷的氨基酸(例如,谷氨酸或天冬氨酸)取代。
带负电荷的氨基酸可以选自酸性氨基酸残基,并且可以是例如天冬氨酸或谷氨酸。因此,当带负电荷的氨基酸被引入CL结构域时,选自由SEQ ID NO:10的第131位丝氨酸、133位缬氨酸、第135位亮氨酸、第162位丝氨酸和第180位苏氨酸,以及在SEQ ID NO:11至14的氨基酸序列上相对应的位置的氨基酸组成的组的至少一个残基,例如一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个残基(例如,四个)各自可以独立地被碱性氨基酸(例如赖氨酸或精氨酸)取代。举例来说,为了将带正电荷的氨基酸引入其中,CL结构域可包含下列突变(在SEQ ID NO:10的氨基酸序列上;并且还应用于另在SEQID NO:11至14的氨基酸序列上相对应的位置的氨基酸残基)中的至少一个,例如一个、两个或更多个(例如,两个)、三个或更多个(例如,三个),或四个或更多个(例如,四个):
用天冬氨酸或谷氨酸(例如谷氨酸)取代第131位丝氨酸;
用天冬氨酸或谷氨酸(例如谷氨酸)取代第133位缬氨酸;
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第135位亮氨酸;
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第162位丝氨酸;和
用天冬氨酸或谷氨酸(例如天冬氨酸)取代第180位苏氨酸。
在一个实施方案中,在将被具有相反电荷的一对氨基酸取代的CH1结构域和CL结构域之间形成氨基酸对的一组两个氨基酸,可以选自下组中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对):基于SEQID NO:1(CH1结构域)和SEQ ID NO:10(CL结构域)的氨基酸序列编号的CH1结构域中第145位亮氨酸和CL结构域中第131位丝氨酸对、CH1结构域第145位亮氨酸和CL结构域第133位缬氨酸对、CH1结构域第147位赖氨酸和CL结构域第180位苏氨酸对、CH1结构域中第183位丝氨酸和CL结构域中第133位缬氨酸对、CH1结构域中第185位缬氨酸和CL结构域中第135位亮氨酸对、CH1结构域中第170位苯丙氨酸和CL结构域中第135位亮氨酸对,以及CH1结构域中第171位脯氨酸和CL结构域中第162位丝氨酸对。例如,引入突变的CH1和CL结构域之间的氨基酸对可以是选自下组中的至少一对或两对或更多对:基于SEQ ID NO:1(CH1结构域)和SEQID NO:10(CL结构域)的氨基酸序列编号的CH1结构域中第145位亮氨酸和CL结构域第131位丝氨酸对、CH1结构域第145位亮氨酸和CL结构域第133位缬氨酸对、CH1结构域第147位赖氨酸和CL结构域中第180位苏氨酸对、CH1结构域中第183位丝氨酸和CL结构域中第133位缬氨酸对,以及CH1结构域中第185位缬氨酸和CL结构域中第135位亮氨酸对。
在第一CH1结构域和第一CL结构域之间引入突变的氨基酸对可以与第二CH1结构域和第二CL结构域之间的氨基酸对相同或不同。
在一个实施方案中,将带正电荷的氨基酸引入第一CH1结构域(向第一CL结构域引入带负电荷的氨基酸),且将带负电荷的氨基酸引入第二CH1结构域(向第二CL结构域引入带正电荷的氨基酸)。
为了增强异源二聚化,可以将以下突变的至少一个,例如一个、两个或三个引入重链的Fc区(具体地,Fc区中的CH3结构域):
(1)在CH3结构域之间的至少一个氨基酸对(两个氨基酸残基中至少一个不疏水)中的一个氨基酸残基被带正电荷的氨基酸取代,且另一个残基被带负电荷的氨基酸取代的突变(以下称为“引入静电相互作用的突变”);
(2)在CH3结构域之间的至少一个氨基酸对中的氨基酸残基相互交换的突变(以下称为“交换突变”);和
(3)在CH3结构域之间的至少一个氨基酸对中的一个氨基酸残基被大氨基酸(例如,诸如色氨酸、苯丙氨酸等的大疏水性氨基酸,)取代,而另一个氨基酸被小氨基酸(例如,诸如丙氨酸、甘氨酸、缬氨酸等的小疏水性氨基酸)取代的突变(下文称为“大小突变”)。
因此,引入突变的CH3结构域可选自下组:人IgG1的CH3结构域(SEQ ID NO:15;根据EU编号对应于第340至447位)、人IgG2的CH3结构域(SEQ ID NO:16)、人IgG3的CH3结构域(SEQ ID NO:17)、人IgG4的CH3结构域(SEQ ID NO:18)、人IgA1的CH3结构域(SEQ ID NO:19)、人IgA2的CH3结构域(SEQ ID NO:20)、人IgD的CH3结构域(SEQ ID NO:21)、人IgE的CH3结构域(SEQ ID NO:22)和人IgM的CH3结构域(SEQ ID NO:23)。
引入突变的第一CH3结构域和第二CH3结构域可源自相同或不同的免疫球蛋白类型,其可以各自独立地选自由IgG1、IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM组成的组。在一个实施方案中,第一CH3结构域和第二CH3结构域均可以是具有SEQ ID NO:15的氨基酸序列的人IgG1的CH3结构域,但不限于此。
第一CH3结构域和第二CH3结构域之间的以下氨基酸对基于具有SEQ ID NO:15的氨基酸的人IgG1的CH3结构域,并且该原则另对应于IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM的CH3结构域(分别为SEQ ID NO:16至23)之间氨基酸对是正确的。
引入一种突变的第一CH3结构域和第二CH3结构域之间的氨基酸对可以是选自由CH3结构域之间的氨基酸对和IgG3、IgG3、IgG4、IgA1、IgA2、IgE和IgM的CH3结构域(分别为SEQ ID NO:16至23)之间相应位置的氨基酸对组成的组中的至少一对,例如,一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对)氨基酸对,列于下表1中。
表1
/>
(链A:第一CH3结构域;链B:第二CH3结构域)
更详细地,第一CH3结构域和第二CH3结构域之间的氨基酸对(其具有下列突变的至少一个:(1)引入静电相互作用的突变(在表2和图2中表示为电荷(J));(2)交换突变(表2和图2中表示为交换(O));(3)大小突变(表2和图2中表示为大小(B)))可以是选自IgG1(SEQID NO:15)的CH3结构域之间的氨基酸对和IgG2、IgG3、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM的CH3结构域(分别为SEQ ID NO:16至23)之间相应位置的氨基酸对的至少一对,例如,一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对)氨基酸对,列于下表2和图2中。
表2
/>
(链A:第一CH3结构域;链B:第二CH3结构域;表2中列出的突变基于IgG1的位置给出,但应用于IgG2、IgG3、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM的CH3结构域中的相应位置)。
如本文所用,例如,“Q347”表示人IgG1的CH3结构域中SEQ ID NO:15的氨基酸序列上第347位谷氨酰胺,并且这种标记方法同样适用于IgG2、IgG3、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM的CH3结构域(分别为SEQ ID NO:16至23)中相应位置的氨基酸残基(下文中,应用相同的定义)。
在下文中,引入突变的CH3结构域之间的氨基酸基于SEQ ID NO:15的氨基酸序列编号,并且除非另有说明,编号应解释为应用于IgG1中指定位置以及其他类型免疫球蛋白(IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE和IgM)的CH3结构域中相应位置的氨基酸。
引入静电相互作用的突变旨在用带正电荷的氨基酸取代Fc区或CH3结构域之间的至少一个氨基酸对(成对的两个氨基酸的至少一个残基不是疏水的)的一个氨基酸残基且带负电荷的氨基酸取代另一个氨基酸残基,以将静电相互作用引入疏水相互作用缺失位点,从而有助于增加引入静电相互作用的结合力。
疏水性氨基酸可选自由甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、脯氨酸、苯丙氨酸和色氨酸组成的组。
带负电荷的氨基酸可以选自酸性氨基酸,并且可以是例如天冬氨酸或谷氨酸。带正电荷的氨基酸可以选自碱性氨基酸,并且可以是例如赖氨酸或精氨酸。
适用于引入静电相互作用的突变的第一CH3结构域和第二CH3结构域之间的氨基酸对可以是选自表2中的氨基酸对编号1至39中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对),并且可以是选自下组中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对):例如第364位丝氨酸和第368位亮氨酸对、第394位苏氨酸和第394位苏氨酸对、第357位谷氨酸和第370位赖氨酸对、第357位谷氨酸和第349位酪氨酸对、第366位苏氨酸和第407位酪氨酸对、第394位苏氨酸和第397位缬氨酸对。
也就是说,CH3结构域中引入静电相互作用的突变可以包括用带正电荷的氨基酸取代选自表2中的氨基酸对编号1至39中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对)的每个氨基酸对的一个氨基酸残基;以及用带负电荷的氨基酸取代另一个氨基酸残基。举例来说,例如,选自下组中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对)的每个氨基酸对中:例如,第364位丝氨酸和第368位亮氨酸对、第394位苏氨酸和第394位苏氨酸对、第357位谷氨酸和第370位赖氨酸对、第357位谷氨酸和第349位酪氨酸对、第366位苏氨酸和第407位酪氨酸对、第394位苏氨酸和第397位缬氨酸对,用带正电荷的氨基酸取代一个氨基酸残基,并用带负电荷的氨基酸取代另一个氨基酸残基。
例如,CH3结构域中引入静电相互作用的突变可包含下列突变中的至少一个,例如,一个、两个或更多个(例如,两个)、三个或更多个(例如三个),或四个或更多个(例如,四个):
用带正电荷的氨基酸取代第364位丝氨酸并用带负电荷的氨基酸取代第368位亮氨酸;
用带正电荷的氨基酸取代第394位苏氨酸并用带负电荷的氨基酸取代第394位苏氨酸;
用带正电荷的氨基酸取代第357位谷氨酸并用带负电荷的氨基酸取代第370位赖氨酸;
用带正电荷的氨基酸取代第357位谷氨酸并用带负电荷的氨基酸取代第349位酪氨酸;
用带正电荷的氨基酸取代第366位苏氨酸并用带负电荷的氨基酸取代第407位酪氨酸;
用带正电荷的氨基酸取代第394位苏氨酸并用带负电荷的氨基酸取代第397位缬氨酸;和
用带正电荷的氨基酸取代第349位酪氨酸并用带负电荷的氨基酸取代第357位谷氨酸。
在CH3结构域中引入这种静电相互作用可以实现60%或更高、65%或更高、70%或更高、73%或更高、75%或更高、78%或更高、80%或更高、85%或更高、90%或更高、95%或更高,或100%的异源二聚化率。
交换突变是指构成氨基酸对的两个氨基酸残基彼此交换(交换)的突变。
如表2和图2所示,可适用交换突变的第一CH3结构域和第二CH3结构域之间的氨基酸对可以选自下组中的至少一对,例如,一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对):第347位谷氨酰胺和第360位赖氨酸对、第357位谷氨酸和第349位酪氨酸对、第354位丝氨酸和第349位酪氨酸对、第357位谷氨酸和第370位赖氨酸对、第360位赖氨酸和第349位酪氨酸对、第364位丝氨酸和第368位亮氨酸对、第364位丝氨酸和第370位赖氨酸对、第368位亮氨酸和第409位赖氨酸对、第390位天冬酰胺和第400位丝氨酸对、第394位苏氨酸和第397位缬氨酸对、第398位亮氨酸和第392位赖氨酸对、第405位苯丙氨酸和第409位赖氨酸对、第407位酪氨酸和第366位苏氨酸对、第411位苏氨酸和第370位赖氨酸对,并且特别是选自下组:第364位丝氨酸和第370位赖氨酸对、第407位酪氨酸和第366位苏氨酸对、第357位谷氨酸和第370位赖氨酸对、第405位苯丙氨酸和第409位赖氨酸对,和第357位谷氨酸和第349位酪氨酸对。
也就是说,CH3结构域中的交换突变可以包括选自下组的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对)中的每一对中的两个配对氨基酸残基之间互换的取代:第347位谷氨酰胺和第360位赖氨酸对、第357位谷氨酸和第349位酪氨酸对、第354位丝氨酸和第349位酪氨酸对、第357位谷氨酸和第370位赖氨酸对、第360位赖氨酸和第349位酪氨酸对、第364位丝氨酸和第368位亮氨酸对、第364位丝氨酸和第370位赖氨酸对、第368位亮氨酸和第409位赖氨酸对、第390位天冬酰胺和第400位丝氨酸对、第394位苏氨酸和第397位缬氨酸对、第398位亮氨酸和第392位赖氨酸对、第405位苯丙氨酸和第409位赖氨酸对、第407位酪氨酸和第366位苏氨酸对、和第411位苏氨酸和第370位赖氨酸对,并且例如选自下组:第364位丝氨酸和第370位赖氨酸对、第407位酪氨酸和第366位苏氨酸对、第357位谷氨酸和第370位赖氨酸对、第405位苯丙氨酸和第409位赖氨酸对,和第357位谷氨酸和第349位酪氨酸对。
例如,CH3结构域中引入静电相互作用的突变可包含下列突变中的至少一个,例如一个、两个或更多个(例如,两个)、三个或更多个(例如三个),或四个或更多个(例如,四个):
用赖氨酸取代第364位丝氨酸并用丝氨酸取代第370位赖氨酸;
用赖氨酸取代第405位苯丙氨酸并用苯丙氨酸取代第409位赖氨酸;
用苏氨酸取代第407位酪氨酸并用酪氨酸取代第366位苏氨酸;
用赖氨酸取代第357位谷氨酸并用谷氨酸取代第370位赖氨酸;和
用酪氨酸取代第357位谷氨酸并用丝氨酸取代第349位酪氨酸。
在CH3结构域中这种交换突变可以实现60%或更高、65%或更高、70%或更高、73%或更高、75%或更高、78%或更高、80%或更高、85%或更高、90%或更高、95%或更高,或100%的异源二聚化率。
大小突变是指在CH3结构域之间的至少一个氨基酸对中的两个配对氨基酸中,一个残基被大疏水性氨基酸(例如,色氨酸、苯丙氨酸等)取代,且另一个是用小疏水性氨基酸(例如,丙氨酸、甘氨酸、缬氨酸等)取代的突变,使得大氨基酸适应由小氨基酸保护的空间,从而有助于异源二聚化。
大氨基酸可以包含环状残基,并且可以选自由色氨酸和苯丙氨酸组成的组,且特别是色氨酸。小氨基酸可以选自由丙氨酸、甘氨酸和缬氨酸组成的组,且例如可以是丙氨酸。
可适用大小突变的第一CH3结构域和第二CH3结构域之间的氨基酸对可以选自表2中的氨基酸对编号1至40中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对),并且例如可以是第409位赖氨酸和第407位酪氨酸对、第409位赖氨酸和第405位苯丙氨酸对,或其组合。
也就是说,大小突变可以包括选自表2中的氨基酸对编号1至40中的至少一对,例如一对、两对或更多对(例如,两对)、三对或更多对(例如,三对),或四对或更多对(例如,四对)的每一对的两个配对氨基酸残基中的一个被例如色氨酸的大疏水性氨基酸(例如,色氨酸、苯丙氨酸等)取代,且另一个用例如丙氨酸的小疏水性氨基酸(例如丙氨酸、甘氨酸、缬氨酸等)取代。举例来说,在第409位赖氨酸和第407位酪氨酸对、第409位赖氨酸和第405位苯丙氨酸对中,或在它们的每一对中,一个残基可以被大疏水性氨基酸取代(例如,苯丙氨酸或色氨酸),而另一个残基可以用小疏水性氨基酸取代(例如丙氨酸、甘氨酸或缬氨酸)。
例如,CH3结构域中的大小突变可以包含下列突变中的至少一种:
用色氨酸取代第409位的赖氨酸并用丙氨酸取代第407位酪氨酸;和
用色氨酸取代第409位的赖氨酸并用丙氨酸取代第405位苯丙氨酸。
经修饰的CH3结构域可包括例如上述三种突变(即引入静电相互作用的突变、交换突变和大小突变)的至少一种,例如一种或两种。
为了对二聚化发挥最有利的作用,经修饰的CH3结构域可包含选自下组中的至少一种,例如一种、两种或三种突变:第364位丝氨酸和第368位亮氨酸对中一个残基用带正电荷的氨基酸取代,且另一个用带负电荷的氨基酸取代(引入静电相互作用的突变)、第364位丝氨酸和第370位赖氨酸对的两个残基彼此互换(交换突变),以及第405位苯丙氨酸和第409位赖氨酸对的两个残基彼此互换(交换突变)。
例如,经修饰的CH3结构域可包含下列突变中的一种、两种或三种:
(a)用带正电荷的氨基酸取代第364位丝氨酸并用带负电荷的氨基酸取代第368位亮氨酸;
(b)用赖氨酸取代第364位丝氨酸并用丝氨酸取代第370位赖氨酸;和
(c)用赖氨酸取代第405位苯丙氨酸并用苯丙氨酸取代第409位赖氨酸。
为了降低单体化速率,但增加二聚化速率,可以在三个选择的突变((a)-(c))之后引入另外的氨基酸修饰。因此,可以引入额外氨基酸突变的氨基酸可以是第364位丝氨酸、第405位苯丙氨酸和/或第409位赖氨酸。例如,当第368位亮氨酸可被带负电荷的氨基酸(天冬氨酸或谷氨酸,例如天冬氨酸)取代,第364位丝氨酸可被带有正电荷的氨基酸(赖氨酸或精氨酸)(S364K或S364R;引入静电相互作用的突变)或天冬酰胺(S364N)取代时,第364位丝氨酸和第368位亮氨酸对将经历引入静电相互作用的突变。此外,在第370位赖氨酸和第364位丝氨酸对中(其将发生交换突变),第370位赖氨酸可被丝氨酸取代,且第364位丝氨酸可被赖氨酸(S364K;交换突变)或精氨酸或天冬酰胺(S364R或S364N)取代。
进一步的,在第409位赖氨酸和第405位苯丙氨酸对中(其将进行交换突变),第409位赖氨酸可以被苯丙氨酸取代(对于交换突变)或被色氨酸取代,且第405位苯丙氨酸可以被赖氨酸取代(F405K;对于交换突变)或被精氨酸、谷氨酰胺或天冬酰胺取代(F405R、F405Q或F405N)。
在一个实施方案中,经修饰的CH3结构域可包含下列突变中的至少一种:
用赖氨酸取代第364位丝氨酸并用天冬氨酸取代第368位亮氨酸;
用赖氨酸取代第364位丝氨酸并用丝氨酸取代第370位赖氨酸;
用赖氨酸取代第405位苯丙氨酸并用苯丙氨酸取代第409位赖氨酸;
用精氨酸取代第405位苯丙氨酸并用苯丙氨酸取代第409位赖氨酸;
用赖氨酸取代第405位苯丙氨酸并用色氨酸取代第409位赖氨酸;和
用精氨酸取代第405位苯丙氨酸并用色氨酸取代第409位赖氨酸。
在一个实施方案中,经修饰的CH3结构域可包含下列双突变中的至少一种:
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用天冬氨酸取代第二CH3结构域中第368位亮氨酸,并用苯丙氨酸取代第一CH3结构域中第409位赖氨酸并用赖氨酸取代第二CH3结构域中第405位苯丙氨酸;
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用天冬氨酸取代第二CH3结构域中第368位亮氨酸,以及用苯丙氨酸取代第一CH3结构域中第409位赖氨酸并用精氨酸取代第二CH3结构域中第405位苯丙氨酸;
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用丝氨酸取代第二CH3结构域中第370位赖氨酸,以及用苯丙氨酸取代第一CH3结构域中第409位赖氨酸并用赖氨酸取代第二CH3结构域中第405位苯丙氨酸;
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用丝氨酸取代第二CH3结构域中第370位赖氨酸,以及用苯丙氨酸取代第一CH3结构域中第409位赖氨酸并用精氨酸取代第二CH3结构域中第405位苯丙氨酸;
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用天冬氨酸取代第二CH3结构域中第368位亮氨酸,以及用色氨酸取代第一CH3结构域中第409位赖氨酸并用赖氨酸取代第二CH3结构域中第405位苯丙氨酸;
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用天冬氨酸取代第二CH3结构域中第368位亮氨酸,以及用色氨酸取代第一CH3结构域中第409位赖氨酸并用精氨酸取代第二CH3结构域中第405位苯丙氨酸;
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用丝氨酸取代第二CH3结构域中第370位赖氨酸,以及用色氨酸取代第一CH3结构域中第409位赖氨酸并用赖氨酸取代第二CH3结构域中第405位苯丙氨酸;或
用赖氨酸取代第一CH3结构域中第364位丝氨酸并用丝氨酸取代第二CH3结构域中第370位赖氨酸,以及用色氨酸取代第一CH3结构域中第409位赖氨酸并用精氨酸取代第二CH3结构域中第405位苯丙氨酸。
在CH3结构域中这种双突变可以实现70%或更高、75%或更高、80%或更高、85%或更高、90%或更高、92%或更高、93%或更高、94%或更高、95%或更高,或96%或更高的异源二聚化率。
本发明的另一方面提供抗B型流感抗体,其包含由SEQ ID NO:27的氨基酸序列组成的重链可变区和由SEQ ID NO:31的氨基酸序列组成的轻链可变区,或其抗原结合片段。本发明的另一方面提供抗A型流感抗体,其包含由SEQ ID NO:29的氨基酸序列组成的重链可变区和由SEQ ID NO:31的氨基酸序列组成的轻链可变区,或其抗原结合片段。
本发明的另一方面提供抗A型流感/抗B型流感双特异性抗体,其包含抗B型流感抗体和抗A型流感抗体,或其抗原结合片段,抗B型流感抗体包含由SEQ ID NO:27的氨基酸序列组成的重链可变区和由SEQ ID NO:31的氨基酸序列组成的轻链可变区,抗A型流感抗体包含由SEQ ID NO:29的氨基酸序列组成的重链可变区和由SEQ ID NO:31的氨基酸序列组成的轻链可变区。抗A型流感/抗B型流感双特异性抗体可包含(1)经修饰的CH3结构域(如上所述,引入的CH3-CH3突变对);(2)突变CH1结构域和突变CL结构域(如上所述,引入CH1-CL的突变对);或者(3)经修饰的CH3结构域,以及突变CH1结构域和突变CL结构域。
本发明的双特异性蛋白质或双特异性抗体是根据蛋白质亚基之间的相关并协调的界面突变(以下称为“Chimps”)构建的双特异性物质。
如本文所用,术语“抗体”是指一类结构相关的糖蛋白,由两对多肽链组成,一对轻(L)低分子量链和一对重(H)链,所有四条链通过二硫键相互连接。已经很好地表征了抗体的结构(参见,例如,[Fundamental Immunology Ch.7(Paul,W.,2nd ed.Raven Press,NY(1989)])。简而言之,每条重链通常由重链可变区(本文缩写为VH)和重链恒定区组成。重链恒定区通常由三个结构域CH1、CH2和CH3组成。重链通过二硫键在所谓的“铰链区”中相互连接。每个轻链通常由轻链可变区(在此缩写为VL)和轻链恒定区组成。轻链恒定区通常由一个结构域CL组成。通常,恒定区中的氨基酸残基的编号根据文献[Kabat et al.,Sequencesof Proteins of Immunological Interest,5th Ed.Public Health Service,NationalInstitutes of Health,Bethesda,Md.(1991)]中描述的EU索引进行。VH和VL区可以进一步细分为高变区(或高变的区域,其可以是序列中和/或结构上定义的环的形式的高变区),也称为互补决定区(CDR),其穿插在更保守的区域中(称为框架区(FR))。每个VH和VL通常由三个CDR和四个FR组成,按照以下顺序从氨基末端到羧基末端排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4(另见文献[Chothia和Lesk J]Mol.Biol.196,901 917(1987)])。
如本文所用,术语“Fab臂”是指一个重链-轻链对。
如本文所用,术语“Fc区”是指包含CH2结构域和CH3结构域的抗体区,并且可选地进一步包含铰链区。
如本文所用,术语“双特异性抗体”是指对至少两种不同表位(通常是非重叠表位)具有特异性的抗体。
如本文所用,术语“全长抗体”是指含有与通常在该同型的抗体中发现的那些相对应的所有重链和轻链恒定结构域和可变结构域的抗体。在一个实施方案中,全长抗体包含两条全长重链和两条全长轻链。如本文所用,“同型”是指由重链恒定区基因编码的抗体类别(例如IgG1、IgG2、IgG3、IgG4、IgD、IgA、IgE或IgM)。
术语“抗原结合片段”意指含有抗体的可变结构域的抗体的一部分,并且可以选自Fab、F(ab')2、scFv、(scFv)2、scFv-Fc、(scFv-Fc)等,但不限于此。
术语“表位”意指能够特异性结合抗体的蛋白质决定簇。表位通常由分子的表面组(诸如氨基酸或糖侧链)组成,并且通常具有特定的三维结构特征以及特定的电荷特征。
术语“双特异性抗体”对于识别和/或结合两种不同抗原或一种抗原上的两种不同(非重叠)表位的抗体是通用的。在一个实施方案中,双特异性抗体可包含一个针对肿瘤细胞抗原的抗原结合位点和另一个针对细胞毒性触发分子的抗原结合位点。举例来说,双特异性抗体可以选自下组:抗FcγRI/抗CD15抗体、抗p185HER2/抗FcγRIII(CD16)抗体、抗CD3/抗恶性B细胞(1D10)抗体、抗CD3/抗p185HER2抗体、抗CD3/抗p97抗体、抗CD3/抗肾细胞癌抗体、抗CD3/抗OVCAR-3抗体、抗CD3/抗L-D1(抗结肠癌)抗体、抗CD3/抗黑素细胞刺激激素类似物抗体、抗EGF受体/抗CD3抗体、抗CD3/抗CAMA1抗体、抗CD3/抗CD19抗体、抗CD3/MoV18抗体、抗神经细胞粘附分子(NCAM)/抗CD3抗体、抗叶酸结合蛋白(FBP)/抗CD3抗体、抗泛癌相关抗原(AMOC-31)/抗CD3抗体,但不限于此。在另一个实施方案中,具有一个与肿瘤抗原特异性结合的抗原结合位点和另一个与毒素结合的抗原结合位点的双特异性抗体可以包括但不限于抗皂素/抗Id-1抗体、抗CD22/抗皂草素抗体、抗CD7/抗皂草素抗体、抗CD38/抗皂草素抗体、抗CEA/抗蓖麻毒素A链抗体、抗干扰素-α(IFN-α)/抗杂交瘤独特型抗体和抗CEA/抗长春花生物碱抗体。在另一个实施方案中,双特异性抗体可选自用于转化酶活化的前药的抗体(诸如抗CD30/抗碱性磷酸酶(其催化丝裂霉素磷酸酯前药转化为丝裂霉素醇)),但不限于此。在另一个实施方案中,双特异性抗体可选自可用作纤维蛋白溶解剂的抗体,诸如抗纤维蛋白/抗组织纤溶酶原激活物(tPA)、抗纤维蛋白/抗尿激酶型纤溶酶原激活物(uPA)等,但不限于此。在另一个实施方案中,双特异性抗体可选自用于靶向至细胞表面受体的免疫复合物的抗体,诸如抗低密度脂蛋白(LDL)/抗Fc受体(例如FcγRI、FcγRII或FcγRIII),但不限于此。在另一个实施方案中,双特异性抗体可选自用于治疗感染性疾病(例如,病毒感染疾病)的抗体,诸如抗A型流感/抗B型流感、抗CD3/抗单纯疱疹病毒(HSV)、抗T细胞受体:CD3复合物/抗流感病毒、抗FcγR/抗HIV等,但不限于此。在另一个实施方案中,双特异性抗体可以选自体外或体内肿瘤检测的抗体,诸如抗CEA/抗EOTUBE、抗CEA/抗DPTA、抗p185 HER2/抗半抗原等,但不限于此。在另一个实施方案中,双特异性抗体可选自用作诊断工具的抗体,诸如抗兔IgG/抗铁蛋白、抗辣根过氧化物酶(HRP)/抗激素、抗生长抑素/抗物质P、抗-HRP/抗-FITC、抗-CEA/抗-β-半乳糖苷酶等。在另一个实施方案中,双特异性抗体的实例包括但不限于包含针对CD30的第一抗原结合位点和针对erbB2的抗原结合位点的抗体;包括针对CD30的第一抗原结合位点和针对假单胞菌外毒素(PE)的第二抗原结合位点的抗体;包括针对CD30的第一抗原结合位点和针对链霉抗生物素蛋白的第二抗原结合位点的抗体。
根据另一个实施方案,双特异性蛋白质的靶向结构域可包含至少一种选自下组的靶标特异性结合多肽:例如各种膜蛋白(各种受体(例如,受体酪氨酸激酶(RTK)等)、受体的胞外域(细胞外结构域))和各种配体(例如各种生长因子、细胞因子等)。受体的实例包括但不限于肿瘤坏死因子受体(TNFR)(例如,TNFR1、TNFR2等)、表皮生长因子受体(EGFR)(例如,Her1(表皮生长因子受体1)、Her2(人表皮生长因子受体2)、Her3(人表皮生长因子受体3)等)、血管生成素受体(例如,Tie1、Tie2等)、转化生长因子受体(例如,TGFbR1、TGFbR2、TGFbR3、TGFaR1等)、骨形态发生蛋白受体(例如,BMPR1b)、白细胞介素受体(例如,白细胞介素12受体亚基β1(IL-12R-b1)、IL-4Ra、IL-12A、IL-4、IL-1R1、IL-17RA、IL-17A、IL-12R-b2、IL-13Ra1、IL-12B、IL-13、IL-1RAP、IL-17RC、IL-17F等)、整联蛋白(例如,整合素α4(ITGA4)、整合素亚基αb2(ITGA2B)、ITGB1、ITGB3等)、干扰素受体(例如,干扰素-α/β受体1(IFNAR1)、IFNAR2、IFNGR等)、Fas(肿瘤坏死因子受体)超家族成员6;TNFRSF6)、VEGF受体(例如,Flt1(fms相关的酪氨酸激酶1)等)、肝细胞生长因子受体(例如Met等)和干扰素γ受体(IFNGR)。配体可以是选自下组中的至少一种:肿瘤坏死因子(TNF)、表皮生长因子(EGF)、血管内皮细胞生长因子(VEGF-A、VEGF-B、VEGF-C、VEGF-D等)、血管生成素(如Ang1、Ang2等)、转化生长因子(TGF)、肝细胞生长因子(HGF)、骨形态发生蛋白(如BMP2、BMP7等)、白细胞介素和干扰素,但是不限于此。
如本文所用,术语“宿主细胞”意指其中已引入表达载体(例如,编码本发明抗体的表达载体)的细胞。重组宿主细胞包括,例如转染瘤(transfectomas)(诸如CHO细胞、HEK293细胞、NS/0细胞和淋巴细胞)。
本发明的抗体中的CL结构域、CH1结构域和Fc区(例如,CH3结构域)可以从任何抗体(诸如IgG1、IgG2、IgG3或IgG4亚型、IgA、IgE、IgD或IgM)获得。抗体可以源自自包含灵长类动物(诸如人、猴等)和啮齿动物(诸如小鼠,大鼠等)的哺乳动物。因为源自哺乳动物的抗体在物种之间表现出高度的序列同源性和结构同源性,所以给出的本说明书中的CL结构域、CH1结构域和CH3结构域的解释,通常适用于源自哺乳动物的抗体。在一个实施方案中,CL结构域、CH1结构域和CH3结构域可以源自IgG(例如IgG1),但不限于此。如上所述,本发明中描述的抗体中的Fc区包含两条不同的重链(例如,可变区序列中的不同)。在两条不同的重链中,至少一条经历氨基酸突变以增加在两条不同重链之间稳定形成异源二聚体的可能性,但降低了在两条相同重链之间稳定形成同源二聚体的可能性。
本说明书中提供的双特异性蛋白质、双特异性抗体及其抗原结合片段可以使用任何方法构建,例如,通过化学合成或重组方法构建。蛋白质、抗体和片段可以是非天然存在的。
本发明中Fc二聚化所必需的突变位点描绘于图2中。总计对于引入静电相互作用突变的位点39个和交换突变的位点14个,以及大小突变的位点40个。在图2中,氨基酸残基根据典型方法表示为大写字母。恒定区中氨基酸残基的编号根据文献[Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,MD.(1991)]中描述的EU索引进行。
本发明的另一方面提供药物组合物,其包含上述双特异性蛋白质或双特异性抗体和可选的药学上可接受的载体。另一方面提供前述双特异性蛋白质或双特异性抗体在制备药物组合物中的用途。另一方面提供了制备包含上述双特异性蛋白质或双特异性抗体的药物组合物的方法。
抗体和包含抗体的组合物(例如,药物组合物)可以用于诊断和治疗,并且因此可以包含在治疗试剂盒或诊断试剂盒中。
如本文所用,“药学上可接受的载体”包括任何和所有生理学上相容的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂、吸收延迟剂、用于制备其他药物的典型载体、赋形剂和添加剂。优选地,载体可适用于静脉内、肌肉内、皮下、肠胃外、脊柱内或表皮施用(例如,通过注射或输注)。
本发明的组合物可通过本领域已知的各种方法施用。如本领域技术人员所理解的,施用途径和/或方式将根据所需结果而变化。为了通过某些施用途径给予本发明化合物,可能需要用材料包被化合物或材料与化合物共同施用以防止其失活。例如,化合物可以在合适的载体(例如脂质体或稀释剂)中施用于受试者。药学上可接受的稀释剂包括生理盐水和水性缓冲溶液。药物载体包括无菌水性溶液或分散液和用于临时制备无菌可注射溶液或分散液的无菌粉末。这些介质和试剂用于药物活性物质的用途是本领域已知的。
本文所用的短语“肠胃外施用”和“施用于胃肠外”是指除通常通过注射的肠内和外用施用以外的施用方式,并包括静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、包膜下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。
这些组合物还可含有佐剂(诸如防腐剂、润湿剂、乳化剂和分散剂)。通过上文的灭菌程序和通过包含各种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等)可以确保防止微生物的存在。还可能需要在组合物中包含等渗剂(诸如糖、氯化钠等)。此外,可以通过包含延迟吸收的试剂(诸如单硬脂酸铝和明胶)来延长可注射药物形式的吸收。无论选择何种施用途径,可以通过本领域技术人员已知的常规方法将本发明的化合物(可以以合适的水合形式使用)和/或本发明的药物组合物配制成药学上可接受的剂型。
可以改变本发明药物组合物中活性成分的实际剂量水平,以便获得对特定患者、组合物和施用方式有效实现所需治疗响应的活性成分的量,而不对患者有毒。所选的剂量水平将取决于多种药代动力学因素,包括所用本发明特定组合物的活性、施用途径、施用时间、所用特定化合物的代谢速率、治疗持续时间、与所用特定组合物组合使用的其他药物、化合物和/或材料、所治疗患者的年龄、性别、体重、状况、一般健康状况和既往病史等医学领域中众所周知的因素。
施用对象可以选自包括灵长类动物(诸如人,猴等)、啮齿动物(诸如小鼠,大鼠等)等的哺乳动物,从中分离出的包括细胞、组织和体液(例如,血液等)及其培养产品。
有益效果
本发明提供作为Chimps蛋白质的高纯度异源二聚体蛋白质(例如抗体)(其显著地不含污染物(诸如同型二聚体或单体)),及其构建技术。本发明的另一个优点是增加双特异性抗体的纯度并向天然抗体引入最少量的突变,从而不引起天然抗体的显著结构变化并降低引起抗体经历功能丧失或异常和/或引发免疫排斥反应的风险。
附图说明
图1是显示可能构建双特异性抗体(总共10个)的各种抗体形式中的仅一个完全异源二聚体双特异性抗体(虚线圆圈)的示意图。A和B分别表示彼此不同的重链,a和b分别表示彼此不同的轻链。
图2显示了根据一个实施方案,用于在Fc恒定区中诱导异源二聚化的静电相互作用、交换和大小方法中使用的抗体的残基位置,以及与其相关的残基位置。
图3是显示表4中列出的引入静电相互作用突变的异源二聚化结果的SDS-PAGE图谱。
图4是显示表5中列出的交换相关突变的异源二聚化结果的SDS-PAGE图谱。
图5是显示表6中列出的大小相关突变异源二聚化结果的SDS-PAGE图谱。
图6a显示了在表7中列出的单个突变中使得能够突出地异源二聚化的12个突变的比较。
图6b显示根据一个实施方案,在两个关键突变的S364K被其他氨基酸取代后的异源二聚化结果。
图6c显示根据一个实施方案,在两个关键突变的F405K被其他氨基酸取代后的异源二聚化结果。
图6d显示根据一个实施方案,在将另外的突变引入三个选定的钥匙-锁突变对S364K-L368D、S364K-K370S和F405K-K409F之后的异源二聚化结果,其中x轴表示分子量(kD)。
图7显示与常规技术(KiH、CPC和AzS对照)相比,单突变S364K-L368D、S364K-K370S和F405K-K409F的异源二聚化效率。当对应于每个钥匙的氨基酸残基改变为其他不同的氨基酸时,K对于S364是最佳的,并且K和R(精氨酸)对F405显示出几乎相同的效果。指示在A链和B链上产生单突变的位置,并且数值表示异源二聚化量。
图8显示与常规技术(KiH、CPC、AzS对照)相比,总共四个双突变对的异源化效率,其中,通过从三个突变对S364K-L368D、S364K-K370S和F405K-K409F的组合中选择两个双突变对,以及将每对的F405突变为K和R两类型获得四个双突变。
图9a至9c是对应于双突变对中的锁突变L368、K370和K409被表6中所示的其他氨基酸取代之后的SDS-PAGE图谱,以便当对应于锁突变的氨基酸残基改变为其他突变时鉴定更好的效果。
图10显示抗体Fab中静电相互作用相关突变、大小相关突变和交换相关突变的位置。
图11是竞争性配对(CPP)试验步骤的示意图。
图12示出了通过图11的过程在重链和轻链之间建立的配对模式,并且在重链和轻链之间的具有常规突变对C1、DuetMab和V23的4D9和2B9被克隆并共表达之后在SDS-PAGE上可视化。
图13是当通过用K(赖氨酸)取代A链(2B9重链)上的靶标氨基酸和D(天冬氨酸)取代B链(4D9重链)上氨基酸的靶标来建立重链和轻链之间的静电相互作用相关突变时,显示配对模式的SDS-PAGE图谱。
图14显示了分别用K和D取代重链L145和轻链V133产生的第30位突变的配对模式,其在突变对列表中表现出相对高的配对准确度,正如在SDS-PAGE上比较了4D9和2B9抗体。
图15和16显示通过SDS-PAGE分析,在S131D和/或S131K被引入抗体的轻链的第29位突变后的配对模式,其中该抗体重链L145被E或D取代并且轻链V133被R取代。
图17显示了通过SDS-PAGE分析的第48位(重链S183和轻链V133分别被K(R)和D(E)取代)的突变对的配对模式。
图18显示了引入表19中所示的突变对c29c30c48FΦ29f30f48及其变体后通过SDS-PAGE分析的配对模式。
图19显示在引入表20的突变对后通过SDS-PAGE分析的配对模式。
图20显示在引入表21的突变对后通过SDS-PAGE分析的配对模式。
图21显示根据一个实施方案,在第34和51位引入选自重链和轻链突变对的突变对的组合后,链的配对比例。
图22显示根据一个实施方案,引入选自重链和轻链突变对的c34Фf51突变对后,链的配对比例。
图23显示根据一个实施方案,引入选自重链和轻链突变对的c40Фf44突变对后,链的配对比例。
图24是根据一个实施方案的双特异性抗体的示意图,其中重链和轻链是突变的。
图25是显示根据一个实施方案构建的抗体中重链的A链和B链以及轻链的a链和b链的热稳定性的图。
图26是pcDNA3的切割图谱。
图27是显示根据一个实施方案构建的双特异性抗体Trabev和Adabev的疏水相互作用色谱(HIC)结果的图,每个具有向其中引入c'29c`30c48Фf`29f`30f`48突变对和AWBB突变对。
图28是显示根据一个实施方案构建的双特异性抗体Trabev的大小排斥色谱(SEC)分析结果的图,其具有向其中引入c'29c`30c48Фf`29f`30f`48突变对和AWBB突变对。
图29是显示根据一个实施方案构建的双特异性抗体Trabev和Adabev的大小排斥色谱(SEC)分析结果的图,每个具有向其中引入c'29c`30c48Фf`29f`30f`48突变对和AWBB突变对。
图30显示了根据一个实施方案构建的双特异性抗体Trabev和Adabev的二聚化模式,每个具有向其中引入c'29c`30c48Фf`29f`30f`48突变对和AWBB突变对。
图31是显示根据一个实施方案构建的双特异性抗体Trabev的抗原(Her2和VEGF)的亲和力的图,其具有向其中引入c'29c`30c48Фf`29f`30f`48突变对和AWBB突变对。
图32是显示根据一个实施方案构建的双特异性抗体Adabev的抗原(TNF-α和VEGF)的亲和力的图,其具有向其中引入c'29c`30c48Фf`29f`30f`48突变对和AWBB突变对。
图33a显示人IgG1重链恒定区和人IgA1重链恒定区(人IgG1重链恒定区:SEQ IDNO:33;人IgA1重链恒定区:SEQ ID NO:34)之间的序列比对。
图33b显示人免疫球蛋白轻链的κ恒定区和λ恒定区(人免疫球蛋白轻链的κ恒定区:SEQ ID NO:35;和人免疫球蛋白轻链的λ恒定区:SEQ ID NO:36)之间的序列比对。
图33c和33d显示人、小鼠和大鼠IgG亚型之间重链恒定区(图33c中的CH1结构域序列和图33d中的CH3结构域序列)(图33c中的人IgG1:SEQ ID NO:1、人IgG2:SEQ ID NO:2、人IgG3:SEQ ID NO:3、人IgG4:SEQ ID NO:4、小鼠IgG1:SEQ ID NO:37、小鼠IgG2a
图34显示了根据一个实施方案构建的抗体中轻链和重链之间的配对水平,所述抗体具有向其中引入c34Фf51突变对。
图35是显示根据一个实施方案构建的双特异性抗体Trabev的HIC结果的图,述抗体具有c34Фf51突变对和AWBB突变对。
图36显示了根据一个实施方案构建的双特异性抗体Adabev的HIC结果图,述抗体具有c34Фf51突变对和AWBB突变对。
图37显示了根据一个实施方案构建的双特异性抗体Trabev和Adabev的二聚化模式,每个都具有向其中引入c34Фf51突变对和AWBB突变对。
图38显示了根据一个实施方案构建的抗体中轻链和重链之间的配对水平,述抗体具有引入了c40Фf44突变对。
图39显示了根据一个实施方案构建的双特异性抗体Trabev的HIC结果的图,述抗体具有c40Фf44突变对和AWBB突变对。
图40显示了根据一个实施方案构建的双特异性抗体Adabev的HIC结果的图,述抗体具有c40Фf44突变对和AWBB突变对。
图41显示了根据一个实施方案构建的双特异性抗体Trabev和Adabev的二聚化模式,每个都具有向其中引入c40Фf44突变对和AWBB突变对。
图42是显示根据比较例单独转染Enb-Fc和Fas-Fc时的同源二聚化水平的SDS-PAGE图谱。
图43是显示将4D9重链称为A链,将与其配对的轻链作为a链,将2B9重链称为B链,将与其配对的轻链作为b链及相应产物的图。
图44是显示表19中抗体的图。
具体实施方式
在下文中,将参考实施例进一步详细描述本发明。然而,应理解,这些实施例仅用于说明目的,不应解释为限制本发明的范围。
对于本发明的实践,在以下步骤后制备所有样品。
蛋白质表达
1、将靶基因克隆到表达载体(pcDNA3(Invitrogen))。
2、在潮湿的CO
3、通过瞬时转染将制备的质粒DNA导入生长至完全汇合的HEK393E细胞中。在转染之前,用PBS(磷酸盐缓冲盐水)洗涤细胞,然后将培养基替换为无血清的高葡萄糖DMEM。
4、孵育一周后,使用条件培养基收获蛋白质,然后过滤。通过蛋白A层析分离Fc-融合蛋白和抗体。
5、在280nm处分析定量测定分离的蛋白质。
实施例1:对两个Fc区的异源二聚化的突变的选择
图2中描绘了对两个Fc区(CH3结构域;SEQ ID NO:15)的异源二聚化的突变位置(基于IgG1)由39个用于静电相互作用相关突变(引入静电相互作用突变)的位置(由“电荷J”表示),14个用于交换相关突变(交换突变)的位置(由“交换O”表示),40个用于大小相关突变(大小突变)的位置(由“大小B”表示)组成。最后在CH3结构域中选择的位置和其中的突变氨基酸总结在表3中。每个突变对应用来自不同抗体的两个Fc区(分别由A链和B链表示),然后克隆用于共表达。对于静电相互作用相关突变,进行突变以用代表带正电荷的氨基酸的K(赖氨酸)取代A链上的相应氨基酸,并用代表带负电荷的氨基酸的D(天冬氨酸)取代B链上的相应氨基酸。进行交换相关突变以相互交换A链和B链上的相应氨基酸。对于与大小相关的突变,相应的氨基酸在A链上被W(色氨酸)取代,在B链上被小尺寸氨基酸A(丙氨酸)取代。
表3
/>
为了通过SDS-PAGE容易地鉴定Fc-融合蛋白的同源二聚体或异源二聚体,使用pcDNA3载体(参见图26;Invitrogen)作为骨架,融合TNF-α受体(TNFRSF1B:NP_001057.1(编码基因:NM_001066.2的CDS;SEQ ID NO:24))的胞外域(SEQ ID NO:24的1-771区域的编码序列)至一条链(链A:依那西普)上的Fc(编码基因:SEQ ID NO:26)和Fas受体(NP_000034.1(编码基因:NM_000043.5的CDS;SEQ ID NO:25))的胞外域(SEQ ID NO:25的编码序列的区域1-519))至另一条链(链B:Fas)上的Fc(编码基因:SEQ ID NO:26)。链A的单体的大小为53kD,而链B的单体的大小为约44kD。因为各自具有Fc-胞外域融合的链A和B在大小上彼此不同,所以可以在SDS-PAGE上容易地区分两个同源二聚体(AA和BB)和一个异源二聚体(AB)。
链A之间和链B之间的二聚化百分比(%)(同源二聚化)分别表示为S
当通过SDS-PAGE观察到二聚化模式时,将具有向其中引入表3的突变的链A和B之间的同源二聚化(AA和BB)和异源二聚化(AB)的比例(%)与链A和B之间没有变异(由WT代表)的比例(%)进行比较。对于引入静电相互作用的突变的结果在表4和图3中给出,对于大小突变的结果在表5和图4中给出以及对于交换相关的突变的结果在表6和图5中给出。
表4
表5
表6
在表4至表6中,占异源二聚化率(%)70%或更高的突变以粗体表示。从表4至6的数据可以理解,测试的突变对表现出60%或更高的异源二聚化率。
通过该结果,选择12个突变对,其异源二聚化的比例高于同源二聚化,异源二聚化率为70%或更高(静电相互作用引入的突变:Y349K-E357D、E357K-Y349D、E357K-K370D、S364K-L368D、T366K-Y407D、T394K-T394D、T394K-V397D;和交换突变:E357Y-Y349E、E357K-K370E、S364K-K370S、F405K-K409F、Y407T-T366Y)(在表4和5中以粗体表示)
将选择的12个氨基酸对中包含的12种氨基酸残基突变中的每一个引入Fas-Fc融合蛋白中,以分别表达在氨基酸位置含有单个突变的突变Fas-Fc融合蛋白。在相同条件下,比较同源二聚体和单体存活率(S
表7
在表7和图6a中,选择两个突变S364K和F405K,其同源二聚化率低但单体存活率高(50%或更高)。
据推测,两个选定的突变充当“钥匙”突变,而与另一个链相互作用的CH3结构域位点是“锁”突变。作为其间的组合,选择三个钥匙-锁对S364K-L368D、S364K-K370S和F405K-K409F。将这些突变对引入链A(钥匙突变)和链B(锁突变)以产生三种不同的单突变对(见表8)。
表8
如上所述,将各个钥匙突变位置的氨基酸用不同的氨基酸残基取代,并测试单突变诱导的异源二聚化效果,以鉴定对该位置处的异源二聚化有效的突变类型。对于S364,观察到用K(赖氨酸)取代导致最高的异源二聚化效果。用N(天冬酰胺)和R(精氨酸)取代后检测到显著的效果(参见图6b)。F405在用K和R取代时表现出优异的类似异源二聚化效果,并且在用N和Q(谷氨酰胺)取代时具有突出的异源二聚化效果(参见图6c)。
图6b和6c中鉴定了额外的突变S364N、S364R、F405R、F405N和F405Q,这些突变被应用于三个已选择的钥匙-锁突变对S364K-L368D、S364K-K370S和F405K-K409F以向链A(TNFR2-Fc)引入锁突变并向链B(Fas-Fc)引入钥匙突变,随后用SDS-PAGE分析异源二聚体化效果。
由此获得的结果描绘于表9和图6d中:
表9
(S
S
S
实施例2:通过单突变测试Fc区的异源二聚化
在SDS-PAGE上对实施例1中选择的三个钥匙锁突变对S364K-L368D、S364K-K370S和F405K-K409F,以及用R取代K的取代F405产生的突变对F405R-K409F,测试异源二聚化。将异源二聚化效果与用常规异源二聚体Fc突变对KiH、CPC和AzS获得的那些作为对照进行比较。
通过GelQuant.NET软件对带强度进行定量,获得本实施例和所有以下实施例中的SDS-PAGE数据。
结果如表10和图7所示:
表10
/>
(S
S
Tm测量如下:
试剂:Invitrogen 4461146“Protein Thermal Shift
仪器:Chromo4-PTC200(MJ Research)
反应混合物:总共20μL
方案:
1、在50.0℃孵育30秒;
2、熔解曲线从50.0℃到90.0℃,每0.2℃读数,保持2秒;
3、在90.0℃孵育2分钟
4、在10.0℃永久孵育
5、结束
如表10和图7所示,当链A和链B各自分别表达时,保留钥匙的链A不形成同源二聚体,而是表示为单体。观察到由共表达产生的样品不含同源二聚体,而主要是异源二聚体(参见图7)。
实施例3:通过双突变的Fc区的异源二聚化
同源二聚化的可信性较低可能是由于钥匙突变在链A和B上均存在而不是在任意一条链上存在。从实施例1中选择的三个突变对的组合制备两个双突变对。对于每个双突变对,F405突变为两类型K和R。因此,获得总共四个双突变对。在SDS-PAGE上分析这些发现的双突变对的异源二聚化,并将二聚化效果与对照KiH、CPC和AzS的那些进行比较。
结果在表11和图8中给出:
表11
/>
如表11和图8所示,两个链中存在的钥匙突变使得能够在单独表达时四个突变对中的任一个都不具有链的同源二聚化。观察到由共表达产生的样品中的所有蛋白质是异源二聚体(参见图8)。另外,在引入F405R的双突变对中测量的热稳定性高于引入F405K的双突变(表11)。
为了检查当对应于锁突变的氨基酸被其他残基取代时是否获得了更好的效果,L368、K370和K409(其是双突变对中的锁)被其他氨基酸残基取代。通过各种突变L368、K370和K409获得的突变组合总结在表12中。在SDS-PAGE上测试突变组合的异源二聚化(NR:8%SDS-PAGE凝胶;样品:上样24ul),并且在图9a至9c中描述结果。
表12
锁变体
/>
测量了组合的热稳定性(参见实施例2),且结果在表13中给出。
表13
分析显示K409W(色氨酸)的热稳定性高于K409F。
基于上面获得的数据,将S364K和K409W突变入链A以及将K370S和F405R突变入链B中以产生双突变对,称为AWBB突变对,用于随后的CH3结构域的Fc异源二聚化试验。
实施例4:抗体Fab中重链和轻链突变的选择
为了选择抗体重链和轻链中的突变,进行静电相互作用相关的突变、大小相关突变和交换相关突变。重链和轻链的相互作用位置如图10所示。
为了容易地鉴定重链和轻链中的突变,克隆了具有相同轻链的抗体。抗流感抗体4D9抗体(抗A型流感抗体)和2B9抗体(抗B型流感抗体)具有相同的轻链(共同轻链:CLC)。因为它们具有相同的轻链,SDS-PAGE分析使得能够容易理解重链和轻链之间的相互作用。尽管轻链的氨基酸序列相同,但两个抗体4D9和2B9在重链的序列和大小方面彼此不同(2B9的重链比4D9的氨基酸残基多6个并且大小(50130.62道尔顿)大于4D9的大小(49499.98道尔顿):它们可以在SDS-PAGE上清楚地区分。因此,SDS-PAGE上的大小分析使得可以理解两条链中的哪一条链与轻链相互作用。
两种抗体4D9和2B9的重链可变区和轻链可变区中的氨基酸序列和编码核酸序列列于下表14中。
表14
两种抗体4D9和2B9使用IgG1的恒定区作为重链恒定区,并且使用κ恒定区作为轻链恒定区。
进行检查以观察其中引入了突变的轻链是否仅与具有与轻链突变相互作用的突变的重链配对。在这方面,共表达轻链、与轻链配对的重链和与轻链形成错配的重链以提供抗体。还原条件下抗体的SDS-PAGE分析可以确定配对准确形成的程度。为方便起见,将4D9重链称为A链,将与其配对的轻链作为a链,将2B9重链称为B链,将与其配对的轻链作为b链(参见图43)。
首先,克隆并共表达已知是有效的重链和轻链之间具有常规突变对的4D9和2B9。在SDS-PAGE上检查通过所得突变链(即两条重链和一条轻链)之间的竞争建立的配对模式(竞争配对(CPP)试验)。进行竞争性配对(CPP)试验的过程在图11中示意性地示出,且这样获得的结果在图12中描绘。如图12所示,所有已知的突变对同时进行正常配对和异常错配。
对于重链和轻链之间的静电相互作用相关突变,引入各种突变对的抗体,(其中B链(2B9重链)中的相应氨基酸被K(赖氨酸)取代,而A链(4D9重链)中的相应氨基酸被D(天冬氨酸)取代)在SDS-PAGE上进行CPP试验(参见图11)。
结果,在静电相互作用相关突变组中筛选了7个被鉴定为经历相对准确配对的候选突变对。在引入了七个筛选的突变对的抗体的SDS-PAGE上的CPP试验结果在表15中给出并在图13中描绘。
表15
(CPP Score(S
a
b
SDS-PAGE上的比较在使用4D9(A链)和2B9(B链)抗体(在表15中以粗体表示)的突变对列表中发现了一些进行相对准确的配对的突变对。为了进一步研究,如表16中那样修饰第30位的突变(表示为c30Φf30)。
表16
第30位的突变分别由K和D取代重链L145和轻链V133产生。从表16的数据可知,对于重链L145和轻链V133分别被R和D取代的变体,观察到效果(配对准确度:Aa配对或Bb配对比)良好(Aa配对准确度75%、Bb配对准确度:60%)(参见图14)。
在轻链上添加突变S131D(称为第29位突变)至第30位的突变或其变体(重链L145和轻链V133分别用K或R,和D或E取代)改善了配对的准确度(参见表17和图15(c29c
表17
如图14和15所示,在重链L145和轻链V133分别由R和D取代并且轻链S131和V133分别由K和R取代,或重链L145在第30位分别由D和E取代并且轻链V133分别由K和D取代的情况下,检测到出色的配对准确度。
此外,还观察到其中分别由K(或R)和D(或E)取代的重链S183和轻链V133突变对(称为第48位突变)是有效的(表18和图17(Aa配对准确度(下部条带):45%,Bb配对准确度(上部条带):95%)。
表18
构建含有第29位、第30位的上述突变与第48位突变(c29c30c48FФ29f30f48)或其变体的组合的抗体(参见表19和图44),然后测试配对准确度。结果如图18所示(下部条带:Aa配对;以及上部条带:Bb配对):
表19
另外,检查了含有第29位突变、第30位突变和第48位突变(见表20)中至少一个的变异突变对的抗体的配对准确度,结果如图19所示(下部条带:Aa配对;以及上部条带:Bb配对):
表20
(Aa:Aa配对准确度;Bb:Bb配对准确度)
进一步地,将第29位突变、第30位突变和第48位突变的组合进行D和E之间的交换以搜索使得能够相对精确配对的组合(表21和图20)。
表21
(Aa:Aa配对准确度;Bb:Bb配对准确度)
从表21和图20中可以看出,所有测试的突变对ab、gh和abgh表现出65%或更高,或95%或更高的配对准确度。其中,abgh被选中并被称为c`29c`30c48Фf`29f`30f`48突变对。
对引入选自表15中鉴定的突变对中第34位和51位的突变对的组合的链的配对进行测试,结果在表22和图21中给出。
表22
另外,将表15的第34位突变和第51位的突变从K变为R,以及从D变为E,然后进行配对测试,以检测具有改善的配对准确度的组合。结果,轻链上的L135和T180各自被E取代的组合在配对准确度方面得到改善,称为c34Фf51突变对(参见表23和图22)。
表23
在表15中发现的各种突变对中,还观察到第40位突变和第44位突变的组合以提高配对准确度。
此外,对所有突变对进行K和R之间以及D和E之间的交换,以寻找使得能够最准确配对的组合。该组合是轻链L135被R和E取代的突变对,并且被称为c40Фf44突变对(参见表24和图23):
表24
实施例5:通过重链之间和重链与轻链之间的偶联形成双特异性抗体
5.1、具有向其中引入c'29c`30c48Фf`29f`30f`48突变对的双特异性抗体
5.1.1、使用4D9/2B9抗体测试重链和轻链之间的偶联
通过偶联含有c'29c`30c48Фf`29f`30f`48突变对的重链和轻链构建抗体(参见表25):
表25
为了检查双特异性抗体中A链、B链、a链和b链之间配对的准确度,在正常配对和异常错配的所有可能组合中共表达各个重链和轻链。通过SDS-PAGE测量的表达水平在下表26中给出。测量组合的热稳定性(Tm),且结果在表27和图25中给出:
表26
表27
参考实施例2中说明的方法测量热稳定性(Tm)。
如表26和27以及图25所示,发现具有向其中引入c'29c`30c48Фf`29f`30f`48突变对的双特异性抗体的正常配对(Aa/Bb)的表达水平和热稳定性高于异常配对(Ab/Ba)。
5.1.2、曲妥单抗/贝伐单抗双特异性抗体或阿达木单抗/贝伐单抗双特异性抗体购买曲妥单抗(
表28
双特异性抗体Trabev和Adabev在以下条件下进行疏水相互作用色谱(HIC),结果如图27所示(y轴:值(mAU);和x轴:时间(分钟)):
仪器:HPLC-U3000
专栏:MAbPac Hic-20
流速:0.2mL/min
检测:UV,280nm
流动相:0.10M乙酸铵,pH7.0
所获得的蛋白质通过HIC柱的通道在不同的时间点形成峰,这取决于蛋白质的疏水性,由此可以解释精确的双特异性抗体的构建。如图27所示,两种不同的同源二聚体抗体(曲妥单抗和贝伐单抗,或阿达木单抗和贝伐单抗)的峰之间与异源二聚化双特异性抗体(Trabev和Adabev)的峰是观察到有区别的,表明双特异性抗体的很好地形成,每种抗体由来自两种不同抗体的半部分组成。
另外,对由此获得的双特异性抗体Trabev和Adabev进行大小排斥色谱(SEC)分析,结果在表29和图28和29中给出(x轴:时间(分钟)):
仪器:HPLC-U3000
柱:大小排斥色谱T SKgel G3000SWXL Tosoh Bioscience
流速:1.0mL/min
检测:UV,280nm
流动相:25mM Tris-HCl(pH8.5),150mM NaCl
表29
在SEC分析中,根据蛋白质大小检测峰,并且可以阐明蛋白质聚集。如表29和图28和29所示,双特异性抗体的峰在时间轴上存在于两个相应抗体的峰之间,表明双特异性抗体的很好地形成。
进一步地,双特异性抗体Trabev和Adabev在SDS-PAGE上的异源化模式描述于图30中。如图30所示,作为异源二聚体的双特异性抗体Trabev和Adabev分别被检测到在曲妥单抗和贝伐单抗之间以及阿达木单抗和贝伐单抗之间的中等大小的单一条带。这些结果意味着双特异性抗体不是同源二聚体,而是仅作为正常配对的结果而构建。
通过ELISA,进行测试以检查BsAb是否有效结合各自的抗原(曲妥单抗:Her2)、贝伐单抗(VEGF)和阿达木单抗(TNF-α)。
抗原的亲和力测量如下:
试剂
检测抗体:山羊抗人κ-HRP(南方生物技术,2060-05)
TMB单溶液(LIFE TECHNOLOGY,002023)
仪器
Emax精密酶标仪(Molecular devices)
方案
包被缓冲液:碳酸盐缓冲液pH 9.6
封闭缓冲液:无蛋白质(TBS)封闭缓冲液(Thermo scientific)
洗涤缓冲液:TBS中0.05%(w/v)Tween20,pH7.4(TBST)
稀释剂:TBS中的0.05%(w/v)Tween20,pH7.4
停止缓冲液:1N盐酸溶液(HCl)
方案
包被:在包被缓冲液中稀释抗原,每孔加入100μl稀释液,4℃孵育过夜(Her2、VEGF:50ng/孔,TNF-α:100ng/孔);
用洗涤缓冲液洗涤3次;
封闭:加入300ul封闭缓冲液,室温(RT)孵育1小时;
用洗涤缓冲液洗涤3次;
结合:以100ng/孔的等分试样加入抗体,并在室温下孵育1小时;
用洗涤缓冲液洗涤3次;
检测抗体:在TBST中以1:4000的比例稀释山羊抗人κ-HRP,并在室温下孵育1小时;
用洗涤缓冲液洗涤3次
检测:每孔加入100μl TMB溶液,在室温下在黑暗中孵育3分钟;
停止溶液:每孔加入100μl 1NHCl;
读数:在光密度450nm下读数
由此获得的结果在表30和图31(对于Trabev)和表31和图32(对于Adabev)中给出:
表30
表31
如表29和图31所示,发现双特异性抗体Trabev分别与曲妥单抗和贝伐单抗的抗原Herst和VEGF结合。此外,表30和图32中的数据证明了双特异性抗体Adabev分别与阿达木单抗和贝伐单抗的抗原TNF-α和VEGF结合。这些结果证实,成功构建了正常发挥所需功能的两种双特异性抗体。
5.2、具有向其中引入c34Фf51突变对的双特异性抗体
参考实施例5.1.1,构建了引入c34Фf51突变对至4D9(Aa)和2B9(Bb)的抗体(参见表23)。对于每条重链,共表达a轻链和b轻链,并在SDS-PAGE上测量内部轻链/重链配对比例(对于重链A和B各自进行)。如实施例2中那样测量Tm,结果在下表32和图34中给出。
表32
(q:轻链/重链比例(%);N/A:不可用)
如表32和图34所示,正常的重链/轻链对(Aa和Bb)分别以高达90%和89%的比例形成,并表现出高的热稳定性。
此外,使用曲妥单抗(
使用参照实施例5.1.2的方法的疏水相互作用色谱法(HIC)分析构建的双特异性抗体Trabev和Adabev,每个具有向其中引入c34Фf51突变对和AWBB突变对。
得到的分析数据在表33和图35(对于Trabev)和表34和图36(对于Adabev)中给出。
表33
表34
从表33和图35以及表34和图36中可以看出,在两种相应的单特异性抗体(曲妥单抗和贝伐单抗,或阿达木单抗和贝伐单抗)的峰之间明显观察到每种异源二聚体双特异性抗体(Trabev和Adabev)的峰。结果意味着很好地形成了具有向其中引入c34Фf51突变对和AWBB突变对的双特异性抗体,每个抗体由来自两种不同抗体的半部分组成。
进一步地,具有向其中引入c34Фf51突变对和AWBB突变对的双特异性抗体的异源化模式描述于图37中(SDS-PAGE凝胶6%,非还原条件)。如图37所示,通过SDS-PAGE分析,发现将c34Фf51突变对和AWBB突变对同时引入已知抗体中来构建纯的异源二聚体。
5.3、具有向其中引入c40Фf44突变对的双特异性抗体
参考实施例5.1.1,构建了具有向其中引入c40Фf44突变对(参见表24)至4D9(Aa)和2B9(Bb)的抗体。对于每条重链,共表达a轻链和b轻链,并在SDS-PAGE上测量内部轻链/重链配对比例(对于重链A和B各自进行)。如实施例2中那样测量Tm,结果在下表35和图38中给出。
表35
(q:轻链/重链配对比例(%);N/A:不可用)
如表35和图38所示,正常的重链/轻链对(Aa和Bb)均以高达99%的比例形成,并表现出高的热稳定性。
此外,使用曲妥单抗(
使用参照实施例5.1.2的方法的疏水相互作用色谱法(HIC)分析构建的双特异性抗体Trabev和Adabev,每个具有向其中引入c40Фf44突变对和AWBB突变对。
得到的分析数据在表36和图39(对于Trabev)和表37和图40(对于Adabev)中给出。
表36
表37
从表36和图39以及表37和图40中可以看出,在两种相应的单特异性抗体(曲妥单抗和贝伐单抗,或阿达木单抗和贝伐单抗)的峰之间明显的观察到每种异源二聚体双特异性抗体(Trabev和Adabev)的峰。结果意味着很好地形成了具有向其中引入c40Фf44突变对和AWBB突变对的双特异性抗体,每个抗体由来自两种不同抗体的半部分组成。此外,在两种单特异性抗体之间仅明显出现一个峰,表明只形成了一种正常配对而在两条重链之间以及重链和轻链之间没有错配。
进一步地,具有向其中引入c40Фf44突变对和AWBB突变对的双特异性抗体的异源化模式描述于图41中(SDS-PAGE凝胶6%,非还原条件)。如图41所示,通过SDS-PAGE分析,发现将c40Фf44突变对和AWBB突变对同时引入已知抗体中构建纯异源二聚体。
对比例1
检测了本文提出的CH3结构域突变的情况下的异源二聚化率,所述CH3结构域的突变与实施例1至3中引入的突变不同,尽管是相同的氨基酸对。
为了对比,参考实施例1构建引入表38突变的TNFRSF1B-Fc融合蛋白(依那西普;Enb)和Fas-Fc融合蛋白(Fas)(表达为BEAT-A和BEAT-B)。
表38
制备具有选自实施例3中的CH3结构域突变的TNFRSF1B-Fc融合蛋白(A链)和Fas-Fc融合蛋白,其是在说明书中提出的CH3结构域突变(例如,具有向其中引入S364K和K409W的A链和具有向其中引入K370S和F405R的B链)(在表38中表示为AW/BB)的代表。
当具有表38中列出的突变对的Enb-Fc和Fas-Fc进行单次转染时,在SDS-PAGE上观察到同源二聚化模式。结果在图42中给出。
如图42所示,AW/BB表现出高百分比的单体,而在BEAT-A和BEAT-B中检测到比单体更高百分比的同源二聚体。在该结果的基础上,当A链和B链之间的表达水平存在差异时,BEAT-A和BEAT-B更可能形成同源二聚体而不是AW/BB。如果在组合重链和轻链以构建双特异性抗体时产生大量同源二聚体,则难以从同源二聚体中分离出精确的异源二聚体,因为异源二聚体与同源二聚体之间的物理性质几乎没有差异。因此,最小化同源二聚化对于构建高纯度的双特异性抗体非常重要。尽可能少地允许异源二聚化的突变组合有利于构建双特异性抗体。
总之,数据显示BEAT-A和BEAT-B由于与AW/BB相比较高的同源二聚化速率而具有低的异源二聚化潜力,并且使得难以分离精确的异源二聚体。
- 靶向KIF20A阳性胰腺癌双特异性抗体NK细胞及制备方法和应用
- 一种即食活性双蛋白为原料制备固态免消化蛋白质的方法
- 双特异性蛋白质及其制备方法
- 靶特异性双突变体融合蛋白质及其制备工艺
