抗类风湿因子的阻断剂及制备方法,应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物技术领域,涉及抗类风湿因子免疫检测干扰物质,尤其涉及抗类风湿因子免疫检测干扰物质的阻断剂及制备方法,应用。
背景技术
干扰物是临床实验室检测误差的一个很重要的来源,广义上干扰物是指导致分析物浓度或催化活力出现偏移的物质,干扰物通过干扰作用来影响分析特异性,从干扰物来源,干扰作用分为内源性和外源性干扰。类风湿因子(RF)是一种抗人或动物IgG分子Fc片段抗原决定簇的抗体,是以变性IgG为靶抗原的自身抗体,人体内普遍存在着类风湿因子。RF最初在类风湿性关节炎(RA)患者血清中发现,RA患者体内有产生RF的B细胞克隆,在变性IgG或EB病毒的直接作用下可大量合成RF,RF主要为IgM类自身抗体,但也有IgG类、IgA类、IgD类和IgE类。人血清中IgM、IgG型类风湿因子(RF)可以与免疫检测系统中的捕获抗体及标记二抗的Fc段直接结合,从而导致假阳性或者假阴性结果。目前有多种方法可以排除此类干扰,但是对于大量样本处理起来极为繁琐,大大增加工作量。阻断剂是一类能应用于体外诊断试剂开发过程中,以达到减少来自患者样本中的蛋白质干扰或者试验过程中的其他因素影响并由此可能造成的假阳性、假阴性的错误检测结果。使用阻断剂来阻断干扰能够使得大量样本的处理变得轻松简单。好的阻断剂必须具备不能干扰正常检测、能够完全阻断干扰等基本性能。
阻断剂是一种需要大量使用的原材料,市面上的优质阻断剂多为进口试剂,价格相对昂贵,存在一定的应用限制。现阶段国内多数效果优质的RF阻断试剂多需要进行化学交联或者一些其他特殊处理,这些后期的处理操作对阻断剂本身也是一种伤害,不同处理批次的效果一致性难以保证;不经过处理的特异性RF单克隆抗体的阻断效果以及应用领域同进口试剂之间的差距较大,主要表现为阻断效果相对较差、不同平台的阻断效果层次不齐、对于不同来源/批次的RF样本存在阻断效果的较大差异。
发明内容
为了解决上述问题,本发明提供了抗类风湿因子免疫检测干扰物质的阻断剂及制备方法,应用,主要针对免疫检测平台的RF阻断的阻断效果优异、批次稳定、一致性好、价格低廉、应用广泛的单克隆抗体,提供RF阻断剂的可变区序列,满足体外重组并方便进行体外亲和力成熟操作,实现RF阻断剂的稳定批量生产和正向效果提高。
为了实现上述目的,本发明采用以下技术方案:
本发明首先提供了抗类风湿因子免疫检测干扰物质的阻断剂的制备方法,包括以下步骤:
一)使用人IgM蛋白进行小鼠免疫,细胞株以及单克隆抗体制备;
二)根据步骤一)进行人IgG蛋白的B/C小鼠免疫和单克隆抗体制备
三)抗人IgM特异性抗体作为阻断剂使用的筛选:
1)抗人IgM单克隆抗体进行竞争ELISA检测和间接ELISA检测,对抗体进行亚类分型和表位区分;竞争ELISA检测筛选获得可能相似/相同的同类型抗体;同时获得表位相似/相同的同种抗体;
2)间接ELISA测试单克隆抗体针对人IgM的表位特异性,使用人IgG蛋白、小鼠IgG蛋白、小鼠IgM蛋白作为抗原,进行单克隆抗体的识别性能测试,保留仅具有人IgM识别性的单克隆抗体株进行下一步筛选;
3)仅具有人IgM识别性的单克隆抗体进行人IgM区段表位特异性筛选,以hIgM_F(ab)2、hIgM_Fc作为抗原,保留具有hIgM_Fc识别性的单克隆抗体;
4)具有hIgM_Fc识别性的单克隆抗体进行RF样本的阻断测试,保留具有RF阻断效果的单克隆抗体;具有RF阻断效果的单克隆抗体测试多份RF样本,保留具有多份RF样本阻断效果的单克隆抗体,得到RF阻断剂。
作为本发明的一种优选方案,所述RF阻断剂中包括重链可变区和轻链可变区。
作为本发明的一种优选方案,轻链可变区包括氨基酸序列如SEQ ID No:4的FRL1,如SEQ ID No:5所示的CDRL1,如SEQ ID No:6所示的FRL2,如SEQ ID No:7所述的CDRL2,如SEQ ID No:8所示的FRL3,如SEQ ID No:9所示的CDRL3与如SEQ ID No:10所示的FRL4。
作为本发明的一种优选方案,重链可变区包括氨基酸序列如SEQ ID No:14所示的FRH1,如SEQ ID No:15所示的CDRH1,如SEQ ID No:16所示的FRH2,如SEQ ID No:17所示的CDRH2,如SEQ ID No:18所示的FRH3,如SEQ ID No:19所示的CDRH3,如SEQ ID No:20所示的FRH4。
作为本发明的一种优选方案,轻链可变区的氨基酸序列如SEQ ID No:2所示。
作为本发明的一种优选方案,重链可变区的氨基酸序列如SEQ ID No:13所示。
作为本发明的一种优选方法,所述阻断剂通过体外重组的方式得到重组RF阻断剂。
本发明还提供了上述的方法制备而成的抗类风湿因子阻断剂或者重组RF阻断剂。
本发明还提供了上述的抗类风湿因子阻断剂或者重组RF阻断剂在免疫检测中的应用。
与现有技术相比,本发明具有以下有益效果:
1)本发明的RF的有效阻断:ELISA检测,阻断168UI(merdiaT_A01270H)的RF仅需要使用该阻断剂15μg/mL,对比某知名HBR(不能提供具体厂家)阻断剂使用量15μg/mL时不能完全阻断干扰;该阻断剂主要针对RF的阻断,同时具有部分黄疸、高脂、溶血样本的阻断效果。
2)本发明的阻断剂不干扰正常检测结果:该阻断剂为人IgM抗体,但也具有人IgG的识别活性、可能也具有人IgA、人IgD和人IgE的识别活性,仅阻断干扰因子的不正常检测,不会带来额外的干扰,对正常检测结果无任何影响。
3)本发明的阻断剂的生产稳定:该阻断剂为IgG1_kappa型鼠单抗,细胞株稳定,抗体得率稳定,不需要进行后期的任何处理,保证了不同批次效果的一致性。
4)本发明的阻断剂可实现体外重组:该阻断剂的完整序列已知,已经进行体外重组表达,获得了较高的表达效率以及纯化得率,在满足应用需求的同时避免了实验鼠异常带来的生产和使用阻碍。
5)本发明实现阻断剂的体外亲和力成熟:该阻断剂经过可变区关键位点的氨基酸的定点突变,不仅实现了阻断效率的提升,同时还能够满足不同平台的检测需求,扩大了阻断剂的应用范围。
附图说明
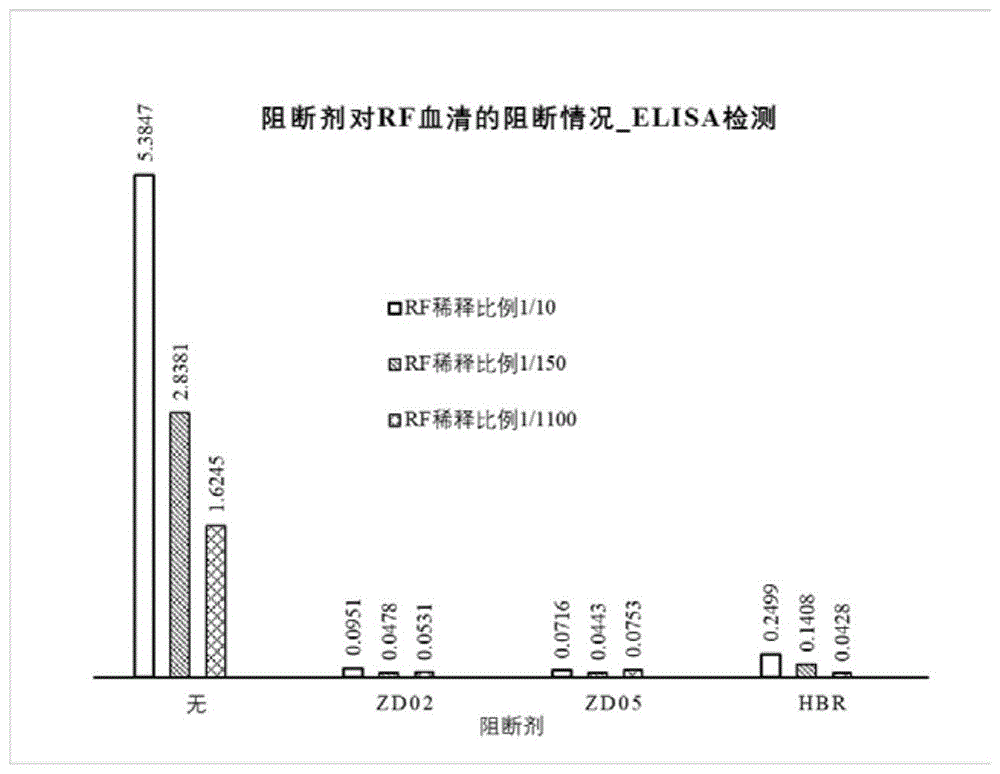
图1是本发明的ZD02&ZD05阻断剂对RF的阻断效果对比。
图2是ZD02&ZD05酶切效果SDS-PAGE分析。
图3是ZD02、CZD02、MZD02阻断效果对比测试。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于理解,下面结合具体实施例,进一步阐述本发明,但下述实施例仅仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
临床检测中的干扰来源主要有两种,外源性干扰和内源性干扰,外源性干扰可以通过严格的样本处理来避免,内源性干扰则需要考虑使用有效的阻断剂,而内源性干扰主要是由自身抗体,如类风湿因子(RF)引起,能够直接同检测抗体的Fc结合,造成检测结果的偏离。类风湿因子主要为IgM类自身抗体,占比超过70%,可以考虑使用阻断剂实现对RF的特异性结合,相似专利可见CN 115677856、CN 113295860、CN106645681、CN202210915782.6,从而达到阻断RF干扰的目的。
RF阻断剂分为主动型和被动型,被动型阻断剂不具有阻断的特异性,主动型阻断剂一般为特异性的多抗或者单抗,考虑使用抗人IgM类蛋白抗体作为RF阻断剂使用。
单克隆抗体技术成熟、应用广泛、操作相对简单,考虑以PEG介导的杂交瘤细胞获取单克隆抗体作为阻断剂的主要来源,相似专利可见CN202210915782.6。
单克隆抗体的大批量获得以及效果提升的途径较多,比如:动物腹水、细胞大规模培养、基因重组、体外亲和力成熟等,均可考虑作为阻断剂的生产条件。通过PCR的方式调取RF阻断剂抗体序列,获得完整的抗体氨基酸和核酸序列,以备体外重组和亲和力成熟操作。
体外重组是一种不要求严格免疫检疫动物培养条件的新颖并快速发展的成熟抗体的获取方式,动物腹水的获取具有不确定性,考虑使用RF阻断剂的完整序列进行真核表达并获取应用水平的重组RF阻断剂。
体外亲和力成熟是一种提高抗体亲和力的有效手段,考虑进行CDR特定位点的氨基酸突变来提高RF阻断剂的亲和力,即提升阻断效果。
实施例1
类风湿因子(RF)阻断剂的制备和筛选方法
通过对RF特性的分析,选择使用人IgM蛋白作为抗原,理论上人IgM中存在部分的RF,人IgM多为天然提取,不同批次之间具有较大的差异,需要准备至少3个不同批次的人IgM蛋白;考虑到人IgM同人IgG之间具有一定程度的交叉,需要准备不同批次的人IgG,用于排除交叉和获取抗变性人IgG抗体,可作为类风湿因子类似物的获取方法;准备免疫动物来源的IgM/IgG蛋白,作为可能存在的交叉干扰的筛选排除。
目前能够获取的类风湿因子的样本均为血液样本,不同厂家/不同批次的样本存在着较大的差异,需准备至少3个不同厂家/批次的样本作为检测的参考标准,同时对大量临床检测样本进行筛选可获得RF含量未知的阳性样本,也可以作为检测的定性和相对定量参考。
具体步骤:
一、使用人IgM蛋白进行小鼠免疫,细胞株以及单克隆抗体制备的简要步骤:
1)选择5~6周龄的免疫缺陷小鼠,BALB/c小白鼠(B/C)、或者C57小黑鼠(均购买自北京维通利华/斯莱克)。
2)以人IgM蛋白(他人提供)进行小鼠免疫。
3)根据所使用的佐剂(购买自sigma)适用的最佳免疫剂量以及免疫间隔分别进行不同方式的免疫注射,可包括皮下、肌肉、腹腔等。第3次加强免疫7天后采集静脉血测试抗血清效价,效价达到10^6(免疫小鼠的抗血清稀释1000000倍仍然具有检测阳性)可进行细胞融合。
4)选择小鼠骨髓瘤细胞SP2/0株系,培养至生长对数期,保持最佳状态。
5)融合前四天再进行一次腹腔的冲击免疫和尾静脉冲击免疫。
6)采用聚乙二醇(PEG)(购买自sigma)细胞融合法。
7)融合细胞培养方式为半固体法培养。
8)阳性细胞株由间接ELISA检测,最终获得单克隆杂交瘤细胞株。
9)通过收集培养上清液和小鼠腹腔诱生腹水,亲和纯化分离获得特异性单克隆抗体。二、根据上述的步骤一进行人IgG蛋白的B/C小鼠免疫和单克隆抗体制备。
三、抗人IgM特异性抗体作为阻断剂使用的筛选:
1)抗人IgM单克隆抗体进行竞争ELISA检测和间接ELISA检测,对抗体进行亚类分型和表位区分。
2)竞争ELISA测试筛选获得可能相似/相同的同类型抗体,抗原为人IgM抗人IgM单克隆抗体之间互为竞争蛋白;同时获得表位相似/相同的同种抗体。
3)间接ELISA测试单克隆抗体(RF阻断剂)的亚类和轻链类型,抗原使用人IgM蛋白,第二抗体使用特异性分型酶。
4)间接ELISA测试单克隆抗体针对人IgM(hIgM)的表位特异性,使用人IgG蛋白(hIgG)、小鼠IgG蛋白(mIgG)、小鼠IgM蛋白(mIgM)作为抗原,进行单克隆抗体的识别性能测试,最终保留仅具有人IgM识别性的单克隆抗体株进行下一步筛选。
5)仅具有人IgM识别性的单克隆抗体进行人IgM区段表位特异性筛选,以hIgM_F(ab)2、hIgM_Fc作为抗原,保留具有hIgM_Fc识别性的单克隆抗体。
6)具有hIgM_Fc识别性的单克隆抗体进行RF样本的阻断测试,保留具有RF阻断效果的单克隆抗体,见表1。
7)具有RF阻断效果的单克隆抗体测试多份RF样本(购自merdian、其他实验室提供),保留具有多份RF样本阻断效果的单克隆抗体,即RF阻断剂,见表1。
8)RF阻断剂进行RF样本阻断的定量测试,保留具RF阻断剂低浓度工作剂量阻断高浓度RF样本的较优质RF阻断剂,见表1。
9)较优质RF阻断剂进行同类型市售HBR阻断剂(标准)的对比测试,保留对RF阻断效果不低于标准的RF阻断剂,即最终RF阻断剂,命名为ZD01、ZD02,见表1。
10)通过蛋白稳定性、批次一致性、蛋白生产得率等各方面综合考量,最终保留ZD02,ZD02蛋白生产得率高、批间差小、蛋白冻融稳定性好、长期保存稳定性好、客户试用正向反馈度高。
本发明所提供的RF阻断为明确的抗hIgM_Fc的IgG1_kappa型鼠单抗,利用PCR扩增和基因测序已知ZD02可变区序列,后期能够进行基因重组获得哺乳动物表达ZD02重组抗体。
在本发明中,实施例1还具有以下的替代方案:
替代方案1:使用RF的重组蛋白,即重组的hIgM蛋白,进行免疫刺激,获得相应的特异性抗体,筛选得到具有RF阻断效果的抗体株,避免了不同批次提取的天然hIgM差异造成的测试偏差,同时减少天然hIgM免疫制备/筛选抗体的巨大工作量(天然hIgM存在一定量的其他人体蛋白的参杂,如白蛋白、纤维蛋白原等,均具有很强的免疫原性)。
替代方案2:使用化学或者物理手段处理过的hIgG,即为变性hIgG,作为免疫原制备其特异性抗体,将其特异性抗体混合物作为抗原,进行免疫,获得抗变性hIgG的IgM型、IgG型抗体,此步骤即为RF模拟;再将抗变性hIgG的IgM型、IgG型抗体作为抗原,制备其特异性抗体,即可作为RF的特异性抗体,筛选具有RF阻断效果的抗体株变得更加简单和高效;同理,可以获得抗变性hIgG的IgA、IgE、IgD抗体,制备并筛选等到相应抗体。
表1.阻断剂的阻断效果测试
参见表1,阻断剂的阻断效果测试(RF、RF-C、假阳1#、假阳2#均为RF阳性标本,PBS稀释1/10使用,阻断剂工作浓度0~100μg/mL,随着阻断剂工作浓度的增加阻断效果提升,数值越低表明阻断效果越好,对照阻断剂ZD001-2、ZD001-5对假阳1#、假阳2#的阻断效果差,ZD03、ZD04几乎无阻断效果,ZD01、ZD02、ZD05、ZD06均具有不低于市售优质优质阻断剂JD-HBR、KQ-HBR的阻断效果)。
对比例1
同HBR阻断剂的表位相同的同类型单克隆抗体的制备和筛选
通过对HBR阻断剂的解析,发现HBR阻断剂具有hIgM-Fc的特异性,为IgG1_kappa型鼠单抗,选择hIgM_Fc作为抗原,进行小鼠免疫,获得抗hIgM-Fc的特异性抗体,对抗hIgM-Fc的特异性抗体进行表位测试,筛选同HBR阻断剂表位一致的抗hIgM-Fc的特异性抗体,对其进行RF的阻断测试,对比阻断效果。
具体步骤:
一、使用hIgM_Fc蛋白进行B/C小鼠免疫,细胞株以及单克隆抗体制备的简要步骤:
1)选择5~6周龄的免疫缺陷小鼠,B/C小白鼠、或者C57小黑鼠。
2)以hIgM_Fc蛋白进行小鼠免疫。
3)根据所使用的佐剂适用的最佳免疫剂量以及免疫间隔分别进行不同方式的免疫注射,可包括皮下、肌肉、腹腔等。第3次加强免疫7天后采集静脉血测试抗血清效价,效价达到10^6可进行细胞融合。
4)选择小鼠骨髓瘤细胞SP2/0株系,培养至生长对数期,保持最佳状态。
5)融合前四天再进行一次腹腔的冲击免疫和尾静脉冲击免疫。
6)采用聚乙二醇(PEG)细胞融合法。
7)融合细胞培养方式为半固体法培养。
8)阳性细胞株由间接ELISA检测,最终获得单克隆杂交瘤细胞株。
9)通过收集培养上清液和小鼠腹腔诱生腹水,亲和纯化分离获得特异性单克隆抗体。
二、同HBR阻断剂相同表位的抗hIgM_Fc单克隆抗体株的筛选:
1)间接ELISA测试抗hIgM_Fc抗体的亚类和轻链类型,抗原使用人hIgM_Fc蛋白,第二抗体使用特异性分型酶,保留IgG1单克隆抗体。
2)使用蛋白L测试IgG1型单克隆抗体的轻链类型,保留具有蛋白L识别性的IgG1单克隆抗体,即IgG1_kappa型。
3)间接ELISA测试单克隆抗体针对hIgM_Fc的表位特异性,使用人IgG蛋白(hIgG)、小鼠IgG蛋白(mIgG)、小鼠IgM蛋白(mIgM)作为抗原,进行单克隆抗体的识别性能测试,最终保留仅具有hIgM识别性的单克隆抗体株进行下一步筛选。
4)仅具有人IgM识别性的IgG1_kappa型单克隆抗体,进行人IgM区段表位特异性筛选,以hIgM_F(ab)2、hIgM_Fc作为抗原,保留具有hIgM_Fc识别性的单克隆抗体,因hIgM_F(ab)2、hIgM_Fc由蛋白酶(购自sigma)酶切获得,存在一定概率的酶切不彻底的残余全抗。
5)具有hIgM_Fc识别性的IgG1_kappa型单克隆抗体竞争测试,抗原使用hIgM_Fc,竞争蛋白为HBR阻断剂,保留对HBR阻断剂竞争率80%以上的IgG1_kappa型单克隆抗体,即具有HBR阻断剂相同/相似表位的抗hIgM_Fc单克隆抗体株,竞争率越大则表示两株抗体所识别的氨基酸序列/表位越相近,见表2。
6)具有HBR阻断剂相同/相似表位的抗hIgM_Fc单克隆抗体株,进行RF样本的阻断测试,对比不同HBR阻断剂竞争率时的具有HBR阻断剂相同/相似表位的抗hIgM_Fc单克隆抗体株的阻断效果,见图1,保留阻断效果最好的两株进行下一步测试,命名为ZD03、ZD04。
7)ZD03、ZD04测试多份RF样本,对比ZD02的阻断效果,显示ZD03、ZD04阻断效果较ZD02差,不可作为阻断剂继续使用,见表1。
表2.HBR竞争ELISA_表位相似性检测
参见表2,HBR竞争ELISA_表位相似性检测(竞争ELISA为两种及以上的蛋白争是否具有同一个表位的免疫检测方法,当测试后的百分比越高说明两者所识别的表位的一致性越高,反之越低,如图所示,ZD03、ZD04表位相似或者相同,且同JD-HBR、KQ-HBR的表位形似或者相同;ZD02、ZD05表位不同,且与其他检测阻断剂之间不具有表位的相似性)。
对比例2
具有RF阻断效果的抗人IgG/IgM抗体制备和筛选
RF中除了IgM型,还具有部分的IgG等其他类型,使用抗hIgG单克隆抗体可能弥补对部分除IgM型RF外的RF阻断,hIgG与hIgM之间保守度较高,具有hIgM的抗体可能具有hIgG的识别性,反之亦然。
具体步骤:
一、使用hIgG蛋白进行B/C小鼠免疫,细胞株以及单克隆抗体制备的简要步骤:
1)选择5~6周龄的免疫缺陷小鼠,B/C小白鼠、或者C57小黑鼠。
2)以hIgG蛋白进行小鼠免疫。
3)根据所使用的佐剂适用的最佳免疫剂量以及免疫间隔分别进行不同方式的免疫注射,可包括皮下、肌肉、腹腔等。第3次加强免疫7天后采集静脉血测试抗血清效价,效价达到10^6可进行细胞融合。
4)选择小鼠骨髓瘤细胞SP2/0株系,培养至生长对数期,保持最佳状态。
5)融合前四天再进行一次腹腔的冲击免疫和尾静脉冲击免疫。
6)采用聚乙二醇(PEG)细胞融合法。
7)融合细胞培养方式为半固体法培养。
8)阳性细胞株由间接ELISA检测,最终获得单克隆杂交瘤细胞株。
9)通过收集培养上清液和小鼠腹腔诱生腹水,亲和纯化分离获得特异性单克隆抗体。
二、抗hIgG抗体作为阻断剂使用的筛选:
1)间接ELISA测试单克隆抗体的表位特异性,使用人IgM蛋白(hIgM)、人IgG蛋白(hIgG)小鼠IgG蛋白(mIgG)、小鼠IgM蛋白(mIgM)作为抗原,进行单克隆抗体的识别性能测试,最终保留具有hIgG/IgM识别性的单克隆抗体株进行下一步筛选,同时对实施例1中的单克隆抗体进行后续的筛选测试。
2)具有hIgG/IgM识别性的单克隆抗体株进行hIgG&hIgM的混合筛选,以hIgG+hIgM作为抗原,保留亲和力好的抗hIgG/IgM单克隆抗体。
3)亲和力好的抗hIgG/IgM单克隆抗体进行RF的阻断测试,保留具有RF阻断效果的抗体株。
4)具有RF阻断效果的单克隆抗体进行RF样本的阻断测试,保留具有RF阻断效果的单克隆抗体。
5)具有RF阻断效果的抗hIgG/IgM单克隆抗体,同ZD01、ZD02的阻断效果进行对比,保留阻断效果不低于ZD02的抗体株,命名为ZD05、ZD06,见表1。
6)测试ZD05、ZD06的识别表位,显示ZD05、ZD06同时具有hIgG和hIgM的识别性。
7)ZD05、ZD06进行RF样本阻断的定量测试,同时测试多份RF样本,以及大量筛选的其假阳性样本,显示ZD05、ZD06对其他假阳性样本具有较好的阻断效果,其效果优于HBR阻断剂,ZD05可作为新的RF阻断剂备选,即ZD02的替换,见图1,ZD02&ZD05阻断剂对RF的阻断效果对比(条形图上的数字代表阻断剂的阻断效果,数字越大表示阻断的效果越差,数字越小则表达阻断的效果越好,如图3所示ZD02、ZD05的阻断效果明显好于HBR,几乎能够完全阻断1/10以内稀释比例的RF)。
对比例3
半抗F(ab)/Fc的RF阻断剂、聚体的RF阻断剂对RF的阻断效果测试
抗体具有“Y”型的基本结构,包含Fab/F(ab)2和Fc区段,免疫检测的中Fc常常带来非特异性的干扰,而Fab/F(ab)2为抗原的特异性结合区段,免疫检测中常常使用半抗的Fab/F(ab)2替代全抗进行检测,排除了Fc可能性干扰的同时增加了抗原抗体的结合机率,增强检测效果;IgM型抗体为五聚体结构,单一分子能够结合更多的抗原,也能够增强抗原抗体的结合效率,增强检测效果。
具体步骤:
1)RF阻断剂ZD02、ZD05半抗的制备:使用胃蛋白酶(购自sigma)对ZD02、ZD05进行酶切,参考专利JP2009195184、CN104498576A、CN108727502A、CN103044547A,酶切比例1:200/600/900(酶:ZD02/05),37℃酶切反应6h、9h、12h,SDS-PAGE分析酶切效果,反应12h时酶切效率>90%,见图2。
2)RF阻断剂ZD02、ZD05半抗的阻断效果测试:酶切后的ZD02、ZD05半抗进行RF的阻断测试,对比全抗,显示半抗失去阻断效果,见表3。
3)RF阻断剂ZD02、ZD05聚体的制备:使用戊二醛(购自鼎国)、SPDP(购自sigma)/Traut`s试剂(购自BBI)对ZD02、ZD05进行化学交联参考专利CN 111393523、CN109575164、CN113049817A,参考文献.doi.org/10.1016/j.bios.2012.09.006、dio:10.1080/09205063.2017.1291296。
4)RF阻断剂PZD02、PZD05聚体的阻断效果测试:化学交联后的ZD02、ZD05聚体PZD02、PZD05进行RF的阻断测试,对比全抗,显示交联后阻断严重降低,见表3。
5)RF阻断剂ZD02、ZD05可逆性聚体制备:使用高温加热的方式,参考专利CN1665838A、CN102432668A、WO1988008673A1、WO2008032039A3,65℃水浴10min,使ZD02、ZD05变性发生聚集。
6)RF阻断剂ZD02、ZD05可逆性聚体的阻断效果测试:高温加热变性后的ZD02、ZD05,进行RF的阻断测试,对比全抗,显示变性聚集后的ZD02、ZD05阻断效果有所提升,但是经-20℃冻融一次后,提升效果丧失,见表3。
综上,使用戊二醛等化学试剂交联获得聚体、或者高温变性形成的聚体都无法应用,主要表现为阻断效果丧失、阻断效果无法保持;酶切获得的小分子半抗丧失阻断能力;ZD02、ZD05的阻断能力主要依赖于抗体的完整性。
通过PCR扩增调取ZD02抗体的序列,并获得ZD02抗体的完整序列信息。
轻链完整DNA序列如下(不含前导序列共计642bp):
GATATTGTGCTGACACAGTCTCCAGCCACCCTGTCTGTGACTCCAGGAGATAGCGTCAGTCTTTCCTGCAGGGCCAGCCAAAGTATTAGGAACAACCTACAATGGTATCAACAAAGGTCACATGAATCTCCAAGGCTTCTCATCAAGTATGCTTCCCAGTCCATTTCTGGGATCCCCTCCAGGTTCAGTGGCAGTGGATCAGGGACAGATTTCACTCTCAGTATCAACAGTGTGGAGACTGAAGATTTTGGGATGTATTTCTGTCGACAGAGTAACAACTGGCCGCTCACGTTCGGTGCTGGGACCAAGCTGGAACTGAAACGCGCCGACGCCGCCCCCACCGTTTCTATTTTTCCCCCTTCCTCCGAACAGCTGACCTCAGGGGGGGCTTCTGTTGTTTGTTTCCTTAACAACTTCTACCCCAAGGACATCAACGTCAAGTGGAAAATTGACGGGAGCGAGAGGCAAAATGGAGTGCTCAATTCATGGACTGACCAAGACTCCAAGGACTCCACTTACAGTATGTCATCTACACTGACTCTCACCAAAGACGAATACGAGAGACATAACAGCTATACATGCGAAGCAACCCATAAGACCTCCACTTCTCCCATTGTCAAATCCTTTAATAGGAACGAGTGTTAA。SEQ ID No:1。
轻链完整氨基酸序列如下(不含前导序列共计214aar):
DIVLTQSPATLSVTPGDSVSLSCRASQSIRNNLQWYQQRSHESPRLLIKYASQSISGIPSRFSGSGSGTDFTLSINSVETEDFGMYFCRQSNNWPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC,SEQ IDNo:2,其中DIVLTQSPATLSVTPGDSVSLSCRASQSIRNNLQWYQQRSHESPRLLIKYASQSISGIPSRFSGSGSGTDFTLSINSVETEDFGMYFCRQSNNWPLTFGAGTKLELK,SEQ ID No:3为轻链可变区序列,基于IMGT编号方案以及Contact定义方案,对可变区进行标注,序列SEQ ID No:4:DIVLTQSPATLSVTPGDSVSLSCRASQSI为FRL1、序列SEQ ID No:5:RNNLQWY为CDRL1、序列SEQ IDNo:6:QQRSHESPR为FRL2、序列SEQ ID No:7:LLIKYASQSI为CDRL2、序列SEQ ID No:8:SGIPSRFSGSGSGTDFTLSINSVETEDFGMYFC为FRL3、序列SEQ ID No:9:RQSNNWPL为CDRL3、序列SEQ IDNo:10:TFGAGTKLELK为FRL4。
重链完整DNA序列如下(不含前导序列共计1374bp):
CAAGTTCAGCTGCAGCAGTCTGGGCCTGAAGTGGTGAGGCCTGGGGTCTCAGTGACGATTTCCTGCAAGGGCTCCGGCTACACATTCACTGATTATGCTATGCACTGGGTGAAGCAGAGTCATGCAAGGAGTCTAGAGTGGATTGGAATTATTAGTCCTTACAATGGAAATACAAACTACAACCAGAAGTTCAAGGGCAAGGCCACAATGACTGTAGACAAGTCCTCCAGCACAGCCTATATGGAACTTGCCAGATTGACATCTGAGGATTCTGCCATCTATTACTGTGCAAAGGCGGGAATCTTCTATGGCCCGGGGCACTTCGATGTCTGGGGCGCAGGGACCACGGTCACCGTTTCCTCA
重链完整氨基酸序列如下(不含前导序列共计457aar):
QVQLQQSGPEVVRPGVSVTISCKGSGYTFTDYAMHWVKQSHARSLEWIGIISPYNGNTNYNQKFKGKATMTVDKSSSTAYMELARLTSEDSAIYYCAKAGIFYGPGHFDVWGAGTTVTVSSAKTTPPSVYPLAPGTAAQTNSVVTLGCLVKGYFPETVTVTWNTGTLTTTVHTFPAFLQTGLYTMTTRVTVPSRTWPRQTVTCRVAHPARRTTVDKKFEPTGPITTINPCPPCKECHKCPAPNFEGGPTVFIFPPNIKDVLMITLTPKVTCVVVDVTEDDPDVQITWFVNNVEVHTAQTQTHREDYNTTIRVVTTLPIQHQDWMTGKEFKCKVNNKDFPTPIESTISKIKGFVRAPQVYILPPPAEQFSRKDVRLTCLVVGFNPGDIRVEWTWNGHTEENYKDTAPVLDRDGRYFIYSMLNMKTTKWEKTDSFTCNVRHEGLKNYYLKKTISRTPGK,SEQ ID No:12,其中QVQLQQSGPEVVRPGVSVTISCKGSGYTFTDYAMHWVKQSHARSLEWIGIISPYNGNTNYNQKFKGKATMTVDKSSSTAY MELARLTSEDSAIYYCAKAGIFYGPGHFDVWGAGTTVTVSS,SEQID No:13为重链可变区序列,基于IMGT编号方案以及Contact定义方案,对可变区进行标注,序列SEQ ID No:14:QVQLQQSGPEVVRPGVSVTISCKGSGYTF为FRH1、序列SEQ ID No:15:TDYAMH为CDRH1、序列SEQ ID No:16:WVKQSHARSLE为FRH2、序列SEQ ID No:17:WIGIISPYNGNTN为CDRH2、序列SEQ ID No:18:YNQKFKGKATMTVDKSSSTAYMELARLTSEDSAIYYC为FRH3、序列SEQ ID No:19:AKAGIFYGPGHFD为CDRH3、序列SEQ ID No:20:VWGAGTTVTVSS为FRH4。
表3.半抗/聚体阻断剂的阻断效果测试
参见表3,半抗/聚体阻断剂的阻断效果测试(测试数值代表阻断的效果,数值越大表示效果越差,反之效果越好,如图所示全抗均具有很好的阻断效果,而酶切处理的所有阻断剂的半抗阻断效果大大降低、戊二醛处理_聚体的所有阻断剂的阻断效果丧失、SPDP/traut`s处理_聚体的所有阻断剂的阻断效果也大幅度降低、加热处理后的ZD02和ZD05阻断效果有提升,但是冻融后效果丧失,即效果不稳定)。
实施例2
ZD02的体外重组
抗体重组技术在科学研究中的应用日益广泛,特别是作为解决持续存在的可重复性难题的一种手段,与传统抗体相比,重组抗体具有良好的批次间一致性、持续供应以及无动物源性生产等优势。
具体步骤:
1)根据PCR扩增结果,获得ZD02抗体的完整序列如上。
2)表达质粒的获得:确认ZD02抗体的轻链和重链的DNA序列,利用基因合成技术构建表达载体ZD02/pcDNA3.1,选择优质的前导肽序列,H6(SEQ ID No:21:氨基酸序列:MEFGLSWLFLVAILKGVQC、SEQ ID No:22:DNA序列:ATGGAGTTTGGGCTGAGCTGGCTTTTTCTTGTGGCGATTCTAAAAGGTGTCCAGTGT)、L1(SEQ ID No:23:氨基酸序列:MDMRVPAQLLGLLLLWLSGARC、SEQID No:24:DNA序列:ATGGACATGAGGGTCCCTGCTCAGCTCCTGGGGCTCCTGCTGCTCTGGCTCTCAGGTGCCAGATGT)。
3)ZD02/pcDNA3.1质粒转染:提前5~7天复苏CHO细胞(购自Gibco),无血清无抗生素培养基(购自gibco、义翘神州)培养,传代3次待细胞状态回复,提取5~10μg的无菌无内毒素的ZD02/pcDNA3.1质粒DNA;使用脂质体转染试剂(购自gibco)进行质粒DTA的转染,置于37℃、5~8% CO
4)ZD02表达株的筛选:转染后培养6h等体积更换培养基;转染后18h进行表达情况的检测:继续培养3天左右,加入具有筛选标记的抗生素;此后每3~4天更换一次抗性培养基,直到出现细胞集落,即为ZD02表达株。
5)ZD02表达株的扩大培养:使用0.25%胰酶(购自DT)消化细胞集落,使用10~20倍体积的新鲜培养基进行稀释,并转移至摇瓶培养,110~135rpm、37℃、5~8% CO
6)ZD02表达株的表达培养:接种密度0.5~3.0*10^6cell/mL,培养体积250~420mL/细胞摇瓶,选择化学成分限定的无血清培养基(购自gibco、义翘神州),培养温度30~37℃、CO
7)ZD02重组抗体的纯化:使用蛋白A亲和层析纯化得到重组的ZD02纯化蛋白,即CZD02,测试浓度纯化以及活性。
8)CZD02的阻断效果:测试CZD02对RF的阻断效果,其阻断效果同ZD02保持一致。
9)CZD02性能稳定性测试:冻融3次阻断效果稳定、4℃保存3周稳定、-20℃保存12个月以上稳定、批次间CV<3%、单批次得率>1.0g、表达株传代20次表达稳定。
综上CZD02可取代ZD02成为RF阻断剂使用,体外重组的重组抗体CZD02效果与天然抗体ZD02基本一致。
实施例3
ZD02的体外亲和力成熟
在实际研发过程中,经过了常规筛选所得的抗体,有诸多方面需要更细致的改进,包括亲和力、免疫原性、半衰期等等,抗体领域这些年来做了很多相关的研究和实践,抗体亲和力成熟是研究的重要方向之一。抗体亲和力的提高有助于改善抗体的特异性和效力,有助于减少使用剂量、提升使用效果、扩大应用范围、降低可能存在的干扰等。
具体步骤:
1)载体库构建:选择轻链的CDR1区域、重链的CDR3区域进行随机突变,使用专业的点突变试剂盒(购自Transgen)进行定点突变,突变位点1~20位氨基酸不等,构建到表达载体pcDNA3.1,获得载体库。
2)抗体库构建:载体库进行CHO细胞的随机转染,检测到蛋白后使用细胞分选器分选细胞,保证单细胞分散,持续培养形成细胞集落后测试表达上清,具有表达的单一细胞集落(即单克隆细胞株)保留,即为抗体库。
3)抗体的筛选:使用特异性的免疫反应检测抗体库中抗体的表达情况以及亲和结合情况,保留高表达且结合亲和力高的抗体株。
4)抗体的测试:对保留的抗体株进行RF阻断效果测试,对比ZD02,保留阻断效果较ZD02更好的,最终保留3株,即MZD02-1、MZD02-2、MZD02-3,对RF的阻断效果较ZD02提升20%~30%,其中MZD02-1的效果最佳,提升幅度接近30%,见图3,且测试除ELISA外的比浊和胶体金平台均达到很好的效果。
突变位点的确认:对MZD02-1、MZD02-2、MZD02-3,进行蛋白质测序,测序结果显示MZD02的轻链CDRL1存在1~4个位点的突变,R→S/G、N→D、N→K、Q→H,重链的CDRH3区域存在2~4个位点的突变,K→R、I→D、G→S、H→Y如表4所示。
表4.ZD02抗体亲和力成熟定点突变位点
综上,ZD02轻链CDRL1区域的氨基酸RNNLQWY,定点突变R→S、Q→H,能够有效提高其对RF的阻断效果;ZD02重链CDRH3区域的氨基酸序列AKAGIFYGPGHFD,突变K→R、I→D、G→S、H→Y对阻断剂的亲和力具有一定的影响,其中部分突变能够显著的提高抗体的亲和力,即提升阻断剂的阻断效果,后期生产可考虑进行MZD02-1的表达和培养。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 一种抗冻剂、环保抗冻管及其制备方法和应用
- 两种新生物碱及其制备方法和在制备抗MRSA的抗菌剂中的应用
- 一种高分子抗冲改性剂及其制备方法和应用
- 一种清除类风湿因子免疫干扰的主动阻断剂及其制备方法
- Hippo信号通路阻断剂在制备抗ER+乳腺肿瘤药物中的应用
