一种利用重组大肠杆菌全细胞催化制备假尿苷的方法、重组大肠杆菌及应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物工程技术领域,尤其是一种利用重组大肠杆菌全细胞催化制备假尿苷的方法、重组大肠杆菌及应用。
背景技术
到目前为止,已经发现了100多种不同类型的RNA修饰,这些修饰大多存在于rRNA、tRNA和snRNA中。最常见和最早发现的修饰之一是从尿苷到假尿苷的异构化。近年来,随着人们对RNA疫苗的关注和研究,将假尿苷及其类似物替换尿苷加入mRNA,能提高mRNA的稳定性并增强其翻译能力,可以解决mRNA药物容易被免疫系统识别而被清除、产生免疫副反应的问题。假尿苷作为一种RNA的代谢产物,具有仅从肾脏排泄的特点,在临床医学上可用于监测肿瘤的发生、发展及肾病的诊治。假尿苷具有十分重要的应用价值,随着假尿苷市场需求量的不断扩大,使得人们在假尿苷的合成方法上开始投入了越来越多的研究。
1961年,首次报道了化学合成假尿苷的方法,但总收率仅为2%,且产物为α和β异构体的混合。目前,假尿苷的生产方法主要有化学合成法、化学-酶法和酶催化法。李静简等(202210798651.4)以2,3,5-三苄氧基-D-核糖酸-1,4-内酯与2,4-二烷氧基-5-溴嘧啶为原料通过加成、还原、脱保护基等反应后得到假尿苷;金峰等(202210473532.1)以D-核糖和尿嘧啶为起始反应物经有机溶剂通过加成、缩合、脂肪酶拆分、脱保护基等反应后得到假尿苷,但两种化学合成方法均存在步骤繁琐、收率较低的问题。肖聪等(2021111581013.9)使用化学-酶法合成假尿苷,先化学合成5-磷酸核糖,再用假尿苷-5-磷酸糖苷酶催化5-磷酸核糖与尿嘧啶合成假尿苷单磷酸,最后去磷酸化得到假尿苷,产量为7.9g/L,转化率为51%。陈伟等(202111581013.9)将来自于Streptomyces sp.ID38640中的假尿苷合成基因pumH、pumJ和pumD克隆至大肠杆菌体内,96h可转化10g/L肌苷产7.2g/L假尿苷。朱文娟等(202310168205X)利用重组大肠杆菌分别表达尿苷磷酸化酶UdP、嘌呤核苷磷酸化酶DeoD、磷酸戊糖变位酶DeoB以及假尿苷-5-磷酸糖苷酶YeiN,再将酶液混合,24h可转化尿苷产生1.16g/L假尿苷,转化率为95%。但以上方法普遍存在步骤复杂繁琐、生产成本高、生产效率低、产品难于回收纯化等缺点,导致产品售价较高,限制了其在生物和医药领域中的大规模应用。因此,迫切需要开发廉价的、适合工业化放大的假尿苷生产工艺。
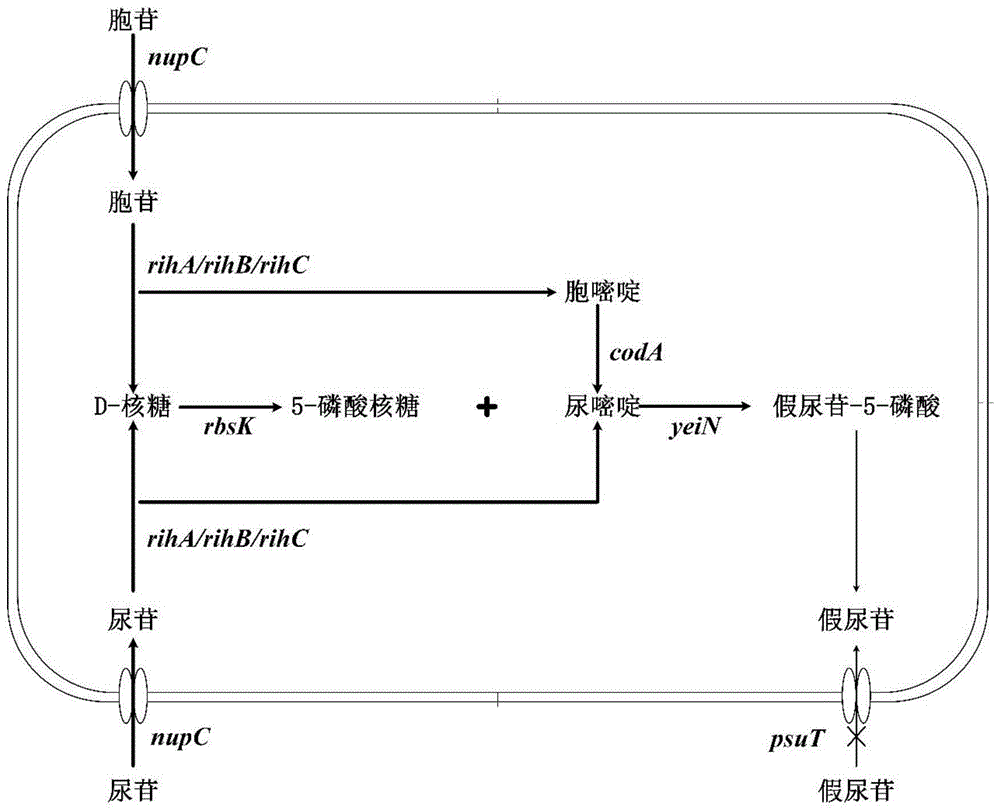
全细胞生物催化法主要借助细胞内的酶进行催化,成为介于发酵法与纯酶催化法之间的生物技术。该方法不仅可以实现酶的级联反应,提高酶的催化效率,更能大大减少酶的纯化过程,使生产成本得到有效控制。因而,胞内的酶在细胞膜或细胞壁的保护下,可具备更高的稳定性与更长的半衰期,易实现催化的高效性。利用全细胞催化法生产核苷类产品是近年来研究的热点。本发明在大肠杆菌E.coli MG1655中构建了新颖的酶催化反应路线,实现了以尿苷或胞苷为底物全细胞催化制备假尿苷新工艺。
通过检索,尚未发现与本发明专利申请相关的专利公开文献。
发明内容
本发明的目的在于克服现有技术中的不足之处,提供一种利用重组大肠杆菌全细胞催化制备假尿苷的方法、重组大肠杆菌及应用。
本发明解决其技术问题所采用的技术方案是:
一种能够全细胞催化制备假尿苷的重组大肠杆菌,其特征在于:所述重组大肠杆菌是在大肠杆菌E.coli MG1655中过表达假尿苷-5-磷酸糖苷酶,过表达核糖激酶,过表达核糖核苷水解酶,过表达胞嘧啶脱氨酶,过表达核苷渗透酶,不表达假尿苷转运蛋白,获得重组大肠杆菌。
进一步地,所述假尿苷-5-磷酸糖苷酶为大肠杆菌yeiN基因编码的蛋白,大肠杆菌yeiN基因的核苷酸序列如SEQ ID NO.1所示;
所述核糖激酶为大肠杆菌rbsK基因编码的蛋白,大肠杆菌rbsK基因的核苷酸序列如SEQ ID NO.2所示;
所述核糖核苷水解酶为大肠杆菌rihA基因或大肠杆菌rihB基因或大肠杆菌rihC基因编码的蛋白,大肠杆菌rihA基因的核苷酸序列如SEQ ID NO.3所示,大肠杆菌rihB基因的核苷酸序列如SEQ ID NO.4所示,大肠杆菌rihC基因的核苷酸序列如SEQ ID NO.5所示;优选大肠杆菌rihA基因编码的蛋白;
所述胞嘧啶脱氨酶为大肠杆菌codA基因编码的蛋白,大肠杆菌codA基因的核苷酸序列如SEQ ID NO.6所示;
所述核苷渗透酶为大肠杆菌nupC基因编码的蛋白,大肠杆菌nupC基因的核苷酸序列如SEQ ID NO.7所示;
所述假尿苷转运蛋白为大肠杆菌psuT基因编码的蛋白,大肠杆菌psuT基因的核苷酸序列如SEQ ID NO.8所示。
进一步地,所述重组大肠杆菌菌株的构建方法,包括如下步骤:
(1)将核苷酸序列如SEQ ID NO.1所示的假尿苷-5-磷酸糖苷酶基因yeiN与启动子P
(2)将核苷酸序列如SEQ ID NO.2所示的核糖激酶基因rbsK与启动子P
(3)将核苷酸序列如SEQ ID NO.3所示的核糖核苷水解酶基因rihA与启动子P
(4)将核苷酸序列如SEQ ID NO.6所示的胞嘧啶脱氨酶基因codA与启动子P
(5)将核苷酸序列如SEQ ID NO.7所示的核苷渗透酶基因nupC与启动子P
(6)将核苷酸序列如SEQ ID NO.8所示的假尿苷转运蛋白基因psuT从重组菌株Ψ1中敲除或失活,获得重组菌株Ψ2;
(7)将(3)和(4)中构建的质粒P3-P6分别电转化到Ψ2中获得重组菌株Ψ3-Ψ6。
如上所述的方法在假尿苷制备中的应用,
一种利用重组大肠杆菌全细胞催化制备假尿苷的方法,所述方法在大肠杆菌E.coli MG1655中过表达假尿苷-5-磷酸糖苷酶,过表达核糖激酶,过表达核糖核苷水解酶,过表达胞嘧啶脱氨酶,过表达核苷渗透酶,不表达假尿苷转运蛋白,获得重组大肠杆菌,利用重组大肠杆菌实现以尿苷或胞苷为底物全细胞催化制备假尿苷。
进一步地,具体包括如下步骤:
(1)将活化好的重组大肠杆菌菌株接种至培养基中,37℃培养14-16h至菌体OD
培养基组成为:葡萄糖20-30g/L,酵母粉3-8g/L,KH
(2)离心收集培养好的菌体,使用PBS缓冲液清洗菌体一次;将清洗后的菌体重悬在反应液中,菌体浓度OD
反应液组成为:葡萄糖15-25g/L,Na
本发明取得的优点和积极效果为:
1、本发明使用核糖核苷水解酶将尿苷或胞苷水解为尿嘧啶、胞嘧啶和D-核糖;使用核糖激酶将D-核糖磷酸化为5-磷酸核糖;使用胞嘧啶脱氨酶将胞嘧啶转化为尿嘧啶;使用假尿苷-5-磷酸糖苷酶催化尿嘧啶与5-磷酸核糖合成假尿苷单磷酸;酶级联反应所需的ATP以及假尿苷单磷酸的去磷酸化过程则通过细胞自身代谢完成。本发明设计的假尿苷酶催化反应路线与现有酶催化法(202310168205X,202111581013.9)相比均不相同(图1),具有较强的创造性。
2、为了提高全细胞催化制备假尿苷的效率,本发明在底盘细胞基因组上整合核苷渗透酶基因nupC,增强了底物尿苷或胞苷向胞内的转运;敲除了底盘细胞中假尿苷转运蛋白基因psuT,减少了产物假尿苷向胞内的转运。此外,优化了全细胞催化底物添加方式,采用流加补料替代一次性投料方式,减少了细胞对于底物的额外消耗。本发明设计了新颖的假尿苷酶催化合成路线,在最优的反应条件下假尿苷的最高产量达到了27.24g/L,转化率达90.8%,生产效率为1.135g·h
3、利用全细胞催化法生产核苷类产品是近年来研究的热点。本发明构建了新颖的酶催化反应路线,通过在大肠杆菌MG1655中过表达假尿苷-5-磷酸糖苷酶,过表达核糖激酶,过表达核糖核苷水解酶,过表达胞嘧啶脱氨酶,过表达核苷渗透酶,不表达假尿苷转运蛋白,获得一株生产性能高效稳定的用于假尿苷生产的重组大肠杆菌并提供其全细胞催化方法,实现了以尿苷或胞苷为底物全细胞催化制备假尿苷新工艺。
附图说明
图1为本发明中假尿苷酶催化反应路线设计图;
图2为本发明中组成型质粒pTrc99aΔlacI的构建示意图;
图3为本发明中重组质粒P1的构建示意图;
图4为本发明中重组质粒P2的构建示意图;
图5为本发明中重组质粒P3的构建示意图;
图6为本发明中重组质粒P4的构建示意图;
图7为本发明中重组质粒P5的构建示意图;
图8为本发明中重组质粒P6的构建示意图;
图9为本发明中nudG整合片段构建及验证电泳图;其中:M:1kb DNAMarker;1:上游同源臂;2:下游同源臂;3:目的基因;4:重叠片段;5:原菌PCR片段;6:阳性单菌落PCR鉴定片段;
图10为本发明中psuT基因敲除片段构建及验证电泳图;其中:M:1kb DNAMarker;1:上游同源臂;2:下游同源臂;3:重叠片段;4:原菌PCR片段;5:阳性单菌落PCR鉴定片段;
图11为本发明中实施例3摇瓶催化结果图;
图12为本发明中实施例5分批补料催化结果图;
图13为本发明中实施例4和6的催化结果图。
具体实施方式
下面结合实施例,对本发明进一步说明,下属实施例是叙述性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
具体实施例中所涉及的各种实验操作,均为本领域的常规技术,本文中没有特别注释的部分,本领域的普通技术人员可以参照本发明申请日之前的各种常用工具书、科技文献或相关的说明书、手册等予以实施。
一种能够全细胞催化制备假尿苷的重组大肠杆菌,其特征在于:所述重组大肠杆菌是在大肠杆菌E.coli MG1655中过表达假尿苷-5-磷酸糖苷酶,过表达核糖激酶,过表达核糖核苷水解酶,过表达胞嘧啶脱氨酶,过表达核苷渗透酶,不表达假尿苷转运蛋白,获得重组大肠杆菌。
较优地,所述假尿苷-5-磷酸糖苷酶为大肠杆菌yeiN基因编码的蛋白,大肠杆菌yeiN基因的核苷酸序列如SEQ ID NO.1所示;
所述核糖激酶为大肠杆菌rbsK基因编码的蛋白,大肠杆菌rbsK基因的核苷酸序列如SEQ ID NO.2所示;
所述核糖核苷水解酶为大肠杆菌rihA基因或大肠杆菌rihB基因或大肠杆菌rihC基因编码的蛋白,大肠杆菌rihA基因的核苷酸序列如SEQ ID NO.3所示,大肠杆菌rihB基因的核苷酸序列如SEQ ID NO.4所示,大肠杆菌rihC基因的核苷酸序列如SEQ ID NO.5所示;优选大肠杆菌rihA基因编码的蛋白;
所述胞嘧啶脱氨酶为大肠杆菌codA基因编码的蛋白,大肠杆菌codA基因的核苷酸序列如SEQ ID NO.6所示;
所述核苷渗透酶为大肠杆菌nupC基因编码的蛋白,大肠杆菌nupC基因的核苷酸序列如SEQ ID NO.7所示;
所述假尿苷转运蛋白为大肠杆菌psuT基因编码的蛋白,大肠杆菌psuT基因的核苷酸序列如SEQ ID NO.8所示。
较优地,所述重组大肠杆菌菌株的构建方法,包括如下步骤:
(1)将核苷酸序列如SEQ ID NO.1所示的假尿苷-5-磷酸糖苷酶基因yeiN与启动子P
(2)将核苷酸序列如SEQ ID NO.2所示的核糖激酶基因rbsK与启动子P
(3)将核苷酸序列如SEQ ID NO.3所示的核糖核苷水解酶基因rihA与启动子P
(4)将核苷酸序列如SEQ ID NO.6所示的胞嘧啶脱氨酶基因codA与启动子P
(5)将核苷酸序列如SEQ ID NO.7所示的核苷渗透酶基因nupC与启动子P
(6)将核苷酸序列如SEQ ID NO.8所示的假尿苷转运蛋白基因psuT从重组菌株Ψ1中敲除或失活,获得重组菌株Ψ2;
(7)将(3)和(4)中构建的质粒P3-P6分别电转化到Ψ2中获得重组菌株Ψ3-Ψ6。
(8)所述启动子P
如上所述的方法在假尿苷制备中的应用,
一种利用重组大肠杆菌全细胞催化制备假尿苷的方法,所述方法在大肠杆菌E.coli MG1655中过表达假尿苷-5-磷酸糖苷酶,过表达核糖激酶,过表达核糖核苷水解酶,过表达胞嘧啶脱氨酶,过表达核苷渗透酶,不表达假尿苷转运蛋白,获得重组大肠杆菌,利用重组大肠杆菌实现以尿苷或胞苷为底物全细胞催化制备假尿苷。
较优地,具体包括如下步骤:
(1)将活化好的重组大肠杆菌菌株接种至培养基中,37℃培养14-16h至菌体OD
培养基组成为:葡萄糖20-30g/L,酵母粉3-8g/L,KH
(2)离心收集培养好的菌体,使用PBS缓冲液清洗菌体一次;将清洗后的菌体重悬在反应液中,菌体浓度OD
反应液组成为:葡萄糖15-25g/L,Na
具体地,相关的制备及检测如下:
实施例1:重组质粒的构建
1、组成型质粒的构建
本发明所用pTrc99a质粒自身含有表达乳糖操纵子阻遏物的lacI基因,在表达该质粒时,需添加异丙基硫代半乳糖苷(Isopropylβ-D-thiogalactoside,IPTG)进行诱导,但IPTG易影响菌体生长,因此构建组成型质粒pTrc99aΔlacI。通过设计两端带有酶切位点Apa I的引物1-S和1-A,利用PCR扩增出不含lacI的线性化pTrc99a载体,再通过重组酶
2、重组质粒P1的构建
根据所需过表达的假尿苷-5-磷酸糖苷酶基因yeiN选择适宜的酶切位点SalI、HindⅢ,对质粒pTrc99aΔlacI进行双酶切;以E.coli MG1655基因组为模板,利用PCR扩增获得含SalI、HindⅢ酶切位点和P
3、重组质粒P2的构建
根据所需过表达的核糖激酶基因rbsK选择适宜的酶切位点BamHⅠ、XbaⅠ,对质粒P1进行双酶切;以E.coli MG1655基因组为模板,利用PCR扩增获得含BamHⅠ、XbaⅠ酶切位点和P
4、重组质粒P3的构建
根据所需过表达的核糖核苷水解酶基因rihA选择适宜的酶切位点SacⅠ、KpnⅠ,对质粒P2进行双酶切;以E.coli MG1655基因组为模板,利用PCR扩增获得含SacⅠ、KpnⅠ酶切位点和P
5、重组质粒P4的构建
根据所需过表达的核糖核苷水解酶基因rihB选择适宜的酶切位点SacⅠ、KpnⅠ,对质粒P2进行双酶切;以E.coli MG1655基因组为模板,利用PCR扩增获得含SacⅠ、KpnⅠ酶切位点和P
6、重组质粒P5的构建
根据所需过表达的核糖核苷水解酶基因rihC选择适宜的酶切位点SacⅠ、KpnⅠ,对质粒P2进行双酶切;以E.coli MG1655基因组为模板,利用PCR扩增获得含SacⅠ、KpnⅠ酶切位点和P
7、重组质粒P6的构建
根据所需过表达的核糖核苷水解酶基因codA选择适宜的酶切位点Nco I、EcoRⅠ,对质粒P3进行双酶切;以E.coli MG1655基因组为模板,利用PCR扩增获得含Nco I、EcoRⅠ酶切位点和P
8、重组质粒构建过程中用到的引物
上述构建过程所涉及的引物见下表:
实施例2:重组菌株的构建
1、基因编辑方法
本发明中采用CRISPR/Cas9介导的基因编辑方法,可参照文献(MetabolicEngineering,2015,31:13-21.)进行。CRISPR/Cas9是一种精确、高效的新型基因靶向修饰技术,该方法所用的两种质粒分别为pGRB与pREDCas9。pREDCas9质粒为温敏型质粒,携带gRNA质粒的消除系统,λ噬菌体的Red重组系统及Cas9蛋白表达系统,具有奇霉素抗性(工作浓度:100mg/L),适培温度32℃;pGRB质粒,以pUC18为骨架,包含启动子J23100,gRNA-Cas9结合区域序列和终止子序列,具有氨苄青霉素抗性(工作浓度:100mg/L),适培温度37℃。
2、重组菌株Ψ1的构建
以E.coli MG1655基因组为模板,根据其yjgX基因的上下游序列设计上游同源臂引物(UP-yjgX-S、UP-yjgX-A)和下游同源臂引物(DN-yjgX-S、DN-yjgX-A),PCR扩增其上下游同源臂片段;根据其nupC基因(如SEQ ID NO.7所示)设计引物(P
3、重组菌株Ψ2的构建
以E.coli MG1655基因组为模板,根据其psuT基因(如SEQ ID NO.8所示)的上下游序列设计上游同源臂引物(UP-psuT-S、UP-psuT-A)和下游同源臂引物(DN-psuT-S、DN-psuT-A),PCR扩增其上下游同源臂片段。上述片段通过重叠PCR的方法融合获得psuT基因的敲除片段(上游同源臂-下游同源臂)。通过引物gRNA-psuT-S和gRNA-psuT-A的退火制得含目的基因靶序列的DNA片段,与线性化的pGRB载体重组后获得重组的pGRB-psuT。将该重组片段和质粒pGRB-psuT电转至含有pREDCas9质粒的Ψ1的感受态细胞,筛选阳性菌株后再将质粒消除获得菌株Ψ2。psuT敲除片段的构建和阳性菌株的PCR验证的电泳图见附图10。其中,上游同源臂的长度为283bp,下游同源臂的长度为492bp,重叠片段的总长为775bp。PCR验证时,阳性菌PCR扩增片段长度应为775bp,原菌PCR扩增片段长度应为1970bp。
4、重组菌株Ψ3-Ψ6的构建
将实施例1中构建的重组质粒P3-P6从DH5α中提出,后分别电转化至重组菌株Ψ2的感受态细胞中,经筛选、菌落PCR鉴定后获得含有重组质粒P3-P6的重组菌株Ψ3-Ψ6。
5、菌株构建过程中用到的引物
上述构建过程所涉及的引物见下表:
实施例3:全细胞催化尿苷生产假尿苷的摇瓶实验
摇瓶培养方法如下:
将活化好的适量菌株接种至培养基中,37℃培养14-16h至菌体OD
离心收集培养好的菌体,使用PBS缓冲液清洗菌体一次。将清洗后的菌体重悬在反应液中,菌体浓度OD
使用菌株Ψ3-Ψ5进行摇瓶催化,催化过程中一次性加入5g/L底物尿苷,结果如图11所示。三株菌的假尿苷产量有所不同,其中过表达rihA菌株Ψ3的假尿苷积累量最高,为3.55g/L,与过表达rihB菌株Ψ4和过表达rihC菌株Ψ5相比分别高22.4%和105.6%。此外,菌株Ψ3和Ψ4没有尿苷剩余,而菌株Ψ5有尿苷剩余。以上结果表明,RihA对尿苷的水解作用明显强于RihB和RihC,更适合作为假尿苷的全细胞催化用酶。
实施例4:全细胞催化胞苷生产假尿苷的摇瓶实验
摇瓶培养方法如下:
将活化好的适量菌株接种至培养基中,37℃培养14-16h至菌体OD
离心收集培养好的菌体,使用PBS缓冲液清洗菌体一次。将清洗后的菌体重悬在反应液中,菌体浓度OD
使用菌株Ψ6进行摇瓶催化,催化过程中一次性加入5g/L底物胞苷,反应24h后假尿苷产量可达3.03g/L,结果如图13所示。
实施例5:全细胞催化尿苷生产假尿苷的分批补料实验
将活化好的适量菌株接种至培养基中,37℃培养14-16h至菌体OD
离心收集培养好的菌体,使用PBS缓冲液清洗菌体一次。将清洗后的菌体重悬在反应液中,菌体浓度OD
使用菌株Ψ5进行分批补料催化,催化过程中分别流加终浓度为5g/L、10g/L、20g/L、30g/L、40g/L的底物尿苷,结果如图12所示。流加终浓度为5g/L的底物尿苷时,Ψ5菌株假尿苷的积累量达到3.89g/L,与一次性投料相比提高了9.6%,说明分批补料方式有助于减少底物尿苷的额外消耗。当底物尿苷流加终浓度从5g/L提升到30g/L时,假尿苷的积累量从3.89g/L提升到27.24g/L,转化率从77.8%提升到90.8%。当底物尿苷流加终浓度为40g/L时,底物尿苷没有完全消耗,剩余4.23g/L,假尿苷的积累量为30.86g/L,转化率为77.2%。
实施例6:全细胞催化胞苷生产假尿苷的分批补料实验
将活化好的适量菌株接种至培养基中,37℃培养14-16h至菌体OD
离心收集培养好的菌体,使用PBS缓冲液清洗菌体一次。将清洗后的菌体重悬在反应液中,菌体浓度OD
使用菌株Ψ6进行分批补料催化,催化过程中分别流加终浓度为30g/L的底物胞苷,结果如图13所示,反应24h假尿苷产量为23.76g/L,转化率为85.9%。
本发明中的相关序列如下:
1
939
DNA
大肠杆菌(E.coli MG1655)
YeiN
1
atgtctgaattaaaaatttcccctgaattattacaaatttccccggaagtgcaggacgctttaaaaaacaaaaaaccggttgtggcgctggaatcgaccattatttctcacgggatgccgttcccacaaaatgcccagaccgcaattgaagttgaagaaactattcgtaaacagggcgctgtacctgccacgatcgccattattggcggcgtgatgaaagtggggttaagcaaagaagaaattgaattactgggtcgtgaagggcataacgtgaccaaagttagtcgtcgcgatttaccttttgttgttgccgccggaaaaaatggcgcaaccactgtggcttcaacgatgattattgcggcgcttgccggaattaaagtatttgccaccgggggaattggtggtgtgcatcgcggggcggaacataccttcgatatttctgccgatttgcaagaactggcaaatactaatgtcaccgttgtttgtgccggggcgaaatctattctcgatttaggattaaccactgagtatttagaaaccttcggtgtgccgttaattggctatcagactaaagcgctgcctgcgtttttctgccgcaccagcccgtttgacgtcagcattcgtctcgacagcgccagcgaaattgcccgtgcaatggtggtgaaatggcaaagcggtctgaacggtggcctcgtggtagcgaacccgatcccggaacagtttgctatgccggaacacactatcaatgcggcgatcgatcaggcggtagctgaagctgaagctcagggagtcattggtaaagaaagtacgccattcctgctggcgcgcgttgctgaactgaccggcggtgacagcctgaaatccaacatccagctggtgttcaacaacgccattctggcgagcgaaattgccaaagaatatcagcgtctcgcgggttaa
2
930
DNA
大肠杆菌(E.coli MG1655)
RbsK
2
atgcaaaacgcaggcagcctcgttgttcttggcagcattaatgctgaccacattcttaatcttcaatcttttcctactccaggcgaaaccgtaaccggtaaccactatcaggttgcatttggcggcaaaggcgcgaatcaggctgtggctgctgggcgtagcggtgcgaatatcgcgtttattgcctgtacgggtgatgacagcattggtgagagcgttcgccagcagctcgccactgataacattgatattactccggtcagcgtgatcaaaggcgaatcaacaggtgtggcgctgatttttgttaatggcgaaggtgagaatgtcatcggtattcatgccggcgctaatgctgccctttccccggcgctggtggaagcgcaacgtgagcgtattgccaacgcgtcagcattattaatgcagctggaatcaccactcgaaagtgtgatggcagcggcgaaaatcgcccatcaaaataagactatcgttgcgcttaacccggctccggctcgcgaacttcctgacgaactgctggcgctggtggacattattacgccaaacgaaacggaagcagaaaagctcaccggtattcgtgttgaaaatgatgaagatgcagcgaaggcggcgcaggtactgcatgaaaaaggtatccgtactgtactgattactttaggaagtcgtggtgtatgggctagcgtgaatggtgaaggtcagcgcgttcctggattccgggtgcaggctgtcgataccattgctgccggagatacctttaacggtgcgttaatcacggcattgctggaagaaaaaccattgccagaggcgattcgttttgcccatgctgccgctgcgattgccgtaacacgtaaaggcgcacaaccttccgtaccgtggcgtgaagagatcgacgcatttttagacaggcagaggtga
3
936
DNA
大肠杆菌(E.coli MG1655)
RihA
3
atggcactgccaattctgttagattgcgacccaggtcatgacgacgctatcgcaatagttctcgccctcgcctcaccagagcttgatgtcaaagcaattacgtcttccgccggaaaccagacaccagaaaaaaccttacgcaatgttctgcgtatgctgaccttgcttaatcgcaccgatattccggtagcaggcggcgcggtaaaaccgttaatgcgtgagttgattatcgcggacaatgtgcacggcgaaagcggtctcgacggcccggcattaccggaaccgacattcgcaccgcaaaactgtacggcggtagagctgatggcgaaaacgctgcgtgaaagtgcggaacctgtcaccattgtgtctaccggaccgcaaactaacgttgccttgctgctcaatagccatccggaactgcatagcaaaattgcccgtatcgtgattatgggtggcgctatggggctgggtaactggacgcctgcggctgaatttaatatttacgttgacccggaagcggcagaaattgtcttccagtcagggatcccggtggtgatggccggtctggatgttactcataaagcacaaatccacgttgaagacaccgagcgtttccgcgcgattggtaaccctgtttcaaccattgttgccgaactgctggatttcttcctcgaatatcataaagacgaaaaatggggctttgtcggcgcaccactgcatgacccatgcaccatcgcctggctgttgaaaccggagttatttacctctgttgagcgctgggttggcgtggaaacacaggggaaatatacccagggtatgacggttgttgattattattatctgacaggcaataaaccgaatgccaccgtaatggtcgatgttgatcgtcagggctttgttgatttactggctgatcgtctgaaattttacgcttaa
4
942
DNA
大肠杆菌(E.coli MG1655)
RihB
4
atggaaaagagaaaaattattctggattgtgatccgggtcatgatgatgctattgctataatgatggcggcgaaacatccggcaatagatttattaggcatcactattgtagcgggtaatcagacgcttgataaaacattaattaatggcctgaatgtttgccagaaactggagattaatgttccggtttatgcggggatgccgcagcccattatgcgtcaacaaatcgttgccgataatattcacggtgaaaccggactggatggcccggtattcgagccgctgacccgccaggcagaaagcactcatgcggtgaaatatatcattgataccctgatggcaagcgatggcgatatcactctggtgccggttggtccgctttcaaatatcgcggtggcaatgcgtatgcaacccgcgatcctgcccaaaatccgtgaaattgtgctaatgggcggcgcttacggtacaggcaacttcacgccatctgccgagttcaacatctttgccgacccggaagccgcacgcgtagtgttcacctccggcgttccattagtgatgatgggcctcgatctcaccaaccagaccgtttgcaccccggacgtgattgctcggatggaaagggcaggcggccccgccggagagctgttcagcgacatcatgaacttcactctcaaaacgcagttcgaaaactacggccttgctggcggcccggtgcacgacgccacctgcatcggttatctgattaaccctgatggcattaaaacccaggagatgtacgtcgaagtggacgtcaacagtggcccttgctatgggcgtaccgtctgcgacgagctgggcgttcttggcaagcccgccaataccaaagtcggcatcactattgatacagactggttctggggattagtcgaagagtgcgtgcgcggctacatcaaaacccattaa
5
915
DNA
大肠杆菌(E.coli MG1655)
RihC
5
atgcgtttacctatcttcctcgatactgaccccggcattgacgatgccgtcgccattgccgccgcgatttttgcacccgaactcgacctgcaactgatgaccaccgtcgcgggtaatgtctcggttgagaaaactacccgcaatgccctgcaactgctgcatttctggaatgcggagattccgctcgcccaaggggccgctgtgccactggtacgcgcaccgcgtgatgcggcatctgtgcacggcgaatcgggaatggctggctacgactttgttgagcacaaccgaaagccgctcgggataccggcgtttctggcgattcgggatgccctgatgcgtgcaccagagcctgttaccctggtggccatcggcccgttaaccaatattgcgctgttactttcacaatgcccggaatgcaagccgtatattcgccgtctggtgatcatgggtggttctgccggacgcggcaactgtacgccaaacgccgagtttaatattgctgccgatccagaagctgctgcctgtgtcttccgcagtggtattgaaatcgtcatgtgcggtttggatgtcaccaatcaggcaatattaactcctgactatctctctacactgccgcagttaaaccgtaccgggaaaatgcttcacgccctgtttagccactaccgtagcggcagtatgcaaagcggcttgcgaatgcacgatctctgcgccatcgcctggctggtgcgcccggacctgttcactctcaaaccctgttttgtggcagtggaaactcagggcgaatttacctcaggcacgacggtggttgatatcgacggttgcctgggcaagccagccaatgtacaggtggcattggatctggatgtgaaaggcttccagcagtgggtggctgaggtgctggctctggcgtcgtaa
6
1284
DNA
大肠杆菌(E.coli MG1655)
CodA
6
gtgtcgaataacgctttacaaacaattattaacgcccggttaccaggcgaagaggggctgtggcagattcatctgcaggacggaaaaatcagcgccattgatgcgcaatccggcgtgatgcccataactgaaaacagcctggatgccgaacaaggtttagttataccgccgtttgtggagccacatattcacctggacaccacgcaaaccgccggacaaccgaactggaatcagtccggcacgctgtttgaaggcattgaacgctgggccgagcgcaaagcgttattaacccatgacgatgtgaaacaacgcgcatggcaaacgctgaaatggcagattgccaacggcattcagcatgtgcgtacccatgtcgatgtttcggatgcaacgctaactgcgctgaaagcaatgctggaagtgaagcaggaagtcgcgccgtggattgatctgcaaatcgtcgccttccctcaggaagggattttgtcgtatcccaacggtgaagcgttgctggaagaggcgttacgcttaggggcagatgtagtgggggcgattccgcattttgaatttacccgtgaatacggcgtggagtcgctgcataaaaccttcgccctggcgcaaaaatacgaccgtctcatcgacgttcactgtgatgagatcgatgacgagcagtcgcgctttgtcgaaaccgttgctgccctggcgcaccatgaaggcatgggcgcgcgagtcaccgccagccacaccacggcaatgcactcctataacggggcgtatacctcacgcctgttccgcttgctgaaaatgtccggtattaactttgtcgccaacccgctggtcaatattcatctgcaaggacgtttcgatacgtatccaaaacgtcgcggcatcacgcgcgttaaagagatgctggagtccggcattaacgtctgctttggtcacgatgatgtcttcgatccgtggtatccgctgggaacggcgaatatgctgcaagtgctgcatatggggctgcatgtttgccagttgatgggctacgggcagattaacgatggcctgaatttaatcacccaccacagcgcaaggacgttgaatttgcaggattacggcattgccgccggaaacagcgccaacctgattatcctgccggctgaaaatgggtttgatgcgctgcgccgtcaggttccggtacgttattcggtacgtggcggcaaggtgattgccagcacacaaccggcacaaaccaccgtatatctggagcagccagaagccatcgattacaaacgttga
7
1203
DNA
大肠杆菌(E.coli MG1655)
NupC
7
atggaccgcgtccttcattttgtactggcacttgccgttgttgcgattctcgcactgctggtaagcagcgaccgcaaaaaaattcgtatccgttatgttattcaactgcttgttatcgaagtgttactggcgtggttcttcctgaactccgacgttggtttaggcttcgtgaaaggcttctccgaaatgttcgaaaaactgctcggatttgccaacgaagggactaacttcgtctttggtagcatgaatgatcaaggcctggcattcttcttcctgaaagtgctgtgcccaatcgtctttatctctgcactgatcggtattctccagcacattcgcgtgttgccggtgatcatccgcgcaattggtttcctgctctccaaagtcaacggcatgggcaaactggaatcctttaacgccgtcagctccctgattctgggtcagtctgaaaactttattgcctataaagatatcctcggcaaaatctcccgtaatcgtatgtacaccatggctgccacggcaatgtccaccgtgtcgatgtccatcgttggtgcatacatgaccatgctggaaccgaaatacgtcgttgctgcgctggtactgaacatgttcagcacctttatcgtgctgtcgctgatcaatccttaccgtgttgatgccagtgaagaaaacatccagatgtccaacctgcacgaaggtcagagcttcttcgaaatgctgggtgaatacattctggcaggtttcaaagttgccattatcgttgccgcgatgctgattggctttatcgccctgatcgccgcgctgaacgcactgtttgccaccgttactggctggtttggctacagcatctccttccagggcatcctgggctacatcttctatccgattgcatgggtgatgggtgttccttccagtgaagcactgcaagtgggcagtatcatggcgaccaaactggtttccaacgagttcgttgcgatgatggatctgcagaaaattgcttccacgctctctccgcgtgctgaaggcatcatctctgtgttcctggtttccttcgctaacttctcttcaatcgggattatcgcaggtgcagttaaaggcctgaatgaagagcaaggtaacgtggtttctcgcttcggtctgaagctggtttacggctctaccctggtgagtgtgctgtctgcgtcaatcgcagcactggtgctgtaa
8
1251
DNA
大肠杆菌(E.coli MG1655)
PsuT
8
atggatataatgagaagtgttgtggggatggtggtgttactggcaatagcatttctgttgtcagtgaataaaaagagcatcagtttgcgcacggttggagccgcactgctgctgcaaatcgctattggtggcatcatgctctacttcccaccgggaaaatgggcagtagaacaggcggcattaggcgttcataaagtgatgtcttacagtgatgccggtagcgccttcatttttggttcgctggttgggccgaaaatggatgtcctgtttgacggtgcgggttttatcttcgcctttcgcgtacttccggcgattattttcgttactgcgctcatcagtctgctgtactacattggcgtgatggggctgctgattcgcatccttggcagcattttccagaaagccctcaacatcagcaaaatcgaatcttttgttgcggttactactattttcctcgggcaaaatgagatcccggcgatcgttaaaccgtttatcgatcgcatgaatcgcaacgagttgtttaccgcaatttgtagcgggatggcgtccattgctggttcgatgatgattggttatgccggaatgggcgtaccaattgactacctgttagcggcatcgctgatggcgatccctggcgggattttgtttgcacgtattcttagcccggcaaccgagccttcgcaggtcacatttgaaaatctgtcgttcagcgaaacgccgccaaaaagctttatcgaagcggcggcgagcggtgcgatgaccgggctaaaaatcgccgctggtgtggcgacggtggtaatggcgtttgtcgcaattattgcgctgatcaacggcattatcggcggaattggcggctggtttggtttcgccaatgcctctctggaaagtatttttggctatgtgctggcaccgctggcgtggatcatgggtgtggactggagtgatgccaatcttgcgggtagcctgattgggcagaaactggcgattaacgaattcgtcgcttacctgagtttctccccatacctgcaaacgggcggcacgctggaagtgaaaaccattgcgattatctcctttgcgctttgtggttttgctaactttggttctatcggtgttgtcgttggcgcattttcggctatttcgccaaaacgcgcgccggaaatcgcccagcttggtttacgggcgctggcagcagcaacgctttccaacctgatgagtgcgactattgccgggttctttattggtctggcgtaa
9
74
DNA
人工序列
9
ttgacaattaatcatccggctcgtataatgtgtggaattgtgagcggataacaatttcacacaggaaacagacc
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
- 一种利用重组大肠杆菌全细胞转化生产宝丹酮的方法
- 一种利用重组大肠杆菌全细胞催化合成L-苹果酸的方法
- 一种利用重组大肠杆菌全细胞催化合成L-苹果酸的方法
