一种半枝莲完整单细胞提取及应用方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及植物单细胞提取领域,具体是指一种半枝莲完整单细胞提取及应用方法。
背景技术
半枝莲为唇形科黄岑属多年生草本植物,可全草入药,含有苯丙氨酸、生物碱、黄酮苷、皂苷、多糖等成分。临床上对于半枝莲的化学成分研究较为充分,但对其抗病的分子机制研究尚属空白,建立半枝莲遗传性能稳定的单细胞群落,有助于未来研究其具体抗肿瘤作用位点和机理。现有单细胞提取方式只能提取到原生质体,并不包括细胞壁,无法保证植物单细胞结构的完整性;或通过亚氯酸钠处理生物质材料进行脱木素反应,植物细胞木质素及半纤维素脱除,获得完整单细胞,但只适用于木本、禾本植物;压电技术制备植物单细胞样本,极易导致细胞的损坏和破碎,且操作方式繁琐。
发明内容
针对上述情况,为克服现有技术的缺陷,本发明提供了一种半枝莲完整单细胞提取及应用方法,为解决现有单细胞提取方法,只能提取得到原生质体,不包括细胞壁,本发明提出通过选取半枝莲幼嫩叶片为实验材料,获得大量疏松的愈伤组织,便于后续完整单细胞悬浮液的制备;同时选用含有多聚半乳糖醛酸酶、吗啉乙磺酸、风车子抑素A4的单细胞液体培养基,可以选择性的在溶解细胞间物质的同时不破坏植物细胞壁结构,促进形成完整单细胞集合体;此外,采用纤维素、木质素、葡萄糖和甘油制备细胞稳定液,能够将收集好的单细胞进行完整保存,解决了所制植物单细胞极易损坏和破碎的问题。
为了实现上述目的,本发明采取的技术方案如下,本发明提出了一种半枝莲完整单细胞提取及应用方法,其中,所述半枝莲完整单细胞提取方法包括如下步骤:
(1)选择健壮新鲜半枝莲植株,选取上部幼嫩叶片,使用无菌去离子水冲洗干净,得到半枝莲原材料;
(2)在超净工作台中,将半枝莲原材料使用70%酒精浸泡15-30 s,再使用无菌去离子水冲洗2-4次,使用剪刀将半枝莲原材料剪成小块,得到半枝莲叶片组织;
(3)以MS培养基为基础培养基,其中6-苄氨基嘌呤的浓度为1-3 mg/L、蔗糖的浓度为20-35 g/L、琼脂粉的浓度为4-6 g/L,在玻璃烧杯中混合温度为40-60℃、混合转速为180-200 r/min、混合时间为5-8 min、调节pH为5.5-6.5,充分搅拌,得到诱导愈伤组织培养基;以1/2MS培养基为基础培养基,其中,风车子抑素A4的浓度为5-8 mg/L、吗啉乙磺酸的浓度为15-20 mg/L、多聚半乳糖醛酸酶的浓度为3-5 mg/L、2,4-二氯苯氧乙酸的浓度为1-2mg/L、6-糖基氨基嘌呤的浓度为0.4-0.6 mg/L,在玻璃烧杯中混合温度为20-28℃、混合转速为180-200 r/min、混合时间为5-8 min、调节pH为5.5-6.0,充分搅拌,得到单细胞液体培养基;
(4)将半枝莲叶片组织放至诱导愈伤组织培养基中恒温27-29℃,培养时间为12-16 d,得到大量疏松的愈伤组织;
(5)使用灭菌的镊子挑取愈伤组织,将其转移至单细胞液体培养基中,在摇床温度为20-28℃、100-150 r/min振荡速度、培养时间为12-24 h,振荡培养得到完整单细胞悬浮液;
(6)以100-300目细胞过滤筛,过滤除去完整单细胞悬液中的大块细胞团,得到细胞滤液;
(7)将细胞滤液以500-800 r/min的转速离心8-12 min,去除上部细胞碎片,采用40-60目细胞过滤筛过滤,得到半枝莲完整单细胞;
(8)以50%甘油为溶剂,其中纤维素的浓度为5-8 g/L、木质素的浓度为2-4 g/L、葡萄糖的浓度为3-6 g/L,充分混匀,得到单细胞稳定剂;
(9)将回收的半枝莲完整单细胞分装于2mL无菌冻存管中,加入单细胞稳定剂,体积比为1:1,于-80℃冷冻保存。
优选地,步骤(1)中,所述健壮新鲜半枝莲植株选用无菌半枝莲组培幼苗。
优选地,步骤(2)中,所述半枝莲原材料使用70%酒精浸泡浸泡25 s,再使用去离子水冲洗3次。
优选地,步骤(3)中,所述诱导愈伤组织培养基,其中6-苄氨基嘌呤的浓度为2 mg/L、蔗糖的浓度为25 g/L、琼脂粉的浓度为5 g/L,在玻璃烧杯中混合温度为55℃、混合转速为190 r/min、混合时间为7 min、调节pH为6.0;所述单细胞液体培养基中,风车子抑素A4的浓度为6 mg/L、吗啉乙磺酸的浓度为18 mg/L、多聚半乳糖醛酸酶的浓度为4 mg/L、2,4-二氯苯氧乙酸的浓度为1.5 mg/L、6-糖基氨基嘌呤的浓度为0.5 mg/L,在玻璃烧杯中混合温度为22℃、混合转速为185 r/min、混合时间为6 min、调节pH为5.6。
优选地,步骤(4)中,所述半枝莲叶片组织培养时间为14 d;步骤(5)中,所述摇床温度为26℃,振荡速度为120 r/min,培养时间为16 h;步骤(6)中,所述细胞过滤筛为200目;步骤(7)中,所述细胞滤液转速为600 r/min,离心10 min,细胞过滤筛为50目。
优选地,步骤(8)中,所述单细胞稳定剂,其中纤维素的浓度为6 g/L、木质素的浓度为3 g/L、葡萄糖的浓度为4 g/L。
本发明还提供了一种半枝莲完整单细胞的应用方法,具体包括如下步骤:
(1)将所提取的半枝莲完整单细胞冻存管,置于冰上解冻10-15 min,得到半枝莲完整单细胞冻存液;
(2)以pH为5.5的磷酸缓冲液为溶剂,其中纤维素酶R10的浓度为13-17 g/L、纤维素酶RS的浓度为10-13 g/L、离析酶的浓度为12-16 g/L,搅拌混匀,得到酶解液;
(3)每1mL半枝莲完整单细胞冻存液中加入50-80 mL酶解液,黑暗条件酶解1.5-3h,得到半枝莲单细胞原生质体;
(4)直接将所制备半枝莲单细胞原生质体通过流式细胞仪进入10xGenomoics系统制备文库,利用Illumina平台测序。
优选地,步骤(1)中,所述半枝莲完整单细胞冻存管,置于冰上解冻12 min。
优选地,步骤(2)中,所述酶解液中纤维素酶R10的浓度为14 g/L、纤维素酶RS的浓度为11 g/L、离析酶的浓度为13 g/L。
优选地,步骤(3)中,所述半枝莲完整单细胞冻存液,每1mL中加入60 mL酶解液,黑暗条件酶解2.5 h。
本发明取得的有益效果如下:
(1)本发明直接从无菌半枝莲组培幼苗植株选取幼嫩叶片,并将其诱导培育出大量疏松的愈伤组织,便于后续完整单细胞悬浮液的制备;
(2)单细胞液体培养基中含有多聚半乳糖醛酸酶,可以选择性地溶解细胞间物质,同时保护了半枝莲细胞的细胞壁结构,吗啉乙磺酸的加入使得酶促反应更加稳定,风车子抑素A4作为植物微管抑制剂,能够形成均一的完整单细胞集合体,可提高半枝莲完整单细胞的产率;
(3)采用木质素、纤维素、葡萄糖和甘油作为细胞稳定液,能够将收集好的完整单细胞进行保存,解决了所制备植物单细胞极易损坏和破碎的问题,随用随取,半枝莲完整单细胞酶解细胞壁后,无需再次离心处理即可进行后续植物完整单细胞RNA测序,简化实验流程。
附图说明
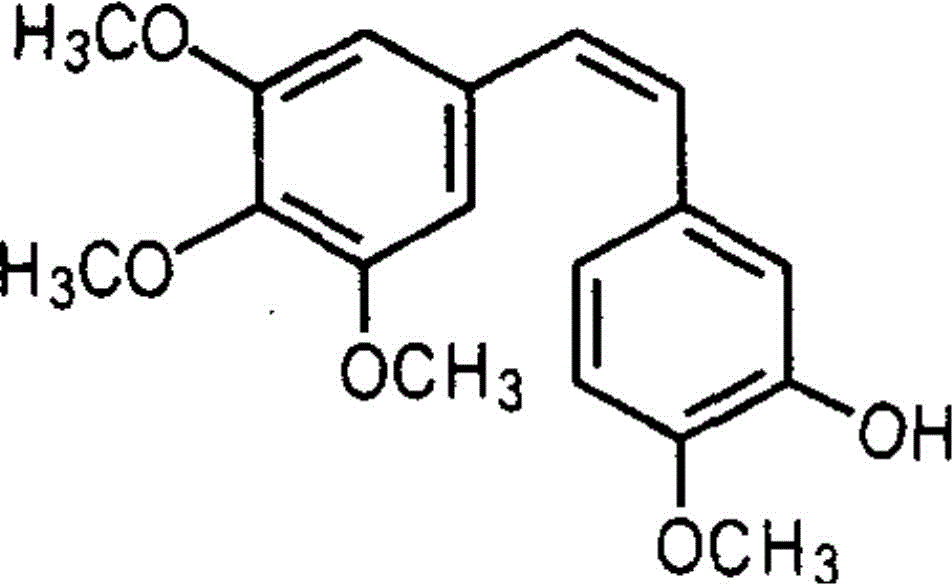
图1为风车子抑素A4化学式图;
图2为本发明工艺流程图。
具体实施方式
下面将结合本发明实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
除非另行定义,文中所使用的所有专业与科学用语与本领域技术人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用,但不能限制本申请的内容。
下述实施例中的实验方法,如无特殊说明,均为常规方法;下述实施例中所用的试验材料及试验菌株,如无特殊说明,均为从商业渠道购买得到的。
实施例1:本实施例提供了一种半枝莲完整单细胞的提取方法,具体包括如下步骤:
(1)选择健壮新鲜无菌半枝莲组培幼苗,选取上部幼嫩叶片,使用无菌去离子水冲洗干净,得到半枝莲原材料;
(2)在超净工作台中,将半枝莲原材料使用70%酒精浸泡15 s,再使用无菌去离子水冲洗2次,使用剪刀将半枝莲原材料剪成小块,得到半枝莲叶片组织;
(3)以MS培养基为基础培养基,其中6-苄氨基嘌呤的浓度为1 mg/L、蔗糖的浓度为20 g/L、琼脂粉的浓度为4 g/L,在玻璃烧杯中混合温度为40℃、混合转速为180 r/min、混合时间为5 min、调节pH为5.5,充分搅拌,得到诱导愈伤组织培养基;以1/2MS培养基为基础培养基,其中,风车子抑素A4的浓度为5 mg/L、吗啉乙磺酸的浓度为15mg/L、多聚半乳糖醛酸酶的浓度为3 mg/L、2,4-二氯苯氧乙酸的浓度为1 mg/L、6-糖基氨基嘌呤的浓度为0.4mg/L,在玻璃烧杯中混合温度为20℃、混合转速为180 r/min、混合时间为5 min、调节pH为5.6,充分搅拌,得到单细胞液体培养基;
(4)将半枝莲叶片组织放至诱导愈伤组织培养基中恒温27℃,培养时间为12 d,得到大量疏松的愈伤组织;
(5)使用灭菌的镊子挑取愈伤组织,将其转移至单细胞液体培养基中,在摇床温度为20℃、100 r/min振荡速度、培养时间为12 h,振荡培养得到完整单细胞悬浮液;
(6)以100目细胞过滤筛,过滤除去完整单细胞悬液中的大块细胞团,得到细胞滤液;
(7)将细胞滤液以500 r/min的转速离心8 min,去除上部细胞碎片,采用40目细胞过滤筛过滤,得到半枝莲完整单细胞;
(8)以50%甘油为溶剂,其中纤维素的浓度为5 g/L、木质素的浓度为2 g/L、葡萄糖的浓度为3 g/L,充分混匀,得到单细胞稳定剂;
(9)将回收的半枝莲完整单细胞分装于2 mL无菌冻存管中,加入单细胞稳定剂,体积比为1:1,于-80℃冷冻保存。
本实施例还提供了一种半枝莲完整单细胞的应用方法,具体包括如下步骤:
(1)将所提取的半枝莲完整单细胞冻存管,置于冰上解冻10 min,得到半枝莲完整单细胞冻存液;
(2)以pH为5.5的磷酸缓冲液为溶剂,其中纤维素酶R10的浓度为13 g/L、纤维素酶RS的浓度为10 g/L、离析酶的浓度为12 g/L,搅拌混匀,得到酶解液;
(3)每1 mL半枝莲完整单细胞冻存液中加入50 mL酶解液,黑暗条件酶解1.5-3 h,得到半枝莲单细胞原生质体;
(4)直接将所制备半枝莲单细胞原生质体通过流式细胞仪进入10xGenomoics系统制备文库,利用Illumina平台测序。
实施例2:本实施例提供了一种半枝莲完整单细胞的提取方法,具体包括如下步骤:
(1)选择健壮新鲜无菌半枝莲组培幼苗,选取上部幼嫩叶片,使用无菌去离子水冲洗干净,得到半枝莲原材料;
(2)在超净工作台中,将半枝莲原材料使用70%酒精浸泡20 s,再使用无菌去离子水冲洗3次,使用剪刀将半枝莲原材料剪成小块,得到半枝莲叶片组织;
(3)以MS培养基为基础培养基,其中6-苄氨基嘌呤的浓度为2 mg/L、蔗糖的浓度为25 g/L、琼脂粉的浓度为5 g/L,在玻璃烧杯中混合温度为50℃、混合转速为190 r/min、混合时间为6 min、调节pH为6.0,充分搅拌,得到诱导愈伤组织培养基;以1/2MS培养基为基础培养基,其中,风车子抑素A4的浓度为6 mg/L、吗啉乙磺酸的浓度为18 mg/L、多聚半乳糖醛酸酶的浓度为4 mg/L、2,4-二氯苯氧乙酸的浓度为1.5 mg/L、6-糖基氨基嘌呤的浓度为0.5mg/L,在玻璃烧杯中混合温度为25℃、混合转速为190 r/min、混合时间为7 min、调节pH为5.8,充分搅拌,得到单细胞液体培养基;
(4)将半枝莲叶片组织放至诱导愈伤组织培养基中恒温28℃,培养时间为14 d,得到大量疏松的愈伤组织;
(5)使用灭菌的镊子挑取愈伤组织,将其转移至单细胞液体培养基中,在摇床温度为25℃、130 r/min振荡速度、培养时间为15 h,振荡培养得到完整单细胞悬浮液;
(6)以200目细胞过滤筛,过滤除去完整单细胞悬液中的大块细胞团,得到细胞滤液;
(7)将细胞滤液以600 r/min的转速离心10 min,去除上部细胞碎片,采用50目细胞过滤筛过滤,得到半枝莲完整单细胞;
(8)以50%甘油为溶剂,其中纤维素的浓度为6 g/L、木质素的浓度为3 g/L、葡萄糖的浓度为4 g/L,充分混匀,得到单细胞稳定剂;
(9)将回收的半枝莲完整单细胞分装于2 mL无菌冻存管中,加入单细胞稳定剂,体积比为1:1,于-80℃冷冻保存。
本实施例还提供了一种半枝莲完整单细胞的应用方法,具体包括如下步骤:
(1)将所提取的半枝莲完整单细胞冻存管,置于冰上解冻12 min,得到半枝莲完整单细胞冻存液;
(2)以pH为5.5的磷酸缓冲液为溶剂,其中纤维素酶R10的浓度为14 g/L、纤维素酶RS的浓度为11 g/L、离析酶的浓度为13 g/L,搅拌混匀,得到酶解液;
(3)每1mL半枝莲完整单细胞冻存液中加入60 mL酶解液,黑暗条件酶解2 h,得到半枝莲单细胞原生质体;
(4)直接将所制备半枝莲单细胞原生质体通过流式细胞仪进入10xGenomoics系统制备文库,利用Illumina平台测序。
实施例3:本实施例提供了一种半枝莲完整单细胞的制备方法,具体包括如下步骤:
(1)选择健壮新鲜无菌半枝莲组培幼苗,选取上部幼嫩叶片,使用无菌去离子水冲洗干净,得到半枝莲原材料;
(2)在超净工作台中,将半枝莲原材料使用70%酒精浸泡30 s,再使用无菌去离子水冲洗4次,使用剪刀将半枝莲原材料剪成小块,得到半枝莲叶片组织;
(3)以MS培养基为基础培养基,其中6-苄氨基嘌呤的浓度为3 mg/L、蔗糖的浓度为35 g/L、琼脂粉的浓度为6 g/L,在玻璃烧杯中混合温度为60℃、混合转速为200 r/min、混合时间为8 min、调节pH为6.5,充分搅拌,得到诱导愈伤组织培养基;以1/2MS培养基为基础培养基,其中,风车子抑素A4的浓度为8 mg/L、吗啉乙磺酸的浓度为20 mg/L、多聚半乳糖醛酸酶的浓度为5 mg/L、2,4-二氯苯氧乙酸的浓度为2 mg/L、6-糖基氨基嘌呤的浓度为0.6mg/L,在玻璃烧杯中混合温度为28℃、混合转速为200 r/min、混合时间为8 min、调节pH为6.0,充分搅拌,得到单细胞液体培养基;
(4)将半枝莲叶片组织放至诱导愈伤组织培养基中恒温29℃,培养时间为16 d,得到大量疏松的愈伤组织;
(5)使用灭菌的镊子挑取愈伤组织,将其转移至单细胞液体培养基中,在摇床温度为28℃、150 r/min振荡速度、培养时间为24 h,振荡培养得到完整单细胞悬浮液;
(6)以300目细胞过滤筛,过滤除去完整单细胞悬液中的大块细胞团,得到细胞滤液;
(7)将细胞滤液以800 r/min的转速离心12 min,去除上部细胞碎片,采用60目细胞过滤筛过滤,得到半枝莲完整单细胞;
(8)以50%甘油为溶剂,其中纤维素的浓度为8 g/L、木质素的浓度为4 g/L、葡萄糖的浓度为6 g/L,充分混匀,得到单细胞稳定剂;
(9)将回收的半枝莲完整单细胞分装于2 mL无菌冻存管中,加入单细胞稳定剂,体积比为1:1,于-80℃冷冻保存。
本实施例还提供了一种半枝莲完整单细胞的应用方法,具体包括如下步骤:
(1)将所提取的半枝莲完整单细胞冻存管,置于冰上解冻15 min,得到半枝莲完整单细胞冻存液;
(2)以pH为5.5的磷酸缓冲液为溶剂,其中纤维素酶R10的浓度为17 g/L、纤维素酶RS的浓度为13 g/L、离析酶的浓度为16 g/L,搅拌混匀,得到酶解液;
(3)每1 mL半枝莲完整单细胞冻存液中加入80 mL酶解液,黑暗条件酶解3 h,得到半枝莲单细胞原生质体;
(4)直接将所制备半枝莲单细胞原生质体通过流式细胞仪进入10xGenomoics系统制备文库,利用Illumina平台测序。
对比例1:本对比例提供了一种半枝莲完整单细胞的制备方法,与实施例1的区别仅在于,所选取半枝莲原材料为无菌半枝莲组培幼苗的茎段,其余组分、组分含量、方法步骤与实施例1相同。
对比例2:本对比例提供了一种半枝莲完整单细胞的制备方法,与实施例1的区别仅在于,所使用单细胞液体培养基中不含风车子抑素A4、多聚半乳糖醛酸酶、吗啉乙磺酸,其余组分、组分含量、方法步骤与实施例1相同。
对比例3:本对比例提供了一种半枝莲完整单细胞的制备方法,与实施例1的区别仅在于,所使用单细胞稳定剂以10%甘油为溶剂,其余组分、组分含量、方法步骤与实施例1相同。
实验例1:疏松愈伤组织的获取:
以实施例1、对比例1所制得的愈伤组织进行试验。
结果分析,实施例1中,将无菌半枝莲组培幼苗的幼嫩叶片,放至诱导愈伤组织培养基中恒温27℃,培养时间为12 d,得到大量疏松的愈伤组织,表面湿润,颜色为乳黄色,适合进行完整单细胞悬浮液的制备;对比例1中,将无菌半枝莲组培幼苗的茎段放至诱导愈伤组织培养基中恒温27℃,培养时间为8 d时,观察到愈伤组织从乳白色变成黄褐色,表面干燥,培养时间为11 d,所培育愈伤组织全部死亡。因此,无菌半枝莲组培幼苗仅适宜采用幼嫩叶片部位进行愈伤组织的培养,并不适宜采用茎段培养,实施例1所选取叶片干净无污染,尚未进入生殖生长阶段,能够获得大量疏松的愈伤组织,便于后续的完整单细胞悬浮液的制备和完整单细胞的提取。
实验例2:半枝莲完整单细胞数量的测定:
以实施例1、对比例2所制得的细胞滤液进行试验,具体包括如下步骤:
(1)移液枪分别吸取10 mL实施例1、对比例2所制得的细胞滤液与10 mL台盼蓝混合均匀于无菌1.5mL离心管中,得到混合液;
(2)取10 uL混合液自血球计数盘上方加入,于10倍生物显微镜下观察,活细胞不染色,死细胞被染成蓝色;
(3)分别计数四个大方格,得到细胞总数,再除以4,乘以10
(4)完整单细胞存活率(%)=每mL细胞悬液蓝色细胞数/每mL细胞悬液总细胞数×100。
效果验证
按照实施例1与对比例2的制备方法所制得的细胞滤液,分别观察其单细胞形态及计算单细胞数量,结果如表一。
表一
结果分析:从表一中可以看出,对比例2相较于实施例1所制得的细胞滤液,完整单细胞数量明显较少,并且存在细胞破损的现象,并且实施例1中完整单细胞存活率为对比例2的5.1倍,可得实施例1中所使用单细胞液体培养基中所含风车子抑素A4作为微管抑制剂,可以提高完整单细胞的产率;多聚半乳糖醛酸酶的加入,可以选择性溶解细胞间物质,同时不破坏细胞的细胞壁结构;吗啉乙磺酸的加入使得酶促反应更加稳定,提高了完整单细胞的存活率。
实验例3:半枝莲完整单细胞冻存液中完整单细胞存活率测定:
(1)移液枪分别吸取10 mL实施例1、对比例3所制得的半枝莲完整单细胞冻存液与10 mL台盼蓝混合均匀于无菌1.5mL离心管中,得到混合液;
(2)取10 uL混合液自血球计数盘上方加入,于10倍生物显微镜下观察,活细胞不染色,死细胞被染成蓝色;
(3)分别计数四个大方格,得到细胞总数,再除以4,乘以10
(4)完整单细胞存活率(%)=每mL细胞悬液蓝色细胞数/每mL细胞悬液总细胞数×100。
按照实施例1与对比例3的制备方法所制得的半枝莲完整单细胞冻存液,分别计算其完整单细胞存活率,结果如表二。
表二
结果分析:从表二中可以看出,对比例3相较于实施例1所制得的半枝莲完整单细胞冻存液,完整单细胞存活率较低,可得实施例1中使用50%甘油为溶剂添加纤维素、木质素、葡萄糖制备单细胞稳定剂,有效提升了半枝莲完整单细胞在贮存过程中的存活率,便于后续实验的现用现取,确保了半枝莲完整单细胞RNA测序的原材料活性。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
以上对本发明及其实施方式进行了描述,这种描述没有限制性,附图中所示的也只是本发明的实施方式之一,实际的应用并不局限于此。总而言之如果本领域的普通技术人员受其启示,在不脱离本发明创造宗旨的情况下,不经创造性的设计出与该技术方案相似的方式及实施例,均应属于本发明的保护范围。
- 一种基于微流体技术的激光单细胞提取方法
- 一种使用Namocell单细胞分离仪进行单细胞分选的方法
- 一种半枝莲提取物及其制备方法和应用
- 一种半枝莲提取物及其制备方法和应用
