詹氏乳杆菌来源纳米囊泡在制备防治卵巢早衰治疗药物中的应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于生物医药技术领域,特别涉及詹氏乳杆菌来源纳米囊泡在制备防治卵巢早衰治疗药物中的应用。
背景技术
卵巢功能衰竭指40岁之前即闭经的现象,其中包括早期卵巢储备功能下降(DOR)阶段和晚期卵巢早衰(POF)阶段。随着病因学的深入研究以及临床病例的不断积累,人们逐渐意识到卵巢功能减退是一种进行性发展的疾病,在DOR阶段,患者卵巢功能减退,产生卵子的质量和数量均下降,雌激素水平下降,患者出现月经紊乱等症状,这一时期可以长达数年之久,如不及早识别并进行干预,最后就发展到卵巢功能减退的终末阶段POF阶段。患者到达POF阶段时,卵巢功能就不可逆了,其主要临床表现为月经失调、盗汗、潮热、烦躁、不孕,同时POF可导致骨质疏松、心血管疾病的发病率增高,严重影响患者身体健康和生活质量。因此,POF的FSH诊断阈值为40 mIU/mL,POI降为25 mIU/mL,其目的在于发现早期卵巢功能减退的女性,及早诊断及早采取措施,改善患者的临床症状。因此进一步完善POI诊治的规范化,同时推进POI的临床研究与发病机制研究,能极大的提高患者的治愈率和为药物的应用提供坚实的基础。
目前,针对卵巢早衰的治疗方案主要是不良生活方式干预、激素干预,但疗效不稳定,且治疗效果不佳,尚无疗效稳定的药物用于临床治疗。而随着近期对肠道菌群研究的深入,肠道菌群与卵巢早衰的关系也逐渐被认知,卵巢早衰发生时有益细菌的减少,有害细菌增多,同时有害细菌的增多会反向的调控免疫系统对卵巢、子宫等生殖器官的免疫激进,加剧卵巢早衰的发展。目前已有研究证实,阴道菌群的失衡可导致卵巢功能的紊乱,子宫发育的受限等;阴道微生物群不仅在女性月经周期中发生变化,而且在生殖过程中也会发生变化。产H
因此,探究阴道菌群与POF的相关作用机制,开发新的含益生菌有效成分制剂将为POF的药物研究与治疗提供新的理论基础与研究思路。
发明内容
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供詹氏乳杆菌来源纳米囊泡(External vesicles of Lactobacillus Jenni origin,LJS-EVs)在制备防治卵巢早衰治疗药物中的应用。
本发明的目的通过下述方案实现:
詹氏乳杆菌来源纳米囊泡(External vesicles of Lactobacillus Jenniorigin,LJS-EVs)在制备防治卵巢早衰治疗药物中的应用。
进一步的,所述詹氏乳杆菌来源纳米囊泡具有强大的保护卵巢颗粒细胞、恢复雷公藤导致的POF作用。
进一步的,所述药物相同或不同的分别包括治疗有效量的詹氏乳杆菌来源纳米囊泡。
进一步的,所述的药物相同或不同的分别可采用常规方法制成各种药用剂型,这些剂型包括:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、颗粒剂、冲剂、丸剂、丹剂、混悬剂、酒剂、酊剂等口服给药的剂型及注射液的给药剂型,如针剂等。
进一步的,所述的药物相同或不同的分别还可含有一种或以上药学上可接受的载体。
进一步的,所述的药物相同或不同的分别还可含有一种或以上药学上可接受的赋形剂。
进一步的,所述的赋形剂可包括稀释剂、湿润剂、润滑剂、填充剂、防腐剂等。
本发明所述的詹氏乳杆菌来源纳米囊泡(LJS-EVs)可以通过本领域技术人员公知的纳米囊泡制备方法得到,如对詹氏乳杆菌培养后得到的培养上清液进行分离得到。
进一步的,分离得到的沉淀即为詹氏乳杆菌来源纳米囊泡(LJS-EVs)。
进一步的,所述分离的方法可为对培养上清液进行超速离心进行分离。
进一步的,所述超速离心的速度可为100000g或以上。
进一步的,所述超速离心的时间可为10-100min。
进一步的,所述超速离心的时间可为50-100min。
进一步的,超速离心所得沉淀可用PBS等缓冲液重悬从而得到詹氏乳杆菌来源纳米囊泡悬浮液。
进一步的,可重复进行一次或以上的超速离心,以获得进一步纯化的詹氏乳杆菌来源纳米囊泡。
进一步的,詹氏乳杆菌来源纳米囊泡悬浮液使用前可使用过滤器过滤以获得无菌的悬浮液。所述的过滤器可为0.22μm的过滤器。
进一步的,超速离心前可使用过滤器过滤以除去较大的杂质;所述的过滤器可为0.45μm的过滤器。
进一步的,超速离心前可对培养上清液进行预离心收集上清液,除去杂质沉淀。
进一步的,预离心的速度可为10000g或以下。
进一步的,所述预离心的时间可为10-60min。
进一步的,可重复进行一次或以上的预离心。通过预离心可将非目标物质分离除去,如除去菌体,减少杂质对于后续超速离心分离的影响。
进一步的,培养上清液通过对詹氏乳杆菌培养后除去菌体得到。
进一步的,采用BHI培养基对詹氏乳杆菌进行培养。
进一步的,培养至菌OD值为2-3时即可停止培养。
进一步的,优选培养过程进行严格的氧量控制。
本发明首次从詹氏乳杆菌中分离得到纳米囊泡,其通过对菌株的培养上清液分离得到,成分天然,无毒副作用,具有良好的生物相容性和安全性,并通过体内外实验中证明其具有强大的保护卵巢颗粒细胞作用,可逆转雷公藤对细胞的抑制作用,甚至促进细胞的增殖,恢复雷公藤导致的POF,为益生菌在POF的应用和防治提供新的理论依据,因此具有广阔的应用前景。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明的LJS-EVs的透射电镜图。
图2为本发明的LJS-EVs的NTA分析结果。
图3为本发明实施例中KGN细胞摄取LJS-EVs的倒置荧光显微镜图。
图4为流式分析DIL-LJS-EVs被KGN细胞摄取后的波峰变化。
图5为本发明的LJS-EVs对KGN细胞增殖能力的影响。
图6和图7为本发明的LJS-EVs对KGN细胞凋亡的影响。
图8为DIL-LJS-EVs示踪LJS-EVs在动物组织和卵巢组织中的分布;其中,A:小动物活体成像观察DIL-LJS-EVs经灌胃后LJS-EVs在动物休内的分布;B:冷冻切片荧光显微镜观察卵巢摄取DIL-LJS-EVs的情况。
图9为本发明的LJS-EVs对雷公藤造模形成的PMOF动物模型的影响,Elisa检测各组动物血清中雌二醇(E
图10为各组动物卵巢形态与对照组的对比。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。下列实施例中涉及的物料若无特殊说明均可从商业渠道获得。所述方法若无特别说明均为常规方法。
一实施方式,詹氏乳杆菌来源纳米囊泡(External vesicles of LactobacillusJenni origin,LJS-EVs)在制备防治卵巢早衰治疗药物中的应用。
一实施例中,所述詹氏乳杆菌来源纳米囊泡具有强大的保护卵巢颗粒细胞、恢复雷公藤导致的POF作用。
一实施例中,所述药物相同或不同的分别包括治疗有效量的詹氏乳杆菌来源纳米囊泡。
一实施例中,所述的药物相同或不同的分别可采用常规方法制成各种药用剂型,这些剂型包括:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、颗粒剂、冲剂、丸剂、丹剂、混悬剂、酒剂、酊剂等口服给药的剂型及注射液的给药剂型,如针剂等。
一实施例中,所述的药物相同或不同的分别还可含有一种或以上药学上可接受的载体。
一实施例中,所述的药物相同或不同的分别还可含有一种或以上药学上可接受的赋形剂。
一实施例中,所述的赋形剂可包括稀释剂、湿润剂、润滑剂、填充剂、防腐剂等。
一实施例中,本发明所述的詹氏乳杆菌来源纳米囊泡(LJS-EVs)可以通过本领域技术人员公知的纳米囊泡制备方法得到。
一实施例中,詹氏乳杆菌来源纳米囊泡(LJS-EVs)通过对詹氏乳杆菌培养后得到的培养上清液进行分离得到。
一实施例中,詹氏乳杆菌为常规市售菌株即可。
一实施例中,分离得到的沉淀即为詹氏乳杆菌来源纳米囊泡(LJS-EVs)。
一实施例中,所述分离的方法可为对培养上清液进行超速离心进行分离。
一实施例中,所述超速离心的速度可为100000g或以上。一实施例中,所述超速离心的速度为100000g;另一实施例中,所述超速离心的速度为130000g;再一实施例中,所述超速离心的速度为120000g。
一实施例中,所述超速离心的时间可为10-100min。
一实施例中,所述超速离心的时间可为50-100min。一实施例中,所述超速离心的时间为70min;另一实施例中,所述超速离心的时间为100min;再一实施例中,所述超速离心的时间为80min。
一实施例中,超速离心所得沉淀可用PBS等缓冲液重悬从而得到詹氏乳杆菌来源纳米囊泡悬浮液。
一实施例中,重复进行一次或以上的超速离心,以获得进一步纯化的詹氏乳杆菌来源纳米囊泡。
一实施例中,詹氏乳杆菌来源纳米囊泡悬浮液使用前可使用过滤器过滤以获得无菌的悬浮液。所述的过滤器可为0.22μm的过滤器。
一实施例中,超速离心前可使用过滤器过滤以除去较大的杂质;所述的过滤器可为0.45μm的过滤器。
一实施例中,超速离心前可对培养上清液进行预离心收集上清液,除去杂质沉淀。
一实施例中,预离心的速度可为10000g或以下。一实施例中,预离心的速度为10000g;另一实施例中,预离心的速度为2000g;再一实施例中,预离心的速度为300g。
一实施例中,所述预离心的时间可为10-60min。一实施例中,预离心的时间为10min;另一实施例中,预离心的时间为20min;再一实施例中,预离心的时间为30min。
一实施例中,重复进行一次或以上的预离心。通过预离心可将分非目标物质分离除去,如除去菌体,减少杂质对于后续超速离心分离的影响。
一实施例中,培养上清液通过对詹氏乳杆菌培养后除去菌体得到。
一实施例中,采用BHI培养基对詹氏乳杆菌进行培养。
一实施例中,培养至菌OD值为2-3时即可停止培养。
一实施例中,优选培养过程进行严格的氧量控制。
一实施例中,詹氏乳杆菌来源纳米囊泡(LJS-EVs)通过对詹氏乳杆菌培养后得到的培养上清液进行分离得到,包括以下具体步骤方法制备得到:
(1)使用BHI培养基对詹氏乳杆菌(常规市售菌株,如菌株编号SHBCC D24914,中文名称詹氏乳杆菌SHBCC D24914拉丁名Lactobacillus jensenii)进行连续培养;
(2)待菌OD值为2-3时停止培养,进行预离心处理,如10000g或以下离心10-60min,可重复一次或以上的预离心(如依次在300g离心10min,上清再在2000g离心20min,上清继续在10000g离心30min),去除菌沉淀,收集上清,并使用0.45um滤头过滤,得到培养上清液;
(3)超速离心分离:100000g或以上超速离心10-100min,如在130000g离心70min,可重复进行一次或以上的超速离心,弃上清,所得沉淀即为詹氏乳杆菌来源纳米囊泡(LJS-EVs);用PBS缓冲液重悬,可获得詹氏乳杆菌来源纳米囊泡悬浮液;
(4)詹氏乳杆菌来源纳米囊泡悬浮液使用前可通过0.22um滤头过滤,获得无菌的悬浮液。
一实施例中,利用透射电镜对詹氏乳杆菌来源纳米囊泡(LJS-EVs)进行形态学鉴定。由透射电镜观察可见,LJS-EVs呈类圆形或椭圆形的囊泡,如托盘状;电镜下明显可观察到50nm-100nm具有膜结构的囊泡结构,结果见图1。
一实施例中,利用纳米颗粒跟踪分析仪测定悬浮液中LJS-EVs的粒径大小。结果显示LJS-EVs粒径主要分布在50-200nm之间,可发现杂峰较少,且具有较低的多分散性指数,结果见图2。
实施例1:人卵巢癌细胞KGN对LJS-EVs的摄取
人卵巢癌细胞KGN购买于上海富衡生物技术有限公司
(1)DIL荧光标记的LJS-EVs:将10mg DIL染料(复申生物)与10
(2)将人卵巢癌细胞KGN接种于6孔板中,待细胞融合度长至50-60%,加入10uLDIL-LJS-EVs,37℃避光孵育6h;PBS洗涤2-3次,每孔加入2mL基础1640培养基,并加入10uL的1mg/mL的DAPI,放入培养箱孵育30-40min;荧光显微镜(舜宇)进行不同倍数拍摄,以PBS与DIL孵育作为阴性对照;结果见图3。
有图可见,DIL-LJS-EVs可以被KGN细胞摄取并在胞内发出DIL染料的红色荧光,而PBS对照组没有观察到荧光,该结果证实DIL-LJS-EVs可被KGN细胞摄取进入胞内。
实施例2:流式细胞技术鉴定KGN对DIL-LJS-EVs摄取
(1)DIL荧光标记的LJS-EVs同实施例1;
(2)将人卵巢癌细胞KGN接种于6孔板中,DIL-LJS-EVs以1×10
(3)流式细胞仪检测DIL阳性的细胞比例;以PBS与DIL孵育作为阴性对照;结果见图4。
由图可见,流式结果可发现对照组与空白对照组(Blank)峰值均较小,无明显的阳性区,而LJS-EVs组有明显的阳性波峰,且远大于另外两组,进一步证实DIL-LJS-EVs可被KGN细胞摄取进入细胞内。
实施例3:LJS-EVs对雷公藤作用下KGN细胞增殖的影响
(1)KGN细胞按照1000个/孔铺设至96孔板,每组每个时间5个复孔进行分组;
(2)干预分组:①对照组:正常培养,在实验过程不做任何处理;②雷公藤实验组:使用10ug/mL的雷公藤刺激浓度作为卵巢早衰细胞模型的刺激浓度,在该浓度下刺激细胞12h后,更换正常培养基继续培养;③雷公藤+雌激素实验组:在雷公藤刺激12h后,移除培养基,每孔加入2mL浓度为1mM 雌激素的新鲜培养基;④雷公藤+LJS-EVs实验组:在雷公藤刺激12h后,移除培养基,每孔加入2mL蛋白浓度为1ug/mL LJS-EVs的新鲜培养基;
(3)各组分别进行孵育,在孵育至目标时间后每孔加入10uL CCK8检测液,37℃避光孵育2h,酶标仪上机检测450nm的吸光度,结果见图5。
由图可见,雷公藤明显抑制KGN细胞的增殖,这提示雷公藤进行的卵巢早衰的体外细胞模型的建立成功;而雌激素和本发明的LJS-EVs可逆转雷公藤的抑制作用,甚至促进KGN细胞的增殖,且本发明的LJS-EVs逆转效果与雌激素的治疗效果相近。
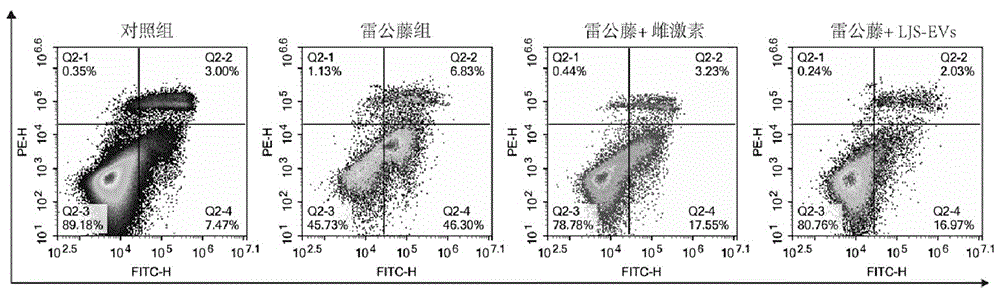
实施例4:LJS-EVs对雷公藤作用下KGN细胞凋亡的影响
(1)将生长状态良好的KGN细胞,使用胰酶消化,并用完全培养基终止消化。1200转离心5min去除上清。加入适量的培养基,对细胞沉淀进行重悬,取适量细胞悬液使用细胞计数仪进行计数,制备2×10
(2)干预分组:①对照组:正常培养,在实验过程不做任何处理;②雷公藤实验组:使用10ug/mL的雷公藤刺激浓度作为卵巢早衰细胞模型的刺激浓度,在该浓度下刺激细胞12h后,更换正常培养基继续培养;③雷公藤+雌激素实验组:在雷公藤刺激12h后,移除培养基,每孔加入2mL浓度为1mM 雌激素的新鲜培养基;④雷公藤+LJS-EVs实验组:在雷公藤刺激12h后,移除培养基,每孔加入2mL蛋白浓度为1ug/mL LJS-EVs的新鲜培养基。各组进行连续培养48h。连续培养时间的起始点以更换去除含有雷公藤培养基的时间作为起始点;
(3)使用无EDTA胰酶对各组细胞进行消化,并用完全培养基终止消化,离心去除含有胰酶的培养基,并使用PBS洗涤2次,使用细胞凋亡检测试剂盒(南京凯基)中的1×Binding Buffer洗涤1次,洗涤完成后使用200uL 1×Binding Buffer重悬细胞,细胞浓度不得低于1.0×10
(4)分别吸取100µL上述细胞悬液,依次加入5µL FITC-AnnexinV,加入5µL PI,涡漩轻柔混匀后,室温避光反应15min;
(5)每组加入400µL 1×Binding Buffer,转移至流式管,按照分组进行标纪,上机进行流式分析;结果见图6和图7。
由图看见,雷公藤显著导致KGN细胞的凋亡,而雌激素和本发明的LJS-EVs可逆转雷公藤的作用,且本发明的LJS-EVs逆转效果与雌激素的治疗效果相近。
实施例5:活体成像技术示踪LJS-EVs灌胃后在动物中的器官分布
(1)DIL荧光标记的LJS-EVs同实施例1;以PBS与DIL孵育作为阴性对照;
(2)采用SD大鼠按照1mL/kg的灌胃量利用DIL-LJS-EVs悬浮液对动物进行灌胃,2h后使用10%的水合氯醛按照100uL/kg的使用量对动物进行麻醉;
(3)动物完全麻醉后,将实验动物放置于小动物活体动物成像仪,上机检测;结果见图8中的A。
由图可见,LJS-EVs灌胃后可经消化道到达机体的其他位置,且在下肢腹腔和生殖器官均有明显的分布。
(4)冷冻切片技术对卵巢组织切片,联合倒置荧光显微镜明确卵巢组织对LJS-EVs的摄取情况:
(a)按照1%的外泌体浓度配制灌胃液,即按照10mg/mL/kg的灌胃量利用DIL-LJS-EVs悬浮液对动物进行灌胃;正常连续喂养5d,处死实验动物;
(b)快速解剖小鼠并取出卵巢,子宫等目的组织;将部份组织使用组织剪剪开,PBS洗净,冻至-80℃留作WB使用,一部份泡至10%中性福尔马林固定,一部份泡至30%蔗糖溶液中,固定剂应有足够的量,一般为组织块体积的10倍以上,固定于蔗糖溶液的组织,固定4h后应尽快移至-80冰箱冰冻;
(c)组织固定,冻硬后,于冷冻切片机上进行切片;
(d)将切片平铺于载玻片上,置于正置荧光显微镜下,进行观察拍照;卵巢切片结果见图8中的B。
由图可见,卵巢切片结果明确LJS-EVs灌胃后可到达卵巢位置,并被卵巢组织所吸收进入卵巢组织细胞中。
实施例6:LJS-EVs对雷公藤造模形成的PMOF动物模型的调控作用
(1)雷公藤造模SD大鼠:动物第1天腹腔注射0.6mg/mL/kg的雷公藤溶液,第2-15天腹腔注射0.8mg/mL的雷公藤溶液,注射体积10mL/kg体重,正常对照组注射同等体积的氯化钠注射液,1次/天,共15天;
(2)干预分组:①正常对照组:对照组正常喂养;②雷公藤组:造模成功后正常喂养;③雷公藤+雌激素实验组:10mg/mL/kg的灌胃量灌胃雌激素;④雷公藤+LJS-EVs实验组:10mg/mL/kg的灌胃量灌胃LJS-EVs;
(3)给药:造模结束后第2天,按分组灌胃,每2天灌胃一次,灌胃7次;
(4)末次给药后第2天结束实验,所有小鼠称重。小鼠眼眶取血:使用乙醚将待实验的小鼠进行麻醉,自小鼠内眼眶下方取血,将装有血液的离心管于室温静置半小时,直至血液出现明显分层后高速离心30min。离心结束后吸取上层血清置新编码的离心管中,于-80℃冰箱中保存。采血后颈椎脱臼处死动物,取双侧卵巢、子宫固定于4%多聚甲醛溶液中过夜固定;
(5)ELISA检测各组动物血液中的雌二醇,抑制素,孕酮的浓度;
(6)对比各组卵巢的形态。
结果如图9-图10所示。由图9可见,雷公藤可抑制动物体内雌二醇和抑制素的分泌,这也提示卵巢早衰模型的构建成功,而这种抑制效果可被雌激素和詹氏乳杆菌来源纳米囊泡(LJS-EVs)所逆转;为了明确卵巢的功能变化,进一步通过卵巢的形态学对比各组的效果,由图10可见,雷公藤组动物的卵巢形态上变细长,整体形态萎缩;而本发明LJS-EVs组卵巢的情况相较于雷公藤组得到明显改善,且与雌激素的治疗效果相近。
本发明首次从詹氏乳杆菌中分离得到纳米囊泡,其通过对菌株的培养上清液分离得到,成分天然,无毒副作用,具有良好的生物相容性和安全性,并通过体内外实验中证明其具有强大的保护卵巢颗粒细胞作用,可逆转雷公藤对细胞的抑制作用,甚至促进细胞的增殖,恢复雷公藤导致的POF,为益生菌在POF的应用和防治提供新的理论依据,因此具有广阔的应用前景。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 辣椒来源纳米囊泡在制备防治动脉粥样硬化疾病药物中的应用
- 辣椒来源纳米囊泡在制备防治动脉粥样硬化疾病药物中的应用
