一种比率荧光探针及其制备方法和应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及荧光探针技术领域,具体涉及一种比率荧光探针及其制备方法和应用。
背景技术
生物胺的生物活性影响着人类健康,是维持人体正常生理活动所不可缺少的物质,它可调节体温、血压、消化、影响细胞等组织生理结构的形成。在生物胺中,酪胺的生理毒性仅次于组胺。人体中的酪胺通过单胺氧化酶途径代谢,而单胺氧化酶抑制剂常被用于治疗抑郁症、帕金森症。而当在接受单胺氧化酶抑制剂治疗的人群在摄入含酪胺食品时,由于酪胺代谢能力下降,而面临更高的酪胺中毒风险。酪胺中毒又被称为“奶酪反应”,表现为偏头痛、心率加快、恶心、呕吐、呼吸紊乱和血糖升高。酪胺对人体健康和食品品质造成负面影响,严格控制食物生产和流通过程中酪胺的含量具有很高的社会价值和经济价值。
因此,迫切需要能够建立定量和直观检测酪胺的荧光检测方法,这对保证食品安全和饮食健康至关重要。
发明内容
针对以上技术问题,本发明提供一种比率荧光探针及其制备方法和应用。该比率荧光探针可实时/现场目视定量检测酪胺,灵敏度高,检测限为1.023μM,检测过程便携、快速且成本低廉。
为解决上述技术问题,本发明采用了如下技术方案:
第一方面,本发明提供一种比率荧光探针,该比率荧光探针由异硫氰酸盐染料修饰半导体聚合物量子点(Pdots)制备得到纳米颗粒,其在530nm处和581nm处分别具有较强的荧光发射峰;其中,异硫氰酸盐染料为异硫氰酸罗丹明B;半导体聚合物量子点由聚苯乙烯马来酸酐共聚物和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]构成。
本发明中异硫氰酸罗丹明B(RBI)作为异硫氰酸盐修饰由聚苯乙烯马来酸酐共聚物(PSMA)和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)](PF8BT)构成的半导体聚合物量子点得到PF8BT-RBI比率荧光探针。异硫氰酸罗丹明B和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的荧光作为酪胺的荧光检测信号,RBI作为能量受体,PF8BT作为能量供体,基于荧光共振能量转移(FRET)机理构建PF8BT-RBI比率荧光探针,PF8BT能量供体吸收能量后转移到RBI能量受体,RBI能量受体发射荧光。根据待检测物酪胺的浓度变化,使得PF8BT能量供体荧光和RBI能量受体荧光强度发生变化,再通过PF8BT、RBI这两者的荧光强度比率与被检测物的浓度呈现线性关系,从而实现待测物质中酪胺的浓度的定量检测。同时,PF8BT和RBI荧光强度的增减导致荧光探针荧光颜色的变化,含酪胺的物质加入PF8BT-RBI比率荧光探针后,溶液在350nm紫外灯激发下会由橙黄色变为黄绿色,实现了可视化检测酪胺。本发明的比率荧光探针对酪胺的检测限为1.023μM,低于酪胺残留允许限,可以准确检测浓度范围在0-250μM的酪胺;可实时/现场目视定量检测酪胺,使检测过程便携、快速且成本低廉,满足水产品新鲜度和安全性的检测需求。
第二方面,本发明还提供上述比率荧光探针的制备方法,包括:
步骤1:将异硫氰酸罗丹明B的二甲基亚砜溶液,聚苯乙烯马来酸酐共聚物的四氢呋喃溶液和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的四氢呋喃溶液混合,并用四氢呋喃定容,得到溶液A;
步骤2:在0℃冰水浴和超声的条件下,将所述溶液A一次性注入超纯水中,持续超声1-2min,再向其中通入气体吹扫同时加热升温去除四氢呋喃后,收集剩余液体用超纯水定容,过滤,所得滤液即为比率荧光探针;
步骤1中所述溶液A中异硫氰酸罗丹明B、聚苯乙烯马来酸酐共聚物和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的质量比为0.005-0.05:0.1-1:1;
所述步骤2中溶液A与超纯水体积比为2-5:10;
所述步骤2中在通入气体吹扫同时加热升温去除四氢呋喃时的温度为95-110℃,保温时间为25-30min;
所述比率荧光探针的制备方法所制的比率荧光探针的粒径为10-200nm。
本发明使用Pdots作为比率荧光传感器的纳米结构,通过再沉淀法将荧光染料嵌入Pdots中。其中异硫氰酸罗丹明B、聚苯乙烯马来酸酐共聚物和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的结构如式(I)所示
上述三种物质均可商业购买得到,省略了复杂的制备过程。
上述步骤1中硫氰酸罗丹明B的二甲基亚砜溶液,聚苯乙烯马来酸酐共聚物和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的四氢呋喃溶液无特定加入顺序,能够将各物料达到混合均匀的状态即可。
上述步骤2中,将溶液A一次性注入超纯水中,侧重一次性无停顿快速的注入,所述快速是指在实验者的条件和设备能力范围内的最快速度。
示例性地,根据实验习惯,本发明提供一种比率荧光探针的制备方法,包括:
步骤1:将异硫氰酸罗丹明B的二甲基亚砜溶液和聚苯乙烯马来酸酐共聚物的四氢呋喃溶液,依次加入聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的四氢呋喃溶液中混合,并用四氢呋喃定容,得到溶液A;
步骤2:在0℃冰水浴和超声的条件下,将所述溶液A一次性注入超纯水中,持续超声1-2min,再向其中通入气体吹扫同时加热升温去除四氢呋喃后,收集剩余液体用超纯水定容,过滤,所得滤液即为比率荧光探针;
步骤1中所述溶液A中异硫氰酸罗丹明B、聚苯乙烯马来酸酐共聚物和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的质量比为0.005-0.05:0.1-1:1;
所述步骤2中溶液A与超纯水体积比为2-5:10;
所述步骤2中在通入气体吹扫同时加热升温去除四氢呋喃时的温度为95-110℃,保温时间为25-30min。
本发明的异硫氰酸罗丹明B(RBI)作为能量受体,所产生的荧光发射峰位于581±5nm,聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)](PF8BT)作为能量供体,所产生的荧光发射峰位于530±5nm。基于荧光共振能量转移(FRET)机理构建PF8BT-RBI比率荧光探针,PF8BT能量供体吸收能量后转移到RBI能量受体,RBI能量受体发射荧光。根据待检测物酪胺的浓度变化,使得PF8BT供体荧光和RBI受体荧光强度发生变化,再通过PF8BT、RBI这两者的荧光强度比率与被检测物的浓度呈现线性关系,从而实现待测物质中酪胺的浓度的定量检测。
优选地,所述异硫氰酸罗丹明B的二甲基亚砜溶液浓度为1-2mg/mL;所述聚苯乙烯马来酸酐共聚物的四氢呋喃溶液浓度为1-2mg/mL;所述聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的四氢呋喃溶液浓度为1-2mg/mL。
优选地,所述溶液A中异硫氰酸罗丹明B、聚苯乙烯马来酸酐共聚物和聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)]的质量比为0.02:0.8:1。
过多的异硫氰酸罗丹明B会增加溶液中的游离荧光染料,从而降低有效反应;而过少的异硫氰酸罗丹明B会降低异硫氰酸罗丹明B的荧光强度,从而降低仪器误差的兼容性而降低检测结果的准确性。
优选地,所述收集剩余液体用超纯水定容至10mL。
优选地,步骤2中气体为氮气、氩气或者氦气中的任意一种或其组合。
优选地,所述过滤为以0.22μm水相滤头过滤。
本发明中,溶剂中的四氢呋喃被挥发完全,剩余的二甲基亚砜的含量≤2‰,不会影响水相滤头的过滤性能,满足使用要求。
第三方面,本发明还提供上述的比率荧光探针或上述比率荧光探针的制备方法得到的比率荧光探针用于酪胺检测中的应用。
第四方面,本发明还提供上述比率荧光探针检测酪胺的方法,包括:将所述比率荧光探针与待测酪胺按比例混合,制成反应体系,在25-30℃下反应10-20min后,采用荧光光谱仪进行光谱检测,通过比率荧光探针在30nm处和581nm处的荧光强度变化,实现对酪胺的检测。
优选地,反应体系制备方法包括:加入50μL比率荧光探针、30μL待测酪胺和适量的缓冲液,制成1mL反应体系;所述缓冲液为PBS缓冲液,pH 7-7.5。
优选地,采用荧光光谱仪进行光谱检测,记录荧光发射峰值在530nm的荧光强度I
本发明的比率荧光探针,在无酪胺存在的条件下,PF8BT能量供体被激发后将能量传递给RBI能量受体,RBI能量受体发射荧光;在酪胺存在的条件下,RBI能量受体的异硫氰酸基团与氨基发生加成反应,并进一步导致RBI发生分子内电荷转移,从而猝灭了RBI的荧光,PF8BT能量供体被激发时,PF8BT能量供体发射荧光。根据的酪胺浓度不同,PF8BT和RBI的两个发射波长的荧光强度发生变化,实现比率荧光检测酪胺的含量。
具体解释为:PF8BT能量供体和RBI能量受体对空间位置的改变非常灵敏。
当PF8BT能量供体和RBI能量受体足够接近时,由于PF8BT能量供体的荧光发射光谱和RBI能量受体的紫外吸收光谱发生了重叠,PF8BT能量供体的发色基团会将能量高效率地转移至RBI能量受体的发色基团上,导致PF8BT能量供体的发射荧光被减弱或消失,而此时,检测到RBI能量受体在581nm的荧光强度。
当PF8BT能量供体和RBI能量受体的相对空间位置被改变后,例如,比率荧光探针中加入待测物质酪胺后,酪胺的氨基与RBI的异硫氰酸基团发生加成反应,使RBI发生荧光猝灭,导致PF8BT能量供体和RBI能量受体的相对空间位置发生改变而无法发生荧光共振能量转移,此时检测到PF8BT能量受体在530nm的荧光。根据待检测物酪胺的浓度变化,使得PF8BT供体荧光和RBI受体荧光强度发生变化,再通过PF8BT、RBI这两者的荧光强度比率与被检测物的浓度呈现线性关系,从而实现待测物质中酪胺的浓度的检测。
优选地,所述荧光测试的条件包括:荧光激发波长为460-485nm,荧光发射光谱观察范围为520-600nm。
第五方面,本发明还提供上述比率荧光探针检测酪胺的方法用于检测养殖水、水产品、肉类中的酪胺的应用。
附图说明
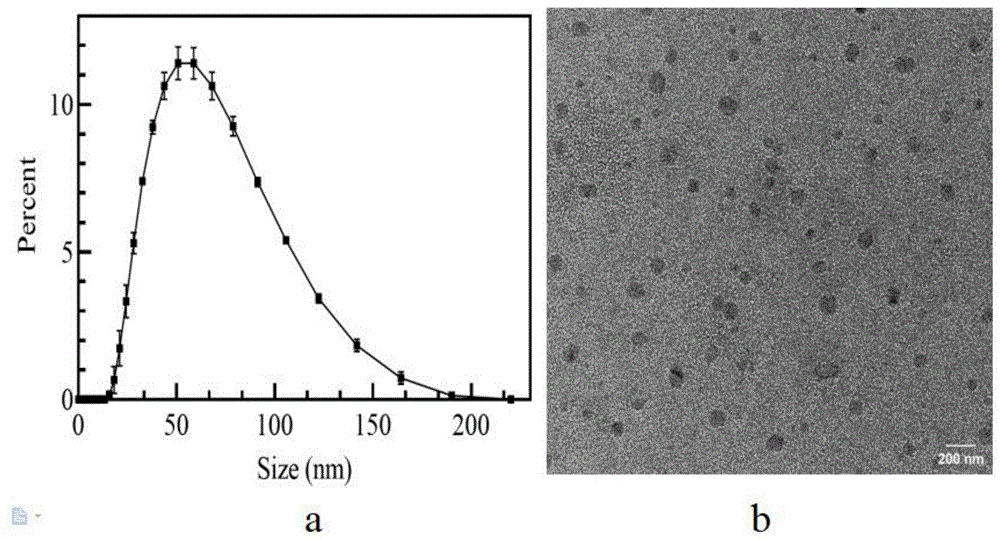
图1为本发明RBI与F8BT质量比为2%的PF8BT-RBI比率荧光探针在透射电镜下的图像和粒度分布图(图1a为粒度分布图,图1b为在透射电镜下的图像);
图2为不同RBI与F8BT质量比下的PF8BT-RBI比率荧光探针溶液的荧光发射峰比率差值;
图3为将不同浓度的异硫氰酸荧光素混入PFO前体溶液中通过纳米沉淀方法制备得到的的荧光探针的荧光发射光谱(图3a),及其归一化后的荧光发射光谱(图3b);
图4为PF8BT-RBI和PPVK-FITC比率荧光探针中加入酪胺反应前后的傅里叶变换红外光谱图(其中,图4A为PF8BT-RBI的傅里叶变换红外光谱图,图4B为PPVK-FITC傅里叶变换红外光谱图);
图5为PF8BT-RBI和PPVK-FITC比率荧光探针的荧光寿命图(其中,图5C为PF8BT、PF8BT-RBI和PF8BT-RBI+酪胺的荧光寿命,图5D为PVK、PPVK-FITC、PPVK-FITC+Tyr的荧光寿命);
图6为PF8BT-RBI和PPVK-FITC比率荧光探针在检测酪胺时的Zeta电位;
图7为PF8BT-RBI和PPVK-FITC比率荧光探针的绝对量子产率;
图8为不同酪胺浓度下PF8BT-RB比率荧光探针溶液的荧光发射光谱;
图9不同酪胺标准液浓度下PF8BT-RBI比率荧光探针溶液的荧光图像;
图10为不同酪胺标准液浓度下PF8BT-RBI比率荧光探针溶液的荧光发射峰比率数值与胺标准液浓度的线性范围。
图11为不同酪胺浓度下PPVK-FITC比率荧光探针溶液的荧光发射光谱;
图12为不同酪胺标准液浓度下PPVK-FITC比率荧光探针溶液的荧光图像;
图13为不同酪胺标准液浓度下PF8BT-RBI比率荧光探针溶液的荧光发射峰比率数值与胺标准液浓度的线性范围;
图14为本发明比率荧光探针中添加不同干扰物质(1,9:空白,2:尸胺,3:1,4-二氨基丁烷二盐酸盐,4:组胺,5:色胺盐酸盐,6:精胺,7:β-苯乙胺,8,16:酪胺,10:Na
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
实施例1
PF8BT-RBI比率荧光探针的制备
取1mL聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)](F8BT)的四氢呋喃溶液(1mg/mL),依次加入0.005-0.05mL的异硫氰酸罗丹明B(RBI)的二甲基亚砜溶液(1mg/mL)和0.8mL聚苯乙烯马来酸酐共聚物(PSMA)的四氢呋喃溶液(1mg/mL)混合,最后用四氢呋喃定容至2mL,得到RBI与F8BT质量比为0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%的溶液A。
将上述各浓度的溶液A一次性注入处于超声环境中的10mL的超纯水中,在0℃冰水浴中持续超声1min,再向其中通入氮气吹扫,以使溶剂挥发,并通过硅油浴加热至100℃,反应30min后,收集剩余液体,然后用超纯水定容至10mL,再用0.22μm水相滤头过滤得到一系列不同异硫氰酸罗丹明B质量浓度的PF8BT-RBI比率荧光探针,储存在4℃冰箱中,待用。
图1为本发明RBI与F8BT质量比为2%的PF8BT-RBI比率荧光探针在透射电镜下的图像和粒度分布图(图1a为粒度分布图,图1b为透射电镜下的图像)。
从图1可知,RBI与F8BT质量比为2%的PF8BT-RBI比率荧光探针为10-200nm的球状颗粒,平均粒径为48.1nm。
实施例2
筛选最佳PF8BT-RBI比率荧光探针
(1)标准储备液的配制
称取酪胺标准品,用PBS缓冲液进行溶解配制成质量浓度为5mM的标准储备液,其中,PBS缓冲液的用pH为7.5的20mM。
(2)不同异硫氰酸罗丹明B浓度下比率荧光探针溶液的荧光发射峰值比率数值差值的分析
取实施例1制备的一系列PF8BT-RBI比率荧光探针,各0.05mL,加入0.03mL的标准储备液,并用PBS缓冲液定容到1mL,得到一系列PF8BT-RBI-酪胺溶液,其中酪胺的浓度为150μM。
取实施例1制备的一系列PF8BT-RBI比率荧光探针,各0.05mL,用PBS缓冲液定容到1mL得到一系列PF8BT-RBI-酪胺空白溶液。
用荧光分光光度计检测PF8BT-RBI-酪胺溶液和PF8BT-RBI-酪胺空白溶液的荧光发射光谱,分别记录PF8BT-RBI-酪胺溶液和PF8BT-RBI-酪胺空白溶液的荧光发射峰值在530nm的荧光强度I
R=I
其中,R:荧光发射峰值比率数值;
I
I
再利用荧光发射峰值比率数值差值公式(III),计算得到标准物质酪胺溶液的荧光发射峰值比率数值差值。
R
其中,R
R
R
以PF8BT-RBI-酪胺溶液中的不同RBI与F8BT质量比为横坐标,R
图2为本发明不同RBI与F8BT质量比下PF8BT-RBI比率荧光探针溶液的荧光发射峰比率差值;
从图2可知,RBI与F8BT质量比为2%时所制备的比率荧光探针对酪胺检测最灵敏,因此,选择RBI与F8BT质量比2%作为制备PF8BT-RBI比率荧光探针溶液A的最佳比例。
实施例3:
PF8BT-RBI比率荧光探针的制备
取1mL聚[(9,9-二辛基芴基-2,7-二基)-alt-(苯并[2,1,3]噻二唑-4,8-二基)](F8BT)的四氢呋喃溶液(1mg/mL),依次加入0.02mL的异硫氰酸罗丹明B(RBI)的二甲基亚砜溶液(1mg/mL)和0.8mL聚苯乙烯马来酸酐共聚物(PSMA)的四氢呋喃溶液(1mg/mL)混合,最后用四氢呋喃定容至2mL,得到溶液A。
将上述溶液A一次性注入处于超声环境中的10mL的超纯水中,在0℃冰水浴中持续超声1min,再向其中通入氮气吹扫,以使溶剂挥发,并通过硅油浴加热至100℃,反应30min后,收集剩余液体,然后用超纯水定容至10mL,再用0.22μm水相滤头过滤得到PF8BT-RBI比率荧光探针,储存在4℃冰箱中,待用。
对比例1
PPVK-FITC比率荧光探针
将实施例3中的F8BT替换为聚(聚(N-乙烯基咔唑))(PPVK),RBI替换为异硫氰酸荧光素(FITC),其与制备方法同实施例3,得到PPVK-FITC比率荧光探针,储存在4℃冰箱中,待用。
对比例2
PFO-FITC比率荧光探针
将实施例1中的F8BT替换为聚9,9-二辛基芴(PFO),RBI替换为异硫氰酸荧光素(FITC)其与制备方法同对比例1,得到PFO与FITC质量比为0-12%的一系列PFO-FITC比率荧光探针,储存在4℃冰箱中,待用。
验证例1
1、将对比例2制备的比率荧光探针进行荧光发射光谱分析。结果如图3所示;
图3为将不同浓度的异硫氰酸荧光素混入PFO前体溶液中通过纳米沉淀方法制备得到的的荧光探针的荧光发射光谱(图3a),及其归一化后的荧光发射光谱(图3b);
从图3可知,PFO-FITC的荧光发射光谱中只有属于PFO的荧光发射峰,没有产生属于FITC的发射峰,因此,PFO和FITC之间不存在荧光共振能量转移,所以PFO-FITC的组合无法构建比率荧光探针。
2、将实施例3、对比例1制备的比率荧光探针中加入酪胺反应前后进行傅里叶变换红外光谱表征,结果如图4所示。
图4为PF8BT-RBI和PPVK-FITC比率荧光探针中加入酪胺反应前后的傅里叶变换红外光谱图(其中,图4A为PF8BT-RBI的傅里叶变换红外光谱图,图4B为PPVK-FITC傅里叶变换红外光谱图);
从图4A可知,PF8BT-RBI的的傅立叶变换红外光谱中,可以发现N=C=S伸缩振动在2050.94cm
3、采用荧光寿命探究PF8BT-RBI和PPVK-FITC比率荧光探针建立比率荧光机制,结果如图5所示。
图5为PF8BT-RBI和PPVK-FITC比率荧光探针的荧光寿命图(其中,图5C为PF8BT、PF8BT-RBI和PF8BT-RBI+酪胺的荧光寿命,图5D为PVK、PPVK-FITC、PPVK-FITC+Tyr的荧光寿命)。
从图5C可知,PF8BT的荧光寿命为2.77ns,加入RBI后变为2.21ns,而加入酪胺后PF8BT的荧光寿命为2.14ns,并没有引起荧光寿命的实质性变化。
从图5D可知,PPVK的荧光寿命为6.43ns,与FITC混合后变为4.07ns,再加入酪胺后变为1444.06ns。
上述荧光寿命的变化表明,PF8BT、PPVK和RBI、FITC之间的荧光淬灭是基于荧光共振能量转移(FRET)的动态猝灭。
4、PF8BT-RBI和PPVK-FITC比率荧光探针在检测酪胺时的Zeta电位,结果如图6所示。
图6为PF8BT-RBI和PPVK-FITC比率荧光探针在检测酪胺时的Zeta电位。
从图6可知,加入酪胺后,PF8BT-RBI和PPVK-FITC在比率荧光探针的电位升高。加入酪胺后,PF8BT-RBI和PPVK-FITC的电位分别增加了1.96mV和3.77mV。这可能是由于酪胺和异硫氰酸基发生反应,比率荧光探针表面的电负性受到抑制。
5、PF8BT-RBI和PPVK-FITC比率荧光探针的绝对量子产率,结果如图7所示。
图7为PF8BT-RBI和PPVK-FITC比率荧光探针的绝对量子产率;
从图7可知,PF8BT、PPVK、PF8BT-RBI和PPVK-FITC的绝对量子产率分别为3.61%、1.48%、9.45%、8.83%。添加异硫氰酸酯染料RBI和FITC后,比率荧光探针的量子产率明显提高。
验证例2
实施例3、对比例1的比率荧光探针的性能比较
1、实施例3的PF8BT-RBI比率荧光探针
(1)标准曲线的绘制
取实施例3制备的PF8BT-RBI比率荧光探针0.05mL,加入不同体积的5mM的酪胺标准储备液,并用PBS缓冲溶液定容到1mL,得到酪胺的检测浓度为0μM、50μM、100μM、150μM、200μM、250μM的均相溶液,在25-30℃下反应10-20min后,进行荧光光谱检测,在荧光激发波长为460-485nm,荧光发射光谱观察范围为520-600nm检测上述各均相溶液荧光发射光谱。
图8为不同酪胺浓度下PF8BT-RBI比率荧光探针溶液的荧光发射光谱;
从图8可知,PF8BT-RBI比率荧光探针在581nm处的荧光发射峰来源于RBI,加入酪胺后出现RBI浓度依赖性淬灭。PF8BT-RBI比率荧光探针在530nm处的荧光发射峰来源于PF8BT,且加入酪胺后PF8BT的荧光发射峰增强。PF8BT和RBI荧光强度的增减导致荧光颜色的变化,在350nm紫外灯下观察溶液荧光颜色变化,含酪胺的物质加入PF8BT-RBI比率荧光探针后,均相溶液在350nm紫外灯激发下会由橙黄色变为黄绿色,如图9所示,其彩图参见实质审查资料。
记录在530nm的荧光强度I
y=0.0041x+0.3949
其中,R
x为酪胺标准溶液浓度;
y为荧光发射峰值比率数值。
图10为不同酪胺标准液浓度下PF8BT-RBI比率荧光探针溶液的荧光发射峰比率数值与胺标准液浓度的线性范围。
从图10可知,本发明的PF8BT-RBI比率荧光探针具有对酪胺灵敏响应性,荧光发射峰比率随着酪胺浓度的增加而增强,能够准确检测浓度范围在0-250μM的酪胺,且在20-150μM的范围内呈线性关系。
2、对比例1的PPVK-FITC比率荧光探针
(1)标准曲线的绘制
取对比例1制备的PPVK-FITC比率荧光探针0.05mL,加入不同体积的5mM的酪胺标准储备液,并用PBS缓冲溶液定容到1mL,得到酪胺的检测浓度为0μM、100μM、150μM、200μM、250μM、300μM、350μM、400μM、450μM、500μM的均相溶液,在25-30℃下反应10-20min后,进行荧光光谱检测,在荧光激发波长为320-470nm,荧光发射光谱观察范围为425-510nm检测上述各均相溶液荧光发射光谱。
图11为不同酪胺浓度下PPVK-FITC比率荧光探针溶液的荧光发射光谱;
从图11可知,PPVK-FITC比率荧光探针在加入酪胺不会引起517nm波长处FITC荧光强度的变化,而PPVK在377nm波长处的荧光强度则因加入酪胺而以浓度依赖性的方式下降。加入酪胺后,在紫外灯下观察溶液荧光颜色变化,发现PPVK-1FITC在紫外激发下的颜色由深蓝变为浅蓝,并逐渐熄灭荧光。如图12所示,其彩图参见实质审查资料。
图12为不同酪胺标准液浓度下PPVK-FITC比率荧光探针溶液的荧光图像。
记录上述各浓度均相溶液的荧光发射光谱在517nm的荧光强度I
y=-0.0051x+6.8857
其中,R
x为酪胺标准溶液浓度;
y为荧光发射峰值比率数值。
图13为不同酪胺标准液浓度下PF8BT-RBI比率荧光探针溶液的荧光发射峰比率数值与胺标准液浓度的线性范围。
根据PF8BT-RBI和PPVK-FITC的校准曲线,采用经典的3σ/s公式求得酪胺的检出限(LOD)。PF8BT-RBI和PPVK-FITC对酪胺的检出限分别为1.023μM和4.312μM。比较检测范围、校正曲线和检测限可知,本发明实施例3制备的PF8BT-RBI比率荧光探针的检测性能更好。
验证例3
1、探究不同生物胺和金属离子对PF8BT-RBI比率荧光探针的比发射率的影响
海产品中存在的其他胺和金属离子会干扰酪胺的检测。因此,有必要研究不同生物胺和金属离子等影响因素对传感器的影响。使用实施例3制备的PF8BT-RBI比率荧光探针来研究PF8BT-RBI比率荧光探针的选择性,在选择性实验中使用七种胺和六种金属离子(氯化物盐溶液)。结果如图14所示。
图14为本发明PF8BT-RBI比率荧光探针中添加不同干扰物质的荧光发射峰比率;
图14中,1和9为空白,2为尸胺,3为1,4-二氨基丁烷二盐酸盐,4为组胺,5为色胺盐酸盐,6为精胺,7为β-苯乙胺,8和16为酪胺,10为Na
2、实施例3制备的PF8BT-RBI比率荧光探针用于检测待测样品的检测的加标回收率
(1)样品的采集和处理
1)金枪鱼样品待测溶液
参照GB5009.208-2016。样品提取液,将三羟甲基氨基甲烷(12.1g)溶于70%的乙醇(950mL)中,然后用盐酸调节pH值至8.5,再用70%的乙醇定容至1000mL。
样品处理液,将金枪鱼(4±0.02g)溶于50mL的离心管中,然后加入10mL的样品提取液,用力涡旋3min,在4000r/min
样品稀释液,将三羟甲基氨基甲烷(12.1g)溶于水(950mL)中,然后用盐酸调节pH值至7.0,再用水定容至1000mL。
将样品处理液(0.6mL)溶解到样品稀释液(1.4mL)中,得到待测溶液。
2)养殖水样
调节水产养殖水中的酪胺至0-250μM的线性范围,并通过水相滤头(0.22μm)过滤,得到待测样品。
(2)样品测定
用实施例3制备的PF8BT-RBI比率荧光探针检测待养殖水样品和金枪鱼样品中酪胺的浓度,由于待测样品中的酪胺含量实际未检出,故进行加标回收实验,即向养殖水样品、金枪鱼样品中分别添加20.0μM、50.0μM、100.0μM的酪胺标准品,采用上述PF8BT-RBI比率荧光探针测定养殖水样品和金枪鱼样品的添加回收率,结果如表1所示。
表1加标回收试验
a)
表1中,采用本发明制备的PF8BT-RBI比率荧光探针检测养殖水样品的平均回收率在85.65%至92.07%之间,回收率良好,有利于校准标准检测曲线。在检测金枪鱼样品时,平均回收率在100.75%至115.71%,R.S.D在4.6%至9.3%。这表明,使用PF8BT-RBI对待测样品中的酪胺进行测定的准确性更容易接受。
综上所述,本发明的PF8BT-RBI比率荧光探针的回收率良好,具有很高的准确度,并且精密度很高。该方法可用于实际样品中的酪胺的检测,在定量和可视化检测方面表现出更好的性能。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
- 一种碳点-金纳米簇复合物的比率荧光探针的制备方法和应用
- 一种比率型粘性耀斑荧光探针及其制备方法和应用
- 一种近红外比率型半胱氨酸荧光探针及其制备方法和应用
- 一种用于定量检测血液中AChE和BChE的比率型荧光探针的制备方法
- 一种用于检测头孢氨苄残留的比率荧光探针的制备方法及其制备的荧光探针和应用
- 一种用于检测头孢氨苄残留的比率荧光探针的制备方法及其制备的荧光探针和应用
