用于治疗癌症的新型的基于重组质膜的囊泡
文献发布时间:2024-04-18 19:58:30
本申请是国际申请日为2018年9月28日的国际申请PCT/KR2018/011504进入中国、申请号为201880076196.9的题为“用于治疗癌症的新型的基于重组质膜的囊泡”的发明专利申请的分案申请。
技术领域
本发明涉及新型的基于重组质膜的囊泡,并且更具体而言,涉及用于治疗癌症的新型的基于重组质膜的囊泡。
背景技术
癌症指与异常细胞生长相关的一组疾病,其具有侵袭和转移到身体的其它部位的潜力。截至2015年,已知全世界存在多于9000万癌症患者,其中每年出现约1400万新的癌症患者。癌症占人类死亡原因的15.7%。最频繁发生的癌症是男性中的肺癌、前列腺癌、结肠癌和胃癌,以及女性中的乳腺癌、结肠癌、肺癌和子宫颈癌。
对于癌症治疗,尝试了各种治疗方法,其包括使用各种抗癌药的化学疗法、通过辐射的放射疗法、靶向与癌症相关的特定体内分子的抗体疗法等。然而,用于化学疗法或辐射中的抗癌药具有严重的副作用,因为这些治疗也影响正常细胞,并且因为癌细胞可以获得对抗癌药的抗性经常导致治疗失败或复发。
最近,使用我们身体的免疫系统的抗癌免疫疗法已在临床治疗中显示令人惊讶的效应。然而,由于癌症的复杂性,抗癌免疫疗法具有局限性,因为该疗法仅在小于约30%的癌症患者中有效。这是因为癌细胞被我们机体的免疫细胞识别为“自身的”,并且因此,重要的是癌细胞被免疫细胞识别为“非自身的”,使得可以诱导癌细胞的吞噬作用,从而诱导扩增的免疫应答。
外泌体是存在于所有生物液体,包括血液、尿和细胞培养物的培养基中的细胞衍生的囊泡,也称为细胞外囊泡或微囊泡。已知外泌体具有30nm至100nm的大小,并且当多囊体与细胞膜融合时从细胞中分泌,直接通过细胞膜分泌,或直接从细胞膜出芽。已知外泌体在各种过程中起重要作用,所述过程例如凝血、细胞间信号传导和代谢废物管理。与脂质体或聚合物型纳米颗粒相比,外泌体作为药物载体具有重要的优点,因为外泌体具有与人体细胞本身的组成相似的组成,并且外泌体是非免疫原性的(Ha等人,Acta Pharm.Sin.B.6(4):287-296,2016)。在这一点上,已使用外泌体进行各种尝试,使得将抗癌药(例如多柔比星)递送至肿瘤组织(Tian等人,Biomaterials.35:2383-2390,2014);使紫杉醇和多柔比星穿过血脑屏障并且递送至大脑(Yang等人,Pharm.Res.32:2003-2014,2015);为了治疗帕金森氏病,使过氧化氢酶穿过血脑屏障并且递送至大脑(Haney等人,J.ControlRelease.207:18-30,2015);或为了治疗癌症,递送对某些基因特异性的siRNA(Shtam等人,Cell Commun.Signal.11:88,2013)等。
细胞外囊泡指以颗粒形式的结构,其中从细胞释放或分泌到细胞外环境内的各种生物分子(例如蛋白质、核酸分子(例如RNA)、各种功能的脂质等)封装在脂质双层的细胞膜中,所述脂质双层与衍生所述各种生物分子的细胞的细胞膜相同。细胞外囊泡指平均直径为100nm至1μm的基于质膜的囊泡,其大于通常大小为30nm至100nm的外泌体的平均直径。
细胞衍生的纳米囊泡,其为被质膜包围的纳米大小的囊泡,指与由细胞分泌且天然形成的外泌体或细胞外囊泡不同的基于质膜的囊泡,所述质膜是通过人工方法(例如,其中使细胞通过微流体通道的挤出过程、多阶段过滤过程等)形成的纳米大小的细胞膜组分。
同时,水疱性口炎病毒糖蛋白(VSV-G)是存在于水疱性口炎病毒的病毒粒子膜中的唯一病毒糖蛋白,并且充当用于病毒粘附和融合到靶细胞内的蛋白质。VSV-G蛋白是包括两个N联聚糖的跨膜蛋白,当不存在其它病毒蛋白时,所述跨膜蛋白可以以低pH依赖性方式起始膜融合事件。由于VSV-G蛋白可以与核酸分子如DNA形成复合物,因此VSV-G蛋白已用作直接基因转移的载体,或已通过产生更稳定和高滴度的基于假型鼠白血病病毒(MLV)的逆转录病毒和基于慢病毒的载体有效地用于基因治疗中。然而,最近已提示除基因之外,VSV-G蛋白还可用于将各种蛋白质递送至异源细胞(Mangeot等人,Mol.Ther.19(9):1656-1666,2011)。
作为对VSV-G蛋白的结构和功能研究的结果,先前确认了其为基于成熟蛋白的第60、162和407个氨基酸残基的组氨酸形成簇并充当pH传感器,信号序列从所述成熟蛋白中去除(Roche等人,Science,313:187-191,2006;Roche等人,Science,315:843-848,2007),并且最近据报道,当上述组氨酸残基中的第162个氨基酸残基,组氨酸突变成精氨酸(H162R)时,它诱导在pH 6.8(其为癌细胞周围的生理pH)下的膜融合,并且在表达VSV-G突变体(H162R)的神经干细胞施用后,促进了癌细胞的死亡(Zhu等人,Mol.Ther.21(8):1492-1497,2013)。
然而,现有技术中公开的方法是难以应用于实际临床环境的技术,因为神经干细胞供应困难,并且癌细胞的杀死作用不是非常显著。
发明内容
技术问题
本发明的目的是解决包括上述问题的各种问题,并且本发明的目的是提供用于癌症的安全治疗的基于重组质膜的囊泡,所述囊泡在癌症微环境之外的条件下不起作用,同时自身有效地杀死癌细胞而无需抗癌药。特别地,本发明的目的是提供基于重组质膜的囊泡,其能够“异种化(xenogenization)”,使得免疫细胞可以将癌细胞识别为“敌人”。然而,这些目的是示例性的,并且本发明的范围并不限于此。
技术方案
根据本发明的一个方面,提供了基于重组质膜的囊泡,其中将VSV-G突变蛋白引入膜内,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代。
根据本发明的另一个方面,提供了用于治疗癌症的药物组合物,其含有基于重组质膜的囊泡作为活性成分。
此外,根据本发明的另外一个方面,提供了用于治疗癌症的药物组合物,其含有基于重组质膜的囊泡,其中将病毒衍生的致融膜蛋白作为活性成分引入膜内。
此外,根据本发明的另外一个方面,提供了基于重组质膜的囊泡,其中将VSV-G突变蛋白引入膜内,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代;或提供了基于重组质膜的囊泡用于制备癌症治疗剂的用途,其中将病毒衍生的致融膜蛋白引入膜内。
根据本发明的另外一个方面,提供了用于治疗患有癌症的受试者中的癌症的方法,其包括向患有癌症的受试者施用基于重组质膜的囊泡或上述那些中的一种或多种药物组合物。
有利效应
根据如上所述构成的本发明的实施方案,本发明可以有效地治疗癌症而不求助于复杂机制如基因转移。
附图说明
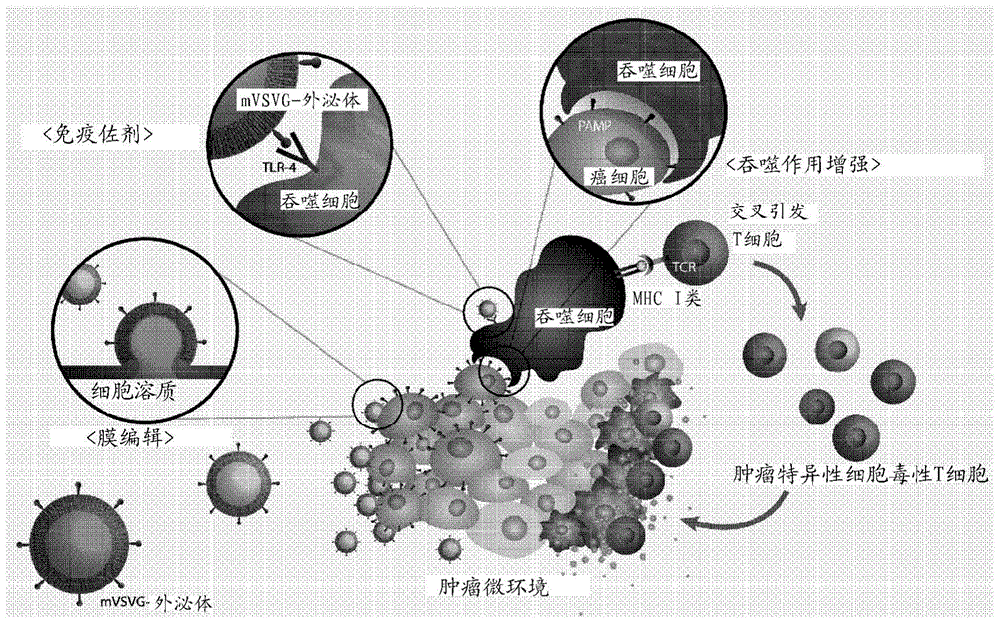
图1是示意性地示出根据本发明的实施方案,重组外泌体的作用机制的示意图,所述重组外泌体包括在癌细胞微环境(pH 6.8)中诱导抗癌免疫效应的突变型VSV-G H162R(下文缩写为“mVSV-G”)。
图2a是质粒图,其示出了用于生产根据本发明的实施方案的重组外泌体的质粒DNA的示意性结构,并且图2b显示了氨基酸序列以及编码其的多核苷酸的核酸序列,所述氨基酸序列示出了野生型VSV-G蛋白和突变的VSV-G蛋白在位置162处的突变,所述突变的VSV-G蛋白用于生产根据本发明的实施方案的重组外泌体。
图3是流程图,其示出了用于生产根据本发明的实施方案包括mVSV-G的重组外泌体的方法。
图4显示了根据本发明的实施方案的重组外泌体,以及用mVSV-G基因构建体转染以便产生重组外泌体的细胞提取物的蛋白质印迹分析的结果。
图5a是用透射电子显微镜拍照的根据本发明的实施方案的重组外泌体的图像,所述重组外泌体包括制备的mVSV-G,并且图5b显示了一系列直方图,其示出了通过动态光散射分析重组外泌体的粒度的分析结果。
图6a显示了一系列图,其示出了当用根据本发明的实施方案的mVSVG-Exo处理三种类型的癌细胞(4T1-Luc、EL4-Ova和CT26.CL25)时,根据pH变化确认与癌细胞的膜融合程度的结果(*:P<0.05;**:P<0.01;***:P<0.001);图6b显示了当用根据本发明的实施方案的mVSVG-Exo处理4T1-Luc细胞时,使用抗VSV-G抗体和抗钙粘蛋白抗体(绿色)染色4T1-Luc细胞后,4T1-Luc细胞的一系列荧光显微镜图像,关于根据pH变化是否存在与癌细胞的膜融合;并且图6c显示了图像,其示出了通过蛋白质印迹关于各种细胞表面上的低密度脂蛋白受体(LDLR)(其称为VSV-G受体)表达的分析结果,所述细胞表面包括三种类型的癌细胞(即,4T1-Luc、EL4-Ova和CT26.CL25)表面。
图7a示出了一系列直方图,其示出了流式细胞术的结果,以根据pH变化观察在其表面上与三种类型的癌细胞(4T1-Luc、EL4-Ova和CT26.CL25)融合后,根据本发明的实施方案的mVSVG-Exo是否促进癌细胞之间的融合;图7b显示了一系列图,其示出了图7a的结果的定量测量的结果;并且图7c示出了一系列图,其显示了细胞生存力分析的结果,以确认根据本发明的实施方案的mVSVG-Exo是否直接诱导癌细胞(4T1-Luc、EL4-Ova和CT26.CL25)的死亡(*:P<0.05;**:P<0.01)。
图8a显示了一系列图,其示出了荧光显微镜图像的分析结果的定量,其中分析了根据本发明的实施方案的包括mVSV-G的重组外泌体和对照外泌体(Con-Exo),对通过巨噬细胞和树突状细胞施加于4T1-Luc乳腺癌细胞的吞噬作用的效应;图8b显示了一系列图,其示出了荧光显微镜图像的分析结果的定量,其中分析了根据本发明的实施方案的包括mVSV-G的重组外泌体和对照外泌体(Con-Exo),对通过巨噬细胞和树突状细胞施加于EL4-Ova淋巴瘤细胞的吞噬作用的效应;并且图8c显示了一系列图,其示出了荧光显微镜图像的分析结果的定量,其中分析了根据本发明的实施方案的包括mVSV-G的重组外泌体和对照外泌体(Con-Exo),对通过巨噬细胞和树突状细胞施加于CT46.CL25结肠癌细胞的吞噬作用的效应(*:P<0.05;**:P<0.01;***:P<0.001)。
图9显示了一系列图,其中为了检查VSVG是否可以充当TLR4激动剂并活化树突状细胞的功能,根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)和对照组外泌体(Con-Exo)分别处理骨髓衍生的树突状细胞,并且记录了骨髓衍生的树突状细胞中的CD40(左)和CD86(右)相对表达率的变化(*:P<0.05;**:P<0.01)。
图10a是比较在4T1-Luc乳腺癌肿瘤模型动物(Balb/c,7周龄的雌性小鼠)中,随着时间过去的癌细胞大小的图,在所述动物中施用根据本发明的实施方案的包括mVSV-G的重组外泌体(200μg)(正方形代表对照组,圆圈代表排除mVSV-G的对照组外泌体,并且三角形代表包括根据本发明实施方案的mVSV-G的重组外泌体);图10b是示出了在图10a中的癌细胞注射16天后,通过处死实验动物而提取的癌组织重量的测量结果的图;并且图10c是示出了用于实验中的动物的重量变化的图,其示出了(*:P<0.05;**:P<0.01:***:P<0.001)。
图11a是示出了在EL4-Ova淋巴瘤肿瘤模型动物(C57BL/6,7周龄的雌性小鼠)中,随着时间过去的癌细胞大小比较的图,在所述动物中施用根据本发明的实施方案的包括mVSV-G的重组外泌体(200μg)(正方形代表对照组,圆圈代表排除mVSV-G的对照组外泌体,并且三角形代表包括根据本发明实施方案的mVSV-G的重组外泌体);图11b是示出了在图11a中的癌细胞注射16天后,通过处死实验动物而提取的癌组织重量的测量结果的图;并且图11c是示出了用于实验中的动物的重量变化的图(*:P<0.05;**:P<0.01;***:P<0.001)。
图12是示出了流式细胞术的结果的图,其中根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)、包括野生型VSV-G的重组外泌体(wtVSVG-Exo)、对照组外泌体(Con-Exo)和作为对照组的PBS施用到肿瘤模型动物(注射EL4-Ova的C57BL/6小鼠)的癌组织内,并且将提取的癌组织转换成单细胞,用抗VSV-G抗体染色,随后经受流式细胞术分析(*:P<0.05;**:P<0.01;***:P<0.001)。
图13a是示出了流式细胞术的结果的图,其中根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)、包括野生型VSV-G的重组外泌体(wtVSVG-Exo)、对照组外泌体(Con-Exo)和作为对照组的PBS,施用到肿瘤模型动物(注射EL4-Ova的C57BL/6小鼠)的癌组织内,并且将提取的肿瘤引流淋巴结转换成单细胞,并且经受使用抗CD11c抗体和抗H2kb-Ova抗体(其为树突状细胞标记物)的流式细胞术分析;图13b是示出了流式细胞术的结果的图,其中将提取的肿瘤引流淋巴结转换成单细胞,并且经受使用抗CD11c抗体和抗CD40抗体的流式细胞术分析;图13c是示出了流式细胞术的结果的图,其中将提取的肿瘤引流淋巴结转换成单细胞,并且经受使用抗CD11c抗体和抗CD86抗体的流式细胞术分析(*:P<0.05;**:P<0.01;***:P<0.001);图13d显示了一系列图像,其示出了在用抗CD8抗体染色肿瘤组织切片后,使用荧光显微镜执行的肿瘤组织中的CD8T细胞的浸润程度的分析结果;并且图13e是示出了图13d中的CD8T细胞进入癌组织内的癌组织的浸润程度的定量结果的图(***:P<0.001)。
图14a是示出了分析结果的图,其中根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)、包括野生型VSV-G的重组外泌体(wtVSVG-Exo)、对照组外泌体(Con-Exo)和作为对照组的PBS,施用到肿瘤模型动物(注射EL4-Ova的C57BL/6小鼠)的癌组织内,并且从提取的肿瘤组织中分离CD11c阳性树突状细胞和F4/80阳性巨噬细胞,并且分别以1∶5的比率与从OT-1转基因小鼠的脾中分离的OT-1CD8 T细胞共培养,并且通过ELISA测定分析培养基的INF-γ表达水平;并且图14b是示出了分析结果的图,其中脾细胞(其中从实验动物中提取的脾组织转换成单细胞)用作为对照组的PBS和卵白蛋白(10μg/ml)(即,癌特异性抗原)处理24小时,随后通过ELISA测定分析培养基的INF-γ表达水平(*:P<0.05;**:P<0.01;***:P<0.001)。
图15a和15b显示了示出测量结果的图(左),其中根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)、对照组外泌体(Con-Exo)和作为对照组的PBS,施用到裸鼠的肿瘤组织内,其中通过向所述裸鼠皮下注射EL4-Ova癌细胞来诱导癌症,并且随着时间过去测量肿瘤组织的体积,以及示出测量结果的图(右),其中在癌细胞注射后第17天时处死小鼠,并且测量提取的肿瘤组织的重量。图15a显示了根据低剂量(两次施用:各100μg)的实验结果;图15b显示了使用相同模型根据高剂量(四次施用:各100t g)的施用结果;并且图15c显示了示出测量结果的图(左),其中将根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)施用到C57BL/6小鼠的肿瘤组织内,从癌细胞注射前一天开始,以3天间隔向所述C57BL/6小鼠腹膜内施用抗CD8抗体,并且皮下注射EL4-Ova癌细胞以便诱导癌症,并且测量随着时间过去的肿瘤组织的体积;以及示出肿瘤组织重量的测量结果的图(右),所述肿瘤组织从在癌细胞注射后第1 8天时处死的小鼠中提取;并且重组IgG用作对照抗体(***:P<0.001)。图15d显示了示出测量结果的图(左),其中根据本发明的实施方案的包括mVSV-G的重组外泌体(mVSVG-Exo)、对照组外泌体(Con-Exo)和作为对照组的PBS,施用到BATF3 KO小鼠(其缺乏CD103和CD8)的肿瘤组织内,在所述BATF3 KO小鼠中通过EL4-Ova癌细胞的皮下注射诱导癌症,随后测量随着时间过去的肿瘤组织的体积;以及示出肿瘤组织重量的测量结果的图(右),所述肿瘤组织从在癌细胞注射后第17天时处死的小鼠中提取。
具体实施方式
术语的定义
如本文使用的,术语“致融膜蛋白”指病毒衍生的膜蛋白,其在诱导病毒与宿主细胞的粘附和膜融合用于病毒渗透到宿主细胞内起关键作用。代表性的例子是衍生自水泡性口炎病毒的包膜糖蛋白(VSV-G)。
如本文使用的,术语“衍生自水疱性口炎病毒的包膜糖蛋白(VSV-G蛋白)”指存在于水疱性口炎病毒的病毒粒子膜中的唯一病毒糖蛋白,并且充当用于病毒粘附和融合至异源细胞的蛋白质。VSV-G蛋白是包括两个N联聚糖的跨膜蛋白,并且在不存在其它病毒蛋白的情况下,可以以低pH依赖性方式起始膜融合。VSV-G蛋白可以与核酸分子如DNA形成复合物,并且因此已用作直接基因转移的载体,或已通过产生更稳定和高滴度的基于假型鼠白血病病毒(MLV)的逆转录病毒和基于慢病毒的载体,有效地用于基因治疗中。然而,最近已提出了VSV-G蛋白质将除基因之外的各种蛋白质递送至异源细胞的可用性(Mangeot等人,Mol.Ther.19(9):1656-1666,2011)。
如本文使用的,术语“基于质膜的囊泡”指被衍生自细胞的细胞膜围绕的纳米大小的囊泡,并且包括通过从细胞中分泌或出芽而产生的外泌体、通过经由人工方法(例如挤压等)加工细胞外囊泡或细胞等制备的细胞衍生的纳米囊泡。
如本文使用的,术语“外泌体”指存在于所有生物液体,包括血液、尿和细胞培养物的培养基中的细胞衍生的囊泡,并且也称为细胞外囊泡或微囊泡。已知外泌体具有30nm至100nm的大小,并且当多囊体与细胞膜融合时从细胞中分泌,或直接通过细胞膜分泌。已知外泌体在各种过程中起重要作用,所述过程例如凝血、细胞间信号传导和代谢废物管理。
如本文使用的,术语“重组外泌体”指人工产生的外泌体,其是以这样的方式获得,使得通过遗传工程制备转化的宿主细胞,其中将编码异源蛋白质的基因转导到能够产生外泌体的宿主细胞内,并且培养转化的宿主细胞,并且从培养液中获得外泌体。重组外泌体包括在外泌体膜内部或之上的转导的异源蛋白。
如本文使用的,术语“细胞外囊泡”指以颗粒形式的结构,其中从细胞释放或分泌到细胞外环境内的各种生物分子(例如蛋白质、核酸分子(例如RNA)、各种功能的脂质等)封装在脂质双层的细胞膜中,所述脂质双层等同于各种生物分子由其衍生的细胞的细胞膜。细胞外囊泡指平均直径为100nm至1μm的基于质膜的囊泡,其大于通常大小为30nm至100nm的外泌体的平均直径。
如本文使用的,术语其为被质膜包围的纳米大小的囊泡的“细胞衍生的纳米囊泡”,指与由细胞分泌且天然形成的外泌体或细胞外囊泡区分开的基于质膜的囊泡,所述质膜是通过人工方法(例如,其中使细胞通过微流体通道的挤出过程、多阶段过滤过程等)形成的纳米大小的细胞膜组分。
如本文使用的,术语“免疫原性细胞死亡”指由细胞增殖抑制剂(例如,蒽环类、奥沙利铂和硼替佐米)或放射疗法和光动力疗法引起的一类细胞死亡。与正常细胞死亡不同,免疫原性细胞死亡,即癌细胞的免疫细胞死亡可以经由树突状细胞的活化、以及特异性T细胞应答的后续活化,来诱导有效的抗癌免疫应答。诱导免疫原性细胞死亡的材料称为“免疫原性细胞死亡诱导剂”。免疫原性细胞死亡和免疫原性细胞死亡诱导剂在Kroemer等人(Annu.Rev.Immunol.,31:51-72,2013)中充分概括。这个文件整体引入本文作为参考。
如本文使用的,术语“蒽环类抗癌药”指衍生自波赛链霉菌青灰变种(Streptomyces peucetius var.caesius)、用于癌症化学疗法中的细胞周期非特异性抗癌药家族。蒽环类抗癌药用于治疗各种癌症,包括白血病、淋巴瘤、乳腺癌、胃癌、子宫癌、卵巢癌、膀胱癌和肺癌,并且是已开发的化学疗法抗癌药中最有效的抗癌药之一。首个发现的蒽环类抗癌药是柔红霉素,紧接着是多柔比星,随后为其后开发的表柔比星、伊达比星、匹克生琼、沙柔比星、戊柔比星等。提出的蒽环类抗癌药的作用机制的实例包括:通过经由DNA/RNA链的碱基之间插入抑制DNA和RNA合成,防止快速生长的癌细胞的复制;通过经由压制拓扑异构酶II的酶活性来抑制超螺旋DNA的松弛,防止转录和复制;通过形成铁介导的游离氧自由基和DNA损伤应答,诱导对DNA、蛋白质和细胞膜的损伤;诱导组蛋白从染色质中的逐出,其使表观基因组和转录物失调等。最近的研究已报道,多柔比星通过活化CD4
如本文使用的,术语“紫杉烷类抗癌药(紫杉类抗癌药或紫杉烷抗癌药)”指衍生自紫杉(Taxus)属物种植物的二萜类紫杉烷衍生物,其为有丝分裂抑制剂,具有能够促进细胞中的微管组装,同时抑制其中的微管分解的机制。当前商业化的药物包括紫杉醇和多西他赛。在其中,紫杉醇是衍生自太平洋紫杉(Taxus brevifolia)的周皮的紫杉烷类抗癌药,并且于1992年被US FDA批准为用于难治性卵巢癌的治疗剂,而多西他赛是衍生自欧洲红豆杉(Taxus baccata)的紫杉烷类抗癌药,并且具有与紫杉醇相似的功效,用于治疗乳腺癌、非细胞肺癌、淋巴瘤、膀胱癌等,并且具有比紫杉醇更高的亲水性。最近,紫杉烷类抗癌药也已显示具有通过使这些癌细胞对细胞毒性T淋巴细胞敏感,而促进癌细胞的免疫原性细胞死亡的机制。
如本文使用的,术语“免疫检查点抑制剂”指这样的一类药物,其阻断由某些类型的免疫系统细胞(例如,T淋巴细胞)和某些癌细胞产生的某些蛋白质,并且这些蛋白质压制免疫应答且防止T淋巴细胞杀死癌细胞。因此,这些蛋白质的阻断可以释放免疫系统的“制动系统”,从而允许T淋巴细胞更好地杀死癌细胞。迄今为止众所周知的“免疫检查点”的实例包括PD-1/PD-L1、CTLA-4/B7-1/B7-2等。PD-1抑制剂的实例包括派姆单抗(商品名:Keytruda)、纳武单抗(商品名:Opdivo)等。作为PD-1的配体,PD-L1抑制剂的实例包括阿特珠单抗(商品名:Tecentriq)、阿维鲁单抗(商品名:Bavencio)等。同时,伊匹单抗(商品名:Yervoy)已被USFDA批准为抑制CTLA-4/B7-1/B7-2相互作用的CTLA-4抑制剂。对于过去的几年,这些药物已取得了令人瞩目的成功,尤其是在患有转移性黑色素瘤或霍奇金淋巴瘤的患者中,并且已在关于不同类型的癌症患者的临床试验中显示极大潜力。
发明详述
根据本发明的一个方面,提供了基于重组质膜的囊泡,其中将VSV-G突变蛋白引入膜内,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代。
基于重组质膜的囊泡可以是外泌体、细胞外囊泡或细胞衍生的纳米囊泡。
可以从哺乳动物细胞中,优选从人细胞中分离/纯化基于重组质膜的囊泡,将其转化到包括编码VSV-G突变蛋白的多核苷酸的基因构建体内,并且因此过表达VSV-G突变蛋白。
基于重组质膜的囊泡可以得自转化为表达VSV-G突变蛋白的细胞。
根据本发明的另一个方面,提供了引入膜内的VSV-G突变蛋白,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代,并且将一种或两种或更多种免疫原性细胞死亡诱导剂掺入其中。
药物掺入基于重组质膜的囊泡内可以通过在药物溶解到其内的细胞培养基中培养细胞来实现,所述细胞进行遗传改造以产生基于重组质膜的囊泡;或可以通过经由在其中溶解免疫原性细胞死亡诱导剂的溶剂中的超声处理,重构基于质膜的重组囊泡来生产(Kim等人,Nanomedicine,12(3):655-664,2016)。任选地,当药物补充在基于质膜的囊泡上时,其中可以将分离的基于质膜的囊泡简单地在适当的溶剂或培养基中与药物混合,随后通过搅拌适当的时间段来混合的方法(Sun等人,Mol.Ther.18(9):1606-1614,2010),或者可以通过电穿孔将亲水性药物(例如核酸)掺入基于质膜的囊泡内。
免疫原性细胞死亡诱导剂可以是蒽环类抗癌药、紫杉烷类抗癌药、抗EGFR抗体、BK通道激动剂、硼替佐米、强心苷、环磷酰胺类抗癌药、GADD34/PP1抑制剂、LV-tSMAC、麻疹病毒、博来霉素、米托蒽醌或奥沙利铂。强心苷可以与非免疫原性细胞死亡诱导剂组合使用;GADD34/PP1抑制剂可以与丝裂霉素组合使用;蒽环类抗癌药可以是柔红霉素、多柔比星、表柔比星、伊达比星、匹克生琼、沙柔比星或戊柔比星;紫杉烷类抗癌药可以是紫杉醇或多西他赛;并且抗EGFR抗体可以是西妥昔单抗。
根据本发明的另外一个方面,提供了用于治疗癌症的药物组合物,其含有基于重组质膜的囊泡作为活性成分。
根据本发明的另外一个方面,提供了用于治疗癌症的药物组合物,其含有基于重组质膜的囊泡,其中将病毒衍生的致融膜蛋白作为活性成分引入膜内。
在上述药物组合物中,病毒衍生的致融膜蛋白可以是水泡性口炎病毒(VSV)-G蛋白、长臂猿白血病病毒(GALV.fus)、流感病毒血凝素、呼吸道合胞病毒的F蛋白、HIV病毒gp120或gp41、黄病毒的E蛋白、甲病毒的E1蛋白、杆状病毒gp64、丙型肝炎病毒gp31或gp70、麻疹病毒的H蛋白或F蛋白、或者埃博拉病毒gp1或gp2;并且VSV-G蛋白可以是野生型VSV-G蛋白或pH敏感性突变型VSV-G蛋白,其中第162个氨基酸,组氨酸由精氨酸取代。
上述药物组合物可以进一步含有一种或两种或更多种抗癌化合物。
抗癌化合物可以是免疫原性细胞死亡诱导剂或免疫检查点抑制剂;免疫原性细胞死亡诱导剂可以是蒽环类抗癌药、紫杉烷类抗癌药、抗EGFR抗体、BK通道激动剂、硼替佐米、强心苷、环磷酰胺类抗癌药、GADD34/PP1抑制剂、LV-tSMAC、麻疹病毒、博来霉素、米托蒽醌或奥沙利铂。强心苷可以与非免疫原性细胞死亡诱导剂组合使用;GADD34/PP1抑制剂可以与丝裂霉素组合使用;蒽环类抗癌药可以是柔红霉素、多柔比星、表柔比星、伊达比星、匹克生琼、沙柔比星或戊柔比星;紫杉烷类抗癌药可以是紫杉醇或多西他赛;并且抗EGFR抗体可以是西妥昔单抗。同时,免疫检查点抑制剂可以是PD-1/PD-L1相互作用抑制剂或CTLA-4/B7-1/B7-2相互作用抑制剂;PD-1/PD-L1相互作用抑制剂可以是靶向PD-1或PDL1的抗体,或者该抗体的功能片段,或者基于单链的抗体类似物;CTLA-4/B7-1/B7-2相互作用抑制剂可以是靶向CTLA-4、B7-1或B7-2的抗体,或者该抗体的功能片段,或者基于单链的抗体类似物;靶向PD-1或PDL1的抗体可以是派姆单抗、纳武单抗、阿特珠单抗或阿维鲁单抗;并且CTLA-4/B7-1/B7-2相互作用抑制剂可以是伊匹单抗。同时,抗体的功能片段可以是Fab、F(ab′)
同时,在上述组合物中,抗癌化合物可以封装在基于质膜的囊泡内部,可以简单地混合且配制,可以分开包装且使用前立即混合,或者可以同时或以交错的时间间隔施用。然而,当免疫检查点抑制剂是抗体、抗体的功能片段或基于单链的抗体类似物时,免疫检查点抑制剂可以封装在外泌体内部,但可以与本发明的衍生自细胞的基于重组质膜的囊泡共施用,或可以存在于基于重组质膜的囊泡的膜表面上以发挥功能。当抗体、抗体的功能片段或基于单链的抗体类似物存在于基于重组质膜的囊泡的膜表面上时,其中根据本发明的实施方案的免疫检查点抑制剂存在于膜表面上的基于重组质膜的囊泡可以以这样的方式制备,使得以与本发明中使用的病毒衍生的致融膜蛋白相同的方式,使用基因重组技术,将编码基于重组质膜的囊泡的基因转导到宿主细胞内,并且表达以呈现于宿主细胞的膜表面上,随后,获得从这些宿主细胞分泌或出芽或者通过人工加工细胞制备的纳米大小的囊泡。在这种情况下,可以将抗体、抗体的功能片段或基于单链的抗体类似物与分开的跨膜结构域或锚定结构域遗传重组,以便呈现在细胞膜表面上。任选地,还能够首先使用IgM或IgD(即,非分泌性膜结合抗体),代替遗传重组以具有跨膜结构域或膜锚定结构域。
在组合物的情况下,基于重组质膜的囊泡和免疫原性细胞死亡诱导剂可以以预混合组合物的形式提供,可以分开包装,并且紧在使用前混合且施用,或以规律的时间间隔分开施用。
本发明的药物组合物可以含有药学上可接受的载体。含有药学上可接受的载体的组合物可以处于各种经口或肠胃外制剂中,但优选处于肠胃外制剂中。在配制组合物时,通常使用稀释剂或赋形剂,例如填料、增量剂、粘合剂、湿润剂、崩解剂、表面活性剂等。用于经口施用的固体制剂包括片剂、丸剂、粉末、颗粒、胶囊等,并且这些固体制剂通过在一种或多种化合物中混合至少一种赋形剂(例如淀粉、碳酸钙、蔗糖或乳糖、明胶等)来制备。除简单的赋形剂之外,还可以使用润滑剂(例如硬脂酸镁、滑石等)。用于经口施用的液体制剂包括悬浮液、用于内用的液体药物、乳剂、糖浆等,并且除常用的简单稀释剂(例如水和液体石蜡)之外,还可以包括各种赋形剂(例如湿润剂、甜味剂、香料、防腐剂等)。用于肠胃外施用的制剂包括无菌水溶液、非水溶剂、悬浮液、乳剂、冻干制剂和栓剂。丙二醇、聚乙二醇、植物油(例如橄榄油)和可注射的酯(例如油酸乙酯)等可以用作非水溶剂和悬浮液。Witepsol、macrogol、tween 61、可可脂、三月桂酸甘油酯油(1aurin butter)、甘油明胶等可以用作用于栓剂的基质。
药物组合物可以具有选自片剂、丸剂、粉末、颗粒、胶囊、悬浮液、溶液、乳剂、糖浆剂、无菌水溶液、非水溶剂、冻干制剂和栓剂的任何一种制剂。
本发明的药物组合物可以经口或肠胃外施用。当药物组合物肠胃外施用时,能够经由各种途径(例如静脉内注射、鼻内吸入、肌内施用、腹膜内施用、经皮吸收等)来施用药物组合物。
本发明的组合物以药学有效量进行施用。
如本文使用的,术语“药学有效量”指足以以适用于医学治疗的合理的利益/风险比来治疗疾病的量。有效剂量水平可以取决于因素,包括受试者的类型、疾病的严重程度、受试者的年龄、性别、药物活性、对药物的敏感性、施用时间、施用途径和排泄速率、治疗的持续时间、同时使用的药物以及医学领域众所周知的其它因素。本发明的药物组合物可以以0.1mg/kg至1g/kg的剂量,且更优选以1mg/kg至500mg/kg的剂量施用。同时,可以根据患者的年龄、性别和状况适当地调节剂量。
本发明的药物组合物可以作为个别的治疗剂或与其它抗癌药组合施用,并且可以与常规抗癌药序贯或同时施用,并且可以施用单剂量或多剂量。考虑到所有上述因素,重要的是施用可以以最小的量获得最大效应而无副作用的量,并且该量可以由本领域技术人员容易地确定。
另外,根据本发明的另外一个方面,提供了基于重组质膜的囊泡,其中将VSV-G突变蛋白引入膜内,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代;或提供了基于重组质膜的囊泡用于制备癌症治疗剂的用途,其中将病毒衍生的致融膜蛋白引入膜内。
根据本发明的另外一个方面,提供了用于治疗患有癌症的受试者中的癌症的方法,其包括向患有癌症的受试者施用基于重组质膜的囊泡或上述那些中的一种或多种药物组合物。
在用于治疗癌症的上述方法中,受试者可以是人或非人哺乳动物。
本发明人已在下述假设下制备了重组外泌体,其在表面上呈现VSV-G H162R突变蛋白(参见图2a至5b):当在低pH下诱导融合的VSV-G蛋白(即,致融膜蛋白)的突变体(H162R)引入外泌体表面上且对癌细胞进行处理时,在正常生理条件(pH 7.4)下不诱导膜融合,但在类似于癌组织的微环境(pH 6.8)的条件下诱导膜融合,并且因为此类膜融合允许癌细胞的死亡,并且VSV-G H162R突变蛋白本身是病原体相关分子模式(PAMP),所以吞噬细胞的吞噬作用和树突状细胞的交叉引发能力得到增强(参见图1)。事实上,如上所述制备的重组外泌体在体外条件下在pH 6.8下选择性诱导癌细胞的膜融合(参见图6a至7b),但确认了重组外泌体本身并未诱导癌细胞的死亡(参见图7C)。另外,根据本发明的实施方案的重组外泌体(mVSVG-Exo)促进了通过巨噬细胞和树突状细胞对各种癌细胞(4T1-Luc、EL4-Ova和CT26.CL25)的吞噬作用(参见图8a至8c),并且确认了这是当VSVG充当TLR4激动剂时出现的现象(参见图9)。当将重组外泌体(mVSVG-Exo)施用于真实的肿瘤模型动物时,确认了实际癌细胞的生长被显著抑制而无副作用(例如体重减轻)(参见图10a至11c),并且通过流式细胞术确认了VSV-G蛋白在从实验动物中提取的肿瘤组织的细胞表面上显著表达(参见图12)。上述结果提示,本发明的重组外泌体是通过各种机制显示出抗癌活性的多功能抗癌药。
另外,本发明人已进行了各种分析,以确定本发明的基于重组质膜的囊泡的抗癌机制,并且因此,已确认了根据本发明的实施方案的重组外泌体不仅可以增加树突状细胞的癌症特异性抗原呈递(图13a),并促进树突状细胞的成熟(参见图13b至13c),而且还可以增加CD8 T细胞浸润到肿瘤组织内(参见图13d和13e)。另外,本发明人已确认,根据本发明的实施方案的重组外泌体可以显著改善癌组织中的树突状细胞的交叉致敏能力(参见图14a),并且还具有免疫记忆能力,因为通过癌症特异性抗原诱导了此类癌症特异性免疫能力(参见图14b)。
此外,为了确定根据本发明的实施方案的重组外泌体是否依赖于T细胞免疫,本发明人已使用缺乏T细胞免疫的裸鼠进行动物实验,并且因此,已确认了抗癌效应消失(参见图15a),并且当药物剂量加倍时,抗癌效应出现(参见图15B)。然而,在使用缺乏CD103和CD8树突状细胞(其在T细胞免疫中起重要作用)的BATF3敲除小鼠进行的动物实验中,即使在施用本发明的重组外泌体的组中也未显示抗癌活性,因此确认了根据本发明的实施方案的重组外泌体通过树突状细胞显示出抗癌活性(参见图15d)。为了鉴定CD8T细胞在根据本发明的实施方案的重组外泌体的抗癌活性中的作用,本发明人已进行了使用野生型小鼠的动物实验,其中使用抗CD8抗体中和CD8,并且因此,已确认了当通过施用抗CD8抗体去除CD8 T细胞时,根据本发明的实施方案的重组外泌体的抗癌活性被去除(参见图15c)。这些结果显示,根据本发明的实施方案的重组外泌体不仅通过在肿瘤微环境中诱导个体的树突状细胞的成熟来增强对癌细胞的先天性免疫应答,而且通过促进CD8 T细胞浸润到肿瘤组织内增强对癌抗原的获得性免疫应答,从而显示出抗癌活性。
此外,本发明人已通过实验确认了,包括野生型VSV-G蛋白而不是pH敏感性VSV-G蛋白的重组外泌体,也通过诱导T细胞特异性免疫应答而显示抗癌活性,尽管效应略微更不有效。尽管不能通过癌细胞与重组外泌体的融合在病毒微环境中的癌细胞表面上呈现病毒衍生的致融膜蛋白,但VSV-G蛋白本身可以充当TLR4激动剂,并且因此确认了,通过在膜中含有野生型VSV-G蛋白的重组外泌体诱导的T细胞特异性免疫应答,是通过经由与吞噬细胞上的TLR4受体结合而活化吞噬细胞所诱导的效应。因此,可以预期,除VSV-G蛋白之外,其它病毒衍生的致融膜蛋白也能够显示出与本发明中使用的wtVSVG外泌体或mVSVG外泌体相似的效应。事实上,已报道病毒衍生的致融膜蛋白(例如,衍生自长臂猿白血病病毒的GALV.fus蛋白)增强了溶瘤性单纯疱疹病毒的抗癌效应(Fu等人,Mol.Ther.7(6):748-754,2003)。
上述结果无需使用其它抗癌药而实现,并且预期根据本发明的实施方案的重组外泌体与其它免疫原性细胞死亡诱导剂(例如,多柔比星)的共施用显示强协同效应。因此,根据本发明的实施方案的重组外泌体预期对于开发新的抗癌药非常有用,所述抗癌药显示出强抗癌活性,同时使常规抗癌药的副作用降到最低。
另外,尽管在通过使用本发明的实施方案的重组外泌体确认了抗癌效应,但当宿主细胞被转化为在膜中包括病毒衍生的致融膜蛋白,随后通过常规方法(即,遗传重组)由转化的宿主细胞制备基于质膜的囊泡时,在结构中类似于重组外泌体的衍生自细胞的基于质膜的囊泡(例如,细胞外囊泡和细胞衍生的纳米囊泡),也预期显示出与根据本发明的实施方案的重组外泌体相同的功能。
实施例
在下文中,参考实施例和实验实施例更详细地描述本发明。然而,本发明并不限于下文公开的这些实施例和实验实施例,而是可以以各种形式实施,并且提供下述实施例以使本发明的公开内容完整,并且将本发明的范围充分地传达给本领域的技术人员。
实施例1:VSV-GH162R构建体的制备
为了制备包括VSV-G H162R突变蛋白的重组外泌体,本发明人首先制备了编码H162R突变蛋白的基因构建体,其中VSV-G的第162个氨基酸残基(基于GenBank编号CAC47944中公开的蛋白质的第178个),组合物由精氨酸取代。具体地,为此目的,使用质粒DNA(pCMV-VSV-G包膜载体,RV-110,Cell Biolabs,下文缩写为“VSV-G构建体”)执行定点诱变,所述质粒DNA包括作为模板的编码野生型VSV-G蛋白(SEQ ID NO:1)的多核苷酸(SEQ IDNO:2),连同SEQ ID NO:3的正向引物(5′-ATA TGC CCC ACT GTC CGC AAC TCT ACA ACCTGG-3′)和SEQ ID NO:4的反向引物(3′-TAT ACG GGG TGA CAG GCGTTGAGATGTTGGACC-5′)(粗体字对应于突变的氨基酸精氨酸)。
实施例2:包括VSV-GH162R的重组外泌体的制备
本发明人将pCMV-VSV-G H162R质粒载体(下文缩写为“VSV-G H162R构建体”,图2a和2b)转染到HEK293T细胞内,并培养48小时,在所述pCMV-VSV-G H162R质粒载体内,插入编码上文实施例1中制备的VSV-G H162R蛋白(SEQ ID NO:5)的基因(SEQ ID NO:6)。随后,回收细胞培养物,序贯地以300g离心10分钟,以2,000g离心10分钟,且以10,000g离心30分钟,使用0.2μm过滤器过滤,并且通过以150,000g超滤3小时来回收团块(图3)。
随后,为了确认VSV-G H162R突变蛋白是否包括在外泌体中,破坏回收的外泌体的部分,并且使用抗VSV-G抗体(Abcam,ab50549)和抗-Alix抗体(外泌体标记物,Santacruz,sc99010)执行蛋白质印迹分析(图4)。结果,如图4中所示,在转化的HEK293T细胞和由此获得的重组外泌体两者中均检测到VSV-G H162R突变蛋白。图4还显示了关于其为外泌体标记物的Alix、CD63和TSG 101的蛋白质印迹分析的结果。这意味着VSV-G H162R突变蛋白通常包括在衍生自转化细胞的外泌体中,以便表达根据本发明的实施方案的VSV-G H162R突变蛋白。
随后,在透射电子显微镜下拍照回收的重组外泌体时(图5a),本发明人使用动态光散射(DLS)分析仪(Malvern zetasizer nano ZS,UK)分析了重组外泌体的粒度(图5b)。结果,如图5b中所示,确认了根据本发明的实施方案制备的重组外泌体(mVSVG-Exo)和对照组外泌体(Con-Exo)均具有大小约80nm的非常窄的光谱。
比较实施例:wtVSVG外泌体的制备
作为比较实施例,本发明人制备了基因构建体,以表达其中第162个氨基酸未突变的野生型VSV-G蛋白,随后制备了使用实施例2的方法在膜中呈现野生型VSV-G蛋白的重组外泌体(wtVSVG-Exo)。
实施例3:其中封装多柔比星的重组外泌体的制备
为了将多柔比星(DOX)(即,免疫原性细胞死亡诱导剂)负载到上文实施例2中制备的重组外泌体中,首先将纯化的外泌体(约10
实验实施例1:在体外条件下分析融合到癌细胞内的VSV-GH162R的存在
为此目的,具体地,本发明人将各5×10
同时,低密度脂蛋白受体(LDLR)是最众所周知的细胞膜的受体,VSVG与之结合以与细胞膜融合。像这样,本发明人使用针对各种细胞包括癌细胞的抗LDLR抗体,通过蛋白质印迹分析检查了LDLR表达的程度,根据本发明的实施方案的重组外泌体与所述细胞融合。结果,如图6c中可见的,证实了LDLR在正常细胞(例如,骨髓衍生的巨噬细胞、骨髓衍生的树突状细胞和脾细胞)中不表达,而LDLR在癌细胞(例如4T1-Luc、EL4-Ova和CT26.CL25)中表达,并且这些结果提示,制备的mVSVG-Exo通过仅靶向癌细胞而融合(图6c)。
实验实施例2:重组外泌体是否促进癌细胞之间的融合
随后,本发明人尝试确认在融合至癌细胞的表面后,mVSVG-Exo是否促进了癌细胞之间的融合。为此目的,具体地,本发明人用深红色(1μM)或绿色CMFDA(1μM)染色各5×10
随后,本发明人检查了mVSVG-Exo本身是否诱导癌细胞的死亡。为此目的,具体地,如上文实验实施例1中所述,使用以pH 7.4或pH 6.8的融合缓冲液,通过用mVSVG-Exo、对照组外泌体(Con-Exo)或缓冲液(仅使用不含外泌体的融合缓冲液的处理)处理其中每一种,本发明人对于4T1-Luc(即,乳腺癌细胞系)、EL4-Ova(即,淋巴瘤细胞系)和CT26.CL25(即,结肠癌细胞系)执行了融合。其后,将5×10
实验实施例3:对癌细胞的吞噬作用的分析
本发明人执行了吞噬作用分析,以确认根据本发明的实施方案的致融外泌体是否促进癌细胞通过巨噬细胞和树突状细胞的吞噬作用。
具体地,如上文实验实施例1中所述,使用以pH 7.4或pH 6.8的融合缓冲液,通过用mVSVG-Exo、对照组外泌体(Con-Exo)或缓冲液(仅使用不含外泌体的融合缓冲液的处理)处理其中每一种,本发明人对于4T1-Luc(即,乳腺癌细胞系)、EL4-Ova(即,淋巴瘤细胞系)和CT26.CL25(即,结肠癌细胞系)执行了融合。在编辑癌细胞的膜后,用pH rodo SE 120ng/ml染色癌细胞。用绿色CMFDA(1μM)染色的骨髓衍生的巨噬细胞和骨髓衍生的树突状细胞与用pH rodo SE染色的癌细胞以1∶2的比率共培养2小时。随后,使用荧光显微镜确认癌细胞通过巨噬细胞和树突状细胞的吞噬程度。作为如图8a至8c中可见的实验的结果,与其它组不同,仅mVSVG-Exo处理的组(其中癌细胞的膜在pH 6.8下进行编辑),显示了通过骨髓衍生的巨噬细胞和骨髓衍生的树突状细胞的癌细胞吞噬作用的增加。另外,由于在pH 6.8下使用mVSVG-Exo编辑癌细胞膜后,在使用抗VSVG抗体预封闭的情况下(在图中标记为“pre”),增强的吞噬作用消失,因此确认了根据本发明的实施方案的重组外泌体的吞噬作用增强效应取决于mVSVG。
这提示本发明的致融外泌体通过不仅促进癌细胞的融合,而且促进癌细胞通过巨噬细胞和树突状细胞的吞噬作用,显示出基于执行抗癌作用的多重功能的抗癌活性。
实验实施例4:通过重组外泌体促进树突状细胞成熟的机制的鉴定
VSV-G蛋白称为TLR4激动剂。像这样,本发明人检查了根据本发明的实施方案的重组外泌体是否通过TLR4途径促进树突状细胞的成熟。为此目的,具体地,将骨髓衍生的树突状细胞(1×10
实验实施例5:体内抗癌效应的分析
本发明人根据上文实验实施例1至4的结果,检查了根据本发明的实施方案的重组外泌体在体内条件下是否可以抑制癌细胞的生长。
具体地,本发明人将癌细胞接种到7周龄的Balb/c野生型小鼠(雌性,n=21)中,其中通过在背部上的皮下接种(第0天)诱导癌症,并且在接种后第5天和第6天时,将100μg从上文实施例2获得的重组外泌体(mVSVG-Exo)或对照组外泌体(Con-Exo)注射到肿瘤内。在这种情况下,仅将PBS施用于对照组。随后,检查癌组织的大小和实验动物的体重,直到以3天间隔的癌细胞接种后的第16天(图10a和10c)。另外,在癌细胞接种后16天,处死所有实验动物,并且从其中提取癌组织并称重(图10b)。
此外,本发明人在C57BL/6野生型小鼠的背部左侧上皮下接种了EL4-Ova癌细胞(1×10
作为如图10a至11c中所示的实验的结果,确认了与对照组相比,作为比较组的wtVSVG-Exo施用组和mVSVG-Exo施用组显示了显著的抗癌效应,并且特别地,与其它组相比,在mVSVG-Exo组中观察到最有效的抗癌效应。
实验实施例6:抗癌活性与引入的VSV-G之间的相关性
本发明人检查了在肿瘤细胞的表面上VSVG蛋白的表达水平,以确定实验实施例5中显示的,根据本发明的实施方案的重组外泌体的体内抗癌效应是否是由于mVSV-G蛋白引入外泌体内。为此目的,具体地,本发明人将EL4-Ova癌细胞(1×10
这些结果确认了,根据本发明的实施方案的重组外泌体的体内抗癌活性通过VSVG蛋白转移到癌细胞膜内引起,所述VSV-G蛋白存在于外泌体膜中(通过在肿瘤微环境中癌细胞和重组外泌体的融合)。
实验实施例7:关于重组外泌体的抗癌机制的研究
7-1:对树突状细胞的作用的检查
本发明人检查了根据本发明的实施方案的重组外泌体是否通过活化树突状细胞的功能而显示出抗癌活性。为此目的,具体地,本发明人将EL4-Ova癌细胞(1×10
7-2:CD8 T细胞对浸润到癌组织内的作用的检查
本发明人检查了根据本发明的实施方案的重组外泌体对CD8T细胞浸润到癌组织内的作用。为此目的,具体地,将从实验实施例7-1的实验动物中提取的癌组织包埋在OCT化合物中,随后制备冷冻切片,其用抗CD8抗体进行染色,并且通过荧光显微镜分析癌组织中的CD8 T细胞侵袭程度(图13d和13e)。结果,mVSVG-Exo施用组显示最佳程度的CD8 T细胞浸润。特别地,由于与对照组或对照外泌体施用组相比,wtVSVG-Exo施用组并未显示差异,因此确认了根据本发明的实施方案的重组外泌体促进CD8T细胞浸润的活性,不仅是由于VSVG本身功能的效应,而且是由于重组外泌体在肿瘤微环境中与癌细胞的融合。
7-3:交叉引发能力的分析
本发明人检查了根据本发明的实施方案的重组外泌体是否具有对CD8T细胞的交叉引发能力。为此目的,具体地,本发明人将EL4-Ova癌细胞(1×10
7-4:免疫记忆能力的检查
本发明人检查了当在完成癌症治疗后相同的癌症复发时,根据本发明的实施方案的重组外泌体是否可以通过记忆癌抗原而触发癌症特异性免疫应答。为此目的,将从上文实验实施例7-3的实验动物中提取的脾组织转换成单细胞,并且将5×10
7-5:与重组外泌体的抗癌活性相关的免疫细胞的鉴定
本发明人尝试检查根据本发明的实施方案的重组外泌体所依赖的免疫细胞。首先,为了确认由于吞噬细胞的吞噬作用增强,在缺乏T细胞免疫的裸鼠中是否也可以显示出抗癌效应,本发明人将EL4-Ova癌细胞(1×10
随后,为了确认mVSVG-Exo的效应依赖于T细胞免疫中的哪种T细胞免疫,本发明人将EL4-Ova癌细胞(1×10
最后,本发明人将EL4-Ova癌细胞(1×10
上文结果提示,根据本发明的实施方案的包括VSV-G H162R突变蛋白的重组外泌体在癌组织的微环境的pH下促进特异性的抗癌免疫效应。包括VSV-G H162R突变蛋白的重组外泌体的此类抗癌效应无需其它抗癌药的帮助即可实现,并且当将其它抗癌药(尤其是免疫原性细胞死亡诱导剂)封装到其中或与其共施用时,预期显著的协同效应。特别地,当将抗癌药掺入具有膜结构的根据本发明的实施方案的重组外泌体内时,重组外泌体可以通过癌细胞特异性融合将掺入内部的抗癌药递送到癌细胞的内部,并且因此,具有的优点在于,可以使通过对正常细胞的作用在抗癌药中可能出现的副作用降到最低。
工业适用性
因此,包括根据本发明的实施方案的重组外泌体的基于重组质膜的囊泡不仅本身具有抗癌活性,而且预期与其它抗癌药组合具有更强的抗癌活性,并且因此,对于新型抗癌药的开发可以是非常有用的,所述新型抗癌药具有强抗癌效应同时使副作用降到最低。
序列表自由文本
SEQ ID NO:1是野生型VSV-G蛋白的氨基酸序列。
SEQ ID NO:2是编码野生型VSV-G蛋白的多核苷酸的核酸序列。
SEQ ID NO:3是用于克隆编码野生型VSV-G蛋白的多核苷酸的正向引物的核酸序列。
SEQ ID NO:4是用于克隆编码野生型VSV-G蛋白的多核苷酸的反向引物的核酸序列。
SEQ ID NO:5是根据本发明的实施方案的H162R突变的VSV-G蛋白的氨基酸序列。
SEQ ID NO:6是编码H162R突变的VSV-G蛋白的多核苷酸的核酸序列。
SEQ ID NO:7是在野生型VSV-G蛋白的第162个氨基酸,组氨酸附近的氨基酸序列。
SEQ ID NO:8是在H162R突变的VSV-G蛋白的第162个氨基酸,精氨酸附近的氨基酸序列。
SEQ ID NO:9是编码在野生型VSV-G蛋白的第162个氨基酸,组氨酸附近的肽的多核苷酸的核酸序列。
SEQ ID NO:10是编码在H162R突变的VSV-G蛋白的第162个氨基酸,精氨酸附近的肽的多核苷酸的核酸序列。
尽管本发明已参考实施例和实验实施例进行描述,但这些仅是示例性的,并且本领域技术人员将理解,各种修改以及其它等价的实施例和实验实施例由其是可能的。因此,本发明的真正技术保护范围由所附权利要求的技术精神来限定。
本发明涉及:
1.一种基于重组质膜的囊泡,其中将VSV-G突变蛋白引入膜内,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代。
2.技术方案1的基于重组质膜的囊泡,其中所述基于重组质膜的囊泡是外泌体、细胞外囊泡或细胞衍生的纳米囊泡。
3.技术方案1的基于重组质膜的囊泡,其中从哺乳动物细胞中分离/纯化所述基于重组质膜的囊泡,将其转化到包含编码VSV-G突变蛋白的多核苷酸的基因构建体内,并且因此过表达所述VSV-G突变蛋白。
4.一种基于重组质膜的囊泡,其中将VSV-G突变蛋白引入膜内,并且将一种或两种或更多种免疫原性细胞死亡诱导剂掺入其中,在所述VSV-G突变蛋白中,第162个氨基酸,组氨酸由精氨酸取代,。
5.技术方案4的基于重组质膜的囊泡,其中所述免疫原性细胞死亡诱导剂是蒽环类抗癌药、紫杉烷类抗癌药、抗EGFR抗体、BK通道激动剂、硼替佐米、强心苷、环磷酰胺类抗癌药、GADD34/PP1抑制剂、LV-tSMAC、麻疹病毒、博来霉素、米托蒽醌或奥沙利铂。
6.一种用于治疗癌症的药物组合物,其包含根据技术方案1至5中任一项的基于重组质膜的囊泡作为活性成分。
7.技术方案6的药物组合物,其进一步包含一种或两种或更多种抗癌化合物。
8.技术方案7的药物组合物,其中所述抗癌化合物是细胞死亡诱导剂或免疫检查点抑制剂。
9.技术方案8的药物组合物,其中所述免疫原性细胞死亡诱导剂是蒽环类抗癌药、紫杉烷类抗癌药、抗EGFR抗体、BK通道激动剂、硼替佐米、强心苷、环磷酰胺类抗癌药、GADD34/PP1抑制剂、LV-tSMAC、麻疹病毒、博来霉素、米托蒽醌或奥沙利铂。
10.技术方案9的药物组合物,其中所述蒽环类抗癌药是柔红霉素、多柔比星、表柔比星、伊达比星、匹克生琼、沙柔比星或戊柔比星。
11.技术方案9的药物组合物,其中所述紫杉烷类抗癌药是紫杉醇或多西他赛。
12.技术方案9的药物组合物,其中所述抗EGFR抗体是西妥昔单抗。
13.一种用于治疗癌症的药物组合物,其包含基于重组质膜的囊泡,其中将病毒衍生的致融膜蛋白作为活性成分引入膜内。
14.技术方案13的药物组合物,其中所述基于重组质膜的囊泡是外泌体、细胞外囊泡或细胞衍生的纳米囊泡。
15.技术方案13的药物组合物,其中所述病毒衍生的致融膜蛋白是水泡性口炎病毒(VSV)-G蛋白、长臂猿白血病病毒(GALV.fus)、流感病毒血凝素、呼吸道合胞病毒的F蛋白、HIV病毒gp120或gp41、黄病毒的E蛋白、甲病毒的E1蛋白、杆状病毒gp64、丙型肝炎病毒gp31或gp70、麻疹病毒的H蛋白或F蛋白、或者埃博拉病毒gp1或gp2。
16.根据技术方案12至15中任一项的药物组合物,其进一步包含一种或两种或更多种抗癌化合物。
17.技术方案16的药物组合物,其中所述抗癌化合物是细胞死亡诱导剂或免疫检查点抑制剂。
18.技术方案17的药物组合物,其中所述免疫原性细胞死亡诱导剂是蒽环类抗癌药、紫杉烷类抗癌药、抗EGFR抗体、BK通道激动剂、硼替佐米、强心苷、环磷酰胺类抗癌药、GADD34/PP1抑制剂、LV-tSMAC、麻疹病毒、博来霉素、米托蒽醌或奥沙利铂。
19.技术方案18的药物组合物,其中所述蒽环类抗癌药是柔红霉素、多柔比星、表柔比星、伊达比星、匹克生琼、沙柔比星或戊柔比星。
20.技术方案18的药物组合物,其中所述紫杉烷类抗癌药是紫杉醇或多西他赛。
21.技术方案18的药物组合物,其中所述抗EGFR抗体是西妥昔单抗。
22.技术方案30的药物组合物,其中所述免疫检查点抑制剂是PD-1/PD-L1相互作用抑制剂或CTLA-4/B7-1/B7-2相互作用抑制剂。
23.技术方案17的药物组合物,其中所述PD-1/PD-L1相互作用抑制剂是靶向PD-1或PDL1的抗体、或所述抗体的功能片段、或基于单链的抗体类似物。
24.技术方案23的药物组合物,其中所述靶向PD-1或PDL1的抗体是派姆单抗、纳武单抗、阿特珠单抗或阿维鲁单抗。
25.技术方案22的药物组合物,其中所述CTLA-4/B7-1/B7-2相互作用抑制剂是靶向CTLA-4、B7-1或B7-2的抗体,或所述抗体的功能片段,或基于单链的抗体类似物。
26.技术方案25的药物组合物,其中所述CTLA-4/B7-1/B7-2相互作用抑制剂是伊匹单抗。
27.技术方案23或25的药物组合物,其中所述基于单链的抗体类似物是scFv、sdAb、双抗体、单抗体、可变淋巴细胞受体(VLR)、纳米抗体或美洲驼重链抗体片段(V
28.技术方案16的药物组合物,其中所述抗癌化合物包封在所述重组外泌体内部。
29.一种用于治疗患有癌症的受试者中的癌症的方法,其包括向所述患有癌症的受试者施用治疗有效量的技术方案6的用于治疗癌症的药物组合物。
30.一种用于治疗患有癌症的受试者中的癌症的方法,其包括向所述患有癌症的受试者施用治疗有效量的技术方案13的用于治疗癌症的药物组合物。
- 用于治疗癌症的新型的基于重组质膜的囊泡
- 用于递送miRNA的源自可食用植物的微囊泡组合物和用于治疗癌症的方法
