微丝束支架及其制备方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及再生医学技术领域,特别是涉及一种微丝束支架及其制备方法。
背景技术
脊髓是中枢神经系统的重要组成部分。脊髓的主要功能是在大脑和周围神经之间传递感觉和运动信息,也是排尿、排便等简单反射活动的低级中枢。脊髓损伤(spinal cordinjury,SCI)是一类严重的中枢神经损伤,导致损伤平面以下的感觉或运动功能部分或全部丧失。除了神经功能障碍外,脊髓损伤患者还经常出现各种并发症,包括压疮、泌尿系统并发症、呼吸系统并发症、深静脉血栓和肺栓塞、痉挛、疼痛、植物性神经反射亢进和骨质疏松症。这些并发症不仅影响康复治疗的过程和效果,而且严重影响患者的生活质量,甚至危及生命。
脊髓损伤导致的功能缺陷通常是永久性的,因为受损神经元的再生反应非常有限,再生轴突暴露于抑制分子、神经胶质疤痕和囊肿中,从而阻止整个损伤部位的生长。全球投入了大量资源和努力来寻求恢复功能丧失的有效疗法,再生医学和组织工程在内的新型治疗方法包括使用组织工程支架,特定生长因子或神经营养因子,抗氧化或抗炎分子以及细胞移植程序已成为有希望的策略。但是目前的技术或多或少地存在一些限制,还不能很好地解决脊髓损伤修复的问题。
发明内容
基于此,有必要提供一种能够用于神经损伤修复的微丝束支架。
另,还有必要提供一种微丝束支架的制备方法。
本发明至少一实施例提供了一种微丝束支架,包括:
套管,所述套管的管壁具有孔隙结构;以及
微丝束,所述微丝束设置于所述套管内,所述微丝束包括多个微丝,多个所述微丝之间具有沿所述套管长度方向延伸的通道;
其中,所述套管和所述微丝束负载有神经营养因子。
在其中一些实施例中,所述微丝的材料包括胶原蛋白以及壳聚糖中的至少一种;和/或
所述套管由纤维网构成,且所述套管具有所述孔隙结构;和/或
所述套管的材料包括壳聚糖以及胶原蛋白中的至少一种。
在其中一些实施例中,所述神经营养因子包括脑源性神经营养因子、神经生长因子、胶质细胞系源性神经营养因子、神经营养因子-3、神经营养因子-4和神经营养因子-5中的至少一种。
在其中一些实施例中,所述微丝的横截面为长方形,所述微丝的宽度为5.0μm~200μm;和/或
所述微丝的横截面为长方形,所述微丝的厚度为5.0μm~200μm;和/或
所述微丝束的直径为2.0mm~20.0mm;和/或
所述微丝束的长度为3.0mm~30mm;和/或
所述套管的长度为3.0mm~30mm。
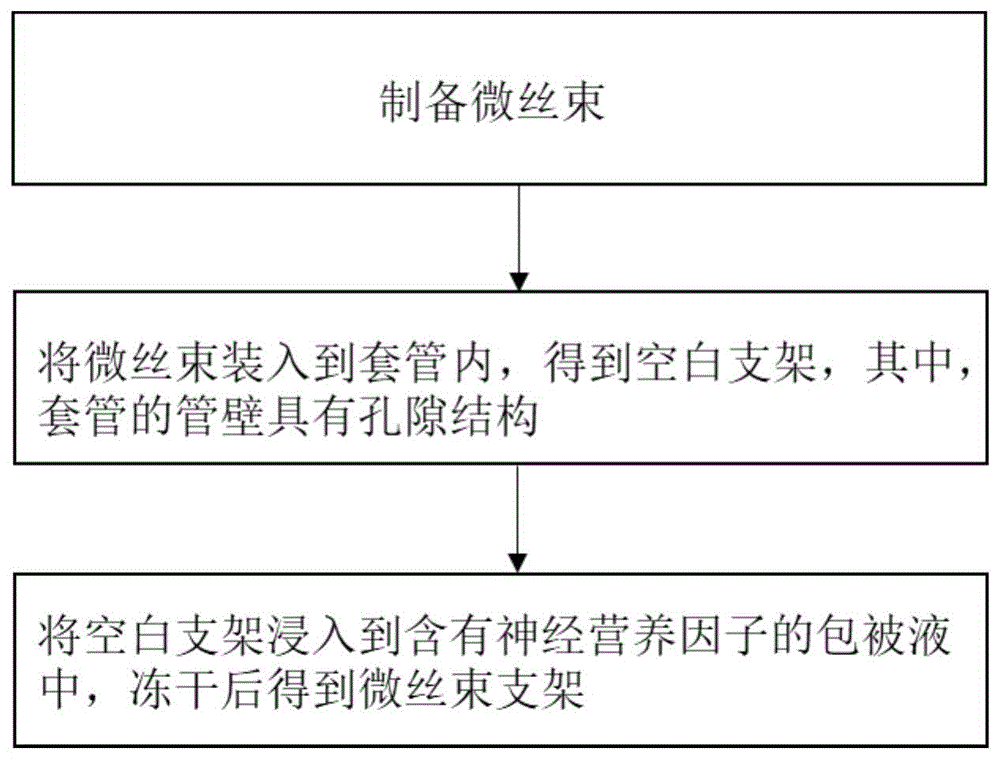
本发明至少一实施例提供了一种微丝束支架的制备方法,包括以下步骤:
制备微丝束;
将所述微丝束装入到套管内,得到空白支架,其中,所述套管的管壁具有孔隙结构;以及
将所述空白支架浸入到含有神经营养因子的包被液中,冻干后得到微丝束支架。
在其中一些实施例中,所述微丝束的制备方法包括以下步骤:
使用高分子膜包裹多个微丝,以对多个所述微丝进行集束,得到所述微丝束;
其中,在将所述微丝束装入到所述套管内之后,且在将所述空白支架浸入到含有神经营养因子的包被液中之前,所述制备方法还包括以下步骤:
去除所述高分子膜。
在其中一些实施例中,所述微丝的制备方法包括以下步骤:
将铸膜材料与酸性溶液混合,得到铸膜液,其中,在所述铸膜液中,所述铸膜材料的质量体积比为0.5%~5.0%;
将所述铸膜液浇注到平板模具上,干燥后得到膜片;以及
切割所述膜片,得到所述微丝。
在其中一些实施例中,所述铸膜材料包括胶原蛋白和壳聚糖中的至少一种;和/或
所述酸性溶液为体积比为0.5%~5%的乙酸水溶液或浓度为0.2mol/L~0.3mol/L的盐酸。
在其中一些实施例中,所述包被液的制备方法包括以下步骤:
将体积比为0.5%~5.0%的乙酸水溶液和成膜材料混合,得到包被液前驱体,其中,在所述包被液前驱体中,所述成膜材料的质量体积比0.5%~1.0%;
向所述包被液前驱体中加入碱性溶液,以将所述包被液前驱体的pH调整到中性;
对调整后的包被液前驱体进行透析,得到成膜溶液;以及
在1℃~4℃的温度下,将所述神经营养因子和所述成膜溶液混合,得到所述包被液,其中,所述包被液中神经营养因子的浓度为0.1μg/mL~1.0μg/mL。
在其中一些实施例中,所述成膜材料包括壳聚糖以及胶原蛋白中的至少一种。
在其中一些实施例中,所述冻干的温度为(-90)℃~(-40)℃。
在其中一些实施例中,所述套管的制备方法包括以下步骤:
采用静电纺丝工艺制备所述套管。
在其中一些实施例中,采用静电纺丝工艺制备所述套管包括以下步骤:
将纺丝材料与体积比为70%~80%的乙酸水溶液混合,得到纺丝液,其中,在所述纺丝液中,所述纺丝材料的质量体积比为5%~20%;以及
设置纺丝条件,并对所述纺丝液进行静电纺丝,得到所述套管;
其中,所述纺丝条件包括以下(1)~(7)中的至少一项:
(1)喷丝口针头粗细为0.2mm~0.8mm;
(2)针尖到收集辊表面的距离为5cm~15cm;
(3)针头的电压为5KV~20KV;
(4)收集辊的电压为(-15)KV~(-5)KV;
(5)纺丝液的推注速度为0.1ml/h~1.0mL/h;
(6)收集辊的直径为2.0mm~20mm;
(7)收集辊的转速为100rpm~3000rpm。
本发明提供的微丝束支架中的多个微丝之间具有沿套管长度方向延伸的通道,通道可作为神经元定向有序生长的通道,使得损伤部位附近的轴突能够定向生长,从而引导神经元有序定向生长,同时微丝束支架能够通过孔隙结构持续缓释神经营养因子,从而有利于神经损伤修复。
附图说明
图1为本发明提供的微丝束支架的制备流程图;
图2为本发明实施例1制备的微丝束支架的缓释性能图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
本发明提供一种微丝束支架,微丝束支架包括套管以及微丝束。
在一实施例中,套管由均匀分布的纤维网构成,且套管的管壁具有均匀分布的孔隙结构。在一实施例中,孔隙结构可为微纳米孔。
在一实施例中,套管的材料包括壳聚糖以及胶原蛋白中的至少一种。其中,由于壳聚糖和胶原蛋白具有较好的生物相容性,因此使得套管也具有较好的生物相容性。
在一实施例中,套管的长度为3.0mm~30mm。
在一实施例中,微丝束设置于套管内。其中,微丝束的长度方向和套管的长度方向为同一方向。在一实施例中,微丝束包括多个微丝。在一实施例中,多个微丝之间具有沿套管长度方向延伸的通道。
其中,微丝具有较好的生物相容性。在一实施例中,微丝的材料包括胶原蛋白以及壳聚糖中的至少一种。
在一实施例中,微丝的横截面为长方形,微丝的宽度为5.0μm~200μm,微丝的厚度为5.0μm~200μm。即微丝横截面的尺寸为(5.0μm~200μm)×(5.0μm~200μm)。
在一实施例中,微丝束的直径为2.0mm~20.0mm。在一实施例中,微丝束的长度为3.0mm~30mm。在一实施例中,微丝束的长度和套管的长度大致相等。
其中,套管和微丝束负载有神经营养因子。具体地,套管的外表面、套管的内表面、孔隙结构、微丝束的表面以及通道内负载有神经营养因子。
在一实施例中,神经营养因子包括脑源性神经营养因子(BDNF)、神经生长因子(NGF)、胶质细胞系源性神经营养因子(GDNF)、神经营养因子-3(NT-3)、神经营养因子-4(NT-4)和神经营养因子-5(NT-5)中的至少一种。其中,神经营养因子有利于神经修复。
请参阅图1,本发明提供一种上述的微丝束支架的制备方法,包括以下步骤:
步骤S11、制备多个微丝。
具体地,将铸膜材料与酸性溶液混合,得到铸膜液,然后将铸膜液浇注到平板模具内,经干燥后得到厚度在微米尺寸的均匀膜片,再使用切片机切割膜片,可以得到任意宽度的微丝。
在一实施例中,铸膜材料包括胶原蛋白和壳聚糖中的至少一种。
在一实施例中,酸性溶液为体积比为0.5%~5%的乙酸水溶液或浓度为0.2mol/L~0.3mol/L的盐酸。其中,体积比为0.5%~5%的乙酸水溶液是指在乙酸水溶液中,乙酸的体积占乙酸水溶液体积的0.5%~5%。
在一实施例中,干燥可在超净工作台中室温干燥,也可在真空干燥箱中干燥,或者先在超净工作台中室温干燥,然后在真空干燥箱中干燥。
在一实施例中,微丝的材料包括胶原蛋白以及壳聚糖中的至少一种。其中,由于胶原蛋白和壳聚糖具有较好的生物相容性,因此微丝也具有较好的生物相容性。
在一实施例中,微丝的横截面为长方形,微丝的宽度为5.0μm~200μm,微丝的厚度为5.0μm~200μm。即微丝横截面的尺寸为(5.0μm~200μm)×(5.0μm~200μm)。可以理解,膜片的厚度即为微丝的厚度。
步骤S12、对多个微丝进行集束,得到微丝束。
具体地,可使用高分子膜包裹多个微丝,以对多个微丝进行集束,得到微丝束。
在一实施例中,微丝束的直径为2.0mm~20.0mm。
在一实施例中,高分子膜的材料包括胶原蛋白以及壳聚糖中的至少一种。
步骤S13、制备套管。
具体地,可采用静电纺丝工艺制备套管。
更具体地,将乙酸和水混合,得到体积比为70%~80%的乙酸水溶液,并将该乙酸水溶液和纺丝材料混合,得到纺丝液,并设置纺丝条件为喷丝口针头粗细为0.2mm~0.8mm(21G),针尖到收集辊表面的距离为5cm~15cm,针头的电压为5KV~20KV,收集辊的电压为(-15)KV~(-5)KV,纺丝液的推注速度为0.1ml/h~1.0mL/h,收集辊的直径为2.0mm~20mm,收集辊的转速为100rpm~3000rpm。可以理解,收集辊的直径即为套管的内径。
其中,体积比为70%~80%的乙酸水溶液是指在乙酸水溶液中,乙酸的体积占乙酸水溶液体积的70%~80%。
在一实施例中,在纺丝液中,纺丝材料的质量体积比为5%~20%。在一实施例中,纺丝材料包括壳聚糖和胶原蛋白中的至少一种。
在一实施例中,套管由均匀分布的纤维网构成,且套管的管壁具有均匀分布的孔隙结构。在一实施例中,孔隙结构可为微纳米孔。
在一实施例中,套管的材料包括壳聚糖以及胶原蛋白中的至少一种。其中,由于壳聚糖和胶原蛋白具有较好的生物相容性,因此使得套管也具有较好的生物相容性。
在一实施例中,套管的长度为3.0mm~30mm。
在一实施例中,多个微丝之间具有沿套管长度方向延伸的通道。
步骤S14、将微丝束装入到套管内,得到空白支架。
具体地,将微丝束的长度剪至3.0mm~30mm,并将长度为3.0mm~30mm的微丝束装入到套管内,得到空白支架。
在另一实施例中,也可先将微丝束装入套管内,然后再将微丝束的长度剪至3.0mm~30mm,得到空白支架。
在一实施例中,套管的长度和微丝束的长度大致相等。其中,微丝束的长度方向和套管的长度方向为同一方向。
在一实施例中,将微丝束装入到套管内之后,还需要去除高分子膜,以得到空白支架。
步骤S15、将空白支架浸入到含有神经营养因子的包被液中,冻干后得到微丝束支架。
在一实施例中,包被液的制备方法包括以下步骤:将乙酸和水混合,得到体积比为0.5%~5.0%的乙酸水溶液,并将该乙酸水溶液和成膜材料混合,得到包被液前驱体,然后向包被液前驱体中加入碱性溶液,以将包被液前驱体的pH调整到中性;再对调整后的包被液前驱体进行透析,得到成膜溶液;最后在1℃~4℃的温度下,将神经营养因子和成膜溶液混合,得到包被液。
在一实施例中,成膜材料包括壳聚糖以及胶原蛋白中的至少一种。在一实施例中,在包被液前驱体中,成膜材料的质量体积比0.5%~1.0%。
在一实施例中,包被液中神经营养因子的浓度为0.1μg/mL~1.0μg/mL。
在一实施例中,冻干的温度为(-90)℃~(-40)℃。
在一实施例中,套管和微丝束内负载有神经营养因子。具体地,套管的外表面、套管的内表面、孔隙结构、微丝束的表面以及通道内负载有神经营养因子。
在一实施例中,神经营养因子包括脑源性神经营养因子(BDNF)、神经生长因子(NGF)、胶质细胞系源性神经营养因子(GDNF)、神经营养因子-3(NT-3)、神经营养因子-4(NT-4)和神经营养因子-5(NT-5)中的至少一种。其中,神经营养因子有利于神经修复。
本发明提供的微丝束支架中的多个微丝之间具有沿套管长度方向延伸的通道,通道可作为神经元定向有序生长的通道,使得损伤部位附近的轴突能够定向生长,从而引导神经元有序定向生长,同时微丝束支架能够通过孔隙结构持续缓释神经营养因子,从而有利于神经损伤修复。此外,微丝束支架还具有良好的生物相容性。
以下通过具体实施例对本发明作进一步说明。
实施例1
(1)将乙酸和水混合,得到乙酸浓度为3%(v/v)的乙酸水溶液,并将该乙酸水溶液溶解胶原蛋白,使胶原蛋白的浓度为0.5%(wt/v),得到铸膜液,并将铸膜液在平板模具中浇铸成膜,先在超净工作台中室温干燥,再在真空干燥箱中干燥,得到厚度为20μm的膜片,然后将所得膜片在高精度切片机上切成宽度为100μm、厚度为20μm的微丝。将所得微丝集束成直径为3.0mm的微丝束备用。
(2)使用高分子膜包裹微丝,以对多根微丝进行集束,得到直径为3.0mm的微丝束。
(3)采用静电纺丝工艺制备套管。具体地,将乙酸和水混合,得到乙酸浓度为80%(v/v)的乙酸水溶液,并将该乙酸水溶液作为溶剂,将壳聚糖作为溶质,并与乙酸水溶液混合,得到壳聚糖浓度为10%(wt/v)的纺丝液;并设置纺丝条件为喷丝口针头粗细为0.40mm(21G),针尖到收集辊表面的距离为10cm~12cm,针头的电压为正压12KV,收集辊的电压为负压12KV,纺丝液的推注速度为0.15ml/h,收集辊的直径为3mm,转速为100rpm。
(4)将步骤(2)中的微丝束装入步骤(3)中的套管内,并将微丝束的长度剪至3.0mm-30.0mm,以使微丝束的长度和套管的长度大致相等,然后去除高分子膜,得到空白支架。
(5)将乙酸和水混合,得到乙酸浓度为1%(v/v)的乙酸水溶液,并将该乙酸水溶液溶解壳聚糖,并使壳聚糖的浓度为0.5%(wt/v),得到壳聚糖溶液前驱体,再向壳聚糖溶液前驱体中缓慢加入氢氧化钠溶液,以调整壳聚糖溶液前驱体的pH到中性,然后透析除盐,得到壳聚糖溶液,然后在1℃~4℃低温控温下,将神经营养因子-3(NT-3)溶解在上述的壳聚糖溶液中,得到NT-3浓度为0.2μg/ml的包被液。
(6)将步骤(4)中的空白支架装入刚能容纳得下的容器内,然后缓慢向容器内注入步骤(5)中的包被液,冻干后得到微丝束支架。
实施例2
实施例2和实施例1基本相同,区别在于:
在步骤(1)中,将该乙酸水溶液溶解壳聚糖,使壳聚糖的浓度为5.0%(wt/v),得到铸膜液;膜片的厚度为100μm;微丝的宽度为10μm,微丝的厚度为100μm。
在步骤(2)中,微丝束的直径为10.0mm。
在步骤(3)中,乙酸水溶液的浓度为70%(v/v),溶质为胶原蛋白,得到的纺丝液中胶原蛋白的浓度为18%(wt/v);收集辊的直径为10.0mm,转速为1000rpm。
在步骤(5)中,将该乙酸水溶液溶解胶原蛋白,并使胶原蛋白的浓度为1.0%(wt/v),得到胶原蛋白溶液前驱体,并将神经营养因子-3改为胶质细胞系源性神经营养因子(GDNF),得到GDNF浓度为0.1μg/ml的包被液。
实施例3
实施例3和实施例1基本相同,区别在于:
在步骤(1)中,用浓度为0.3mol/L的盐酸溶解胶原蛋白,使胶原蛋白的浓度为5.0%(wt/v),得到铸膜液;膜片的厚度为100μm;微丝的宽度为100μm,微丝的厚度为100μm。
在步骤(2)中,微丝束的直径为10.0mm。
在步骤(3)中,收集辊的直径为10.0mm,转速为600rpm。
在步骤(5)中,将神经营养因子-3改为脑源性神经营养因子(BDNF),得到BDNF浓度为0.3μg/ml的包被液。
实施例4
实施例4和实施例1基本相同,区别在于:
在步骤(1)中,用浓度为0.2mol/L的盐酸溶解壳聚糖,使壳聚糖的浓度为0.5%(wt/v),得到铸膜液;微丝的宽度为10μm。
在步骤(3)中,乙酸水溶液的浓度为70%(v/v),溶质为胶原蛋白,得到的纺丝液中胶原蛋白的浓度为18%(wt/v)。
在步骤(5)中,将该乙酸水溶液溶解胶原蛋白,并使胶原蛋白的浓度为1.0%(wt/v),得到胶原蛋白溶液前驱体,并将神经营养因子-3改为神经生长因子(NGF),得到NGF浓度为0.3μg/ml的包被液。
实施例5
实施例5和实施例1基本相同,区别在于:
在步骤(1)中,铸膜液中胶原蛋白的浓度为1.5%(wt/v);膜片的厚度为60μm;微丝的宽度为20μm,微丝的厚度为60μm。
在步骤(2)中,微丝束的直径为6.0mm。
在步骤(3)中,收集辊的直径为6.0mm,转速为500rpm。
在步骤(5)中,将神经营养因子-3改为神经营养因子-4(NT-4)。
实施例6
实施例6和实施例1基本相同,区别在于:
在步骤(1)中,将该乙酸水溶液溶解壳聚糖,使壳聚糖的浓度为3.0%(wt/v),得到铸膜液;膜片的厚度为50μm;微丝的宽度为15μm,微丝的厚度为50μm。
在步骤(2)中,微丝束的直径为6.0mm。
在步骤(3)中,乙酸水溶液的浓度为70%(v/v),溶质为胶原蛋白,得到的纺丝液中胶原蛋白的浓度为18%(wt/v);收集辊的直径为6.0mm,转速为400rpm。
在步骤(5)中,将该乙酸水溶液溶解胶原蛋白,并使胶原蛋白的浓度为1.0%(wt/v),得到胶原蛋白溶液前驱体,并将神经营养因子-3改为神经营养因子-5(NT-5),得到NT-5浓度为0.3μg/ml的包被液。
对实施例1~6制备微丝束支架的部分实验条件进行总结,具体如下表1所示。
表1实施例1~6制备微丝束支架的部分实验条件
分别测试实施例1~6制备的微丝束支架的缓释性能。
现以实施例1为例对微丝束支架的缓释性能的测试方法进行详细说明,实施例2~6的测试方法可参照实施例1的测试方法。
NT-3的检测采用市售NT-3的检测试剂盒,按照说明书进行操作。
先确定每个微丝束支架所负载的NT-3的量:1mL神经因子包被液中加入NT-3的量为已知量W
将包被有NT-3的微丝束支架放置于安瓿瓶中(平行样品3个),加入1mL的PBS,在37℃培养箱中孵育1天后,吸出PBS溶液,加入新的PBS继续孵育。吸出的PBS标记后保存于-20℃冷冻箱内。按照上述方法,于第3天、第5天、第7天、第14天、第21天、第28天、第35天和第42天收集含有NT-3缓释的PBS溶液。
检测微丝束支架于第1天、第3天、第5天、第7天、第14天、第21天、第28天、第35天和第42天释放出来NT-3的浓度并计算出NT-3的量,可计算得出微丝束支架累计释放曲线。
请参阅图2,可知,实施例1制备的微丝束支架中的神经营养因子的缓释时间可达42天以上。另外,经过测试可知,实施例2~6制备的微丝束支架中的神经营养因子的缓释时间也均可达42天以上。由此可知,实施例1~6制备的微丝束支架结构能够长时间的持续缓释神经营养因子,从而有利于神经损伤修复。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种多色聚酯纤维混合刷丝束及其制备方法
- 大丝束碳纤维复丝拉伸试样及其制备装置和方法
- 方向性生物微纳米纤维支架快速制备装置及微纳米纤维支架的制备方法
- 具微通道网络的支架的制备方法和具微通道网络的支架
